Interferon lambda 1 (IFN‐λ1), também denominado interleucina 29 (IL‐29), é um novo membro da família IFN tipo III ou IFN‐λ. A IL‐29 desempenha um papel importante na patogênese de muitos tipos de doenças autoimunes e inflamatórias.
ObjetivoEstudar o papel da IL‐29 na patogênese da psoríase vulgar (PV).
MétodosDetectamos os níveis séricos de IL‐29 em 41 pacientes com PV, 23 pacientes com dermatite atópica e 38 controles pareados por idade e gênero por ensaio imunoenzimático (ELISA) sanduíche. Os efeitos da IL‐29 na expressão de citocinas, como IL‐6, IL‐17, IL‐8, IL‐4, IL10, IFN‐γ e fator de necrose tumoral‐α (TNF‐α), em células mononucleares de sangue periférico (CMSP) e células HaCat foram determinadas por PCR quantitativo em tempo real.
ResultadosNossos dados indicaram que os níveis séricos de IL‐29 estavam significativamente elevados em pacientes com PV quando comparados com pacientes com dermatite atópica e o grupo controle. Além disso, os níveis séricos de IL‐29 estavam intimamente associados à gravidade da PV. Ademais, a IL‐29 regulou positivamente os níveis de expressão de mRNA de IL‐6, IL‐17 e TNF‐α em CMSP de pacientes com PV, e aumentou a expressão de IL‐6 e IL‐8 nas células HaCat.
ConclusãoEste estudo fornece as primeiras observações sobre a associação de IL‐29 e PV e mostrou níveis séricos elevados de IL‐29. Sugere‐se que a IL‐29 pode desempenhar um papel na patogênese da PV.
A psoríase é um distúrbio cutâneo inflamatório crônico comum mediado por células T, histopatologicamente caracterizado por hiperproliferação de queratinócitos e infiltração vascular dérmica por células mononucleares.1–4 Entretanto, os mecanismos moleculares envolvidos no desenvolvimento dessa doença ainda não foram totalmente elucidados.
O interferon lambda 1 (IFN‐λ1), também chamado interleucina 29 (IL‐29), é um novo membro da família IFN tipo III ou IFN‐λ. A família IFN tipo III é composta por IFN‐λ1 (IL‐29), IFN‐λ2 (IL‐28A) e IFN‐λ3 (IL‐28B). Muitos investigadores demonstraram que a IL‐29 desempenha um papel importante na patogênese de muitos tipos de doenças autoimunes e inflamatórias, como esclerose sistêmica, artrite reumatoide e lúpus eritematoso sistêmico.5–7 Entretanto, a associação de IL‐29 com a psoríase vulgar (PV) ainda é pouco compreendida. Assim, neste estudo, comparamos os níveis séricos de IL‐29 em pacientes com PV, dermatite atópica e em controles saudáveis.
Mais recentemente, pesquisas indicaram que a IL‐29 pode afetar a produção de citocinas ao ativar o transdutor de sinal/Janus Kinase e ativadores da via de transcrição. A IL‐29 regulou positivamente a expressão de IL‐1β, IL‐8, MCP‐1 e promoveu a migração de monócitos/macrófagos na síndrome de Simpson‐Golabi‐Behmel em humanos.8 A IL‐29 pode aumentar a produção de IL‐10, IL‐8 e IL‐6 em macrófagos e inibir a liberação de IL‐13 em células T.9–11 Além disso, He et al. relataram que a IL‐29 poderia induzir a secreção de IL‐6 e TNF das células T CD14+, bem como IL‐4 e IL‐13 dos mastócitos.12 Os queratinócitos, sendo células importantes na imunidade inata, desempenham um papel importante na inflamação cutânea e na resposta imune por meio da expressão de citocinas e peptídeos antimicrobianos na psoríase. As células HaCat são um tipo de linhagem celular de queratinócitos. Para estudar o papel da IL‐29 na patogênese da PV, investigamos neste estudo os efeitos da IL‐29 na expressão do mRNA de citocinas (incluindo IL‐6, TNF‐α, IL‐17, IL‐8, IL‐4, IFN‐γ e IL‐10) em células mononucleares de sangue periférico (CMSP) de pacientes com PV e na linhagem celular de queratinócitos HaCaT.
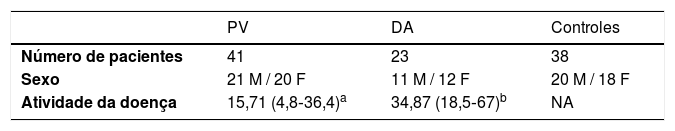
MétodosPacientesQuarenta e um pacientes com PV, 23 pacientes com dermatite atópica (DA) e 38 controles pareados por idade e gênero foram incluídos neste estudo. A história detalhada de cada paciente é fornecida na tabela 1. A gravidade da doença em pacientes com PV ou DA foi determinada pelo Índice de Área e Gravidade da Psoríase (PASI, Psoriasis Area and Severity Index) ou pelo escore da DA (SCORAD, Scoring Atopic Dermatitis). Entre eles, 17 pacientes com PV foram tratados com esteroide tópico e alcatrão e composto oral com glicirrizina (cada comprimido contém glicirrizina 25mg, glicirrizinato de monoamônio 35mg, glicina 25mg e DL‐metionina 25mg). Os pacientes foram tratados com uma dose de dois comprimidos por vez, três vezes/dia. Nippon Kayaku, Tóquio, Japão. As amostras de soro desses pacientes foram coletadas antes e depois do tratamento. Além disso, amostras de sangue heparinizado foram coletadas de 16 pacientes com PV. Não havia qualquer história de infecções virais recentes, linfocitose ou linfopenia, ou qualquer outra investigação correspondente nesses pacientes. Todos os pacientes com PV tinham rigorosamente PV somente, sem qualquer sobreposição de outros fenótipos.
Dados demográficos da coorte
| PV | DA | Controles | |
|---|---|---|---|
| Número de pacientes | 41 | 23 | 38 |
| Sexo | 21 M / 20 F | 11 M / 12 F | 20 M / 18 F |
| Atividade da doença | 15,71 (4,8‐36,4)a | 34,87 (18,5‐67)b | NA |
Os níveis séricos de IL‐29 em diferentes grupos de pacientes foram medidos por kits de ensaio imunoenzimático ELISA (Enzyme‐Linked Immunosorbent Assay) comercialmente disponíveis (Boster, Wuhan, China) seguindo as instruções do fabricante.
Cultura de célulasAs CMSP de pacientes com PV foram isoladas do sangue periférico coletado por centrifugação de gradiente de densidade utilizando kits comercialmente disponíveis (Tianjin Haoyang Biological Manufacture Co. Ltd., Tianjin, China). As CMSP isoladas de cada paciente foram divididas em dois grupos e cultivadas em DMEM contendo 10% de FBS, 100mg/mL de penicilina e estreptomicina em placa de seis poços com 1mL/poço. Um grupo de células foi tratado com 100 ng/mL de IL‐29 recombinante (Peprotech, Londres, RU) por 6 horas, e o outro grupo foi tratado com PBS como controle. Após o tratamento, o RNA total foi extraído com o reagente Trizol (Invitrogen Corp, Carlsbad, CA, EUA) de acordo com as instruções do fabricante.
As células HaCaT foram cultivadas em DMEM contendo 10% de FBS, 100mg/mL de penicilina e estreptomicina e tratadas com IL‐29 recombinante (1 ng/mL, 10 ng/mL, 100 ng/mL, 1000 ng/mL) ou TNF‐α (10 ng/mL) por 2 horas. As células foram tratadas com PBS como controle. Após o tratamento, o RNA total das células foi extraído com o reagente Trizol de acordo com as instruções do fabricante.
PCR quantitativa em tempo realOs níveis de mRNA de IL‐6, TNF‐α, IL‐17, IL‐4, IFN‐γ, IL‐10 e GAPDH em CMSP após incubação com IL‐29 ou PBS e a expressão de IL‐6, IL‐8 e GAPDH em células HaCat após incubação com IL‐29, TNF‐α ou PBS foram determinados por PCR quantitativa em tempo real. O cDNA foi sintetizado a partir do RNA total utilizando o kit de reagentes RT com gDNA Eraser (Takara, Dalian, China). As amostras de cDNA foram amplificadas em um volume de reação de 20μL contendo 10μL de 2× SYBR Green Master Mix (Takara, Dalian, China), 2μL de cDNA e 0,25μM de primers qPCR. Foram utilizados os seguintes primers: IL‐4 (P216616, Bioneer, Inc., Daejeon, Coreia); IL‐6 (P211161, Bioneer, Inc., Daejeon, Coreia); IL‐10 (P285360, Bioneer, Inc., Daejeon, Coreia); IL‐17 (P291322, Bioneer, Inc., Daejeon, Coreia); IFN‐γ (Catálogo: HQP009467, GeneCopoeia, EUA); TNF‐α (P237423, Bioneer, Inc., Daejeon, Coreia); GAPDH (5’‐CGGAGTCAACGGATTTGGTC‐3’ e 5’‐CGGTGCCATGGAATTTGCCA‐3’). As condições foram 95°C por 5 minutos, e 95°C por 15 segundos e 60°C por 30 segundos de 40 ciclos com uma extensão final a 72°C por 5 minutos. Os níveis de mRNA de IL‐6, TNF‐α, IL‐17, IL‐4, IFN‐γ, IL‐10 e IL‐8 foram expressos como níveis relativos de mRNA em comparação com o controle e determinados pelo método 2‐ΔΔCt.
Análise estatísticaCada experimento foi realizado pelo menos três vezes. Os dados foram expressos como média ± DP. As diferenças estatísticas entre os grupos foram determinadas de acordo com a análise de variância unilateral, teste t de Student ou teste U de Mann‐Whitney. Os dados pareados foram comparados pelo teste signed‐rank de Wilcoxon. A associação da IL‐29 com os escores PASI foi analisada pelo teste de Spearman; p < 0,05 foi definido como estatisticamente significativo.
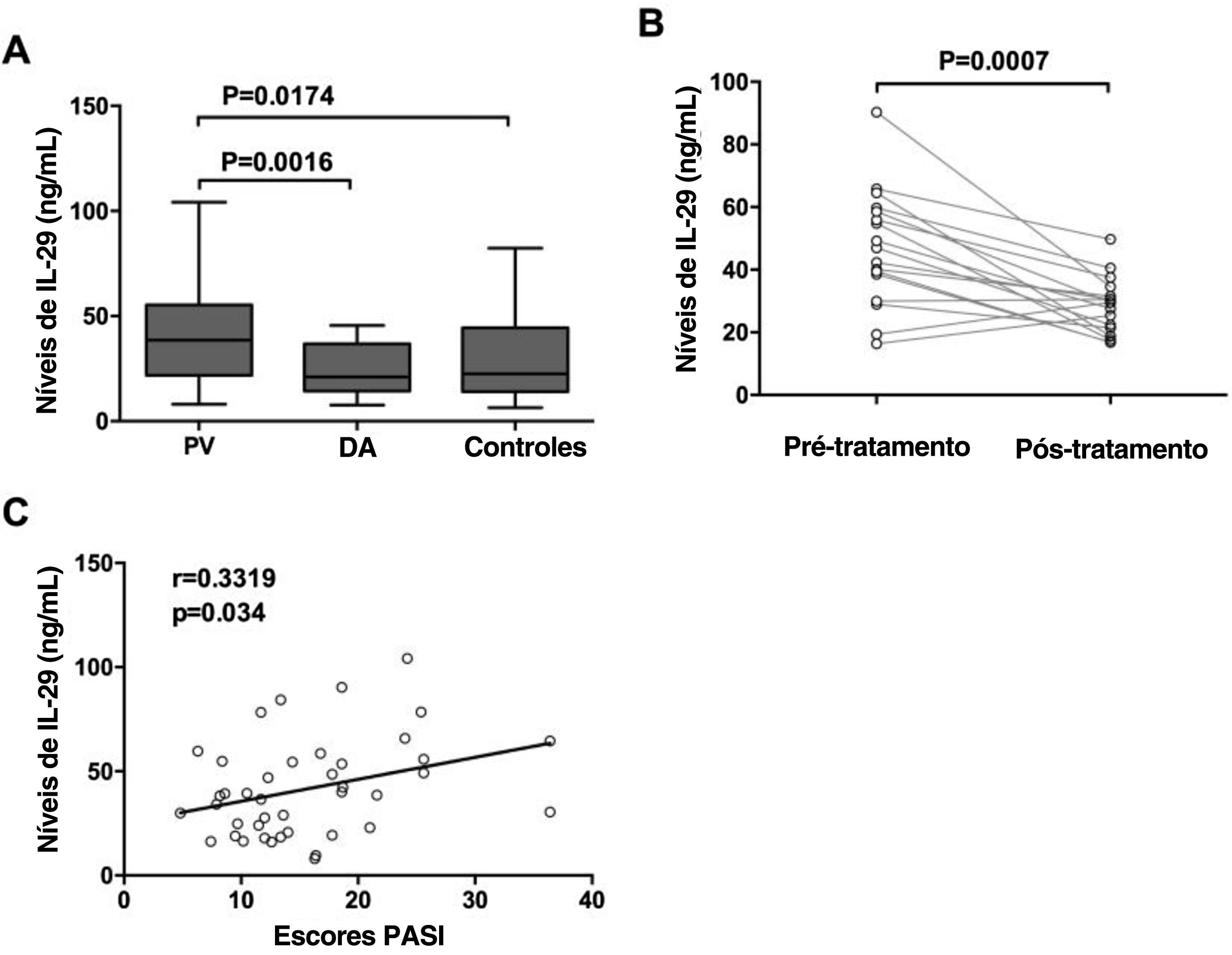
ResultadosNíveis séricos elevados de IL‐29 em pacientes com PVOs níveis séricos de IL‐29 em pacientes com PV e DA e controles foram detectados por ELISA. Como mostrado na figura 1A, os níveis séricos de IL‐29 em pacientes com PV (41,62 ± 23,26 ng/mL) foram significativamente maiores do que aqueles em pacientes com DA (24,35 ± 12,57 ng/mL) e grupo controle (29,83 ± 19,52 ng/mL). Além disso, 17 pacientes com PV tinham níveis séricos de IL‐29 nitidamente elevados quando comparados com aqueles após o tratamento (fig. 1B; p = 0,0007). Além disso, como mostrado na figura 1C, os níveis séricos de IL‐29 em pacientes com PV foram correlacionados com os escores PASI (r = 0,3319, p = 0,034).
Aumento dos níveis séricos de IL‐29 em pacientes com psoríase vulgar (PV). Os níveis séricos de IL‐29 em pacientes com PV e dermatite atópica (DA) e controles saudáveis foram determinados por ELISA. A, Os níveis séricos de IL‐29 em pacientes com PV em estágio agudo foram significativamente maiores do que em pacientes com DA e controles; os valores de p são baseados no teste U de Mann‐Whitney. B, O teste signed‐rank de Wilcoxon para dados pareados mostrou que os níveis séricos de IL‐29 de 17 pacientes com PV no estágio agudo foram significativamente maiores do que aqueles no estágio de convalescença. C, Uma correlação positiva foi demonstrada entre os níveis séricos de IL‐29 e os escores PASI em pacientes com PV pelos testes de Spearman.
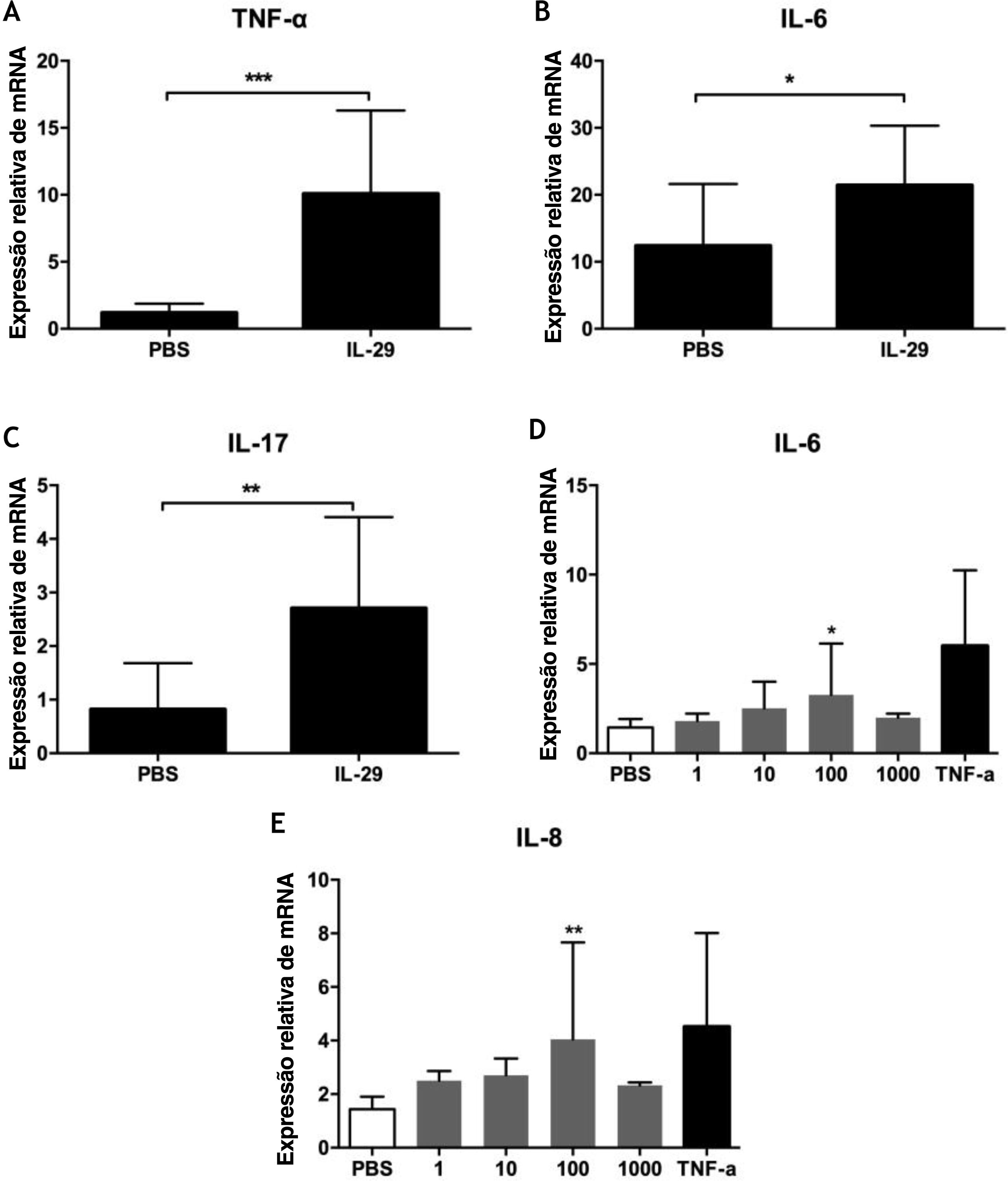
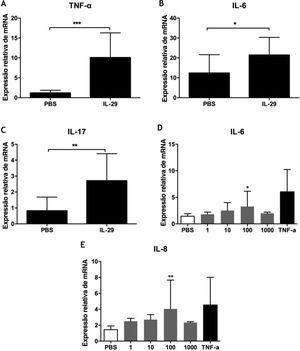
Para explorar o papel da IL‐29 na patogênese da PV, analisamos os efeitos da IL‐29 na expressão do mRNA de citocinas (incluindo IL‐6, TNF‐α, IL‐17, IL‐4, IFN‐γ e IL‐ 10) em CMSP de 10 pacientes com PV por PCR quantitativa em tempo real. Como mostrado na figura 2A‐C, a IL‐29 causou um aumento acentuado nos níveis de mRNA de IL‐6, TNF‐α e IL‐17 em CMSP de pacientes com PV tratados com IL‐29 quando comparados com controles tratados com PBS. Entretanto, a expressão de mRNA de IL‐4, IL10 e IFN‐γ não apresentou alterações em CMSP de pacientes com PV após a incubação com IL‐29 (dados não mostrados).
A‐C, Expressão de mRNA de IL‐6, IL‐17 e TNF‐α induzida por IL‐29 em células mononucleares de sangue periférico (CMSP) de pacientes com psoríase vulgar (PV). As CMSP obtidas de 10 pacientes com PV foram tratadas com IL‐29 100 ng/mL ou PBS por 6 horas. Em seguida, a expressão de mRNA de IL‐6, IL‐17 e TNF‐α nas CMSP foi medida por PCR quantitativa em tempo real. O IL‐29 nitidamente aumentou a expressão de mRNA de IL‐6, IL‐17 e TNF‐α nas CMSP. Os valores de p são baseados no teste t. n = 10, *p < 0,05, **p < 0,01, em comparação com o grupo controle. D‐E, A IL‐29 aumentou a expressão de mRNA de IL‐6 e IL‐8 em células HaCat. As células HaCat foram tratadas com IL‐29 recombinante (1 ng/mL, 10 ng/mL, 100 ng/mL, 1000 ng/mL) ou TNF‐α (10 ng/mL) por 2 horas. Subsequentemente, a expressão de mRNA de IL‐6 e IL‐8 em células HaCat foi medida por PCR quantitativa em tempo real. A IL‐29 nitidamente aumentou o mRNA de IL‐6 e IL‐8 em células HaCat. Os valores de p são baseados na análise de variância unilateral. n = 10, *p < 0,05, **p < 0,01, em comparação com o grupo controle. Todos os dados são expressos como média ± DP.
Para explorar a função da IL‐29 na patogênese da PV, também testamos a expressão de mRNA de citocinas (IL‐6 e IL‐8) em células HaCat após tratamento com IL‐29 recombinante por PCR quantitativa em tempo real. Como mostrado nas figuras 2D e 2E, a IL‐29 causou um aumento nítido nos níveis de mRNA de IL‐6 e IL‐8 em células HaCat tratadas com IL‐29 quando comparadas com controles tratados com PBS.
DiscussãoComo descrito, a IL‐29, um novo membro da família das citocinas IFN tipo III, está intimamente relacionada com a patogênese de muitos tipos de doenças autoimunes e inflamatórias.5,7,13,14 Neste estudo, aumento dos níveis séricos de IL‐29 foi encontrado em pacientes com PV em comparação com aqueles em pacientes com DA e controles saudáveis. Além disso, os níveis séricos de IL‐29 foram correlacionados com a gravidade da PV. Os dados sugerem que a IL‐29 pode desempenhar um papel na patogênese da PV.
Muitos pesquisadores relataram que a IL‐29 pode ser expressa em muitos tipos de células e apresentar atividades imunorregulatórias em CMSP virgens (naïve).1,15 Wang et al. demonstraram que a IL‐29 aumenta a produção de citocinas pró‐inflamatórias induzidas por receptor toll‐like (TLR) em sinoviócitos semelhantes a fibroblastos na artrite reumatoide (FLSs‐AR) por meio da regulação positiva de TLR.16 Gallagher et al. relataram que a IL‐29 parece ser um inibidor das respostas Th2 humanas, cuja ação é principalmente direcionada à IL‐13, mas que também pode afetar as respostas Th2 em geral e não evoca uma elevação complementar da secreção de IFN‐γ.10 Yan et al. demonstraram que a IL‐29 combinada com o fator estimulador de colônia de granulócitos‐macrófagos humanos recombinantes (rhGM‐CSF) e IL‐4 pode induzir a maturação das células dendríticas (CD), aumentar a expressão das moléculas coestimulatórias e estimular a produção de citocinas e quimiocinas na fase de tolerância imunológica e na fase de depuração imunológica.17 Muitos estudos mostraram que as células Th1/Th17 desempenham papéis cruciais na patogênese da psoríase.18–20 Lesões psoriásicas podem secretar muitas citocinas inflamatórias, como IFN‐γ, IL‐6, IL‐1 β, IL‐8, IL‐17 e TNF‐α, que contribuem para o desenvolvimento da psoríase.21 Neste estudo, foram investigados os efeitos da IL‐29 na expressão de mRNA de citocinas (incluindo IL‐6, TNF‐α, IL‐17, IL‐4, IFN‐γ e IL‐10) em CMSP de pacientes com PV e células HaCat tratadas com IL‐29. Foi demonstrado que a IL‐29 aumentou significativamente a expressão do mRNA de TNF‐α, IL‐6 e IL‐17 em CMSP de pacientes com PV. Também foi demonstrado que a IL‐29 obviamente aumentou a expressão do mRNA da IL‐6 e IL‐8 em células HaCat. Um estudo anterior indicou que TNF‐α, IL‐6, IL‐8 e IL‐17 desempenham papel crucial na patogênese da PV.18,22 Portanto, sugere‐se que a IL‐29 pode regular positivamente a expressão de citocinas em CMSP e queratinócitos e aumentar a reação inflamatória na patogênese da PV.
ConclusãoTomados em conjunto, os dados deste estudo fornecem as primeiras observações sobre a associação de IL‐29 e PV e demonstraram níveis séricos elevados de IL‐29 em pacientes com PV. Sugere‐se que a IL‐29 pode atuar como uma citocina pró‐inflamatória e desempenhar um papel na patogênese da PV.
Declaração de éticaA pesquisa em humanos foi aprovada pelo Comitê de Ética do Chengdu Second People's Hospital (n° 2015007). Todos os pacientes eram asiáticos e assinaram o termo de consentimento livre e esclarecido.
Suporte financeiroO estudo recebeu, em parte, suporte financeiro da Natural Science Foundation of China (81470143) e do Provincial Department of Science and Technology de Sichuan (19YYJC0557).
Contribuição dos autoresLi‐Xin Fu: Concepção, planejamento e definição do conteúdo intelectual; busca na literartura; estudos experimentais; preparação do manuscrito; edição do manuscrito.
Tao Chen: Concepção, planejamento e definição do conteúdo intelectual; preparação do manuscrito; edição do manuscrito.
Zai‐Pei Guo: Concepção, planejamento e definição do conteúdo intelectual; revisão do manuscrito.
Na Cao: Obtenção e análise dos dados.
Li‐Wen Zhang: Busca na literartura; estudos experimentais
Pei‐Mei Zhou: Obtenção e análise dos dados.
Conflito de interessesNenhum.
Como citar este artigo: Fu LX, Chen T, Guo ZP, Cao N, Zhang LW, Zhou PM. Enhanced serum interferon‐lambda 1 interferon-lambda 1/interleukin-29 levels in patients with psoriasis vulgaris. An Bras Dermatol. 2021;96:416–21.
Trabalho realizado no Departamento de Dermatologia e Venereologia, Chengdu Second People's Hospital and Open Laboratory, West China Institute of Woman and Children's Health, West China Second University Hospital, Sichuan University, Chengdu, Sichuan, China.