Os imunobiológicos representam inovadora opção terapêutica na Dermatologia. São indicados nos casos graves e refratários de diferentes doenças quando há contraindicação, intolerância ou falha da terapia sistêmica convencional e nos casos com prejuízo importante da qualidade de vida dos doentes. Os principais imunobiológicos utilizados na Dermatologia incluem, basicamente, inibidores do fator de necrose tumoral alfa (anti‐TNF), inibidores da interleucina 12 e 23 (anti‐IL12/23), inibidores da interleucina 17 e do seu receptor (anti‐IL17), inibidores da interleucina 23 (anti‐IL23), rituximabe (anticorpo anti‐CD20), dupilumabe (anti‐IL4/IL13) e a imunoglobulina endovenosa. Sua ação imunomoduladora pode estar associada ao aumento no risco de infecções no curto e no longo prazo, devendo cada caso ser avaliado individualmente, conforme o risco inerente à medicação, ao estado geral do paciente, e sobre a necessidade de precauções a serem tomadas. Discutiremos neste artigo os principais riscos de infecção associados ao uso dos imunobiológicos, abordando o risco nos imunocompetentes e nos imunossuprimidos, vacinação, infecções fúngicas, tuberculose, hanseníase e hepatites virais, e como conduzir o paciente nos mais diversos cenários.
Os imunobiológicos (IB) representam uma inovadora e eficaz opção terapêutica na Medicina e, em especial, na Dermatologia. Caracterizam um grupo de medicamentos produzidos por sistemas biológicos vivos por meio de modernas técnicas de biotecnologia. Classificam‐se em três grupos principais: anticorpos monoclonais, proteínas de fusão e citocinas. Os IB interagem com proteínas humanas específicas implicadas na cascata inflamatória de diferentes doenças imunomediadas, como psoríase, dermatite atópica (DA), hidradenite supurativa, urticária, dermatoses bolhosas autoimunes e doenças do tecido conectivo.1–3
Com alta complexidade e variabilidade estrutural, os IB têm seu componente ativo heterogêneo e de difícil caracterização e replicação. Em virtude de sua estrutura molecular complexa e do grande número de etapas envolvidas em seu desenvolvimento, caracterizam medicações de alto custo e acesso restrito.4
Indicados nos casos graves e refratários de diferentes doenças; na contraindicação, intolerância ou fracasso à terapia sistêmica clássica; em casos de doentes com grave deterioração da qualidade de vida e/ou incapacidade física ou psicossocial, os IB incluem, basicamente, inibidores do fator de necrose tumoral alfa (anti‐TNF), inibidores da interleucina 12 e 23 (anti‐IL12/23), inibidores da interleucina 17 e do seu receptor (anti‐IL17), inibidores da interleucina 23 (anti‐IL23), rituximabe (anticorpo anti‐CD20), dupilumabe (anti‐IL4/IL13) e a imunoglobulina endovenosa.
Para o tratamento da psoríase, que representa a doença dermatológica com o maior número de aprovações de IB, podemos destacar, entre os fármacos com ação anti‐TNF, o infliximabe (anticorpo monoclonal quimérico), o etanercepte (proteína de fusão), o adalimumabe (anticorpo monoclonal humanizado) e o certolizumabe pegol (anti‐TNF peguilado); aqueles com ação anti‐IL12/23 (ustequinumabe), ação anti‐IL23 (guselcumabe, risanquizumabe), anti‐IL17 (secuquinumabe, ixequizumabe e o bimequizumabe) e ação antirreceptor de anti‐IL17 (brodalumabe). O espesolimabe (antirreceptor de IL36) foi aprovado em 2023 para o tratamento de exacerbações de psoríase pustulosa generalizada em adultos.5–8
Os IB não apresentam toxicidade específica para nenhum órgão ou sistema; no entanto, seu efeito imunomodulador pode estar associado à ocorrência de efeitos adversos a curto e a longo prazo, como infecções graves e oportunistas. Portanto, antes da introdução da terapia IB específica, a decisão terapêutica deve ser compartilhada com o paciente e uma série de cuidados e precauções tornam‐se essenciais. Durante o tratamento, a vigilância deve ser constante, tanto por parte do médico prescritor quanto do paciente. Diferentes situações específicas, como vacinação, cirurgia e gestação, poderão ocorrer, cabendo ao especialista discutir com seu paciente a conduta mais adequada visando diminuir o risco de intercorrências indesejáveis.9
A seguir, o real risco de infecções associado aos IB é discutido, tanto em pacientes imunocompetentes quanto imunocomprometidos, o risco de infecções fúngicas e hanseníase na vigência da terapêutica imunobiológica, a condução apropriada de casos de coinfecção com hepatite B e C e a importância do esquema vacinal adequado.
Risco de infecção com os diferentes imunobiológicos usados na DermatologiaEm pacientes com doenças imunomediadas tratados com IB, a ocorrência de infecções pode decorrer do risco inerente à própria doença de base, do efeito imunomodulador do tratamento preconizado, da associação com terapias imunossupressoras e da presença de diferentes comorbidades, como obesidade e diabetes mellitus.
A alta prevalência de infecções cutâneas em pacientes com DA é bem estabelecida. Alterações da barreira cutânea associadas a uma ampla gama de alterações imunológicas aumentam a suscetibilidade a diferentes infecções, em especial por vírus, como herpes simples, molusco contagioso e verruga vulgar, e por Staphylococcus aureus.10 Em pacientes com psoríase, evidenciam‐se elevadas taxas de internação hospitalar decorrentes de infecções quando comparadas à população geral, relacionadas principalmente à gravidade da psoríase e não aos tratamentos sistêmicos utilizados.11 No caso da hidradenite supurativa, observam‐se elevadas taxas de infecção cutânea e extracutânea, possivelmente decorrentes de quebra da barreira cutânea e desregulação do sistema imune.12
O real risco de infecção associado ao uso dos IB tem sido avaliado em estudos controlados e randomizados, em registros populacionais e em revisões sistemáticas da literatura. A psoríase apresenta a maior variedade de opções terapêuticas e um longo tempo de seguimento, e o consenso atual é de que tais IB não apresentem nenhum risco ou apenas risco mínimo de infecção quando comparados aos tratamentos sistêmicos clássicos.13 Registros de farmacovigilância desenvolvidos a longo prazo, como o da British Association of Dermatologists Biologics and Immunomodulators Register, no Reino Unido (BADBIR), PsoBest na Alemanha e BIOBADADERM na Espanha, não evidenciam, até o presente momento, sinal de alerta para o risco de infecções, principalmente quando o screening pré‐tratamento e o de seguimento anual são realizados de maneira adequada.1 Por outro lado, Dobry et al., avaliando as taxas de infecção em 5.889 pacientes nos EUA, identificaram risco aumentado de infecções graves nos casos de psoríase em uso de IB quando comparados a pacientes tratados com não IB (adjusted hazzard ratio [aHR]: 1,31; intervalo de confiança [IC] 95%: 1,02–1,68), especificamente para as infecções cutâneas e de partes moles (Ahr=1,75; 95%IC 1,19–2,56).14 No entanto, comentários posteriores a essa publicação enfatizaram as baixas taxas de infecção em ambos os grupos de pacientes reportados (com e sem tratamento IB) e a relevância do risco de infecções graves inerentes a própria gravidade da psoríase, haja vista que os pacientes mais graves são mais propensos a receber tratamento com IB.15
Dados de vida real avaliando o risco de infecções graves em 11 560 novos tratamentos IB em pacientes com psoríase e artrite psoriásica identificaram risco reduzido de infecções graves em pacientes tratados com anti‐IL17 e anti‐IL12/23 quando comparado ao uso de anti‐TNF em pacientes sem exposição prévia aos IB. Em pacientes bioexperimentados, não houve diferença quanto à ocorrência de infecções sérias entre essas três classes.16
Em geral, infecções cutâneas e respiratórias são as mais prevalentes na vigência de IB. Por outro lado, devemos salientar que a ocorrência de infecções granulomatosas, como a tuberculose, e de infecções fúngicas, principalmente por cândida, caracteriza situação especial associada ao mecanismo inerente da classe anti‐TNF e anti‐IL17, respectivamente.6
Já em se tratando do dupilumabe, anticorpo monoclonal humano dirigido contra a subunidade α do receptor de IL4 e IL13 e aprovado para o tratamento da DA moderada a grave, o efeito adverso mais comumente relatado é a conjuntivite. Revisões sistemáticas da literatura e metanálises de vida real evidenciam taxas de conjuntivite em 26,1% de um total de 908 pacientes de DA. Infecções por herpes simples vírus foram identificadas em 5,8% de 546 casos de DA.17
O rituximabe caracteriza um anticorpo monoclonal quimérico anti‐CD20 que depleta os linfócitos B que apresentam o antígeno de superfície CD20. É indicado para uma ampla variedade de doenças, incluindo neoplasias, condições reumatológicas e imunodeficiências primárias, e em alguns países (incluindo Estados Unidos e Europa), também para o pênfigo vulgar. Indicações off‐label na dermatologia brasileira incluem os pênfigos, o lúpus eritematoso sistêmico e o angioedema, entre outros.18,19 Entre os efeitos adversos, o rituximabe está associado ao risco de hipogamaglobulinemia e infecções. Apesar de os estudos iniciais não evidenciarem aumento significante do risco de infecções, relatos têm demonstrado taxas de infecções graves de até 5,2 por 100 pacientes‐ano, comparados a 3,7 por 100 pacientes‐ano no grupo placebo, além de casos de hipogamaglobulinemia prolongada e sintomática.20,21
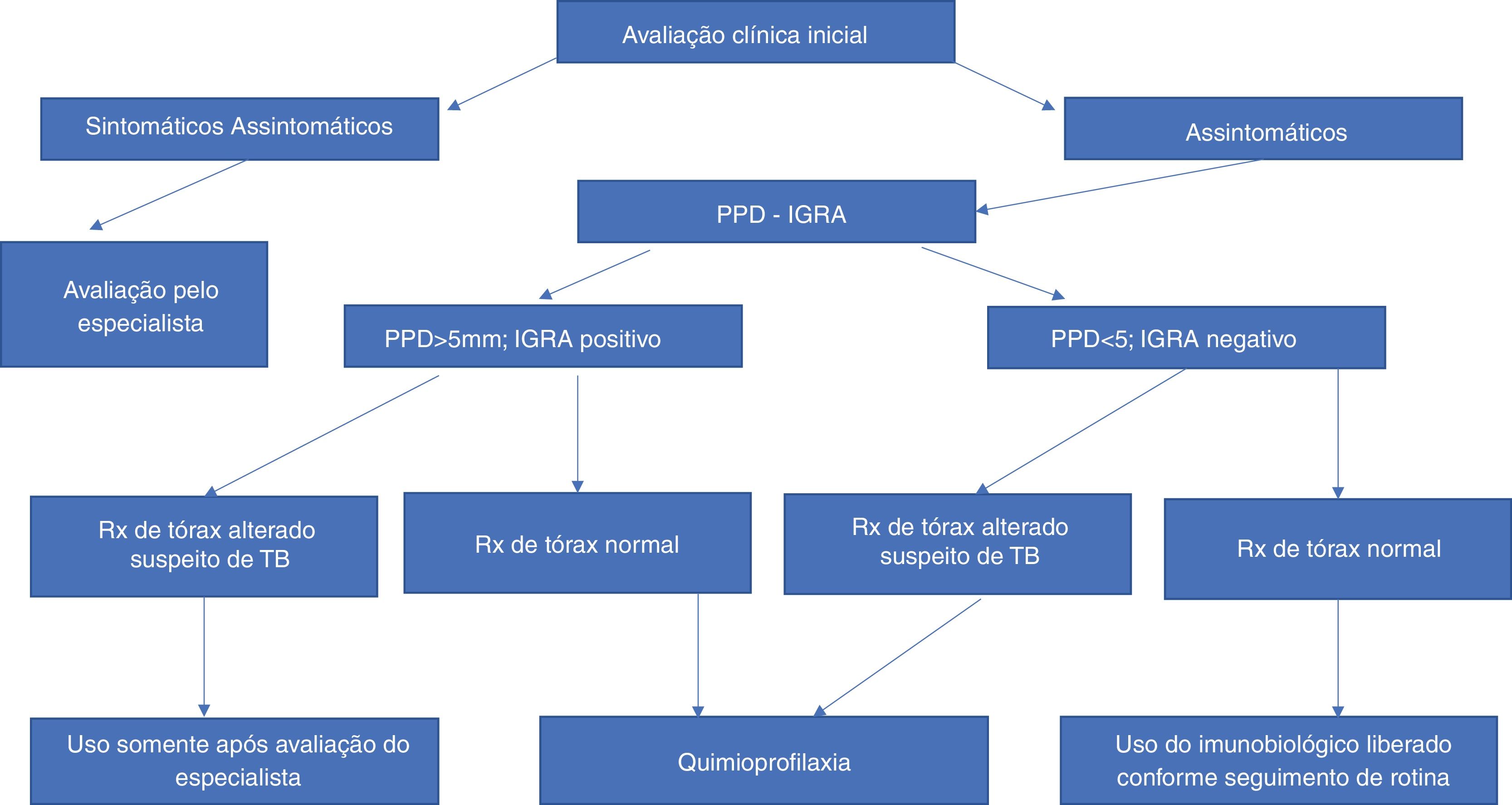
TuberculoseA probabilidade de reativação de tuberculose latente é maior em pacientes em uso de anti‐TNF. Desde a introdução da investigação para tuberculose latente, as taxas de reativação de tuberculose diminuíram drasticamente. Assim, a anamnese minuciosa quanto ao contato presente ou passado com tuberculose é essencial. O screening para diagnosticar indivíduos infectados pelo Mycobacterium tuberculosis deve incluir o teste cutâneo da tuberculina, que utiliza a preparação padrão de derivado purificado de proteína (PPD), e radiografia de tórax (fig. 1).22 Testes realizados in vitro para a detecção de tuberculose latente, baseados na quantificação da produção de IFN‐γ, auxiliam o diagnóstico, porém ainda apresentam custo elevado.23 As primeiras versões desses testes (Quantiferon‐TB®, Cellestis Limited, Carnegie, Austrália), aprovadas pela Food and Drug Administration (FDA), em 2001, utilizavam o PPD como antígeno estimulador, levando aos mesmos problemas de especificidade vistos nos testes cutâneos.24 O Quantiferon‐TB‐Gold® é um ensaio utilizando o ESAT‐6 e o CFP‐10 como antígenos estimuladores. Esse último ensaio utiliza sangue total e quantifica a presença de IFN‐γ pelo método de ELISA (enzyme‐linked immunosorbent assay). O teste T‐SPOT TB® (Oxford® Immunotec, Marlborough, EUA) usa um ensaio de ELISPOT (enzyme‐linked‐immunospot assay) com células mononucleares periféricas produtoras de IFN‐у, em resposta ao estímulo como ESAT‐6 e CFP‐10.25,26
Uso de imunobiológicos em pacientes imunocomprometidosAs populações de pacientes imunocomprometidos mais importantes, em termos numéricos, são as de pacientes com HIV (vírus da imunodeficiência humana) e de pacientes submetidos a transplante de órgão sólido.
Apesar de ambos os grupos serem imunocomprometidos, eles apresentam tipos diferentes de imunossupressão. A infecção pelo HIV leva a comprometimento progressivo da imunidade celular; os pacientes que fazem uso da terapia antirretroviral (TARV) apresentam restauração dessa imunidade, com elevação da contagem sérica dos linfócitos T CD4+ e queda da carga viral, que pode ficar indetectável. Quando isso ocorre, os pacientes tendem a ter maior sobrevida e, assim, podem desenvolver doenças autoimunes, doença inflamatória intestinal (DII) e até mesmo neoplasias, às vezes gerando indicação de IB.27 Os pacientes transplantados de órgão sólido, por sua vez, apresentam imunossupressão mais importante, complexa e irreversível, enquanto persistir o uso dos medicamentos imunossupressores, que evitam o risco de rejeição ao órgão transplantado.28 É importante destacar que essas duas populações são habitualmente excluídas dos estudos clínicos de IB. Portanto, o que sabemos a esse respeito é extraído de relatos e séries de casos, e poucos estudos de revisão.
Infecção pelo HIV e imunobiológicosA infecção pelo HIV pode desencadear e agravar quadros de psoríase; essa probabilidade aumenta nos pacientes com maior imunossupressão, que apresentam baixa contagem de linfócitos T CD4+. Pacientes com CD4 <200 células/mm3 apresentam maior risco de psoríase grave.29
Em revisão sistemática publicada em 2019, os autores revisaram casos de psoríase em populações especiais, que receberam tratamento com IB entre 1989 e 2018. Dentre os pacientes com infecção pelo HIV que receberam IB anti‐TNF (etanercepte, infliximabe ou adalimumabe), não se observou queda do CD4 nem aumento do número de infecções oportunistas (IO). O único anti‐IL incluído nessa revisão foi o ustequinumabe (anti‐IL12/23), verificando‐se bom perfil de eficácia e segurança nesse grupo, inclusive com melhora do CD4 e da carga viral em alguns pacientes.30
Um estudo retrospectivo multicêntrico reuniu 23 pacientes com infecção pelo HIV (cinco com AIDS) que apresentavam psoríase moderada a grave e fizeram uso de IB (etanercepte, infliximabe ou ustequinumabe) entre 2008 e 2016. O seguimento médio foi de três anos: 76% alcançaram PASI 75, e o CD4 ficou estável ou até aumentou em alguns pacientes. Um paciente que recebeu infliximabe desenvolveu tuberculose miliar. Os autores concluem que esses IB foram eficazes e apresentaram perfil de segurança aceitável nessa população.31
Em série italiana de 10 pacientes com infecção pelo HIV e psoríase, publicada em 2017, seis receberam anti‐TNF (quatro etanercepte e dois adalimumabe) e quatro receberam ustequinumabe. Todos alcançaram PASI 75 em três meses. O seguimento médio foi de 35 meses, e nenhum paciente apresentou IO nesse período.32
Relato de dois pacientes com HIV e psoríase eritrodérmica que receberam anti‐IL17 (um secuquinumabe e outro ixequizumabe) mostrou que ambos tiveram rápido controle da eritrodermia, sem complicações infecciosas.33
Já há também relatos do uso de anti‐IL23 para tratamento de psoríase em pacientes com infecção pelo HIV demonstrando eficácia e segurança.34
Revisão sistemática recentemente publicada a respeito do uso do dupilumabe em pacientes com infecção pelo HIV reuniu 27 casos (23 publicados e quatro de experiência pessoal do autor). Desses, 96% apresentaram melhora da asma ou da DA, sem alterações da carga viral em 100% deles e sem alteração do CD4 em 80%. Os autores concluem que essa medicação é segura se utilizada em pacientes com CD4 estável e carga viral baixa.35
Transplante de órgãos sólidos e imunobiológicosRevisão sistemática publicada em 2021 avaliou a segurança do uso dos IB em pacientes receptores de transplante de órgãos sólidos. Foram revisados 111 artigos, dos quais 57 eram séries de casos, com um total de 187 pacientes. Destes, 141 haviam recebido transplante de fígado, 42 de rim, três de coração e um de rim‐fígado. Com relação aos medicamentos imunossupressores recebidos por esses pacientes, os mais utilizados foram os inibidores da calcineurina, seguidos pelos corticosteroides, micofenolato sódico e, por último, os inibidores da m‐Tor. Quanto à indicação de IB, em 81% dos pacientes foi DII; 7,5% tiveram indicações reumatológicas; em 6%, febre hereditária periódica; e em 5%, psoríase. A classe de IB mais utilizada foi anti‐TNF (78% dos pacientes). Verificou‐se que 29% dos pacientes apresentaram infecções; as mais frequentes foram as infecções bacterianas e as virais, por citomegalovírus e herpes simples. Neoplasias ocorreram em 9% dos pacientes, principalmente tumores colorretais e câncer de pele não melanoma. Ocorreram nove óbitos entre os 187 pacientes, mas os autores concluem ser difícil estabelecer uma relação direta ente o uso dos IB e os óbitos, pelo grande número de variáveis envolvidas.28
Com relação aos anti‐TNF, vários artigos mencionam risco aumentado de câncer de pele não melanoma e de infecções graves, inclusive como causa de óbito, em receptores de órgãos sólidos.36,37
Quanto aos anti‐IL, o número de publicações é pequeno, até por serem IB de uso mais recente. Há relatos publicados do uso do anti‐IL12/23 (ustequinumabe) para psoríase e DII com boa resposta ao tratamento e sem complicações.38,39 Com relação aos anti‐IL17, há dois relatos de pacientes com psoríase que receberam ixequizumabe, com bom controle da psoríase e também sem complicações.40
O guideline de tratamento de psoríase da American Academy of Dermatology menciona que os IB (anti‐TNF, anti‐IL12/23, anti‐IL17 e anti‐IL23) podem ser utilizados em pacientes com infecção pelo HIV, desde que estejam recebendo TARV, apresentem CD4 normal, carga viral indetectável e que não tenham IO recentes. Não há menção ao uso de IB em receptores de transplante de órgão sólido.41
O Consenso Brasileiro de Psoríase de 2020 também sugere que os IB podem ser utilizados em pacientes com infecção pelo HIV, avaliando‐se caso a caso, e que seriam possivelmente mais seguros para esses pacientes do que imunossupressores como o metotrexato e a ciclosporina. O Consenso também não menciona seu uso em pacientes transplantados.6
Portanto, quanto ao uso de IB em pacientes imunocomprometidos, os estudos sugerem que, em pacientes com infecção pelo HIV, dentre os IB, preferencialmente os anti‐IL podem ser utilizados somente naqueles em uso regular da TARV, carga viral indetectável, CD4 normal e sem infecções recentes. Em receptores de transplante de órgão sólido, os IB devem ser evitados, mas quando muito necessário, os anti‐IL parecem ser mais seguros do que os anti‐TNF.
Infecções fúngicas e terapia imunobiológicaO risco real de infecções fúngicas secundárias ao uso de IB é difícil de precisar em virtude da inerente predisposição a infecções fúngicas em pacientes com doenças autoimunes, ao uso concomitante de imunossupressores e à endemicidade geográfica de algumas micoses.42
Anti‐TNFJá na primeira década de uso, algumas revisões chamaram atenção para a associação de infecções fúngicas aos anti‐TNF,43,44 e em 2008 a FDA alertou sobre o aumento do risco de infecções fúngicas invasivas após 240 casos de histoplasmose.45 Duas décadas após, há algumas evidências sobre IO com o uso desses fármacos.42,43 Os anti‐TNF foram associados a um pequeno, porém significante, aumento do risco de infecções graves. O adalimumabe e o infliximabe são associados a risco maior de IO, incluindo infecções fúngicas como histoplasmose, coccidioidomicose, candidíase e aspergilose, em comparação ao etanercepte.46 No entanto, depois de um número maior de pacientes tratados ao longo do tempo, pode‐se considerar que infecções fúngicas são infrequentes. Num estudo com mais de 30.000 pacientes tratados com anti‐TNF durante 2007‐2009, 158 pacientes (0,51%) desenvolveram micoses ou micobacterioses; cerca de metade dessas infecções foram fúngicas, incluindo histoplasmose, pneumocistose, criptococcose, coccidioidomicose, e blastomicose.47 Em relação aos novos anti‐TNF, um estudo recente constatou que o risco de infecção grave com certolizumabe não foi significantemente maior do que com outros anti‐TNF.48 A segurança do golimumabe foi verificada em uma grande série recente na qual as infecções foram o efeito adverso mais comum; entretanto, nenhuma infecção fúngica foi observada.49
Anti‐ILPacientes psoriásicos em uso de ustequinumabe apresentaram frequência menor de infecções graves do que foi observado durante o tratamento com infliximabe e outros IB. Uma avaliação de segurança de longo prazo incluiu 1.482 pacientes com pelo menos quatro anos de exposição ao ustequinumabe, e nenhuma infecção fúngica foi relatada.50
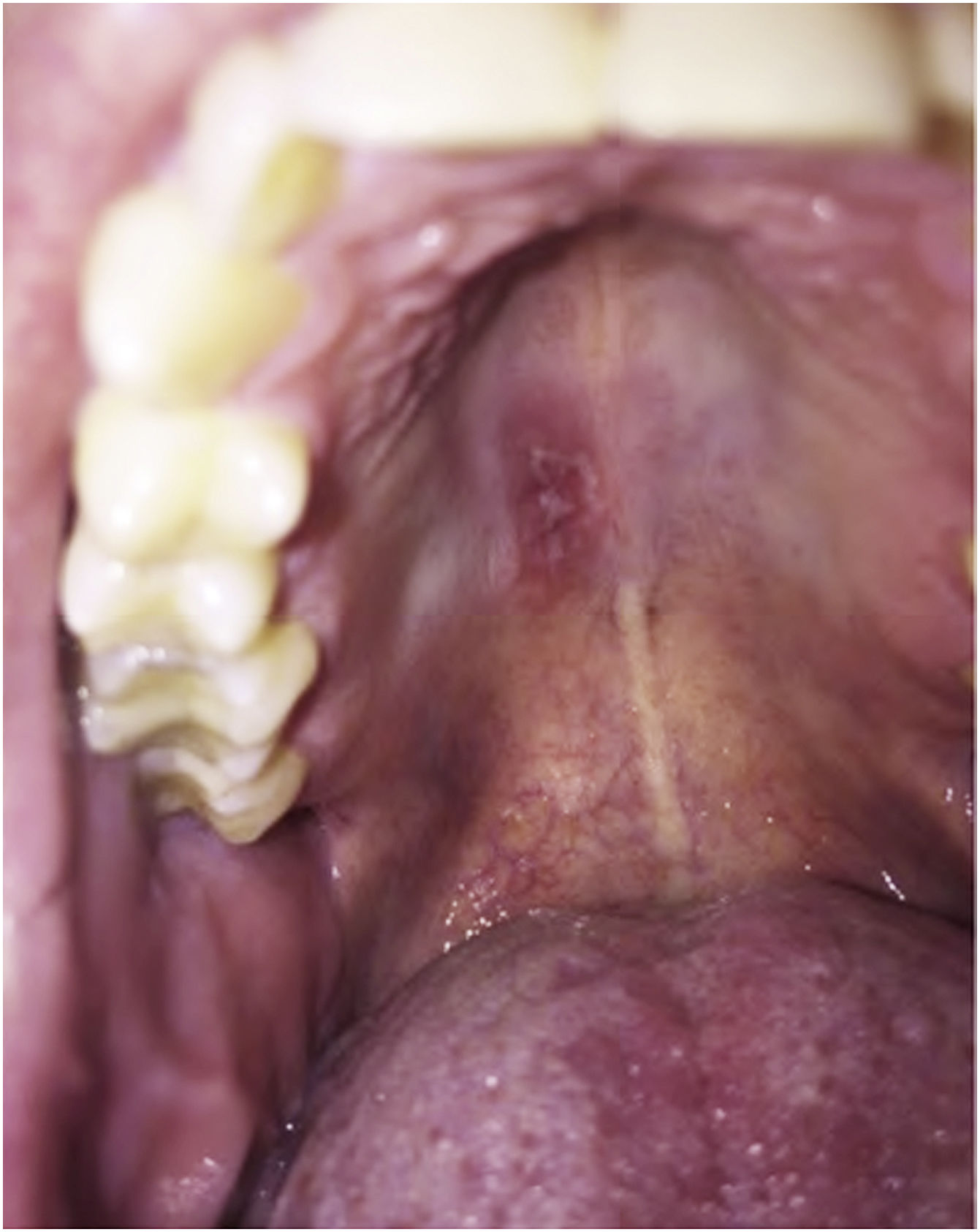
As imunodeficiências primárias que resultam de mutações nos genes que codificam a IL17 aumentam a suscetibilidade a infecções por cândida. Como esperado, nos pacientes que receberam anti‐IL17 (brodalumabe, secuquinumabe e ixequizumabe) houve aumento da incidência de candidíase. No entanto, na maioria das vezes a resposta terapêutica foi boa, sem necessidade de suspender o anti‐IL17.51 A figura 2 apresenta um caso de candidíase oral com uso de anti‐IL17.
O risco de infecção fúngica sistêmica com anti‐IL23 em pacientes com psoríase foi investigado em 16 estudos controlados e randomizados. Não foram observados casos de infecções fúngicas graves em pacientes tratados com risanquizumabe, guselcumabe e tildraquizumabe.52
Uma metanálise incluindo oito estudos controlados mostrou que os pacientes tratados com dupilumabe apresentaram menor risco de infecção cutânea e aumento não significante de infecções por herpes. A normalização da barreira da pele, microbioma e tratamento da resposta imune aberrante na DA são motivos possíveis.53
RituximabeO risco de infecções fúngicas invasivas após o tratamento com anticorpos monoclonais anti‐CD20 parece ser baixo, e uma exceção poderia ser a pneumocistose, pois alguns estudos sugeriram possível risco aumentado.54 No entanto, as evidências atuais sustentam que a profilaxia anti‐Pneumocystis deve ser considerada apenas naqueles que também recebem outros imunossupressores concomitantes.55
As doenças autoimunes já carregam risco inerente de infecções e, portanto, é importante avaliar o risco específico de infecção por imunossupressores em cada doença. Apesar de alguma variabilidade, nas doenças imunomediadas sistêmicas há maior probabilidade de utilizar múltiplos imunossupressores e em doses mais elevadas, ao contrário do que ocorre nos pacientes dermatológicos. O uso concomitante de outros imunossupressores é fator bem estabelecido para aumentar o risco de infecções fúngicas em pacientes em uso de anti‐TNF.56
Uma revisão de 19 estudos para avaliar a incidência de infecções fúngicas em pacientes em uso de IB para psoríase incluiu 4.547 pacientes em uso de etanercepte, infliximabe, adalimumabe ou ustequinumabe. Houve um caso de coccidioidomicose em paciente usando adalimumabe, e nenhuma infecção fúngica grave foi relatada.57
Um estudo retrospectivo recente verificou o benefício da profilaxia com cotrimoxazol no risco de pneumonia por Pneumocystis em pacientes com pênfigo em uso de rituximabe. Foram revisados os prontuários de 494 pacientes, dos quais 235 receberam cotrimoxazol. A incidência de PCP foi baixa, sem diferença significante entre os grupos (p=0,84). Os autores concluíram que não há consenso sobre a necessidade de profilaxia em virtude da baixa incidência de complicações da PCP nesses pacientes, e não é obrigatório tratar todos os pacientes com pênfigo recebendo rituximabe.58
Infecções fúngicas endêmicas no BrasilA paracoccidioidomicose (PCM) é micose sistêmica causada por Paracoccidioides brasiliensis e P. lutzii, endêmica e limitada à América Latina, do México à Argentina. Apesar de incomum, a PCM tem sido relatada em pacientes com imunossupressão, e a maioria desses em pacientes com HIV. Apenas três casos de PCM relacionados a IB foram relatados.59–61 Nesses pacientes, a infecção surgiu mais de um ano após a introdução da medicação.
Nas últimas décadas, a esporotricose emergiu como micose endêmica associada à transmissão felina no Sul e Sudeste do Brasil. Assim como na PCM, a esporotricose disseminada tem sido descrita em pacientes com AIDS; há poucos relatos da doença em pacientes com outras condições imunossupressoras e escassos com terapia biológica.62 Como o uso de IB vem aumentando, esses casos, embora raros, demonstram a importância de incluir PCM e esporotricose na lista de IO em pacientes em imunoterapia de longa duração provenientes de áreas endêmicas.63
Hanseníase e imunobiológicosEm 2004, dados do sistema de notificação de eventos adversos da FDA foram analisados para verificar a incidência de infecções granulomatosas durante o uso de anti‐TNF. Até aquela data, 346.000 pacientes haviam sido tratados com infliximabe e etanercepte, e 639 eventos adversos infecciosos haviam ocorrido. No grupo do infliximabe, houve apenas um caso de hanseníase, mas não foram fornecidas informações adicionais sobre o paciente.43
Um estudo multicêntrico brasileiro examinou dados de 1.037 pacientes (750 tratados com IB e 287 controles). Infecções ocorreram em 23% dos pacientes em uso de IB, a maioria de vias aéreas superiores, três casos de tuberculose e apenas um caso de hanseníase tuberculoide.64
Em 2020, uma revisão sistemática analisou a incidência de hanseníase em pacientes em uso de anti‐TNF. Ao final, 10 pacientes adquiriram hanseníase no Brasil (n=6), Estados Unidos (n=2), Grécia (n=1) e Espanha (n=1). No Brasil e na Índia, a hanseníase é endêmica, e a Índia relata o maior número de casos da doença globalmente, com 114.451 casos em 2019; portanto, os autores argumentam que os pacientes da Índia deveriam estar nesta lista. Eles consideraram que dificuldades financeiras e a falta de disponibilidade poderiam reduzir o uso de produtos IB em países endêmicos e explicar a ausência de casos de hanseníase na Índia.65
Um estudo de coorte recente avaliou o risco de hanseníase em pacientes em uso de IB e imunossupressores convencionais para doenças dermatológicas e reumatológicas. Foram incluídos 405 pacientes (268 imunossuprimidos) de 2014 a 2019. Dez casos de hanseníase foram diagnosticados (nove em imunossuprimidos). O uso de corticosteroides foi associado a risco aumentado de hanseníase, e o uso dos anti‐TNF foi associado a menor risco de hanseníase do que os corticosteroides.66
Tratamento das reações hansênicas com imunobiológicosAs reações hansênicas são eventos imunoinflamatórios agudos que ocorrem em alguns pacientes em resposta a antígenos do M. leprae. Frequentemente são acompanhados de neurites e aumentam a chance de incapacidade. O pequeno número de casos publicados (nove no total) indica que os anti‐TNF podem ser úteis no tratamento de indivíduos com reações refratárias crônicas ou incapazes de tolerar terapias padrão em virtude dos efeitos adversos. Uma vez que mesmo os estados reacionais crônicos tendem a evoluir com diminuição da gravidade e frequência ao longo do tempo, são necessários ensaios clínicos randomizados para estabelecer o papel dos anti‐TNF no tratamento de reações graves.65,67
Hepatites e imunobiológicosO risco exato de reativação de hepatite B e C nos pacientes em uso de terapia biológica não é definido uma vez que esses pacientes não podem participar dos estudos pivotais das medicações, em virtude dos critérios de exclusão.
Estima‐se que a hepatite B possa acometer mais de 370 milhões de pessoas no mundo. A prevalência de hepatite B em psoríase nos Estados Unidos é de 0,5%, e de hepatite C, 1,3%. Não há dados de prevalência disponíveis no Brasil até o momento nessa população.6,68,69 Em pacientes com pênfigo, estudos estimam que a prevalência de hepatite B seja de 0,6%‐1,2%.70,71
Todos os pacientes devem realizar sorologias para hepatite B e C antes de iniciar a terapia com IB.
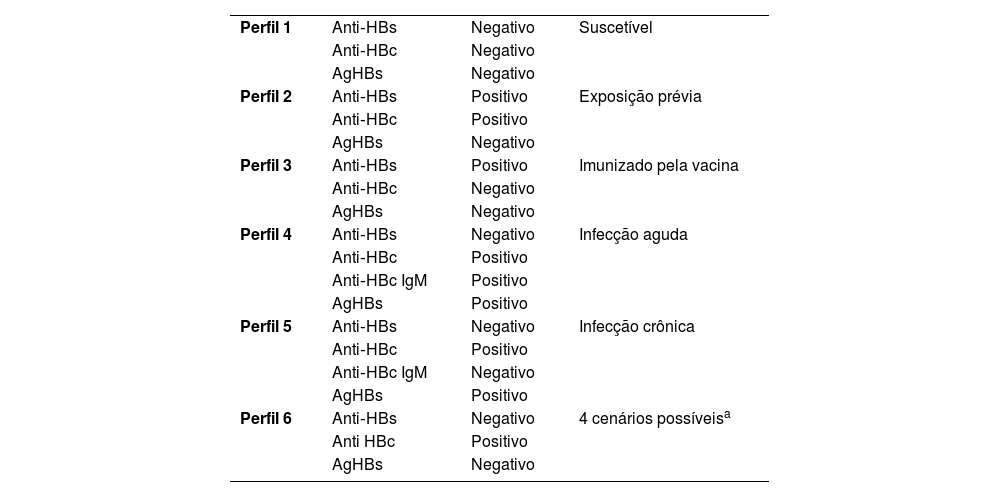
Hepatite BRecomenda‐se que antes de iniciar o uso da terapia com IB todos os pacientes realizem sorologia para hepatite B, incluindo anti‐HBc (anticorpo contra o core do vírus da hepatite B), AgHBs (antígeno de superfície do vírus da hepatite B) e anti‐HBs (anticorpo contra o antígeno de superfície do vírus da hepatite B). A tabela 1 mostra os perfis sorológicos possíveis e suas interpretações.69–71
Interpretação dos perfis sorológicos da hepatite B
| Perfil 1 | Anti‐HBs | Negativo | Suscetível |
| Anti‐HBc | Negativo | ||
| AgHBs | Negativo | ||
| Perfil 2 | Anti‐HBs | Positivo | Exposição prévia |
| Anti‐HBc | Positivo | ||
| AgHBs | Negativo | ||
| Perfil 3 | Anti‐HBs | Positivo | Imunizado pela vacina |
| Anti‐HBc | Negativo | ||
| AgHBs | Negativo | ||
| Perfil 4 | Anti‐HBs | Negativo | Infecção aguda |
| Anti‐HBc | Positivo | ||
| Anti‐HBc IgM | Positivo | ||
| AgHBs | Positivo | ||
| Perfil 5 | Anti‐HBs | Negativo | Infecção crônica |
| Anti‐HBc | Positivo | ||
| Anti‐HBc IgM | Negativo | ||
| AgHBs | Positivo | ||
| Perfil 6 | Anti‐HBs | Negativo | 4 cenários possíveisa |
| Anti HBc | Positivo | ||
| AgHBs | Negativo |
Adaptada de Lok. 2023.75
Cenários possíveis: 1) paciente se recuperando de hepatite B aguda; 2) paciente pode ter infecção prévia e o teste não ser sensível o suficiente para detectar níveis muito baixos de anti‐HBs; 3) falso‐positivo para anti‐HBc; 4) possível nível de AgHBs indetectável, e a pessoa está cronicamente infectada – possível hepatite B oculta (anti‐HBs pode ser positivo nesses casos também).
Todos os pacientes suscetíveis devem receber vacinação contra hepatite B, sempre que possível, antes de iniciar o tratamento com IB.
Todos os pacientes com passado de hepatite B devem realizar dosagem do DNA viral antes do início do tratamento com IB, portanto; pacientes AgHBs positivos devem realizar dosagem de DNA viral. O teste também deve ser considerado no caso de AgHBs negativo com anti‐HBc positivo, na tentativa de detectar hepatite B oculta.6,72–75
O risco de reativação da hepatite B parece ser maior em pacientes com infecção crônica pelo vírus e menor nos pacientes com infecção prévia ou hepatite oculta.6,72,73
Uso de quimioprofilaxiaRecomenda‐se o uso de quimioprofilaxia para pacientes com hepatite B crônica, e deve ser considerada em pacientes com infecção prévia e hepatite B oculta que forem submetidos à imunossupressão. Alguns autores consideram que a profilaxia deva ser empregada apenas nos pacientes com câncer em quimioterapia e nos pacientes transplantados de órgãos sólidos.76,77
Deve ser iniciada antes do tratamento e continuada por 6 a 18 meses após o final do mesmo. Os fármacos de escolha são o tenofovir e o entecavir.78
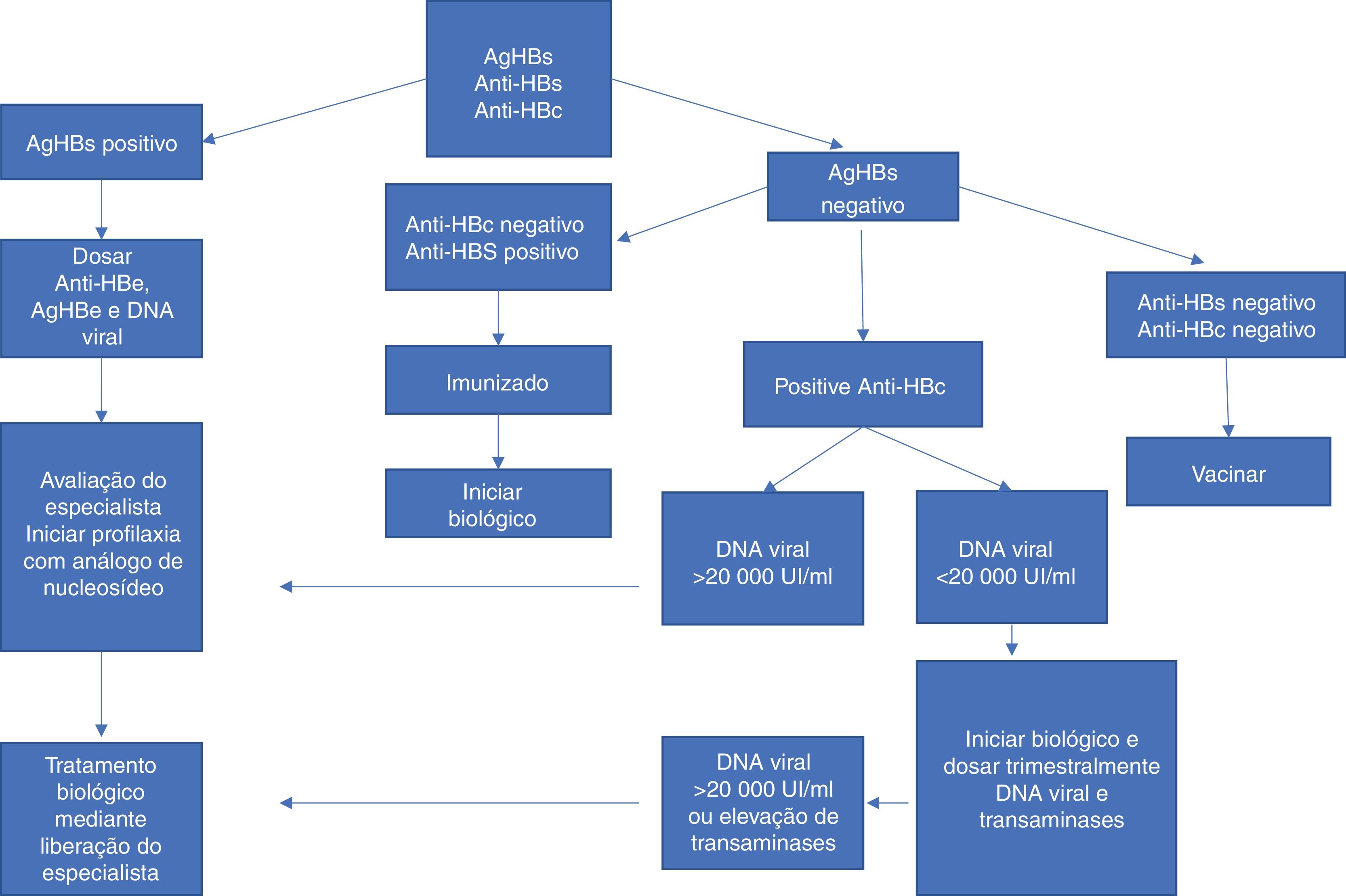
A figura 3 resume a conduta nos casos de uso de IB e hepatite B.
Conduta nos casos de uso de imunobiológico e hepatite B. Adaptada de Romiti et al., 2020.6
O uso dos antagonistas do TNF‐α parece estar associado a maiores taxas de reativação de hepatite B em relação ao ustequinumabe e ao secuquinumabe.72,73
Há estudos, porém, que posicionam o ustequinumabe como risco moderado para reativação de hepatite B, o que pode estar associado ao bloqueio da IL12 que teria papel importante no controle da replicação viral.78,79
Alguns autores sugerem que, em pacientes com psoríase e infecção pela hepatite B crônica ou prévia, a primeira escolha deva ser o uso dos anti‐IL17, seguidos pelos anti‐ IL23, porém a evidência para suportar essa recomendação é baixa, e mais estudos são necessários para embasá‐la.72
Hepatite B e dupilumabeA segurança do dupilumabe em pacientes com hepatite B é incerta. Os estudos pivotais com dupilumabe excluíram os pacientes com hepatite B.80
Relatos de caso sugerem não haver aumento do risco de reativação de hepatite B com o uso de dupilumabe.81
Apesar da pouca evidência, no que se refere aos pacientes com infecção crônica ou pregressa por hepatite B, alguns autores sugerem que nos casos de DA grave nos quais o uso de terapia sistêmica seja indicado, o dupilumabe deva ser o fármaco de escolha à frente de outros imunossupressores.82
Hepatite B e rituximabeOs dados sobre reativação da hepatite B em pacientes com pênfigo usando rituximabe são escassos. Estudos sugerem que o risco de reativação da hepatite B nesses pacientes não é tão alto quanto nos doentes com neoplasia hematológica e transplantados de órgão sólido usando rituximabe. O uso do rituximabe no tratamento dos pacientes com pênfigo parece ser mais seguro do que o uso de altas doses de corticosteroide, provocando menores taxas de reativação da hepatite B.71
Nesses casos, sugere‐se que a profilaxia antiviral seja iniciada antes do uso do IB, e mantida durante o tratamento por até 18 meses após seu término, com monitoramento de DNA viral e transaminases.71
Hepatite C e o uso de imunobiológicosNo que se refere a hepatite C e psoríase, o uso dos IB é contraindicado durante a hepatite aguda.69,83–86 O risco de reativação de hepatite C em pacientes com hepatite C crônica e baixos níveis de RNA viral parece ser muito baixo.69,83–86
O uso de IB pode ser feito com cautela, com acompanhamento de um especialista. Dosagens de transaminases e RNA viral devem ser feitos trimestralmente. Estudos prévios demonstraram, inclusive, que o uso de anti‐TNF levou a reduções na carga viral dos pacientes. Os anti‐IL17 parecem ter perfil de segurança favorável nessa população. A segurança dos anti‐IL23 em pacientes com psoríase e hepatite C crônica permanece incerta.69,83–86
Até o presente, não há clara evidência de que o uso do rituximabe piore o curso evolutivo da hepatite C nos pacientes com pênfigo. O risco‐benefício do uso da medicação deve ser discutido com o especialista (gastroenterologista; hepatologista; infectologista) e comparado às outras terapêuticas disponíveis para fornecer a melhor opção de acordo com cada caso.87
Há poucos dados na literatura sobre o uso de dupilumabe em pacientes com hepatite C, e o perfil de segurança ainda é incerto. Entretanto, alguns autores recomendam o uso do dupilumabe como terapêutica de primeira escolha nos pacientes com DA grave que necessitam do uso de imunossupressores para controle da doença.82
Vacinação: como proceder em pacientes sob terapia com imunobiológicosO risco de infecções é maior nos pacientes com doenças crônicas imunomediadas, como psoríase, DA e pênfigo vulgar. Além disso, há maior taxa de determinados tipos de infecções nos pacientes em terapia com IB, destacando‐se infecções respiratórias, seguida pelo herpes‐zóster.88,89
A maior ocorrência de herpes‐zóster em idosos e indivíduos imunocomprometidos gera importante morbidade, podendo resultar em dor, depressão, neuralgia pós‐herpética, encefalite, doença oftalmológica com perda de visão e manifestação neurológica como a síndrome de Ramsay‐Hunt. Em imunocomprometidos, o acometimento oftalmológico ocorre em até 25% dos pacientes, e neuralgia pós‐herpética em até 30% deles.90
A reativação de hepatite B com os tratamentos IB é baixa. Assim, a vacinação é uma das medidas preventivas de maior impacto na diminuição da ocorrência da hepatite, suas complicações e sequelas em qualquer faixa etária.6
Em virtude da maior suscetibilidade às infecções, sugere‐se que a atualização da carteira vacinal dos pacientes que têm indicação de terapia com IB seja implementada a fim de reduzir o risco de algumas infecções e, consequentemente, diminuir a taxa de morbimortalidade desse grupo específico de pacientes.91 Preferencialmente, deve‐se atualizar o cartão vacinal duas a quatro semanas antes de iniciar terapias potencialmente imunossupressoras, incluindo IB.92,93 A vacinação dos contactantes também é uma orientação importante.
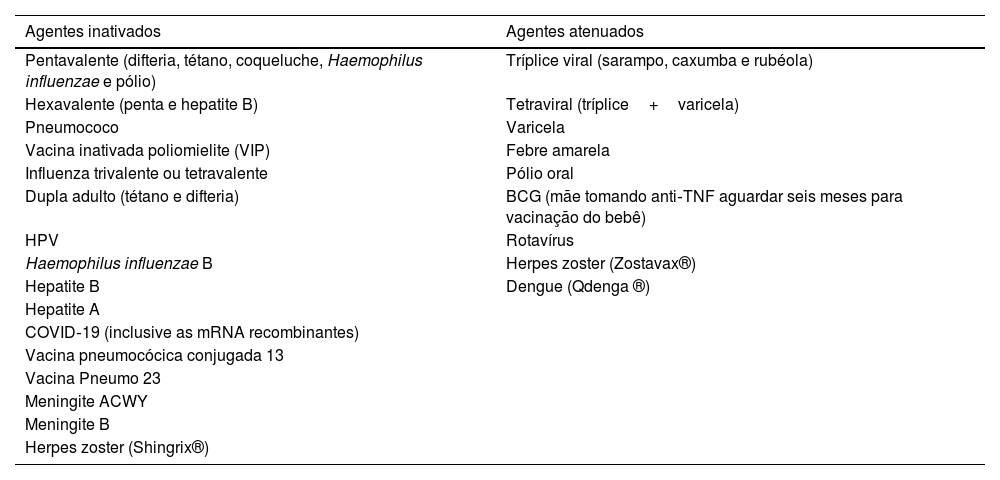
Vacinas de agentes vivos atenuados são geralmente contraindicadas em pacientes sob tratamento com imunomoduladores; porém, o risco de complicações depende do grau de supressão imune e dos fatores de risco individuais. Vacinas de agentes inativados podem ser aplicadas durante o uso de terapias sistêmicas imunomoduladoras, embora haja risco de reduzir sua imunogenicidade.93 A tabela 2 apresenta a lista das principais vacinas e a natureza dos agentes IB (inativados ou atenuados).6
Principais vacinas e a natureza dos agentes biológicos
| Agentes inativados | Agentes atenuados |
|---|---|
| Pentavalente (difteria, tétano, coqueluche, Haemophilus influenzae e pólio) | Tríplice viral (sarampo, caxumba e rubéola) |
| Hexavalente (penta e hepatite B) | Tetraviral (tríplice+varicela) |
| Pneumococo | Varicela |
| Vacina inativada poliomielite (VIP) | Febre amarela |
| Influenza trivalente ou tetravalente | Pólio oral |
| Dupla adulto (tétano e difteria) | BCG (mãe tomando anti‐TNF aguardar seis meses para vacinação do bebê) |
| HPV | Rotavírus |
| Haemophilus influenzae B | Herpes zoster (Zostavax®) |
| Hepatite B | Dengue (Qdenga ®) |
| Hepatite A | |
| COVID‐19 (inclusive as mRNA recombinantes) | |
| Vacina pneumocócica conjugada 13 | |
| Vacina Pneumo 23 | |
| Meningite ACWY | |
| Meningite B | |
| Herpes zoster (Shingrix®) |
Durante o tratamento com IB, faz‐se necessário avaliar a situação epidemiológica, a medicação em uso e a atividade da doença, para que se decida qual o melhor momento para a vacinação.92,93 A busca de janelas de oportunidade para vacinação deve ser feita. Deve‐se avaliar sempre o controle da doença versus risco de suspensão do fármaco de maneira individualizada. Sempre que possível, recomenda‐se completar a vacinação, respeitando‐se os intervalos entre a interrupção dos fármacos em uso e a imunização.91–94
No que se refere ao período de suspensão da aplicação dos IB antes e após o uso de vacinas com agentes vivos ou atenuados, recomenda‐se suspender o tratamento ao menos quatro a cinco meias‐vidas antes da vacinação, e aguardar cerca de 30 dias após a vacinação para reintrodução.95
Deve‐se orientar os pacientes quanto à possibilidade de receber imunização passiva nos Centros de Referência para Imunobiológicos Especiais (CRIE) frente à exposição a situações específicas, quando esse recurso for disponível: imunoglobulina humana anti‐hepatite B, antirrábica, antivaricela e antitetânica.
A vacinação contra a gripe deve ser indicada em todos os pacientes. Para aqueles com baixos níveis de complemento ou asplenia funcional, as vacinas contra Haemophilus influenza tipo B, pneumococo e meningococo devem ser as indicadas. A vacina pneumocócica conjugada 13 (VPC13) e a vacina para herpes‐zóster devem ser consideradas para todos os adultos (acima de 19 anos) em imunossupressão ou terapia com IB.92,93
Mais recentemente, foi desenvolvida uma vacina recombinante não viva para prevenção de herpes‐zóster (Shingrix®), que é a única recomendada em imunocomprometidos. A imunização se constitui de duas doses intramusculares: a primeira no mês zero e a segunda, dois a seis meses após.96
Outra questão importante é que seja realizada a imunização necessária com componentes vivos atenuados apenas após a leitura do teste de PPD, pois ambos não devem ser realizados concomitantemente, pelo risco de resultado falso‐negativo. Caso o paciente tenha recebido alguma dessas vacinas, o PPD só deverá ser efetuado após quatro semanas.97
Recomenda‐se refazer o cartão, juntamente com todas as vacinas indicadas para a faixa etária, em pacientes que não sabem referir sobre antecedentes vacinais ou que tenham perdido o cartão de imunização, considerando‐se como não previamente vacinados.
Devem‐se solicitar as sorologias disponíveis para verificar se o paciente é suscetível a alguma das doenças preveníveis por vacina, ou para confirmar resposta após sua administração. Para varicela, deve‐se considerar suscetível todo paciente que nega doença prévia ou não se recorda.98
Recomenda‐se verificar a soroconversão para hepatite B nos pacientes imunizados quando em terapia imunossupressora, e antes de iniciar o IB. Testes sorológicos para avaliar soroconversão, quando possíveis, devem ser realizados, e doses adicionais dos imunizantes devem ser administradas caso não tenha ocorrido de maneira adequada.99
Vale destacar que o uso de agentes anti‐TNF (principalmente certolizumabe e infliximabe), sexo masculino e vacinação para hepatite B após início do tratamento com anti‐TNF são fatores de risco para não resposta a essa vacina. Desse modo, a vacina para hepatite B deve ser administrada antes do início do tratamento com anti‐TNF ou no máximo até seis meses após o início.100 Já em relação à nova opção da VPC13, não se recomenda a verificação de reposta sorológica, pois ela não é representativa do status imunológico.101
Outro ponto importante é que as taxas de eventos adversos são semelhantes entre crianças que foram expostas intraútero a agentes anti‐TNF antes do terceiro trimestre de gestação e aquelas que foram expostas no terceiro trimestre. Todos os eventos adversos foram espontaneamente resolvidos, e nenhum evento grave ocorreu, como ativação de tuberculose ou morte. A administração da BCG após 6 meses de idade apresenta baixo risco em crianças expostas a agentes anti‐TNF no útero. Porém, a vacinação BCG não deve ser atrasada para além de 12 meses, mesmo se testes para dosagem do medicamento não forem possíveis. Mesmo em crianças que receberam a vacina BCG dentro dos seis primeiros meses após o nascimento, o risco foi baixo e sem eventos adversos graves. O custo‐benefício em se realizar ou não precocemente a vacinação deve ser individualizada e analisada de acordo com a epidemiologia de cada local.102
Em relação à COVID‐19, nenhuma das vacinas de uso populacional no Brasil é de vírus vivo atenuado e, portanto, todas elas podem ser utilizadas por pacientes em uso de medicações IB, salvo se houver alguma contraindicação específica.
A eficácia das vacinas pode ser reduzida em virtude do uso de medicamentos imunossupressores; no entanto, até o momento, não há estudos sobre efeitos das vacinas nos pacientes portadores de doenças crônicas e/ou em uso de IB.103
Em relação à monkeypox, existem três vacinas possíveis: ACAM2000, LC16 e MVA‐BN (Jynneos/Imvanex). A LC16 é um imunizante minimamente replicante, é a mais moderna e mais utilizada. Esse é o imunizante aprovado pela ANVISA e adquirido pelo governo brasileiro. Como é uma vacina de vírus atenuado pouco replicante, pode ser utilizada em indivíduos imunocomprometidos.104
Roteiro de condutaA seguir, apresentamos um roteiro de como avaliar e acompanhar os pacientes em uso de IB, tanto antes, quanto durante o tratamento.
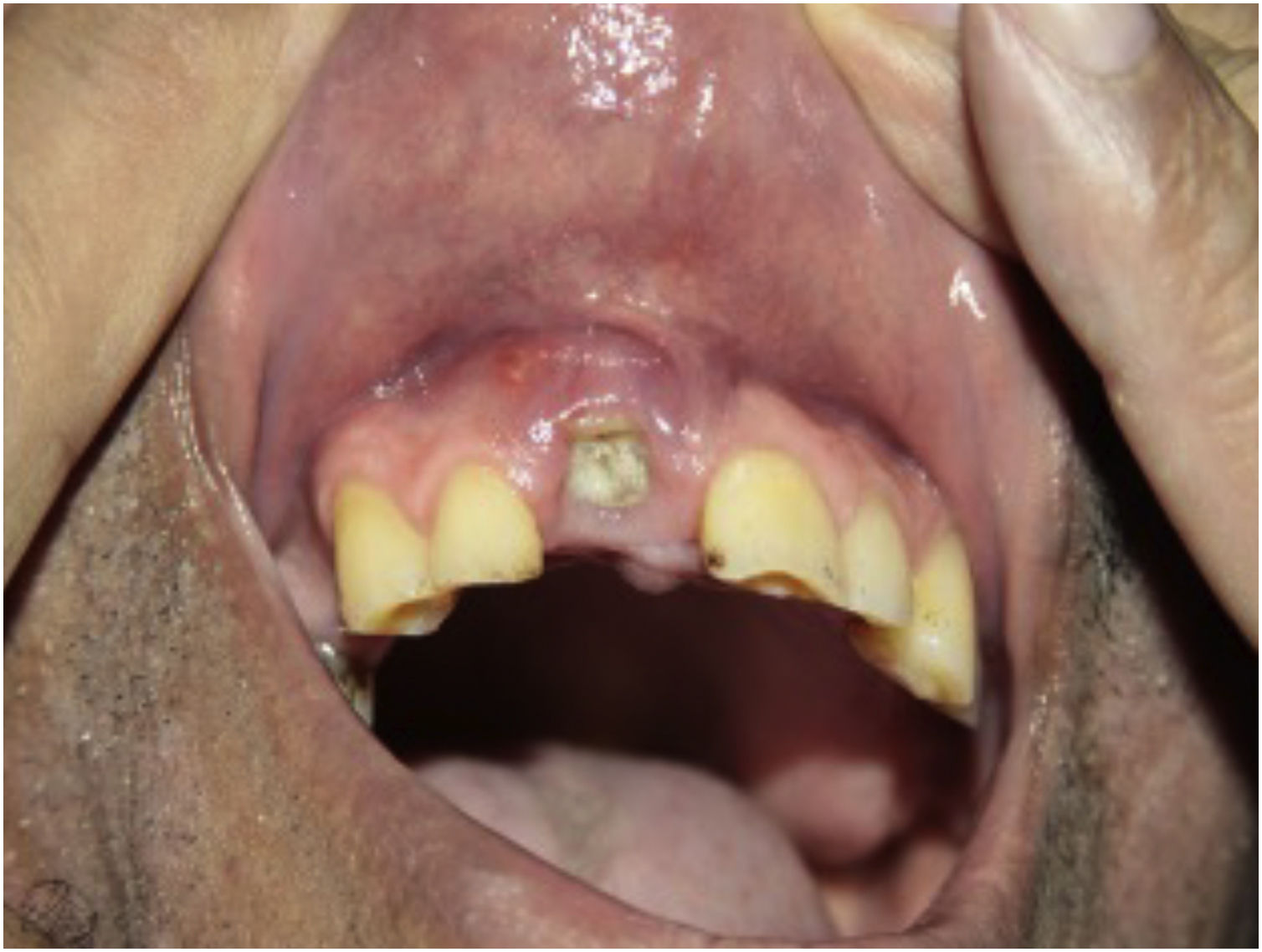
Pré‐tratamentoRealizar anamnese e exame físico completo. Verificar antecedentes epidemiológicos, principalmente procedência e viagens recentes. Na anamnese e durante o exame clínico, estar atento para sinais e sintomas de infecção (fig. 4), neoplasias (inclusive câncer de pele), gestação, doença desmielinizante e outras doenças autoimunes, bem como doença hepática e cardiovascular. Em pacientes com psoríase, avaliar o sistema musculoesquelético para investigar quadro de artrite psoriásica, dactilite ou entesite.26,105
A busca ativa de sinais de infecção, antes e durante a terapia biológica, deve incluir:26,105 pulso e temperatura; oroscopia e otoscopia; palpação linfonodal; ausculta cardíaca e de campos pleuropulmonares; palpação de abdome; inspeção de todo o tegumento, incluindo unhas e mucosas; inspeção da saúde dentária.
Orientações gerais: o tratamento com IB não deve ser iniciado na vigência de infecções, incluindo as infecções crônicas ou localizadas, e está totalmente contraindicado em pacientes com septicemia ou em risco de septicemia. O paciente deve ser alertado a evitar o contato com pessoas portadoras de infecções graves e contagiosas e procurar avaliação médica quando da presença de qualquer sinal ou sintoma de infecção. Estudos demonstram que o risco de infecções graves é maior durante os primeiros seis meses de tratamento com os IB anti‐TNF, principalmente quando comparado aos anos subsequentes.16
O calendário vacinal deve obrigatoriamente ser atualizado. O risco da presença de comorbidades deve ser discutido com o paciente, e sua identificação e seguimento devem constar da rotina de investigação. Assim, aferição dos níveis pressóricos, peso e medidas da cintura pélvica devem ser registrados antes e durante o tratamento.26,105
A seguir, listamos as contraindicações à introdução de IB em psoríase:106
Contraindicações absolutas: infecção aguda grave (p. ex., tuberculose ativa); hipersensibilidade a qualquer um dos ativos ou excipientes; necessidade de receber vacinas com vírus vivo atenuado concomitante ao tratamento.
Contraindicações relativas: infecções crônicas (hepatite B ou C, HIV); malignidades ou desordens linfoproliferativas.
Exames laboratoriais devem ser solicitados antes e durante a terapia com IB. A investigação específica de doenças autoimunes deverá ser solicitada na presença de indícios das doenças durante a anamnese e/ou exame físico.26,106,107 Na tabela 3, sugerimos os exames a serem solicitados, bem como a periodicidade de sua realização.
Exames de screening e durante o seguimento da terapia imunobiológica
| Exame | Pré | Cada 2 a 5 meses |
|---|---|---|
| Hemograma completo | X | X |
| Enzimas hepáticas | X | X |
| Função renal | X | X |
| Urina I | X | X |
| Teste de gravidez | X | X |
| PPD ou IGRA e RX de tórax | X | Quando indicado |
| Sorologias Hepatite e HIV | X | Quando indicado |
Modificada de Nast et al., 2017.106
Os mesmos cuidados com a anamnese e exame físico devem ser realizados periodicamente durante a terapia com IB. A vigilância ativa e contínua em relação à tuberculose nos pacientes tratados principalmente com anti‐TNF é mandatória, especialmente em países com altas taxas da doença ou nos indivíduos com permanência em zonas endêmicas.26,106,107 Exames de rotina devem preferencialmente ser solicitados a cada 2‐5 meses durante o seguimento (tabela 3).
Suporte financeiroNenhum.
Contribuição dos autoresRicardo Romiti: Concepção; Levantamento dos dados, ou análise e interpretação dos dados; redação do artigo ou revisão crítica do conteúdo intelectual importante; obtenção, análise e interpretação dos dados; revisão crítica da literatura; aprovação final da versão final do manuscrito.
André Luís da Silva Hirayama: Concepção; levantamento dos dados, ou análise e interpretação dos dados; redação do artigo ou revisão crítica do conteúdo intelectual importante; obtenção, análise e interpretação dos dados; revisão crítica da literatura; aprovação final da versão final do manuscrito.
Adriana Maria Porro: Concepção; levantamento dos dados, ou análise e interpretação dos dados; redação do artigo ou revisão crítica do conteúdo intelectual importante; obtenção, análise e interpretação dos dados; revisão crítica da literatura; aprovação final da versão final do manuscrito.
Heitor de Sá Gonçalves: Concepção; levantamento dos dados, ou análise e interpretação dos dados; redação do artigo ou revisão crítica do conteúdo intelectual importante; obtenção, análise e interpretação dos dados; revisão crítica da literatura; aprovação final da versão final do manuscrito.
Luciane Donida Bartoli Miot: Concepção; levantamento dos dados, ou análise e interpretação dos dados; redação do artigo ou revisão crítica do conteúdo intelectual importante; obtenção, análise e interpretação dos dados; revisão crítica da literatura; aprovação final da versão final do manuscrito.
Sandra Maria Barbosa Durães: Concepção; levantamento dos dados, ou análise e interpretação dos dados; redação do artigo ou revisão crítica do conteúdo intelectual importante; obtenção, análise e interpretação dos dados; revisão crítica da literatura; aprovação final da versão final do manuscrito.
Silvio Alencar Marques: Concepção; levantamento dos dados, ou análise e interpretação dos dados; redação do artigo ou revisão crítica do conteúdo intelectual importante; obtenção, análise e interpretação dos dados; revisão crítica da literatura; aprovação final da versão final do manuscrito.
Conflito de interessesRicardo Romiti: Abbvie – conselho consultivo, consultor, palestrante, investigador; Boehringer‐Ingelheim – conselho consultivo, consultor, palestrante, investigador; Eli‐Lilly – conselho consultivo, consultor, palestrante, investigador; Janssen – conselho consultivo, consultor, palestrante; Leo Pharma – conselho consultivo, consultor, palestrante; Novartis – conselho consultivo, consultor, palestrante; UCB Biopharma – conselho consultivo, consultor, palestrante.
André Luís da Silva Hirayama: Abbvie – palestrante, investigador; Boehringer‐Ingelheim – palestrante, consultor, investigador; Eli‐Lilly – investigador; Janssen – palestrante, consultor; Novartis – palestrante, consultor.
Adriana Maria Porro: Abbvie – conselho consultivo, outros; Boehringer‐Ingelheim – conselho consultivo; Janssen – conselho consultivo, investigador, outros; Leo Pharma – palestrante, outros; Novartis – conselho consultivo, outros; Pfizer – outros.
Heitor Sá Gonçalves: Nenhum.
Luciane Donida Bartoli Miot: Abbvie – palestrante, investigador; Janssen – palestrante; Novartis – palestrante.
Sandra Maria Barbosa Durães: Nenhum.
Silvio Alencar Marques: Abbvie – investigador; Boehringer‐Ingelheim – consultor.
Como citar este artigo: Romiti R, Hirayama ALS, Porro AM, Gonçalves HS, Miot LDB, Durães SMB, et al. Infections in the era of immunobiologicals. An Bras Dermatol. 2024;9:167–80.
Trabalho realizado no Departamento de Dermatologia, Hospital das Clínicas da Universidade de São Paulo, São Paulo, SP, Brasil.