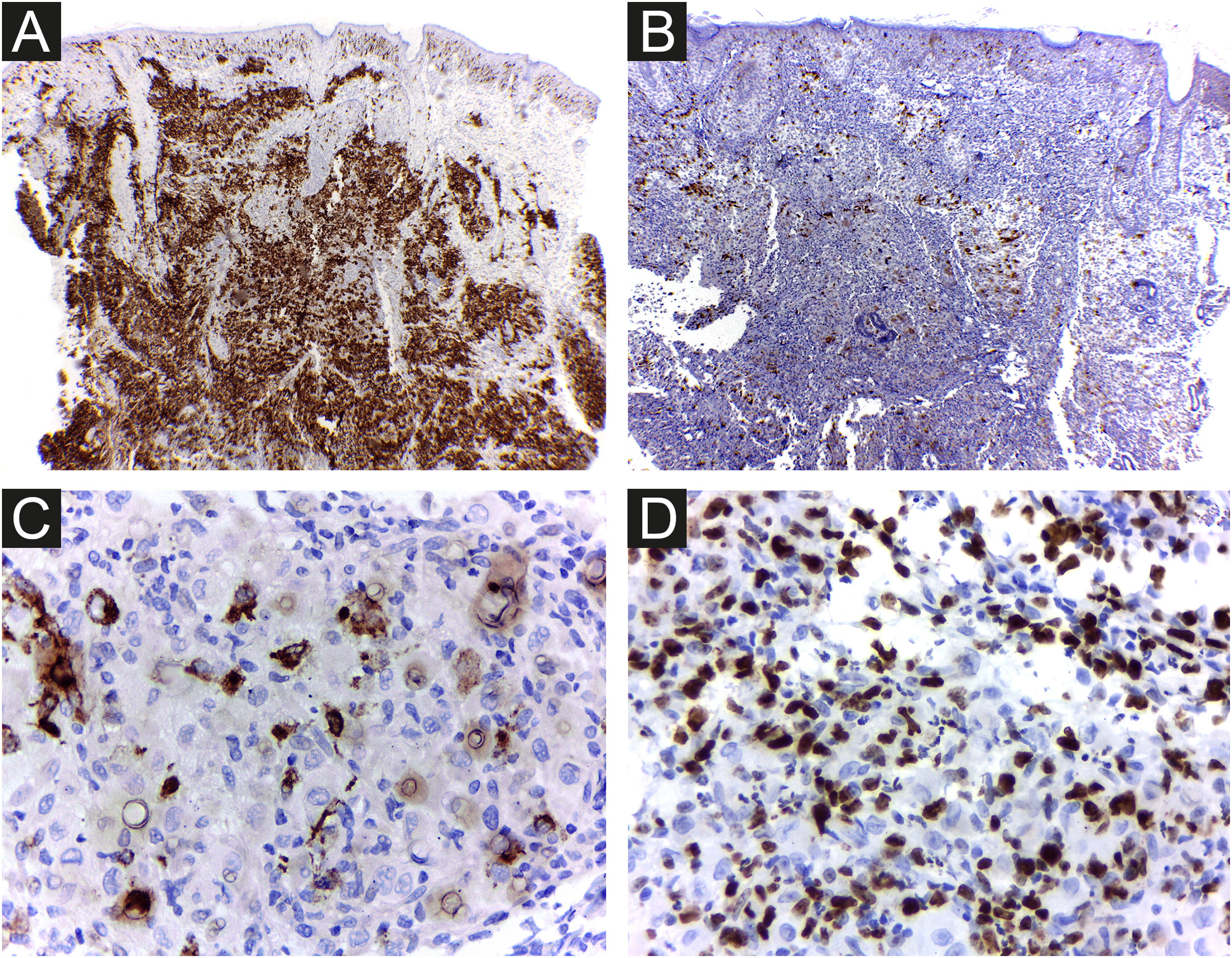
A retículo‐histiocitose de Hashimoto‐Pritzker congênita e autocurativa é a variante benigna da histiocitose de células de Langerhans (HCL). Caracteriza‐se por múltiplas lesões cutâneas (congênitas ou que surgem nos primeiros dias após o nascimento), sem manifestações sistêmicas e com resolução espontânea em dias a meses. Relata‐se o caso de um menino com lesão cutânea congênita em uma das pernas, variante rara da doença. Na histopatologia, foi encontrada densa infiltração cutânea de células imunomarcadas com proteína S100, CD1a, e CD207. O índice de imunorreatividade com Ki‐67 foi alto (62%). A resolução espontânea completa ocorreu sete dias após a biópsia (25 dias após o nascimento). Doença monolesional, lesão de membro distal, ausência de lesões em mucosa ou área seborreica e menos de 25% de células de Langerhans com grânulos de Birbeck foram considerados possíveis indícios para um prognóstico favorável na HCL. Porém, como medida de precaução, a criança será acompanhada até pelo menos os 2 anos de idade.
A histiocitose de células de Langerhans (HCL) compreende quatro variantes clínicas: Hand‐Schüller‐Christian, granuloma eosinofílico, Letterer‐Siwe e Hashimoto‐Pritzker.
Em comum, apresentam proliferação de células de Langerhans (CLs), com grânulos de Birbeck na microscopia eletrônica e imunorreatividade para proteína S100, CD1a e CD207 (langerina).1
A retículo‐histiocitose de Hashimoto‐Pritzker congênita e autocurativa é a variante benigna da HCL. A doença é caracterizada por múltiplas lesões cutâneas, congênitas ou surgindo nos primeiros dias após o nascimento, sem manifestações sistêmicas, e com resolução espontânea em dias a meses.1 A apresentação como lesão única, mais rara, é descrita.
Relato do casoUm recém‐nascido do sexo masculino, saudável, apresentou lesão única de pele na perna esquerda. Ele foi concebido por fertilização in vitro, de pais não consanguíneos; todos os exames sorológicos pré‐natais foram normais e o parto ocorreu por cesariana, sem intercorrências. Ao nascimento, foram administradas as vacinas BCG e contra hepatite B.
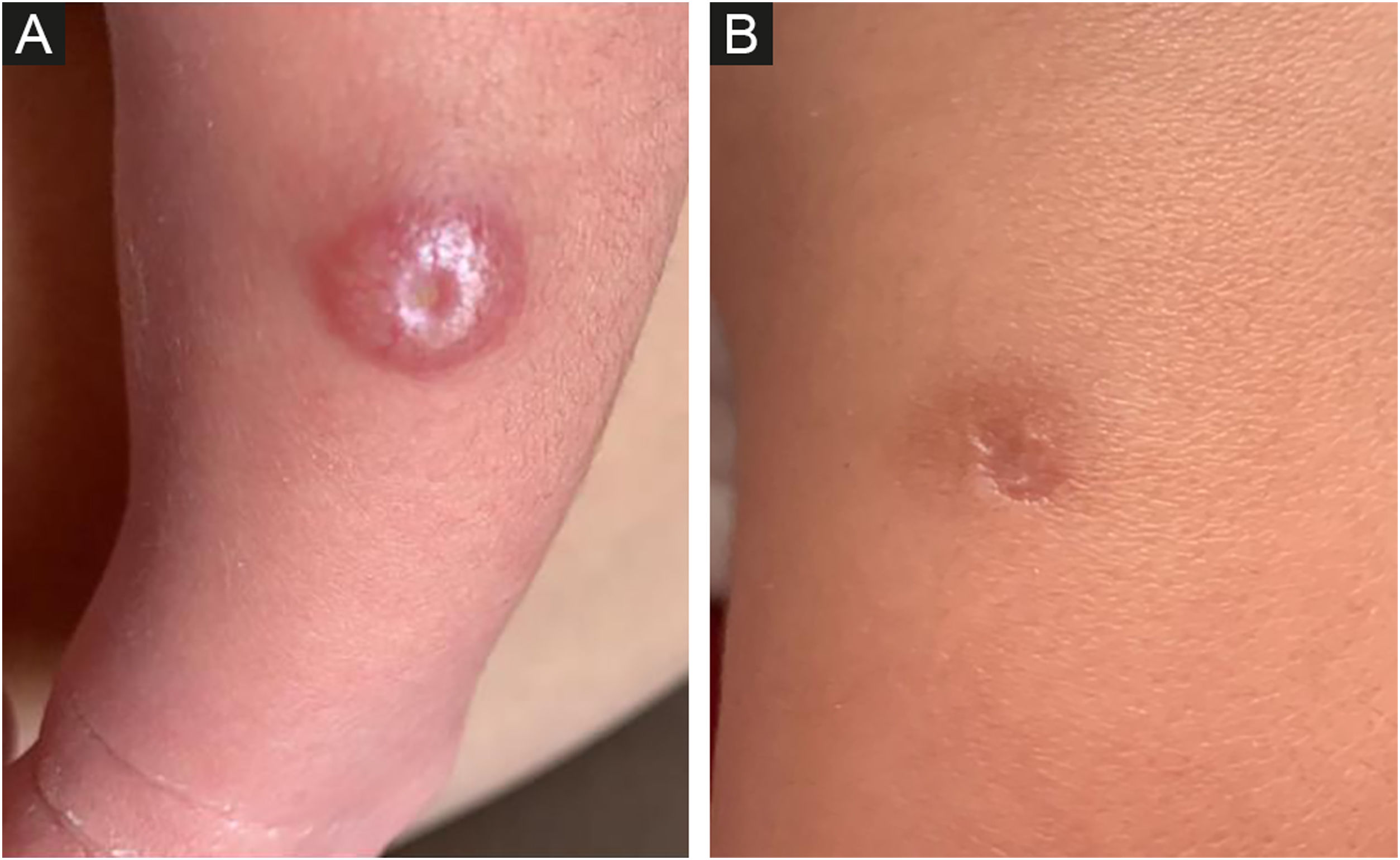
O exame dermatológico revelou, na perna esquerda (terço médio, face ântero‐lateral), a presença de lesão pápulo‐nodular, eritemato‐hipercrômica, medindo 1,2cm, com centro exulcerado (fig. 1A). Após dez dias, não houve melhora com o uso de antibióticos e a lesão estava mais infiltrada e brilhante, medindo 1,5cm de diâmetro, com ulceração central de 0,4cm.
Histiocitose de Hashimoto‐Pritzker. (A) Lesão congênita pápulo‐nodular, eritemato‐hipercrômica, na pele da perna esquerda, com centro ulcerado. (B) Autorregressão completa 27 dias após o nascimento e sete dias após a biópsia. A área central da cicatriz corresponde ao local da biópsia por punch.
Aos 18 dias de idade, foi realizada biópsia e, após sete dias, a lesão apresentou resolução completa, sendo substituída por uma mácula hipercrômica de 1cm, com área cicatricial central correspondente ao local da biópsia por punch (fig. 1B).
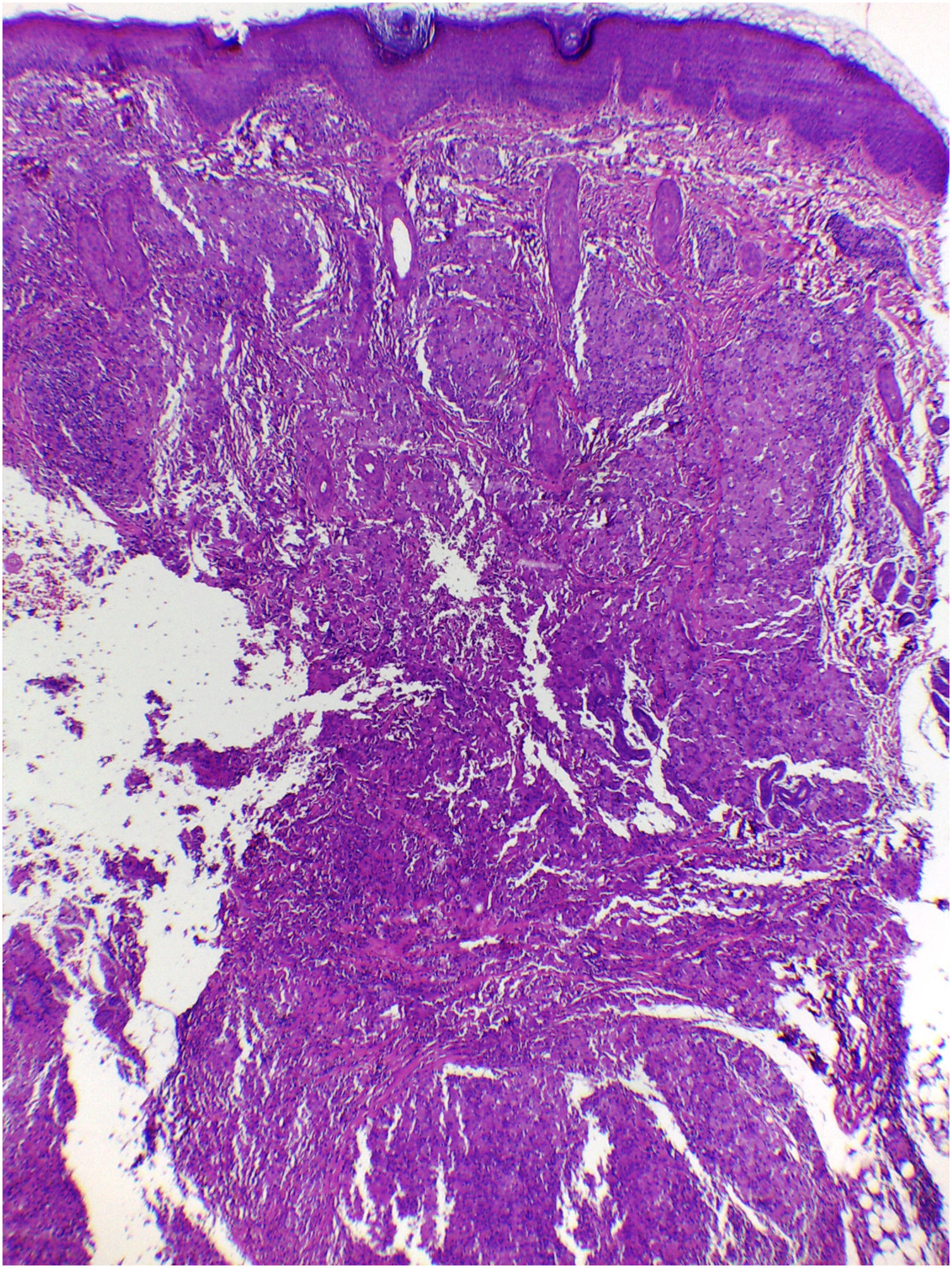
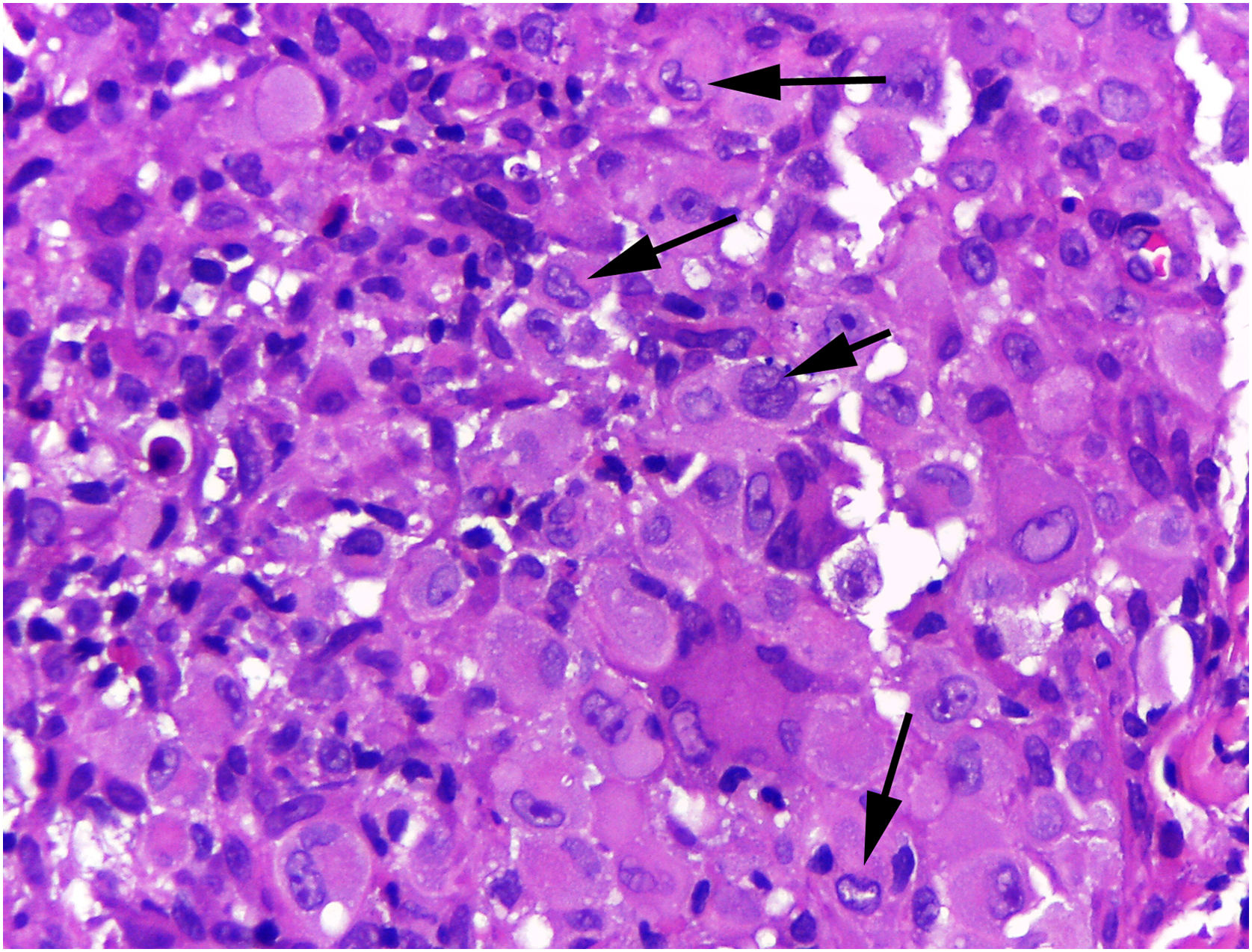
Na histopatologia, a derme e a hipoderme apresentavam‐se densamente infiltradas por células com citoplasma eosinofílico abundante, núcleos claros ovoides ou em forma de rim, com várias mitoses, misturadas com pequena quantidade de eosinófilos e linfócitos (figs. 2–4).
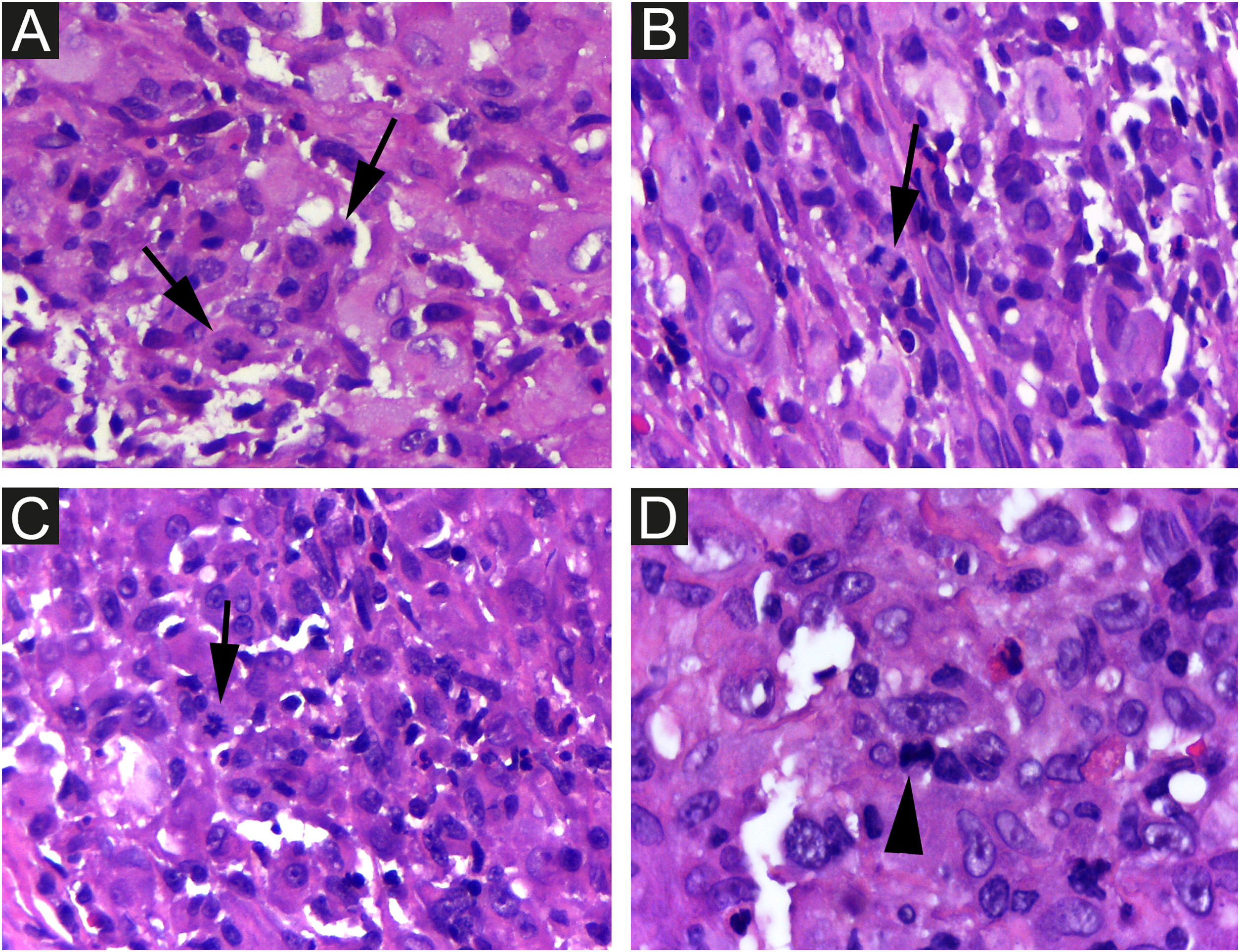
As células foram fortemente imunorreativas com as proteínas CD1a e S100, e menos para CD207; o índice de Ki67 foi alto (62%; fig. 5).
Os exames laboratoriais de rotina, ultrassonografia e radiografias ósseas foram normais, sem recorrência no seguimento aos 8 meses de vida.
DiscussãoA retículo‐histiocitose de Hashimoto‐Pritzker (RHP) é caracterizada por múltiplas lesões dermatológicas nodulares.1 Entretanto, a frequência da forma solitária é provavelmente subestimada, talvez pela rápida regressão espontânea das lesões, pelos achados clínicos inespecíficos e porque algumas lesões passam despercebidas e não são diagnosticadas. Zunino et al. relataram oito casos e, na literatura revisada, encontraram 30% dos casos com lesão única.2
Para estabelecer o diagnóstico de HCL, é necessário o suporte de dados clínicos, histopatológicos e imuno‐histoquímicos. Os diagnósticos diferenciais considerados na presença de lesão pápulo‐nodular congênita são o mastocitoma congênito, granuloma eosinofílico, xantogranuloma juvenil, nevo de Spitz congênito, hemangioma, forma cutânea de leucemia ou linfoma, fibrossarcoma congênito, hamartoma infantil e miofibroma infantil.2 O infiltrado misto de células inflamatórias contendo macrófagos com amplo citoplasma acidófilo e núcleos clivados é indicativo dessa condição. A imunomarcação com CD1a e CD207 define a presença de HCL. Os mesmos achados histopatológicos da lesão solitária podem ser vistos na doença multifocal uni ou multissistêmica.3
No estudo imuno‐histoquímico das amostras de sete pacientes com HPR, foi encontrada imunorreatividade para as proteínas S100 e CD1a. O fenótipo de CLs foi confirmado pela presença específica de grânulos de Birbeck na microscopia eletrônica, realizada em metade dos casos.2 A langerina (CD207) é um receptor de superfície nas CLs, um dos principais constituintes moleculares dos grânulos de Birbeck. A imunomarcação para CD207 permite descartar a possibilidade de histiocitose indeterminada.3
É difícil prever a gravidade da doença com base nos achados clínicos e histopatológicos iniciais. Há risco de mortalidade de aproximadamente 3%, e a chance de recidiva na RHP é de 10%.3 Portanto, é importante que os médicos descartem formas congênitas mais graves de HCL e realizem exames regulares de seguimento dos pacientes para evitar mortalidade futura. Considerando a HCL em geral, o paciente do presente caso apresentava como fatores clínicos ligados ao melhor prognóstico: doença limitada à pele e monolesional, lesão em membro distal e ausência de lesões em região de mucosa ou área seborreica. Se esses fatores prognósticos específicos se aplicam ou não à RHP, ainda não foi determinado. Achados de microscopia eletrônica, como menos de 25% de CLs com grânulos de Birbeck, foram considerados possíveis pistas para prognóstico favorável,3 e a densidade de células CD1a+ encontradas na lesão do paciente foi muito maior do que a de CD207+ (fig. 5A e B). Como medida de precaução, a criança será acompanhada com exame físico regular até pelo menos 2 anos de idade e por meio de exames laboratoriais completos e radiografias ósseas a cada seis meses.2
É aconselhável realizar a biópsia o mais precocemente possível, para obter elementos que caracterizem a forma cutânea isolada dessa histiocitose. Neste caso, é provável que a autocicatrização tenha sido acelerada pela biópsia, pois seu crescimento e infiltração desde o nascimento regrediram nos primeiros dias após procedimento. Além da retículo‐histiocitose de Hashimoto‐Pritzker, há muitos outros casos de regressão espontânea de tumores relatados na literatura, e várias hipóteses patogenéticas de regressão são propostas para diferentes tipos de tumores. Alguns desses mecanismos incluem apoptose, eficácia do sistema imunológico, microambiente tumoral4 e vacina.5
A densidade de linfócitos T‐regulatórios não parece ser preditiva da evolução da doença na HCL. Entretanto, em relatos de câncer de laringe6 e linfoma de células B,7 a regressão observada após a biópsia foi atribuída a provável ativação da resposta imune6 ou desorganização do microambiente e reação imune em decorrência do trauma do procedimento.7
Ki‐67 tem papel na divisão celular e geralmente é utilizado como marcador prognóstico e preditor de recorrência. O índice proliferativo encontrado no paciente do presente relato (62%) foi alto e superior ao descrito na literatura para RHP; assim, o papel da hipóxia e apoptose deve ser considerado. O resultado da avaliação imuno‐histoquímica com Ki‐67 em estudo de 11 casos foi 38,50±19,61 (média±DP).8 Não foram encontradas diferenças no índice proliferativo comparando HCL cutânea autorregressiva em 21 pacientes e HCL cutânea não autorregressiva em dez pacientes.9
A criança recebeu as vacinas BCG e contra hepatite B, e seu efeito também deve ser considerado. A utilidade do BCG para induzir a remissão tumoral5 foi verificada no câncer de bexiga, e a vacina DTP (difteria‐tétano‐coqueluche) foi descrita como fator da indução de regressão no melanoma metastático.10
Suporte financeiroNenhum.
Contribuição dos autoresLuciana Prates Nogueira de Lima: Concepção do estudo; obtenção de dados; redação do manuscrito; aprovação da versão final do manuscrito.
Carolina Viza Amorim: Obtenção de dados; aprovação da versão final do manuscrito.
Rachel Martins Marinho: Obtenção de dados; aprovação da versão final do manuscrito.
Maria Letícia Cintra: Obtenção de dados; redação do manuscrito; participação efetiva na orientação da pesquisa; aprovação da versão final do manuscrito.
Elemir Macedo de Souza: Análise e interpretação; revisão crítica; orientação da pesquisa; aprovação da versão final do manuscrito.
Conflito de interessesNenhum.
Como citar este artigo: Lima LPN, Amorim CV, Marinho RM, Cintra ML, Souza EM. Congenital solitary reticulohistiocytosis (Hashimoto ‐ Pritzker) ‐ Case report. An Bras Dermatol. 2022;97:778–82.
Trabalho realizado no Departamento de Dermatologia e Patologia, Universidade Estadual de Campinas, Campinas, SP, Brasil.