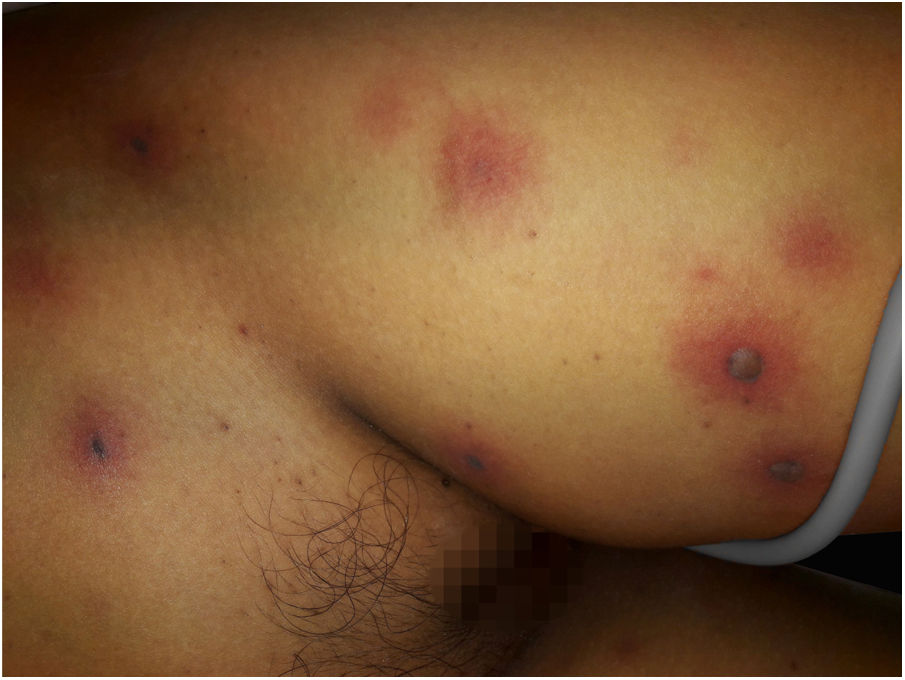
Relata‐se o caso de paciente de 13 anos com histórico de leucemia mieloide aguda que, após um transplante de medula óssea, começou a vomitar e experimentou deterioração rapidamente progressiva da consciência, além de máculas eritematovioláceas disseminadas e algumas bolhas com conteúdo hemorrágico no interior. A biópsia de pele evidenciou estruturas filamentosas intravasculares. A hemocultura confirmou a presença de Fusarium oxysporum. Iniciou‐se tratamento intravenoso com voriconazol. A paciente evoluiu desfavoravelmente com múltiplas lesões cutâneas necróticas, lesões cerebrais isquêmicas e morte.
Os fungos Fusarium spp são encontrados no solo, no ar e nas plantas; eles afetam principalmente pacientes imunocomprometidos e podem causar doença localizada, focalmente invasiva ou disseminada.1,2 Pacientes imunossuprimidos e portadores de neoplasias hematológicas são muito suscetíveis ao desenvolvimento de formas invasivas, mostram alta mortalidade.2–4 Neste relato é descrito o caso de paciente com leucemia mieloide aguda, que apresentou fusariose invasiva com evolução fulminante após um transplante de medula óssea.
Relato do casoAdolescente de 13 anos, do sexo feminino, apresentava leucemia mieloblástica aguda havia três anos, alcançou remissão completa da doença. A paciente apresentou sua primeira recaída hematológica havia três meses, alcançou uma nova remissão completa e, nessas condições, foi planejado um transplante alogênico de medula óssea (TMO). O condicionamento mielossupressor foi feito com bussulfano e fludarabina, administrados em conjunto com profilaxia infecciosa com aciclovir, trimetoprima‐sulfametoxazol e fluconazol. Cinco dias após o transplante, foi iniciada a administração de fator estimulador de colônias de granulócitos (Neupogen® 300μg/kg/dia).
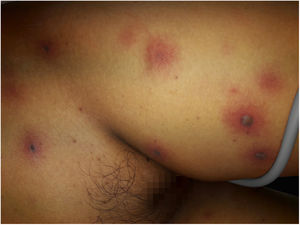
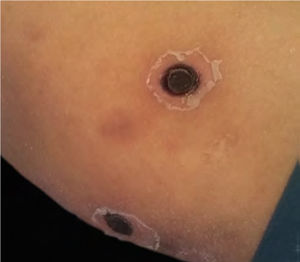
Após uma semana de TMO, a paciente começou a sentir dor de cabeça e vômito, apresentou paralisia facial central e deterioração rapidamente progressiva da consciência, até atingir 7 pontos de acordo com a Escala de Glasgow; isso motivou sua admissão na Unidade de Terapia Intensiva. O tratamento antibiótico foi ajustado para um esquema de amplo espectro com meropenem 60mg/kg/dia e vancomicina 40mg/kg/dia. À época, um dermatologista foi consultado devido ao surgimento repentino de múltiplas lesões cutâneas disseminadas. Ao exame físico, a paciente apresentava dermatose disseminada no tronco, membros inferiores e superiores, caracterizada por máculas eritematovioláceas arredondadas, infiltradas à palpação, e algumas bolhas com conteúdo hemorrágico no interior (fig. 1). Exames laboratoriais mostraram hemoglobina: 9,4mg/dL; leucócitos: 2.800mm3 (60% de neutrófilos); plaquetas: 53.000mm3. A paciente apresentava função hepática e renal normais. As hemoculturas foram negativas. Além disso, a reação em cadeia da polimerase foi negativa para citomegalovírus, vírus varicela zoster e vírus herpes simplex tipos 1 e 2.
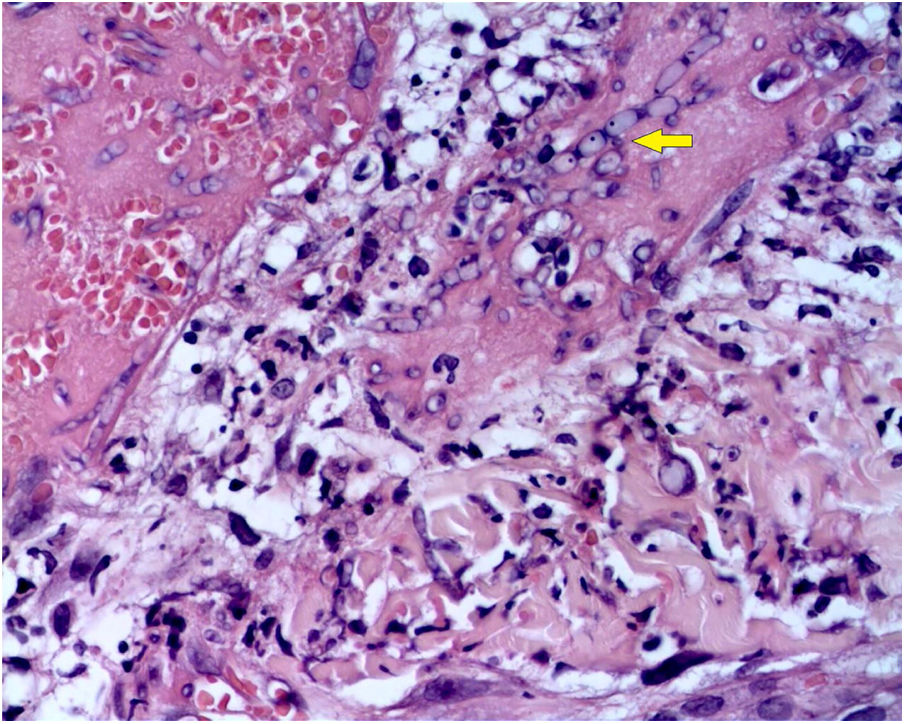
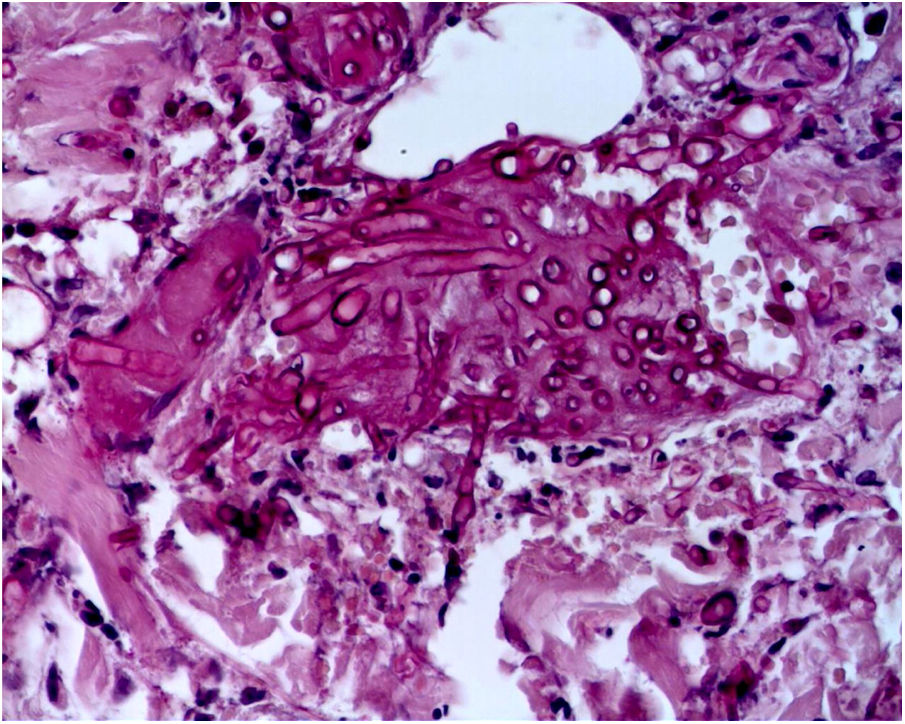
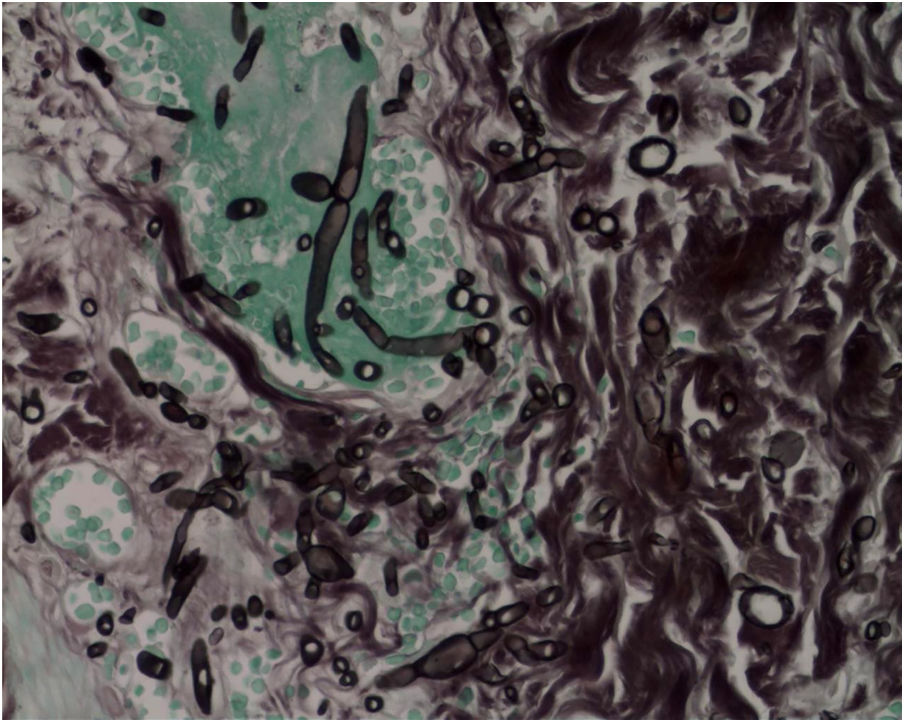
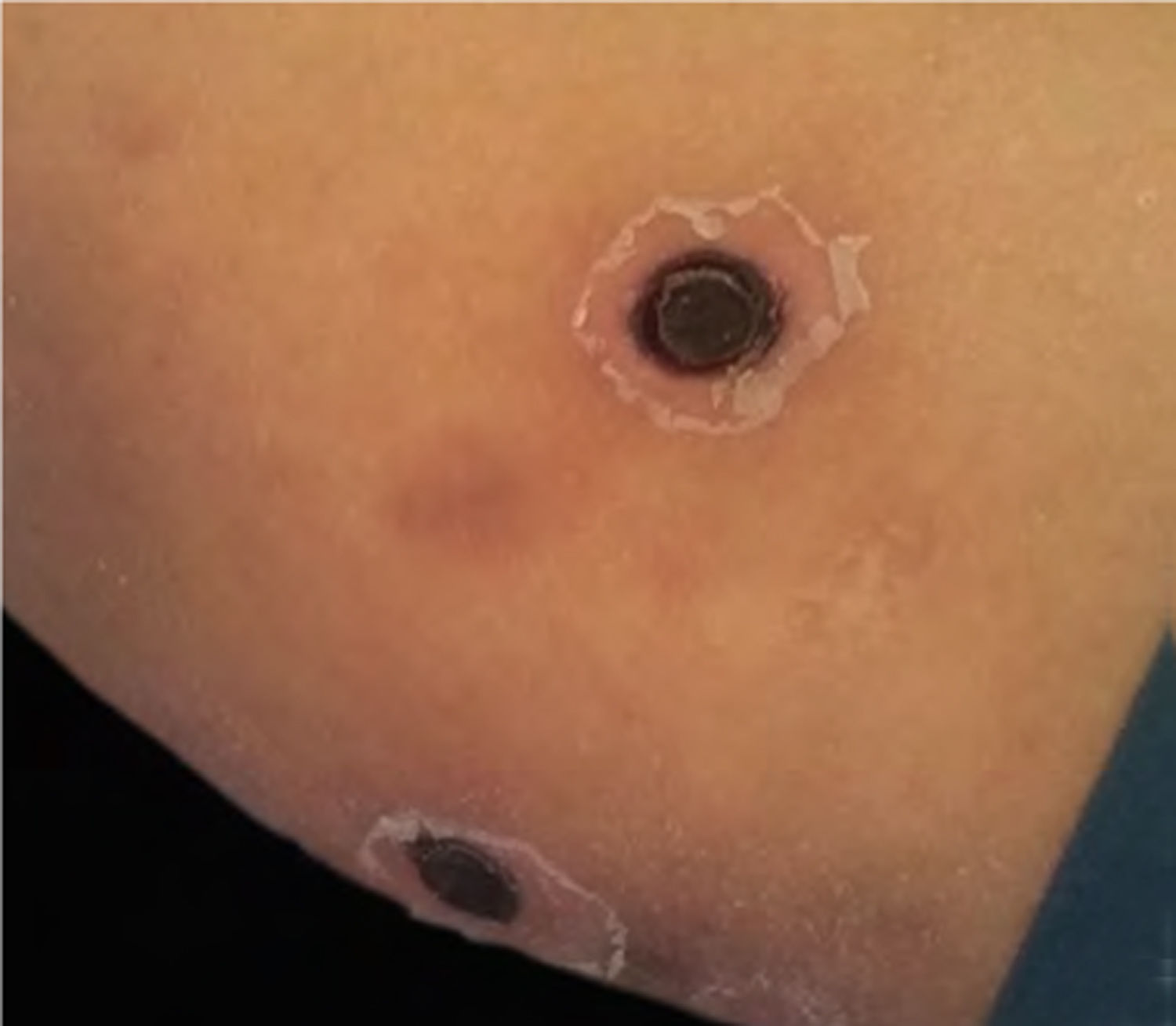
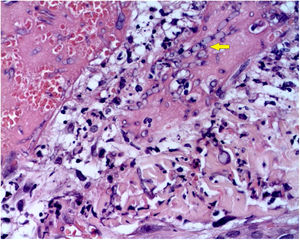
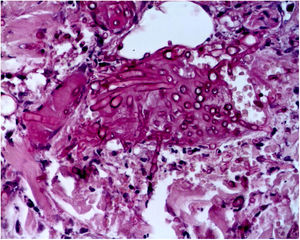
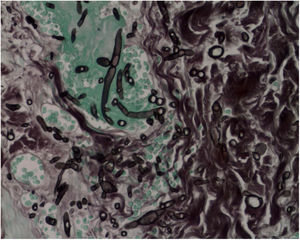
A biópsia da pele foi corada com hematoxilina‐eosina, PAS e Grocott‐Gomori, evidenciou acantólise intraepidérmica, vasos com necrose fibrinoide da parede e trombose oclusiva. A biópsia também evidenciou infiltrado inflamatório perivascular superficial composto por linfócitos, neutrófilos e leucocitoclasia, destacou a presença de estruturas filamentosas intravasculares, corresponderam a hifas septadas e conidiosporos (figs. 2‐4). Uma hemocultura subsequente confirmou a presença de Fusarium oxysporum e iniciou‐se tratamento com voriconazol 4mg/kg/dose intravenosa, duas vezes ao dia. A paciente evoluiu desfavoravelmente e com lesões cutâneas com aparência necrótica central e colarinho descamativo (fig. 5). Posteriormente, começou a sofrer de diabetes insipidus grave (crise de hipernatremia de até 170 mEq/L). A ressonância magnética do cérebro, feita 20 dias após o transplante, evidenciou presença de lesões isquêmicas extensas e edema cerebral, com hérnia tonsilar e compressão bulbo‐espinal. Três semanas após o transplante, a paciente faleceu.
Fusariose. Histopatologia de lesão cutânea (Hematoxilina & eosina, 40×). Vasos com necrose da parede fibrinoide e trombose oclusiva em seus lúmens, acompanhados por um infiltrado inflamatório perivascular superficial composto por linfócitos, neutrófilos e leucocitoclasia. A seta amarela destaca a presença de estruturas filamentosas intravasculares, correspondentes às hifas septadas.
Devido à sua alta adaptabilidade, os fungos Fusarium spp. são observados no solo em todas as partes do mundo, inclusive regiões tropicais, desérticas e até árticas. Quanto à incidência, eles são a segunda causa mais frequente de infecção invasiva por fungos em pacientes hemato‐oncológicos, após Aspergillus spp.5 Os fatores de risco para fusariose invasiva são neutropenia grave, baixa imunidade celular, quimioterapia de indução recente para leucemia, TMO recente e doença do enxerto contra hospedeiro.1,6 Do mesmo modo, os autores destacam que a paciente atual era portadora de leucemia mieloide aguda e havia sido submetida recentemente a um TMO. Após um TMO, a ocorrência de neutropenia grave é esperada no contexto do condicionamento mielossupressor necessário para esse procedimento.
Formas invasivas de fusariose mostram comprometimento cutâneo em 63% dos casos, caracterizado pela presença de nódulos subcutâneos, máculas eritematosas ou pústulas vesiculares que podem se tornar necróticas.4,7 Esse patógeno é altamente invasivo e angioinvasivo, produz infartos de tecidos como os evidenciados no cérebro da paciente atual, que geram esporulação intravascular, favorecem uma maior sensibilidade das hemoculturas nos estágios finais da doença8Fusarium spp. são resistentes a múltiplos antifúngicos, mas são altamente suscetíveis à anfotericina B e ao voriconazol.1,9,10 No entanto, a neutropenia grave é o fator prognóstico mais importante, determina letalidade em até 75% dos casos.6,10
Considerações finaisA fusariose invasiva é extremamente grave e está associada a alta mortalidade em pacientes imunossuprimidos. Ela requer tratamento antifúngico intensivo e administração de fator estimulador de colônias de granulócitos, pois seu prognóstico está intimamente relacionado à recuperação da neutropenia. Deve ser enfatizado o papel do dermatologista como parte de uma equipe multidisciplinar; deve haver alta suspeita diagnóstica dessa patologia no caso de pacientes imunossuprimidos com manifestações clínicas semelhantes às previamente descritas.
Suporte financeiroNenhum.
Contribuição dos autoresNelson Turra: Aprovação da versão final do manuscrito; elaboração e redação do manuscrito; participação efetiva na orientação da pesquisa; participação intelectual em conduta propedêutica e/ou terapêutica de casos estudados; revisão crítica da literatura; revisão crítica do manuscrito.
Agustina Acosta: Aprovação da versão final do manuscrito; participação efetiva na orientação da pesquisa; participação intelectual em conduta propedêutica e/ou terapêutica de casos estudados; revisão crítica da literatura; revisão crítica do manuscrito.
Andrea Incoronato: Aprovação da versão final do manuscrito; participação efetiva na orientação da pesquisa; participação intelectual em conduta propedêutica e/ou terapêutica de casos estudados; revisão crítica da literatura; revisão crítica do manuscrito.
Pilar Beltramo: Aprovação da versão final do manuscrito; participação efetiva na orientação da pesquisa; participação intelectual em conduta propedêutica e/ou terapêutica de casos estudados; revisão crítica da literatura; revisão crítica do manuscrito.
Conflitos de interesseNenhum.