Em estudos recentes, os microRNAs (miRNAs) demonstraram desempenhar um papel importante na patogênese da psoríase. No entanto, a literatura apresenta poucos estudos que avaliem miRNAs no sangue de pacientes com psoríase, inclusive um grande número de painéis de miRNA.
ObjetivoAvaliar a expressão de miRNA em amostras de sangue de pacientes com psoríase, bem como avaliar a associação entre a expressão de miRNA e a gravidade da psoríase.
MétodosEstudo de caso controle em 52 pacientes com psoríase vulgar e 54 controles. O histórico médico dos pacientes, os escores do Índice de Gravidade da Psoríase por Área (PASI) e do Índice de Qualidade de Vida em Dermatologia (DLQI, do inglês Dermatology Life Quality Index) foram registrados. Os 42 primers de miRNA relacionados à doença foram avaliados por PCR em tempo real.
ResultadosNo grupo de pacientes, 13,4% apresentaram comprometimento ungueal e 8,2% apresentaram artrite psoriásica. Os escores médios do PASI e DLQI foram 7,90 ± 8,83 e 8,13 ± 5,50, respectivamente. Entre os 42 primers de miRNA, as expressões de hsa‐miR‐155‐5p, hsa‐miR‐369‐3p, hsa‐miR‐193b‐3p, hsa‐miR‐498, hsa‐miR‐1266‐5p, hsa‐let‐7d‐5p, hsa‐miR‐205‐5p, hsa‐let‐7c‐5p, hsa‐miR‐30b‐3p e hsa‐miR‐515‐3p estavam significativamente reguladas para cima, enquanto as expressões de hsa‐miR‐21‐5p, hsa‐miR‐142‐3p, hsa‐miR‐424‐5p, hsa‐miR‐223‐3p, hsa‐miR‐26a‐5p, hsa‐miR‐106b‐5p, hsa‐miR‐126‐5p, hsa‐miR‐181a‐5p, hsa‐miR‐222‐3p, hsa‐miR‐22‐3p, hsa‐miR‐24‐3p, hsa‐miR‐17‐3p, hsa‐miR‐30b‐5p, hsa‐miR‐130a‐3p, hsa‐miR‐30e‐5p e hsa‐miR‐16‐5p estavam significativamente reguladas para baixo em pacientes com psoríase em comparação ao grupo controle (p < 0,05).
Limitações do estudoUma vez que o estudo incluiu pacientes com psoríase leve a moderada, que na maioria das vezes só receberam tratamentos tópicos, as alterações nos miRNAs antes e depois dos tratamentos sistêmicos não foram avaliadas.
ConclusãoA detecção de regulação para cima ou para baixo na expressão de 24 miRNA em pacientes com psoríase, mesmo naqueles com doença mais leve, respalda ainda mais o papel dos miRNAs na patogênese da psoríase. Estudos futuros devem esclarecer se os miRNAs podem ser usados como um marcador para o prognóstico da psoríase ou como um agente terapêutico no tratamento da psoríase.
A psoríase é doença dermatológica inflamatória crônica, hiperproliferativa, caracterizada por placas escamosas eritematosas, cuja etiologia é genética.1–3 Embora a psoríase seja observada em 1% a 3% da população em geral, os pacientes com psoríase constituem 6% a 8% dos indivíduos admitidos nas clínicas de dermatologia.4 Ainda que sua patogênese não possa ser totalmente explicada, a psoríase é considerada uma doença poligênica com interação de fatores genéticos e ambientais. O gen primário de resolução antigênica HLA‐Cw6, localizado no PSORS1 e que codifica um alelo do complexo principal de histocompatibilidade I (MHCI), foi significativamente associado à psoríase. Foram observadas alterações nos genes PSORS1 e PSORS2 no desenvolvimento da doença, afetando células imunes e queratinócitos. Os fatores genéticos afetam os sintomas clínicos, a idade de início da doença, seu tipo e gravidade.5,6
Os microRNAs (miRNAs) são membros da pequena família de RNA, cujo comprimento varia entre 19 a 25 nucleotídeos.7 Mais de 2.500 miRNAs que desempenham um papel fundamental na regulação de processos biológicos básicos foram identificados até o momento.8 Os miRNAs regulam a expressão gênica durante a transcrição e podem atuar como um gene supressor de tumor e/ou oncogene em doenças ou tecidos específicos.9 Estudos recentes mostraram que os miRNAs estão envolvidos na patogênese da psoríase.10–13 Após o primeiro estudo que demonstrou a associação entre miRNAs e psoríase, mais de 250 miRNAs foram relatados como expressos de maneira aberrante na psoríase.14 Vários perfis de miRNA foram estudados em amostras de pele, sangue e cabelo de pacientes com psoríase. Polimorfismos genéticos de miRNAs específicos (como miR‐146a) têm sido associados à patogênese da psoríase.15,16 No entanto, na maioria dos estudos disponíveis, as expressões de miRNA foram demonstradas em lesões cutâneas psoriásicas por meio de painéis de miRNA relativamente pequenos.
Este estudo teve como objetivo identificar e caracterizar expressões de miRNA em amostras de sangue de pacientes com psoríase por meio de um grande painel de miRNA e investigar a relação entre a expressão de miRNA e a gravidade da psoríase com o Índice de Área e Gravidade da Psoríase (PASI) e o Índice de Qualidade de Vida em Dermatologia (DLQI).
Material e métodosDesenho do estudoEste foi um estudo de caso controle que incluiu 52 pacientes com psoríase e 54 controles saudáveis recrutados nos Departamentos de Dermatologia e Genética Médica da Faculdade de Medicina da Universidade Muğla Sıtkı Koçman. O Comitê de Ética em Pesquisa Clínica da Universidade Muğla Sıtkı Koçman aprovou este estudo. Os pacientes e controles assinaram um termo de consentimento livre e esclarecido. O estudo incluiu 52 pacientes com psoríase vulgar e 54 voluntários de mesma idade e sexo, que foram admitidos no ambulatório de dermatologia e atenderam aos critérios de inclusão/exclusão. Foram incluídos os pacientes com idade > 18 anos que concordaram em participar do estudo. Os seguintes critérios de exclusão foram adotados: idade < 18 anos, pacientes com psoríase que não em placas (psoríase pustulosa e psoríase eritrodérmica, entre outras), pacientes com doenças sistêmicas (como doença coronariana, insuficiência hepática, insuficiência renal e neoplasia maligna) e pacientes grávidas ou lactantes.
O histórico médico dos pacientes (idade, duração da doença, presença de artrite psoriásica e comprometimento ungueal e tratamentos atuais) foi registrado no prontuário dos pacientes. A gravidade da doença foi calculada com o escore PASI. Além disso, foram registrados o escore do DLQI dos pacientes.
Dois a três mL de sangue dos pacientes foram coletados em tubos de EDTA e enviados ao Laboratório de Genética Médica. Os RNAs dos pacientes foram armazenados a −80°C até a feitura do estudo. Usando o miRNeasy Mini Kit (QIAGEN Sample & Assay Technologies Hilden, Alemanha), o miRNA foi isolado de acordo com o protocolo recomendado pelo fabricante. O kit miScript II RT (Qiagen) foi usado para converter os RNAs obtidos em um DNA computacional (cDNA). Os níveis de expressão do miRNA foram determinados pelo dispositivo Biomark Real‐Time PCR (Fluidigm).
Quarenta e dois primers de miRNA que podem estar relacionados à psoríase (hsa‐miR‐155‐5p, hsa‐miR‐31‐5p, hsa‐miR‐99a‐5p, hsa‐miR‐128‐3p, hsa‐miR‐146a‐5p, hsa‐miR‐210‐3p, hsa‐miR‐369‐3p, hsa‐miR‐378a‐3p, hsa‐let‐7i‐5p, hsa‐miR‐193b‐3p, hsa‐miR‐498, hsa‐miR‐551a, hsa‐miR‐1266‐5p, hsa‐let‐7d‐5p, hsa‐miR‐205‐5p, hsa‐let‐7c‐3p, hsa‐let‐7c‐5p, hsa‐miR‐30b‐3p, hsa‐miR‐130a‐5p, hsa‐miR‐515‐3p, hsa‐miR‐21‐5p, hsa‐miR‐125b‐5p, hsa‐miR‐142‐3p, hsa‐miR‐424‐5p, hsa‐miR‐223‐3p, hsa‐miR‐425‐3p, hsa‐miR‐26a‐5p, hsa‐miR‐26b‐5p, hsa‐miR‐106b‐5p, hsa‐miR‐126‐5p, hsa‐miR‐181a‐5p, hsa‐miR‐221‐3p, hsa‐miR‐222‐3p, hsa‐miR‐22‐3p, hsa‐miR‐24‐3p, hsa‐miR‐17‐3p, hsa‐miR‐17‐5p, hsa‐miR‐30b‐5p, and hsa‐miR‐130a‐3p, hsa‐miR‐30e‐5p, hsa‐miR‐16‐5p, and hsa‐miR‐30a‐5p) foram analisados.10–13
No grupo de pacientes, foi avaliada a relação entre expressão de miRNA e escore do PASI, escore do DLQI e comprometimento ungueal.
Análise de dadosA análise estatística do estudo foi feita com o SPSS® for Windows, v. 15.0. Os resultados foram apresentados como média ± desvio‐padrão. A análise foi feita no site http://www.qiagen.com/us/shop/genes‐and‐pathways/data‐analysis‐center‐overview‐page/. Os resultados da RT‐PCR (valores de Ct) foram calculados pelo método 2‐ΔΔCT. Após o cálculo desses valores, o teste t de Student foi empregado para fazer comparações entre os grupos (cálculo dos valores‐p); valores‐p < 0,05 foram considerados estatisticamente significativos.
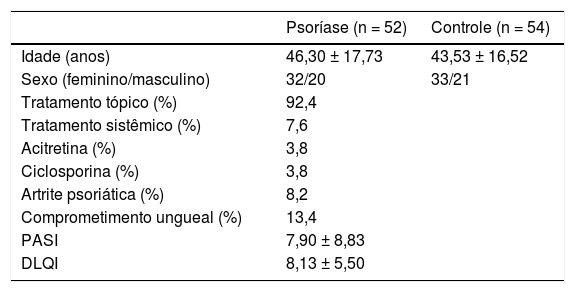
ResultadosO estudo incluiu 52 pacientes com psoríase (32 mulheres, 20 homens; faixa etária: 18 a 68 anos) e 54 controles (33 mulheres, 21 homens; faixa etária: 18 a 69 anos). A idade média foi de 46,3 ± 17,7 anos e 43,5 ± 16,5 anos nos grupos pacientes e controles, respectivamente (p > 0,05). Enquanto 7,6% dos pacientes foram submetidos a tratamentos sistêmicos (3,8%, ciclosporina; 3,8%, acitretina), 92,4% receberam apenas tratamentos tópicos. No grupo de pacientes, 13,4% apresentaram comprometimento ungueal e 8,2% apresentaram artrite psoriásica. O escore médio do PASI foi de 7,90 ± 8,83 e o escore médio do DLQI foi de 8,13 ± 5,50 no grupo de pacientes (tabela 1).
Características sociodemográficas e parâmetros bioquímicos dos grupos pacientes e controles
| Psoríase (n = 52) | Controle (n = 54) | |
|---|---|---|
| Idade (anos) | 46,30 ± 17,73 | 43,53 ± 16,52 |
| Sexo (feminino/masculino) | 32/20 | 33/21 |
| Tratamento tópico (%) | 92,4 | |
| Tratamento sistêmico (%) | 7,6 | |
| Acitretina (%) | 3,8 | |
| Ciclosporina (%) | 3,8 | |
| Artrite psoriática (%) | 8,2 | |
| Comprometimento ungueal (%) | 13,4 | |
| PASI | 7,90 ± 8,83 | |
| DLQI | 8,13 ± 5,50 |
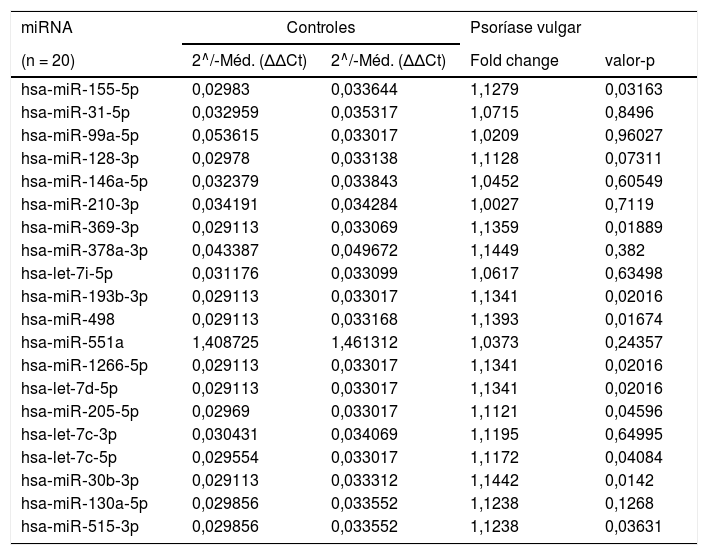
As tabelas 2 e 3 apresentam expressões de miRNA reguladas dez para mais e para menos, respectivamente, nos grupos de pacientes e de controles. Observou‐se uma regulação para mais significativa na expressão de hsa‐miR‐155‐5p, hsa‐miR‐369‐3p, hsa‐miR‐193b‐3p, hsa‐miR‐498, hsa‐miR‐1266‐5p, hsa‐let‐7d‐5p, hsa‐miR‐205‐5p, hsa‐let‐7c‐5p, hsa‐miR‐30b‐3p e hsa‐miR‐515‐3p no grupo de pacientes em comparação com o grupo de controles (p < 0,05; tabela 2).
miRNAs com expressão regulada para mais nos grupos de pacientes e de controles
| miRNA | Controles | Psoríase vulgar | ||
|---|---|---|---|---|
| (n = 20) | 2∧/‐Méd. (ΔΔCt) | 2∧/‐Méd. (ΔΔCt) | Fold change | valor‐p |
| hsa‐miR‐155‐5p | 0,02983 | 0,033644 | 1,1279 | 0,03163 |
| hsa‐miR‐31‐5p | 0,032959 | 0,035317 | 1,0715 | 0,8496 |
| hsa‐miR‐99a‐5p | 0,053615 | 0,033017 | 1,0209 | 0,96027 |
| hsa‐miR‐128‐3p | 0,02978 | 0,033138 | 1,1128 | 0,07311 |
| hsa‐miR‐146a‐5p | 0,032379 | 0,033843 | 1,0452 | 0,60549 |
| hsa‐miR‐210‐3p | 0,034191 | 0,034284 | 1,0027 | 0,7119 |
| hsa‐miR‐369‐3p | 0,029113 | 0,033069 | 1,1359 | 0,01889 |
| hsa‐miR‐378a‐3p | 0,043387 | 0,049672 | 1,1449 | 0,382 |
| hsa‐let‐7i‐5p | 0,031176 | 0,033099 | 1,0617 | 0,63498 |
| hsa‐miR‐193b‐3p | 0,029113 | 0,033017 | 1,1341 | 0,02016 |
| hsa‐miR‐498 | 0,029113 | 0,033168 | 1,1393 | 0,01674 |
| hsa‐miR‐551a | 1,408725 | 1,461312 | 1,0373 | 0,24357 |
| hsa‐miR‐1266‐5p | 0,029113 | 0,033017 | 1,1341 | 0,02016 |
| hsa‐let‐7d‐5p | 0,029113 | 0,033017 | 1,1341 | 0,02016 |
| hsa‐miR‐205‐5p | 0,02969 | 0,033017 | 1,1121 | 0,04596 |
| hsa‐let‐7c‐3p | 0,030431 | 0,034069 | 1,1195 | 0,64995 |
| hsa‐let‐7c‐5p | 0,029554 | 0,033017 | 1,1172 | 0,04084 |
| hsa‐miR‐30b‐3p | 0,029113 | 0,033312 | 1,1442 | 0,0142 |
| hsa‐miR‐130a‐5p | 0,029856 | 0,033552 | 1,1238 | 0,1268 |
| hsa‐miR‐515‐3p | 0,029856 | 0,033552 | 1,1238 | 0,03631 |
Δ, Delta; ˄, regulação para mais (vermelho).
Valores de fold change e fold regulation maiores que 2 estão apresentados em vermelho.
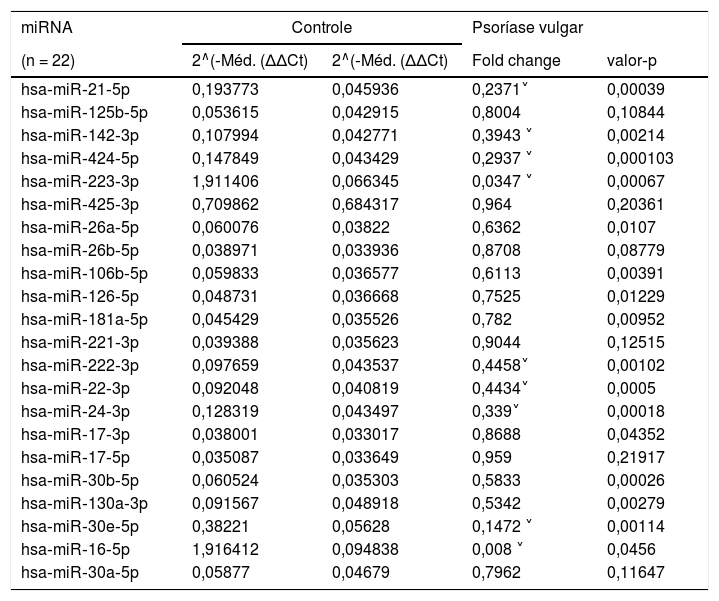
Verificou‐se uma regulação para menos significativa na expressão de hsa‐miR‐21‐5p, hsa‐miR‐142‐3p, hsa‐miR‐424‐5p, hsa‐miR‐223‐3p, hsa‐miR‐26a‐5p, hsa‐miR‐106b‐5p, hsa‐miR‐126‐5p, hsa‐miR‐181a‐5p, hsa‐miR‐222‐3p, hsa‐miR‐22‐3p, hsa‐miR‐24‐3p, hsa‐miR‐17‐3p, hsa‐miR‐30b‐5p, hsa‐miR‐130a‐3p, hsa‐miR‐30e‐5p e hsa‐miR‐16‐5p no grupo de pacientes em comparação com o grupo de controles (p < 0,05; tabela 3). As Tabelas 2 e 3 também apresentam as fold changes no grupo de pacientes em comparação com o grupo controle.
miRNAs com expressão regulada para menos nos grupos de pacientes e controles
| miRNA | Controle | Psoríase vulgar | ||
|---|---|---|---|---|
| (n = 22) | 2∧(‐Méd. (ΔΔCt) | 2∧(‐Méd. (ΔΔCt) | Fold change | valor‐p |
| hsa‐miR‐21‐5p | 0,193773 | 0,045936 | 0,2371˅ | 0,00039 |
| hsa‐miR‐125b‐5p | 0,053615 | 0,042915 | 0,8004 | 0,10844 |
| hsa‐miR‐142‐3p | 0,107994 | 0,042771 | 0,3943 ˅ | 0,00214 |
| hsa‐miR‐424‐5p | 0,147849 | 0,043429 | 0,2937 ˅ | 0,000103 |
| hsa‐miR‐223‐3p | 1,911406 | 0,066345 | 0,0347 ˅ | 0,00067 |
| hsa‐miR‐425‐3p | 0,709862 | 0,684317 | 0,964 | 0,20361 |
| hsa‐miR‐26a‐5p | 0,060076 | 0,03822 | 0,6362 | 0,0107 |
| hsa‐miR‐26b‐5p | 0,038971 | 0,033936 | 0,8708 | 0,08779 |
| hsa‐miR‐106b‐5p | 0,059833 | 0,036577 | 0,6113 | 0,00391 |
| hsa‐miR‐126‐5p | 0,048731 | 0,036668 | 0,7525 | 0,01229 |
| hsa‐miR‐181a‐5p | 0,045429 | 0,035526 | 0,782 | 0,00952 |
| hsa‐miR‐221‐3p | 0,039388 | 0,035623 | 0,9044 | 0,12515 |
| hsa‐miR‐222‐3p | 0,097659 | 0,043537 | 0,4458˅ | 0,00102 |
| hsa‐miR‐22‐3p | 0,092048 | 0,040819 | 0,4434˅ | 0,0005 |
| hsa‐miR‐24‐3p | 0,128319 | 0,043497 | 0,339˅ | 0,00018 |
| hsa‐miR‐17‐3p | 0,038001 | 0,033017 | 0,8688 | 0,04352 |
| hsa‐miR‐17‐5p | 0,035087 | 0,033649 | 0,959 | 0,21917 |
| hsa‐miR‐30b‐5p | 0,060524 | 0,035303 | 0,5833 | 0,00026 |
| hsa‐miR‐130a‐3p | 0,091567 | 0,048918 | 0,5342 | 0,00279 |
| hsa‐miR‐30e‐5p | 0,38221 | 0,05628 | 0,1472 ˅ | 0,00114 |
| hsa‐miR‐16‐5p | 1,916412 | 0,094838 | 0,008 ˅ | 0,0456 |
| hsa‐miR‐30a‐5p | 0,05877 | 0,04679 | 0,7962 | 0,11647 |
Δ, Delta; ˅, regulação para menos (azul).
Valores de fold change menores que 0,5 são indicados em azul.
No grupo de pacientes, não foi observada relação significativa entre as expressões de miRNA e o escore PASI, o escore DLQI e o comprometimento ungueal.
DiscussãoA psoríase é doença inflamatória crônica da pele em cuja patogênese estão envolvidos queratinócitos epidérmicos, células imunes e mediadores inflamatórios. Nos últimos anos, demonstrou‐se que os miRNAs regulam a diferenciação, a proliferação e a resposta de citocinas dos queratinócitos, a sobrevivência e a ativação das células T, bem como a associação entre imunócitos e queratinócitos. Embora diferentes perfis de expressão de miRNAs tenham sido relatados em pacientes com psoríase, os miRNAs não foram identificados como um biomarcador para diagnóstico, atividade e gravidade da doença na prática clínica.17 Embora a maioria dos pacientes incluídos no presente estudo apresentasse doença mais leve, foi observada regulação regulação para cima e para baixo na expressão de miRNA em amostras de soro de pacientes com psoríase; os presentes achados são compatíveis com os dados da literatura existente em amostras de soro e pele de pacientes com psoríase.18–20 No entanto, no presente estudo, essas expressões de miRNA não estavam significativamente associadas ao escore PASI, DLQI e comprometimento ungueal.
Foi demonstrado que muitos miRNAs que envolvem miR‐203 e miR‐125b desempenham papéis‐chave na resposta inflamatória, disfunção imunológica e doenças hiperproliferativas, inclusive psoríase. Sugere‐se que os miRNAs detectados em amostras de sangue podem ser biomarcadores no diagnóstico, prognóstico e resposta ao tratamento.21 No presente estudo, embora o miR‐146a e o miR125b tenham sido regulados para cima e para baixo nos pacientes com psoríase, respectivamente, a associação não foi estatisticamente significativa.
A expressão de diversos miRNAs foi relacionada à atividade ou gravidade da psoríase em vários estudos. No estudo de Hou RX et al., verificou‐se maior expressão do miR‐155‐5p nas células‐tronco mesenquimais dérmicas de pacientes com psoríase.18 Guo et al. observaram que a expressão do miR‐369‐3p estava aumentada no soro e na pele dos pacientes com psoríase e associada à atividade da doença.19 Em outro estudo, a expressão de miR‐1266‐5p foi relatada como aumentada no soro de pacientes com psoríase e associada à atividade da doença.20 De forma semelhante, no presente estudo as expressões de miR‐155‐5p, miR‐369‐3p e miR‐1266‐5p estavam significativamente aumentadas em pacientes com psoríase quando comparadas aos controles. No entanto, nenhuma associação estatisticamente significativa foi observada entre miRNAs e gravidade da doença. Esse resultado pode ser devido ao fato de a maioria dos pacientes apresentar psoríase leve ou moderada.
O efeito de diversos tratamentos sistêmicos nas expressões de miRNA e o papel dos miRNAs na patogênese da doença foram investigados. Raaby et al. não detectaram alterações na expressão do miRNA quatro dias após o tratamento com adalimumabe, sugeriram que o perfil de expressão de citocinas não é facilitado por alterações precoces na expressão do miRNA.22 Em contraste com o presente estudo, os níveis de miR‐142‐3p estavam aumentados em pacientes com psoríase e diminuíram com o tratamento com etanercepte no estudo de Pivarcsi et al.23 Ichıhara et al. encontraram uma expressão diminuída de miR‐424 nos tecidos de pacientes com psoríase e observaram que a diminuição da expressão de miR‐424 associada a níveis aumentados de MEK1 e ciclina E1 pode induzir a proliferação de queratinócitos na epiderme.24 Da mesma maneira, no presente estudo, a expressão do miR‐424 estava regulada para baixo em pacientes com psoríase quando comparada aos controles.
Estudos sobre miRNAs e outras doenças crônicas também podem ser úteis para entender a patogênese e o efeito dos tratamentos sistêmicos na psoríase. Em um estudo feito em pacientes com artrite reumatoide, Xiang et al. observaram que a expressão aumentada de miR‐498 suprimia a diferenciação de células Th17, ao focar em STAT3.25 Em outro estudo de Wang et al., foi demonstrado que miR‐223 causava doença inflamatória intestinal pela via IL23.26 Sabe‐se que a via IL23/17 desempenha um papel fundamental na patogênese da psoríase; tratamentos contra essa via, como o anti‐IL17 (secuquinumabe), são eficazes no tratamento da psoríase.27,28 Consequentemente, a superexpressão do miR‐498 pode ser eficaz no tratamento da psoríase pela via IL17. Embora os autores não tenham investigado as expressões de miRNA antes e após os tratamentos, observou‐se uma expressão significativamente aumentada de miR‐498 em pacientes com psoríase. Em outro estudo, An et al. demonstraram que a suprarregulação do miR‐205 inibe o desenvolvimento de queloide, suprime a produção do fator de crescimento do endotélio vascular (VEGF).29 Chamorro‐Jorganes et al. relataram que o VEGF estimula as células endoteliais para a angiogênese por indução do miR‐17.30 Como é sabido que o VEGF está envolvido na patogênese da psoríase, esses relatos respaldam a hipótese de que a expressão de miR‐205 e miR‐17 pode afetar o desenvolvimento da psoríase via VEGF.31 No presente estudo, enquanto a expressão de miR‐205‐5p estava significativamente regulada para cima, a expressão de mir‐17‐3p estava significativamente regulada para baixo em pacientes com psoríase quando comparada aos controles.
Vários tipos de miRNA estão envolvidos na patogênese de diversos tipos de psoríase. Enquanto a via IL23/Th17 é responsável pelo desenvolvimento da psoríase vulgar, IL‐1, IL‐36 e IL‐6 são citocinas envolvidas no desenvolvimento da psoríase pustulosa.32 Chyi‐Ying et al. relataram que o miR‐26 reduz a IL‐6, que é ativada pelo TNF‐α.33 MiR‐26 pode estar envolvido no desenvolvimento de psoríase mediada por IL‐6. Os medicamentos que suprimem a liberação de IL‐6, como o tocilizumabe, são usados no tratamento da artrite reumatoide e da artrite reumatoide juvenil e estão entre as possíveis opções de tratamento futuro da psoríase pustulosa.32
O transdutor de sinal e ativação da transcrição (STAT3) foi apontado recentemente como um ator‐chave na patogênese da psoríase e de condições inflamatórias similares à psoríase. Relata‐se que a hiperatividade do STAT3 é uma mediadora da sinalização da maioria das citocinas, inclusive a interleucina IL‐23/IL‐17, e é observada em quase todos os tipos de células envolvidas no surgimento da doença.34 Maimaiti et al. apontaram que o miR‐106b modula a angiogênese em células endoteliais e afeta a expressão de STAT3.35 Em outro estudo, foi demonstrado que o STAT3 inibe a expressão de miR‐22 em pacientes com linfoma cutâneo de células T.36 Assim, o miR‐22 pode ser inibido pela patogênese mediada por STAT3 na psoríase. No presente estudo, as expressões de miR‐106b‐5p e miR‐22 foram significativamente reguladas para cima e para baixo nos pacientes com psoríase, respectivamente, respaldando esses achados.
O presente estudo tem algumas limitações: apenas pacientes com psoríase leve a moderada foram incluídos e a maioria estava em tratamento tópico; portanto, não foi possível avaliar as alterações na expressão de miRNA antes e após tratamentos sistêmicos. Além disso, os pacientes atuais apresentavam psoríase do tipo placa e, portanto, a expressão de miRNA não foi avaliada em outros tipos de psoríase.
ConclusãoO presente estudo incluiu pacientes com psoríase leve a moderada e avaliou miRNAs de amostras de sangue em vez de lesões cutâneas; um determinado conjunto de miRNAs estava regulado para mais ou para menos nos pacientes com psoríase, um achado compatível com a literatura existente. Portanto, os presentes resultados confirmam mais uma vez o papel dos miRNAs na patogênese da psoríase. No entanto, não foi observada associação entre a expressão de miRNA e o escore PASI, o escore DLQI e o comprometimento ungueal nos pacientes. Estudos adicionais devem ser feitos para entender melhor se os miRNAs podem ser usados como um marcador para o prognóstico da psoríase, qual miRNA é mais específico para cada tipo de psoríase e se os miRNAs podem ser usados no tratamento da psoríase no futuro.
Suporte financeiroNenhum.
Contribuição dos autoresEmine Tugba Alatas: Concepção e planejamento do estudo; elaboração e redação do manuscrito; obtenção, análise e interpretação dos dados; participação efetiva na orientação da pesquisa; participação intelectual em conduta propedêutica e/ou terapêutica de casos estudados.
Murat Kara: Análise estatística; concepção e planejamento do estudo; obtenção, análise e interpretação dos dados.
Gursoy Dogan: Aprovação da versão final do manuscrito; revisão crítica do manuscrito.
Aslı Akın Belli: Aprovação da versão final do manuscrito; revisão crítica da literatura; revisão crítica do manuscrito.
Conflitos de interesseNenhum.
Como citar este artigo: Alatas ET, Kara M, Dogan G, Belli AA. Blood microRNA expressions in patients with mild to moderate psoriasis and the relationship between microRNAs and psoriasis activity. An Bras Dermatol. 2020;95:702–7.
Trabalho realizado no Departamento de Dermatologia, University of Muğla Sıtkı Koçman, Mugla, Turquia.