Eventos adversos mucocutâneos são comuns durante o tratamento antineoplásico, com repercussões variáveis para o paciente e seu esquema terapêutico.
ObjetivoAvaliar os eventos adversos mais comuns, bem como os fármacos implicados pelo seu surgimento, e as consequências para o tratamento oncológico.
MétodosRealizou‐se um estudo retrospectivo por meio da análise dos pacientes atendidos pelo Serviço de Dermatologia Clínica de um hospital oncológico público.
ResultadosForam avaliados 138 pacientes que apresentaram um total de 200 eventos adversos, sendo os mais comuns: alterações ungueais e periungueais (20%), erupção pápulo‐pustulosa (13%), erupção acneiforme (12%), síndrome mão‐pé (6,5%), reação mão‐pé (6%) e xerose (6%). Os grupos de tratamento antineoplásico de maior associação foram quimioterapia clássica (46,2%), terapia alvo (32,3%) e outros fármacos não antineoplásicos utilizados nos protocolos de neoplasia (16,5%). Do total de pacientes, 17,4% tiveram o tratamento suspenso ou alterado em decorrência do evento adverso dermatológico.
Limitações do estudoEstudo retrospectivo e análise somente dos pacientes que foram encaminhados para avaliação dermatológica especializada, o que impediu verificar a incidência real dos eventos adversos.
ConclusãoUma grande variedade de manifestações dermatológicas decorrem do tratamento antineoplásico com diferentes fármacos e, não raramente, resultam na suspensão ou modificação dos esquemas terapêuticos.
Anualmente, 625 mil brasileiros recebem o diagnóstico de câncer e cerca de 230 mil vão a óbito por essa etiologia.1,2 Felizmente, diversos foram os avanços na terapêutica dos pacientes oncológicos, que abrange cirurgia, radioterapia e terapias sistêmicas (quimioterapia clássica, terapia hormonal, terapia alvo e imunoterapia), possibilitando maior sobrevida ou mesmo a cura desses pacientes.
Ressalta‐se, porém, que todas essas modalidades terapêuticas cursam com potenciais eventos adversos (EAs). No caso das terapias sistêmicas que interferem no crescimento das células malignas, têm‐se também interferência na proliferação de células não neoplásicas, o que pode resultar em alterações cutâneas, de seus anexos e mucosas.3
As manifestações tegumentares adversas mais comuns incluem: eflúvio anágeno, xerose, mucosite, hiperpigmentação, síndrome mão‐pé, radiation recall, reações de hipersensibilidade, danos por extravasamento e alterações ungueais.4
A maioria dos eventos adversos são benignos e autolimitados e não exigem a cessação do tratamento, embora, frequentemente, cursem com considerável desconforto físico e/ou mental e prejuízo à qualidade de vida do paciente.5,6 Outros resultam em complicações graves, com a necessidade de redução da dose ou mesmo suspensão do fármaco implicado.6,7
Contudo, nem todas as alterações dermatológicas desenvolvidas ao longo do tratamento são em decorrência da ação direta dos medicamentos. Outras etiologias para essas manifestações incluem processos infecciosos, síndromes paraneoplásicas, doença do enxerto‐versus‐hospedeiro, deficiências nutricionais, reações à radioterapia, outras neoplasias e metástases cutâneas.6
Assim, tanto os dermatologistas como os oncologistas precisam estar cientes desses efeitos para que sejam reconhecidos e manejados adequadamente. Em muitos casos, medidas preventivas podem ser empregadas previamente ao início do tratamento para a minimização do risco.7
Em decorrência da ausência de casuística brasileira relativa ao tema, este trabalho objetivou relatar as manifestações cutâneas secundárias à terapia sistêmica antineoplásica mais prevalentes nos pacientes encaminhados para avaliação dermatológica em um hospital oncológico público, assim como descrever os agentes envolvidos em seu desenvolvimento e as implicações desses EAs no tratamento oncológico.
MétodosRealizou‐se um estudo observacional retrospectivo, por meio da revisão do prontuário eletrônico dos pacientes atendidos pelas interconsultas dermatológicas e pelo Ambulatório de Dermatologia Clínica do Hospital das Clínicas da Faculdade de Medicina da Universidade de São Paulo durante o período de primeiro de janeiro de 2014 a 31 de dezembro de 2018.
Foram incluídos todos os pacientes cuja hipótese diagnóstica para sua manifestação dermatológica fosse de reação adversa mucocutânea relacionada à terapia sistêmica antineoplásica. Foram excluídos aqueles em que a hipótese de erupção cutânea secundária à terapia sistêmica antineoplásica não foi confirmada, ou que, pela revisão do prontuário, não se pode concluir o agente etiológico por dados incompletos ou perda de seguimento.
Extraiu‐se do prontuário características demográficas (sexo, idade quando do surgimento do EA e tipo de neoplasia), das terapias sistêmicas (fármaco), dos EAs mucocutâneos (tipo, duração e grau, de acordo com Common Terminology Criteria for Adverse Events v5.0)8 e dos desfechos do tratamento oncológico (se suspensão ou modificação pelo Evento Adverso [EA] mucocutâneo).
As terapias sistêmicas antineoplásicas foram divididas em: quimioterapia clássica (cujo mecanismo implica na interferência direta em alguma fase do ciclo celular, sem especificidade celular), terapia alvo (age por meio de ligação do fármaco a uma proteína ou receptor apenas das células alvo), imunoterapia (agentes que atuam aumentando ou alterando a imunidade do sistema imunológico do indivíduo), terapia hormonal (grupo de fármacos que atuam no crescimento induzido por hormônios de alguns cânceres) e fármacos complementares ao esquema antineoplásico (medicamentos que fazem parte dos protocolos de tratamento, porém não se enquadram nas categorias anteriores). Posteriormente, dividiu‐se cada grupo de tratamento antineoplásico em subgrupos, de acordo com sua classificação. Os quimioterápicos clássicos foram divididos em antimetabólicos, antraciclinas, alquilantes, taxanos, alcaloides, antibiótico antitumoral, inibidores da topoisomerase I e II e mecanismo desconhecido; os fármacos empregados na terapia alvo, em anti‐EGFR, anti‐VEGFR, anti‐EGFR e anti‐VEGFR, anti‐PDGFR e c‐Kit, inibidor de tirosina‐quinase, inibidor de MEK e anti‐HER‐2; imunoterápicos, em anti‐PD‐1; e hormonioterapia, em inibidor da aromatase e inibidor androgênico.9
As variáveis não paramétricas foram descritas pela mediana, valores mínimos e máximos, e as variáveis qualitativas foram representadas por suas frequências absolutas (N) e relativas (%). Os dados obtidos pelo protocolo de pesquisa foram analisados com auxílio do software STATA, versão 13 (STATA Corp., Texas, Estados Unidos). Esta pesquisa foi aprovada pelo Núcleo de Pesquisa do ICESP e pelo Comitê de Ética da Faculdade de Medicina da Universidade de São Paulo (CEP/FMUSP), sob registro 1476/2019.
ResultadosForam revisados os prontuários de 765 pacientes, dos quais 138 (18,0%) preencheram os critérios de inclusão. As razões para exclusão foram: manifestação mucocutânea não relacionada ao uso de fármacos antineoplásicos (n=508; 81,0%), presença insuficiente de informações no prontuário que inviabilizaram estabelecer o vínculo entre o tratamento e o EA (n=74; 11,8%), ausência de lesão ou presença de lesão residual na primeira consulta dermatológica (n=25; 4,0%), perda de seguimento por óbito, falta ou alta hospitalar (n=14; 2,2%) e não definição diagnóstica por resolução do quadro durante o seguimento e antes de sua elucidação (n=6; 1,0%). Dos pacientes incluídos, 70 eram do sexo feminino (50,7%) e 68 do sexo masculino (49,3%), com mediana de idade de 54 anos (variando entre 19 e 90 anos). As neoplasias malignas que mais frequentemente acometeram os pacientes foram as de mama (n=26; 18,8%), cólon (n=23; 16,7%) e tireoide (n=10; 7,2% – tabela 1).
Características demográficas dos pacientes
| Característica | n (%) |
|---|---|
| Sexo | |
| Feminino | 70 (50,7) |
| Masculino | 68 (49,3) |
| Idade (em anos) | |
| Mediana (variação) | 54 (19–90) |
| Neoplasia maligna (CID‐10) | |
| Mama (C50) | 26 (18,8) |
| Cólon (C18) | 23 (16,7) |
| Tireoide (C73) | 10 (7,2) |
| Linfoma não Hodgkin (C83) | 9 (6,5) |
| Pulmão (C34) | 8 (5,8) |
| Linfoma de Hodgkin (C81) | 7 (5,0) |
| Leucemia mieloide (C92) | 6 (4,3) |
| Testículo (C62) | 5 (3,6) |
| Estômago (C16) | 5 (3,6) |
| Reto (C20) | 5 (3,6) |
| Outrasa | 33 (23,9) |
| Total | 138 (100,0) |
a Outros: fígado (3), mieloma múltiplo (3), pele (3), ânus e canal anal (2), colo do útero (2), encéfalo (2), esôfago (2), intestino delgado (2), ovário (2), partes moles (2), próstata (2), rim (2), leucemia linfoide (2), bexiga (1), corpo do útero (1), orofaringe (1), pâncreas (1), retossigmoide (1).
Quanto aos EAs, 67,4% dos pacientes apresentaram um EA (n=93); em 22,5% foram identificados dois EAs concomitantes à ocasião da avaliação dermatológica (n=31); em 8,0%, três EAs (n=11); e em 2,1%, quatro EAs (n=3). A mediana de tempo entre o início dos sintomas e a primeira consulta dermatológica foi de 25,5 dias. Dos EAs, 27 foram classificados como grau I (19,6%), 16 como grau II (11,6%), 13 como grau III (9,4%) e 2 como grau IV (1,4%). Não foram identificados pacientes com grau V e não se encontrou registro no prontuário em referência a graduação em 80 pacientes (58,0%).
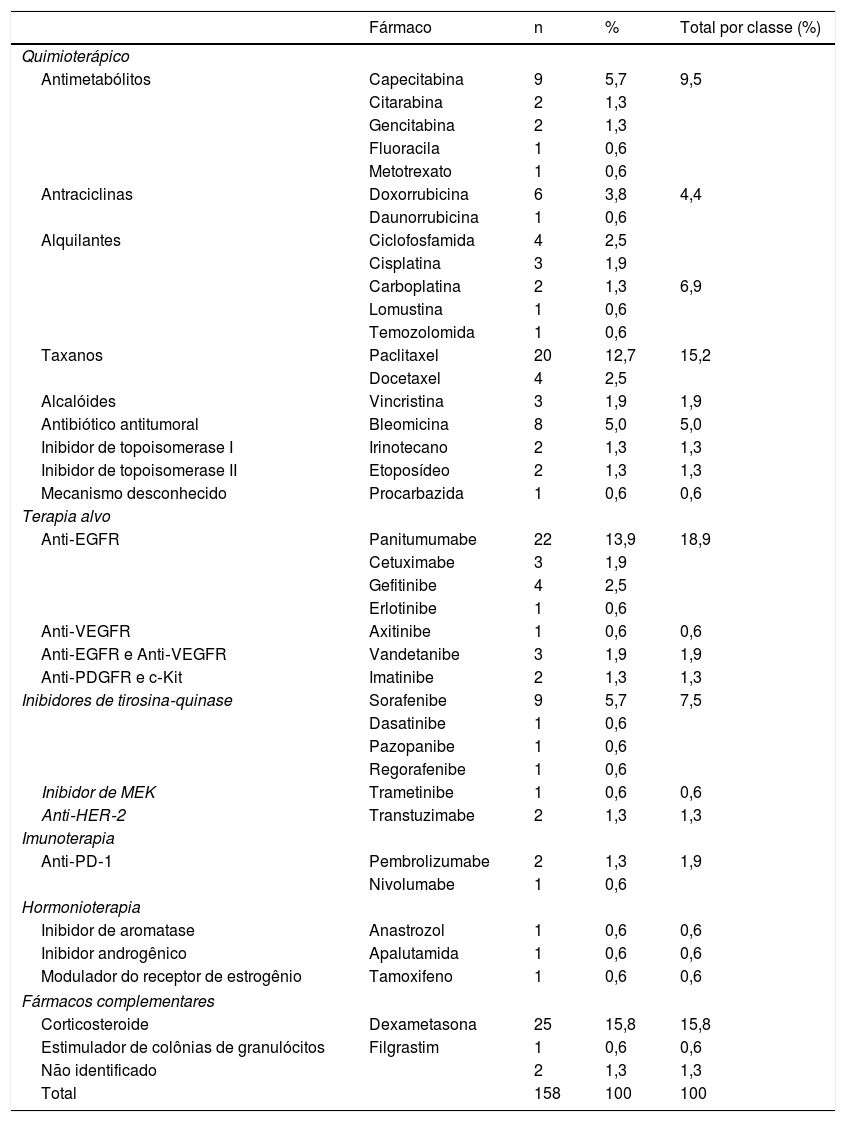
Em relação aos tratamentos sistêmicos antineoplásicos, a quimioterapia clássica foi o principal grupo medicamentoso responsável pelos EAs, compreendendo 73 casos (46,2%), seguida por terapia alvo (n=51; 32,3%), outros fármacos não antineoplásicos utilizados em conjunto com protocolos de quimioterapia (n=26; 16,5%), imunoterapia (n=3; 1,9%) e hormonioterapia (n=2; 1,3%). Em dois casos (1,3%) não foi possível identificar o fármaco empregado, pois os pacientes encontravam‐se em protocolo de pesquisa duplo cego (tabela 2).
Classes e fármacos utilizados na terapia oncológica sistêmica, responsáveis pelas reações adversas mucocutâneas
| Fármaco | n | % | Total por classe (%) | |
|---|---|---|---|---|
| Quimioterápico | ||||
| Antimetabólitos | Capecitabina | 9 | 5,7 | 9,5 |
| Citarabina | 2 | 1,3 | ||
| Gencitabina | 2 | 1,3 | ||
| Fluoracila | 1 | 0,6 | ||
| Metotrexato | 1 | 0,6 | ||
| Antraciclinas | Doxorrubicina | 6 | 3,8 | 4,4 |
| Daunorrubicina | 1 | 0,6 | ||
| Alquilantes | Ciclofosfamida | 4 | 2,5 | |
| Cisplatina | 3 | 1,9 | ||
| Carboplatina | 2 | 1,3 | 6,9 | |
| Lomustina | 1 | 0,6 | ||
| Temozolomida | 1 | 0,6 | ||
| Taxanos | Paclitaxel | 20 | 12,7 | 15,2 |
| Docetaxel | 4 | 2,5 | ||
| Alcalóides | Vincristina | 3 | 1,9 | 1,9 |
| Antibiótico antitumoral | Bleomicina | 8 | 5,0 | 5,0 |
| Inibidor de topoisomerase I | Irinotecano | 2 | 1,3 | 1,3 |
| Inibidor de topoisomerase II | Etoposídeo | 2 | 1,3 | 1,3 |
| Mecanismo desconhecido | Procarbazida | 1 | 0,6 | 0,6 |
| Terapia alvo | ||||
| Anti‐EGFR | Panitumumabe | 22 | 13,9 | 18,9 |
| Cetuximabe | 3 | 1,9 | ||
| Gefitinibe | 4 | 2,5 | ||
| Erlotinibe | 1 | 0,6 | ||
| Anti‐VEGFR | Axitinibe | 1 | 0,6 | 0,6 |
| Anti‐EGFR e Anti‐VEGFR | Vandetanibe | 3 | 1,9 | 1,9 |
| Anti‐PDGFR e c‐Kit | Imatinibe | 2 | 1,3 | 1,3 |
| Inibidores de tirosina‐quinase | Sorafenibe | 9 | 5,7 | 7,5 |
| Dasatinibe | 1 | 0,6 | ||
| Pazopanibe | 1 | 0,6 | ||
| Regorafenibe | 1 | 0,6 | ||
| Inibidor de MEK | Trametinibe | 1 | 0,6 | 0,6 |
| Anti‐HER‐2 | Transtuzimabe | 2 | 1,3 | 1,3 |
| Imunoterapia | ||||
| Anti‐PD‐1 | Pembrolizumabe | 2 | 1,3 | 1,9 |
| Nivolumabe | 1 | 0,6 | ||
| Hormonioterapia | ||||
| Inibidor de aromatase | Anastrozol | 1 | 0,6 | 0,6 |
| Inibidor androgênico | Apalutamida | 1 | 0,6 | 0,6 |
| Modulador do receptor de estrogênio | Tamoxifeno | 1 | 0,6 | 0,6 |
| Fármacos complementares | ||||
| Corticosteroide | Dexametasona | 25 | 15,8 | 15,8 |
| Estimulador de colônias de granulócitos | Filgrastim | 1 | 0,6 | 0,6 |
| Não identificado | 2 | 1,3 | 1,3 | |
| Total | 158 | 100 | 100 | |
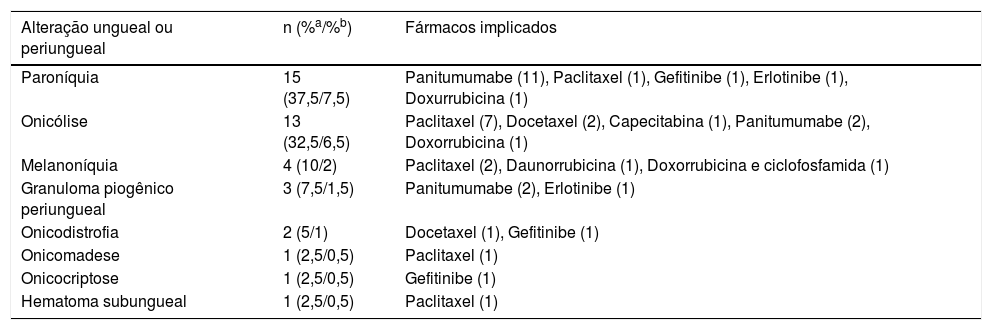
O grupo de EAs mais encontrado nesta casuística foi de alterações ungueais e periungueais, acometendo 40 pacientes e responsáveis por 20% das toxicidades dermatológicas do estudo (tabela 3). Dentre as alterações ungueais e periungueais, a paroníquia e a onicólise (15 e 13 pacientes, respectivamente) foram as mais relatadas. Ademais, melanoníquia (quatro pacientes), granuloma piogênico periungueal (três pacientes), onicodistrofia (dois pacientes), onicomadese (um paciente), onicocriptose (um paciente) e hematoma subungueal (um paciente) também estiveram reportados (tabela 4). Os fármacos mais implicados para tais efeitos foram os inibidores do receptor do fator de crescimento epidérmico (EGFR), representados pelo panitumumabe, gefitinibe e erlotibine, responsáveis por 50% das alterações ungueais (paroníquias, granulomas periungueais, onicólise, onicodistrofia e onicocriptose). O segundo grupo de tratamento antineoplásico com maior responsabilidade para as alterações ungueais e periungueais foram os quimioterápicos alquilantes e taxanos, causadores de alterações ungueais ou periungueais em 15 pacientes deste estudo: onicólise (nove pacientes), melanoníquia (dois pacientes), onicomadese (um paciente), onicodistrofia (um paciente) e hematoma subungueal (um paciente).
Manifestações adversas mucocutâneas secundárias às terapias oncológicas sistêmicas
| Alteração mucocutânea | n (%) | Fármacos implicados |
|---|---|---|
| Alterações ungueais e periungueais | 40 (20) | Panitumumabe (15), Paclitaxel (12), Docetaxel (3), Gefitinibe (3), Doxorrubicina (2), Daunorrubicina (1), Ertolinibe (2), Capecitabina (1), Doxurrubicina e ciclofosfamida (1) |
| Erupção pápulo‐pustulosa | 26 (13) | Panitumumabe (15), Cetuximabe (3), Sorafenibe (2), Vandetanibe (2), Gefitinibe (1), Pazopanibe (1), Trantuzumabe (1), Dabrafenibe e trametinibe (1) |
| Erupção acneiforme | 24 (12) | Dexametasona/prednisona (24) |
| Síndrome mão‐pé | 13 (6,5) | Capecitabina (5), Paclitaxel (3), Cisplatina (1), Citarabina (1), Gencitabina (1), Fluorouracil e oxaliplatina (1), Cisplatina e capecitabina (1) |
| Reação mão‐pé | 12 (6) | Sorafenibe (8), Axitinibe (1), Cetuximabe (1), Regorafenibe (1), Panitumumabe (1) |
| Xerose | 12 (6) | Panitumumabe (6), Bleomicina (1), Ertolinibe (1), Gefitinibe (1), Pembrolizumabe (1), Transtuzumabe (1), Não identificado (1)a |
| Exantemas | 9 (4,5) | Carboplatina e paclitaxel (1), Dasatinibe (1), Gencitabina (1), Imatinibe (1), Irinotecano e panitumumabe (1), Panitumumabe (1), Sorafenibe (1), Não identificado (2)a |
| Dermatite flagelada | 8 (4) | Bleomicina (8) |
| Tricomegalia | 5 (2,5) | Panitumumabe (4), Gefitinibe (1) |
| Hipertricose | 5 (2,5) | Panitumumabe (4), Gefitinibe (1) |
| Fotossensibilidade | 4 (2) | Apalutamida (1), Capecitabina (1), Paclitaxel (1), Vandetanibe (1) |
| Fissura | 4 (2) | Panitumumabe (4) |
| Eflúvio anágeno | 3 (1,5) | Carboplatina e docetaxel (1), Docetaxel (1), Paclitaxel (1) |
| Prurido | 3 (1,5) | Paclitaxel (2), Pembrolizumabe (1) |
| Mucosite | 3 (1,5) | Citarabina e metotrexato (1), Sorafenibe (1), Não identificado (1)a |
| Lentiginose acral | 2 (1) | Capecitabina (1), Capecitabina, paclitaxel e gencitabina (1) |
| Agravo do melasma | 2 (1) | Paclitaxel (2) |
| Irritação de queratose actínica | 2 (1) | Cisplatina (1), Vincristina e doxorrubicina (1) |
| Hiperpigmentação acral | 2 (1) | Capecitabina (1), Doxorrubicina e ciclofosfamida (1) |
| Urticária | 2 (1) | Lomustina, vincristina e procarbazina (1), Temozolomida (1) |
| Outros | 17 (8,5) | Sorafenibe (3), Imatinibe (2), Paclitaxel (2), Doxorrubicina, ciclofosfamida e paclitaxel (1), Tamoxifeno (1), Etoposideo e cisplatina (1), Vandetanibe (1), Etoposídeo, vincristina, ciclofosfamida e doxorrubicina (1), Nivolumabe (1), Pembrolizumabe (1), Filgrastim (1), Capecitabina (1), Pazopanibe (1) |
Alterações ungueais e periungueais e as terapias antineoplásicas implicadas
| Alteração ungueal ou periungueal | n (%a/%b) | Fármacos implicados |
|---|---|---|
| Paroníquia | 15 (37,5/7,5) | Panitumumabe (11), Paclitaxel (1), Gefitinibe (1), Erlotinibe (1), Doxurrubicina (1) |
| Onicólise | 13 (32,5/6,5) | Paclitaxel (7), Docetaxel (2), Capecitabina (1), Panitumumabe (2), Doxorrubicina (1) |
| Melanoníquia | 4 (10/2) | Paclitaxel (2), Daunorrubicina (1), Doxorrubicina e ciclofosfamida (1) |
| Granuloma piogênico periungueal | 3 (7,5/1,5) | Panitumumabe (2), Erlotinibe (1) |
| Onicodistrofia | 2 (5/1) | Docetaxel (1), Gefitinibe (1) |
| Onicomadese | 1 (2,5/0,5) | Paclitaxel (1) |
| Onicocriptose | 1 (2,5/0,5) | Gefitinibe (1) |
| Hematoma subungueal | 1 (2,5/0,5) | Paclitaxel (1) |
O segundo EA mais observado foi a erupção pápulo‐pustulosa (EPP; n=26; 13,0%), majoritariamente secundária ao uso de inibidores do EGFR, por seu bloqueio por anticorpos monoclonais (cetuximabe e panitumumabe), ou pela ação de pequenas moléculas (erlotinibe, gefitinibe e vandetanibe). A EPP também foi observada pela ação de inibidores não seletivos multiquinase (sorafenibe e pazobanibe) e de inibidor de MEK (trametinibe; tabela 3).
Erupção acneiforme (n=24; 12,0%) foi o terceiro EA mais observado, tendo sido secundária, em sua totalidade, ao uso de corticoterapia sistêmica adjunta às terapias oncológicas. Dentre as erupções acrais, a síndrome mão‐pé (SMP), ou eritrodisestesia, esteve presente em 13 pacientes, e foi responsável por 6,5% do total dos EAs do estudo nesta pesquisa. Para esses EAs, a capecitabina foi a substância mais implicada (seis pacientes), seguida pelo paclitaxel (três pacientes). Por sua vez, a reação mão‐pé (RMP) foi encontrada em 12 pacientes neste estudo (6,0%), frequentemente associada ao sorafenibe (oito pacientes).
Xerose acometeu 12 pacientes (6,0%) e foi determinada em sua maioria pelo uso de inibidores de EGFR (panitumumabe, erlotinibe e gefitinibe). Alterações da haste pilar estiveram presentes em 10 pacientes (quatro com tricomegalia, quatro com hipertricose, um com tricomegalia e hipertricose e um com repigmentação da haste) e foram responsáveis por 5,5% dos EAs. Em sua totalidade, foram causados pelos inibidores de EGFR panitumumabe (n=7), gefitinibe (n=2) e vandetanibe (n=1). Exantemas, presentes em nove pacientes e perfazendo 4,5% dos EAs ocorreram na vigência de quimioterapia, terapia alvo e imunoterapia. Dermatite flagelada ocorreu em oito pacientes (4,0%), todos secundários ao uso da bleomicina.
Outros EAs, menos frequentemente encontrados, foram fotossensibilidade (total de quatro pacientes), um caso por capecitabina, um caso por paclitaxel, um caso por apalutamida e um caso por vandetanibe; eflúvio anágeno (total de três pacientes) por carboplatina e docetaxel (um caso), docetaxel (um caso) e paclitaxel (um caso); mucosite (total de três pacientes) ocasionada por citarabina e metotrexato (um caso), sorafenibe (um caso) e não identificado (um caso); lentiginose acral (total de dois pacientes) ocasionada por capecitabina (um caso) e capecitabina, paclitaxel e gencitabina (um caso); agravo de melasma (total de dois pacientes), ambos por paclitaxel; irritação de queratose actínica (total de dois pacientes), secundária ao uso de cisplatina (um caso) e vincristina e doxorrubicina (um caso); hiperpigmentação acral (total de dois pacientes), devido a capecitabina (um caso) e doxorrubicina e ciclofosfamida (um caso); urticária (total de dois pacientes), desencadeada por lomustina, vincristina e procarbazina (um caso) e por temozolomida (um caso); alopecia androgenética agravada pelo uso de doxorrubicina, ciclofosfamida e paclitaxel (um caso); dermatite vesicante por extravasamento do paclitaxel (um caso); dermatite eczematosa secundária ao tamoxifeno (um caso); eritema tóxico em decorrência de etoposídeo e cisplatina (um caso); pigmentação folicular causada por vandetanibe (um caso); erupção intertriginosa devido ao uso de etoposídeo, vincristina, ciclofosfamida e doxorrubicina (um caso); lipodistrofia por nivolumabe (um caso); líquen plano pilar secundário ao imatinibe (um caso); lúpus subagudo após uso de paclitaxel (um caso); necrólise epidérmica tóxica decorrente do uso de imatinibe (um caso); psoríase em placas por pembrolizumabe (um caso); queratose pilar por sorafenibe (um caso); síndrome de sweet após uso de filgrastim (um caso); foliculite perfurante devido ao sorafenibe (um caso); repigmentação de vitiligo secundária ao uso de capecitabina (um caso); e por fim, despigmentação cutâneo‐capilar após utilização de pazopanibe (um caso), perfazendo estes, individualmente, 0,5% da casuística.
Dos pacientes avaliados pela equipe de dermatologia, 24 deles (17,4%) tiveram o esquema de tratamento antineoplásico alterado ou suspenso. Dentre eles, nove tiveram mais de um EA concomitante (dois EPP e paroníquia; um EPP e xerose; um EPP e RMP; um onicólise e fotossensibilidade; um RMP e onicólise; uma xerose e fissura; um EPP e granuloma piogênico periungueal; um SMP e repigmentação do vitiligo). Os EAs que mais comumente resultaram nesse desfecho foram erupção pápulo‐pustulosa (sete casos), RMP (cinco casos) e SMP (cinco casos – tabela 5). Em seis pacientes, a alteração ou suspensão ocorreu após a avaliação dermatológica especializada; destes, três casos foram de SMP (dois causados por capecitabina e um em decorrência do uso de citarabina), um por erupção pápulo‐pustulosa (panitumumabe), um caso de fotossensibilidade (capecitabina) e o último secundário à farmacodermia (tamoxifeno). Em 18 pacientes os tratamentos foram suspensos ou modificados pelo oncologista, previamente à consulta dermatológica, dos quais um pode ser reintroduzido após a avaliação especializada (vandetanibe, responsável pela erupção pápulo‐pustulosa).
Fármacos e suas reações adversas que culminaram na sua suspensão
| Evento adverso | na | Fármaco implicado |
|---|---|---|
| Erupção pápulo‐pustulosa | 7 | Panitumumabe (5), Vandetanibe (1), Sorafenibe (1) |
| Reação mão‐pé | 5 | Sorafenibe (3), Panitumumabe (1), Axitinibe (1) |
| Síndrome mão‐pé | 5 | Capecitabina (4), Citarabina (1) |
| Paroníquia | 3 | Panitumumabe (3) |
| Xerose | 3 | Panitumumabe (3) |
| Fotossensibilidade | 2 | Capecitabina (1), Paclitaxel (1) |
| Dermatite flagelada | 1 | Bleomicina (1) |
| Farmacodermia | 1 | Tamoxifeno (1) |
| NET | 1 | Imatinibe (1) |
| Onicólise | 1 | Paclitaxel (1) |
| Granuloma piogênico | 1 | Panitumumabe (1) |
| Fissura | 1 | Panitumumabe (1) |
| Total | 31 |
Embora relevantes por sua incidência e morbidades, as toxicidades cutâneas são foco de poucas pesquisas, em geral no contexto de estudos clínicos fase II e III.5 Estudos epidemiológicos acerca dos assuntos são escassos e utilizam‐se de diferentes populações e esquemas antineoplásicos, dificultando a determinação de suas incidências.4,5
Nesta casuística, alterações ungueais e perigungueais foram os EAs mais comuns. Em estudos prospectivos de incidência geral de EAs, sua prevalência variou entre 2,9 e 23,1%, e foi, em geral, o terceiro tipo de EA de maior ocorrência.4,5 Fatos que justifiquem sua posição nesta pesquisa incluem a menor frequência de encaminhamento de efeitos adversos mais comuns (p. ex., eflúvio anágeno) e que, em muitos casos, essas reações não eram o motivo do encaminhamento, porém acompanhavam outros EAs, sendo assim identificadas, registradas em prontuário e consequentemente incluídas nesta pesquisa.
Nas literaturas específicas de alterações ungueais e periungueais secundárias a tratamentos antineoplásicos, tem‐se como fármacos de maior associação os taxanos e a terapia alvo.10 Sabe‐se que os inibidores de EGFR causam paroníquia em 10 a 15% de seus usuários.11 Nos casos extremos, pode haver o desenvolvimento de abscessos periungueais e lesões tipo granulomas piogênicos próximos à borda ungueal (o último identificado em três pacientes deste estudo, secundário ao uso de panitumumabe e erlotinibe). Já os taxanos, classicamente associados a alterações ungueais, são responsáveis por até 88% dessas manifestações em seu uso, as quais podem interferir nas atividades diárias de até 43% dos pacientes.3 Os efeitos mais reportados na literatura em relação a essa última classe são onicólise, linhas de Beau, hiperpigmentação ungueal, leuconíquia, paroníquia aguda e hemorragias subungueais e em estilhaço.3,12
Ainda sobre os inibidores de EGFR, implicados em 18,9% do total dos EAs desta casuística geral, foram responsáveis por 73,1% das erupções pápulo‐pustulosas do presente estudo. É o EA mais comum dessa terapia antineoplásica, ocorrendo em 50 a 100% dos pacientes.11,13,14
A erupção acneiforme, reação adversa muito frequente após uso de corticosteroides, foi reportada em 24 dos pacientes desta casuística, secundária ao uso de dexametasona e prednisona, adjuntos aos esquemas antineoplásicos. Na literatura existem poucos dados sobre esse EA nesse contexto, provavelmente em razão de seu uso em quase a totalidade dos esquemas quimioterápicos e, também, por ser um EA muito esperado.
A SMP, presente em 13 pacientes, foi responsável por 6,5% do total dos EAs do estudo, classificada em grau I (seis pacientes), grau II (um paciente), grau III (dois pacientes) e não graduada em quatro casos. Esse EA foi responsável pela suspensão do tratamento oncológico em dois pacientes (graus I e grau II) e modificação da dose da quimioterapia em três casos (dois graduados como III e um não classificado), mostrando o impacto na qualidade de vida do paciente e a importância do reconhecimento dessa toxicidade. Classicamente secundária a agentes quimioterápicos convencionais (doxorrubicina, capecitabina, citarabina, 5‐fluorouracil e docetaxel), nesta pesquisa a capecitabina foi o fármaco mais implicado (seis pacientes), seguido pelo paclitaxel (três pacientes). Na literatura, encontra‐se uma incidência de SMP de 50 a 60% em pacientes em uso de capecitabina.12 A RMP, apesar de compartilhar a mesma hipótese fisiopatogênica da SMP, é bastante distinta clinicamente, representando 20 a 40% dos EAs dos inibidores de multiquinase na literatura.10,15,16 Nesta casuística, foi um dos EAs mais observados (tabela 4), bem como frequente causa de suspensão ou modificação do esquema quimioterápico (tabela 5).
Com uma incidência variando entre 1 a 84%, xerose é um EA comum.10 Embora possa se desenvolver na vigência do uso de quimioterápicos clássicos, sua ocorrência se tornou mais problemática com o emprego das terapias alvos, pela maior gravidade do quadro e cronicidade do uso. Um dos grupos de maior associação são os do anti‐EGFR, que pode cursar com xerose em até 35% dos pacientes e, nesta pesquisa, foi responsável por 2/3 dos casos. Adicionalmente, esse EA pode evoluir para eczema asteatótico e fissuras dolorosas nas extremidades digitais (presente em quatro pacientes desta pesquisa), com grande impacto na qualidade de vida dos pacientes.11 Em alguns casos requer, inclusive, a modificação do tratamento como ocorrido em três pacientes desta pesquisa.
Reações exantemáticas podem ocorrer em todas as modalidades de tratamento sistêmico antineoplásico. Entretanto, os dados na literatura a respeito de reações exantemáticas são bastante heterogêneos, o que dificulta sua interpretação.10 Além disso, frequentemente são desencadeadas por causas não medicamentosas. No presente estudo, reações exantemáticas foram associadas a quimioterápicos e terapia alvo.
A dermatite flagelada, quando induzida farmacologicamente, se dá pelo uso de bleomicina, com uma ocorrência variando entre 8 a 66%.17 Em concordância com os dados da literatura, todos os casos de dermatite flagelada desta pesquisa foram causados pelo uso desse quimioterápico.
Alterações de haste capilar caracteristicamente ocorrem com o uso de anti‐EGFR (tendo ocorrido exclusivamente nesta pesquisa pelo uso dos anti‐EGFRs panitumumabe, gefitinibe e vandetanibe, corroborando assim com as informações vigentes). Dados da literatura apontam que estão presentes em até 80% dos pacientes após o sexto mês de tratamento. Incluem manifestações como alopecia e alterações na taxa de crescimento, espessura, formato e, mais raramente, na pigmentação da haste capilar.18
Fotossensibilidade não é um EA prevalente nos estudos epidemiológicos, achado compatível com o baixo número de casos presentes nesta pesquisa.4,5 Ela pode ser causada tanto por quimioterapia clássica como pela terapia alvo. No primeiro grupo, os de maior associação são dacarbazina, 5‐fluorouracil, tegafur e capecitabina; no segundo, vandetanibe, vemurafenibe e nivolumabe.6,19,20 No presente estudo, encontrou‐se como responsáveis por esse EA representantes de ambas as classes (com dois casos secundários à quimioterapia clássica, pelo uso de capecitabina e placitaxel, e um caso pelo uso de terapia alvo com vandetanibe). Além disso, identificou‐se em um paciente o hormonioterápico apalutamida como causa da fotossensibilidade. Apesar de pouco representativo neste estudo, esse EA motivou a suspensão do esquema antineoplásico em dois pacientes, totalizando 8,3% dos casos suspensos. Ressalta‐se ainda que vários outros fármacos utilizados no tratamento do câncer podem ser indutores de fotossensibilidade.6,19
EAs comuns da quimioterapia tradicional, como eflúvio anágeno, que pode acometer cerca de 75% desses pacientes, e mucosite, que afeta 40 a 70% dos doentes, tiveram baixa representatividade nesta pesquisa.3–6 Tal achado pode ser explicado por uma maior familiaridade do oncologista com esses EAs e por sua reversibilidade após o tratamento, resultando em menor taxa de encaminhamento para o dermatologista.
Como limitações deste estudo, destacam‐se seu desenho, que impossibilitou o cálculo da prevalência das reações adversas, e o grande número de pacientes excluídos em decorrência da insuficiência de informações no prontuário médico (n=74; 11,8%). Em razão de a base de dados ser composta apenas por pacientes encaminhados para avaliação dermatológica, pode ter‐se inflado o número de reações adversas menos comuns e, consequentemente, de menor familiarização pelo oncologista. Essas limitações demonstram a necessidade da realização de estudos prospectivos nos usuários de terapias sistêmicas antineoplásicas com o objetivo de se obter a real prevalência de cada EA com o uso das diferentes opções terapêuticas empregadas.
Outra limitação foi a baixa taxa de EAs quantificados, que se tornou prática sistemática no serviço mais recentemente. Esse registro possibilita documentar e classificar os efeitos tóxicos das terapias oncológicas, ressaltando‐se que uma graduação acurada é importante tanto ao iniciar o tratamento do EA quanto para avaliar a resposta clínica.3
A interferência dos EAs na qualidade de vida dos pacientes não foi considerada neste estudo, porém salienta‐se a relevância da introdução dessa avaliação como rotina, procurando obter subsídios para uma assistência mais eficiente e humanizada.
Observou‐se uma baixa taxa de ocorrência de EAs relacionados à imunoterapia nesta casuística, fenômeno que pode ser explicado pela não disponibilidade dessa modalidade terapêutica pelo Sistema Único de Saúde (SUS) durante o período do estudo – os casos incluídos são oriundos de protocolos de pesquisa.
Por fim, ressalta‐se a importância do estabelecimento de uma terminologia comum entre os diversos profissionais de saúde envolvidos no manejo do paciente, permitindo que seja feita uma padronização do tratamento e ajustes nas doses de acordo com a gravidade da expressão clínica dos EAs. O National Cancer Institute's Common Terminology Criteria for Adverse Events (CTCAE – Critério Comum de Terminologia para Eventos Adversos) é uma ferramenta padronizada para a classificação dos efeitos tóxicos das terapias oncológicas.
ConclusãoOs EAs mucocutâneos secundários às terapias antineoplásicas comumente afligem os pacientes e não raro resultam em alteração do tratamento oncológico. Com o desenvolvimento de novos medicamentos, mais EAs são identificados. Esse fato torna fundamental a contínua atualização dos dermatologistas com o objetivo de se atingir o máximo de precisão diagnóstica e a melhor abordagem terapêutica dos EAs, com um equilíbrio ideal entre o desfecho oncológico e a qualidade de vida para o paciente.
Suporte financeiroNenhum.
Contribuição dos autoresWilliam Queiroz Guimarães Wiegandt Ceglio: Aprovação da versão final do manuscrito; concepção e planejamento do estudo; elaboração e redação do manuscrito; obtenção, análise e interpretação dos dados; revisão crítica do manuscrito.
Marina Mattos Rebeis: Aprovação da versão final do manuscrito; concepção e planejamento do estudo; elaboração e redação do manuscrito; obtenção, análise e interpretação dos dados; revisão crítica do manuscrito.
Marcela Ferreira Santana: Aprovação da versão final do manuscrito; concepção e planejamento do estudo; elaboração e redação do manuscrito; obtenção, análise e interpretação dos dados; revisão crítica do manuscrito.
Denis Miyashiro: Aprovação da versão final do manuscrito; concepção e planejamento do estudo; revisão crítica do manuscrito.
Jade Cury‐Martins: Aprovação da versão final do manuscrito; concepção e planejamento do estudo; revisão crítica do manuscrito.
José Antônio Sanches: Aprovação da versão final do manuscrito; concepção e planejamento do estudo; revisão crítica do manuscrito.
Conflito de interessesNenhum.
Como citar este artigo: Ceglio WQG, Rebeis MM, Santana MF, Miyashiro D, Cury‐Martins J, Sanches JA. Cutaneous adverse events to systemic antineoplastic therapies: a retrospective study in a public oncologic hospital. An Bras Dermatol. 2022;97:14–21.
Trabalho realizado no Instituto do Câncer do Estado de São Paulo (ICESP) do Hospital das Clínicas da Faculdade de Medicina da Universidade de São Paulo, São Paulo, SP, Brasil.