Estudos anteriores demonstraram que anormalidades nos testes do olho seco e disfunção da glândula meibomiana (DGM) podem ocorrer na psoríase.
ObjetivosO objetivo do presente estudo foi avaliar a doença do olho seco (DOS), DGM em pacientes com psoríase, utilizando a meibografia, que é um método atual, objetivo e não invasivo para pacientes com doenças da glândula meibomiana, a fim de investigar a relação entre a gravidade da doença e o envolvimento ocular.
MétodosEste estudo incluiu 50 participantes com psoríase e 50 indivíduos saudáveis. Todos os indivíduos foram examinados pelo mesmo dermatologista e encaminhados para exame oftalmológico, incluindo avaliação das alterações da margem das pálpebras, obstrução da glândula meibomiana, avaliação do índice de doença da superfície ocular, teste do tempo de ruptura do filme lacrimal, teste de Schirmer e avaliação da conjuntiva e da córnea na coloração com fluoresceína. Além disso, as pálpebras superiores e inferiores foram avaliadas por meio da meibografia para perda da glândula meibomiana.
ResultadosDGM (28%), perda da glândula meibomiana (PGM) (29,5%), escore superior na meibografia (0,61 ±0,81), escore inferior na meibografia (0,46 ±0,61) e DOS (22%) foram significativamente maiores no grupo psoríase em comparação ao grupo controle (p=0,008, p<0,001, p=0,027, p=0,041, p=0,044, respectivamente). Houve relação significativa entre DGM e Índice de Área e Gravidade da Psoríase (PASI; p=0,015, odds ratio=1,211). Houve relação positiva significativa entre PGM e o PASI (p<0,001, r=608) e duração da psoríase (p<0,001, r=0,547).
Limitações do estudoGrupo de estudo pequeno e incapacidade de detectar mudanças na qualidade da secreção meibomiana com a meibografia foram as limitações do estudo.
ConclusõesA psoríase pode afetar a morfologia da glândula meibomiana, podendo causar alterações estruturais nas glândulas meibomianas, e como consequência, pode determinar DGM e DOS. Portanto, oftalmologistas e dermatologistas devem estar atentos a essa situação e coavaliar os pacientes em relação a essas questões.
A psoríase é doença inflamatória crônica que afeta 2 a 5% da população mundial, com múltiplas manifestações extracutâneas.1,2 O envolvimento ocular é particularmente comum e afeta aproximadamente 10% dos casos.3–5 Uveíte, conjuntivite, blefarite e olho seco estão associados à psoríase.4,6,7 Entretanto, as manifestações oculares da doença podem ser sutis e se apresentar na forma subclínica.6
As glândulas meibomianas (GM) são glândulas sebáceas localizadas nas pálpebras, responsáveis pela secreção de lipídeos que desempenham um papel importante na superfície ocular, evitando a evaporação das lágrimas.8
A disfunção da glândula meibomiana (DGM) é doença crônica caracterizada por obstrução do ducto terminal e/ou alterações quantitativo‐qualitativas nas secreções.9 A prevalência de DGM varia entre 3,5 e 74,5%.10,11 Obstrução da GM, as secreções meibomianas, telangiectasias, perda da glândula, bem como combinação de alguns desses parâmetros foram usadas para diagnosticar a DGM.12,13 Uma relação significativa foi encontrada entre a psoríase e a DGM em estudos; no entanto, a meibografia não foi utilizada nos estudos com psoríase, embora essa abordagem não invasiva agora seja amplamente preferida para uso clínico e tenha possibilitado a realização de muitos estudos clínicos sobre doenças da glândula meibomiana.14–16 Além disso, a meibografia permite uma observação objetiva das glândulas meibomianas.16
A DGM pode causar ou exacerbar os sintomas do olho seco; aproximadamente dois terços dos pacientes com DOS têm DGM.17,18 Assim, pode‐se dizer que a DGM e a doença do olho seco (DOS) frequentemente são vistas juntas. Além disso, anormalidades nos testes de olho seco foram detectadas em estudos sobre psoríase.19–21O objetivo do presente estudo foi avaliar a DOS e a DGM com o uso de meibografia, bem como os critérios diagnósticos atuais para pacientes com psoríase.
Materiais e métodosDesenho e população do estudoO presente estudo foi realizado com a aprovação do protocolo pelo Comitê de Ética em Pesquisa, em 19/04/2019 e sob número 03/59 no Departamento de Dermatologia e Oftalmologia, Aksaray University Research and Training Hospital, entre maio e agosto de 2019. Todos os procedimentos do estudo foram realizados de acordo com a Declaração de Helsinque. O consentimento informado por escrito foi obtido de todos os participantes antes do estudo.
Este estudo de centro único, prospectivo e controlado incluiu 50 participantes (50 olhos) entre 18 e 65 anos de idade, que foram clinicamente e histopatologicamente diagnosticados com psoríase em placas ou vulgar. Um grupo controle saudável pareado (por sexo e idade; n=50, 50 olhos), sem histórico familiar de psoríase, também foi incluído em nosso estudo.
Os participantes com infecção ocular, alergia, alterações da superfície ocular, história de cirurgia ou lesão ocular, usuários de medicamentos tópicos ou sistêmicos que podem afetar a superfície ocular e usuários de lentes de contato foram excluídos do nosso estudo. Pacientes com qualquer doença dermatológica diferente de psoríase em placas e aqueles com doenças sistêmicas e neoplasias malignas, e pacientes com histórico de tratamento com psolareno+ultravioleta A (PUVA) não foram incluídos no estudo.
Diagnóstico e avaliação da gravidade da psoríaseA gravidade da doença foi avaliada utilizando‐se o Índice de Área e Gravidade da Psoríase (PASI, do inglês Psoriasis Area and Severity Index). A gravidade da psoríase em placas foi classificada como doença leve e moderada a grave. A doença leve foi definida como PASI ≤ 10, e a doença moderada a grave foi agrupada como PASI >10.22 As características demográficas e os escores médios do PASI foram registrados e documentados.
Diagnóstico e avaliação das doenças ocularesOs exames e testes foram realizados sequencialmente da seguinte forma: as pálpebras superiores e inferiores foram avaliadas com um microscópio para presença de obstrução, telangiectasia, margens irregulares da pálpebra (chanfradura ou notching) e deslocamento da junção mucocutânea. Após o exame, foram realizados coloração da superfície ocular com fluoresceína, teste do tempo de ruptura do filme lacrimal (BUT, do inglês Break‐Up Time), teste de Schirmer e meibografia. Os resultados desses testes foram registrados.
Os critérios diagnósticos recomendados pelo MGD Study Group no Japão foram utilizados para o diagnóstico da DGM.23 A DGM foi diagnosticada quando a GM estava ocluída e havia anormalidades nas margens da pálpebra. O BG‐4M Non‐Contact System foi utilizado na meibografia (Sirius, Costruzione Strumenti Oftalmici, Firenze, Itália). A avaliação da GM foi realizada com o auxílio de imagens de infravermelho de um biomicroscópio com lâmpada de fenda e uma câmera de vídeo. A taxa de perda da glândula meibomiana (PGM) para a área total das glândulas foi calculada utilizando‐se um software. Com esse software, o examinador marcava a área total e a perda de área, e o percentual da PGM era calculado pelo software. PGM foi registrada como grau 0 (sem perda da GM), grau 1 (0 a 1/3da GM total), grau 2 (1/3 a 2/3da GM total) e grau 3 (> 2/3da GM total).24 A classificação da PGM foi realizada com cegamento, pelo mesmo pesquisador. A distorção da GM foi registrada como 0 (< 50% de alterações) ou 1 (> 50% de alterações). Os escores na meibografia e a distorção da GM para as pálpebras superiores e inferiores foram avaliados para o olho direito.
O diagnóstico da doença do olho seco foi verificado utilizando‐se os critérios Tear Film & Ocular Surface Society Dry Eye Workshop II (TFOS DEWS II) modificados: o índice de doença da superfície ocular (OSDI, do inglês ocular surface disease index) >13 mais um no teste BUT <10 s, escore do teste de Schirmer <10mm ou coloração da córnea e conjuntiva >0.25 O teste BUT, teste de Schirmer e coloração da córnea e conjuntiva foram realizados no olho direito.
Análise estatísticaA análise estatística foi realizada com o software SPSS, versão 23.0 para Windows (SPSS Inc., Chicago, IL, EUA). O teste de Shapiro‐Wilk foi usado para avaliar se a distribuição dos dados numéricos era normal. O teste t para amostras independentes (para uma distribuição normal) e o teste de Mann‐Whitney (distribuição não normal) foram utilizados para comparar as médias das variáveis numéricas entre os dois grupos. O teste de qui‐quadrado foi usado para comparar as médias das variáveis categóricas entre os dois grupos. A análise de correlação de Spearman foi usada para determinar a relação entre as variáveis numéricas que apresentavam distribuição normal. Análises de regressão logística binária foram aplicadas para calcular os odds ratios para as associações entre as variáveis explicativas; valores de p <0,05 foram considerados estatisticamente significativos.
ResultadosOs pacientes com diagnóstico de psoríase (n=50) neste estudo incluíram 26 (52%) mulheres e 24 (48%) homens, e a média de idade dos 50 pacientes era de 43,4 ±14,1 (variação, 18‐65) anos. Além disso, 25 indivíduos (50%) do grupo controle eram do sexo feminino e 25 (50%) do sexo masculino. A média de idade do grupo controle (n=50) era de 41,2 ±8,1 (variação, 21‐65) anos. Não houve diferenças estatisticamente significativas na idade e sexo entre os dois grupos (p >0,05).
De acordo com a anamnese clínica, 4 dos 50 pacientes (8%) apresentavam sintomas oculares subjetivos, como prurido, sensação de queimação e ardência.
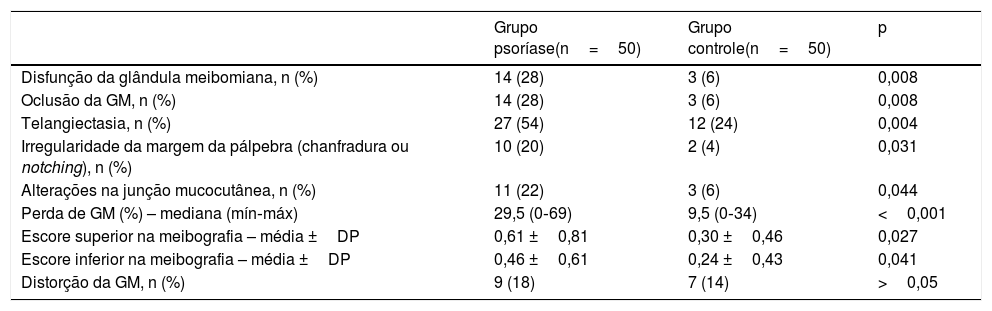
A frequência de DGM foi de 28% (n=14) no grupo com psoríase e 6% (n=3) no grupo controle (p=0,008). Uma comparação da oclusão da glândula meibomiana, telangiectasia, deslocamento da junção mucocutânea e irregularidade da margem da pálpebra (chanfradura) é apresentada na tabela 1.
Comparação das anormalidades da glândula meibomiana entre os grupos com psoríase e controle
| Grupo psoríase(n=50) | Grupo controle(n=50) | p | |
|---|---|---|---|
| Disfunção da glândula meibomiana, n (%) | 14 (28) | 3 (6) | 0,008 |
| Oclusão da GM, n (%) | 14 (28) | 3 (6) | 0,008 |
| Telangiectasia, n (%) | 27 (54) | 12 (24) | 0,004 |
| Irregularidade da margem da pálpebra (chanfradura ou notching), n (%) | 10 (20) | 2 (4) | 0,031 |
| Alterações na junção mucocutânea, n (%) | 11 (22) | 3 (6) | 0,044 |
| Perda de GM (%) – mediana (mín‐máx) | 29,5 (0‐69) | 9,5 (0‐34) | <0,001 |
| Escore superior na meibografia – média ±DP | 0,61 ±0,81 | 0,30 ±0,46 | 0,027 |
| Escore inferior na meibografia – média ±DP | 0,46 ±0,61 | 0,24 ±0,43 | 0,041 |
| Distorção da GM, n (%) | 9 (18) | 7 (14) | >0,05 |
GM, glândula meibomiana.
A PGM era de 29,5% no grupo com psoríase e 9,5% no grupo controle (p <0,001). A comparação dos escores superior e inferior na meibografia é mostrada na tabela 1. Não foram detectadas diferenças na distorção da GM entre os grupos (p >0,05).
A frequência de DOS no grupo com psoríase era de 22% (n=11), enquanto no grupo controle era de 6% (n=3; p=0,044). A comparação do OSDI, teste BUT, teste de Schirmer e o escore na coloração da córnea é apresentada na tabela 2.
Parâmetros da superfície ocular nos grupos psoríase e controle
| Grupo psoríase(n=50) | Grupo controle(n=50) | p | |
|---|---|---|---|
| OSDI – mediana (mín.–máx.) | 11,5 (0‐23) | 7 (0‐17) | 0,005 |
| Tempo de ruptura do filme lacrimal (s) – mediana (mín.–máx.) | 8 (4‐18) | 14,5 (6‐19) | <0,001 |
| Escore no teste de Schirmer (mm) – mediana (mín.–máx.) | 14 (5‐24) | 16 (4‐25) | >0,05 |
| Escore de coloração – média ±DP | 0,52 ±0,71 | 0,24 ±0,62 | 0,038 |
| Doença do olho seco, n (%) | 11 (22) | 3 (6) | 0,044 |
OSDI, Índice de doença da superfície ocular.
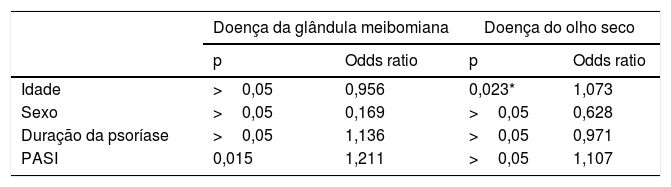
O teste de correlação de Spearman foi realizado entre PGM, escores PASI e a duração da psoríase. Uma correlação significativa positiva foi encontrada entre os escores PGM e PASI (p <0,001; r=0,608), bem como a duração da psoríase (p <0,001; r=0,547).
A relação entre a DGM e idade, sexo, duração da psoríase e escores PASI foi avaliada através do teste de regressão logística binomial. Uma relação significativa foi encontrada entre os escores DGM e PASI (p=0,015, OR=1,211). Não foi observada relação significativa entre idade, sexo e duração da psoríase (p >0,05; tabela 3).
Resultados do modelo de regressão logística binomial para pacientes com psoríase
| Doença da glândula meibomiana | Doença do olho seco | |||
|---|---|---|---|---|
| p | Odds ratio | p | Odds ratio | |
| Idade | >0,05 | 0,956 | 0,023* | 1,073 |
| Sexo | >0,05 | 0,169 | >0,05 | 0,628 |
| Duração da psoríase | >0,05 | 1,136 | >0,05 | 0,971 |
| PASI | 0,015 | 1,211 | >0,05 | 1,107 |
PASI, Índice de área e gravidade da psoríase.
A relação entre DOS e idade, sexo, duração da psoríase e escores PASI foi avaliada através do teste de regressão logística binomial. Foi encontrada uma relação significativa entre DOS e idade (p=0,023, OR=1,073). Não foi observada relação significativa entre sexo, tempo de psoríase e escores PASI (p >0,05; tabela 3).
DiscussãoNossos dados representam o primeiro relato sobre PGM, DGM e DOS mais elevados em pacientes com psoríase do que na população saudável com o uso da técnica da meibografia e sua relação positiva com a gravidade da doença.
Em estudos anteriores sobre psoríase e DGM realizados sem meibografia, de acordo com diferentes critérios diagnósticos, verificou‐se uma alta taxa de DGM em pacientes com psoríase.14,15 Zengin et al. realizaram um estudo com 70 pacientes com psoríase, e verificaram que os pacientes com psoríase apresentavam mais obstrução, índices de espessura e um volume normal de secreção da glândula meibomiana. Eles declararam que um tipo obstrutivo de DGM pode resultar do aumento da renovação do epitélio que reveste o ducto da glândula meibomiana em pacientes com psoríase.14 Aragona et al. realizaram um estudo com 66 pacientes com psoríase, e verificaram deterioração significativa nos testes de superfície ocular, como alteração da camada lipídica do filme lacrimal, instabilidade do filme lacrimal, lesões epiteliais da córnea e conjuntiva e leve metaplasia escamosa na citologia de imprint no grupo de pacientes comparados com os participantes saudáveis.15 De acordo com os critérios do MGD Study Group no Japão,25 a frequência de DGM no presente estudo foi significativamente maior, afetando 28% dos pacientes com psoríase, o que foi consistente com a literatura.
Anormalidades no teste do olho seco em pacientes com psoríase foram demonstradas em vários estudos.19–21 Ghalamkarpour et al. realizaram um estudo com 200 pacientes psoriásicos e 100 controles saudáveis, e verificaram que os valores médios dos testes BUT e Schirmer em pacientes com psoríase foram significativamente menores do que nos controles, e escores significativamente maiores do OSDI foram observados nos pacientes em comparação com os controles. A doença do olho seco foi observada com maior frequência nos pacientes do que no grupo saudável. Eles sugeriram que a inflamação sistêmica em pacientes com psoríase pode desempenhar um papel importante nas anormalidades do olho seco.19 Demirci et al. realizaram um estudo com 30 pacientes com psoríase e 30 controles, e verificaram que os valores de osmolaridade lacrimal, OSDI, escores da escala de Oxford eram significativamente mais elevados e o escore no teste BUT foi significativamente menor no grupo de pacientes em comparação com o grupo controle saudável. Eles sugeriram que a psoríase pode afetar a osmolaridade da lágrima e a função do filme lacrimal através de processos inflamatórios.20 Em estudo de Santos da Cruz et al., com 43 pacientes com psoríase e 86 controles, verificou‐se que os pacientes com psoríase tinham taxa estatisticamente maior de olho seco (16,28%), provável olho seco (32,56%) e blefarite (16,28%) e doença da superfície ocular e os testes de Rosa Bengala foram mais anormais em pacientes com psoríase.21 No presente estudo, de acordo com os critérios do TFOS DEWS II,25 a frequência de DOS foi significativamente maior em 22% dos pacientes com psoríase, o que está de acordo com a literatura.
O mecanismo pelo qual a psoríase induz a DGM ainda não foi esclarecido. A psoríase é doença inflamatória crônica da pele, caracterizada por hiperproliferação e hiperqueratinização epidérmicas.26 Uma grande quantidade de células é produzida nessa doença; essas alterações podem ocorrer nas glândulas meibomianas e resultar na obstrução das glândulas e na DGM.14,15,20,21 A diminuição das secreções meibomianas devido à DGM no grupo com psoríase pode ter resultado no aumento da evaporação da lágrima. Além disso, a DOS pode ter ocorrido em razão do aumento da osmolaridade lacrimal decorrente da inflamação em pacientes com psoríase.20 Há algumas semelhanças nos mecanismos de privilégio imunológico do folículo piloso e do olho.27 As glândulas meibomianas fazem parte da rede de glândulas sebáceas da pele e, portanto, respondem às mesmas reações inflamatórias que atuam na queda de cabelo. Desse modo, ter uma doença no couro cabeludo, como a psoríase ou o líquen plano pilar, pode representar um risco para DGM e DOS.28 Por outro lado, vários estudos indicam uma associação de DGM com doenças inflamatórias da superfície ocular, como a doença de Sjögren, e o epitélio conjuntival pode ser alvo direto do processo inflamatório que leva à infiltração de linfócitos na conjuntiva tarsal e, além disso, o envolvimento direto das glândulas sebáceas ocorre em pacientes com líquen plano pilar.29,30 De maneira similar, esse envolvimento pode ser explicado por meio desse mecanismo na psoríase, que é doença inflamatória crônica, imunomediada por linfócitos T e células dendríticas.
O presente estudo tem algumas limitações. Em primeiro lugar, incluiu número relativamente pequeno de pacientes. Em segundo lugar, o método de meibografia mostra apenas alterações morfológicas nas glândulas meibomianas; portanto, não foram avaliadas alterações na qualidade da secreção meibomiana.
ConclusãoDe acordo com os resultados do presente estudo, sugerimos que a psoríase pode afetar a morfologia da glândula meibomiana, podendo causar alterações estruturais nas glândulas meibomianas e podendo determinar DGM e DOS. A meibografia é um método objetivo atual, de abordagem não invasiva, amplamente preferido pelos médicos para pacientes com doenças da glândula meibomiana e tem permitido a realização de muitos estudos sobre DGM. O presente estudo é o primeiro relato que avaliou a DGM em pacientes com psoríase utilizando a técnica de meibografia e sua correlação positiva com a gravidade da doença. Por outro lado, a literatura dermatológica geralmente não indica adequadamente essas complicações; entretanto, compreensão e manejo completos do envolvimento oftálmico são importantes para o cuidado abrangente de pacientes com psoríase.6 Portanto, dermatologistas e oftalmologistas devem estar cientes da DGM e DOS, as quais podem ser vistas em pacientes com psoríase. No presente estudo, 4 de 50 pacientes (8%) apresentaram sintomas oculares. Portanto, considera‐se que exames oftalmológicos periódicos devam ser realizados em pacientes com psoríase, principalmente naqueles que apresentam escores elevados no PASI, independente da presença de sintomas oculares, e que o diagnóstico precoce da condição dá aos pacientes a chance de tratamento, melhorando sua qualidade de vida.
Suporte financeiroNenhum.
Contribuição dos autoresFunda Kemeriz: Aprovação da versão final do manuscrito; revisão crítica da literatura; obtenção, análise e interpretação dos dados; participação efetiva na orientação da pesquisa; participação intelectual em cobduta propedêutica e/ou terapêutica dos casos estudados; revisão crítica do manuscrito; elaboração e redação do manuscrito; concepção e planejamento do estudo.
Burcu Tuğrul: Aprovação da versão final do manuscrito; revisão crítica da literatura; participação efetiva na orientação da pesquisa; revisão crítica do manuscrito; elaboração e redação do manuscrito.
Erdoğan Yaşar: Aprovação da versão final do manuscrito; revisão crítica da literatura; obtenção, análise e interpretação dos dados; participação efetiva na orientação da pesquisa; participação intelectual em cobduta propedêutica e/ou terapêutica dos casos estudados; revisão crítica do manuscrito; elaboração e redação do manuscrito; análise estatística; concepção e planejamento do estudo.
Conflito de interessesNenhum.
Como citar este artigo: Kemeriz F, Tugrul B, Yasar E. Evaluation of ocular psoriasis with meibography. An Bras Dermatol. 2022;97:22–7.
Trabalho realizado no Departamento de Dermatologia e Oftalmologia, Aksaray University Faculty e University, Ankara Oncology Training and Research Hospital, Turquia.