O uso de corticosteroides tópicos é comum na prática dermatológica. Em virtude de seu efeito anti‐inflamatório e imunomodulador, muitas vezes são os fármacos de escolha no tratamento de dermatites. Entretanto, pouco se discute a respeito do papel dos corticosteroides como possíveis desencadeantes do processo alérgico.1,2
Por se tratar de moléculas de baixo peso molecular e caráter lipofílico, os corticosteroides têm a capacidade de penetrar a barreira cutânea com relativa facilidade, ligando‐se a proteínas carreadoras e transformando‐se em imunógenos, que são fagocitados e sensibilizam linfócitos T, de modo que em contatos posteriores possam suscitar reação de hipersensibilidade celular, manifestando‐se como dermatite alérgica de contato (DAC).2–4A frequência de DAC a corticosteroides varia entre 0,5 a 5% na literatura.1,3 No Brasil, não há dados estatísticos sobre o tema, o que justifica a elaboração do atual estudo, aprovado pelo Comitê de Ética da instituição (33471620.7.0000.5479).
Por meio da análise de dados de prontuários do serviço, foi computado um total de seis pacientes com diagnóstico de DAC a corticosteroides, dois (33,3%) do sexo masculino e quatro (66,7%) do feminino, que representam 1% do total dos casos submetidos a testes de contato no período de 2014 a 2018. A média de idade desses pacientes foi de 60 anos (37 a 76 anos); o período de evolução dos sintomas variou de cinco meses a 17 anos, com tempo médio para diagnóstico de cinco anos e meio. O longo período observado reflete provável dificuldade de acesso a serviço dermatológico especializado, retardando o diagnóstico e implicando em maior morbidade.
De acordo com a literatura, os principais fatores de risco para DAC a corticosteroides são: presença de dermatoses crônicas prévias, uso de corticosteroides sem acompanhamento médico e suscetibilidade genética.1 Corroborando com esses achados, os seis pacientes apresentavam histórico de uso irregular e prolongado de corticosteroides tópicos, assim como dermatoses prévias: psoríase em dois (33,3%), dermatite de estase em dois (33,3%) e eczema crônico de etiologia não definida em outros dois (33,3%).
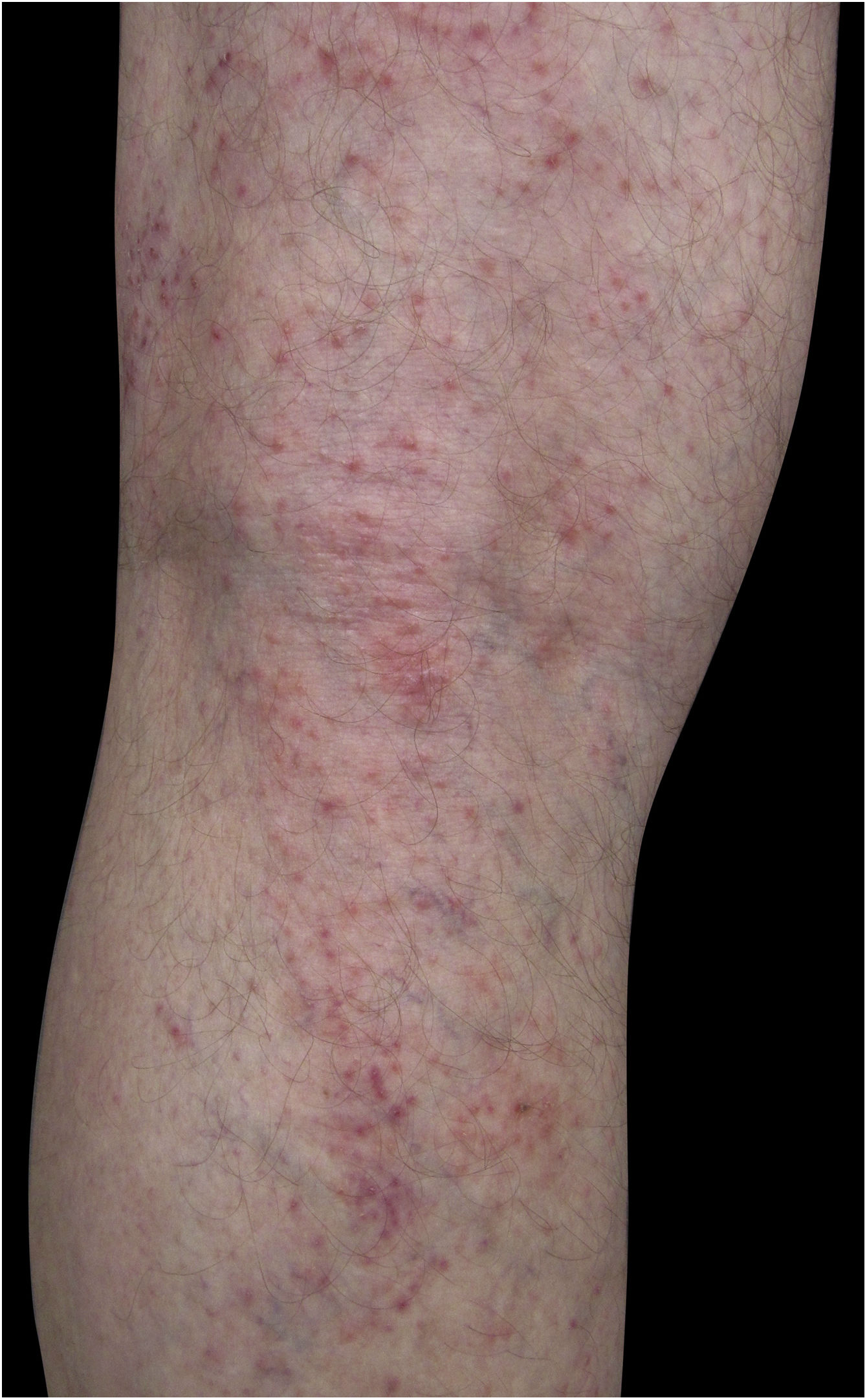
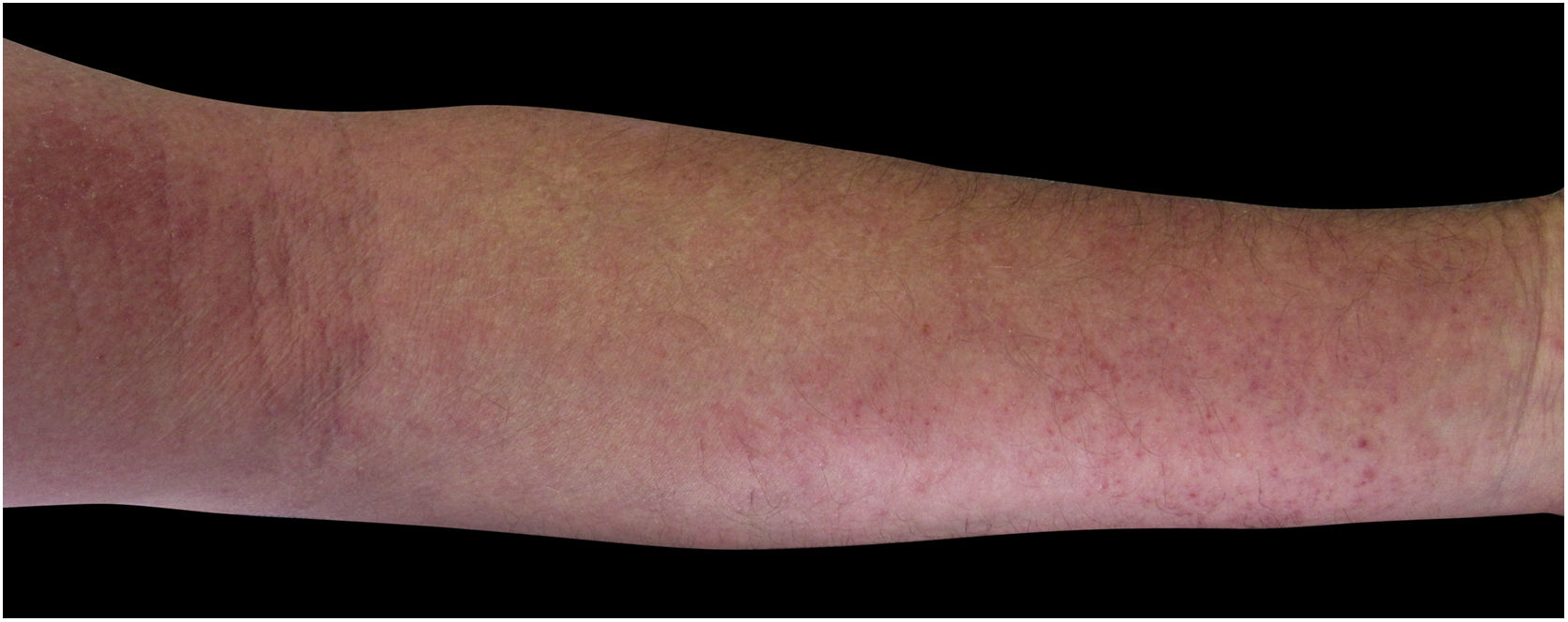
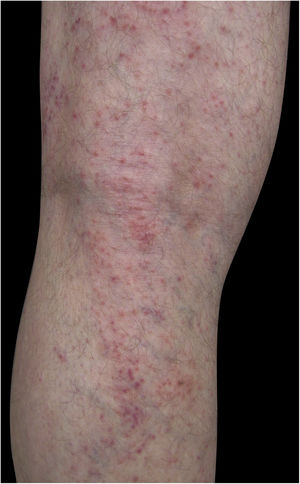
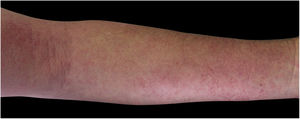
Quatro (66,7%) dos seis casos apresentavam lesões nos membros inferiores, dois (33,3%) nos membros superiores, um (16,7%) no tronco; dois (33,7%) tinham padrão disseminado (figs. 1 e 2). O quadro típico, como ocorreu em nossos casos, é de uma dermatose refratária ao tratamento com corticosteroides, caracterizada por lesões eczematosas que podem se apresentar mais evidentes nas bordas do que no centro. Além disso, é possível haver sinais indicativos de uso crônico de corticosteroides, como atrofia cutânea, rosácea, dermatite perioral e perinasal.1,5
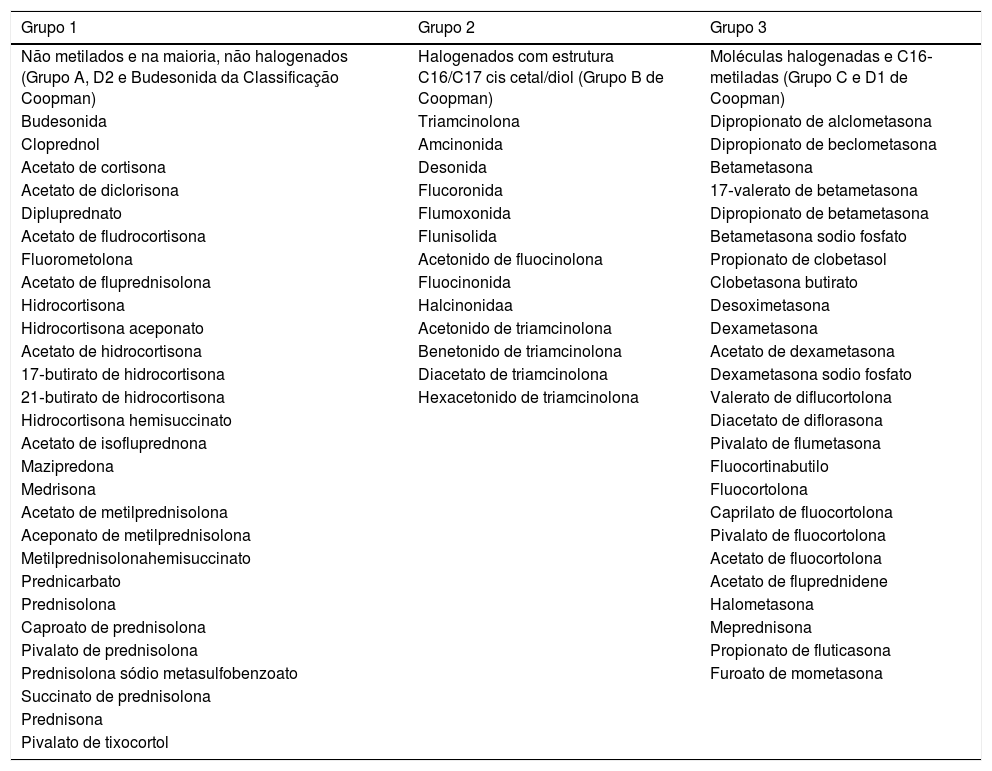
Em 1989, Coopman et al. categorizaram os corticosteroides tópicos em quatro grupos: A (tipo hidrocortisona), B (acetonídeos), C (tipo betametasona não esterificada) e D (ésteres, subdivididos em D1‐estáveis, e D2‐lábeis). Em 2011, Baeck et al. propuseram outro sistema de classificação com base em padrões de metilação e perfis alergênicos derivados de testes de contato, dividindo‐os em três grupos (tabela 1). Os corticosteroides do Grupo 1 produzem reações alérgicas com mais frequência, enquanto os do Grupo 3 têm o menor poder de sensibilização e risco de reações cruzadas. Todavia, é importante ressaltar que um mesmo paciente pode manifestar hipersensibilidade a mais de um grupo.1,6–8O teste de contato é a ferramenta diagnóstica padrão‐ouro e deve ser realizado para confirmar a suspeita e individualizar a conduta terapêutica, que pode variar desde a substituição do corticosteroide por outro pertencente a um grupo diferente, até o afastamento completo dessa classe farmacológica.1,5
Classificação dos corticosteroides (Baeck et al., 2011)7
| Grupo 1 | Grupo 2 | Grupo 3 |
|---|---|---|
| Não metilados e na maioria, não halogenados (Grupo A, D2 e Budesonida da Classificação Coopman) | Halogenados com estrutura C16/C17 cis cetal/diol (Grupo B de Coopman) | Moléculas halogenadas e C16‐metiladas (Grupo C e D1 de Coopman) |
| Budesonida | Triamcinolona | Dipropionato de alclometasona |
| Cloprednol | Amcinonida | Dipropionato de beclometasona |
| Acetato de cortisona | Desonida | Betametasona |
| Acetato de diclorisona | Flucoronida | 17‐valerato de betametasona |
| Dipluprednato | Flumoxonida | Dipropionato de betametasona |
| Acetato de fludrocortisona | Flunisolida | Betametasona sodio fosfato |
| Fluorometolona | Acetonido de fluocinolona | Propionato de clobetasol |
| Acetato de fluprednisolona | Fluocinonida | Clobetasona butirato |
| Hidrocortisona | Halcinonidaa | Desoximetasona |
| Hidrocortisona aceponato | Acetonido de triamcinolona | Dexametasona |
| Acetato de hidrocortisona | Benetonido de triamcinolona | Acetato de dexametasona |
| 17‐butirato de hidrocortisona | Diacetato de triamcinolona | Dexametasona sodio fosfato |
| 21‐butirato de hidrocortisona | Hexacetonido de triamcinolona | Valerato de diflucortolona |
| Hidrocortisona hemisuccinato | Diacetato de diflorasona | |
| Acetato de isofluprednona | Pivalato de flumetasona | |
| Mazipredona | Fluocortinabutilo | |
| Medrisona | Fluocortolona | |
| Acetato de metilprednisolona | Caprilato de fluocortolona | |
| Aceponato de metilprednisolona | Pivalato de fluocortolona | |
| Metilprednisolonahemisuccinato | Acetato de fluocortolona | |
| Prednicarbato | Acetato de fluprednidene | |
| Prednisolona | Halometasona | |
| Caproato de prednisolona | Meprednisona | |
| Pivalato de prednisolona | Propionato de fluticasona | |
| Prednisolona sódio metasulfobenzoato | Furoato de mometasona | |
| Succinato de prednisolona | ||
| Prednisona | ||
| Pivalato de tixocortol |
Estudos mostram pivalato de tixocortol, budesonida e 17‐butirato de hidrocortisona como os corticosteroides com maior chance de causar DAC.2 Isso provavelmente se deve à maior capacidade dessas moléculas de se ligarem à arginina das proteínas séricas, formando um antígeno.1 Esses marcadores identificam a maioria dos pacientes com DAC a corticosteroides; no entanto, já que todos pertencem ao Grupo 1, pacientes alérgicos a outros grupos podem passar despercebidos. Portanto, nos pacientes com positividade para algum desses marcadores e naqueles com alta suspeita clínica, o ideal é expandir o estudo do teste de contato usando uma série específica de corticosteroides contendo representantes de todos os grupos.
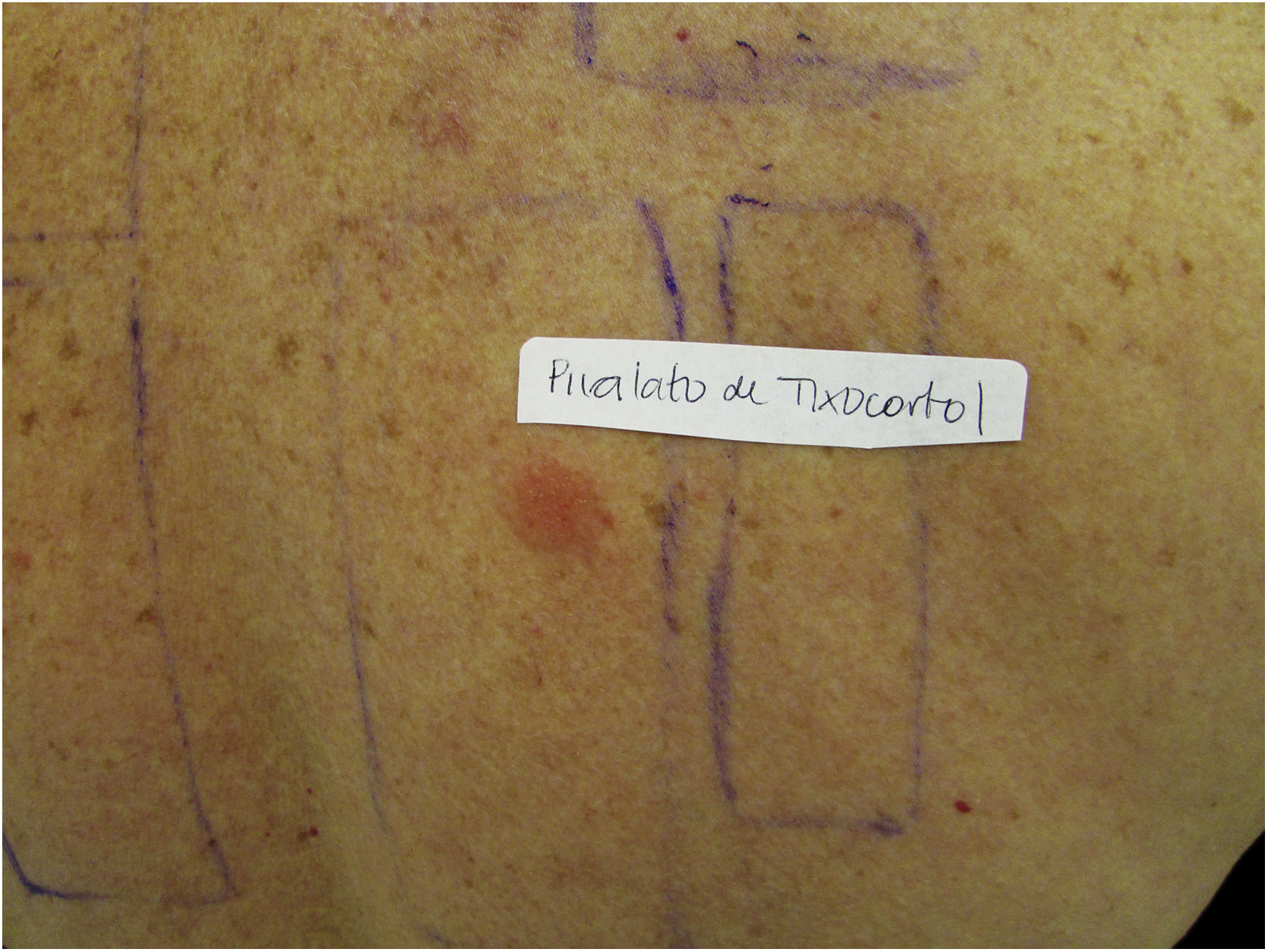
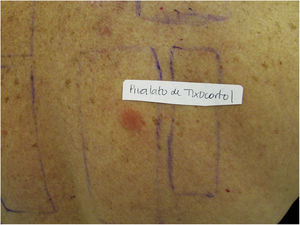
Os portadores de DAC a corticosteroides diagnosticados em nosso serviço foram testados com a bateria complementar latino‐americana (Chemotechnique), que contém 17‐butirato de hidrocortisona, budesonida e pivalato de tixocortol, além da bateria padrão brasileira (FDA Allergenic). Dentre eles, um (16,7%) apresentou positividade apenas para o pivalato de tixocortol (fig. 3), três (50%) para budesonida e os outros dois (33,3%) simultaneamente para budesonida e tixocortol. O uso da bateria complementar nos testes de contato foi imprescindível para viabilizar o diagnóstico em questão, já que não há marcadores de corticosteroides na bateria padrão. Em todos os casos foi recomendado o afastamento do contato com corticosteroides do Grupo 1. Embora o ideal fosse realizar novo teste com bateria específica de corticosteroides, tal conduta não foi possível nesses casos. Em um dos pacientes com lesões disseminadas, utilizou‐se metotrexate e fototerapia. Nos demais, houve boa resposta com a troca dos medicamentos em uso para corticosteroides do Grupo 3, como propionato de fluticasona e valerato de betametasona.
Além disso, cinco (83,3%) dos pacientes eram polissensibilizados, ou seja, apresentaram três ou mais reações positivas a alérgenos não relacionados entre si. Tais alérgenos eram componentes de medicamentos tópicos (neomicina, bacitracina, benzocaína, prometazina), conservantes (Kathon CG®, formaldeído, timerosal), componentes da borracha (tiuram e carba‐mix) e metais (sulfato de níquel, cloreto de cobalto), dados compatíveis com a literatura, pois trata‐se de indivíduos com dermatoses crônicas, que apresentam quebra de barreira cutânea, e se sensibilizam a múltiplos componentes de medicamentos, emolientes e outros contactantes.1,9,10
Há ainda outros elementos presentes em medicamentos tópicos (além do princípio ativo) que podem atuar como alérgenos, como estabilizantes (p. ex., etilenodiamina), veículos (p. ex., propilenoglicol) e fragrâncias, reforçando ainda mais a importância dos testes de contato.
Portanto, a DAC a corticosteroides deve ser considerada uma hipótese diante de quadros recorrentes, sem resposta ao tratamento com corticoterapia. Testes de contato devem ser indicados nesses casos, visando o afastamento do agente causal e a introdução precoce do tratamento adequado.
Suporte financeiroNenhum.
Contribuição dos autoresMariana de Figueiredo Silva Hafner: Concepção e planejamento do estudo; elaboração e redação do manuscrito; obtenção, análise e interpretação dos dados; participação efetiva na orientação da pesquisa; participação intelectual em conduta propedêutica e/ou terapêutica de casos estudados; revisão crítica da literatura; revisão crítica do manuscrito; aprovação da versão final do manuscrito.
Amanda Ivanchuk Lopes: Elaboração e redação do manuscrito; obtenção, análise e interpretação dos dados; aprovação da versão final do manuscrito.
Nathalie Mie Suzuki: Prticipação efetiva na orientação da pesquisa; participação intelectual em conduta propedêutica e/ou terapêutica de casos estudados; revisão crítica da literatura; revisão crítica do manuscrito; aprovação da versão final do manuscrito.
Rosana Lazzarini: Concepção e planejamento do estudo; elaboração e redação do manuscrito; obtenção, análise e interpretação dos dados; participação efetiva na orientação da pesquisa; participação intelectual em conduta propedêutica e/ou terapêutica de casos estudados; revisão crítica da literatura; revisão crítica do manuscrito; aprovação da versão final do manuscrito.
Conflito de interessesNenhum.
Como citar este artigo: Hafner MFS, Lopes AI, Suzuki NM, Lazzarini R. Allergic contact dermatitis to corticosteroids: experience of a referral clinic from 2014 to 2018. An Bras Dermatol. 2022;97:379–82.
Trabalho realizado na Clínica de Dermatologia da Santa Casa de São Paulo, São Paulo, SP, Brasil.