A cirurgia micrográfica de Mohs é técnica consagrada no tratamento de neoplasias cutâneas. Oferece maiores índices de cura, e as principais indicações são tumores cutâneos malignos não melanoma. Poucos estudos são realizados envolvendo tratamento de tumores raros por meio desta técnica.
ObjetivoEstudar os tumores cutâneos raros e variantes raras de carcinoma basocelular e carcinoma espinocelular submetidos à cirurgia micrográfica de Mohs em serviço terciário em relação a frequência, evolução livre de doença e aplicabilidade do método cirúrgico para esse grupo de tumores.
MétodosEstudo retrospectivo observacional incluindo os tumores cutâneos raros ou variantes menos comuns de carcinoma basocelular e carcinoma espinocelular tratados utilizando a técnica da cirurgia micrográfica de Mohs entre outubro de 2008 e abril de 2021.
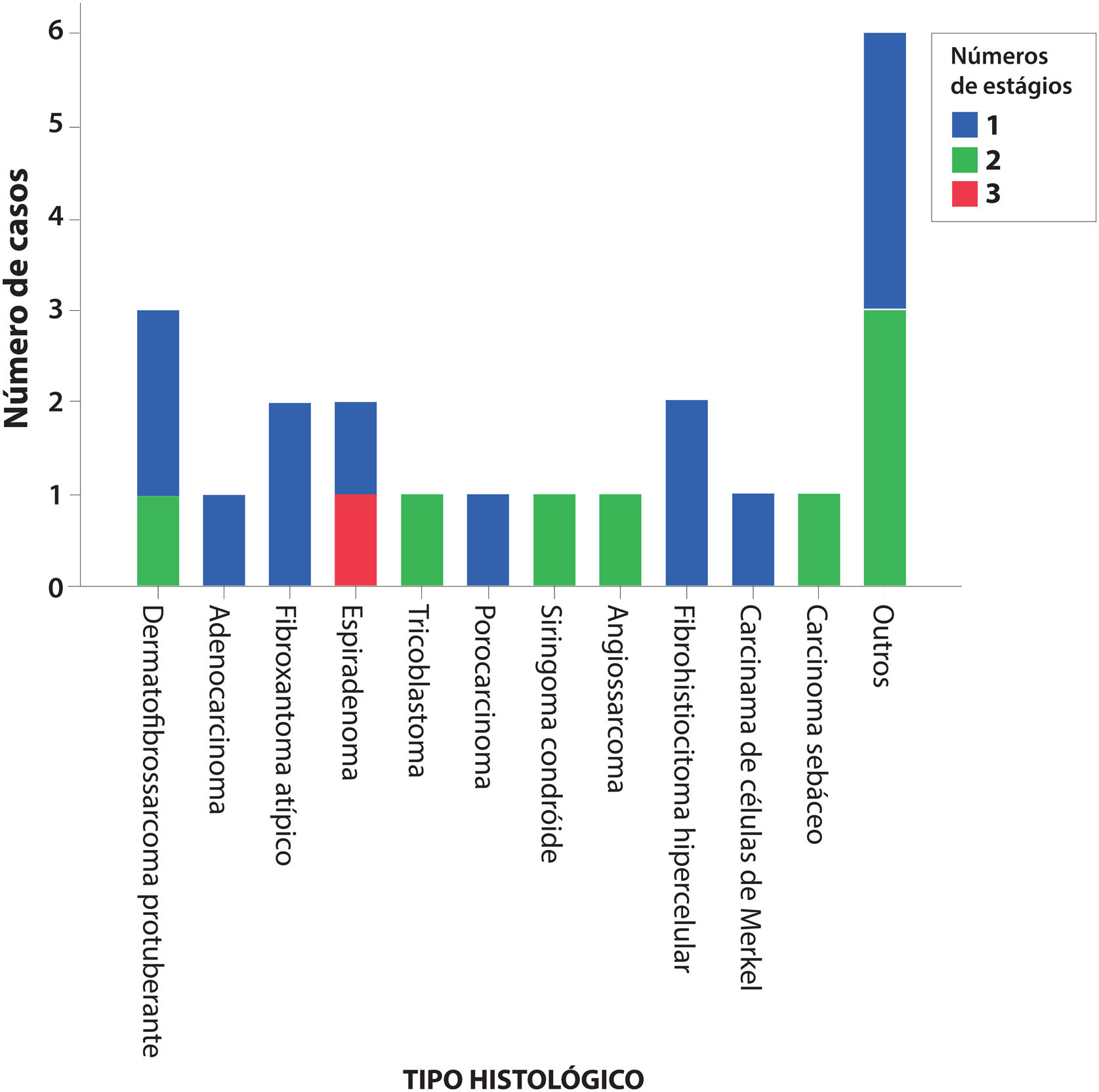
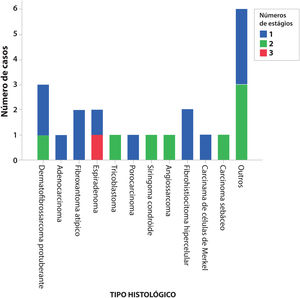
ResultadosDurante o período, 437 tumores foram tratados usando a cirurgia micrográfica de Mohs e 22 (5%) tumores cutâneos raros foram selecionados, sendo três dermatofibrossarcomas protuberantes, dois fibroxantomas atípicos, dois espiradenomas, dois fibro‐histiocitomas hipercelulares, um adenocarcinoma cutâneo primário, um tricoblastoma, um porocarcinoma, um siringoma condroide, um angiossarcoma cutâneo, um carcinoma de células de Merkel e um carcinoma sebáceo. Seis outros casos de variantes raras de carcinoma basocelular com diferenciação tricoepiteliomatosa, carcinoma basocelular metatípico e de carcinoma espinocelular de células claras foram incluídos. Não houve casos de recidiva, com média de seis anos de seguimento.
Limitações do estudoTrata‐se de estudo retrospectivo envolvendo neoplasias pouco frequentes em apenas um centro de referência além de disponibilidade relativa da técnica cirúrgica no serviço público.
ConclusãoEsta série de casos retrospectiva mostrou que a cirurgia micrográfica de Mohs é tratamento apropriado para os tumores cutâneos raros; corresponderam a 5% dos tumores tratados pela técnica, no período de 12 anos, e não houve recidivas.
O câncer de pele é o mais frequente no Brasil e corresponde a cerca de 30% de todos os tumores malignos registrados.1 Apresenta altos índices de cura, se detectado precocemente, mas pode resultar em significativa morbidade se não for corretamente diagnosticado e tratado, principalmente os tumores com tipos histológicos mais agressivos e infiltrativos.2,3
A cirurgia micrográfica de Mohs (CMM) é considerada, atualmente, o método mais eficaz para o tratamento de diversos tipos de câncer de pele.4 É caracterizada pela identificação da lesão, pelo mapeamento preciso de todas as etapas do processo e pela avaliação completa das margens tumorais. A relação entre a presença de neoplasia no exame histológico e sua correta localização no mapa cirúrgico é essencial para a ressecção completa da lesão e preservação de tecido sadio.4 A CMM oferece os maiores índices de cura para inúmeras neoplasias cutâneas mais frequentes, como carcinoma basocelular (CBC) e carcinoma espinocelular (CEC) em suas formas clássicas ou também nas raras formas mistas, incluindo‐se CBC com diferenciação anexial, CBC escamoso ou metatípico ou CEC de células claras. Há, ainda, outros tumores cutâneos pouco comuns, porém com alto risco de recidiva e que não apresentam critérios bem‐estabelecidos em relação ao tratamento, e que podem se beneficiar desta técnica.5–7
Os tumores cutâneos raros ou pouco comuns não apresentam definição exata; nesse grupo podem ser incluídas as neoplasias cutâneas benignas ou malignas de baixa prevalência que, além da raridade, também podem apresentar característica recidivante. Com a ausência de uniformidade dos casos reportados, a verdadeira incidência é desconhecida.7 Podem ser divididos, de acordo com a origem histológica, em alguns grupos, com alguns tumores principais. De maneira resumida, podem ser agrupados de acordo com a tabela 1.7–13
Neoplasias cutâneas raras divididas quanto à origem histológica e exemplos de cada grupo7–13
| Neoplasias cutâneas raras | ||
|---|---|---|
| Anexiais | Diferenciação folicular | Tricoblastoma |
| Tricoepitelioma | ||
| Carcinoma triquilemal | ||
| Diferenciação sebácea | Carcinoma sebáceo | |
| Diferenciação sudorípara | Espiradenoma | |
| Hidradenoma | ||
| Vasculares | Angiossarcoma, sarcoma de Kaposi | |
| Neurais e neuroendócrinas | Carcinoma de células de Merkel | |
| Fibro‐histiocíticas | Dermatofibroma e variantes atípica e celular | |
| Fibroxantoma atípico | ||
| Dermatofibrossarcoma protuberante | ||
| Musculares, adipocíticas e cartilaginosas | Leiomiossarcoma, condroma | |
Os tumores de origem anexial podem apresentar diferenciação folicular como o carcinoma triquilemal e o tricoblastoma, diferenciação sebácea como o carcinoma sebáceo ou diferenciação sudorípara como o carcinoma microcístico anexial (CMA) e o espiradenoma. O CMA é uma neoplasia maligna agressiva originária das glândulas sudoríparas com estroma denso ao redor dos blocos tumorais e extensa infiltração local.14 Há, também, os de origem vascular, como o angiossarcoma.10
O exemplo dos tumores de origem neuroendócrina é o carcinoma de células de Merkel (CCM), tumor cutâneo neuroendócrino agressivo com aumento da prevalência nos últimos anos, chegando a 0,7 casos a cada 100.000 habitantes nos EUA. Apresenta elevada taxa de metástase e mortalidade, com sobrevida em cinco anos de 62% nos estágios iniciais e de 13,5% nos estágios avançados.11,15–17
Também é reconhecido o grupo das neoplasias de origem fibro‐histiocítica que compreende neoplasias como o dermatofibrossarcoma protuberante (DFSP) e o fibroxantoma atípico (FXA).12 O DFSP é tumor maligno de crescimento lento e assimétrico com extensão subclínica imprevisível. Histologicamente, há infiltração difusa de células fusiformes, com padrão estoriforme. O DFSP apresenta taxas de incidência reportadas que variam de 0,8 a 5 por milhão de habitantes.18 Um estudo populacional de 1972 a 2002 mostrou 4,2 por milhão.19 O FXA é tumor fibro‐histiocítico de potencial maligno intermediário. Corresponde a cerca de 0,002% dos tumores cutâneos, de acordo com um estudo de 10 anos da Nova Zelândia.20
Há ainda os tumores de origem muscular, adipocítica ou cartilaginosa.13 Muitos desses tumores não apresentam estimativa de prevalência e incidência, em razão do pequeno número de casos, com estudos apenas com base em pequenos relatos.
O objetivo principal do tratamento é a cura oncológica, mas também se deve almejar a preservação da função e o máximo de tecido saudável, além de resultado cosmético satisfatório.21
Em relação aos tumores cutâneos menos prevalentes, os métodos não cirúrgicos são raramente indicados. Radioterapia e tratamentos sistêmicos envolvendo imunoterapia podem ser alternativas em pacientes com contraindicação ao procedimento cirúrgico.22 Além disso, em se tratando de tumores cutâneos raros com sua característica recidivante, métodos cirúrgicos nos quais não é possível a avaliação das margens cirúrgicas, como a eletrocoagulação e a criocirurgia, não são rotineiramente indicados.21,23
O método mais utilizado é a cirurgia convencional com margens amplas, caracterizada pela exérese tumoral e pelo fechamento da ferida operatória. A lesão visível é retirada com margem de segurança padronizada e variável, de acordo com o tipo e as características do tumor. A padronização das margens de segurança ocorre principalmente em CBC e CEC, porém não é bem‐estabelecida para os tumores menos prevalentes.5,6
A peça cirúrgica é enviada para avaliação anatomopatológica. O médico patologista, posteriormente, confirma o subtipo histológico e o comprometimento ou não das margens nos cortes avaliados. São realizados múltiplos cortes sequenciais na peça; no entanto, não são avaliadas 100% das margens, e sim por amostragem. Por esse motivo, pode ocorrer escape tumoral em margem não avaliada, resultando em falso negativo.24
A CMM é o método mais conhecido entre as opções de cirurgia micrográfica com controle intraoperatório total de margens (CMCITM). Todas as margens são avaliadas durante a realização da cirurgia, com cortes de congelação e reconstrução em um único tempo cirúrgico, diferente da cirurgia convencional e da congelação simples, que também é feita por amostragem.4–6,25
A CMCITM é a técnica mais eficaz no tratamento das neoplasias cutâneas. É realizada a remoção da massa tumoral delimitada clinicamente com margem mínima de segurança, que é variável de acordo com o tipo histológico do tumor. É necessário rigoroso mapeamento de todas as margens do fragmento obtido para que seja possível uma perfeita correlação com o defeito cirúrgico deixado no paciente. São realizadas marcações na peça, pontos de referência e orientação entre o tumor e a pele, além de coloração do fragmento com cores variadas. As cores são importantes para identificação e orientação das margens estudadas, além de localização espacial de eventual tumor encontrado nos fragmentos. O mapa pode ser realizado em papel ou de maneira digital, por meio de fotos e aplicativos de edição.4,25
As amostras são submetidas à congelação no criostato, e as lâminas confeccionadas são coradas pela Hematoxilina & eosina (H&E) e levadas ao microscópio óptico para avaliação pelo cirurgião micrográfico. Uma vez detectada a presença de neoplasia em algum dos fragmentos, a área acometida é identificada no mapa para, então, realizar‐se a ressecção direcionada do fragmento adicional, poupando‐se tecido são. A exérese tumoral encerra‐se quando todas as margens se encontram negativas para a neoplasia.4,25
Entre os diferentes métodos de CMCITM, existem a CMM clássica a 45 graus, CMM variante a 90 graus, utilizada no presente estudo, e a técnica de Munique, todos com taxas de cura semelhantes entre si.25 A escolha do método dependerá do treinamento e da experiência do profissional, sem repercussão para o paciente que se submeterá ao procedimento.
A CMM, mesmo amplamente reconhecida para tratamento de vários desses tumores, comuns e raros, com taxas superiores de cura, ainda é subutilizada. Idealmente, poderia ser considerada primeira escolha em tumores de alto risco, primários ou recidivados.26,27 No entanto, em decorrência da reduzida disponibilidade, do custo mais elevado de implantação e manutenção além da necessidade de profissionais especializados, com treinamento no método e oncologia cutânea em processo longo de formação, é principalmente indicada em tumores recidivados, após vários tratamentos prévios, o que diminui sua eficácia.
A maioria dos estudos publicados em CMM tem como tema o tratamento dos tumores epiteliais CBC e CEC, os tipos mais comuns desse grupo e que contam com critérios bem‐estabelecidos de indicação. Há, no entanto, indicação de tratamento cirúrgico para múltiplos outros tumores menos comuns.5,6,26–36
Os tumores cutâneos raros são comumente tratados pela técnica cirúrgica convencional com margens amplas, não havendo consenso em relação à padronização dessas margens. Apesar disso, excisões incompletas e recidivas ocorrem frequentemente.5,6,37–39
Flohil et al.5 relataram um estudo dos tumores raros tratados por meio da CMM em um centro universitário da Holanda. A revisão retrospectiva incluiu 80 tumores raros incluindo dermatofibrossarcoma protuberante (33%), fibroxantoma atípico (27,5%), CCM (11,25%), carcinoma anexial microcístico (10%), carcinoma sebáceo (7,5%), doença de Paget extramamária (2,5%), espiradenocarcinoma (1,25%), entre outros. Concluiu que a CMM é tratamento apropriado para os tumores raros com apenas dois casos de recidiva, ambos fibroxantomas atípicos.5
O DFSP é o tumor raro com maior número de relatos de tratamento por meio da CMM.26,29 A disseminação subclínica dessa neoplasia torna sua remoção completa difícil, com altas taxas de recidiva em séries de casos. Cernea et al.26 justificam a indicação da técnica da CMM para tratamento do DFSP nas diretrizes da Sociedade Brasileira de Dermatologia, com base nas evidências disponíveis que indicam menor taxa de recidiva. Ainda que seja o tumor raro com maior número de relatos, há carência de estudos de melhor qualidade, randomizados e controlados e com maior tempo de seguimento.
Esse tumor apresenta altos índices de recidivas, podendo chegar a 26% a 53% em algumas séries de casos.18,19,29 Uma revisão sistemática reuniu dados de DFSP tratados por CMM, de 1995 a 2011, incluindo 23 estudos não randomizados, dos quais quatro eram comparativos. A taxa de recidiva observada foi de 1,1% no grupo da CMM contra 6,3% no grupo da cirurgia convencional.29
Apesar de rotineiramente indicada para tumores malignos, a CMM pode, também, ser utilizada em caso de tumores benignos grandes, mal delimitados e com alto risco de recidiva. Como exemplo, há o tricoblastoma, um tumor de anexo raro, de crescimento lento e bem‐circunscrito e, ainda que benigno, existem relatos de casos de tricoblastomas com evolução mais agressiva.30,39 Embora raro, o risco de transformação maligna existe e deve ser levado em consideração na indicação do tratamento e na avaliação da CMM.30
Não foram encontrados estudos brasileiros reunindo diversos tipos histológicos de tumores cutâneos menos frequentes – apenas relatos de casos individuais ou séries de casos, como o DFSP, principal tumor raro associado à CMM.26,30
Relatos envolvendo o emprego da CMM no tratamento dos tumores cutâneos menos usuais são escassos, porém reportam menores taxas de recidiva,5,6,26–36 sendo necessários mais estudos na área.
Pacientes e métodosDesenho do estudoEstudo retrospectivo observacional incluindo todos os tumores cutâneos raros ou variantes menos comuns de CBC e CEC tratados utilizando a técnica da CMM variante 90 graus, pela Divisão de Dermatologia do Hospital de Clínicas da Unicamp, entre outubro de 2008 e abril de 2021.
Comitê de Ética em PesquisaO estudo foi aprovado pelo Comitê de Ética em Pesquisa da instituição sob número de parecer 3.113.179 com Termo de Consentimento Livre e Esclarecido (TCLE). O TCLE foi submetido para assinatura do paciente no momento da consulta de seguimento ambulatorial.
Coleta de dadosOs dados foram coletados por meio da revisão dos prontuários médicos e dos registros fotográficos dos procedimentos, incluídos em banco de dados específico da cirurgia micrográfica do serviço. Todos os pacientes eram maiores de 18 anos e provenientes do Ambulatório de Tumores Cutâneos do hospital. Após o procedimento, os participantes mantiveram seguimento clínico periódico, sendo possível a avaliação de recidiva tumoral.
Todos os pacientes tratados foram identificados e incluídos, no momento da cirurgia, em registro único, o que possibilitou a exatidão dos dados coletados. Nesse registro, foram incluídos dados dos pacientes como nome, número de registro hospitalar, data de nascimento, sexo, idade no momento da cirurgia, data do procedimento. Também foram registrados dados da neoplasia, como tipo histológico, se recidivado ou primário, além de detalhes do procedimento, como número de fases, número de fragmentos, reconstrução, mapa cirúrgico com documentação fotográfica e evolução clínica.
Critérios de inclusãoForam incluídos todos os pacientes maiores de 18 anos, com diagnóstico histológico confirmado de neoplasia cutânea rara ou variantes menos prevalentes de CBC e CEC submetidos a tratamento cirúrgico por meio da CMM no período de outubro de 2008 a abril de 2021. As variantes menos prevalentes de CBC e CEC que poderiam ser incluídas eram: CBC com diferenciação anexial ou tricoepiteliomatosa, CBC metatípico ou carcinoma basoescamoso, CEC de células claras ou CEC acantolítico. O procedimento foi realizado por dermatologistas especializados em cirurgia micrográfica e certificados pela Sociedade Brasileira de Dermatologia e seguiu os critérios estabelecidos pelo Comitê de Ética em Pesquisa.
Exames histopatológicos e técnica cirúrgicaTodos os pacientes foram tratados pela técnica de CMM variante a 90 graus, caracterizada pela separação do fragmento em margens laterais e profundas com corte a 90 graus, posterior congelação ao criostato com cortes de 5 micra de espessura. As lâminas confeccionadas foram coradas com H&E e, após, avaliadas pelos cirurgiões micrográficos.4,25 Como tratava‐se de tumores raros, as lâminas também foram avaliadas por dermatopatologista da equipe. Após a seleção dos pacientes, as lâminas confeccionadas durante os respectivos procedimentos foram recuperadas para registro fotográfico da pesquisa.
Análise dos resultadosElaborou‐se a análise descritiva dos tumores raros, descrição da técnica segundo o número de fases, evolução livre de doença e casos de recidiva. A análise estatística apenas descritiva foi realizada com uso do programa SPSS Statistics 20 para Windows.
ResultadosDurante o período de outubro de 2008 a abril de 2021, 437 tumores foram operados pela técnica da CMM e 22 (5%) casos foram selecionados por serem considerados raros ou variantes raras de CBC e CEC. Os outros 95% correspondiam a subtipos comuns de CBC e CEC, além de um caso de lentigo maligno.
Em relação ao gênero, 12 (54,5%) pacientes eram do sexo feminino e 10 (45,5%) do sexo masculino. Em relação à localização das lesões, 15 (68,2%) eram localizadas na cabeça e pescoço, quatro (18,2%) no tronco e três (13,6%) nas extremidades.
No total, 22 pacientes, com um tumor cutâneo raro cada, foram tratados completamente com CMM. Os tumores eram três dermatofibrossarcomas protuberantes, dois fibroxantomas atípicos, dois espiradenomas, dois fibro‐histiocitoma hipercelulares atípicos, um adenocarcinoma cutâneo primário, um tricoblastoma, um porocarcinoma, um siringoma condroide, um angiossarcoma cutâneo, um carcinoma de células de Merkel e um carcinoma sebáceo. Seis outros casos de variantes raras de carcinoma basocelular e de carcinoma espinocelular incluíram quatro CBC com diferenciação folicular tricoepiteliomatosa, um CBC metatípico e um CEC de células claras.
A idade média dos pacientes no momento da CMM foi de 54 anos. Os pacientes mais jovens tinham 25 anos e o mais velho, 84 anos. Sete pacientes apresentavam menos de 50 anos de idade (três dermatofibrossarcomas protuberantes, dois fibro‐histiocitoma hipercelulares, um adenocarcinoma e um fibroxantoma atípico).
Não houve casos de recidiva durante o seguimento médio de 72 meses. Nenhum caso foi excluído por tempo mínimo de seguimento, justificando casos com tempos diferentes de acompanhamento clínico descritos na tabela 2. Como todos os pacientes mantiveram seguimento clínico, foi possível que todos fossem avaliados por dermatologista no momento da coleta dos dados para identificar possível recidiva tumoral.
Características dos pacientes, tumores e do procedimento cirúrgico
| Pacientes e características do tumor | Total | DFSP | FXA | ESP | FH | AdeCa | TRB | PoCa | SirCo | ANS | CCM | CS | Outrosa |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Número total de tumores | 22 | 3 | 2 | 2 | 2 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 6 |
| Gênero | |||||||||||||
| Masculino | 10 (45,5%) | 0 | 2 | 0 | 1 | 0 | 0 | 1 | 1 | 1 | 0 | 1 | 3 |
| Feminino | 12 (54,5%) | 3 | 0 | 2 | 1 | 1 | 1 | 0 | 0 | 0 | 1 | 0 | 3 |
| Idade média na CMM | 54,7 | 35,3 | 64,5 | 57 | 27 | 29 | 66 | 71 | 62 | 73 | 50 | 79 | 61,77 |
| Número de estágios | |||||||||||||
| 1 | 13 (59,1%) | 2 | 2 | 1 | 2 | 1 | 0 | 1 | 0 | 0 | 1 | 0 | 3 |
| 2 | 8 (36,4%) | 1 | 0 | 0 | 0 | 0 | 1 | 0 | 1 | 1 | 0 | 1 | 3 |
| 3 | 1 (4,5%) | 0 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Número médio de fragmentos | 6,9 | 9 | 7,5 | 11 | 4 | 5 | 8 | 4 | 6 | 9 | 5 | 6 | 6,17 |
| Seguimento médio em meses | 72,24 | 84,7 | 58,5 | 60,5 | 102 | 98 | 120 | 41 | 32 | 27 | 17 | 6 | 81 |
| Recidiva | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Localização do tumor | |||||||||||||
| Cabeça e pescoço | 15 (68,2%) | 0 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 0 | 1 | 6 |
| Tronco | 4 (18,2%) | 3 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Extremidades | 3 (13,6%) | 0 | 0 | 1 | 1 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 0 |
| Tratamento prévio | |||||||||||||
| Nenhum | 9 (40,9%) | 0 | 0 | 0 | 1 | 0 | 0 | 1 | 1 | 1 | 1 | 1 | 3 |
| Excisão incompleta | 13 (59,1%) | 3 | 2 | 2 | 1 | 1 | 1 | 0 | 0 | 0 | 0 | 0 | 3 |
| Reconstrução | |||||||||||||
| Complexa | 14 (63,6%) | 0 | 1 | 1 | 1 | 0 | 1 | 1 | 1 | 1 | 1 | 1 | 5 |
| Não complexa | 8 (36,4%) | 3 | 1 | 1 | 1 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 1 |
DFSP, dermatofibrossarcoma protuberante; FH, fibro‐histiocitoma hipercelular; ESP, espiradenoma; TRB, tricoblastoma; AdeCa, adenocarcinoma, SirCo, siringoma condroide; PoCa, porocarcinoma; CCM, carcinoma de células de Merkel; ANS, angiossarcoma; CS, carcinoma sebáceo; FXA, fibroxantoma atípico.
Os três casos com menos tempo de seguimento são um angiossarcoma cutâneo (27 meses), um CCM (17 meses) e um carcinoma sebáceo (6 meses), porém todos estão em acompanhamento rigoroso de suas neoplasias com exclusão de doença a distância e foram incluídos com o objetivo de enfatizar a aplicabilidade da técnica cirúrgica para esse grupo de tumores.
Entre os casos selecionados, 13 (59,1%) deles já haviam sido submetidos à cirurgia convencional prévia, porém, em decorrência da excisão incompleta das margens, foram indicados para tratamento pela CMM.
A figura 1 mostra o número necessário de estágios da CMM para completa excisão tumoral. O único caso que precisou de três estágios foi um espiradenoma recidivado.
Em 14 (63,6%) casos, os pacientes necessitaram de reconstrução complexa após o procedimento, envolvendo enxertos ou retalhos, e em oito (36,4%) houve possibilidade de reconstrução não complexa, por fechamento primário ou segunda intenção. Na tabela 2, há a descrição dos 22 casos tratados, resumindo os dados encontrados.
DiscussãoEsta série de casos retrospectiva mostra que a CMM é tratamento apropriado para tumores cutâneos raros. Em oposição ao CBC e ao CEC, que têm indicações claras para a realização da CMM ao classificar‐se as lesões em alto e baixo risco, as neoplasias menos prevalentes ainda não contam com critérios bem‐estabelecidos. Pode ser indicada para lesões primárias ou recidivadas, mal delimitadas, localizadas em regiões anatômicas com necessidade de poupar tecido sadio ou com característica de elevada recidiva, como o DFSP.5,6 Em relação aos tumores cutâneos raros benignos, estaria indicada em lesões recidivadas, grandes, mal delimitadas ou com risco de transformação maligna.5,6
Com o benefício de avaliação completa das margens tumorais, a CMM proporciona menores taxas de recidiva também para esse grupo de tumores e cada caso precisa ser avaliado individualmente.5–8,26–36
As neoplasias cutâneas menos prevalentes corresponderam a cerca de 5% de todos os tumores tratados no serviço pela CMM no período de 12 anos. Não houve casos de recidiva, com média de seis anos de seguimento; a maioria dos casos (59,1%) correspondia a tumores com excisão incompleta prévia e, portanto, maior risco de recidiva.
Observa‐se, ainda, que, apesar de não ter sido selecionado por não se tratar de tumor cutâneo raro, o caso de lentigo maligno realizado por meio de CMM com imuno‐histoquímica intraoperatória reforça as possibilidades de expansão da técnica.34 A imuno‐histoquímica, apesar de pouco disponível, com custo elevado e aumento no tempo cirúrgico, pode trazer benefícios na avaliação de muitos desses tumores durante a CMM.34
Há dificuldade na definição de tumor raro e determinação de dados de incidência e prevalência, em razão do pequeno número de casos de alguns deles. Diversos outros tumores já apresentaram relatos de tratamento pela CMM e não foram encontrados nesta casuística – por exemplo, carcinoma anexial microcístico e doença de Paget extramamária.
Apesar de o estudo ter sido realizado em um serviço terciário, referência para oncologia cutânea e cirurgia de alta complexidade, com elevada demanda, a realização da CMM é limitada pela oferta da técnica. Nota‐se, ainda, que há dificuldade na realização de estudos prospectivos e randomizados em um único centro de pesquisa, envolvendo neoplasias menos frequentes.5,6
Neste trabalho não houve casos de recidiva local ou a distância em média de seis anos de seguimento, o que está de acordo com outros dados da literatura.5,6 Um centro universitário na Holanda relatou uma série de casos retrospectiva de tumores raros tratados pela CMM. Foram incluídos 80 tumores e concluiu‐se que a CMM é um tratamento apropriado para esse grupo de tumores, com apenas dois casos de recidiva.5
Em relação à localização das lesões nesta casuística, 68,2% dos tumores eram localizados na região de cabeça e pescoço, o que pode ser explicado pelos critérios de indicação da CMM e não por maior prevalência desses tumores nesse local. Trata‐se de região de maior risco para recidiva e onde há também necessidade de poupar tecido sadio. Nessa topografia anatômica, a segurança da avaliação completa das margens tumorais anterior à reconstrução do defeito cirúrgico também é um dos critérios para escolha do método. Uma exceção é o DFSP, neoplasia com maior prevalência no tronco e membros.18,19
O DFSP é o tumor raro com maior número de estudos com CMM.26,29,32 Em 58 casos de DFSP, foi calculada a extensão de invasão do tumor por meio do estudo das margens por cortes de congelação utilizados na CMM e observou‐se que 15,5% dos tumores teriam sido excisados incompletamente se fosse utilizada a margem cirúrgica de 3cm.35 Um estudo retrospectivo canadense com 48 casos de DFSP primários, 28 tratados por cirurgia convencional e 20 por CMM, encontrou 21,4% de margens positivas no primeiro grupo.32
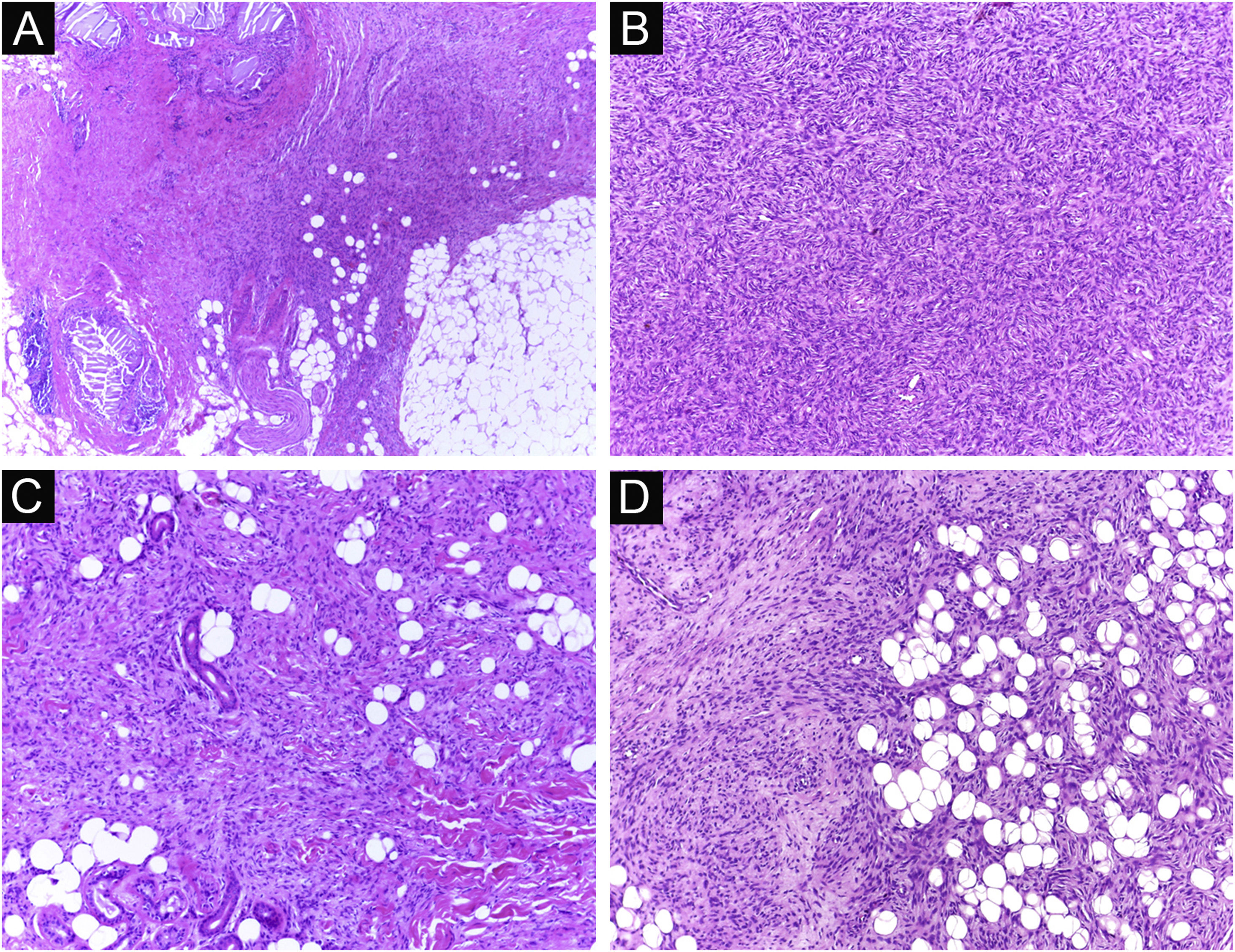
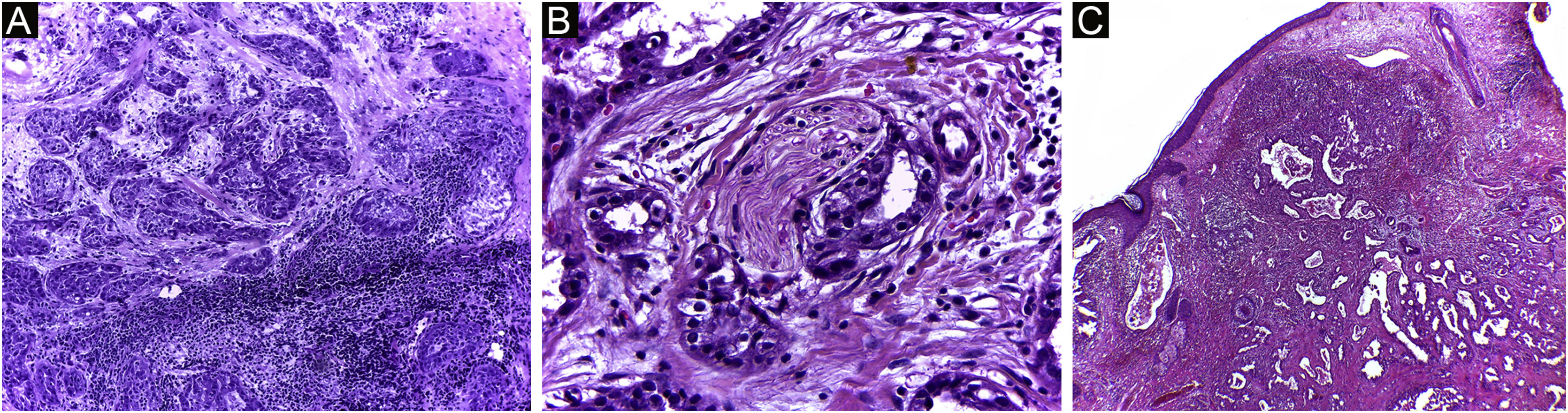
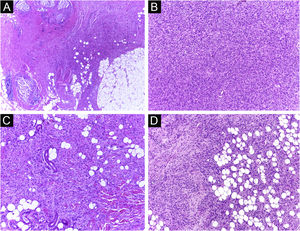
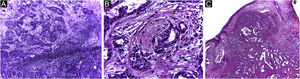
É relatado que o DFSP está associado com mais estágios e grandes defeitos, pois não há consenso em relação à margem inicial, que é maior comparando‐se com outros tumores, frequentemente iniciando‐se em 1cm. Ainda assim, a margem menor do que a de 3cm utilizada frequentemente na cirurgia convencional. Na observação deste estudo, foram tratados três casos por meio da CMM, excisados incompletamente na primeira abordagem, dos quais dois deles com margens negativas em apenas um estágio. Ambos os casos foram submetidos à CMM logo após a identificação de margens comprometidas na cirurgia convencional; no entanto, ainda apresentaram tumor residual. A indicação rápida do procedimento pode justificar a obtenção de margens livres já no primeiro estágio, com menor extensão subclínica da lesão residual. Os dois casos têm 138 e 110 meses de seguimento cada, sem sinais de recidiva. O longo tempo de seguimento sem evidência de doença clínica reforça a adequada indicação da técnica cirúrgica. A figura 2 exemplifica as características histológicas do DFSP, com infiltração tumoral profunda e assimétrica, que corroboram a indicação da CMM.
Dermatofibrossarcoma protuberante (parafina, H&E). (A) Neoplasia recidivada invadindo a hipoderme à direita da imagem e, à esquerda, área de fibrose cicatricial com reação a corpo estranho, secundários à cirurgia convencional prévia. (B) Área sólida de padrão estoriforme. (C e D) Periferia infiltrativa da neoplasia, com fascículos de células fusiformes monomórficas invadindo tecido fibroconjuntivo à esquerda, e tecido adiposo em ambas. Fonte: Arquivos Dermatologia/Anatomia patológica HC‐Unicamp.
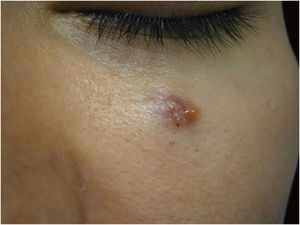
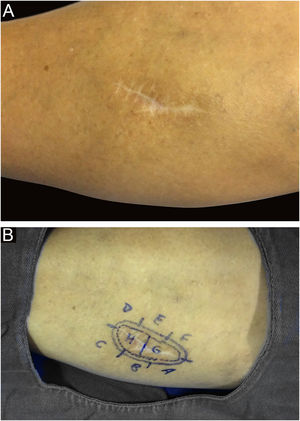
Entre outros exemplos, apresenta‐se o tricoblastoma, um tumor de anexo cutâneo raro, de crescimento lento. Nesta casuística, houve um caso de tricoblastoma recidivado em uma paciente de 66 anos (fig. 3). Obtiveram‐se margens negativas em dois estágios e sem sinais de recidiva em 10 anos de seguimento. Ainda que benigno, existem relatos de casos de evolução mais agressiva, principalmente em tumores extensos, recidivados, de longo tempo de evolução.30,39
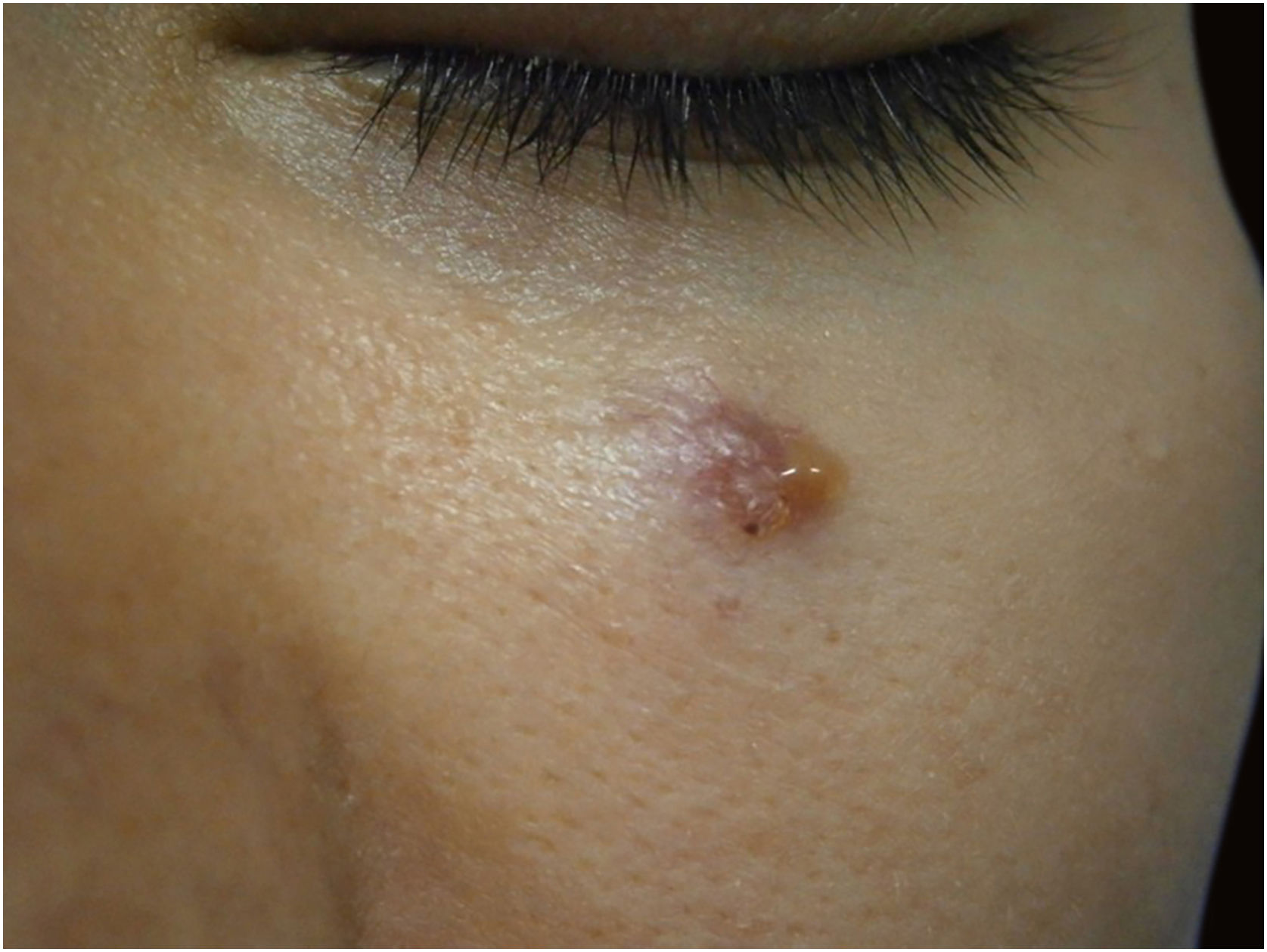
Nesta casuística, também foi incluído um caso de adenocarcinoma primário cutâneo, diagnosticado após realização de múltiplos recortes de parafina e painel amplo de imuno‐histoquímica, além de investigação extensa e multidisciplinar para exclusão de outro possível sítio primário que não o cutâneo. Existem poucos relatos de tumores do tipo adenocarcinoma tratados pela CMM.35
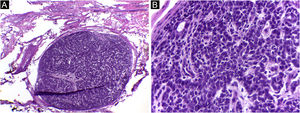
Neste relato, a dificuldade de diagnóstico inicial definitivo da lesão, em virtude de as características clínicas não serem específicas, associada às alterações no exame anatomopatológico e na imuno‐histoquímica que levaram à necessidade de afastar um tumor primário causando metástase cutânea (figs. 4 e 5). Após a conclusão diagnóstica de que se tratava de adenocarcinoma cutâneo primário, a opção terapêutica através da CMM reforçou a importância dessa técnica cirúrgica. A paciente está em seguimento clínico há oito anos, sem recidiva da lesão cutânea e sem evidência de outro sítio primário.
Adenocarcinoma primário cutâneo (H&E). (A) Cortes de 5 micra de espessura em congelação, exibindo estruturas glandulares infiltrando a derme reticular, associada a inflamação crônica. (B) Em parafina, exibindo infiltração neoplásica perineural. (C) Em parafina, panorâmica exibindo tumor mal circunscrito, constituído por estruturas glandulares irregulares invadindo a derme. Fonte: Arquivos Dermatologia/Anatomia patológica HC‐Unicamp.
Ressalta‐se, ainda, que o caso com maior número de estágios e fragmentos foi o de um espiradenoma recidivado. Descrito em 1956 por Kersting e Helwig, o espiradenoma é uma neoplasia benigna rara de glândulas sudoríparas, indiferenciada ou pouco diferenciada. Há risco de transformação maligna, principalmente nas lesões maiores e mais antigas.38 O tratamento de escolha é cirúrgico, porém não há recomendação clara de margens. Pouco se sabe sobre o comportamento desses tumores, uma vez que são raros, com poucos casos publicados. A CMM deve ser considerada em espiradenomas recidivados, grandes ou em locais críticos para garantir a excisão completa e poupar tecido.
Nesse caso tratava‐se de lesão com margens comprometidas na primeira abordagem, crescimento rápido em poucos meses e dolorosa. Por esse motivo foi indicada a CMM, e o fato de necessitar de três estágios para obtenção de margens negativas corroborou a indicação, comprovando que a lesão teria sido incompletamente removida pela técnica convencional33,37,38 (figs. 6 e 7).
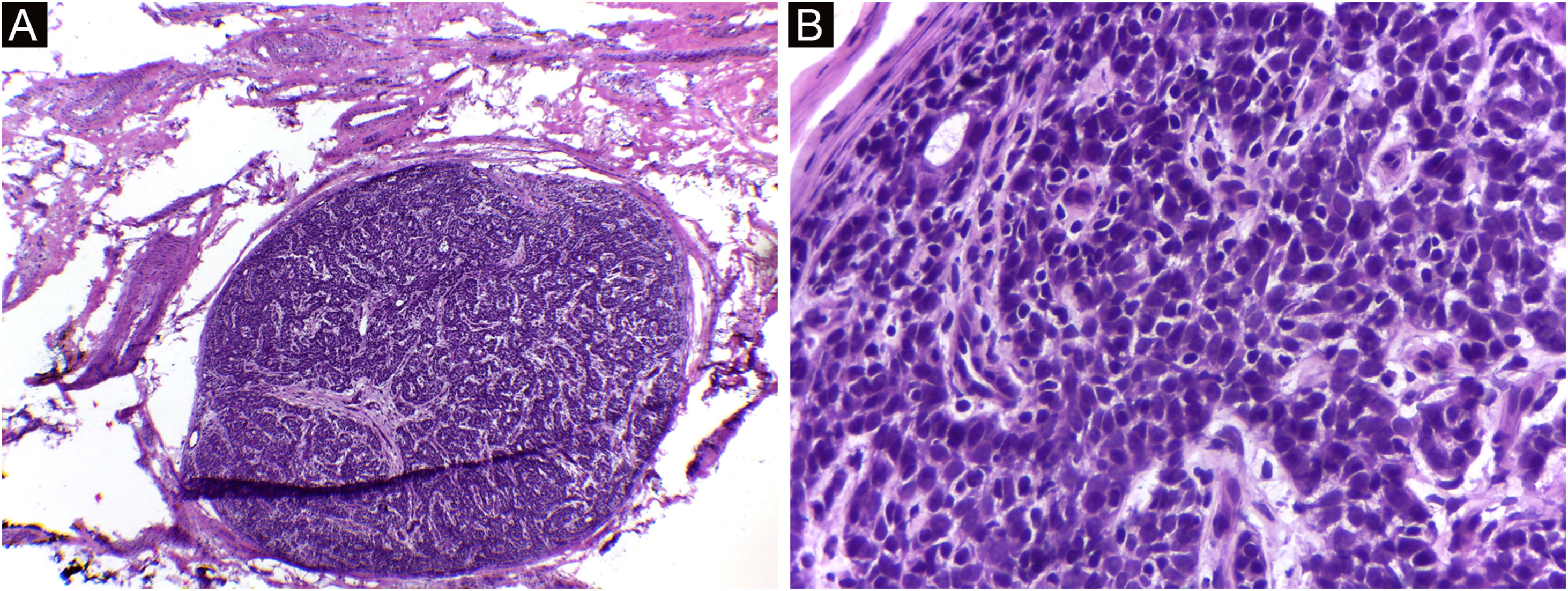
Espiradenoma (cortes de 5 micra de espessura em congelação corados com H&E). (A) Padrão multinodular, com nódulos circunscritos relativamente grandes posicionados dentro da derme e subcutâneo. (B) As células basaloides são de dois tipos. Na periferia, são pequenas com núcleo hipercrômico, e no centro ou em torno de pequenos lumens, são maiores com núcleo pálido. Fonte: Arquivos Dermatologia/Anatomia patológica HC‐Unicamp.
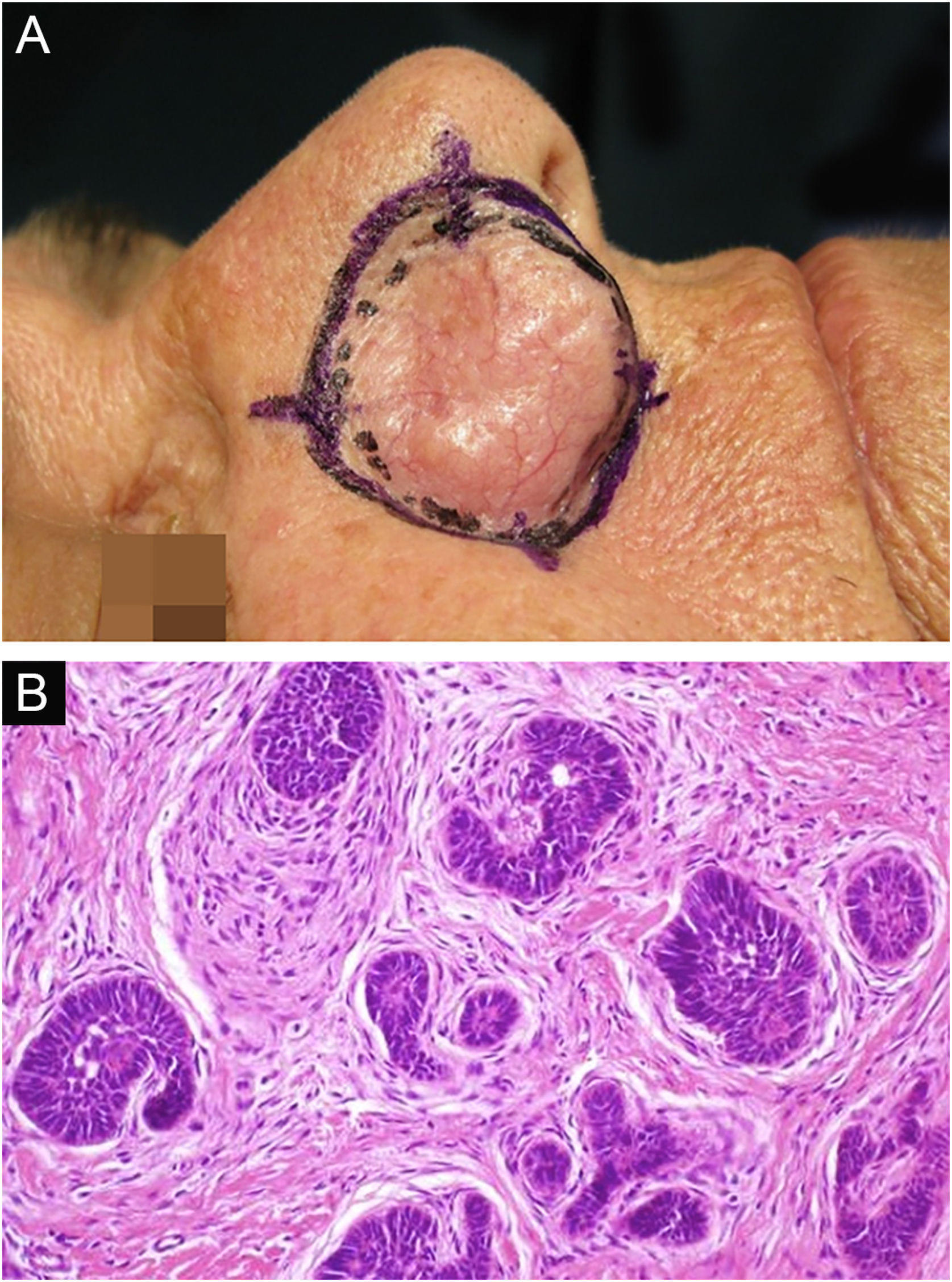
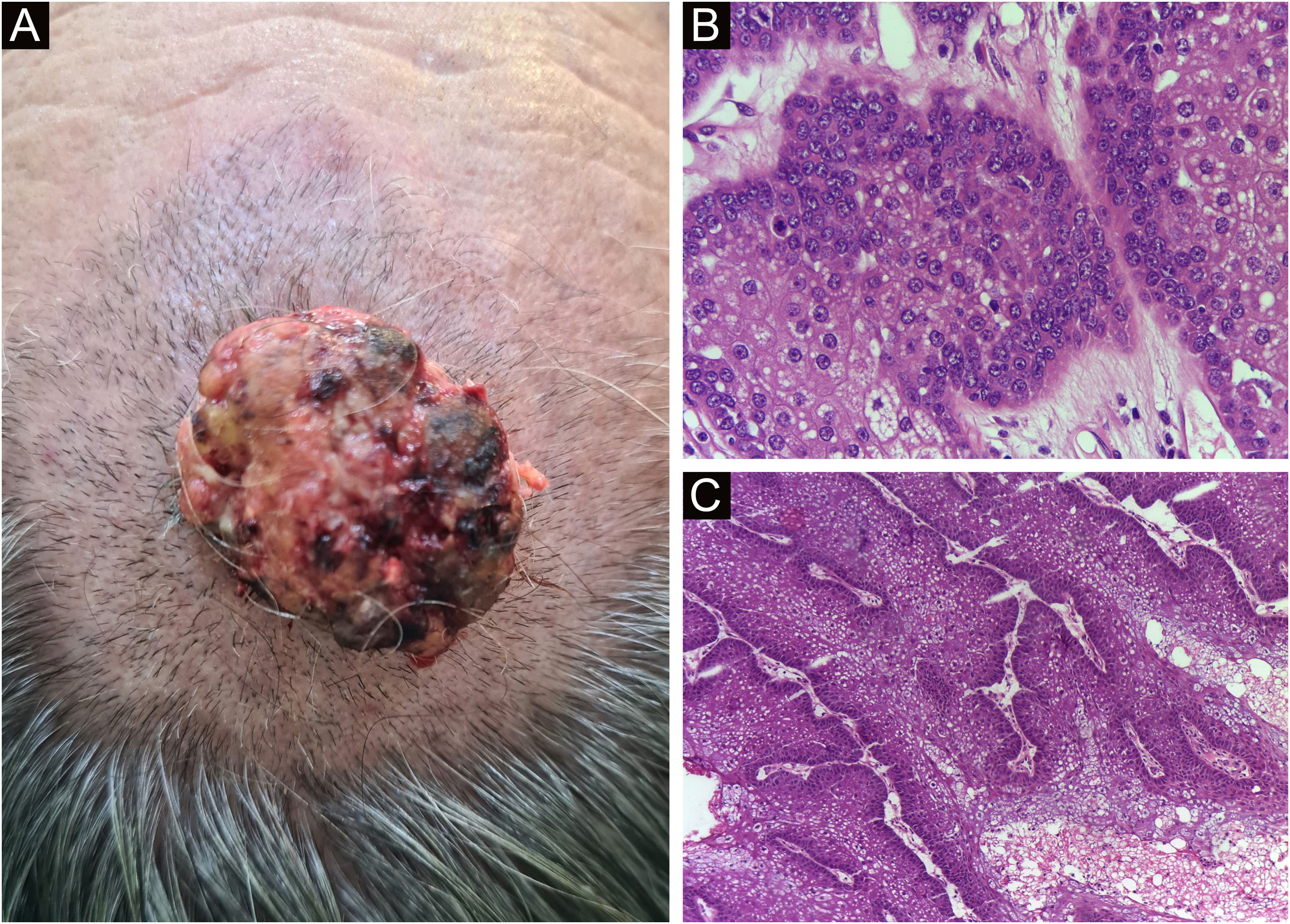
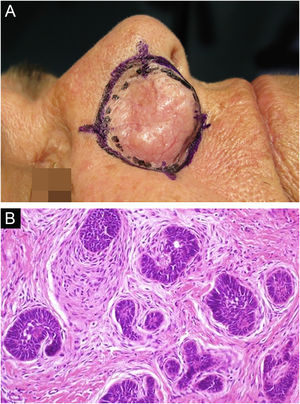
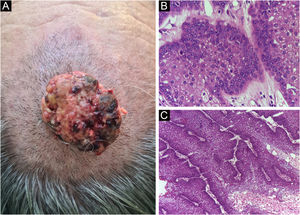
Por fim, ressalta‐se a inclusão de um caso de carcinoma sebáceo no couro cabeludo (fig. 8). Trata‐se de tumor anexial raro, com sua maioria localizada na região periocular, caracterizado por ser tumor de crescimento rápido, muitas vezes subdiagnosticado, com risco de metástase a distância além de associação com outras neoplasias viscerais e cutâneas relacionadas à síndrome de Muir Torre. Um estudo chinês reuniu 360 casos localizados nas pálpebras, e em apenas 62,5% deles o carcinoma sebáceo era a hipótese clínica inicial. Cerca de 20% incluíam hipóteses de lesões benignas como calázio, blefarite e nevo. A CMM foi a técnica de escolha para o tratamento de 31,9% desses casos e demonstrou melhor controle de recidiva local, com taxa de cura em cinco anos de cerca de 90%, comparando‐se com a cirurgia convencional, cuja taxa de cura varia de 60% a 80%.40
(A) Carcinoma sebáceo extraocular. (B) Lóbulos pouco definidos de células basaloides e células sebáceas pouco desenvolvidas (corte de parafina, H&E). Atipia moderada. (C) Debulking tumoral durante cirurgia micrográfica de Mohs (corte de congelação de 5 micra de espessura, H&E). Fonte: Arquivos Dermatologia/HC‐Unicamp.
Atualmente, o tratamento cirúrgico é o padrão‐ouro para todos os tumores cutâneos com algumas indicações de tratamento não cirúrgico para lesões superficiais e menos agressivas, como o CBC superficial, ou em pacientes com contraindicações ao procedimento.
Em relação aos tumores raros, em decorrência da ausência de critérios bem‐estabelecidos de tratamento e dados de literatura suficientes, o uso de técnicas não cirúrgicas para as lesões iniciais é raramente indicado. Em virtude de sua característica redicivante, sendo excisados incompletamente pela cirurgia convencional com margens amplas, a indicação da CMM é suportada pelos dados da literatura e deve‐se considerar a ampliação do método.5,6,26–36
ConclusãoEsta série retrospectiva de casos mostra que a CMM é técnica apropriada para o tratamento dos tumores cutâneos raros. Em relação à frequência, corresponderam a cerca de 5% de todos os casos tratados pela CMM no período de 12 anos. Não foram observadas recidivas no período estudado.
Com o benefício da avaliação completa das margens tumorais associada a menores taxas de recidiva relatadas na literatura, deve‐se considerar a possibilidade de estender‐se a aplicação do método, o que poderá ampliar os melhores resultados.
Suporte financeiroO presente trabalho foi realizado com apoio do Funadersp, Fundo de Apoio à Dermatologia de São Paulo – Sebastião Sampaio, projeto 86‐2019.
Contribuição dos autoresThais Helena Buffo: Análise estatística; aprovação da versão final do manuscrito; concepção e planejamento do estudo; elaboração e redação do manuscrito; obtenção, análise e interpretação dos dados; participação intelectual em conduta propedêutica e/ou terapêutica de casos estudados; revisão crítica da literatura; revisão crítica do manuscrito.
Rafael Fantelli Stelini: Aprovação da versão final do manuscrito; elaboração e redação do manuscrito; obtenção, análise e interpretação dos dados; participação efetiva na orientação da pesquisa; participação intelectual em conduta propedêutica e/ou terapêutica de casos estudados; revisão crítica do manuscrito.
Juliana Yumi Massuda Serrano: Análise estatística; aprovação da versão final do manuscrito; concepção e planejamento do estudo; participação intelectual em conduta propedêutica e/ou terapêutica de casos estudados; revisão crítica do manuscrito.
Luciana Takata Pontes: Aprovação da versão final do manuscrito; concepção e planejamento do estudo; obtenção, análise e interpretação dos dados; participação intelectual em conduta propedêutica e/ou terapêutica de casos estudados; revisão crítica do manuscrito.
Renata Ferreira Magalhães: Aprovação da versão final do manuscrito; concepção e planejamento do estudo; participação efetiva na orientação da pesquisa; participação intelectual em conduta propedêutica e/ou terapêutica de casos estudados; revisão crítica do manuscrito.
Aparecida Machado de Moraes: Aprovação da versão final do manuscrito; concepção e planejamento do estudo; obtenção, análise e interpretação dos dados; participação efetiva na orientação da pesquisa; participação intelectual em conduta propedêutica e/ou terapêutica de casos estudados; revisão crítica da literatura; revisão crítica do manuscrito.
Conflito de interessesNenhum.
Os autores agradecem à Funadersp pelo apoio financeiro, número de fomento 86‐2019.
Como citar este artigo: Buffo TH, Stelini RF, Serrano JYM, Pontes LT, Magalhães RF, Moraes AM. Mohs micrographic surgery in rare cutaneous tumors: a retrospective study at a Brazilian tertiary university hospital. An Bras Dermatol. 2023;98:36–46.
Trabalho realizado no Hospital de Clínicas, Universidade Estadual de Campinas, Campinas, SP, Brasil.