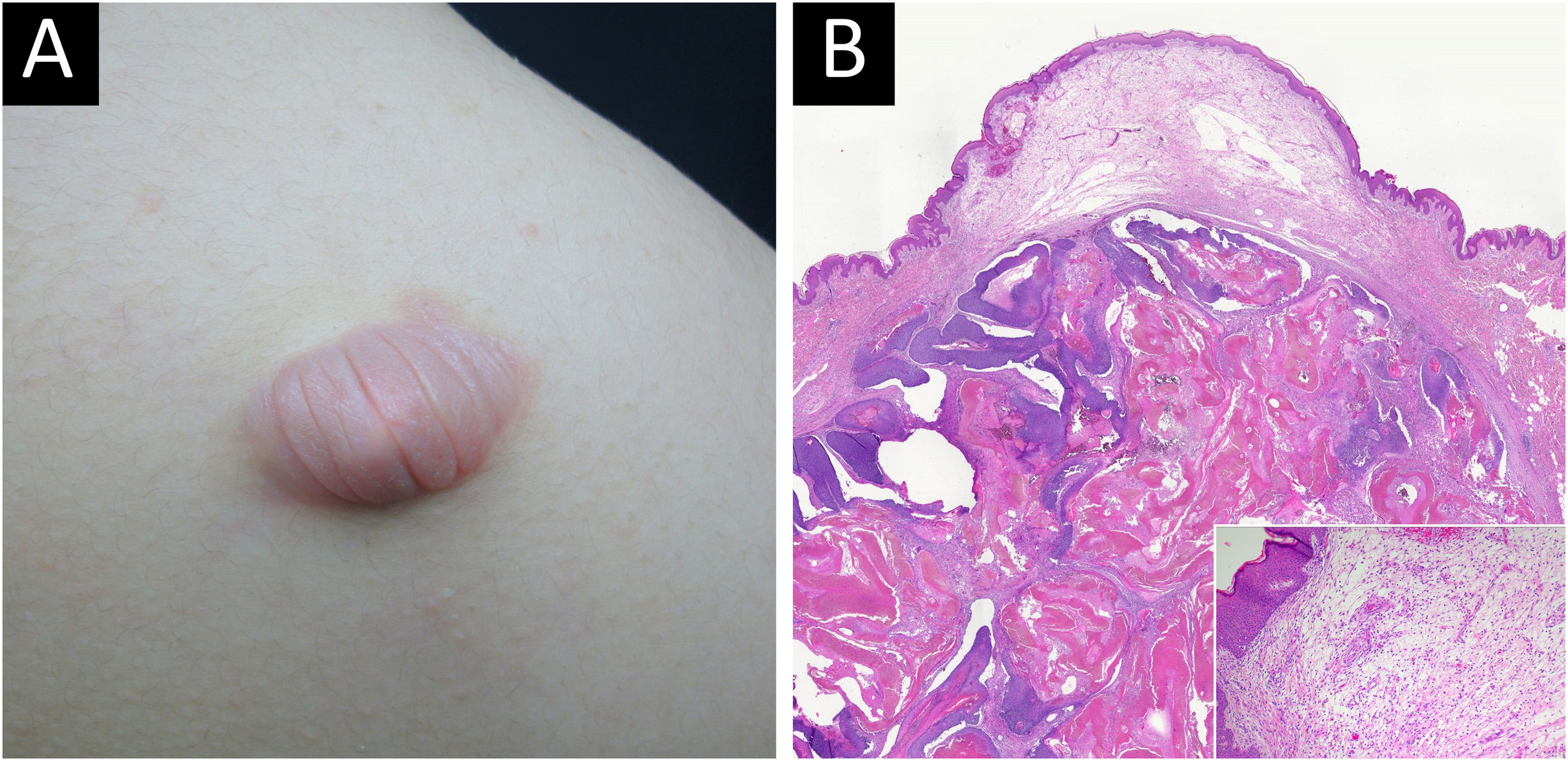
O pilomatrixoma bolhoso é variante rara do pilomatrixoma. Por ter sido publicado na forma de relatos de casos esporádicos, a compreensão limitada de suas características clinicopatológicas restringe seu diagnóstico e tratamento eficazes.
ObjetivosEste estudo teve como objetivo analisar as características clinicopatológicas e imuno‐histoquímicas do pilomatrixoma bolhoso para melhor compreender sua transformação bolhosa.
MétodosFoi realizado um estudo retrospectivo de 12 pacientes com pilomatrixoma bolhoso e comparados seus dados clínicos, histopatológicos e imuno‐histoquímicos com os de pacientes com a forma comum.
ResultadosO pilomatrixoma bolhoso não apresentou preferência de gênero, com idade média de início de 31,2 anos. Os locais comuns foram as extremidades superiores e o tronco. O pilomatrixoma bolhoso apresentou menor duração da doença, maior diâmetro e maior tendência de aumento de tamanho do que o pilomatrixoma comum. Na histopatologia, o pilomatrixoma bolhoso apresentava um estágio cronológico mais precoce, menos calcificação, mais figuras de mitose e características dérmicas distintas em comparação com a forma comum. Na imuno‐histoquímica, a expressão de metaloproteinase de matriz (MMP)‐2, MMP‐9, receptor do fator de crescimento do endotélio vascular‐3 (VEGFR‐3) e VEGF‐C estava elevada.
Limitações do estudoO estudo foi retrospectivo e o tamanho da amostra foi pequeno.
ConclusãoAs características distintas do pilomatrixoma bolhoso resultam potencialmente de alterações dérmicas associadas à liberação de fatores angiogênicos e enzimas proteolíticas. Esta análise abrangente fornece novas informações sobre as características clínicas e a patogênese do pilomatrixoma bolhoso.
O pilomatrixoma, também conhecido como epitelioma calcificante de Malherbe, é neoplasia benigna originada de células da matriz do pelo.1–3 Apresenta‐se como nódulo solitário, firme e profundo, com pele normal sobrejacente. O pilomatrixoma bolhoso é variante morfológica raramente relatada, caracterizada pelo tumor ser recoberto por pele macia, muito pregueada, assemelhando estrias, ou com formação de pseudobolha.4–9 Na histopatologia foram relatadas fibras colágenas dérmicas rompidas, dilatação dos vasos linfáticos dérmicos e linfederma em casos de pilomatrixoma bolhoso.9,10 Até o momento, apenas alguns casos esporádicos de pilomatrixoma bolhoso foram publicados como relatos de caso, com revisão da literatura.5–9,11–19 A compreensão limitada das características clínicopatológicas dificulta o diagnóstico clínico e o tratamento adequados.
Diversas teorias foram propostas para explicar a origem do pilomatrixoma do tipo bolhoso. Foram implicados como fatores desencadeantes: irritação mecânica; obstrução dos vasos linfáticos e congestão do fluido linfático causada pela pressão do núcleo do pilomatrixoma; e liberação de enzimas elastolíticas pelas células tumorais ou infiltração de células inflamatórias que induzem a ruptura das fibras de colágeno e dilatação dos vasos linfáticos.7–9 O objetivo deste estudo foi identificar novas características, incluindo histórico de trauma, tamanho do nódulo tumoral, duração da doença e fatores angiogênicos/linfangiogênicos ou enzimas proteolíticas no pilomatrixoma bolhoso.
Foram avaliadas as características clinicopatológicas e imuno‐histoquímicas de 12 pacientes com pilomatrixoma bolhoso e também o desenvolvimento da morfologia bolhosa. Este é o primeiro estudo abrangente a analisar casos de pilomatrixoma bolhoso diagnosticados em um único centro na República da Coreia.
MétodosPacientesUm total de 12 pacientes com diagnóstico de pilomatrixoma bolhoso foi estudado retrospectivamente no Jeonbuk National University Hospital entre janeiro de 2009 e maio de 2018. Este estudo foi aprovado pelo Conselho de Ética institucional. O consentimento informado foi obtido de todos os pacientes.
Achados clínicosForam coletados os seguintes dados demográficos e clínicos: idade, gênero, localização, duração, impressão clínica, histórico de trauma, tamanho e alteração no tamanho.
Achados histopatológicosAs biopsias dos tumores foram fixadas em formol a 10% e emblocadas em parafina. Em seguida, cortes de 4μm de espessura foram corados com hematoxilina & eosina (H&E), elástica (Roche, Basel, Suíça) e elástica‐van Gieson (EVG, Muto, Tóquio, Japão). Dois dermatopatologistas avaliaram os seguintes dados histopatológicos na coloração de H&E de todas as amostras biopsiadas: características do tumor (estágio cronológico, epitélio escamoso, epitélio basaloide, células transicionais, células sombra, infiltrado inflamatório, células gigantes, calcificação e mitoses) e alterações dérmicas (dilatação de vasos linfáticos e sanguíneos, aumento do número de vasos linfáticos e sanguíneos, edema, aumento do espaço intersticial, escassez e rompimento de fibras colágenas e escassez de fibras elásticas). Os estágios cronológicos foram categorizados histopatologicamente em inicial, totalmente desenvolvido, regressivo precoce e regressivo tardio.20 A lesão inicial (estágio 1) era um pequeno cisto revestido por epitélio escamoso e basaloide contendo filamentos de queratina e células sombra. A lesão totalmente desenvolvida (estágio 2) era uma grande massa de tecido córneo eosinofílico contendo células sombra com revestimento periférico de epitélio basaloide. Lesões regressivas precoces (estágio 3) mostravam infiltrado inflamatório com células gigantes histiocíticas multinucleadas. Na periferia havia pequenos focos de células basaloides. A lesão regressiva tardia (estágio 4) era composta por massa confluente de matriz folicular eosinofílica, de formato irregular, e células sombra com graus variados de calcificação e ossificação. Estava rodeada por estroma hialinizado e esclerótico. Nesse estágio o infiltrado inflamatório era escasso ou ausente. Quando dois ou mais estágios eram observados simultaneamente, o estágio com características dominantes era selecionado. A determinação dos achados histopatológicos dérmicos, referentes às fibras colágenas e elásticas, foi avaliada na coloração elástica e EVG em todas as amostras.
Achados imuno‐histoquímicosA imuno‐marcação foi realizada em cortes do tecido emblocado em parafina, de acordo com as instruções do fabricante e protocolos laboratoriais estabelecidos. Foram utilizados os seguintes anticorpos primários: CD31 (Dako, Glostrup, Dinamarca; diluição 1:1000), CD34 (Roche, Basel, Suíça; RTU), D2‐40 (Roche, Basel, Suíça; RTU), MMP‐2 (Abcam, Cambridge, Reino Unido; ab97779; diluição 1:1000), MMP‐9 (Abcam, Cambridge, Reino Unido; ab137867; diluição 1:2000), VEGFR‐3 (Abcam, Cambridge, Reino Unido; ab27278; diluição 1:100) e VEGF‐C (Abcam, Cambridge, Reino Unido; ab9546; diluição 1:100). Os achados histopatológicos dérmicos da vasculatura linfática e sanguínea foram avaliados por dois dermatopatologistas em todas as amostras usando CD31, CD34 e D2‐40. Dois dermatopatologistas também avaliaram a imunorreatividade de MMP‐2, MMP‐9, VEGFR‐3 e VEGF‐C usando o escore H, que avalia tanto a intensidade da coloração quanto a fração de células coradas em cada intensidade.21,22 A intensidade da coloração recebeu em escore de “0” para nenhuma evidência de marcação, “1+” para imunomarcação fraca, visível em grande aumento, “2+” para imunomarcação moderada, “3+” para imunomarcação forte e visível em pequeno aumento. A porcentagem de células coradas (0% a 100%) em cada intensidade de imunomarcação foi determinada visualmente. O escore H foi calculado pela fórmula: 0×(porcentagem de células “0”) + 1× (porcentagem de células “1+”) + 2× (porcentagem de células “2+”) + 3×(porcentagens de células “3+”), com intervalo de 0 a 300.
Análise comparativa entre pilomatrixoma bolhoso e comumPara investigar de maneira abrangente as diferenças nas características clínicas entre pilomatrixoma bolhoso e comum, foram analisados 159 casos de 150 pacientes com pilomatrixoma comum comprovado por biopsia durante o mesmo período no JBNUH. Cinco pacientes apresentaram duas lesões; um paciente apresentou três lesões de pilomatrixoma e dois pacientes apresentaram recorrência. Para analisar as características histopatológicas e imuno‐histopatológicas da derme e do tumor, foram excluídos 143 casos de espécimes de pilomatrixoma comum: 1) amostra de tumor biopsiada por enucleação sem tecido dérmico ou 2) amostra mal orientada e insuficiente para avaliar as características da transformação bolhosa na derme. Foram avaliadas as características histopatológicas e imuno‐histopatológicas de 16 pilomatrixomas comuns completamente excisados, incluindo epiderme, derme e tumor.
Análise estatísticaAs análises estatísticas foram realizadas utilizando SPSS versão 25 (SPSS Inc., Chicago, IL, EUA) e R versão 4.2.1. Todos os dados clínicos e histopatológicos foram analisados pelo teste de qui‐quadrado ou teste exato de Fisher, exceto os dados do estágio cronológico. Foi utilizado o teste do qui‐quadrado se as frequências celulares esperadas <5 fossem inferiores a 20%, e o teste exato de Fisher se as frequências celulares esperadas <5 fossem superiores a 20%. O teste de qui‐quadrado foi utilizado para analisar os dados referentes a epitélio escamoso, aumento de vasos linfáticos, dilatação dos vasos sanguíneos, edema, aumento do espaço intersticial, fibras elásticas esparsas e fibras colágenas esparsas, enquanto os demais dados foram analisados pelo teste exato de Fisher. Enquanto isso, o estágio cronológico (estágios: 1–4) e a imunorreatividade (escore H: 0–300) foram avaliados usando o software R, o teste de soma de postos de Wilcoxon, porque suas categorias ordenadas exibiram tendência linear significante. Resultados com valor de p <0,05 foram considerados estatisticamente significantes.
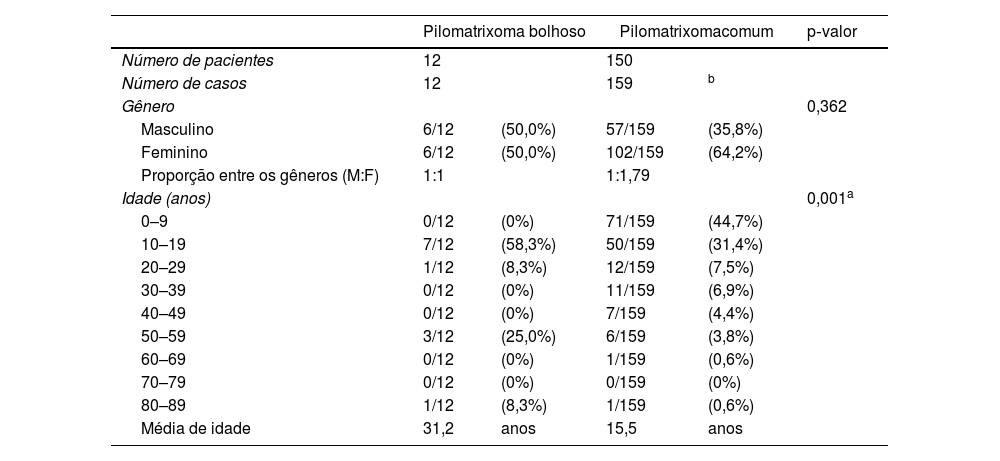
ResultadosAchados clínicosO pilomatrixoma bolhoso não apresentou preferência por gênero, e o pilomatrixoma comum teve predileção pelo gênero feminino (relação M:F=1:1,79). O pilomatrixoma bolhoso ocorreu predominantemente em pacientes com idade entre 10 e 19 anos (58,3%), seguido daqueles com idade entre 50 e 59 anos (25,0%). Por outro lado, o pilomatrixoma comum ocorreu predominantemente em pacientes com idade de 0 a 9 anos (44,7%), seguido por pacientes de 10 a 19 anos (31,4%). As idades médias de início foram 31,2 e 15,5 anos para o pilomatrixoma bolhoso e o pilomatrixoma comum, respectivamente (tabela 1).
Dados demográficos de pacientes com pilomatrixoma
| Pilomatrixoma bolhoso | Pilomatrixomacomum | p‐valor | |||
|---|---|---|---|---|---|
| Número de pacientes | 12 | 150 | |||
| Número de casos | 12 | 159 | b | ||
| Gênero | 0,362 | ||||
| Masculino | 6/12 | (50,0%) | 57/159 | (35,8%) | |
| Feminino | 6/12 | (50,0%) | 102/159 | (64,2%) | |
| Proporção entre os gêneros (M:F) | 1:1 | 1:1,79 | |||
| Idade (anos) | 0,001a | ||||
| 0–9 | 0/12 | (0%) | 71/159 | (44,7%) | |
| 10–19 | 7/12 | (58,3%) | 50/159 | (31,4%) | |
| 20–29 | 1/12 | (8,3%) | 12/159 | (7,5%) | |
| 30–39 | 0/12 | (0%) | 11/159 | (6,9%) | |
| 40–49 | 0/12 | (0%) | 7/159 | (4,4%) | |
| 50–59 | 3/12 | (25,0%) | 6/159 | (3,8%) | |
| 60–69 | 0/12 | (0%) | 1/159 | (0,6%) | |
| 70–79 | 0/12 | (0%) | 0/159 | (0%) | |
| 80–89 | 1/12 | (8,3%) | 1/159 | (0,6%) | |
| Média de idade | 31,2 | anos | 15,5 | anos | |
Apenas cinco (41,7%) casos de pilomatrixoma bolhoso foram clinicamente diagnosticados como pilomatrixoma, enquanto 66% dos casos de pilomatrixoma comum foram clinicamente diagnosticados como pilomatrixoma. O pilomatrixoma bolhoso foi encontrado com maior frequência nas extremidades superiores (41,7%), seguido pelo tronco (25,0%), enquanto a forma comum foi encontrada com maior frequência na face (54,1%), seguida pelas extremidades superiores (22,6%).
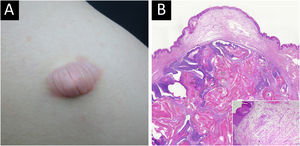
Pilomatrixoma bolhoso foi detectado em 10/11 (90,9%) pacientes em três meses, e pilomatrixoma comum foi detectado em apenas 43/134 (32,1%) pacientes no mesmo período. O tamanho do pilomatrixoma bolhoso foi maior que 1,0cm em todos os 12 pacientes (100%), enquanto o do pilomatrixoma comum foi menor que 1,0cm em 73/159 (52,2%) pacientes. O tamanho médio do tumor foi de 1,68cm para o pilomatrixoma bolhoso e 0,99cm para o pilomatrixoma comum. Todos os pacientes com pilomatrixoma bolhoso (8/8, 100%) queixaram‐se de aumento no tamanho do tumor. Quatro pacientes com pilomatrixoma bolhoso tinham histórico de trauma no tumor, enquanto isso ocorreu em 18 pacientes com a forma comum (tabela 2, fig. 1).
Diferenças clínicas entre pilomatrixoma bolhoso e comum
| Pilomatricoma bolhoso | Pilomatricoma comum | p‐valor | |||
|---|---|---|---|---|---|
| Impressão clínicaa | |||||
| Pilomatrixoma | 5/12 | (41,7%) | 105/159 | (66,0%) | <0,001a |
| Hemangioma | 3/12 | (25,0%) | 0/159 | (0,0%) | |
| Cisto epidérmico | 0/12 | (0,0%) | 37/159 | (23,3%) | |
| Cisto triquilemal | 1/12 | (8,3%) | 2/159 | (1,3%) | |
| Cisto dermoide | 0/12 | (8,3%) | 2/159 | (1,3%) | |
| Lipoma | 1/12 | (0,0%) | 2/159 | (1,3%) | |
| Outros | 2/12 | (16,7%) | 11/159 | (6,9%) | |
| Total | 12/12 | (100,0%) | 159/159 | (100,0%) | |
| Localizaçãoa | |||||
| Couro cabeludo | 2/12 | (16,7%) | 5/159 | (3,1%) | 0,002a |
| Face | 1/12 | (8,3%) | 86/159 | (54,1%) | |
| Pescoço | 1/12 | (8,3%) | 18/159 | (11,3%) | |
| Extremidade superior | 5/12 | (41,7%) | 36/159 | (22,6%) | |
| Extremidade inferior | 0/12 | (0%) | 4/159 | (2,5%) | |
| Tronco | 3/12 | (25,0%) | 10/159 | (6,3%) | |
| Total | 12/12 | (100,0%) | 159/159 | (100,0%) | |
| Duraçãoa | |||||
| 0 <D ≤ 3 meses | 10/11 | (90,9%) | 43/134 | (32,1%) | 0,001a |
| 3 <D ≤ 12 meses | 1/11 | (9,1%) | 65/134 | (48,5%) | |
| D >12 meses | 0 | (0,0%) | 26/134 | (19,4%) | |
| Total | 11/11 | (100,0%) | 134/134 | (100,0%) | |
| ND | 1/12 | 25/159 | |||
| Tamanhoa | |||||
| 0 <T <0,5 cm | 0/12 | (0%) | 14/159 | (8,8%) | <0,001a |
| 0,5cm ≤ T <1,0 cm | 0/12 | (0%) | 69/159 | (43,4%) | |
| 1,0cm ≤ T <1,5 cm | 5/12 | (41,7%) | 53/159 | (33,3%) | |
| 1,5cm ≤ T <2,0 cm | 3/12 | (25,0%) | 16/159 | (10,1%) | |
| 2,0cm ≤ T <2,5 cm | 2/12 | (16,7%) | 4/159 | (2,5%) | |
| 2,5cm ≤ T <3,0 cm | 1/12 | (8,3%) | 1/159 | (0,6%) | |
| T ≥ 3,0 cm | 1/12 | (8,3%) | 2/159 | (1,3%) | |
| Total | 12/12 | (100,0%) | 159/159 | (100%) | |
| Mudança de tamanho | |||||
| Sem mudança | 0/8 | (0,0%) | 23/90 | (25,6%) | 0,192 |
| Aumento | 8/8 | (100,0%) | 64/90 | (71,1%) | |
| Diminuição de tamanho | 0/8 | (0,0%) | 3/90 | (3,3%) | |
| Total | 8/8 | (100,0%) | 90/90 | (100,0%) | |
| ND | 4/12 | 69/159 | |||
| Histórico de trauma | |||||
| Histórico (+) | 4/6 | (66,7%) | 18/47 | (38,3%) | 0,219 |
| Histórico (–) | 2/6 | (33,3%) | 29/47 | (61,7%) | |
| ND | 6/12 | 112/159 | |||
Em relação aos dados histopatológicos do tumor, a diferença no estágio cronológico, calcificação e figuras de mitose entre pacientes com ambos os tipos de pilomatrixoma foi estatisticamente significante. Dos 12 pacientes com pilomatrixoma bolhoso, sete (58,3%) e cinco (41,7%) foram diagnosticados nos estágios cronológicos 3 e 2, respectivamente. Dos 16 pacientes com pilomatrixoma comum, 12 (75,0%), três (18,8%) e um (6,3%) foram diagnosticados nos estágios 3, 4 e 2, respectivamente. Calcificação e figuras de mitose foram observadas em cinco (41,7%) e oito (66,7%) pacientes com pilomatrixoma bolhoso, respectivamente. Enquanto isso, 14 (87,5%) e três (18,8%) pacientes com pilomatrixoma comum apresentaram calcificação e figuras de mitose, respectivamente.
Ao contrário do pilomatrixoma comum, quase todos os pacientes com pilomatrixoma bolhoso apresentaram alterações dérmicas, incluindo vasos linfáticos dilatados (66,7%) ou aumentados (100%), vasos sanguíneos dilatados (83,3%) ou aumentados (100%), edema dérmico (100%), aumento do espaço intersticial (100%), fibras elásticas esparsas (100%), diminuição (100%) e ruptura (66,7%) das fibras colágenas (tabela 3, fig. 1.
Diferenças histopatológicas entre pilomatrixoma bolhoso e comum
| Pilomatrixoma bolhoso | Pilomatricoma comum | p‐valor | |||
|---|---|---|---|---|---|
| Tumor | |||||
| Estágio cronológico | 0,013a | ||||
| 1. Inicial | 0/12 | (0,0%) | 0/16 | (0,0%) | |
| 2. Totalmente desenvolvido | 5/12 | (41,7%) | 1/16 | (6,3%) | |
| 3. Regressivo precoce | 7/12 | (58,3%) | 12/16 | (75,0%) | |
| 4. Regressivo tardio | 0/12 | (0,0%) | 3/16 | (18,8%) | |
| Epitélio escamoso | 5/12 | (41,7%) | 7/16 | (43,8%) | 0,912 |
| Epitélio basaloide | 12/12 | (100,0%) | 13/16 | (81,3%) | 0,238 |
| Células transicionais | 12/12 | (100,0%) | 11/16 | (68,8%) | 0,053 |
| Células sombra | 12/12 | (100,0%) | 16/16 | (100,0%) | |
| Infiltrado inflamatóri | 12/12 | (100,0%) | 15/16 | (93,8%) | 1 |
| Células gigantes | 12/12 | (100,0%) | 14/16 | (87,5%) | 0,492 |
| Calcificaçãoa | 5/12 | (41,7%) | 14/16 | (87,5%) | 0,017a |
| Mitosesa | 8/12 | (66,7%) | 3/16 | (18,8%) | 0,019a |
| Alterações dérmicas | |||||
| Vasos linfáticos dilatadosa | 8/12 | (66,7%) | 2/16 | (12,5%) | 0,005a |
| Vasos linfáticos aumentadosa | 12/12 | (100,0%) | 1/16 | (6,3%) | 0,000a |
| Vasos sanguíneos dilatadosa | 10/12 | (83,3%) | 4/16 | (25,0%) | 0,006a |
| Aumento dos vasos sanguíneosa | 12/12 | (100,0%) | 6/16 | (37,5%) | 0,001a |
| Edemaa | 12/12 | (100,0%) | 0/16 | (0,0%) | <0,001a |
| Aumento do espaço intersticiala | 12/12 | (100,0%) | 0/16 | (0,0%) | <0,001a |
| Fibras elásticas esparsasa | 12/12 | (100,0%) | 0/16 | (0,0%) | <0,001a |
| Fibras de colágeno esparsasa | 12/12 | (100,0%) | 0/16 | (0,0%) | <0,001a |
| Ruptura das fibras de colágenoa | 8/12 | (66,7%) | 0/16 | (0,0%) | <0,001a |
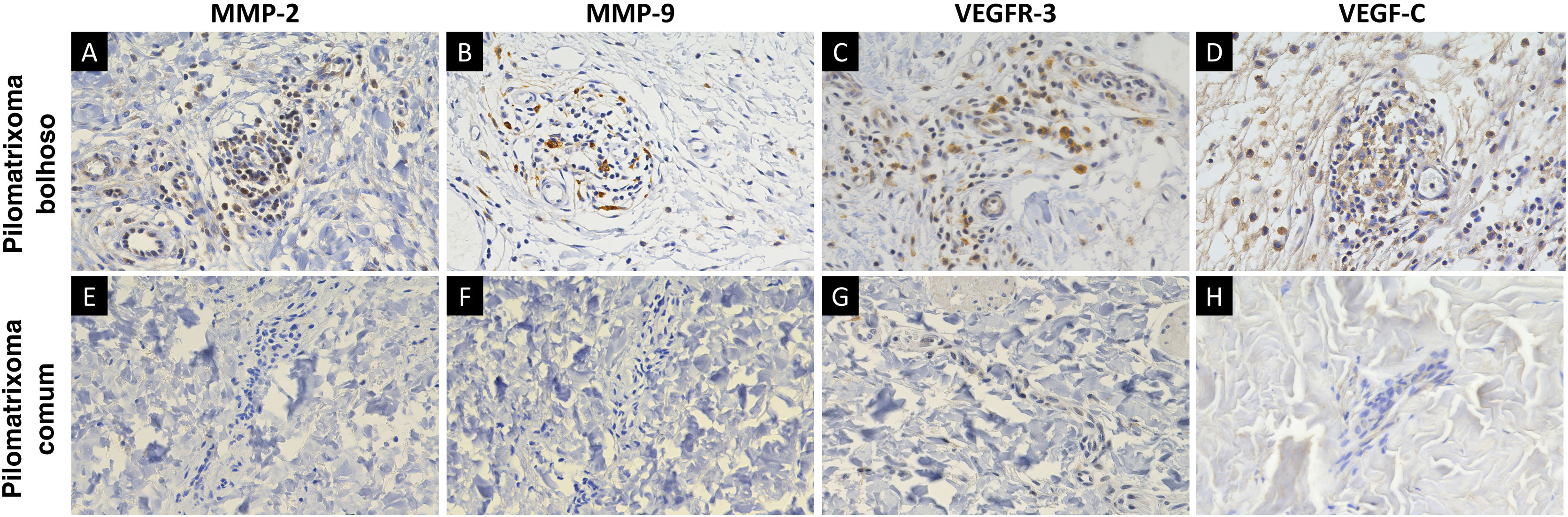
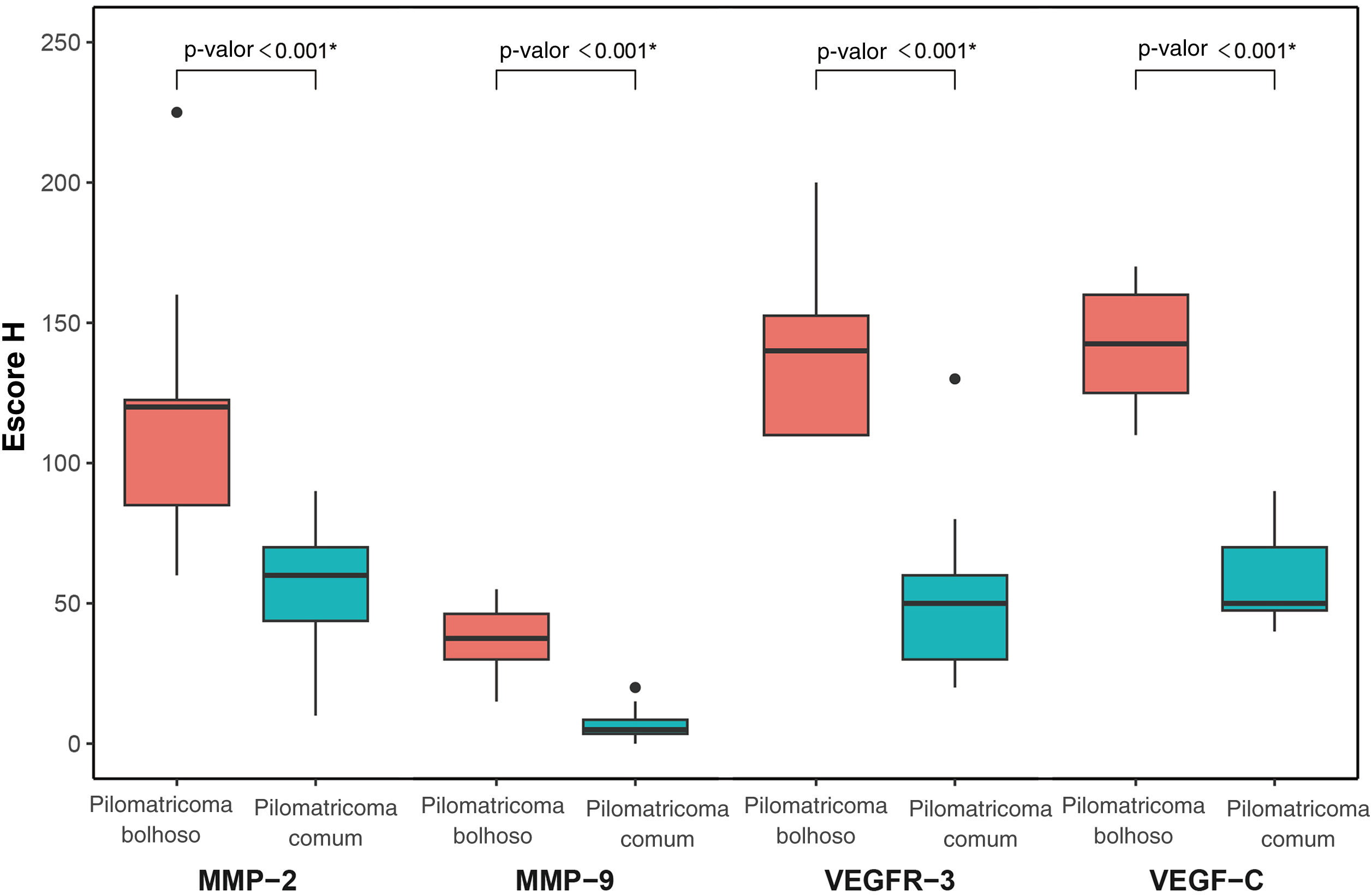
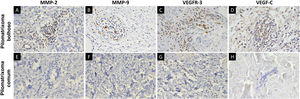
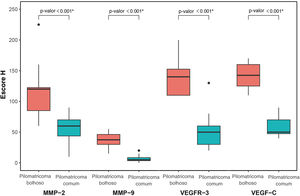
MMP‐2, MMP‐9, VEGFR‐3 e VEGF‐C foram expressos em células inflamatórias dérmicas e células endoteliais (fig. 2). Em pacientes com pilomatrixoma bolhoso, as células positivas para MMP‐2 e MMP‐9 apresentaram escores H mais elevados do que aquelas em pacientes com pilomatrixoma comum. Além disso, os níveis de expressão de VEGFR‐3 e VEGF‐C em pacientes com pilomatrixoma bolhoso foram maiores do que em pacientes com pilomatrixoma comum. As diferenças na imunorreatividade de MMP‐2, MMP‐9, VEGFR‐3 e VEGF‐C nos grupos bolhoso e comum foram estatisticamente significantes (fig. 3).
O pilomatrixoma bolhoso é variante rara do pilomatrixoma que geralmente se apresenta como bolha semitransparente com pregueamento, com nódulo firme subjacente.9 No presente estudo, 3/5 dos casos de pilomatrixoma bolhoso foram clinicamente diagnosticados erroneamente como outras doenças antes da confirmação histopatológica, destacando que a morfologia peculiar do pilomatrixoma bolhoso dificulta o diagnóstico. Além disso, os resultados do presente estudo revelaram que o pilomatrixoma bolhoso tem características demográficas e clínicas distintas em termos de idade de início, locais de predileção, tamanho do tumor e taxa de crescimento, o que poderia facilitar um diagnóstico adequado. Aproximadamente 60% dos pilomatrixomas se desenvolvem nas primeiras duas décadas de vida, principalmente na primeira década,1,4,23 e o grupo que tinha a forma comum neste estudo apresentava distribuição etária semelhante. O pilomatrixoma bolhoso neste estudo não afetou indivíduos com menos de 10 anos, e a idade média dos pacientes suscetíveis ao pilomatrixoma bolhoso foi maior do que a dos pacientes suscetíveis ao pilomatricoma comum (31,2 vs. 15,5 anos). Os locais comuns das lesões de pilomatrixoma são tipicamente cabeça, membros superiores, pescoço, tronco e membros inferiores, em ordem decrescente de frequência,1,2,24 como mostrado em pacientes com pilomatrixoma comum neste estudo. O pilomatrixoma bolhoso apareceu com maior frequência nas extremidades superiores (n=5; 41,7%) e no tronco, especialmente no ombro (n=3; 25,5%). Esses resultados são consistentes com a revisão de Chen et al., na qual 11/16 casos relatados de pilomatrixoma bolhoso foram encontrados no ombro ou na parte superior do braço.9 Neste estudo, o pilomatrixoma bolhoso apresentou clinicamente menor tempo de evolução do tumor, maior tamanho do tumor e aumento no tamanho do tumor em comparação com o pilomatrixoma comum. A forma bolhosa revelou histopatologicamente estágio cronológico mais precoce, menos calcificação e mais figuras de mitose que a forma comum. Esses resultados sugerem que o pilomatrixoma bolhoso atinge mais de 1cm de tamanho em período relativamente curto. Assim, o diagnóstico precoce e as decisões cirúrgicas são cruciais para o manejo da forma bolhosa.
O pilomatrixoma bolhoso foi chamado de pilomatrixoma pseudobolhoso em alguns estudos na literatura porque os espaços semelhantes a bolhas são preenchidos por líquido linfático.6 Neste estudo, o pilomatrixoma bolhoso apresentou degradação do tecido conjuntivo e desenvolvimento da vascularização na derme, enquanto a forma comum apresentou apenas alterações histopatológicas mínimas na vascularização dérmica. Essas características histopatológicas dérmicas distintas foram consistentes com sua morfologia bolhosa que constituem, mais precisamente, alterações pseudobolhosas. As proteínas da família MMP podem degradar proteoliticamente a matriz extracelular e facilitar a migração celular.25 Diversos estudos demonstraram que as MMPs estão envolvidas no desenvolvimento da elastólise da derme média e da neoangiogênese.26–28 Um estudo recente demonstrou associação entre a expressão de MMP‐9 e 12 e três casos de pilomatrixoma tipo bolhoso/anetodérmico.19 Assim, foi avaliada a expressão de MMP‐2 e MMP‐9, da família das gelatinases, que foram altamente expressas nas células inflamatórias dérmicas do pilomatrixoma bolhoso. Supõe‐se que essas proteínas facilitem a degradação das fibras de colágeno e elastina e, consequentemente, o crescimento tumoral do pilomatrixoma bolhoso.
O papel principal do sistema linfático é manter a homeostase dos fluidos teciduais, cuja disfunção pode resultar em linfedema e linfangiogênese patológica, causando inflamação e metástase tumoral.29,30 O VEGFR‐3 e seu ligante, VEGF‐C, são potentes indutores do desenvolvimento vascular linfático.29 Este estudo mostrou que a expressão de VEGFR‐3 e VEGF‐C foi significantemente maior nas células inflamatórias dérmicas e no endotélio vascular no pilomatrixoma bolhoso do que na forma comum. Este é o primeiro estudo sobre a expressão de VEGF‐C e VEGFR‐3 em pilomatrixoma bolhoso. É importante investigar melhor se a linfangiogênese induzida por VEGF‐C e VEGFR‐3 em pacientes com pilomatrixoma bolhoso está associada a resposta inflamatória dérmica e/ou progressão tumoral.
Diversas teorias foram propostas para explicar a origem do pilomatrixoma bolhoso. Inui et al. sugeriram que irritação mecânica pode resultar na formação do pilomatrixoma bolhoso;7 entretanto, neste estudo, apenas quatro pacientes com pilomatrixoma bolhoso apresentavam histórico de trauma, e nenhum dos 18 pacientes com a forma comum que sofreram acidente traumático desenvolveu tumores bolhosos. De acordo com Chen et al., uma história de coçadura mecânica local foi relatada em apenas dois de 16 casos de pilomatrixoma bolhoso.9 Enquanto isso, a prevalência da forma bolhosa nas extremidades superiores e nos braços implica alta probabilidade de exposição a traumas, e os pacientes podem ter esquecido os eventos traumáticos com intensidade fraca, como o atrito. Portanto, a teoria que propõe uma transformação bolhosa do pilomatrixoma comum induzida por irritação mecânica requer validação adicional.
Além disso, foi sugerido que pressão adicional na parte central do pilomatrixoma ou na área de crescimento do nódulo tumoral pode bloquear os vasos linfáticos e causar vazamento de fluido linfático.7,8 Foi ainda sugerido que o tumor e/ou células inflamatórias secretam enzimas elastolíticas que degradam a matriz extracelular.7,9 Neste estudo, alterações bolhosas não foram observadas em 26 pacientes com pilomatrixoma comum com duração maior do que um ano e em 76 pacientes com pilomatrixoma comum de tamanho maior que 1cm. No geral, o pilomatrixoma bolhoso pode ocorrer a partir da liberação dérmica de MMPs, VEGFR‐3 e VEGF‐C, e não por alteração degenerativa induzida por estímulo traumático ou pela pressão crescente ou duradoura do nódulo tumoral, embora sejam necessários estudos adicionais.
ConclusãoEste estudo revelou que o pilomatrixoma bolhoso é clinicamente caracterizado por tumor de crescimento rápido atingindo tamanho maior que 1cm, com predileção pela extremidade superior e ombro em pacientes idosos e histopatologicamente sendo constituído por tecido conjuntivo dérmico frouxo com aumento da vascularização, em comparação com o pilomatrixoma comum. É provável que essas características clinicopatológicas distintas estejam associadas à liberação dérmica de MMPs, VEGFR‐3 e VEGFR‐C. Embora sejam necessárias investigações adicionais com uma coorte maior, o presente estudo pode melhorar a compreensão da patogênese e auxiliar no diagnóstico e tratamento do pilomatrixoma bolhoso.
Suporte financeiroNenhum
Status de aprovação do CEPRevisado e aprovado pelo Comitê de Ética em Pesquisa do JBNUH (IRB n° 2019‐04‐061‐001).
Conflito de interessesNenhum.
Como citar este artigo: Nam KH, Lee SK, Lee IJ, Park J, Yun SK. Clinicopathological and immunohistochemical characteristics of bullous pilomatricoma: a retrospective, single‐center study, and comparison with ordinary pilomatricoma. An Bras Dermatol. 2024;99:362–9.
Trabalho realizado no Departamento de Dermatologia, Jeonbuk National University Medical School, Jeonju, Jeollabuk‐do, República da Coreia.