A psoríase representa fenótipo inflamatório crônico moldado por interações genéticas, caracterizado pela hiperproliferação de queratinócitos e comumente afetando a pele e as articulações. Estudos experimentais e clínicos sugerem que o locus do gene IL‐17F desempenhe papel como citocina central na imunopatogênese da psoríase.
ObjetivosCom base no papel central da IL‐17F na patogênese da psoríase, levantou‐se a hipótese de que variações nesse gene poderiam afetar a suscetibilidade e gravidade dessa doença. Portanto, o presente estudo pretende analisar se a variante IL‐17F rs763780 tem efeito na patogênese da psoríase na população turca.
MétodoNeste estudo de caso‐controle, o grupo de estudo consistiu em 603 pessoas (201 pacientes com psoríase – 73 homens e 128 mulheres; e 402 controles – 146 homens e 256 mulheres) genotipados em termos do polimorfismo IL‐17F rs763780 com o TaqMan 5’ Allelic Discrimination Test.
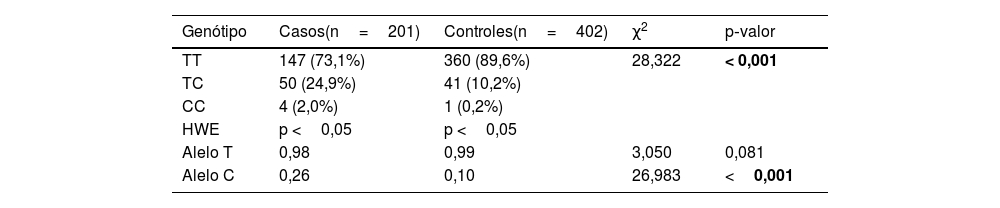
ResultadosAs distribuições genotípicas do polimorfismo IL‐17F rs763780 entre os grupos de pacientes e controle foram estatisticamente diferentes, e os genótipos TC (genótipo heterozigoto) e CC (genótipo mutante homozigoto) foram mais representados no grupo de pacientes do que no grupo controle (24,9% vs. 10,2%; 2,0% vs. 0,2%, respectivamente). Além disso, o alelo variante C foi mais prevalente no grupo de pacientes e isso foi estatisticamente significante (p<0,001), e a presença do alelo C foi associada a um risco 3,14 vezes maior de psoríase (IC 95% 2,015‐24,921).
Limitações do estudoO presente estudo tem algumas limitações. A primeira delas é o tamanho relativamente pequeno da amostra. A segunda é que não foi possível medir os níveis da expressão de IL‐17F. No entanto, os dados do estudo chamam a atenção para a importância da IL‐17F, indicando que merece ser avaliada em um grupo amostral maior.
ConclusãoOs autores relatam que o genótipo IL‐17F rs763780 TC e CC e o alelo C estão associados ao aumento do risco de psoríase na população turca.
A psoríase representa fenótipo inflamatório crônico moldado por interações genéticas, caracterizado pela hiperproliferação de queratinócitos e comumente afetando a pele e as articulações.1 A psoríase afeta 1% a 3% da população mundial, e os pacientes também têm que lidar com os problemas psicológicos e fisiológicos causados pela doença.2,3 É muito importante identificar indivíduos em risco de contrair psoríase com comorbidades significantes, incluindo doenças cardiovasculares, diabetes e depressão, e revisar opções de tratamento precoce. Embora a complexa etiologia mediada imunologicamente ainda não tenha sido totalmente elucidada, a descoberta do eixo interleucina (IL)‐23/IL‐17, que é importante na fisiopatologia da psoríase, mudou a perspectiva nas opções de tratamento da doença e atraiu atenção para a família IL‐17, um dos mediadores importantes nessa via.4–6 IL‐17A e IL‐17F, que são membros da família IL‐17 e têm aproximadamente 50% de homologia estrutural, desempenham papel central na patogênese da psoríase e ambas têm sido associadas a doenças inflamatórias imunomediadas, incluindo a psoríase.7–10 Tanto a IL‐17A quanto a IL‐17F atuam na regulação positiva da resposta inflamatória, mostrando interações complexas com citocinas pró‐inflamatórias.11 Relatos de níveis aumentados de mRNA de IL‐17A e IL‐17F no líquido sinovial de pacientes com artrite psoriásica apoiam essa dupla associação.12 Os agentes bloqueadores de IL‐17A são amplamente aceitos no tratamento da psoríase, mas a diferença nas respostas individuais ao tratamento e a diminuição de resposta ao longo do tempo levaram à formulação de opções alternativas de tratamento, como o bimequizumabe, que emergiu como nova estratégia que tem como alvo tanto IL‐17A quanto IL‐17F. Com base em dados de estudos clínicos e experimentais sobre essa nova estratégia de tratamento, pode‐se afirmar que o duplo bloqueio proporciona melhora dos sintomas da doença em pouco tempo, e melhor resposta anti‐inflamatória é obtida na regulação de genes relacionados ao processo inflamatório em comparação aos tratamentos direcionados apenas à IL‐17A.12–15 Desse modo, parece possível dizer que o locus do gene IL‐17F desempenha papel como citocina central na imunopatogênese da psoríase. Além disso, a demonstração do aumento da produção de IL‐6 e IL‐8 pela indução de IL‐17F em lesões cutâneas de pacientes com psoríase endossou mais uma vez o papel da IL‐17F na patogênese da psoríase.16,17 Por fim, o relato de que camundongos knockout para IL‐17F apresentam maior resistência à psoríase em comparação com camundongos knockout para IL‐17A indica que IL‐17F está intimamente relacionada à psoríase.18 Apesar de seu papel central na patogênese da psoríase, o número de estudos que investigam o efeito das variações no locus do gene IL‐7F na patogênese da doença é bastante limitado e, além disso, não existem dados relacionados com essa questão na sociedade turca. Os componentes genéticos podem afetar não apenas a suscetibilidade à doença, mas também o tipo clínico, a idade de início, a gravidade e até mesmo o risco de artrite psoriásica. Portanto, o objetivo do presente estudo foi investigar a possível relação da variante IL‐17F rs763780 com a doença.
MétodosDesenho do estudoO presente protocolo de estudo foi aprovado pelo Comitê de Ética da Faculdade de Medicina da Giresun University (número do comitê de ética: KAEK‐115) e consentimento informado por escrito foi obtido de todos os pacientes. Todos os procedimentos realizados neste estudo estavam em conformidade com os padrões éticos do comitê de pesquisa institucional e/ou nacional e com a Declaração de Helsinque da World Medical Association.19 Neste estudo, 201 pacientes com psoríase atendidos no Giresun University A. İlhan Özdemir Training and Research Hospital entre 2019 e 2021, com diagnóstico clínico ou histopatológico, foram incluídos no grupo de estudo. Como grupo controle, foram incluídos 402 indivíduos atendidos no ambulatório de dermatologia com doença dermatológica, pareados por idade (sem evidência clínica de psoríase ou outras doenças autoimunes). Esses indivíduos não tinham histórico de psoríase ou qualquer doença inflamatória crônica. As características demográficas e clínicas dos pacientes com psoríase e do grupo controle foram registradas em planilhas sincronizadas para uso posterior. Artrite psoriásica foi investigada em todos os pacientes. Crianças (idade < 18; n=8), participantes grávidas e lactantes (n=3) e participantes (n=13) com histórico de qualquer doença imunológica ou inflamatória foram excluídos do estudo.
Análise do genótipo da IL‐17F rs763780As análises de DNA foram realizadas com kit comercial (Roche High Pure Isolation Kit, Alemanha) utilizando sangue periférico coletado dos pacientes do estudo, e os níveis de DNA foram calculados determinando sua pureza e armazenados a +4°C até o momento do estudo. As variações alélicas IL‐17F rs763780 foram genotipadas com o método PCR em tempo real e teste quantitativo bidirecional TaqMan 5’ Allelic Discrimination Test (Applied Biosystems, Foster City, CA) utilizando protocolos estabelecidos de acordo com as instruções do fabricante. A amplificação por PCR foi realizada a 95°C por 10 minutos, a 95°C por 15 segundos, a 55°C por 1 minuto e a 72°C por 1 minuto em 45 ciclos. Para controle, 10% das amostras selecionadas aleatoriamente foram genotipadas em duplicata, e a precisão dos resultados foi novamente confirmada.
Análise estatísticaA análise estatística deste estudo foi realizada utilizando o programa SPSS 20. A significância estatística foi considerada como p < 0,05. Alelos e frequências genotípicas foram calculados por contagem direta. As distribuições genotípicas nos grupos de estudo foram analisadas por compatibilidade com o equilíbrio de Hardy‐Weinberg (HWE, do inglês Hardy‐Weinberg equilibrium). O teste de Qui‐Quadrado (χ2) foi utilizado para avaliar as diferenças intergrupos na frequência de genótipo e alelos. Odds ratio (OR) e intervalo de confiança de 95% (IC95%) são utilizados para determinar o fator de risco entre os grupos. Para determinar a relação entre o risco de psoríase e a presença do alelo IL‐17F rs763780C, foram realizados modelo de regressão logística binária e análise de regressão multivariada, com significância de p < 0,05. A psoríase foi utilizada como variável dependente.
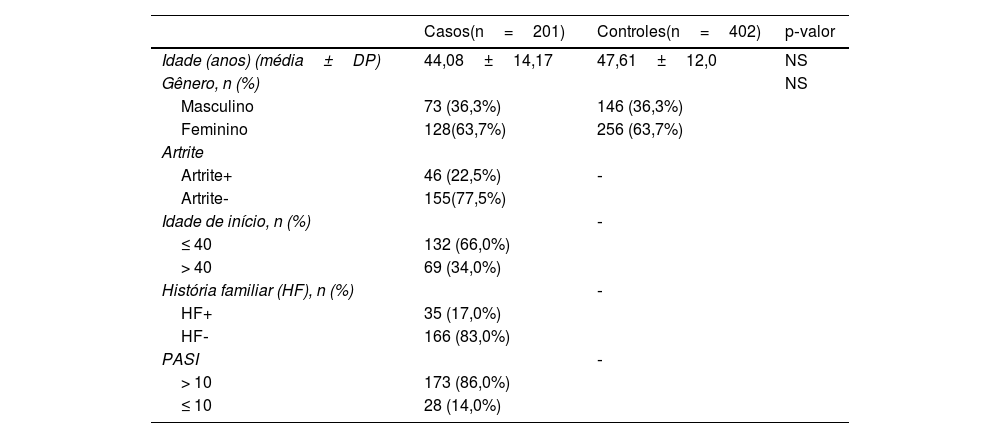
ResultadosAs informações das características demográficas dos grupos de trabalho são mostradas na tabela 1. Artrite psoriásica foi observada em 46 dos pacientes com psoríase, enquanto nenhum sinal de artrite psoriásica foi encontrado em 155 pacientes. Quando os pacientes foram divididos em dois grupos de acordo com a idade de início da psoríase, o número de pacientes com psoríase de início precoce (idade ≤ 40) foi de 132, e o número de pacientes com psoríase de início tardio (idade> 40) foi de 69. Trinta e cinco dos pacientes tinham história de psoríase em parentes de primeiro grau e em 166 pacientes não foi identificada história de psoríase em parentes de primeiro grau. O número de pacientes cujo escore PASI (do inglês Psoriasis Area and Severity Index) era ≤ 10 foi 28, e o restante do grupo de psoríase, 173 pacientes, apresentou escore PASI> 10. As distribuições genotípicas e as frações alélicas das populações de estudo são apresentadas na tabela 2. Tanto o grupo de pacientes quanto o grupo controle mostraram compatibilidade com o HWE. Há diferença estatisticamente significante entre os grupos de pacientes e controle em termos de distribuições genotípicas (p < 0,001). Os genótipos TC e CC foram mais representados no grupo de pacientes do que no grupo controle (24,9% vs. 10,2%; 2,0% vs. 0,2%, respectivamente). Além disso, o alelo variante C foi mais prevalente no grupo de pacientes e isso foi estatisticamente significante (p < 0,001), e a presença do alelo C foi associada a um risco 3,14 vezes maior de psoríase (IC95% 2,015‐24,921). Quando as distribuições genotípicas no grupo de pacientes foram avaliadas em termos de história familiar, artrite psoriásica, idade de início e gênero, não foi observada diferença estatística (dados não mostrados). Os resultados da análise de regressão logística para comprovar a relação entre psoríase e o alelo IL‐17F C também confirmaram que o alelo variante C aumenta o risco de psoríase (p < 0,001; IC95% 2,015‐4,491).
Características demográficas da população do estudo
| Casos(n=201) | Controles(n=402) | p‐valor | |
|---|---|---|---|
| Idade (anos) (média±DP) | 44,08±14,17 | 47,61±12,0 | NS |
| Gênero, n (%) | NS | ||
| Masculino | 73 (36,3%) | 146 (36,3%) | |
| Feminino | 128(63,7%) | 256 (63,7%) | |
| Artrite | |||
| Artrite+ | 46 (22,5%) | ‐ | |
| Artrite‐ | 155(77,5%) | ||
| Idade de início, n (%) | ‐ | ||
| ≤ 40 | 132 (66,0%) | ||
| > 40 | 69 (34,0%) | ||
| História familiar (HF), n (%) | ‐ | ||
| HF+ | 35 (17,0%) | ||
| HF‐ | 166 (83,0%) | ||
| PASI | ‐ | ||
| > 10 | 173 (86,0%) | ||
| ≤ 10 | 28 (14,0%) | ||
Os valores médios foram comparados entre pacientes e controles por meio do teste t de Student. Os dados qualitativos foram analisados pelo teste de Qui‐Quadrado.
Os dados são apresentados como média±DP e n (%). Os valores em negrito foram estatisticamente significantes (p < 0,05).
NS, não significante, PASI, Psoriasis Area and Severity Index; n, número de amostras.
Genótipos e fração alélica nos grupos de estudo
| Genótipo | Casos(n=201) | Controles(n=402) | χ2 | p‐valor |
|---|---|---|---|---|
| TT | 147 (73,1%) | 360 (89,6%) | 28,322 | < 0,001 |
| TC | 50 (24,9%) | 41 (10,2%) | ||
| CC | 4 (2,0%) | 1 (0,2%) | ||
| HWE | p <0,05 | p <0,05 | ||
| Alelo T | 0,98 | 0,99 | 3,050 | 0,081 |
| Alelo C | 0,26 | 0,10 | 26,983 | <0,001 |
Genótipos e frações alélicas foram analisados pelo teste de Qui‐Quadrado. Os dados são apresentados como n (%). Os valores em negrito foram estatisticamente significantes (p <0,05).
n, número de amostras; HWE, equilíbrio de Hardy‐Weinberg.
Existem seis membros da família IL‐17 (IL17A‐IL17F), que desempenham papel crítico na patogênese da psoríase.20–22 Os mais estudados são IL‐17A e IL‐17F, que têm funções biológicas semelhantes, mostrando 50% de homologia. Ambos têm sido frequentemente associados a muitas doenças inflamatórias, incluindo a psoríase.23–25 Embora a IL‐17A pareça desempenhar papel central na patogênese da psoríase, estudos recentes relataram um nível crescente de IL‐17F na pele lesionada da psoríase, além da demonstração de que IL‐17F tem funções semelhantes às de IL‐17A e começou‐se a focar no possível papel crítico de IL‐17F na imunopatogênese da doença.26 Os resultados de um estudo recente de Bertelsen et al. forneceram evidências de que IL‐17F desempenha papel fundamental no eixo IL‐23/IL‐1726 e mostraram que a estimulação de IL‐17F induz a expressão de IκBκ, cujo papel crítico na patogênese da psoríase foi demonstrado anteriormente27 em queratinócitos humanos, alterando os níveis de mRNA e de proteína, e desempenhando papel na regulação de muitos genes, como os associados à psoríase.26 Outras evidências acumuladas mostram que a variante IL‐17F rs763780 produz diferentes respostas medicamentosas às abordagens terapêuticas. Essa situação destacou mais uma vez o papel crítico da IL‐17F na patogênese da psoríase.28 Os pesquisadores avaliaram a resposta PASI 75 em um grupo de estudo de 194 pacientes com psoríase e associaram o genótipo IL17F rs763780 TT a melhor resposta ao tratamento com ustequinumabe. Dados de outro estudo no qual ustequinumabe foi administrado também relataram diminuição nos níveis de IL‐17A e IL‐17F na semana 24, mas essa diminuição foi significante apenas entre IL‐17F e placebos.29 Embora o papel da IL‐17F na imunopatogênese da psoríase não tenha sido totalmente esclarecido, a determinação das variantes desse gene é de grande importância em termos de criação de opções de tratamento paciente‐específicas. No entanto, há poucos estudos sobre esse assunto na literatura, e a investigação é bastante limitada. Um desses estudos, de Kaur et al., associou a variante IL‐17F rs763780 ao aumento da suscetibilidade à psoríase.30 No presente estudo, foi observado que os genótipos portadores do alelo variante prevaleciam no grupo de pacientes em comparação ao grupo controle, o que é semelhante aos dados de Kaur et al. Além disso, os autores avaliaram que o alelo variante está associado a um risco 3,1 vezes maior de psoríase. Da mesma maneira, Choi et al., que definiram IL‐17F como um novo locus de risco para psoríase, relataram que os genótipos portadores do alelo variante estavam mais amplamente representados no grupo de pacientes.31 Consistente com esses dados, outro estudo em população coreana relatou que o genótipo da variante homozigótica estava associado a um risco 3,27 vezes maior de psoríase.32 Contudo os dados de estudos conduzidos em populações japonesas e espanholas33 não relataram associação entre a variante IL‐17F rs763780 e psoríase. Isso pode ser explicado pelo fato de que um gene depende de seu contexto genômico e pode exibir diferentes padrões de expressão em diferentes grupos étnicos.34 Com base nas informações obtidas do presente estudo, os autores enfatizam a relação da IL‐17F com a psoríase. Além disso, tem‐se a impressão de que a variante IL‐17F rs763780 induziu suscetibilidade à doença pelo alelo C. Como a psoríase apresenta muitas comorbidades, é importante determinar os grupos de risco e aplicar precocemente as opções de tratamento. A variante IL‐17F rs763780 pode ser recomendada como biomarcador apropriado pois tratamentos apropriados, visando o alvo correto, possibilitarão aos médicos diminuir a morbidade na doença.
LimitaçõesO presente estudo tem algumas limitações. A primeira delas é o tamanho relativamente pequeno da amostra. Um tamanho de amostra maior aumentaria o poder estatístico. A segunda limitação é que não foi possível medir os níveis de expressão de IL‐17F. No entanto, o presente estudo chama a atenção para a importância da IL‐17F que merece ser avaliada em um grupo amostral maior.
ConclusãoCom base nas informações obtidas no presente estudo, os autores enfatizam a relação da IL‐17F com a psoríase. Além disso, os genótipos IL‐17F rs763780 TC e CC e o alelo C estão associados ao aumento do risco de psoríase na população turca, de acordo com essa amostra. Como a psoríase apresenta elevadas comorbidades, é importante determinar os grupos de risco e aplicar precocemente as opções de tratamento. A variante IL‐17F rs763780 pode ser recomendada como biomarcador apropriado pois tratamentos apropriados, visando o alvo correto, possibilitarão aos médicos diminuir a morbidade na doença.
Suporte financeiroO presente estudo foi financiado por uma bolsa da Scientific Research Projects Coordination Unit, Giresun University (Projeto n° SAĞ‐BAP‐A‐270220‐07).
Contribuição dos autoresAyşegül Başak Akadam‐Teker: Concepção do estudo, fornecimento de amostras, análise dos dados, pesquisa na literatura, redação do artigo e realização do trabalho laboratorial.
Burak Akşan: Fornecimento de amostras, análise dos dados e pesquisa na literatura.
Conflito de interessesNenhum.
Como citar este artigo: Akadam‐Teker AB, Akşan B. Association of IL‐17F rs763780 polymorphism and risk of psoriasis in Turkish population: a case‐control study. An Bras Dermatol. 2024;99:357–61.
Trabalho realizado no Departamento de Genética Médica e no Departamento de Doenças Cutâneas, Faculdade de Medicina, Giresun University, Giresun, Turquia.