O citocromo P450 (CYP) 2J2 é principalmente expresso em tecidos extra‐hepáticos. Ele metaboliza o ácido araquidônico (AA) em ácidos epoxieicosatrienoicos (EETs), com vários efeitos cardioprotetores e anti‐inflamatórios. O polimorfismo do CYP2J2 foi identificado como um fator de risco para doenças cardiovasculares, mas sua associação com a psoríase permanece desconhecida.
ObjetivoAvaliar se o polimorfismo do CYP2J2 é um fator de risco para psoríase em uma população turca.
MétodosO estudo incluiu 94 pacientes com psoríase e 100 controles saudáveis, pareados por idade e sexo. Características demográficas e clínicas detalhadas foram registradas e os escores do Índice de Área e Gravidade da Psoríase (PASI, do inglês Psoriasis Area and Severity Index) foram calculados para pacientes com psoríase. Amostras de sangue venoso foram coletadas de todos os participantes e o polimorfismo CYP2J2 50G>T (rs890293) foi analisado por reação em cadeia da polimerase (PCR).
ResultadosAs frequências do alelo T e do genótipo TT+GT aumentaram em pacientes com psoríase vulgar (PsV) em comparação ao grupo controle (p=0,024 e p=0,029, respectivamente; OR=2,82; IC 95%: 1,11–7,15). Não foi identificada associação entre o polimorfismo do CYP2J2 e as características clínicas da psoríase.
Limitações do estudoUm número reduzido de pacientes foi incluído no estudo.
ConclusãoO polimorfismo CYP2J2 50G>T (rs890293) foi associado a um risco aumentado de PsV na população turca.
A psoríase é uma doença dermatológica inflamatória crônica, caracterizada por pápulas e placas bem delimitadas com escamas prateadas. No entanto, os estudos relatam uma ampla variação na prevalência (0–11,8%), de acordo com idade, sexo e etnia. Acredita‐se que a psoríase afete cerca de 2% da população em geral,1 incide igualmente em homens e mulheres. Embora possa começar em qualquer idade, foram observados dois picos etários de incidência: o primeiro na segunda e terceira décadas e o segundo na quinta e sexta décadas.2 O comprometimento de pele, unhas ou articulações pode ser observado em até 50% dos pacientes. A associação da psoríase com vários distúrbios sistêmicos, como doenças cardiovasculares, infecções, distúrbios metabólicos, doenças renais, doenças gastrintestinais e câncer, está bem documentada.3–5 A etiopatogênese da doença ainda não está bem esclarecida. A psoríase é classificada como uma doença multifatorial; fatores genéticos, ambientais, imunológicos e inflamatórios contribuem para sua patogênese.6 Inflamação, tanto lesional quanto sistêmica, é uma característica importante da psoríase. Muitos estudos que avaliaram a inflamação sistêmica na psoríase apontaram que marcadores de inflamação (especialmente proteína C‐reativa, fator de necrose tumoral [TNF]‐α, molécula de adesão intercelular [ICAM]‐1, E‐selectina e interleucinas [IL]‐1β, IL ‐6, IL‐10) estão aumentados em pacientes psoriásicos, criam um estado inflamatório sistêmico que pode levar a comorbidades como doenças cardiovasculares.7
As enzimas do citocromo P450 (CYP) são hemoproteínas localizadas principalmente no retículo endoplasmático (RE) ou na membrana mitocondrial em humanos. A principal função dos CYPs é metabolizar medicamentos, xenobióticos não medicamentosos e endobióticos, como ácidos graxos, esteroides e hormônios esteroides, ácidos biliares, vitamina D, prostaglandinas e ácido araquidônico (AA).8–10 O AA é metabolizado em quatro ácidos epoxieicosatrienoicos (EETs) 5,6‐EET, 8,9‐EET, 11,12‐EET e 14,15‐EET. Os EETs promovem relaxamento vascular, têm efeito anti‐inflamatório no endotélio e efeito cardioprotetor durante eventos isquêmicos.11,12 Além de seu efeito favorável sobre doenças cardiovasculares e inflamatórias, os EETs também podem promover proliferação, migração e sobrevivência nas células tumorais.13 O CYP2J2 (isoforma do CYP, expresso principalmente no fígado, coração, intestino delgado, rim e cérebro) é um dos principais CYPs que convertem AA em EETs.14 O polimorfismo do CYP2J2 foi estudado em doenças cardiovasculares, acidente vascular cerebral isquêmico e doença de Alzheimer e demonstrou‐se que ele aumenta a suscetibilidade a essas doenças.15–18
O objetivo deste estudo foi investigar o polimorfismo do CYP2J2 na psoríase, uma doença dermatológica inflamatória crônica que pode ser acompanhada por doenças cardiovasculares.
Material e métodosPopulação do estudoNo presente estudo, 94 pacientes com psoríase diagnosticada clínica ou histopatologicamente foram admitidos no Hospital de Pesquisa e Treinamento Ankara Numune entre janeiro de 2015 e julho de 2016. Como grupo controle, foram recrutados 100 pacientes pareados por sexo e idade admitidos no ambulatório de dermatologia, com uma doença dermatológica que não psoríase e sem histórico de doença inflamatória crônica. As características demográficas e clínicas (subtipo da doença, duração, gravidade, histórico familiar, tratamentos, histórico de artrite psoriásica e comprometimento de localização especial, como couro cabeludo, áreas flexurais e unhas) dos pacientes com psoríase e do grupo controle foram registradas. A artrite psoriásica foi avaliada em todos os pacientes. O histórico de artrite psoriásica foi coletado; os pacientes com artralgia ou artrite ativa foram encaminhados ao departamento de reumatologia para um diagnóstico definitivo de artrite psoriásica. Pacientes com idade<18, participantes grávidas ou lactantes e participantes com histórico de doenças imunológicas ou inflamatórias foram excluídos do estudo.
O estudo foi aprovado pelo comitê de ética local (E‐15‐612) e todos os participantes assinaram um termo de consentimento livre e esclarecido antes do estudo.
Análise do polimorfismoO desenho do primer foi feito para a amplificação por reação em cadeia da polimerase (PCR) da região do polimorfismo CYP2J2 ‐50G>T, de modo que o local do polimorfismo estivesse a 150bp de ambas as extremidades do amplicon de PCR. Isso foi necessário porque foi usado um kit de sequenciamento que faz a leitura a 150 pb das duas extremidades. Antes de pedirem os primers, os autores adicionaram sequências específicas de cerca de 30 nucleotídios às extremidades 5’ dos primers, para tornar os amplicons adequados para o sequenciamento indexado nas plataformas Illumina. A tabela 1 resume os pares de primers de PCR, as sequências específicas de locus e as sequências adicionadas para a PCR índice. As amostras de DNA foram obtidas isolando‐se 200μL de amostras de sangue de cada participante, com um QIAamp DNA Blood Mini Kit (Qiagen Inc.). As PCRs foram feitas em amostras de DNA isoladas com os primers projetados; as reações foram verificadas usando eletroforese em gel de agarose a 2%. Uma segunda PCR para fins de indexação foi feita para adicionar sequências índice aos amplicons, para alcançar a multiplexação no sequenciamento de próximo gene. Para cada uma das amostras, foi usada uma combinação diferente de primers índice. As reações de indexação por PCR também foram verificadas com eletroforese em gel de agarose a 2%. Volumes iguais de reações de PCR indexadas foram misturados para obter um pool de PCR, que incluía todos os amplicons de todas as amostras. O pool de PCR foi purificado com um kit NucleoFast® 96 PCR (Macherey‐Nagel GmbH). O pool purificado foi quantificado com um espectrofotômetro de microvolume e diluído de acordo com as recomendações da Illumina Inc. O sequenciamento de segunda geração das amostras foi feito com o sistema Miseq (Illumina Inc.). A genotipagem das amostras foi finalizada quando os dados foram analisados no software IGV v. 2.3 (Broad Institute).
Pares de primers de PCR, as sequências específicas de locus e as sequências adicionadas para a PCR índice
| Primers | |
| CYP2J2_‐50_F | TCGTCGGCAGCGTCAGATGTGTATAAGAGACAGCTCCTAGCCTGGCCTTTTCTGAGAC |
| CYP2J2_‐50_R | GTCTCGTGGGCTCGGAGATGTGTATAAGAGACAGCATGGCTCAGACGTCCTCCTGCTC |
| Sequências específicas de locus | |
| CYP2J2_‐50_F | CTCCTAGCCTGGCCTTTTCTGAGAC |
| CYP2J2_‐50_R | CATGGCTCAGACGTCCTCCTGCTC |
| Sequências adicionadas para a PCR índice | |
| seq (i5)+adaptador no primer construído | TCGTCGGCAGCGTCAGATGTGTATAAGAGACAG |
| seq (i7)+adaptador no primer construído | GTCTCGTGGGCTCGGAGATGTGTATAAGAGACAG |
O SPSS Statistics para Windows v. 21.0 (IBM Corp. – Armonk, NY, Estados Unidos) foi usado para análise estatística. As variáveis quantitativas foram analisadas com o teste qui‐quadrado ou o teste exato de Fisher, quando necessário; as variáveis qualitativas foram analisadas com o teste U de Mann‐Whitney. A correlação entre variáveis qualitativas foi avaliada pelo teste de correlação de Spearman. Valores‐p<0,05 foram considerados como diferenças estatisticamente significativas em todas as análises.
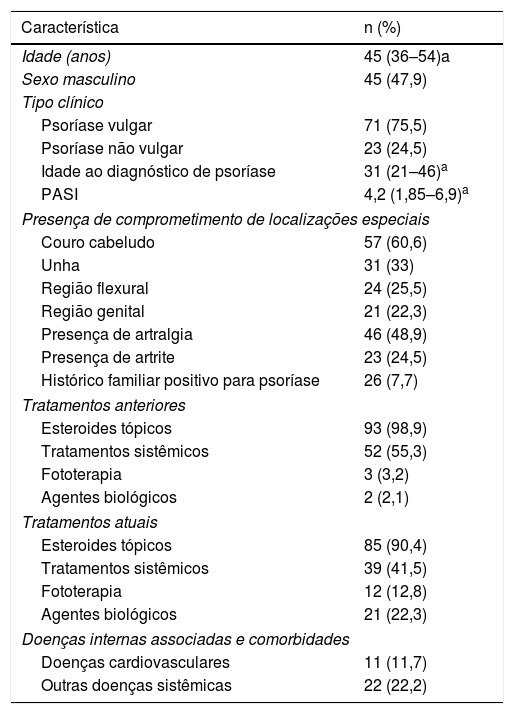
ResultadosCaracterísticas dos pacientes e características clínicas da psoríaseAs características dos pacientes e os aspectos clínicos da psoríase estão resumidos na tabela 1. Na distribuição por sexo, 47% dos pacientes eram do sexo masculino e 53% do feminino. A idade média dos pacientes foi de 44,66 anos (DP=12,6) e a idade média ao diagnóstico de psoríase foi de 33,21 anos (DP=14,9). A idade dos pacientes e a idade ao diagnóstico foram semelhantes nos pacientes do sexo masculino e feminino (p=0,39 e 0,53, respectivamente).
O PASI médio dos pacientes com psoríase foi 4,51 (DP=3,86). A psoríase vulgar (PsV) foi o tipo mais comum, identificada em 76% de todos os pacientes com psoríase. A psoríase palmoplantar foi o segundo tipo mais comum (11%), seguida pela gutata (6%), eritrodérmica (4%) e pustulosa (3%). O comprometimento de pelo menos uma das localizações especiais, como couro cabeludo, região flexural ou região genital, foi observado em 74,5% dos pacientes com psoríase. O couro cabeludo foi a localização especial mais frequentemente afetada. Artralgia foi identificada em 47% dos pacientes com psoríase e 23% dos pacientes foram diagnosticados com artrite psoriásica.
Os tratamentos anteriores e atuais estão resumidos na tabela 2. Os esteroides tópicos foram o tratamento anterior e atual mais comum em pacientes com psoríase (99% e 90%, respectivamente). Entre os pacientes, 23,1% apresentavam pelo menos uma doença sistêmica ou comorbidade associada. Doenças cardiovasculares foram observadas em 11,7% dos pacientes, e outras doenças sistêmicas em 22,2% (tabela 2).
Características dos pacientes e características clínicas da psoríase
| Característica | n (%) |
|---|---|
| Idade (anos) | 45 (36–54)a |
| Sexo masculino | 45 (47,9) |
| Tipo clínico | |
| Psoríase vulgar | 71 (75,5) |
| Psoríase não vulgar | 23 (24,5) |
| Idade ao diagnóstico de psoríase | 31 (21–46)a |
| PASI | 4,2 (1,85–6,9)a |
| Presença de comprometimento de localizações especiais | |
| Couro cabeludo | 57 (60,6) |
| Unha | 31 (33) |
| Região flexural | 24 (25,5) |
| Região genital | 21 (22,3) |
| Presença de artralgia | 46 (48,9) |
| Presença de artrite | 23 (24,5) |
| Histórico familiar positivo para psoríase | 26 (7,7) |
| Tratamentos anteriores | |
| Esteroides tópicos | 93 (98,9) |
| Tratamentos sistêmicos | 52 (55,3) |
| Fototerapia | 3 (3,2) |
| Agentes biológicos | 2 (2,1) |
| Tratamentos atuais | |
| Esteroides tópicos | 85 (90,4) |
| Tratamentos sistêmicos | 39 (41,5) |
| Fototerapia | 12 (12,8) |
| Agentes biológicos | 21 (22,3) |
| Doenças internas associadas e comorbidades | |
| Doenças cardiovasculares | 11 (11,7) |
| Outras doenças sistêmicas | 22 (22,2) |
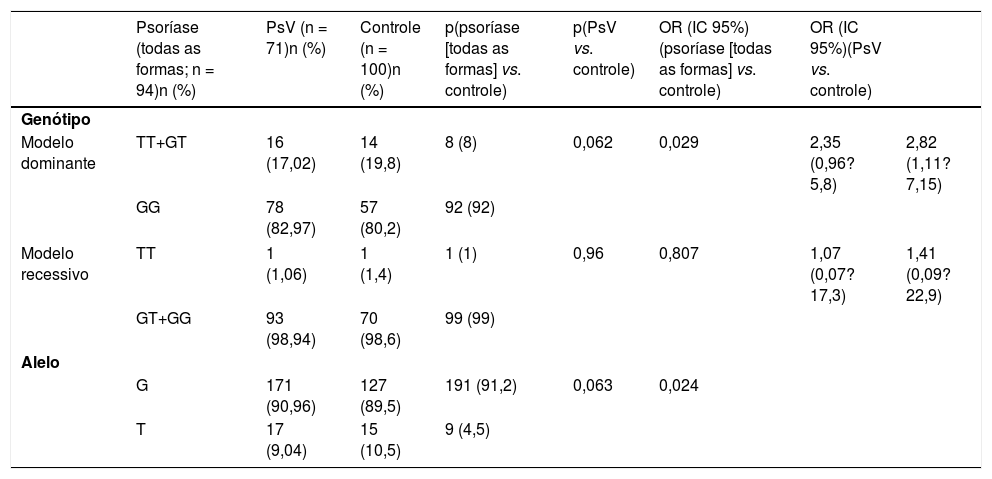
A frequência alélica e a distribuição do genótipo do gene CYP2J2 em pacientes com psoríase e controles estão descritas na tabela 3. O alelo T e o genótipo TT+GT no modelo dominante foram mais frequentes em pacientes com psoríase em comparação com os controles (frequência do alelo T 9,04% vs. 4,5% e frequência do genótipo TT+GT 17,02% vs. 8%), mas essa diferença clínica não foi estatisticamente significativa (p=0,063 e p=0,062, respectivamente). Os pacientes com psoríase foram divididos em dois subgrupos: vulgar (PsV) e não vulgar (nVP). A análise de subgrupos mostrou que as frequências do alelo T e do genótipo TT+GT eram maiores em pacientes com PsV em comparação com o grupo controle (p=0,024 e p=0,029, respectivamente), indicou que o polimorfismo do CYP2J2 estava associado a um aumento do risco de desenvolver PsV (OR=2,82; IC 95%: 1,11‐7,15; p=0,029).
Frequência alélica e distribuição de genótipos do gene CYP2J2 em pacientes com psoríase e controles
| Psoríase (todas as formas; n = 94)n (%) | PsV (n = 71)n (%) | Controle (n = 100)n (%) | p(psoríase [todas as formas] vs. controle) | p(PsV vs. controle) | OR (IC 95%)(psoríase [todas as formas] vs. controle) | OR (IC 95%)(PsV vs. controle) | ||
|---|---|---|---|---|---|---|---|---|
| Genótipo | ||||||||
| Modelo dominante | TT+GT | 16 (17,02) | 14 (19,8) | 8 (8) | 0,062 | 0,029 | 2,35 (0,96?5,8) | 2,82 (1,11?7,15) |
| GG | 78 (82,97) | 57 (80,2) | 92 (92) | |||||
| Modelo recessivo | TT | 1 (1,06) | 1 (1,4) | 1 (1) | 0,96 | 0,807 | 1,07 (0,07?17,3) | 1,41 (0,09?22,9) |
| GT+GG | 93 (98,94) | 70 (98,6) | 99 (99) | |||||
| Alelo | ||||||||
| G | 171 (90,96) | 127 (89,5) | 191 (91,2) | 0,063 | 0,024 | |||
| T | 17 (9,04) | 15 (10,5) | 9 (4,5) | |||||
PsV, psoríase vulgar.
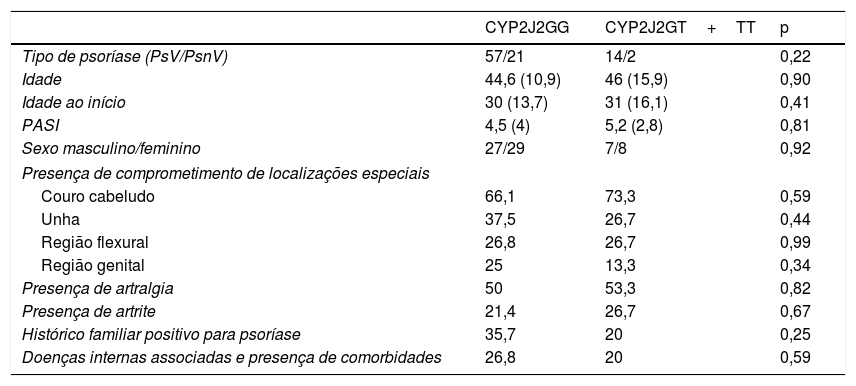
As características demográficas e as características da doença de pacientes com psoríase com genótipo GG (tipo selvagem) e genótipo GT+TT (polimorfismo homozigoto ou heterozigoto) foram comparadas e resumidas na tabela 4. Embora o grupo polimórfico apresentasse mais pacientes com PsV do que pacientes com PsnV (> 2 vezes), o resultado não foi estatisticamente significativo (p=0,22). A idade e o sexo dos pacientes, idade ao início da doença, PASI, presença de comprometimento de localizações especiais, presença de artralgia e artrite, histórico familiar positivo para psoríase, presença de doenças associadas e modalidades de tratamento foram semelhantes entre pacientes com psoríase com e sem polimorfismo.
Características demográficas e características da doença em pacientes com psoríase com genótipo GG e genótipo GT+TT
| CYP2J2GG | CYP2J2GT+TT | p | |
|---|---|---|---|
| Tipo de psoríase (PsV/PsnV) | 57/21 | 14/2 | 0,22 |
| Idade | 44,6 (10,9) | 46 (15,9) | 0,90 |
| Idade ao início | 30 (13,7) | 31 (16,1) | 0,41 |
| PASI | 4,5 (4) | 5,2 (2,8) | 0,81 |
| Sexo masculino/feminino | 27/29 | 7/8 | 0,92 |
| Presença de comprometimento de localizações especiais | |||
| Couro cabeludo | 66,1 | 73,3 | 0,59 |
| Unha | 37,5 | 26,7 | 0,44 |
| Região flexural | 26,8 | 26,7 | 0,99 |
| Região genital | 25 | 13,3 | 0,34 |
| Presença de artralgia | 50 | 53,3 | 0,82 |
| Presença de artrite | 21,4 | 26,7 | 0,67 |
| Histórico familiar positivo para psoríase | 35,7 | 20 | 0,25 |
| Doenças internas associadas e presença de comorbidades | 26,8 | 20 | 0,59 |
Este estudo investigou o possível papel do polimorfismo do CYP2J2 como fator de risco em pacientes com psoríase. Os resultados demonstram uma frequência significativamente mais alta do alelo T em pacientes com PsV e um risco aumentado de psoríase em pacientes com polimorfismo CYP2J2 no modelo dominante. Tanto quanto é do conhecimento dos autores, este é o primeiro estudo que investiga o papel do polimorfismo CYP2J2 na psoríase.
O CYP2J2 50G>T é um dos polimorfismos funcionais do CYP2J2 mais estudados. Spiecker et al. estudaram o efeito do polimorfismo CYP2J2 50G>T e observaram uma diminuição na ligação do fator de transcrição Sp1 ao DNA, uma redução na atividade do promotor e menores concentrações plasmáticas de EET em pacientes com polimorfismo G‐50T em comparação com participantes com tipo selvagem.19 EETs derivados do CYP2J2 induzem vasodilatação, inibem inflamação, apoptose e trombose e apresentam efeitos cardioprotetores.20 Ao alterar suas concentrações plasmáticas, o polimorfismo do CYP pode afetar o papel cardioprotetor dos EETs e desempenhar um papel na patogênese das doenças cardiovasculares.
O polimorfismo do CYP2J2 foi estudado principalmente em doenças cardiovasculares, apresentou resultados contraditórios entre diferentes grupos étnicos. Estudos que investigaram o polimorfismo CYP2J2 em doenças coronarianas revelaram um aumento do risco na população alemã, diminuição do risco em negros e nenhuma associação em brancos e na população sueca.18,19,21,22 Polonikov et al. evidenciaram um risco aumentado de hipertensão em pacientes russos; no entanto, essa associação não foi confirmada em negros ou brancos.23–25 Polonikov et al. também descreveram uma relação sexo‐específica entre o polimorfismo do CYP2J2 e a hipertensão em pacientes russas do sexo feminino.26 Não foi identificada associação significativa entre o polimorfismo CYP2J2 e acidente vascular cerebral nas populações sueca e chinesa.18,27 Estudos recentes também demonstraram que o CYP2J2 aumentou os níveis circulantes de EET e angiogênese induzida e melhorou a função cardíaca em ratos após infarto do miocárdio.28 As doenças cardiovasculares são comorbidades frequentes e importantes na psoríase. O presente estudo avaliou a associação entre polimorfismo do CYP2J2 e comorbidades cardiovasculares. Não foi observada uma associação significativa entre o polimorfismo do CYP2J2 e a frequência de comorbidade, sugeriu‐se que o CYP2J2 pode aumentar o risco do surgimento de PsV, mas não está associado a um risco aumentado de comorbidades cardiovasculares em pacientes com psoríase.
Além de seus efeitos cardiovasculares, os EETs derivados do CYP2J2 também modulam a inflamação.29 Node et al. estudaram o efeito dos EETs derivados do CYP2J2 na inflamação vascular. Seu estudo revelou que os EETs podem modular a resposta inflamatória pela inibição da expressão induzida por citocinas pró‐inflamatórias (TNF‐α, IL‐1α e lipopolissacarídio bacteriano) das moléculas de adesão endotelial vascular (VCAM‐1, ICAM‐1 e E‐selectin) e diminuir o número de leucócitos mononucleares móveis/aderentes.29 Os EETs também apresentam efeitos anti‐inflamatórios pela inibição do fator nuclear kappaB (NF‐κB) e IκB quinase, ativação dos receptores ativados pelo proliferador de peroxissoma, aumento da expressão da eNOS e regulação da homeostase do retículo endoplasmático.30
Embora o efeito anti‐inflamatório dos EETs esteja bem documentado, poucos estudos investigaram o polimorfismo do CYP2J2 em doenças inflamatórias. Wang et al. estudaram o polimorfismo do CYP2J2 em pacientes com diabetes mellitus. Embora não tenha sido observada diferença significativa entre pacientes diabéticos e um grupo controle, em pacientes diabéticos o polimorfismo do CYP2J2 demonstrou estar associado a menor idade de início.31 Os autores estudaram o polimorfismo CYP2J2 na psoríase, uma doença dermatológica inflamatória crônica, e observaram um risco aumentado de psoríase em pacientes com polimorfismo CYP2J2. Na análise agrupada, que incluiu todos os pacientes com psoríase, embora o polimorfismo do CYP tenha sido maior em pacientes com psoríase, os resultados não atingiram significância estatística. Na análise de subgrupos de subtipos de psoríase, observou‐se uma diferença estatisticamente significativa entre o polimorfismo CYP em pacientes com PsV e o grupo controle. O polimorfismo do CYP foi identificado como um fator de risco para PsV, mas não para PsnV. A psoríase é um distúrbio dermatológico inflamatório, no qual a suscetibilidade genética tem um efeito significativo na patogênese da doença. O histórico familiar de psoríase difere entre os grupos étnicos; a prevalência de histórico familiar positivo é estimada em aproximadamente 30%.32,33 PSORS1 e PSORS2 são dois dos loci de suscetibilidade mais conhecidos para a psoríase. O HLA‐C*06:02 está localizado no locus PSORS1 e o papel do HLA‐C*06:02 na psoríase é bem estabelecido. Estudos recentes confirmaram a importância do HLA‐C*06:02 na suscetibilidade genética da psoríase, bem como seu impacto na resposta ao tratamento.34 Juntamente com o HLA‐C*06:02, um grande estudo genético feito por Zhou et al. revelou vários novos locais de suscetibilidade, como HLA‐C*07:04, rs118179173, HLA‐B aminoácido 67, HLA‐DPB1*05:01 e BTNL2 aminoácido 281.35 O membro da família de recrutamento de caspase 14 (CARD14) está localizado no locus PSORS2 e ativa a via NF‐κB. O CARD14 foi classificado como um gene de suscetibilidade à psoríase e muitos estudos recentes se propuseram a demonstrar o papel do CARD14 na patogênese da psoríase. As mutações de ganho de função do CARD14 ativam a via de transdução de sinal NF‐κB e foi demonstrado que a atividade aumentada do NF‐κB devido a mutações no CARD14 está ligada à psoríase pustulosa.36 Zhu et al. também investigaram variantes do CARD14 em pacientes com PsV. O estudo revelou cinco mutações, mas as mutações também foram observadas no grupo controle e não foi possível estabelecer uma clara relação mutação‐doença.37 Tanaka et al. investigaram o papel imunológico de CARD14 no modelo murino de psoríase e demonstraram que a expressão do mRNA de IL‐23 e a infiltração de células T produtoras de IL‐17 diminuíram em camundongos com deficiência de CARD14.38 O estudo também mostrou que as alterações inflamatórias psoriasiformes da pele eram menores em camundongos com deficiência de CARD14, sugeriu o possível papel imunológico inflamatório da CARD14 na patogênese da psoríase.38 Além do PSORS1 e PSORS2, muitos loci de suscetibilidade à psoríase foram identificados com estudos de associação ampla do genoma (genome‐wide association studies [GWAS]). Tsoi et al. fizeram uma metanálise de GWAS e identificaram 16 novos locais de suscetibilidade que regulam I‐κB quinase/via NF‐κB e citotoxicidade e que respondem a estímulos externos e diferenciação de leucócitos.39 Além dessas variações genéticas, também foram identificadas algumas mutações e polimorfismos específicos do subtipo. Li et al. demonstraram que o polimorfismo no gene antagonista do receptor de IL‐36 (IL36RN) estava associado ao aumento do risco de psoríase pustulosa.40 Twelves et al. investigaram as frequências de mutação IL36RN entre diferentes subtipos de psoríase pustulosa e observaram que as mutações IL36RN eram mais frequentes entre pacientes com psoríase pustulosa generalizada.41 Estudos com diferentes antecedentes genéticos em diferentes subtipos de psoríase sugerem que a PsnV pode ser uma doença diferente, e não um subtipo de psoríase, o que é consistente com os presentes resultados.
No presente estudo, não foi observada associação entre o polimorfismo CYP2J2 e as características clínicas da psoríase. A maioria dos pacientes com psoríase incluídos no estudo estava em tratamento. Com o tratamento, as principais características clínicas, como PASI, comprometimento das unhas, artralgia e artrite podem ser modificadas.
Uma das limitações deste estudo é que ele não verificou as concentrações de EET e sua associação com o polimorfismo do CYP2J2. O polimorfismo do CYP2J2 pode contribuir para o processo inflamatório e a patogênese da psoríase pela alteração das concentrações de ETT; porém, mais estudos são necessários para compreender a relação entre psoríase e polimorfismo do CYP‐ETT. Outra limitação foi o número restrito de pacientes com psoríase com comorbidades cardiovasculares. O presente estudo não demonstrou relação entre o polimorfismo do CYP e as comorbidades, mas isso pode ser devido ao erro do tipo II (beta).
A base genética da psoríase é complexa e difere entre os grupos étnicos e os subtipos de psoríase. O polimorfismo CPY – como outros polimorfismos – pode variar entre os grupos étnicos. Para generalizar os presentes resultados, são necessários estudos adicionais com diferentes grupos étnicos e diferentes subtipos de psoríase.
Suporte financeiroBolsa de pesquisa da Sociedade Turca de Dermatologia (2017/53).
Contribuição dos autoresYıldız Hayran: Análise estatística; aprovação da versão final do manuscrito; concepção e planejamento do estudo; elaboração e redação do manuscrito; obtenção, análise e interpretação dos dados; participação efetiva na orientação da pesquisa; participação intelectual em conduta propedêutica e/ou terapêutica de casos estudados; revisão crítica da literatura; revisão crítica do manuscrito.
Nuran Allı: Aprovação da versão final do manuscrito; revisão crítica do manuscrito.
Pınar İncel Uysal: Elaboração e redação do manuscrito; obtenção, análise e interpretação dos dados.
Tuba Çandar: Participação efetiva na orientação da pesquisa; revisão crítica do manuscrito.
Conflitos de interesseNenhum.
Como citar este artigo: Hayran Y, Allı N, Uysal Pİ, Çandar T. Association of CYP2J2 polymorphism with susceptibility to psoriasis in Turkish population: a case‐control study. An Bras Dermatol. 2020;95:25–31.
Trabalho realizado no Departamento de Dermatologia, Ankara Numune Training and Research Hospital, Ankara, Turquia.