A ictiose arlequim (IA) é doença de pele rara com letalidade extremamente alta em decorrência da mutação do gene ABCA12. Em virtude de sua raridade e do início frequentemente tardio, a triagem pré‐natal para IA é extremamente difícil, e a maioria das gestantes pode facilmente perder o período adequado para realizar exames precisos.
ObjetivoResumir as características ultrassonográficas da IA para fins de diagnóstico pré‐natal.
MétodosOs autores descrevem um caso de IA sem histórico familiar, diagnosticado por meio de ultrassonografia pré‐natal. As características ultrassonográficas da IA e as características clínicas das gestantes foram resumidas por meio de pesquisa na literatura relevante ao longo de quase duas décadas.
ResultadosAs apresentações ultrassonográficas específicas, incluindo descamação da pele, mãos cerradas e pés tortos, ectrópio, nariz achatado, restrição de crescimento fetal, polidrâmnio e líquido amniótico ecogênico podem estar relacionadas especialmente a distúrbios de pele em fetos com IA. Também foi identificada nova mutação patogênica do gene ABCA12 e o possível mecanismo patogênico é explicado.
Limitações do estudoDeve‐se ter cuidado ao resumir as características da doença em virtude do pequeno número de casos; os autores enfrentaram a possibilidade de busca incompleta de casos.
ConclusõesA IA tem características ultrassonográficas relativamente únicas. Portanto, a ultrassonografia em 2D combinada com a ultrassonografia em 3D pode ser um método eficaz para o diagnóstico pré‐natal de IA. Além disso, uma nova mutação patogênica do gene ABCA12 pode fornecer pistas importantes para futuras pesquisas sobre a etiologia da IA. Entretanto, os autores consideram que estudos adicionais são necessários para fornecer mais evidências para o diagnóstico pré‐natal.
A ictiose arlequim (IA) é doença genética autossômica recessiva rara (prevalência de 1/300.000‐1/1.000.000) com alta taxa de mortalidade.1,2 Fetos com IA podem desenvolver alterações cutâneas graves durante o desenvolvimento, incluindo grandes e espessas escamas em forma de placas cobrindo todo o corpo, eclábio, ectrópio grave e orelhas achatadas, e progressão tardia para eritrodermia esfoliativa grave. Insuficiência respiratória, perda de líquido e calor, infecções de pele e distúrbios metabólicos eletrolíticos são as principais razões para o mau prognóstico da IA. Infelizmente, não há tratamento eficaz para a doença.3 Métodos confiáveis para o diagnóstico pré‐natal são, portanto, essenciais para a detecção neonatal de IA.
Antes de 2005, nenhum gene candidato para IA havia sido identificado, e o diagnóstico da doença dependia de histopatologia em biópsias intrauterinas da pele fetal entre 19 e 23 semanas.4–6 Entretanto, como esse método é invasivo e tecnicamente difícil, ele aumenta o risco de múltiplas complicações na gravidez. Portanto, depois que o gene ABCA12 foi identificado como o gene causador da IA, a análise da mutação do gene ABCA12 pela análise do líquido amniótico e sangue do cordão umbilical tornou‐se método eficaz para o diagnóstico pré‐natal de IA.7,8 No entanto, grávidas sem histórico familiar ou histórico de gravidez com IA muitas vezes optam por não realizar a triagem pré‐natal específica para IA utilizando os métodos mencionados acima. A ultrassonografia (US), contudo, como exame não invasivo e de baixo custo, parece ser método eficaz para o diagnóstico pré‐natal de IA.
No presente estudo, os autores realizaram com sucesso o diagnóstico pré‐natal utilizando US em 2D combinada com 3D em um feto com IA sem histórico familiar. Análise cromossômica por microarray (CMA, do inglês chromosomal microarray analysis) e análise da sequência de Sanger foram usadas para identificar anormalidades cromossômicas fetais e identificar a mutação patogênica do gene ABCA12.9,10 Além disso, pesquisando a literatura publicada sobre IA, os autores resumiram as características ultrassonográficas da doença.
MétodosFontes de dadosOs dados ultrassonográficos e clínicos da paciente foram obtidos do banco de dados médico eletrônico do Second Affiliated Hospital da Dalian Medical University. O dispositivo de diagnóstico por US colorida GE Voluson E8 com frequência de sonda definida de 2,5 a 5,0MHz foi usado no presente estudo. A análise por microarray de microRNA foi processada com um chip de microarray comercial de 750K, e as mutações foram detectadas por análise de dados da sequência de Sanger.
Estratégia de buscaA estratégia de busca no banco de dados MEDLINE/Pubmed utilizou as seguintes palavras‐chave: “Ichthyosis, Lamellar” e “Ultrasonography, Prenatal” [Mesh], adaptadas às demais bases de dados quando necessário.
ResultadosApresentação do casoO presente caso descreve uma paciente do sexo feminino, de 40 anos, gesta 1, para 0, que concebeu espontaneamente, sem histórico familiar de IA. A mãe negou histórico de medicação ou infecção e histórico de exposição ambiental adversa durante a gravidez. Os achados ultrassonográficos no início da gravidez, com 13 semanas, e os achados da US no exame durante o período intermediário da gravidez com 24 +3 semanas não mostraram anormalidades significantes; a transluscência nucal (TN) foi de 2,1mm. Os resultados da triagem pré‐natal não invasiva (NIPS, do inglês noninvasive prenatal screening) foram negativos. Até 30 +2 semanas de gestação, os demais exames pré‐natais foram normais.
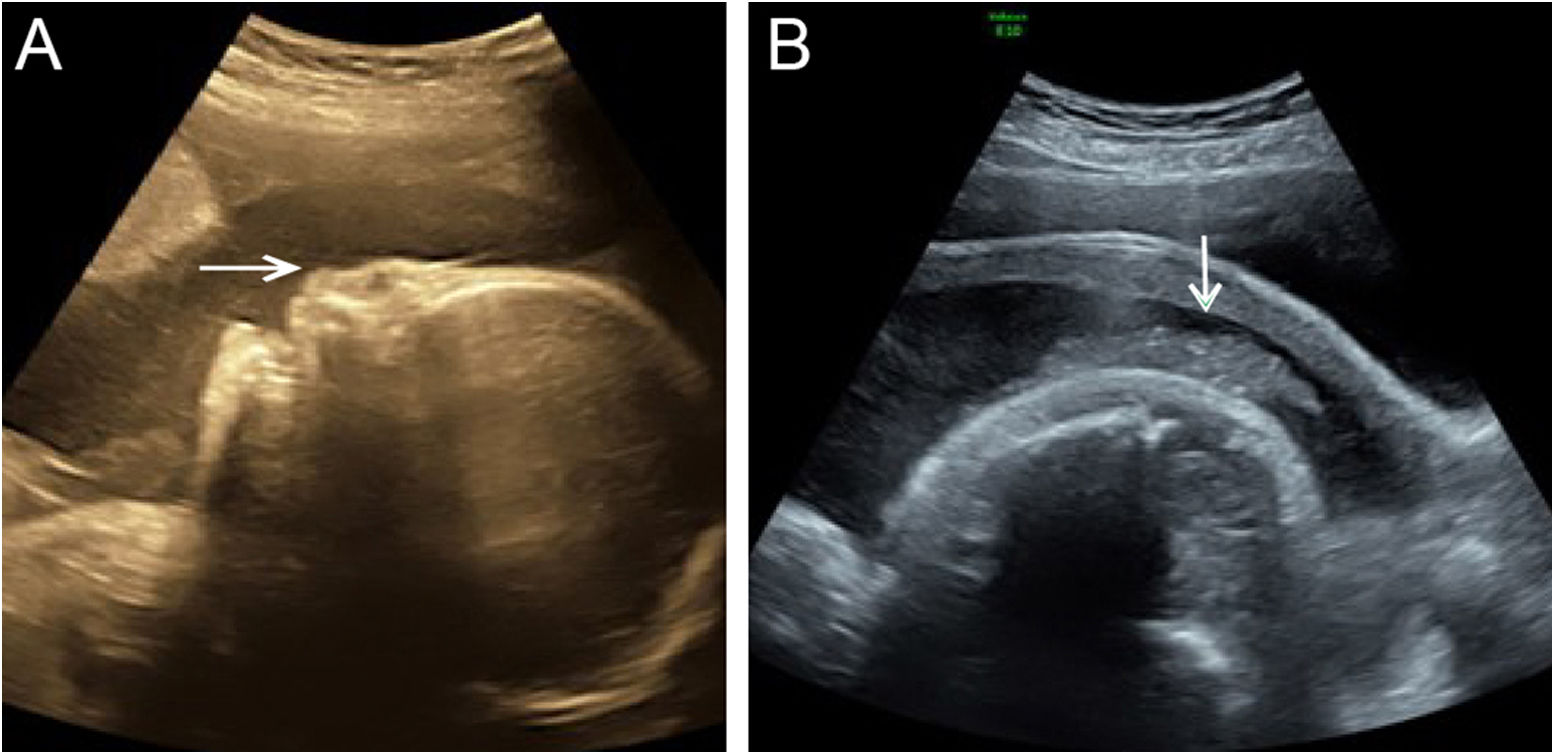
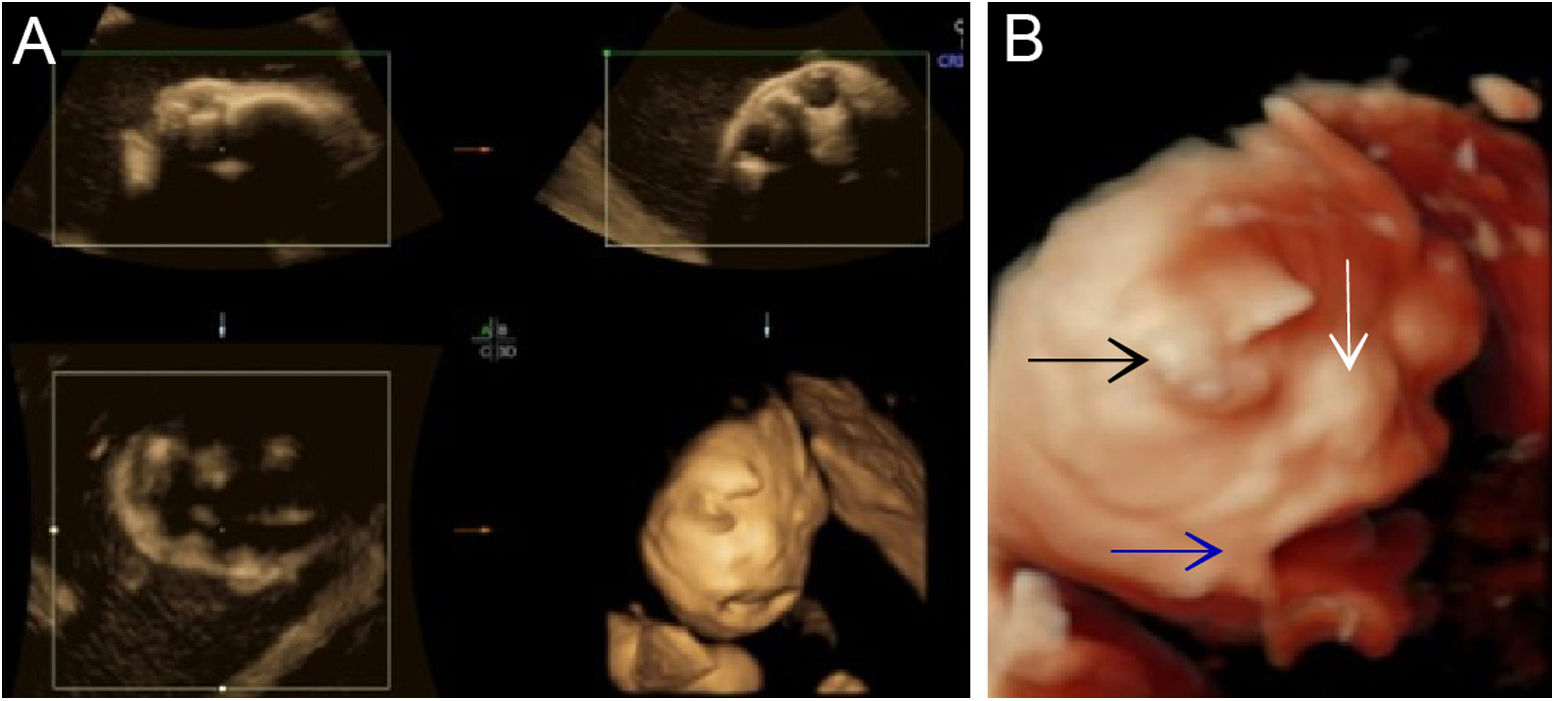
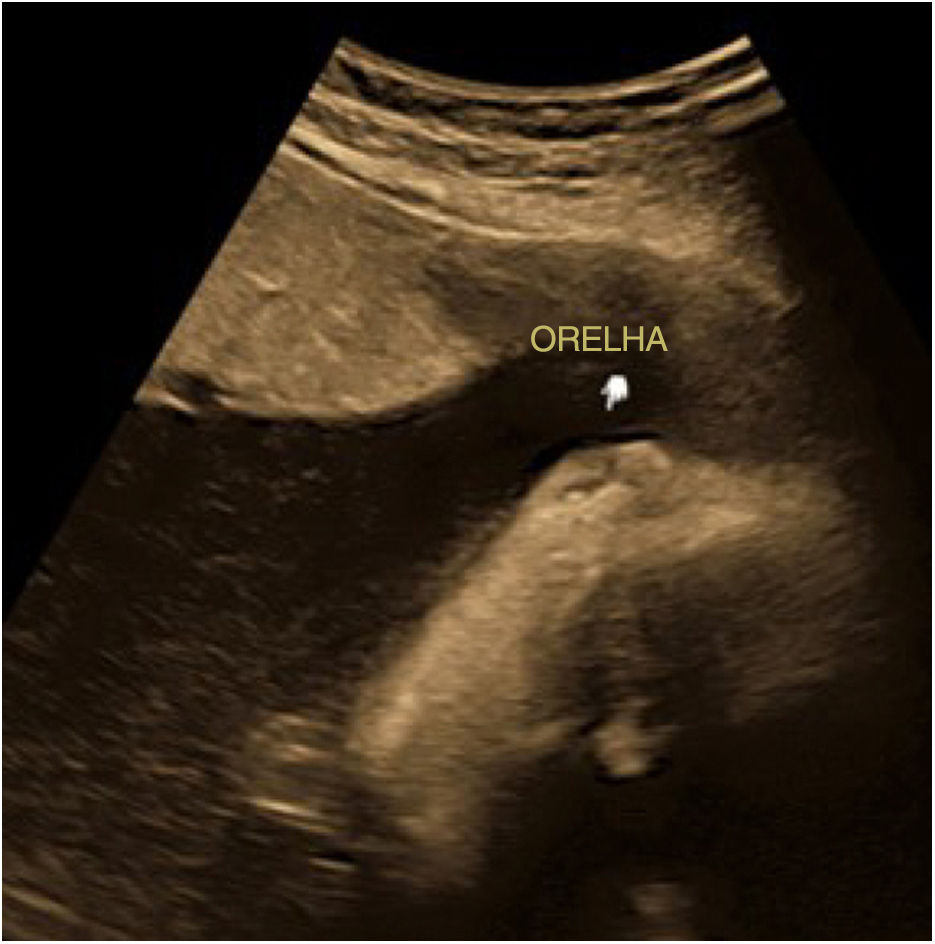
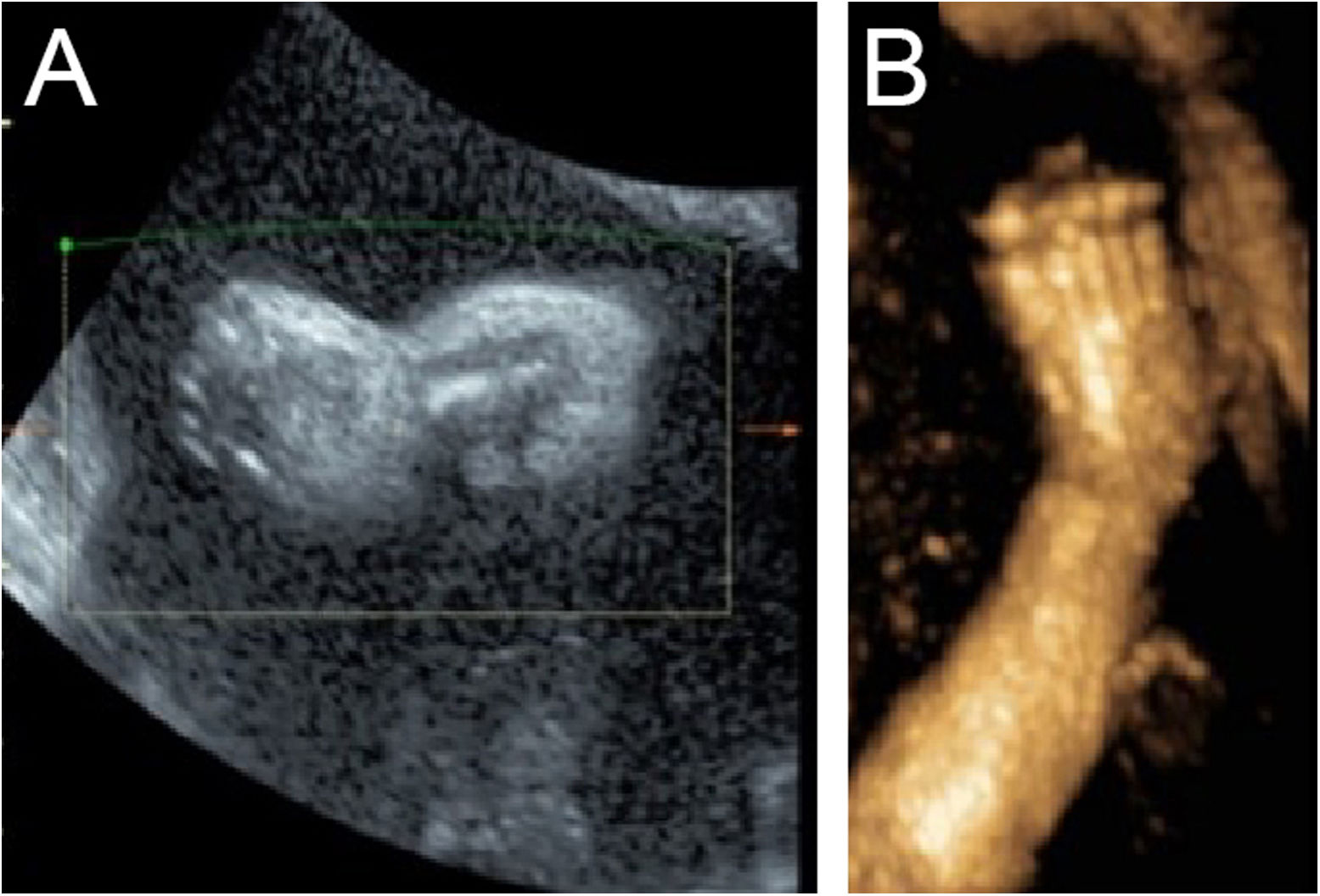
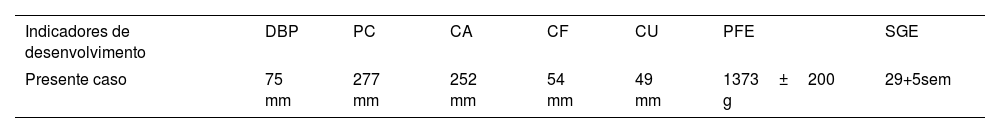
Embora o exame de US no final da gravidez com 30 +2 semanas não tenha sugerido nenhuma anormalidade significante dos indicadores de desenvolvimento (tabela 1), os autores observaram características ultrassonográficas típicas, incluindo nariz achatado, descamação da pele (fig. 1A,B), ectrópio, língua voltada para cima e fenda bucal anormalmente grande (semelhante à boca de peixe; fig. 2A,B), microtia (fig. 3) e índice de líquido amniótico (AFI, do inglês amniotic fluid index) de 340mm. Por outro lado, a avaliação por US de outros órgãos, como cérebro, coração e rins, foi normal e a imagem de fluxo por Doppler colorido (CDFI, do inglês color Doppler flow imaging) indicou ausência de anormalidade óbvia no sinal de fluxo sanguíneo da artéria cerebral média e da artéria umbilical.
Medidas ultrassonográficas dos parâmetros de desenvolvimento
| Indicadores de desenvolvimento | DBP | PC | CA | CF | CU | PFE | SGE |
|---|---|---|---|---|---|---|---|
| Presente caso | 75 mm | 277 mm | 252 mm | 54 mm | 49 mm | 1373±200 g | 29+5sem |
DBP, diâmetro biparietal; PC, perímetro cefálico; CA, circunferência abdominal; CF, comprimento do fêmur; CU, comprimento do úmero; PFE, peso fetal estimado; SGE, semana gestacional estimada.
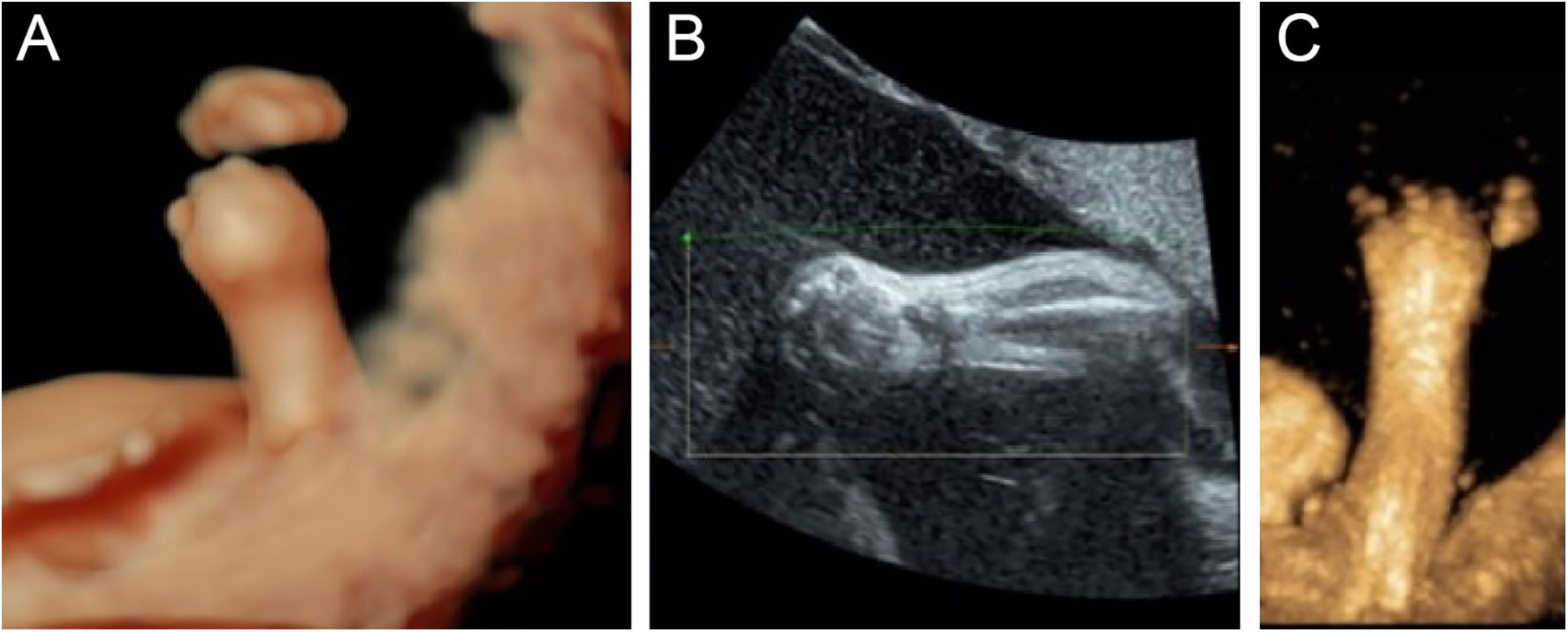
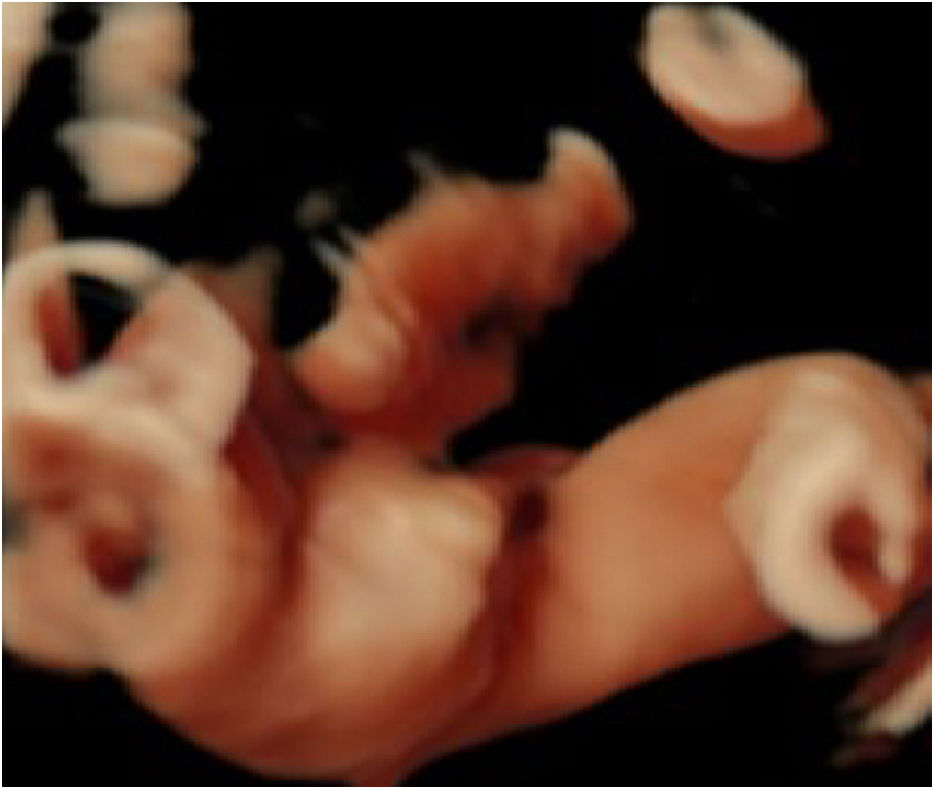
Para melhor observação, foi realizada reconstrução tridimensional (3D) da imagem; os achados foram os seguintes: edema de palmas, mãos cerradas, encurtamento de falanges e metacarpos (fig. 4 A‐C), pés tortos (fig. 5 A, B), testículos não descidos (fig. 6) e líquido amniótico ecogênico. Após aconselhamento, o casal decidiu interromper a gravidez e foi solicitado o teste genético. A pele do feto estava espessada, com fissuras profundas, difusamente eritematosa em todo o corpo, com aparência de “armadura”. O feto apresentava ectrópio, nariz achatado e pequeno. Foram observadas a abertura da boca e a protrusão da língua. Além disso, os membros eram rígidos e edematosos, as mãos cerradas, os pés voltados para dentro e os dedos das mãos e dos pés eram pequenos. Os testículos estavam ausentes no saco escrotal. Foi confirmado que o diagnóstico baseado na US pré‐natal havia sido preciso (fig. 7).
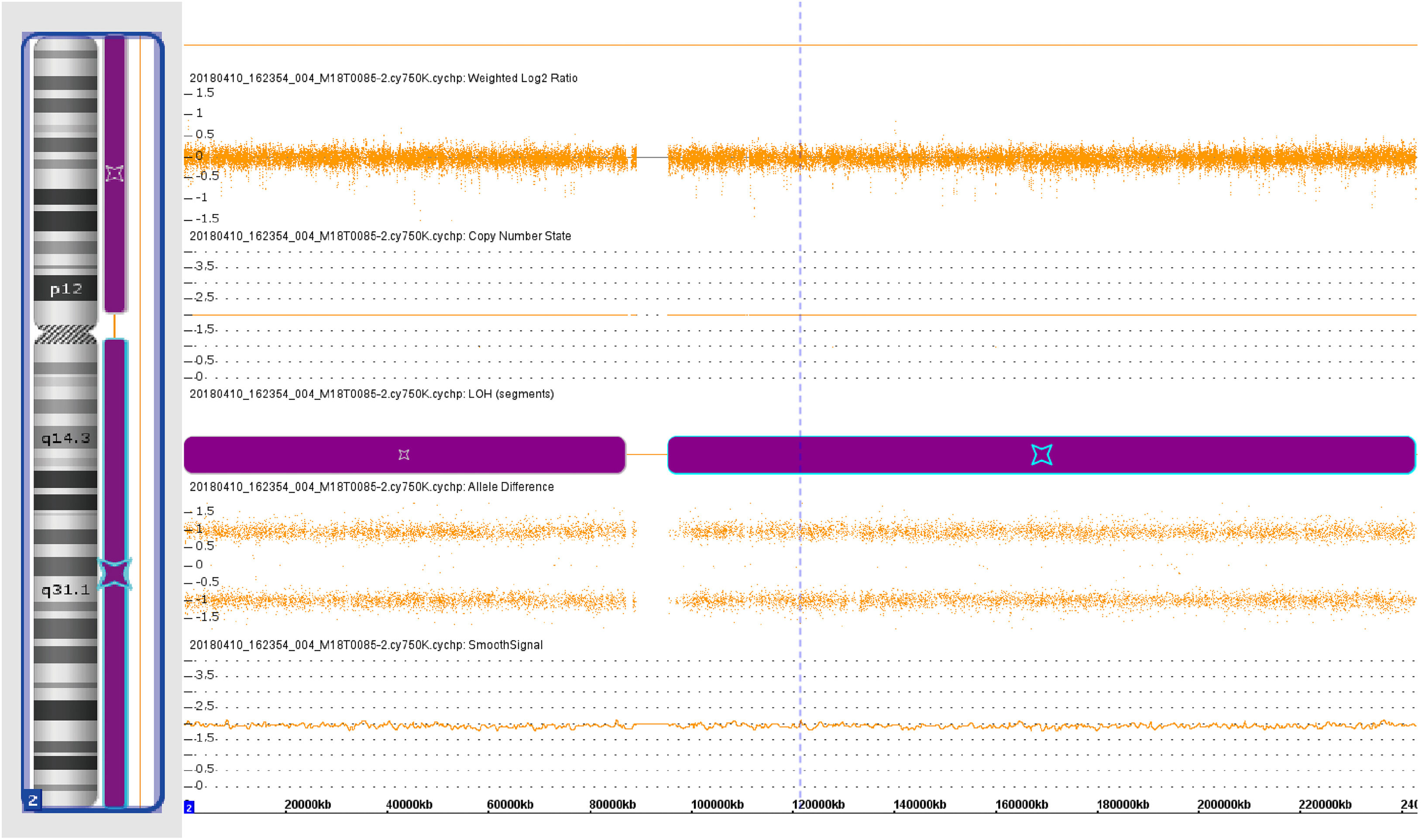
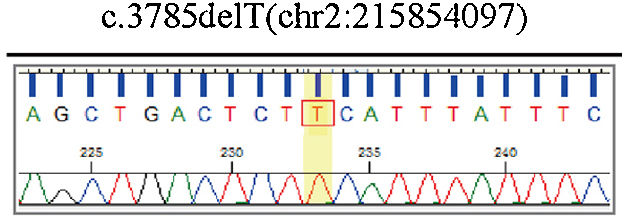
Os resultados preliminares dos ensaios de microarray cromossômicos sugeriram que as informações do genótipo revelaram perda de heterozigosidade (LOH, do inglês loss of heterozigosity) no cromossomo 2 (fig. 8). Além disso, mutação patogênica no gene ABCA12 (ABCA12:c.3785delT) em homozigose foi identificada com base no resultado da análise da sequência de Sanger (fig. 9).
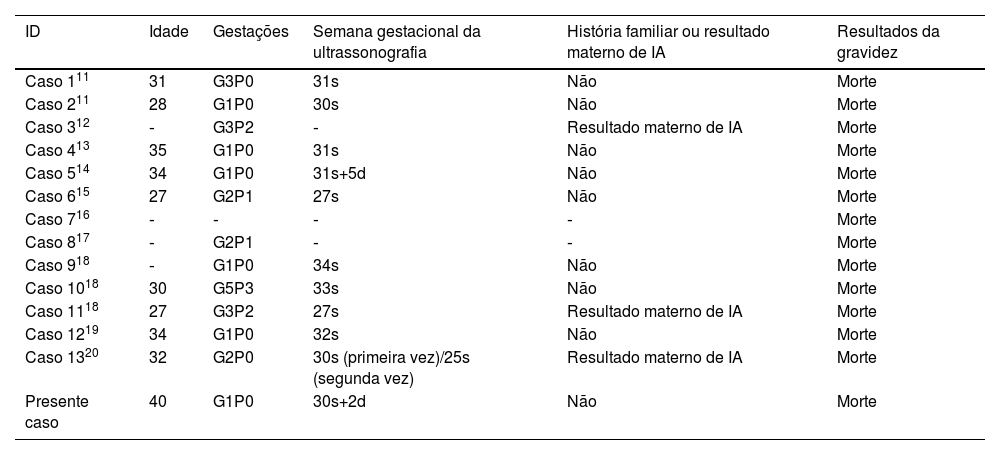
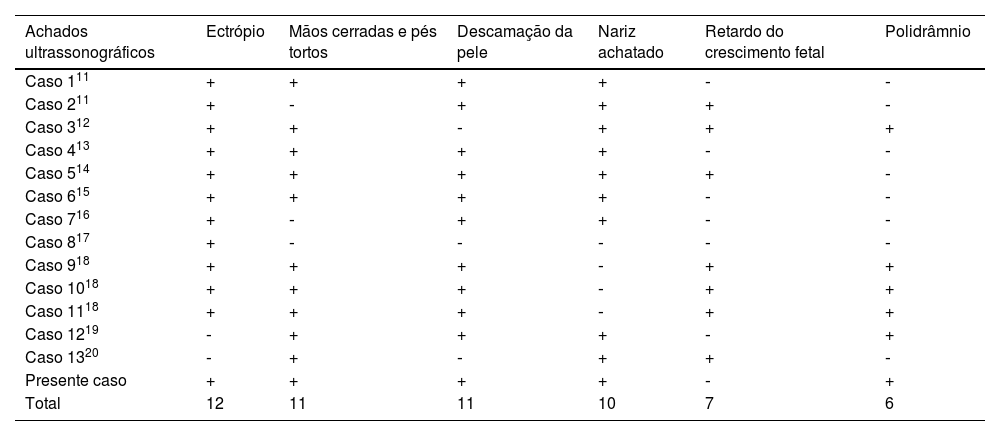
Pesquisa na literaturaPor meio da pesquisa dos casos publicados, foram identificados 13 casos de IA diagnosticados por US pré‐natal. Ao integrar características clínicas e ultrassonográficas de todos os casos, foi observado que a idade materna oscilou em uma ampla faixa de 27 a 40 anos e que a proporção de pacientes com história familiar foi baixa (3/13). O início da IA concentrou‐se no terceiro trimestre da gravidez e nenhum dos fetos com IA sobreviveu (tabela 2).11–20 Os autores analisaram e resumiram 13 características ultrassônicas típicas da IA (tabela 3).11–20 Descamação da pele, mãos cerradas e pés tortos, ectrópio, nariz achatado, retardo do crescimento fetal, polidrâmnio e líquido amniótico ecogênico são as mais frequentes (≥ 5). Além disso, como no presente caso, os autores encontraram fetos com IA que apresentavam associação de microtia, encurtamento de falanges e metacarpos, com anomalias genitais (testículos não descidos), que raramente ou nunca foram mencionados em relatos anteriores.
Características clínicas e resultados da gravidez em todos os casos
| ID | Idade | Gestações | Semana gestacional da ultrassonografia | História familiar ou resultado materno de IA | Resultados da gravidez |
|---|---|---|---|---|---|
| Caso 111 | 31 | G3P0 | 31s | Não | Morte |
| Caso 211 | 28 | G1P0 | 30s | Não | Morte |
| Caso 312 | ‐ | G3P2 | ‐ | Resultado materno de IA | Morte |
| Caso 413 | 35 | G1P0 | 31s | Não | Morte |
| Caso 514 | 34 | G1P0 | 31s+5d | Não | Morte |
| Caso 615 | 27 | G2P1 | 27s | Não | Morte |
| Caso 716 | ‐ | ‐ | ‐ | ‐ | Morte |
| Caso 817 | ‐ | G2P1 | ‐ | ‐ | Morte |
| Caso 918 | ‐ | G1P0 | 34s | Não | Morte |
| Caso 1018 | 30 | G5P3 | 33s | Não | Morte |
| Caso 1118 | 27 | G3P2 | 27s | Resultado materno de IA | Morte |
| Caso 1219 | 34 | G1P0 | 32s | Não | Morte |
| Caso 1320 | 32 | G2P0 | 30s (primeira vez)/25s (segunda vez) | Resultado materno de IA | Morte |
| Presente caso | 40 | G1P0 | 30s+2d | Não | Morte |
O símbolo “‐” indica dados anteriormente não mencionados na literatura.
IA, ictiose arlequim.
Treze características ultrassonográficas típicas de IA nos casos publicados
| Achados ultrassonográficos | Ectrópio | Mãos cerradas e pés tortos | Descamação da pele | Nariz achatado | Retardo do crescimento fetal | Polidrâmnio |
|---|---|---|---|---|---|---|
| Caso 111 | + | + | + | + | ‐ | ‐ |
| Caso 211 | + | ‐ | + | + | + | ‐ |
| Caso 312 | + | + | ‐ | + | + | + |
| Caso 413 | + | + | + | + | ‐ | ‐ |
| Caso 514 | + | + | + | + | + | ‐ |
| Caso 615 | + | + | + | + | ‐ | ‐ |
| Caso 716 | + | ‐ | + | + | ‐ | ‐ |
| Caso 817 | + | ‐ | ‐ | ‐ | ‐ | ‐ |
| Caso 918 | + | + | + | ‐ | + | + |
| Caso 1018 | + | + | + | ‐ | + | + |
| Caso 1118 | + | + | + | ‐ | + | + |
| Caso 1219 | ‐ | + | + | + | ‐ | + |
| Caso 1320 | ‐ | + | ‐ | + | + | ‐ |
| Presente caso | + | + | + | + | ‐ | + |
| Total | 12 | 11 | 11 | 10 | 7 | 6 |
| Achados ultrassonográficos | Líquido amniótico ecogênico | ‘Boca de peixe’ | Macroglossia | Edema subcutâneo | Micrognatia | Microcefalia | Cordão umbilical curto |
|---|---|---|---|---|---|---|---|
| Caso 111 | + | + | ‐ | ‐ | ‐ | ‐ | ‐ |
| Caso 211 | + | ‐ | ‐ | + | ‐ | ‐ | ‐ |
| Caso 312 | ‐ | ‐ | ‐ | ‐ | + | ‐ | + |
| Caso 413 | ‐ | + | ‐ | ‐ | ‐ | ‐ | ‐ |
| Caso 514 | + | + | + | + | + | + | ‐ |
| Caso 615 | ‐ | ‐ | ‐ | ‐ | ‐ | ‐ | ‐ |
| Caso 716 | ‐ | ‐ | + | ‐ | ‐ | ‐ | ‐ |
| Caso 817 | ‐ | ‐ | ‐ | ‐ | ‐ | ‐ | ‐ |
| Caso 918 | ‐ | ‐ | ‐ | ‐ | ‐ | ‐ | ‐ |
| Caso 1018 | ‐ | ‐ | ‐ | ‐ | ‐ | ‐ | ‐ |
| Caso 1118 | ‐ | ‐ | ‐ | ‐ | ‐ | ‐ | ‐ |
| Caso 1219 | + | ‐ | + | ‐ | ‐ | ‐ | ‐ |
| Caso 1320 | ‐ | ‐ | ‐ | ‐ | ‐ | + | ‐ |
| Presente caso | + | + | + | + | ‐ | ‐ | ‐ |
| Total | 5 | 4 | 4 | 3 | 2 | 2 | 1 |
Os símbolos “+” ou “‐” representam características ultrassonográficas de presença ou ausência, respectivamente.
A IA é genodermatose rara com alta letalidade, não havendo tratamento eficaz para a doença. Com base nos resultados deste estudo, foi encontrada uma ampla faixa etária materna de casos de IA (variando de 27 a 40 anos) e nenhuma anormalidade significante nos exames do primeiro e segundo trimestres. Em virtude de sua raridade e do período de início, a triagem pré‐natal para IA é extremamente difícil, e a maioria das mulheres grávidas, especialmente aquelas sem histórico familiar, pode facilmente perder o período adequado para realizar exames precisos, como a detecção de alterações moleculares no líquido amniótico e no sangue do cordão umbilical.11 Entretanto, algumas características ultrassonográficas específicas da IA podem ser detectadas no exame ultrassonográfico no final da gravidez (variando de 27 a 34 semanas). Espera‐se que o uso pré‐natal da US, em virtude da ausência de radiação ionizante, sua conveniência e aplicabilidade clínica, seja ferramenta eficaz para a triagem pré‐natal de IA.
No presente estudo, os autores resumiram as principais características ultrassonográficas de IA pesquisando a literatura relevante, e os resultados são apresentados na tabela 3.11–20 As características com ocorrência em mais de cinco casos foram as seguintes: (1) descamação da pele; (2) mãos cerradas e pés tortos; (3) ectrópio; (4) nariz achatado; (5) retardo do crescimento fetal; (6) polidrâmnio; (7) líquido amniótico ecogênico. Os autores acreditam que as apresentações ultrassonográficas específicas descritas acima podem estar relacionadas principalmente a alterações da pele em fetos com IA. Por exemplo, o espessamento anormal da pele pode limitar o movimento dos membros fetais e afetar o crescimento e desenvolvimento intrauterinos. Como o líquido amniótico e a pele fetal apresentam difusão livre durante a gravidez,21 isso também parece explicar por que a IA pode causar polidrâmnio. A descamação da pele também é considerada uma das causas do líquido amniótico ecogênico.
A observação tridimensional permitiu aos autores obter mais informações visuais de imagens estereoscópicas e descobrir as características ultrassonográficas específicas da IA. Além disso, a maioria dos casos de IA apresenta polidrâmnio, o que favorece a aquisição de imagens tridimensionais.22 Portanto, os autores declaram que a combinação de US em 2D e 3D pode ser de maior utilidade para o diagnóstico pré‐natal de IA.
O gene ABCA12, localizado na membrana celular, é um transportador de lipídios de queratinócitos epidérmicos e o defeito no ABCA12 leva à quebra da barreira lipídica da pele.8,23 Os resultados da análise de microarray cromossômico do presente caso mostraram a perda de heterozigosidade (LOH) no cromossomo 2. A análise de sequenciamento do gene ABCA12 identificou uma nova mutação ‐ ABCA12:c.3785delT. A mutação ABCA12:c.3785delT é uma mutação frameshift e de deleção que faz com que a fenilalanina se converta em serina em sua cadeia peptídica codificadora e gere um códon de terminação prematura na posição 42 do novo frame de leitura. Carregar códons de parada prematura pode gerar proteínas truncadas24 e induzir um processo de degradação do mRNA chamado decaimento do mRNA mediado por nonsense.25 Essas causas levam à perda de função da proteína original (p.Phe1262Serfs*42). Os achados do presente caso fornecem novas pistas para uma investigação mais aprofundada sobre a patogênese da IA.
ConclusãoA IA tem características ultrassonográficas relativamente específicas; portanto, o exame sistemático de mulheres grávidas utilizando US em 2D combinado com 3D no terceiro trimestre da gravidez pode reduzir drasticamente a taxa de diagnósticos não realizados ou errados de IA. Além disso, uma nova mutação patogênica no gene ABCA12 foi identificada, a qual explicou o possível mecanismo patogênico.
Suporte financeiroNenhum.
Contribuição dos autoresZesi Liu: Aprovação da versão final do manuscrito; revisão crítica da literatura; participação efetiva na orientação da pesquisa; elaboração e redação do manuscrito; concepção e planejamento do estudo.
Chunli Jing: Aprovação da versão final do manuscrito; participação efetiva na orientação da pesquisa; obtenção, análise e interpretação dos dados; revisão crítica do manuscrito; concepção e planejamento do estudo.
Conflito de interessesNenhum.