A queilite actínica (QA) é condição inflamatória crônica potencialmente maligna que pode progredir para carcinoma espinocelular do lábio. A radiação ultravioleta é o principal fator associado ao desenvolvimento da QA.1‐3 A exposição crônica à radiação ultravioleta leva à geração de espécies reativas de oxigênio que podem causar modificações oxidativas nas bases do DNA, principalmente na guanina, gerando 8‐hidroxi‐2’‐desoxiguanosina (8‐OHdG), que pode desencadear mutações genéticas e, portanto, tem sido utilizada como marcador sensível de dano oxidativo e como fator prognóstico para câncer de pele, de pulmão, de esôfago, de mama, de cólon e linfoma, entre outros.4,5
Trata‐se de estudo retrospectivo, descritivo e semiquantitativo da expressão imuno‐histoquímica da proteína 8‐OHdG no epitélio de revestimento de 57 amostras de QA. O estudo foi aprovado pelo Comitê de Ética da Universidade Federal do Rio Grande do Norte (Protocolo n° 3.476.834).
Para o estudo morfológico, foram obtidos cortes de 5μm do material emblocado em parafina, montados em lâminas de vidro e corados pelo método da hematoxilina & eosina. Os cortes histológicos foram examinados e classificados como sem ou com displasia epitelial que foi graduada como displasia leve, moderada ou grave de acordo com os critérios morfológicos da Organização Mundial da Saúde (OMS).6
Para a análise imuno‐histoquímica, o material tratado com o anticorpo anti‐8‐OHdG (Santa Cruz Biotechnology Cat# sc‐66036, RRID: AB 832272) foi examinado por dois avaliadores previamente calibrados e cegados. A análise foi realizada por microscopia óptica nos aumentos de 100× e 400× no componente epitelial em toda a lesão, cuja extensão foi determinada pela área de elastose solar no tecido conjuntivo e por alterações epiteliais, se presentes. Os casos foram categorizados com base em escore de imunorreatividade. Para esse propósito, a intensidade da coloração foi avaliada primeiramente no epitélio e classificada da seguinte maneira: 0 (negativa), 1 (fraca), 2 (moderada) e 3 (forte). Foi considerada a intensidade predominante em cada caso. A imunomarcação foi analisada semiquantitativamente, atribuindo‐se os seguintes escores: 0 (negativo), 1 (1% a 50% de células positivas) e 2 (51% a 100% de células positivas). As células epiteliais que exibiam coloração marrom no núcleo e/ou citoplasma foram classificadas como positivas.5,7 O escore de imunorreatividade foi então calculado multiplicando‐se o escore de intensidade da coloração pelo escore da porcentagem de células positivas. O escore final de cada caso variou de 0 a 6, em que 0‐2 = imunorreatividade fraca, 3‐4 = imunorreatividade moderada e 5‐6=imunorreatividade forte.
Houve predomínio de pacientes do sexo masculino (72,2%) e brancos (64,9%), não fumantes ou ex‐fumantes (49,2%), com idade igual ou superior a 40 anos (93%) e com história de exposição crônica à radiação ultravioleta (66,7%). Manchas brancas foram a característica clínica mais frequente nos casos estudados (56,1%), seguidas de placa branca e descamação; ulceração foi menos comum (10,5%; tabela 1).
Distribuição amostral de acordo com os dados demográficos e características clínicas da queilite actínica
| n | % | |
|---|---|---|
| Gênero | ||
| Masculino | 44 | 72,2 |
| Feminino | 13 | 22,8 |
| Idade (anos) | ||
| <40 | 4 | 7,0 |
| ≥ 40 | 53 | 93,0 |
| Etniaa | ||
| Branca | 37 | 64,9 |
| Negra | 15 | 26,3 |
| Tabagismoa | ||
| Não fumante | 11 | 19,3 |
| Fumante | 4 | 7,0 |
| Ex‐fumante | 17 | 29,8 |
| Descamação | ||
| Sim | 27 | 47,4 |
| Não | 30 | 52,6 |
| Mancha branca | ||
| Sim | 32 | 56,1 |
| Não | 25 | 43,9 |
| Placa branca | ||
| Sim | 28 | 49,1 |
| Não | 29 | 50,9 |
| Eritema | ||
| Sim | 25 | 43,9 |
| Não | 32 | 56,1 |
| Úlcera | ||
| Sim | 6 | 10,5 |
| Não | 51 | 89,5 |
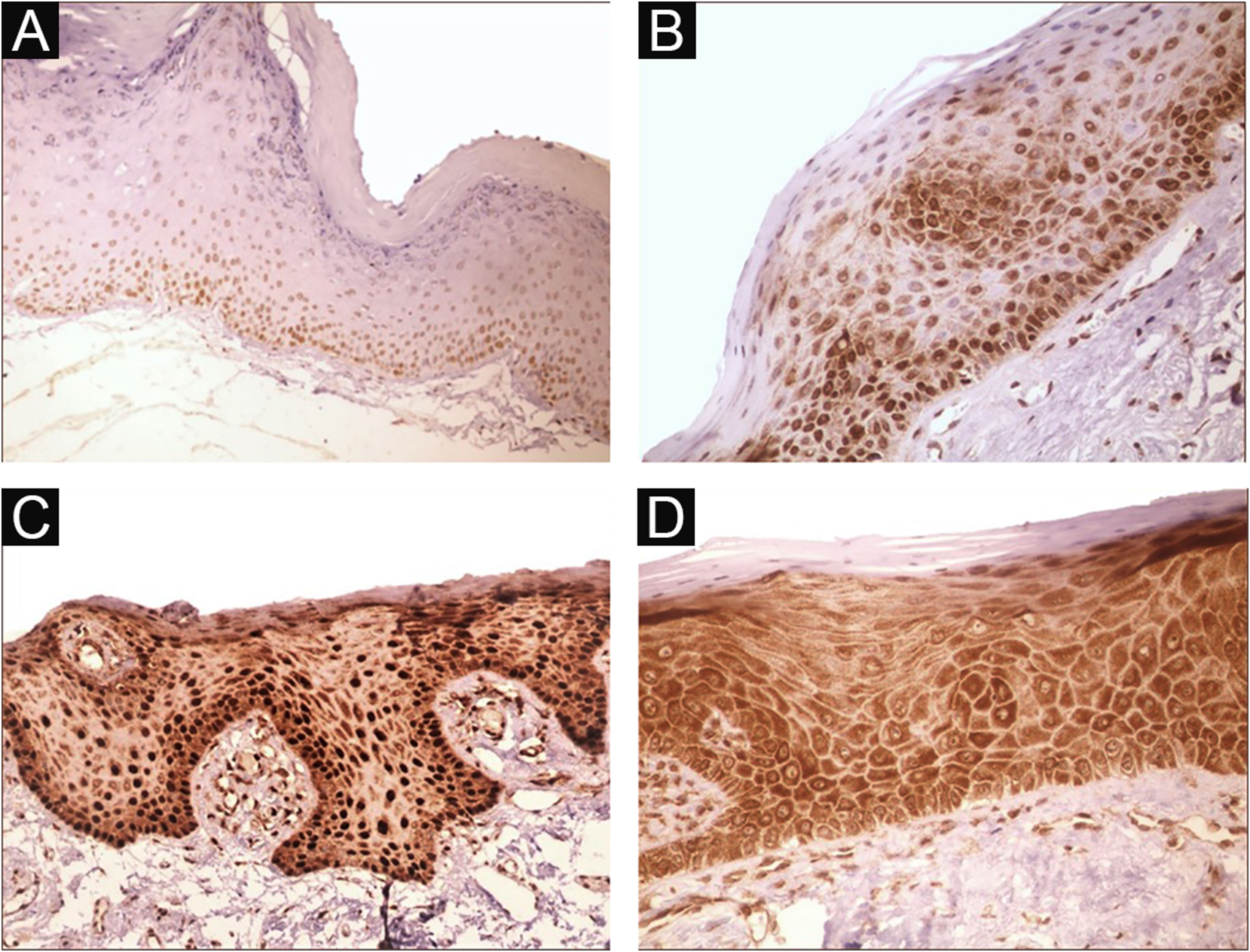
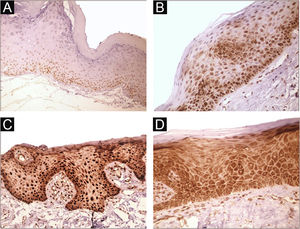
Imunomarcação nas células epiteliais foi observada em 100% dos casos analisados, principalmente nas camadas basal e parabasal do epitélio. A imunomarcação foi predominantemente nuclear com coloração citoplasmática de pequena intensidade em 39,6% dos casos e coloração predominantemente citoplasmática em 12,1%, enquanto a mesma intensidade foi observada no núcleo e citoplasma de 48,3% dos casos. Forte imunorreatividade ao anticorpo foi detectada em 64,9% dos casos (fig. 1). A imunomarcação no núcleo e no citoplasma pode ser explicada pelo fato de que 8‐OHdG é encontrada tanto no DNA nuclear quanto no mitocondrial.8,9
Perfil de expressão de 8‐OHdG na queilite actínica (QA). (A) Escore de imunorreatividade 1 em QA sem displasia epitelial (100×). (B) Escore de imunorreatividade 2 em QA com displasia epitelial de pequeno grau. Notar o predomínio da imunomarcação nuclear (200×). (C) Escore de imunorreatividade 3 em QA com displasia epitelial moderada. Notar o predomínio da imunomarcação nuclear (200×). (D) Escore de imunorreatividade 3 em QA com displasia epitelial moderada. Notar o predomínio de coloração citoplasmática (200×).
O estresse oxidativo no DNA estava presente independentemente das características clínicas das lesões. Não foram encontradas diferenças estatisticamente significantes na expressão de 8‐OHdG de acordo com as características clínicas das lesões (p>0,05; tabela 2) ou presença de tabagismo (p=0,266; tabela 3). Prabhulkar e Li monitoraram a cinética de liberação de 8‐OhdG na superfície de uma célula epitelial pulmonar exposta à nicotina para avaliar o dano oxidativo causado pelo tabaco; os autores observaram que quanto maior o nível de exposição celular à nicotina, maior o dano oxidativo ao DNA, promovendo aumento no nível de 8‐OhdG secretada pela célula.8 Nas amostras do presente estudo, foram observados danos oxidativos ao DNA demonstrados pela presença de 8‐OhdG, independentemente da exposição dos indivíduos ao tabaco.
Tamanho amostral, mediana, 25° e 75° quartis e significância estatística (p) para escore de imunorreatividade da 8‐OHdG de acordo com as características clínicas da queilite actínica
| Variável | Imunorreatividade da 8‐OHdG | |||
|---|---|---|---|---|
| n | Mediana | Q25‐Q75 | p | |
| Descamação | 0,741 | |||
| Sim | 27 | 3,00 | 2,00‐3,00 | |
| Não | 30 | 3,00 | 1,75‐3,00 | |
| Mancha branca | 0,506 | |||
| Sim | 32 | 3,00 | 2,00‐3,00 | |
| Não | 25 | 3,00 | 1,50‐3,00 | |
| Placa branca | 0,479 | |||
| Sim | 28 | 3,00 | 1,25‐3,00 | |
| Não | 29 | 3,00 | 2,00‐3,00 | |
| Eritema | 0,087 | |||
| Sim | 25 | 3,00 | 1,00‐3,00 | |
| Não | 32 | 3,00 | 2,25‐3,00 | |
| Úlcera | 0,065 | |||
| Sim | 6 | 1,50 | 1,00‐3,00 | |
| Não | 51 | 3,00 | 2,00‐3,00 | |
Teste de Mann‐Whitney.
Tamanho amostral, mediana, 25° e 75° quartis e significância estatística (p) para o escore final de imunorreatividade da 8‐OHdG de acordo com o tabagismo
| Variável | Imunorreatividade da 8‐OHdG | |||
|---|---|---|---|---|
| n | Mediana | Q25‐Q75 | p | |
| Fumante | 4 | 3,00 | 3,00‐3,00 | |
| Não fumante | 11 | 3,00 | 1,00‐3,00 | 0,266 |
| Ex‐fumante | 17 | 3,00 | 1,50‐3,00 | |
Teste de Kruskal‐Wallis.
A classificação histopatológica revelou algum grau de displasia epitelial em 87,7% dos casos. Displasia epitelial de pequeno grau foi a mais comum (38,6%), seguida pela displasia epitelial moderada (29,8%) e acentuada (19,3%). Displasia epitelial esteve ausente em 12,3% dos casos. Forte imunorreatividade foi observada na maioria dos casos, independentemente da presença de displasia epitelial ou de seu grau. Não foi observada diferença significante na expressão de 8‐OhdG entre os diferentes graus de displasia epitelial oral (p=0,225; tabela 4). De maneira similar, Yoshifuku et al. também encontraram predominância de forte imunorreatividade com 8OHdG em lesões de ceratose actínica (presença de displasia epitelial de pequeno grau ou moderada) e doença de Bowen (displasia epitelial acentuada).5 Esses achados podem ser explicados pelo fato de que a exposição crônica à radiação ultravioleta desencadeia a produção contínua de espécies reativas de oxigênio e estresse oxidativo e, consequentemente, a formação constante de 8‐OHdG.
Tamanho amostral, mediana, 25° e 75° quartis e significância estatística (p) para escore de imunorreatividade da 8‐OHdG de acordo com a classificação da OMS para displasia epitelial oral
| Classificação da OMS | Imunorreatividade da 8‐OHdG | |||
|---|---|---|---|---|
| n | Mediana | Q25‐Q75 | p | |
| Sem displasia | 7 | 3,00 | 3,00‐3,00 | |
| Displasia epitelial de pequeno grau | 22 | 3,00 | 2,00‐3,00 | 0,225 |
| Displasia epitelial moderada | 17 | 3,00 | 3,00‐3,00 | |
| Displasia epitelial acentuada | 11 | 3,00 | 2,50‐3,00 | |
Teste de Kruskal‐Wallis.
Embora a expressão de 8‐OHdG seja útil para a avaliação do dano oxidativo ao DNA e esteja bem estabelecida como indicador prognóstico em diferentes tipos de câncer, com evidências sugerindo que o dano oxidativo ao DNA por meio da formação de 8‐OHdG está envolvido na patogênese e progressão do carcinoma espinocelular,7,8,10 os presentes resultados apontam para dificuldades na utilização desse marcador para estabelecer associação com características clinicodemográficas e com o grau morfológico da queilite actínica, uma vez que a 8‐OHdG foi expressa de modo marcante na maioria dos casos analisados.
Os resultados do presente estudo confirmam que o estresse oxidativo por danos ao DNA desempenha papel na queilite actínica, como sugerido pela forte expressão imuno‐histoquímica de 8‐OHdG nos casos analisados. Entretanto, a falta de diferença significante na imunorreatividade anti‐8‐OHdG entre diferentes graus de displasia epitelial oral e fatores clinicodemográficos demonstra que esse marcador está alterado independentemente das características clínicas e do grau de displasia epitelial, e as modificações oxidativas da base do DNA são um evento inicial na carcinogênese labial. Assim, tratamentos medicamentosos adjuvantes que minimizem os danos causados pelo estresse oxidativo, como agentes antioxidantes tópicos, podem ser medidas terapêuticas úteis em pacientes com queilite actínica.
Suporte financeiroNenhum.
Contribuição dos autoresCíntia Barreto de Oliveira Varela: Obtenção, análise e interpretação dos dados; revisão crítica da literatura; elaboração e redação do manuscrito; aprovação da versão final do manuscrito.
Cristianne Kalinne Santos Medeiros: Obtenção, análise e interpretação dos dados; análise estatística; aprovação da versão final do manuscrito.
Jabes Gennedyr da Cruz Lima: Obtenção, análise e interpretação dos dados; aprovação da versão final do manuscrito.
Éricka Janine Dantas da Silveira: Concepção e planejamento do estudo; participação efetiva na orientação da pesquisa; aprovação da versão final do manuscrito.
Patrícia Teixeira de Oliveira: Concepção e planejamento do estudo; participação efetiva na orientação da pesquisa; aprovação da versão final do manuscrito.
Conflito de interessesNenhum.
Como citar este artigo: Varela CBO, Medeiros CKS, Lima JGC, Da Silveira EJD, Oliveira PT. 8‐Hydroxy‐2’‐deoxyguanosine protein immunoexpression is associated with the pathogenesis of actinic cheilitis. An Bras Dermatol. 2024;99:433–6.
Trabalho realizado no Departamento de Odontologia, Universidade Federal do Rio Grande do Norte, Natal, RN, Brasil.