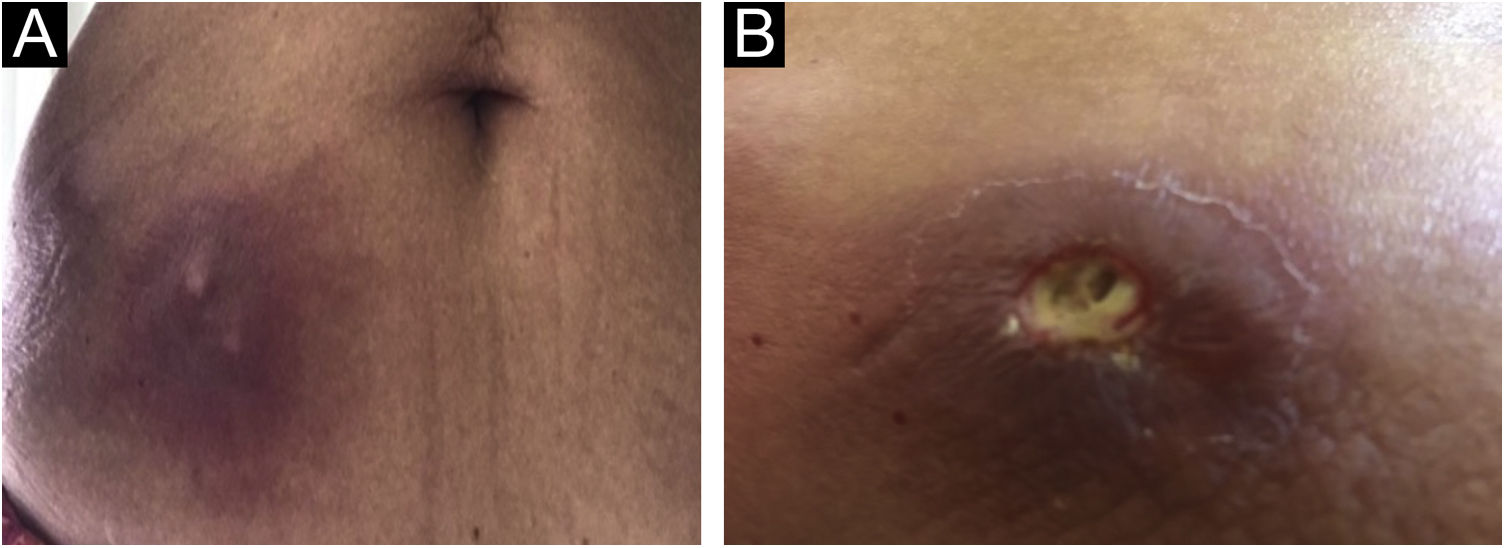
Apresentamos o caso de uma paciente de 60 anos que, preocupada com a pandemia de COVID‐19, realizou imunoterapia com proteína purificada derivada (PPD) de Mycobacterium bovis, substância usada para teste tuberculínico de Mantoux. A terapia realizada, com indicação médica, consistiu em autoaplicações subcutâneas, uma por dia, em três dias consecutivos, na região do abdome. Em uma semana a paciente evoluiu com intensa inflamação nos locais das injeções, caracterizada por nódulos dolorosos e eritematosos, com saída de secreção purulenta (fig. 1), seguido de melhora espontânea e lesões cicatriciais em um mês.
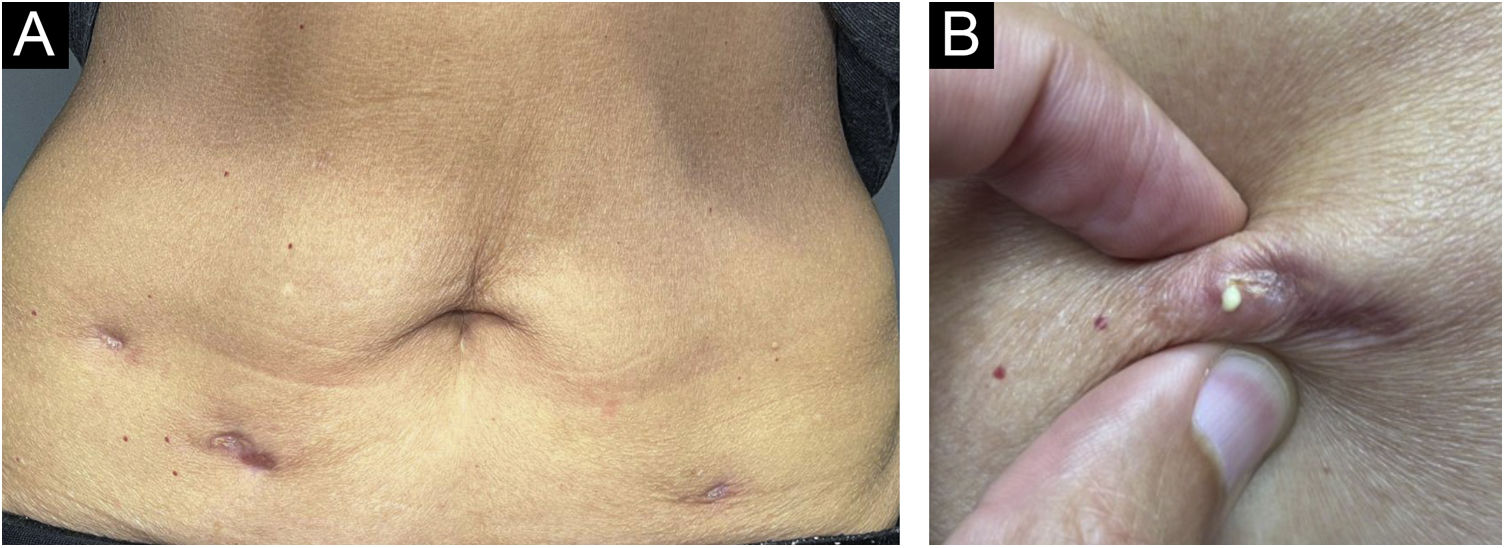
Após um ano, a paciente buscou auxílio dermatológico com intenção de melhorar esteticamente as lesões. Ao exame clínico, apresentava três placas subcutâneas mais palpáveis que visíveis com cerca de 3cm cada, sobrepostas por pele atrófica, com eliminação de secreção caseosa à expressão (fig. 2). Não havia sintomas sistêmicos, tosse ou demais lesões cutâneas. A paciente trouxe a bula do produto injetado,1 e com a hipótese de reação de superdosagem de PPD foi realizada biopsia cutânea, cuja análise histopatológica evidenciou na coloração de Hematoxilina & eosina (HE) presença de dermatose granulomatosa tipo tuberculoide com necrose caseosa, quadro compatível com “PPD‐ite” (fig. 3). O material caseoso foi enviado para pesquisa de PCR pelo método de Xpert MTB/RIF® conforme relatado na literatura,2 com resultado negativo para M. tuberculosis. Outros exames, como hemograma completo, IGRA e raio‐X de tórax, estavam sem alterações, indicando doença reacional localizada, restrita aos pontos de inoculação.
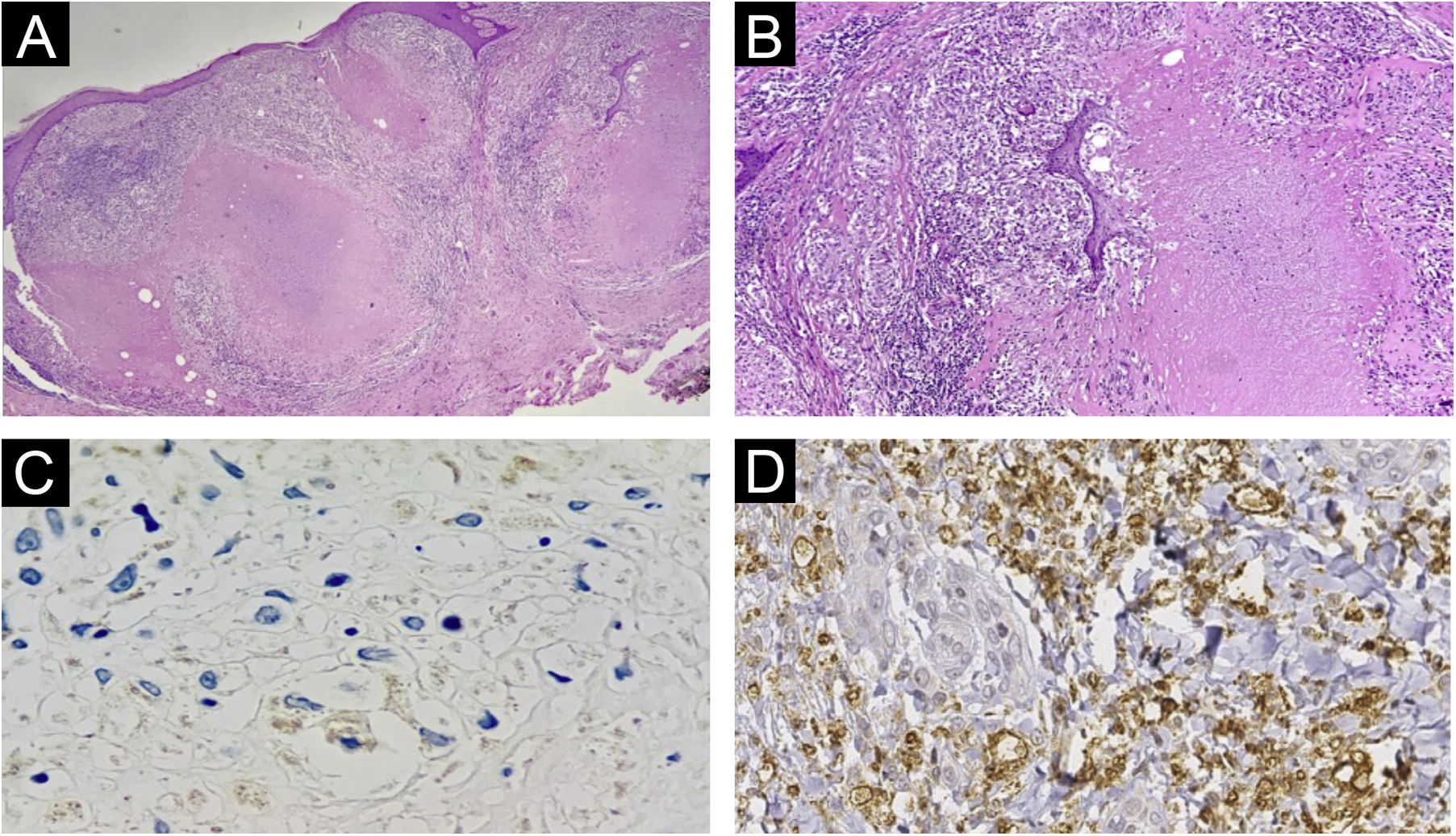
Exames histopatológicos da paciente com “PPD‐ite”. (A) Dermatose granulomatosa com intensa necrose caseosa (Hematoxilina & eosina, 40×). (B) Detalhe do granuloma tuberculoide com necrose caseosa (Hematoxilina & eosina, 100×). (C‐D) Reação de imuno‐histoquímica para Mycobacterium tuberculosis negativa.
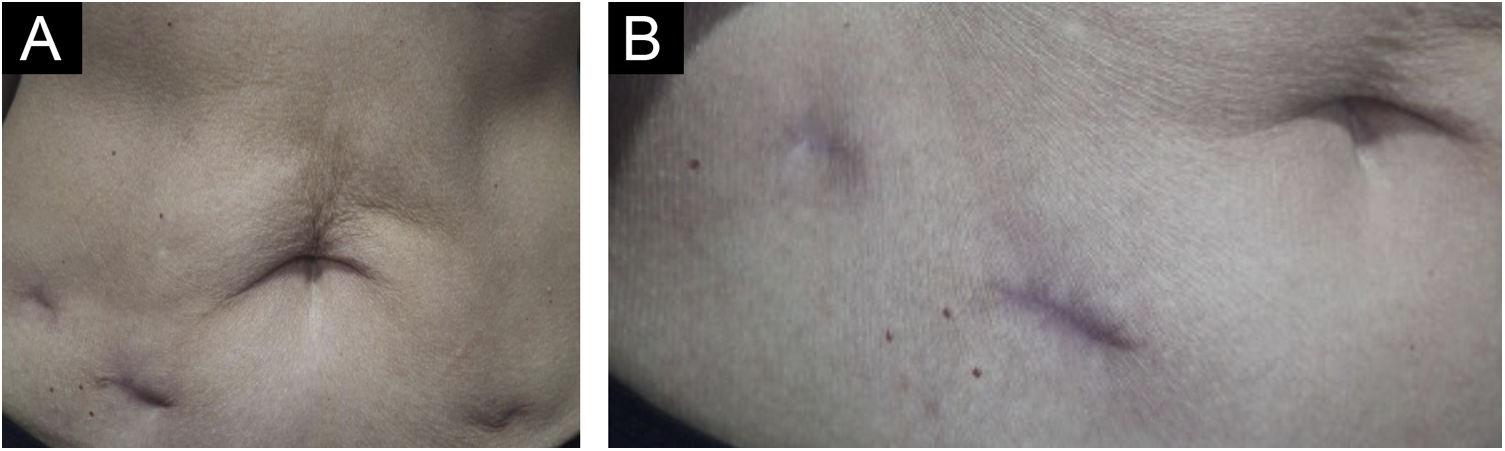
Optou‐se por tratamento com exérese cirúrgica das lesões; o material foi enviado para cultura para microbactérias, que resultou negativa. Nova análise histopatológica, com reação imuno‐histoquímica para M. tuberculosis e colorações de Ziehl‐Neelsen e Fite‐Faraco que resultaram negativas e corroboraram o diagnóstico de “PPD‐ite”. A paciente evoluiu com cicatrização total das feridas operatórias, mantendo seguimento na dermatologia e infectologia (fig. 4).
A tuberculose cutânea (TBC) é forma rara de micobacteriose, representando 1%‐2% de todas as formas de tuberculose extrapulmonar. O agente etiológico principal é M. tuberculosis e, ocasionalmente, M. bovis e bacilo Calmette‐Guérin (vacina BCG), cepa atenuada de M. bovis.3 Diversos estudos defendem o uso da vacina BCG como imunoterapia no tratamento de neoplasias (bexiga e melanoma), asma, doença de Parkinson, papilomatose respiratória recorrente e até de verrugas cutâneas recorrentes.4‐6 As descrições do uso do PPD com o mesmo intuito são mais raras.7
Com a pandemia de COVID‐19, notou‐se associação de cursos menos graves da doença em pacientes previamente vacinados com a vacina BCG,8 motivando alguns médicos a indicar imunoterapia com PPD, como o ocorrido com a paciente. Importante ressaltar que o PPD faz parte da prática diária médica de países de alta prevalência de tuberculose, como o Brasil, e que são raros os casos de efeitos adversos quando o exame é realizado da maneira adequada.
A bula do produto injetado pela paciente destaca que a substância está indicada para pesquisa imunológica de sensibilidade tardia (imunidade celular) à bactéria M. tuberculosis, e que seu uso não é indicado como imunoterapia. Também explicita os riscos de superdosagem, que podem cursar com quadros semelhantes ao apresentado.1 Se não tivéssemos acesso à bula do produto utilizado, poderíamos ter confundido o quadro de dermatose granulomatosa reacional por superdosagem de PPD com um de TBC por injeção de BCG.
O exame histopatológico apresentou informações que trouxeram aprendizados importantes. As colorações de Ziehl‐Neelsen e Fite Faraco não evidenciarem agente, reforçando o fato de se tratar de dermatose reacional sem presença de micobactéria. Já a reação de imuno‐histoquímica negativa indica ausência de reação com antígenos do parasita. Assim, o resultado se relaciona à presença do produto injetado, justamente uma proteína purificada derivada de micobactéria. O exame de PCR negativo do caseum reforça esse raciocínio. Por fim, o HE apresentando granulomas com necrose caseosa central nos mostra que esse padrão tão relatado nas infecções por micobactérias tuberculosas está relacionado ao estímulo imunológico provocado pelo antígeno proteico, não necessariamente à presença da bactéria.
O tratamento proposto com exérese cirúrgica foi indicado após discussão interdisciplinar com a equipe da infectologia. Descrita como opção terapêutica para lesões de TBC refratárias,3 mostrou‐se boa alternativa para o quadro essencialmente cutâneo localizado e trouxe a resolução do quadro sem expor a paciente a tratamento medicamentoso prolongado que poderia trazer efeitos colaterais indesejáveis, principalmente considerando sua faixa etária. A paciente mantém seguimento há seis meses, sem sinais de recidiva.
Suporte financeiroNenhum.
Contribuição dos autoresJohn Veasey: Concepção e o desenho do estudo; levantamento dos dados, ou análise e interpretação dos dados; redação do artigo ou revisão crítica do conteúdo intelectual importante; obtenção, análise e interpretação dos dados; participação efetiva na orientação da pesquisa; participação intelectual em conduta propedêutica e/ou terapêutica de casos estudados; revisão crítica da literatura; aprovação final da versão final do manuscrito.
Victoria Elia: Levantamento dos dados, ou análise e interpretação dos dados; redação do artigo ou revisão crítica do conteúdo intelectual importante; obtenção, análise e interpretação dos dados; participação intelectual em conduta propedêutica e/ou terapêutica de casos estudados; revisão crítica da literatura; aprovação final da versão final do manuscrito.
Ana Ribeiro: Participação intelectual em conduta propedêutica e/ou terapêutica de casos estudados.
Rute Lellis: Levantamento dos dados, ou análise e interpretação dos dados; redação do artigo ou revisão crítica do conteúdo intelectual importante; obtenção, análise e interpretação dos dados.
Conflito de interessesNenhum.
Como citar este artigo: Veasey JV, Elia VC, Ribeiro AE, Lellis RF. Overdosage of PPD immunotherapy causing tuberculosis‐like skin lesions. An Bras Dermatol. 2024;99:636–8.
Trabalho realizado na Clínica de Dermatologia, Hospital da Santa Casa de São Paulo, São Paulo, SP, Brasil.