Terapias de alvo molecular, como anticorpos monoclonais (mAbs) e inibidores de Janus Quinase (JAKis), surgiram como ferramentas essenciais para o tratamento de doenças dermatológicas. Essas terapias modulam o sistema imune por vias de sinalização específicas, proporcionando alternativas eficazes aos agentes imunossupressores sistêmicos tradicionais. Esta revisão tem como objetivo fornecer um resumo atualizado das terapias imunológicas direcionadas para doenças inflamatórias da pele, considerando sua fisiopatologia, eficácia, dosagem e perfis de segurança.
MétodosA revisão seguiu as diretrizes Preferred Reporting Items for Systematic Reviews and Meta‐analyses (PRISMA). Uma busca sistemática foi conduzida na base de dados PubMed nos últimos 10 anos, com foco em ensaios clínicos randomizados, relatos de casos e séries de casos relacionados a terapias imunológicas direcionadas em dermatologia. Critérios de elegibilidade foram aplicados e os dados foram extraídos de cada estudo, incluindo dados de citações, desenho do estudo e resultados.
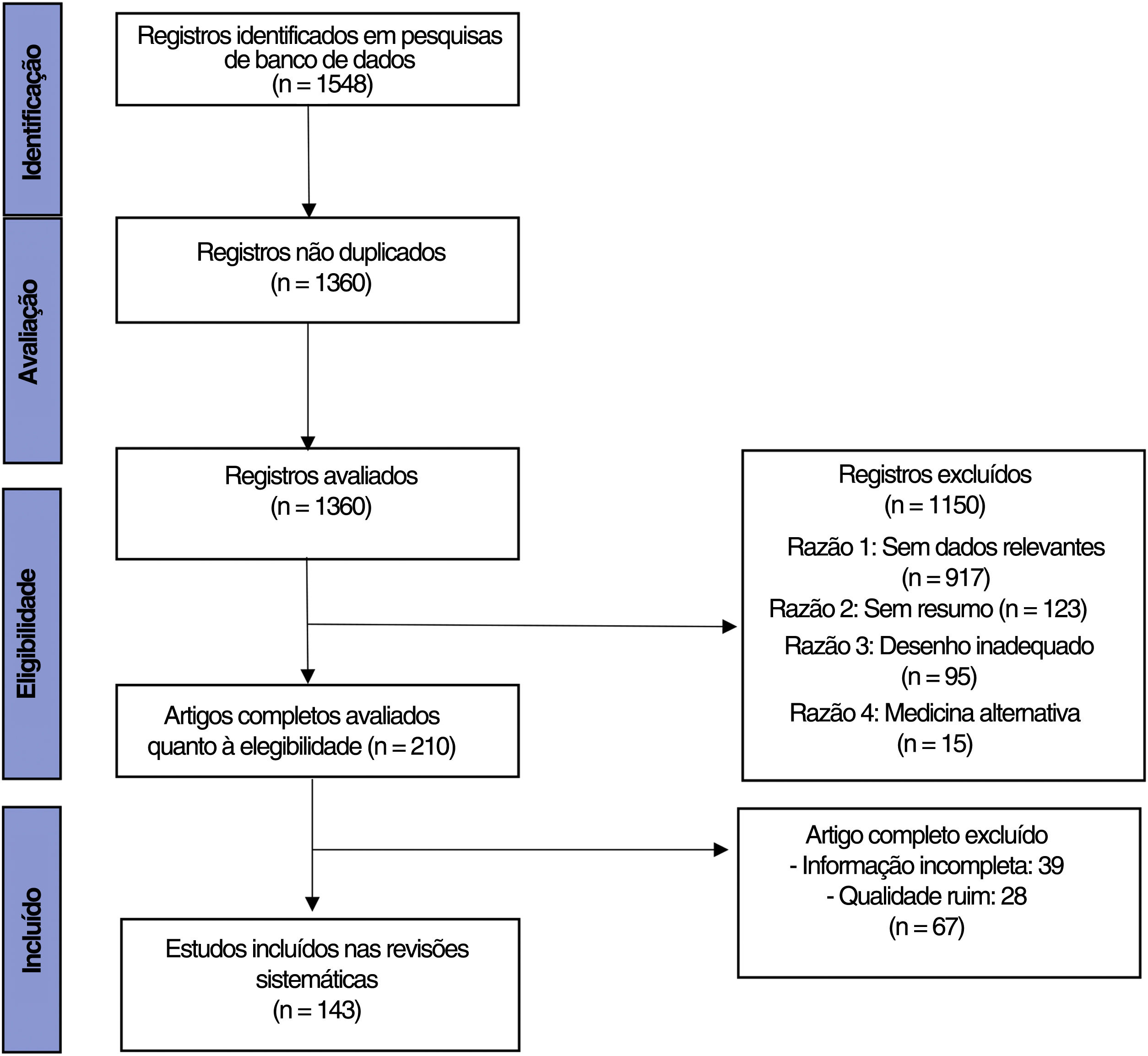
ResultadosForam identificados 1.360 artigos não duplicados com a estratégia de busca inicial. A revisão do título e do resumo excluiu 1.150, enquanto a revisão do texto completo excluiu 50 artigos adicionais. A revisão incluiu 143 estudos publicados entre 2012 e 2022, destacando 39 medicamentos atualmente sob investigação ou em uso para o tratamento de doenças inflamatórias da pele.
Limitações do estudoA heterogeneidade das informações resumidas limita esta revisão. Algumas recomendações originaram‐se de dados de ensaios clínicos, enquanto outras se basearam em análises retrospectivas e pequenas séries de casos. As recomendações provavelmente serão atualizadas à medida que novos resultados surgirem.
ConclusãoAs terapias direcionadas revolucionaram o tratamento de doenças crônicas da pele, oferecendo novas opções para pacientes que não respondem aos tratamentos padrão. Reações paradoxais são raramente observadas. Mais estudos são necessários para compreender completamente os mecanismos e a natureza dessas terapias. Em geral, as terapias imunológicas direcionadas em dermatologia representam um desenvolvimento promissor, melhorando significantemente a qualidade de vida dos pacientes com doenças crônicas inflamatórias da pele.
As terapias de alvo molecular tornaram‐se ferramenta importante para o tratamento de doenças dermatológicas.1
Os principais grupos de terapia direcionada para doenças inflamatórias da pele são os anticorpos monoclonais (mAbs) e os inibidores da Janus Quinase (JAKis), mas também existem proteínas de fusão produzidas por DNA recombinante, como o etanercepte. Anteriormente chamados de produtos biológicos, uma vez que eram sintetizados como produtos de organismos vivos, atualmente essas terapias também são compostas de pequenas moléculas – portanto, os termos terapia direcionada ou terapia‐alvo devem ser preferidos.2 Além disso, o termo moduladores imunológicos direcionados é utilizado em livros de referência.3
O mecanismo de ação é heterogêneo entre as diferentes moléculas, mas todas elas modulam o sistema imunológico por meio de impulsos estimulatórios ou inibitórios, atuando em pontos específicos das vias de sinalização da inflamação.4 Sua eficácia e perfil de segurança são frequentemente homólogos aos agentes imunossupressores sistêmicos padrão ou até melhores. Como todos os novos medicamentos, eles não estão isentos de eventos adversos (EA) e seu custo representa barreira importante para sua acessibilidade.5
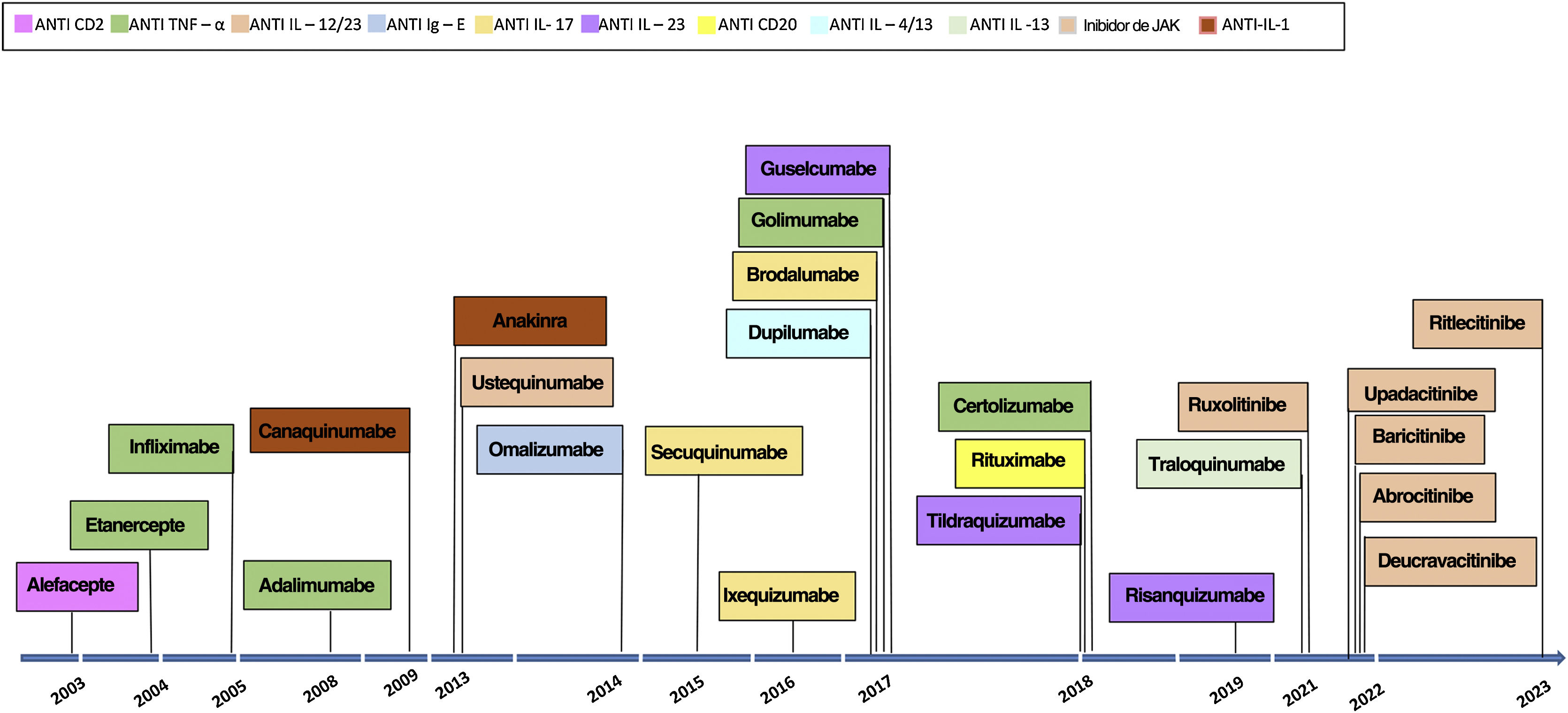
Os primeiros exemplos de terapias imunológicas direcionadas para doenças inflamatórias em dermatologia foram os ensaios clínicos de alefacepte,6 efalizumabe,7 etanercepte8 e infliximabe9 para psoríase no início dos anos 2000. Alefacepte e efalizumabe foram substituídos por moléculas mais novas com renovação constante dos medicamentos utilizados em terapias imunológicas direcionadas para diferentes doenças inflamatórias da pele (fig. 1).
Esta revisão narrativa tem como objetivo atualizar, resumir e priorizar a grande quantidade de informações sobre importantes doenças inflamatórias cutâneas em formato prático para uso na clínica. Indicações de uso são sugeridas considerando dados atuais sobre eficácia, dose e perfil de segurança da imunoterapia direcionada.
Material e métodosEsta revisão foi realizada com base nas diretrizes Preferred Reporting Items for Systematic Reviews and Meta‐analyses (PRISMA).10 Foi feita pesquisa sistemática no banco de dados Pubmed nos últimos 10 anos (janeiro de 2012 a julho de 2023; estratégia de busca, ver Material Suplementar 1). As referências de todos os estudos incluídos também foram avaliadas para identificar quaisquer estudos elegíveis adicionais. Foram selecionadas revisões sistemáticas e ensaios clínicos randomizados (RCE, em inglês). Também foram incluídos relatos de casos e séries de casos, se realizados em humanos. Os estudos foram excluídos se o produto biológico utilizado estivesse no contexto da medicina alternativa ou se a qualidade do relato fosse considerada insuficiente.
Extração de dadosOs títulos e resumos de todos os artigos foram selecionados de maneira independente para elegibilidade por dois autores (E.L. e C.L.). Os textos completos dos artigos considerados potencialmente elegíveis foram avaliados criticamente e avaliados quanto à elegibilidade. Qualquer desacordo sobre a inclusão ou exclusão de um artigo entre os dois investigadores foi analisado por um terceiro investigador (RC) para chegar a um consenso. Os dados extraídos de cada estudo incluíram dados de citação (título do estudo, autores, ano de publicação), desenho do estudo (objetivo do estudo, período, cenário) e resultados (demografia da população, medidas de desfecho).
ResultadosBusca na literaturaForam identificados 1.360 artigos não duplicados com a estratégia de busca inicial. A revisão do título e do resumo excluiu 1.150, enquanto a revisão do texto completo excluiu 50 artigos adicionais. Foram incluídos 143 estudos nesta revisão, como descrito no fluxograma PRISMA (fig. 2).
PsoríaseA psoríase é doença cutânea crônica imunomediada que afeta aproximadamente 1% da população mundial.11–13 Apesar de evidências convincentes que apoiam o uso de terapias imunológicas direcionadas, a seleção de medicamento específico pode ser desafiadora.14 A decisão final do tratamento deve incluir a preferência do paciente e, eventualmente, a consulta com médicos de outras especialidades para equilibrar riscos e benefícios.
Critérios de eligibilidadeOs pacientes devem ser considerados para terapia imunológica direcionada em diversas circunstâncias: se houver psoríase grave,15–17 definida como envolvimento superior a 10% da área de superfície corporal (ASC) total, escore PASI (Psoriasis Area and Severity Index) ou DLQI (Dermatology Life Quality Index) >10 ou comprometimento de locais específicos (mãos, pés, couro cabeludo, rosto ou área genital); quando a psoríase causa prurido não tratável ou tem consequências emocionais graves com duração da doença superior a seis meses,15 ou não responde à terapia convencional, ou não pode receber terapia sistêmica padrão em virtude do estado geral do paciente e de comorbidades ou quando o paciente tem doença grave, como psoríase eritrodérmica, pustulosa ou artrite psoriásica.15–17
TerapiaExistem múltiplas imunoterapias direcionadas para a psoríase. Terapias direcionadas como anti‐TNF‐α, anti‐IL‐17, anti‐IL‐23 e anti‐IL‐12/23 podem atingir PASI‐90 em mais pacientes do que o tratamento sistêmico anterior (p. ex., ciclosporina e metotrexato).18 Os tratamentos anti‐IL‐17 (ou seja, ixequizumabe, secuquinumabe e brodalumabe) e anti‐IL‐23 (risanquizumabe, tildrakizumabe e guselcumabe) mostraram proporção maior de pacientes que alcançaram PASI‐90 em comparação com todas as intervenções sistêmicas avaliadas na última metanálise de rede.18
Os inibidores de TNF‐α foram os primeiros medicamentos biológicos aprovados para o tratamento da psoríase.12,19 A metanálise mostra que, nessa classe, o infliximabe tem a maior eficácia, seguido pelo certolizumabe, adalimumabe e etanercepte.18,19 A FDA aprovou sequencialmente o etanercepte (2004), infliximabe (2005), adalimumabe (2008), golimumabe (2017) e certolizumabe (2018).
Os inibidores da IL‐17 atingem eliminação total da doença (isto é, PASI‐100) em cerca de metade dos pacientes11,12 e têm início de ação mais rápido. Os medicamentos aprovados pela FDA para tratar a psoríase são secuquinumabe (2015), ixekizumabe (2016) e brodalumabe (2017).
Os inibidores de IL‐23, risanquizumabe e guselcumabe, demonstraram recentemente melhor perfil de eficácia e segurança em comparação com o anti‐IL‐17 e regime de dosagem conveniente.20,21 Os medicamentos aprovados pela FDA são guselcumabe (2017), tildraquizumabe (2018) e risanquizumabe (2019). Ustequinumabe (2013) é um mAb que inibe IL‐12 e IL‐23.
JAKis (deucravacitinibe, peficitinibe, baricitinibe, solcitinibe, itacitinibe, abrocitinibe, brepocitinibe, ruxolitinibe e tofacitinibe) também têm sido utilizados para o tratamento de pacientes psoriásicos.22,23 Embora ainda não haja dados completos sobre o impacto clínico final no tratamento da psoríase, ensaios recentes mostram resposta melhor do que certas terapias convencionais (p. ex., metotrexato, ciclosporina), mas inferior à terapia imunológica direcionada (p. ex., risanquizumabe).18 O deucravacitinibe24,25, um inibidor alostérico seletivo da tirosina quinase 2 (TYK2), é o único JAKi aprovado pela FDA (2022), alcançando PASI‐75 de 70% na semana 24.
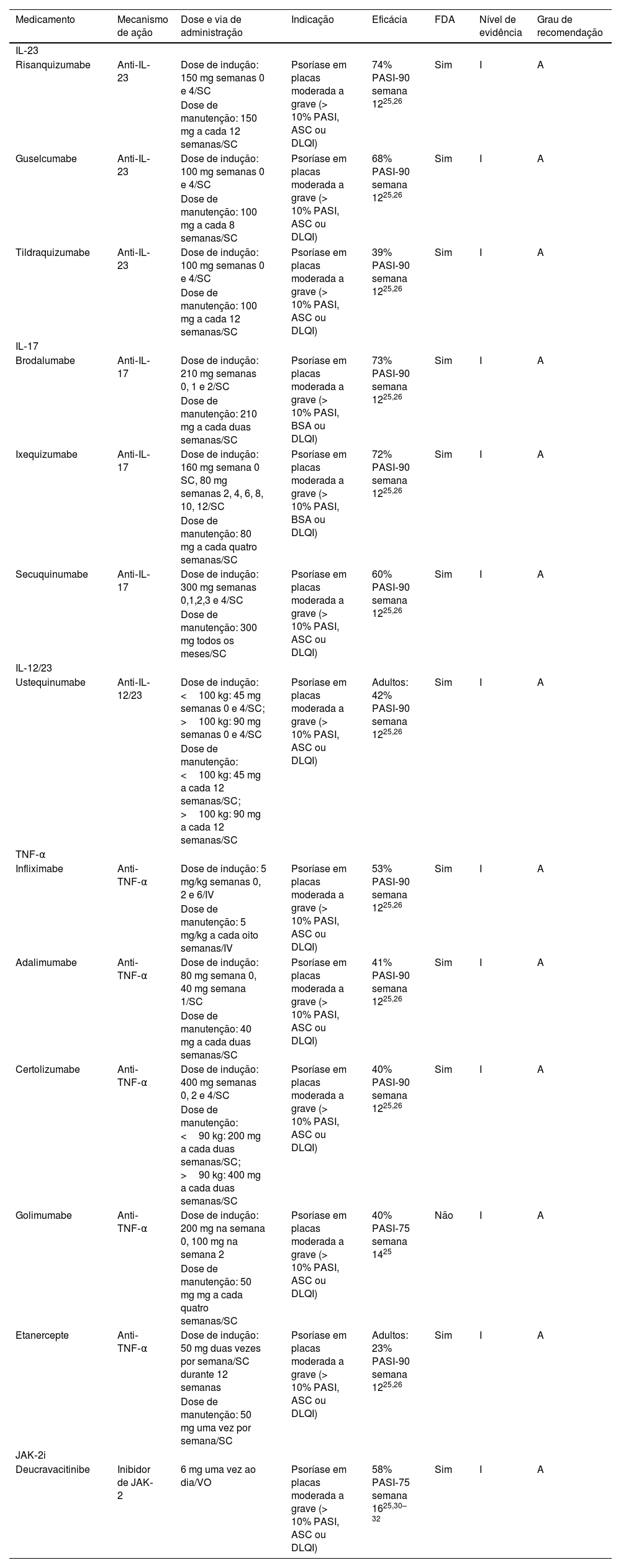
Nos últimos anos (2004‐2020) foram publicadas 51 diretrizes clínicas abordando o tratamento da psoríase, e 41 delas mencionam o uso de produtos biológicos.26 Durante o período de 2021‐2022, várias sociedades dermatológicas atualizaram suas diretrizes clínicas considerando a aprovação de novas moléculas pelas agências reguladoras de medicamentos.27–33 As diretrizes reconhecem medicamentos anti‐IL‐23 e anti‐IL‐17 como parte dos tratamentos de primeira linha para o manejo da psoríase. Há grande preocupação em relação a seu alto custo e acessibilidade. A decisão final para a seleção de um medicamento para o tratamento do paciente psoriásico depende de diversos fatores clínicos e epidemiológicos (tabela 1).
Terapias imunológicas direcionadas para psoríase
| Medicamento | Mecanismo de ação | Dose e via de administração | Indicação | Eficácia | FDA | Nível de evidência | Grau de recomendação |
|---|---|---|---|---|---|---|---|
| IL‐23 | |||||||
| Risanquizumabe | Anti‐IL‐23 | Dose de indução: 150 mg semanas 0 e 4/SC | Psoríase em placas moderada a grave (> 10% PASI, ASC ou DLQI) | 74% PASI‐90 semana 1225,26 | Sim | I | A |
| Dose de manutenção: 150 mg a cada 12 semanas/SC | |||||||
| Guselcumabe | Anti‐IL‐23 | Dose de indução: 100 mg semanas 0 e 4/SC | Psoríase em placas moderada a grave (> 10% PASI, ASC ou DLQI) | 68% PASI‐90 semana 1225,26 | Sim | I | A |
| Dose de manutenção: 100 mg a cada 8 semanas/SC | |||||||
| Tildraquizumabe | Anti‐IL‐23 | Dose de indução: 100 mg semanas 0 e 4/SC | Psoríase em placas moderada a grave (> 10% PASI, ASC ou DLQI) | 39% PASI‐90 semana 1225,26 | Sim | I | A |
| Dose de manutenção: 100 mg a cada 12 semanas/SC | |||||||
| IL‐17 | |||||||
| Brodalumabe | Anti‐IL‐17 | Dose de indução: 210 mg semanas 0, 1 e 2/SC | Psoríase em placas moderada a grave (> 10% PASI, BSA ou DLQI) | 73% PASI‐90 semana 1225,26 | Sim | I | A |
| Dose de manutenção: 210 mg a cada duas semanas/SC | |||||||
| Ixequizumabe | Anti‐IL‐17 | Dose de indução: 160 mg semana 0 SC, 80 mg semanas 2, 4, 6, 8, 10, 12/SC | Psoríase em placas moderada a grave (> 10% PASI, BSA ou DLQI) | 72% PASI‐90 semana 1225,26 | Sim | I | A |
| Dose de manutenção: 80 mg a cada quatro semanas/SC | |||||||
| Secuquinumabe | Anti‐IL‐17 | Dose de indução: 300 mg semanas 0,1,2,3 e 4/SC | Psoríase em placas moderada a grave (> 10% PASI, ASC ou DLQI) | 60% PASI‐90 semana 1225,26 | Sim | I | A |
| Dose de manutenção: 300 mg todos os meses/SC | |||||||
| IL‐12/23 | |||||||
| Ustequinumabe | Anti‐IL‐12/23 | Dose de indução: <100 kg: 45 mg semanas 0 e 4/SC; >100 kg: 90 mg semanas 0 e 4/SC | Psoríase em placas moderada a grave (> 10% PASI, ASC ou DLQI) | Adultos: 42% PASI‐90 semana 1225,26 | Sim | I | A |
| Dose de manutenção: <100 kg: 45 mg a cada 12 semanas/SC; >100 kg: 90 mg a cada 12 semanas/SC | |||||||
| TNF‐α | |||||||
| Infliximabe | Anti‐TNF‐α | Dose de indução: 5 mg/kg semanas 0, 2 e 6/IV | Psoríase em placas moderada a grave (> 10% PASI, ASC ou DLQI) | 53% PASI‐90 semana 1225,26 | Sim | I | A |
| Dose de manutenção: 5 mg/kg a cada oito semanas/IV | |||||||
| Adalimumabe | Anti‐TNF‐α | Dose de indução: 80 mg semana 0, 40 mg semana 1/SC | Psoríase em placas moderada a grave (> 10% PASI, ASC ou DLQI) | 41% PASI‐90 semana 1225,26 | Sim | I | A |
| Dose de manutenção: 40 mg a cada duas semanas/SC | |||||||
| Certolizumabe | Anti‐TNF‐α | Dose de indução: 400 mg semanas 0, 2 e 4/SC | Psoríase em placas moderada a grave (> 10% PASI, ASC ou DLQI) | 40% PASI‐90 semana 1225,26 | Sim | I | A |
| Dose de manutenção: <90 kg: 200 mg a cada duas semanas/SC; >90 kg: 400 mg a cada duas semanas/SC | |||||||
| Golimumabe | Anti‐TNF‐α | Dose de indução: 200 mg na semana 0, 100 mg na semana 2 | Psoríase em placas moderada a grave (> 10% PASI, ASC ou DLQI) | 40% PASI‐75 semana 1425 | Não | I | A |
| Dose de manutenção: 50 mg mg a cada quatro semanas/SC | |||||||
| Etanercepte | Anti‐TNF‐α | Dose de indução: 50 mg duas vezes por semana/SC durante 12 semanas | Psoríase em placas moderada a grave (> 10% PASI, ASC ou DLQI) | Adultos: 23% PASI‐90 semana 1225,26 | Sim | I | A |
| Dose de manutenção: 50 mg uma vez por semana/SC | |||||||
| JAK‐2i | |||||||
| Deucravacitinibe | Inibidor de JAK‐2 | 6 mg uma vez ao dia/VO | Psoríase em placas moderada a grave (> 10% PASI, ASC ou DLQI) | 58% PASI‐75 semana 1625,30–32 | Sim | I | A |
SC, subcutânea; VO, via oral; IV, intravenosa; a, anos; PASI, Psoriasis Area and Severity Index; ASC, área da superfície corporal; DLQI, Dermatology Life Quality Index.
O perfil de segurança da imunoterapia direcionada para psoríase está bem descrito; os EA mais comuns são as infecções do trato respiratório superior e reações no local da injeção para todas as classes de medicamentos.34,35 Considerações gerais devem ser tomadas em relação à reativação de tuberculose e hepatites B e C. O uso de JAKis também deve considerar infecções anteriores por membros da família Herpesvírus.36,37
As evidências atuais mostram que a imunoterapia direcionada não aumenta o risco de EA cardiovasculares importantes, como infarto do miocárdio, acidente vascular encefálico ou morte cardiovascular ou a incidência de neoplasias malignas.35,37–39Reação adversa cutânea comum é a mudança fenotípica de psoríase para eczema atópico, que ocorre em até 1%‐12,1% dos pacientes que tomam medicamentos anti‐TNF‐α ou anti‐IL‐17/IL‐23.40 O tratamento tópico foi bem‐sucedido em alguns casos, mas em outros o tratamento biológico precisa ser interrompido.
Reação paradoxal – piora da psoríase e/ou novas lesões psoriásicas – foi relatada com o uso de certos medicamentos (p. ex., medicamentos anti‐TNF‐α e ustequinumabe). Essas reações geralmente não exigem a interrupção da terapia e são autolimitadas.37 Outras reações adversas relevantes com a classe anti‐TNF‐α são infecção do trato urinário, dor nas costas, artralgia, prurido e erisipela, e infecções fúngicas invasivas, linfoma, insuficiência cardíaca, citopenia, indução ou exacerbação de doença desmielinizante e síndrome semelhante a lúpus (p. ex., infliximabe).40
Os medicamentos anti‐IL‐17 e anti‐IL‐12/23 têm menos dados sobre seu perfil de segurança. Uma reação adversa de interesse nos inibidores de IL‐17 e IL‐12/23 é a candidíase mucocutânea (1,7% em pacientes tratados com secuquinumabe, 3,3% com ixequizumabe, 4,0% com brodalumabe e 2,3% de ustequinumabe).41 Episódios de exacerbação de doença inflamatória intestinal também foram observados com o uso desses medicamentos. Pacientes com história de doença de Crohn ou colite ulcerativa devem ser tratados com outra imunoterapia direcionada.37
Para os JAKis, os EA mais comuns foram reativação de herpes simples, úlceras bucais, pneumonia, COVID‐19, neoplasias malignas, incluindo linfoma, rabdomiólise, aumento da creatina fosfoquinase, aumento dos triglicerídeos e aumento das transaminases.23
Com os dados disponíveis, as taxas de qualquer EA foram as mais baixas para tildraquizumabe, certolizumabe e etanercepte.34 Para EA graves, os mais baixos foram para certolizumabe, risanquizumabe e etanercepte. No tratamento de longo prazo, o risanquizumabe apresentou o perfil de risco‐benefício mais favorável.34
Populações especiaisGrávidas: o único mAb aprovado pela FDA para uso em pacientes grávidas é o certolizumabe pegol. É um fragmento peguilado da porção Fab dirigido contra o TNF‐α que não atravessa a membrana placentária.12,19
Pediátrica: Os mAbs autorizados pela FDA para crianças >4 anos são etanercepte e adalimumabe, secuquinumabe a partir dos 6 anos e ustequinumabe a partir dos 12 anos.18,19,42
Dermatite atópicaA dermatite atópica (DA) é doença inflamatória cutânea crônica e recidivante que afeta 2%‐5% dos adultos e 20% das crianças.43 A eficácia da terapia imunológica direcionada na DA foi comprovada por vários estudos. Uma revisão sistemática recente de 60 ensaios clínicos realizados em 16.579 pacientes confirma a eficácia clínica dessas terapias direcionadas na DA.44
Critérios de elegibilidadeTanto crianças quanto adultos podem ser considerados para receber terapia imunológica direcionada se tiverem doença grave, definida como envolvimento de mais de 10% da ASC total, Avaliação Global do Investigador (IGA) de pelo menos 3, escore EASI (Eczema Area and Severity Index) ≥ 16, escore SCORAD (Scoring Atopic Dermatitis) ≥ 50 e escore de gravidade da Pruritus Numerical Rating Scale (PP‐NRS) ≥ 4, ou quando o prurido é intratável ou tem consequências emocionais graves.45,46
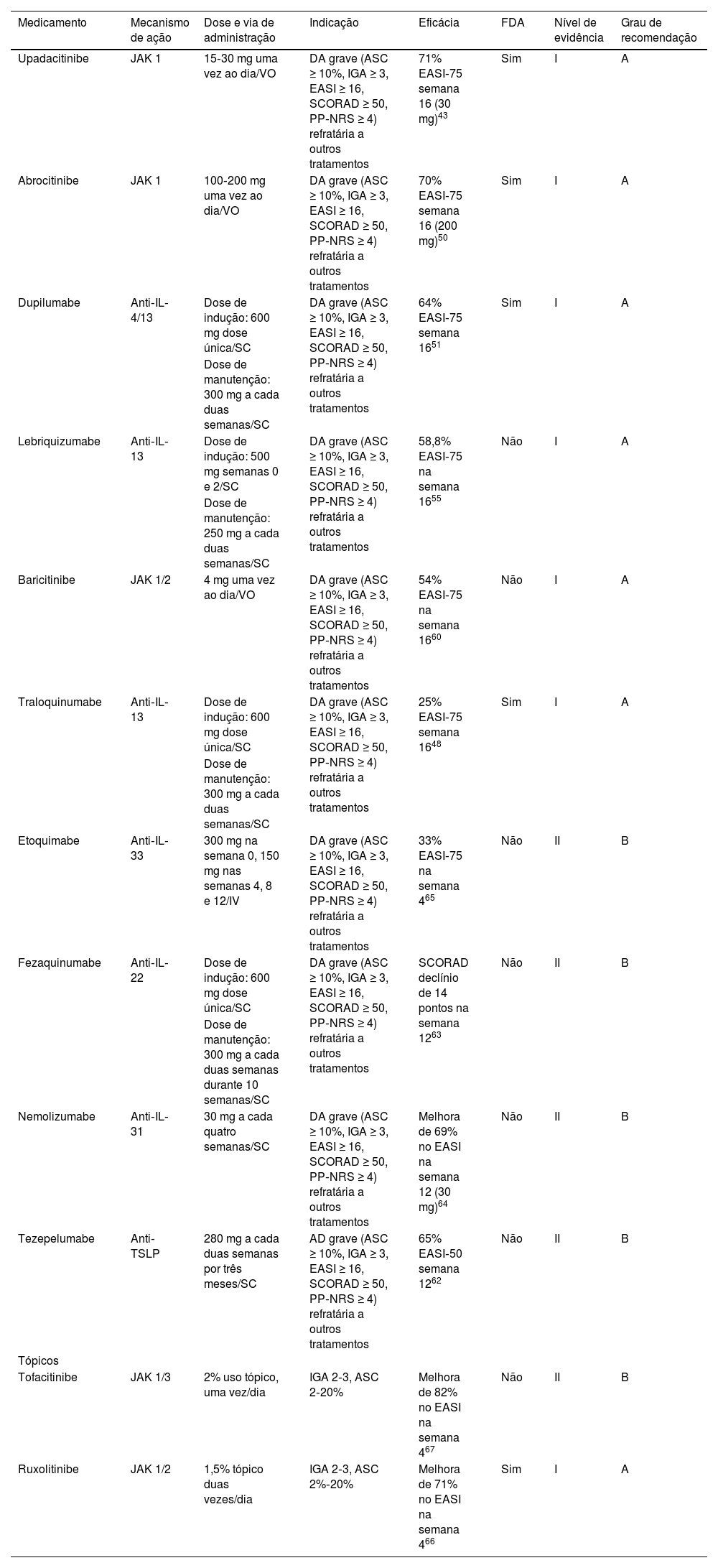
TerapiaEstão disponíveis múltiplas terapias direcionadas para a DA que devem ser selecionadas de acordo com diferentes critérios clínicos em cada paciente (tabela 2). O dupilumabe demonstrou eficácia semelhante à ciclosporina em doses mais altas em pacientes com mais de 6 meses de idade, com resposta mais confiável e superioridade ao metotrexato e à azatioprina, e consideravelmente menos efeitos adversos.44 Isso tornou a terapia imunológica direcionada muito promissora na DA, mas a comparação da eficácia e segurança entre as terapias direcionadas é difícil.44,47 Quatro medicamentos sistêmicos foram aprovados pela FDA (dupilumabe,48 traloquinumabe,49 abrocitinibe50 e upadacitinibe51) e outros medicamentos estão sendo usados off‐label ou em ensaios clínicos.
Terapias imunológicas direcionadas para dermatite atópica
| Medicamento | Mecanismo de ação | Dose e via de administração | Indicação | Eficácia | FDA | Nível de evidência | Grau de recomendação |
|---|---|---|---|---|---|---|---|
| Upadacitinibe | JAK 1 | 15‐30 mg uma vez ao dia/VO | DA grave (ASC ≥ 10%, IGA ≥ 3, EASI ≥ 16, SCORAD ≥ 50, PP‐NRS ≥ 4) refratária a outros tratamentos | 71% EASI‐75 semana 16 (30 mg)43 | Sim | I | A |
| Abrocitinibe | JAK 1 | 100‐200 mg uma vez ao dia/VO | DA grave (ASC ≥ 10%, IGA ≥ 3, EASI ≥ 16, SCORAD ≥ 50, PP‐NRS ≥ 4) refratária a outros tratamentos | 70% EASI‐75 semana 16 (200 mg)50 | Sim | I | A |
| Dupilumabe | Anti‐IL‐4/13 | Dose de indução: 600 mg dose única/SC | DA grave (ASC ≥ 10%, IGA ≥ 3, EASI ≥ 16, SCORAD ≥ 50, PP‐NRS ≥ 4) refratária a outros tratamentos | 64% EASI‐75 semana 1651 | Sim | I | A |
| Dose de manutenção: 300 mg a cada duas semanas/SC | |||||||
| Lebriquizumabe | Anti‐IL‐13 | Dose de indução: 500 mg semanas 0 e 2/SC | DA grave (ASC ≥ 10%, IGA ≥ 3, EASI ≥ 16, SCORAD ≥ 50, PP‐NRS ≥ 4) refratária a outros tratamentos | 58,8% EASI‐75 na semana 1655 | Não | I | A |
| Dose de manutenção: 250 mg a cada duas semanas/SC | |||||||
| Baricitinibe | JAK 1/2 | 4 mg uma vez ao dia/VO | DA grave (ASC ≥ 10%, IGA ≥ 3, EASI ≥ 16, SCORAD ≥ 50, PP‐NRS ≥ 4) refratária a outros tratamentos | 54% EASI‐75 na semana 1660 | Não | I | A |
| Traloquinumabe | Anti‐IL‐13 | Dose de indução: 600 mg dose única/SC | DA grave (ASC ≥ 10%, IGA ≥ 3, EASI ≥ 16, SCORAD ≥ 50, PP‐NRS ≥ 4) refratária a outros tratamentos | 25% EASI‐75 semana 1648 | Sim | I | A |
| Dose de manutenção: 300 mg a cada duas semanas/SC | |||||||
| Etoquimabe | Anti‐IL‐33 | 300 mg na semana 0, 150 mg nas semanas 4, 8 e 12/IV | DA grave (ASC ≥ 10%, IGA ≥ 3, EASI ≥ 16, SCORAD ≥ 50, PP‐NRS ≥ 4) refratária a outros tratamentos | 33% EASI‐75 na semana 465 | Não | II | B |
| Fezaquinumabe | Anti‐IL‐22 | Dose de indução: 600 mg dose única/SC | DA grave (ASC ≥ 10%, IGA ≥ 3, EASI ≥ 16, SCORAD ≥ 50, PP‐NRS ≥ 4) refratária a outros tratamentos | SCORAD declínio de 14 pontos na semana 1263 | Não | II | B |
| Dose de manutenção: 300 mg a cada duas semanas durante 10 semanas/SC | |||||||
| Nemolizumabe | Anti‐IL‐31 | 30 mg a cada quatro semanas/SC | DA grave (ASC ≥ 10%, IGA ≥ 3, EASI ≥ 16, SCORAD ≥ 50, PP‐NRS ≥ 4) refratária a outros tratamentos | Melhora de 69% no EASI na semana 12 (30 mg)64 | Não | II | B |
| Tezepelumabe | Anti‐TSLP | 280 mg a cada duas semanas por três meses/SC | AD grave (ASC ≥ 10%, IGA ≥ 3, EASI ≥ 16, SCORAD ≥ 50, PP‐NRS ≥ 4) refratária a outros tratamentos | 65% EASI‐50 semana 1262 | Não | II | B |
| Tópicos | |||||||
| Tofacitinibe | JAK 1/3 | 2% uso tópico, uma vez/dia | IGA 2‐3, ASC 2‐20% | Melhora de 82% no EASI na semana 467 | Não | II | B |
| Ruxolitinibe | JAK 1/2 | 1,5% tópico duas vezes/dia | IGA 2‐3, ASC 2%‐20% | Melhora de 71% no EASI na semana 466 | Sim | I | A |
SC, subcutânea; VO, via oral; IV, intravenosa; EASI, Eczema Area and Severity Index; ASC, área de superfície corporal; IGA, avaliação global do investigador; SCORAD, SCORing Atopic Dermatitis, PP‐NRS, Peak Pruritus Numerical Rating Scale; DA, dermatite atópica.
Em comparação com dupilumabe, o abrocitinibe, 200mg/dia, e upadacitinibe, 30mg/dia, foram associados a reduções mais altas nos escores EASI, enquanto com baricitinibe e traloquinumabe, as reduções nos escores EASI foram semelhantes ou ligeiramente piores do que com dupilumabe.44
Dupilumabe é mAb anti‐IL‐4/13 aprovado pela FDA em 2017 para o tratamento de DA moderada a grave, a partir dos 6 meses de idade.52 O efeito terapêutico do dupilumabe é mediado principalmente pela inibição da subunidade alfa do receptor da IL‐4 (IL‐4Rα).53,54
Traloquinumabe é mAb anti‐IL‐13 aprovado pela FDA em 2021 para o tratamento de DA moderada a grave em adultos. Em dois ECRs, 300mg de traloquinumabe a cada duas semanas alcançou escore EASI‐75 em 25%‐33,2% dos pacientes em 16 semanas de tratamento. Esses ECRs também mostraram melhoras precoces no prurido, interferência no sono e escore DLQI. Os pacientes mantiveram essas respostas após 52 semanas de tratamento com traloquinumabe sem qualquer medicação de resgate.49,55 Lebriquizumabe, mAb que tem como alvo a IL‐13 foi avaliado em dois ensaios de fase 3 randomizados, duplo‐cegos, controlados por placebo, em pacientes maiores de 12 anos com DA moderada a grave mostrando escore EASI‐75 em 58,8% e 52,1% dos pacientes, respectivamente, na semana 16.56
O abrocitinibe é inibidor de JAK‐1 aprovado pela FDA em 2022 para o tratamento de DA em adultos. Na DA moderada a grave, o abrocitinibe mostrou respostas consistentes no tratamento e não apresentou novas preocupações de segurança em comparação com o dupilumabe.46,57–59 Ele é utilizado na dose de 200mg/dia, atingindo 70% do escore EASI‐75 na semana 12 de tratamento.58
Upadacitinibe é um inibidor de JAK‐1 aprovado pela FDA (2022) para o tratamento de DA em pacientes >12 anos. Ele mostra uma melhora no escore EASI‐75 de 71% na semana 16 com uma dose de 30mg/dia por via oral.60
Recentemente, o baricitinibe, um inibidor de primeira geração de JAK 1‐2 ainda não aprovado pela FDA na DA, completou ECR de fase 2 e 3 em combinação com corticosteroides tópicos em adultos com DA moderada a grave. Na semana 16, o baricitinibe 4mg proporcionou melhora de 54,9% e 59,4% no escore EASI no BREEZE‐AD1 e BREEZE‐AD2, respectivamente.61
Tezepelumabe é mAb humano que se liga à linfopoietina estromal do timo (TSLP, citocina derivada de células epiteliais que induz a produção de citocinas Th2, incluindo IL‐4, IL‐5 e IL‐13)62 usado no tratamento da asma. Ele foi testado em doses de 280mg a cada duas semanas em estudos de fase 2, alcançando escore EASI‐50 em 65% dos pacientes na 12ª semana de tratamento.63 Fezaquinumabe, mAb humano contra IL‐22, está em estudos de fase 2. Doses de indução de 600mg seguidas de 300mg a cada duas semanas demonstraram melhora no escore IGA a partir de 12 semanas de uso.64 Nemolizumabe é mAb anti‐IL‐31RA experimentado em estudos de fase 2. Foi relatado que 42% dos pacientes tratados apresentaram melhora no escore EASI após 12 semanas de uso.65 O etoquimabe é outro mAb experimental que se liga à IL‐33 em fase inicial de desenvolvimento. No momento, os estudos testaram doses de 300mg IV uma vez, alcançando escore EASI‐50 em 100% dos participantes em 140 dias.66
Novas terapias imunológicas tópicas direcionadas para DA apareceram recentemente como ferramentas terapêuticas. O creme de ruxolitinibe 1,5% (aprovado pela FDA em 2021) para pacientes >12 anos mostra melhora de 71,6% no escore EASI após quatro semanas de uso.67 O creme de tofacitinibe 2% mostrou melhora de 82% no escore EASI após quatro semanas de uso e está aguardando a aprovação da FDA.68,69
Perfil de segurança da imunoterapia direcionada para DAOs EA mais comuns foram infecções do trato respiratório superior e reações no local da injeção para todas as classes.44,45 Considerações gerais devem ser observadas em relação à reativação de tuberculose, hepatite B e, no caso de JAKis, considerar também infecções por membros da família Herpesvírus.58,60 Outros EA comuns em todas as classes foram sintomas oculares (conjuntivite, ceratite, blefarite, prurido ocular, ressecamento e desconforto ocular). Dupilumabe e traloquinumabe não requerem monitoramento laboratorial, mas abrocitinibe, baricitinibe e upadacitinibe necessitam de seguimento laboratorial. Eles podem induzir elevação da creatinofosfoquinase, trombocitopenia e neutropenia.45 Outros EA relatados para JAKis são náusea, cefaleia, diarreia, fadiga, acne, dor abdominal e mialgias.70
Recentemente, observou‐se risco aumentado de artrite inflamatória soronegativa e psoríase em pacientes em uso de dupilumabe.71 Com base nas evidências atuais, parece que o uso de anti‐TNF‐α para psoríase e anti‐IL‐4/13 para DA estão inversamente relacionados. O bloqueio duplo com dupilumabe está associado a doenças psoriasiformes, enquanto medicamentos biológicos para psoríase podem causar mudança fenotípica para eczema.72
Para produtos tópicos, irritação local leve foi o EA mais comum.67,68
Não existem dados suficientes para determinar se qualquer terapia imunológica direcionada é mais segura do que outra para a DA. O abrocitinibe, 100mg/dia, foi associado a 2,6 vezes mais chances de EA graves em comparação com dupilumabe, mas com doses mais altas (isto é, abrocitinibe, 200mg/dia) as chances foram menores (1,4).44
Taxas mais baixas de EA graves foram observadas com dupilumabe em comparação com placebo.44 Dupilumabe também está associado a aumento não significante na infecção por herpes. A razão para a diminuição de infecções cutâneas, incluindo eczema herpético, é desconhecida, mas a melhora na barreira cutânea e no microbioma causada pela imunoterapia direcionada pode explicar essa observação.73
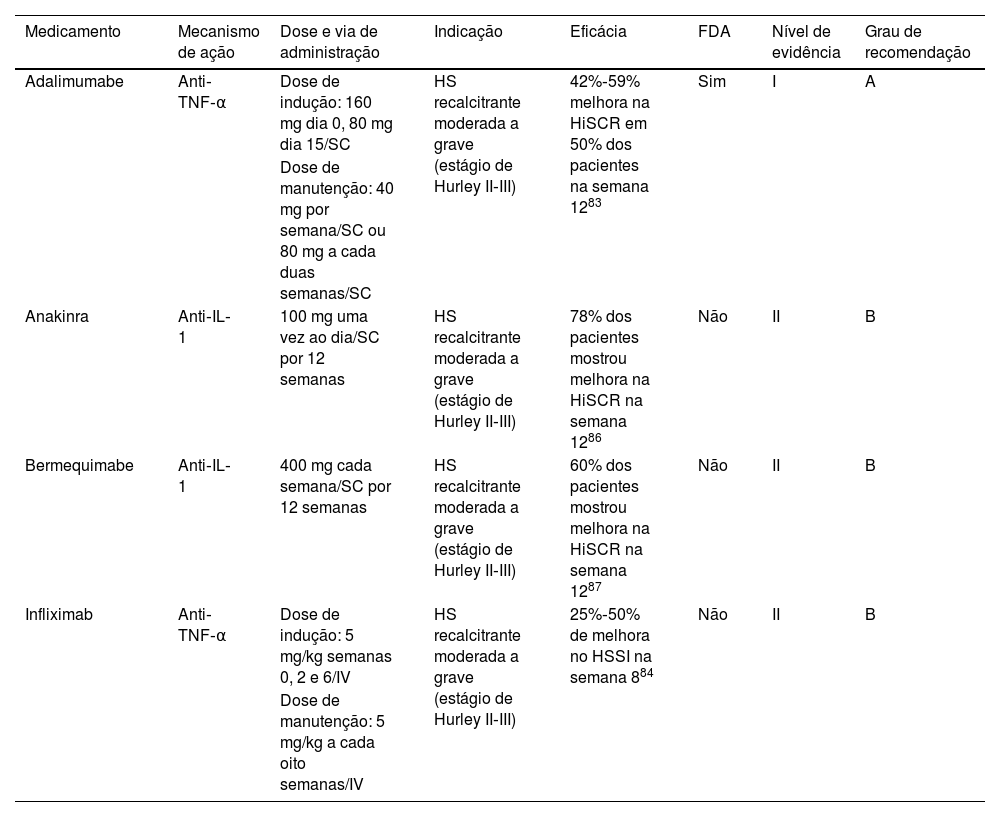
Hidradenite supurativaA hidradenite supurativa (HS) é doença autoinflamatória do folículo pilossebáceo com prevalência variando de 0,05%‐4,1%.74 Existem pelo menos nove diretrizes clínicas que consideram o uso de produtos biológicos no manejo da HS.75–83
Critérios de eligibilidadeO manejo com imunoterapia direcionada deve ser considerado precocemente em casos graves. As diretrizes internacionais recomendam iniciar tratamento direcionado para HS recalcitrante moderada a grave, definida como estágio II‐III de Hurley, ou contagem total de abcessos e nódulos inflamatórios ≥ 3 no início do estudo e resposta inadequada ao tratamento com antibióticos orais por pelo menos 90 dias.
TerapiaExistem poucas terapias direcionadas para HS que devem ser selecionadas de acordo com diferentes critérios clínicos em cada paciente (tabela 3). O adalimumabe84 é o único tratamento biológico aprovado pela FDA para HS (2015) e é recomendado como medicamento biológico de primeira linha em todas as diretrizes; o infliximabe é a segunda opção.74 Anakinra e bermequimabe podem ser considerados após falha dos agentes anti‐TNF‐α, mas as evidências que apoiam sua eficácia na HS são limitadas.74
Terapias imunológicas direcionadas para hidradenite supurativa
| Medicamento | Mecanismo de ação | Dose e via de administração | Indicação | Eficácia | FDA | Nível de evidência | Grau de recomendação |
|---|---|---|---|---|---|---|---|
| Adalimumabe | Anti‐TNF‐α | Dose de indução: 160 mg dia 0, 80 mg dia 15/SC | HS recalcitrante moderada a grave (estágio de Hurley II‐III) | 42%‐59% melhora na HiSCR em 50% dos pacientes na semana 1283 | Sim | I | A |
| Dose de manutenção: 40 mg por semana/SC ou 80 mg a cada duas semanas/SC | |||||||
| Anakinra | Anti‐IL‐1 | 100 mg uma vez ao dia/SC por 12 semanas | HS recalcitrante moderada a grave (estágio de Hurley II‐III) | 78% dos pacientes mostrou melhora na HiSCR na semana 1286 | Não | II | B |
| Bermequimabe | Anti‐IL‐1 | 400 mg cada semana/SC por 12 semanas | HS recalcitrante moderada a grave (estágio de Hurley II‐III) | 60% dos pacientes mostrou melhora na HiSCR na semana 1287 | Não | II | B |
| Infliximab | Anti‐TNF‐α | Dose de indução: 5 mg/kg semanas 0, 2 e 6/IV | HS recalcitrante moderada a grave (estágio de Hurley II‐III) | 25%‐50% de melhora no HSSI na semana 884 | Não | II | B |
| Dose de manutenção: 5 mg/kg a cada oito semanas/IV |
SC, subcutânea; IV, intravenosa; HiSCR, Hidradenitis Suppurativa Clinical Response; HSSI, Hidradenitis Suppurativa Severity Index.
O adalimumabe mostrou melhora de 41,8% a 58,9% na resposta clínica à HS (HiSCR, Hidradenitis Suppurativa Clinical Response) em 50% dos pacientes em 12 semanas.84 O infliximabe demonstrou melhora de 25%‐50% no Hidradenitis Suppurativa Severity Index (HSSI) em 60% dos pacientes em oito semanas.85 Outros anti‐TNFs não são utilizados para tratar a HS, como etanercepte ou golimumabe, em virtude de reações paradoxais de piora ou indução da doença.74,86
Os medicamentos anti‐IL‐1 comprovaram sua eficácia em pequenos ECR controlados por placebo.87,88 Anakinra mostrou melhora >50% no Disease Activity Score (DAS) em 78% dos pacientes em 12 semanas de tratamento.87 O bermequimabe mostrou melhora de 60% no HiSCR em 12 semanas de tratamento.88 Esses medicamentos devem ser considerados quando os pacientes não são candidatos à terapia anti‐TNF‐α.
As diretrizes clínicas também mencionam outros produtos biológicos que têm sido utilizados com sucesso em séries de casos para o tratamento da HS (guselcumabe, risanquizumabe, secuquinumabe, bimequizumabe e upadacitinibe), mas os resultados em pacientes tratados com esses medicamentos baseiam‐se principalmente em relatos de casos isolados, o que não é suficiente para recomendar seu uso no ambiente clínico.86
Perfil de segurança da imunoterapia direcionada para HSO perfil de segurança dos medicamentos anti‐TNF‐α foi discutido em seção anterior (ver Psoríase). Para os medicamentos anti‐IL‐1, as considerações gerais são semelhantes entre eles. Os EA mais comuns são reações no local da injeção e infecções do trato respiratório superior. Outros EA relatados são cefaleia, dor abdominal, diarreia e sintomas semelhantes aos da gripe.89
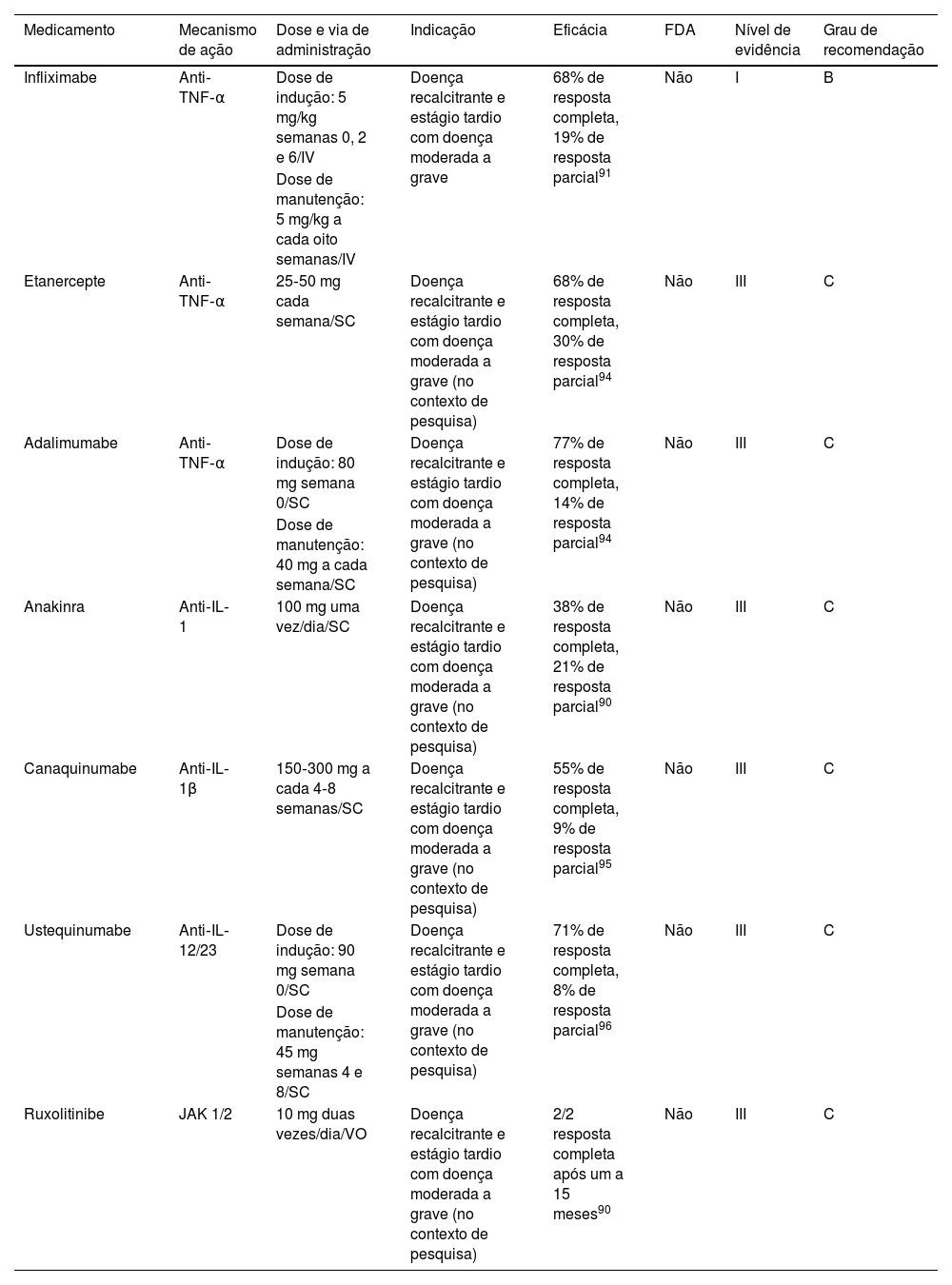
Pioderma gangrenosoO pioderma gangrenoso (PG) é dermatose neutrofílica caracterizada por úlceras cutâneas crônicas e recorrentes com borda necrolítica, com incidência estimada de 3‐10/1.000.000 de casos por ano.90 Atualmente, não existem medicamentos aprovados pela FDA para essa doença. Recentemente, novas terapias imunológicas direcionadas têm sido utilizadas com algum sucesso para tratar casos refratários de PG, mas ensaios clínicos são necessários para estabelecer a real eficácia dessas terapias.91–93
Critérios de eligibilidadeSugere‐se considerar a imunoterapia direcionada no PG após estudo completo para estabelecer o diagnóstico dessa condição.94 A doença deve ser recalcitrante ou de intensidade moderada a grave (ASC >10%, locais anatômicos complexos ou dor excruciante).
TerapiaExistem poucas terapias direcionadas para o PG que devem ser selecionadas de acordo com diferentes critérios clínicos em cada paciente (tabela 4). O medicamento com mais dados para o tratamento do PG é o infliximabe.94 O infliximabe demonstrou melhora das lesões na quarta semana (20/29 pacientes), com remissão completa em 21% na sexta semana.94 O infliximabe também tem sido utilizado com sucesso em combinação com outros medicamentos (corticosteroides sistêmicos orais, azatioprina, micofenolato de mofetil e ciclosporina).92,93,95
Terapias imunológicas direcionadas para pioderma gangrenoso
| Medicamento | Mecanismo de ação | Dose e via de administração | Indicação | Eficácia | FDA | Nível de evidência | Grau de recomendação |
|---|---|---|---|---|---|---|---|
| Infliximabe | Anti‐TNF‐α | Dose de indução: 5 mg/kg semanas 0, 2 e 6/IV | Doença recalcitrante e estágio tardio com doença moderada a grave | 68% de resposta completa, 19% de resposta parcial91 | Não | I | B |
| Dose de manutenção: 5 mg/kg a cada oito semanas/IV | |||||||
| Etanercepte | Anti‐TNF‐α | 25‐50 mg cada semana/SC | Doença recalcitrante e estágio tardio com doença moderada a grave (no contexto de pesquisa) | 68% de resposta completa, 30% de resposta parcial94 | Não | III | C |
| Adalimumabe | Anti‐TNF‐α | Dose de indução: 80 mg semana 0/SC | Doença recalcitrante e estágio tardio com doença moderada a grave (no contexto de pesquisa) | 77% de resposta completa, 14% de resposta parcial94 | Não | III | C |
| Dose de manutenção: 40 mg a cada semana/SC | |||||||
| Anakinra | Anti‐IL‐1 | 100 mg uma vez/dia/SC | Doença recalcitrante e estágio tardio com doença moderada a grave (no contexto de pesquisa) | 38% de resposta completa, 21% de resposta parcial90 | Não | III | C |
| Canaquinumabe | Anti‐IL‐1β | 150‐300 mg a cada 4‐8 semanas/SC | Doença recalcitrante e estágio tardio com doença moderada a grave (no contexto de pesquisa) | 55% de resposta completa, 9% de resposta parcial95 | Não | III | C |
| Ustequinumabe | Anti‐IL‐12/23 | Dose de indução: 90 mg semana 0/SC | Doença recalcitrante e estágio tardio com doença moderada a grave (no contexto de pesquisa) | 71% de resposta completa, 8% de resposta parcial96 | Não | III | C |
| Dose de manutenção: 45 mg semanas 4 e 8/SC | |||||||
| Ruxolitinibe | JAK 1/2 | 10 mg duas vezes/dia/VO | Doença recalcitrante e estágio tardio com doença moderada a grave (no contexto de pesquisa) | 2/2 resposta completa após um a 15 meses90 | Não | III | C |
SC, subcutânea; VO, via oral.
Há relatos de casos de PG tratados com adalimumabe e etanercepte.95 Com base nesses dados observacionais, não foram encontradas diferenças significantes nas taxas de resposta parcial ou completa ao infliximabe, adalimumabe e etanercepte. Em uma revisão semissistemática sobre inibidores de TNF‐α, foi encontrada taxa de resposta parcial de 87% e resposta completa de 67%.95 O corticosteroide e a ciclosporina podem atingir 90% de taxa de resposta parcial e apenas 47% de taxa de resposta completa após seis meses.95
Medicamentos anti‐IL‐1 também têm sido utilizados para tratar PG.91 Há 29 casos relatados na literatura do uso de anakinra em pacientes com comorbidades como artrite reumatoide, psoríase e síndromes PASH (pioderma gangrenoso, acne e hidradenite supurativa) e PAPA (artrite piogênica, pioderma gangrenoso e acne) na dose de 100mg/dia.91,92 Em um ensaio não controlado, canaquinumabe foi usado em cinco pacientes com PG refratário a esteroides. Quatro mostraram redução no tamanho da lesão‐alvo e três alcançaram remissão completa.96
Outras terapias imunológicas direcionadas usadas com sucesso são ustequinumabe (anti‐IL‐12/23)97 e ruxolitinibe (anti‐JAK1‐2).91,92
Perfil de segurança da imunoterapia direcionada para PGHá casos relatados de indução paradoxal de PG com o uso de adalimumabe, etanercepte e, em menor número, com infliximabe.90
As reações adversas específicas do canaquinumabe são piora da artrite reumatoide, pirexia, vômitos, sinusite e artralgia e, para anakinra, ganho ponderal, dor musculoesquelética e vertigem.96
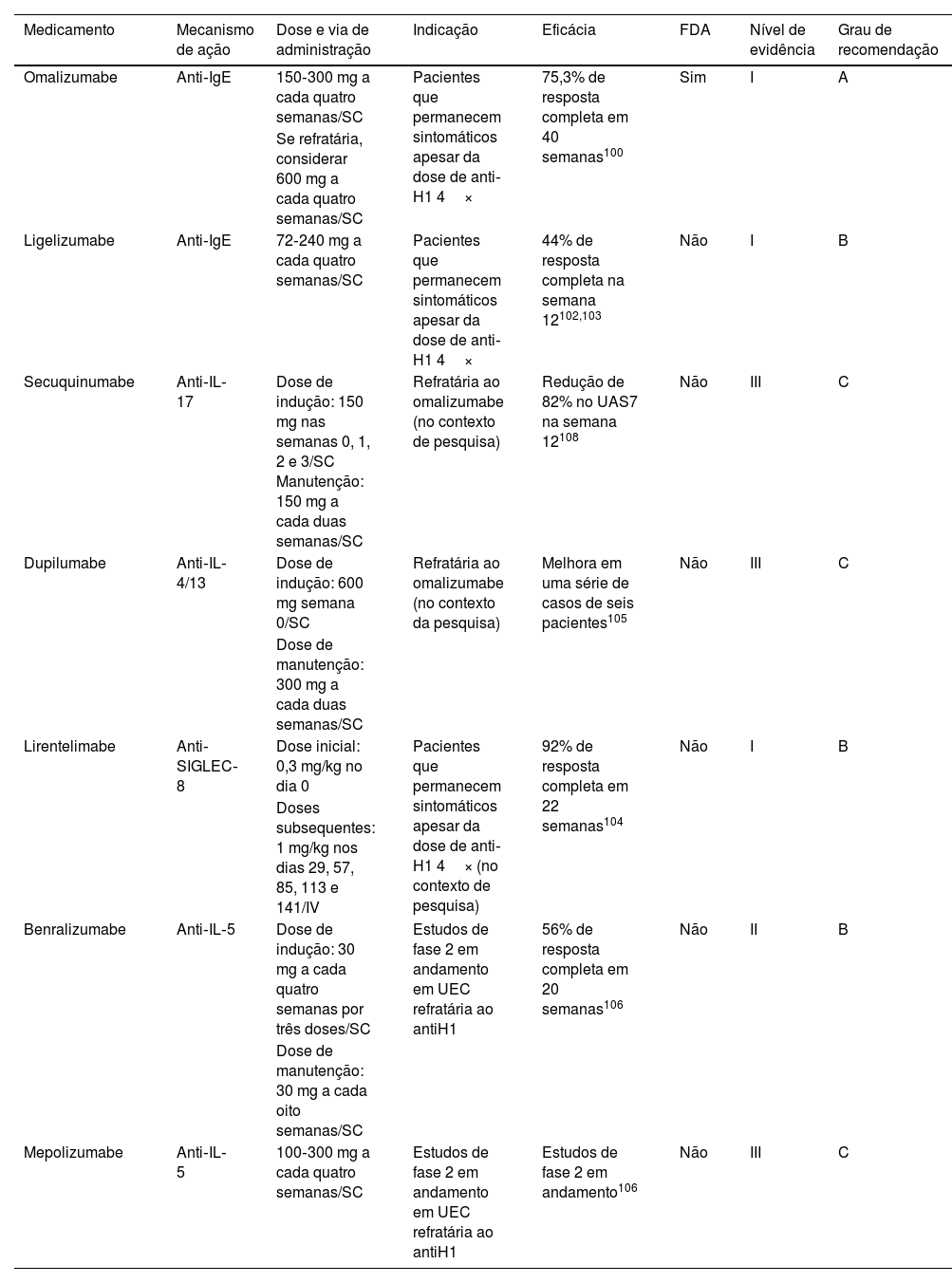
Urticária espontânea crônicaA urticária espontânea crônica (UEC) é definida pelo aparecimento de pápulas pruriginosas transitórias e/ou angioedema por pelo menos seis semanas sem um gatilho reconhecível.98 A prevalência global de UEC é de 1,1%, de acordo com a Global Burden of Disease.99
Critérios de eligibilidadeAdultos e adolescentes com 12 anos ou mais podem ser considerados para terapia imunológica direcionada se permanecerem sintomáticos apesar do tratamento com anti‐histamínicos H1 até quatro vezes a dose padrão, ou se persistirem sintomáticos com a terapia combinada (anti‐histamínicos H1 quatro vezes a dose padrão mais anti‐histamínicos H2 e/ou antagonista do receptor de leucotrieno).98,100
TerapiaExiste apenas uma imunoterapia direcionada atualmente aprovada para UEC, e outras opções devem ser selecionadas em casos refratários ou no contexto de pesquisa (tabela 5). O omalizumabe, um mAb anti‐IgE, foi aprovado pela FDA em 2014 para uso em pacientes >12 anos com UEC. Essa autorização foi baseada em dois ECRs (ASTERIA I e ASTERIA II).101 ECRs mostraram que, em 40 semanas, 75,3% dos pacientes com UEC obtiveram resposta completa e 14,6% tiveram resposta parcial.102
Terapias imunológicas direcionadas para urticária espontânea crônica
| Medicamento | Mecanismo de ação | Dose e via de administração | Indicação | Eficácia | FDA | Nível de evidência | Grau de recomendação |
|---|---|---|---|---|---|---|---|
| Omalizumabe | Anti‐IgE | 150‐300 mg a cada quatro semanas/SC | Pacientes que permanecem sintomáticos apesar da dose de anti‐H1 4× | 75,3% de resposta completa em 40 semanas100 | Sim | I | A |
| Se refratária, considerar 600 mg a cada quatro semanas/SC | |||||||
| Ligelizumabe | Anti‐IgE | 72‐240 mg a cada quatro semanas/SC | Pacientes que permanecem sintomáticos apesar da dose de anti‐H1 4× | 44% de resposta completa na semana 12102,103 | Não | I | B |
| Secuquinumabe | Anti‐IL‐17 | Dose de indução: 150 mg nas semanas 0, 1, 2 e 3/SC Manutenção: 150 mg a cada duas semanas/SC | Refratária ao omalizumabe (no contexto de pesquisa) | Redução de 82% no UAS7 na semana 12108 | Não | III | C |
| Dupilumabe | Anti‐IL‐4/13 | Dose de indução: 600 mg semana 0/SC | Refratária ao omalizumabe (no contexto da pesquisa) | Melhora em uma série de casos de seis pacientes105 | Não | III | C |
| Dose de manutenção: 300 mg a cada duas semanas/SC | |||||||
| Lirentelimabe | Anti‐SIGLEC‐8 | Dose inicial: 0,3 mg/kg no dia 0 | Pacientes que permanecem sintomáticos apesar da dose de anti‐H1 4× (no contexto de pesquisa) | 92% de resposta completa em 22 semanas104 | Não | I | B |
| Doses subsequentes: 1 mg/kg nos dias 29, 57, 85, 113 e 141/IV | |||||||
| Benralizumabe | Anti‐IL‐5 | Dose de indução: 30 mg a cada quatro semanas por três doses/SC | Estudos de fase 2 em andamento em UEC refratária ao antiH1 | 56% de resposta completa em 20 semanas106 | Não | II | B |
| Dose de manutenção: 30 mg a cada oito semanas/SC | |||||||
| Mepolizumabe | Anti‐IL‐5 | 100‐300 mg a cada quatro semanas/SC | Estudos de fase 2 em andamento em UEC refratária ao antiH1 | Estudos de fase 2 em andamento106 | Não | III | C |
SC, subcutânea; IV, intravenosa; UAS7, Urticaria Activity Score por 7 dias seguidos.
O ligelizumabe, um mAb anti‐IgE, ainda está em estudo, mas ensaios clínicos recentes para o tratamento da UEC estão mostrando eficácia semelhante ao omalizumabe.103,104
Lirentelimabe é mAb de lectina 8 semelhante à imunoglobulina com ligação ao ácido antissiálico (anti‐SIGLEC‐8, um receptor inibitório presente em eosinófilos e mastócitos). A ligação ao SIGLEC‐8 induz a morte de eosinófilos, inibe a degranulação mediada por IgE dos mastócitos e a síntese de novo de prostaglandina D2. Os resultados de um estudo de fase 2 com lirentelimabe para o tratamento de UEC e para o tratamento de urticária induzível demonstraram 92% de resposta completa na semana 22 e apenas 36% de resposta completa em pacientes anteriormente refratários ao tratamento com omalizumabe.105
O dupilumabe demonstrou resposta parcial em relatos de casos.106 Benralizumabe e mepolizumabe, ambas moléculas experimentais anti‐IL‐5R e anti‐IL‐5, respectivamente, também foram utilizados.107 Em ambos os casos, os pacientes tratados apresentaram melhora clínica.108 O secuquinumabe tem sido usado em relatos de casos para o tratamento de UEC em pacientes refratários ao tratamento com anti‐histamínicos H1 e omalizumabe, mostrando redução significante na atividade da doença desde o início.109
Perfil de segurança da imunoterapia direcionada para UECOs efeitos adversos mais comuns, mas controláveis, do omalizumabe são cefaleia, dor abdominal superior, pirexia e reação local no local da injeção. Efeitos adversos mais graves, como reação anafilática, síncope e angioedema, foram relatados com frequência inferior a 1/1.000.98
Para o lirentelimabe, os EA mais comuns incluíram reações relacionadas à infusão, nasofaringite e cefaleia. Não ocorreram EA graves relacionados ao tratamento.105
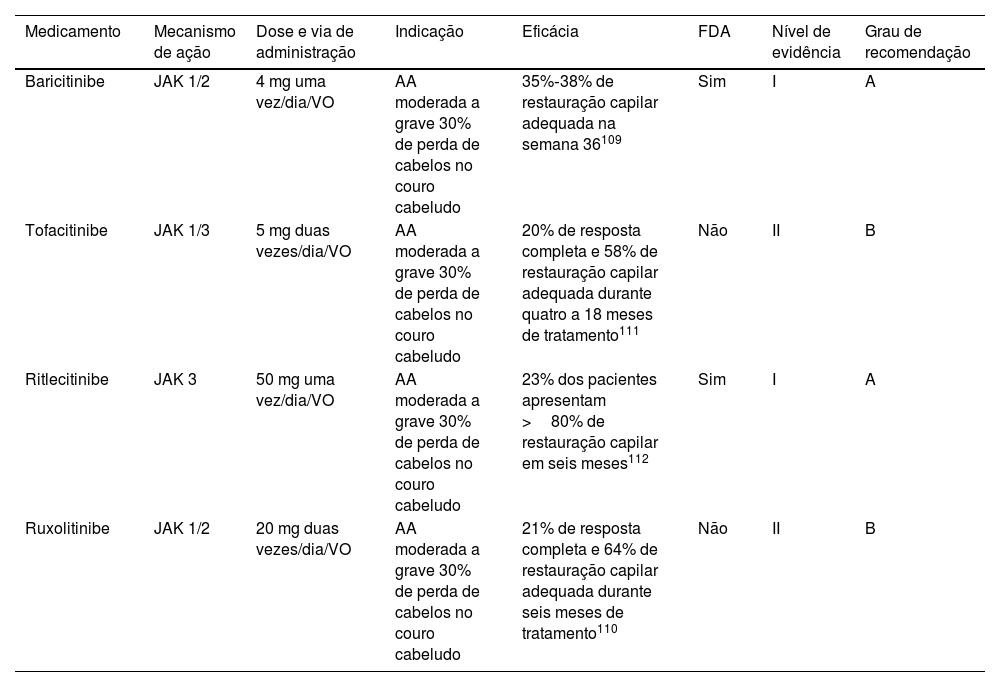
Alopecia areataAlopecia areata (AA) é doença autoimune decorrente da perda do privilégio imunológico do folículo piloso. Recentemente, a FDA aprovou o baricitinibe para tratamento de AA (2022) e muitos outros JAKis estão em estudo avançado para aprovação.
Critérios de eligibilidadeOs pacientes devem ser considerados para tratamento com JAKis se tiverem doença moderada ou grave (perda total de cabelos ≥ 30% do couro cabeludo por pelo menos três a seis meses, medida utilizando o escore da ferramenta Severity of Alopecia Tool [SALT] ou resposta refratária ao tratamento convencional nos últimos seis meses). Não há limitação quanto à duração anterior da alopecia e os estudos consideraram pacientes com ampla variação de duração da AA como candidatos ao tratamento com JAKis.110,111
TerapiaExiste apenas uma imunoterapia direcionada atualmente aprovada para AA, mas outras opções têm sido utilizadas com sucesso e devem ser selecionadas de acordo com diferentes critérios clínicos em cada paciente (tabela 6). A FDA aprovou o baricitinibe (2022), um JAK 1‐2i, para o tratamento de AA em adultos. Sua eficácia foi avaliada em dois ensaios randomizados, duplo‐cegos e controlados por placebo (BRAVE AA‐1 e BRAVE AA‐2).110 Os pacientes nesses estudos receberam 2 ou 4mg de baricitinibe por dia. Os resultados finais na semana 36 mostraram resposta adequada de 22% com 2mg e 38% com 4mg Resultados semelhantes foram observados no BRAVE AA‐2 (19% de resposta adequada com 2mg e 35% com 4mg).110 Tofacitinibe, um JAK 1‐3i, tem sido usado para tratar casos moderados a graves de AA com >50% de perda de cabelo no couro cabeludo em adultos, alcançando resposta completa em 20% dos pacientes tratados e 77% de resposta parcial em quatro a 18 meses de tratamento.112 Em 2023, a FDA aprovou o ritlecitinibe para o tratamento da AA em pessoas com mais de 12 anos com base nos resultados do estudo ALLEGRO, no qual 23% dos pacientes alcançaram recuperação capilar de pelo menos 80% após seis meses de tratamento.113 Ruxolitinibe é o último JAKi usado para o tratamento da AA, atingindo de forma geral resposta em 93% dos pacientes e resposta completa em 21% dos pacientes tratados em seis meses de seguimento.111
Terapias imunológicas direcionadas para alopecia areata
| Medicamento | Mecanismo de ação | Dose e via de administração | Indicação | Eficácia | FDA | Nível de evidência | Grau de recomendação |
|---|---|---|---|---|---|---|---|
| Baricitinibe | JAK 1/2 | 4 mg uma vez/dia/VO | AA moderada a grave 30% de perda de cabelos no couro cabeludo | 35%‐38% de restauração capilar adequada na semana 36109 | Sim | I | A |
| Tofacitinibe | JAK 1/3 | 5 mg duas vezes/dia/VO | AA moderada a grave 30% de perda de cabelos no couro cabeludo | 20% de resposta completa e 58% de restauração capilar adequada durante quatro a 18 meses de tratamento111 | Não | II | B |
| Ritlecitinibe | JAK 3 | 50 mg uma vez/dia/VO | AA moderada a grave 30% de perda de cabelos no couro cabeludo | 23% dos pacientes apresentam >80% de restauração capilar em seis meses112 | Sim | I | A |
| Ruxolitinibe | JAK 1/2 | 20 mg duas vezes/dia/VO | AA moderada a grave 30% de perda de cabelos no couro cabeludo | 21% de resposta completa e 64% de restauração capilar adequada durante seis meses de tratamento110 | Não | II | B |
VO, via oral.
O perfil de segurança dos medicamentos inibidores de JAK foi extensivamente estudado e, em geral, todos os JAKis utilizados para o tratamento de AA são bem tolerados. Infecções do trato respiratório superior, hipercolesterolemia, creatina fosfoquinase elevada, cefaleia, diarreia e nasofaringite são os EA relatados com mais frequência. Os efeitos adversos menos comuns incluíram outras infecções, como herpes‐zóster, herpes‐simples, infecções do trato urinário e gastroenterite.110–112
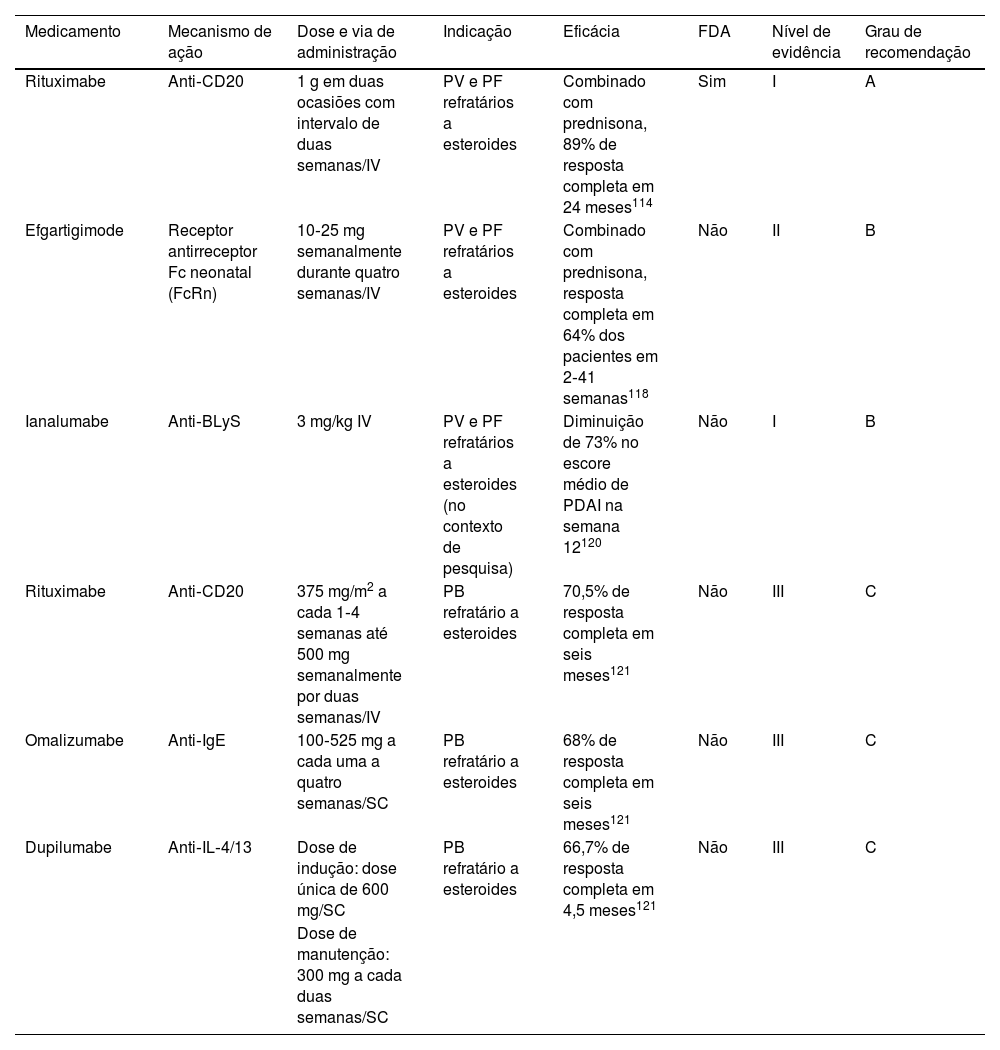
Doenças bolhosas autoimunesAs doenças bolhosas autoimunes são um grupo de doenças caracterizadas pela produção de autoanticorpos contra moléculas de adesão da pele.114 Essa revisão irá discutir a imunoterapia direcionada para pênfigo vulgar (PV), pênfigo foliáceo (PF) e penfigoide bolhoso (PB).
Critérios de eligibilidadeOs pacientes são candidatos à imunoterapia direcionada como opção de primeira linha em casos de PV/PF moderado a grave de início recente ou em pacientes previamente tratados que não alcançam remissão clínica com corticosteroides sistêmicos ou adjuvantes imunossupressores.114 A gravidade da doença deve ser medida por meio do escore do Pemphigus Disease and Area Index (PDAI). O envolvimento múltiplo das mucosas (oral, nasofaríngea, conjuntival, genital) ou PDAI ≥15 são considerados doença moderada. Pacientes com escore PDAI ≥45 ou lesões orais, disfagia e perda ponderal apresentam doença grave.115,116
TerapiaO rituximabe é o único medicamento biológico aprovado pela FDA (2018) para doenças bolhosas e é considerado a primeira opção terapêutica para PV e PF pelas diretrizes internacionais.116 Essa aprovação foi baseada nos resultados do Rituxi3,115 no qual 89% dos pacientes com pênfigo tratados com rituximabe e prednisolona oral estavam livres da doença e sem necessidade de qualquer tratamento adicional após 24 meses, em comparação com 34% com prednisolona isoladamente. O tratamento com rituximabe também reduziu a dose de corticosteroides necessária para a remissão clínica, reduzindo os efeitos adversos associados a altas doses de esteroides117 (tabela 7).
Terapias imunológicas direcionadas para doenças bolhosas
| Medicamento | Mecanismo de ação | Dose e via de administração | Indicação | Eficácia | FDA | Nível de evidência | Grau de recomendação |
|---|---|---|---|---|---|---|---|
| Rituximabe | Anti‐CD20 | 1 g em duas ocasiões com intervalo de duas semanas/IV | PV e PF refratários a esteroides | Combinado com prednisona, 89% de resposta completa em 24 meses114 | Sim | I | A |
| Efgartigimode | Receptor antirreceptor Fc neonatal (FcRn) | 10‐25 mg semanalmente durante quatro semanas/IV | PV e PF refratários a esteroides | Combinado com prednisona, resposta completa em 64% dos pacientes em 2‐41 semanas118 | Não | II | B |
| Ianalumabe | Anti‐BLyS | 3 mg/kg IV | PV e PF refratários a esteroides (no contexto de pesquisa) | Diminuição de 73% no escore médio de PDAI na semana 12120 | Não | I | B |
| Rituximabe | Anti‐CD20 | 375 mg/m2 a cada 1‐4 semanas até 500 mg semanalmente por duas semanas/IV | PB refratário a esteroides | 70,5% de resposta completa em seis meses121 | Não | III | C |
| Omalizumabe | Anti‐IgE | 100‐525 mg a cada uma a quatro semanas/SC | PB refratário a esteroides | 68% de resposta completa em seis meses121 | Não | III | C |
| Dupilumabe | Anti‐IL‐4/13 | Dose de indução: dose única de 600 mg/SC | PB refratário a esteroides | 66,7% de resposta completa em 4,5 meses121 | Não | III | C |
| Dose de manutenção: 300 mg a cada duas semanas/SC |
SC, subcutânea; IV, intravenosa; PDAI, Pemphigus Disease and Area Index.
Efgartigimode é anticorpo IgG1 humano direcionado ao receptor Fc neonatal. O bloqueio do receptor Fc neonatal diminui a disponibilidade de anticorpos IgG patogênicos e foi testado para o tratamento de PF e PV.118 Em um ensaio de fase 2, a utilização isolada de efgartigimode demonstrou controle precoce da doença em 90% dos pacientes após 17 dias. Combinado com prednisona, levou à remissão clínica completa em 64% dos pacientes após seis meses.119 Dois ensaios clínicos de fase 3 avaliando a eficácia e a segurança do efgartigimode em adultos com pênfigo (NCT04598451 e NCT04598477) estão em andamento.117
O fator de ativação de células B (BAFF), também conhecido como estimulador de linfócitos B (BLyS), é um importante ativador de células B.120 O ianalumabe é um mAb experimental que se liga ao BLyS. Um ensaio clínico de fase 2 foi conduzido para determinar as doses, o benefício e a segurança do ianalumabe em pacientes com PV, mostrando diminuição de 73% no escore médio do PDAI na semana 12 em sete pacientes com pênfigo em comparação com controles tratados com placebo.121
Tratamento com rituximabe, omalizumabe e dupilumabe está relatado em pacientes com PB. Cao et al.122 conduziram uma revisão sistemática para avaliar o uso desses três produtos biológicos em pacientes com PB refratários ao uso de outras terapias sistêmicas, como corticosteroides sistêmicos, metotrexato, micofenolato de mofetil, azatioprina, ciclosporina e ciclofosfamida. Os autores descobriram que o rituximabe levou à remissão completa em 70,5% e à remissão parcial em 23,8% dos pacientes após seis meses de seguimento, com taxa de recorrência de 20,5%.122 O omalizumabe levou à remissão completa em 67,9% e à remissão parcial em 20,8% dos pacientes em seis meses, com taxa de recorrência de 5,7%.122 O dupilumabe levou à remissão completa em 66,7% e à remissão parcial em 19,4% dos pacientes após 4,5 meses de tratamento, com taxa de recorrência de 5,6%.123,124
Perfil de segurança da imunoterapia direcionada para doenças bolhosasEmbora o rituximabe seja um excelente medicamento para PV ou PF graves, ele também está associado a EA graves bem conhecidos. Os mais bem documentados são reações à infusão, infecções, distúrbios cardíacos e casos de leucoencefalopatia multifocal progressiva fatal.114 A maioria desses EA pode ser controlada clinicamente se forem reconhecidos no estágio inicial.
Um estudo recente mostrou que o tratamento com rituximabe foi associado a menor risco de desenvolvimento de comorbidades cardiovasculares e metabólicas, por isso pode ser particularmente preferido em indivíduos com fatores de risco cardiovasculares e metabólicos, para os quais os EA relacionados aos corticosteroides devem ser rigorosamente evitados.125
Outras doenças dermatológicasSerão consideradas nesta seção doenças com evidências escassas (pequenos ensaios ou séries de casos, evidências indiretas de outras doenças ou ensaios em andamento sem resultados) ou com terapia tópica, mas sem terapia sistêmica disponível (tabela 8).
Terapias imunológicas direcionadas para outras doenças
| Doença | Medicamento | Mecanismo de ação | Dose e via de administração | Indicação | Eficácia | FDA | Nível de evidência | Grau de recomendação |
|---|---|---|---|---|---|---|---|---|
| SSJ/NET | Etanercepte | Anti‐TNF‐α | <65 kg: 25 mg dias 0 e 3/SC | Em uso no contexto de pesquisa | Mortalidade de 7,6%126 | Não | III | C |
| >65 kg: 50 mg dias 0 e 3/SC | ||||||||
| Infliximabe | Anti‐TNF‐α | 5 mg/kg dose única/IV | Em uso no contexto de pesquisa | Mortalidade de 22%127 | Não | III | C | |
| Líquen plano | Adalimumabe | Anti‐TNF‐α | Dose de indução: 80 mg semana 0/SC, 40 mg semana 1/SC | 2ª linha em LP mucoso, 3ª linha em LP cutâneo | Melhora no prurido e na cicatrização de lesões cutâneas durante um período de seis meses133 | Não | III | C |
| Dose de manutenção: 40 mg a cada duas semanas SC | ||||||||
| Ruxolitinibe | JAK 1/2 | 1,5% tópico duas vezes ao dia | Líquen plano cutâneo | Diminuição de 7,6 pontos de mCAILS em quatro semanas134 | Não | II | B | |
| Tofacitinibe | JAK 1/3 | 5 mg duas vezes/dia/VO | Líquen plano pilar e líquen plano hipertrófico | Melhora de 46% no LPPAI em 12 semanas no líquen plano pilar145 | Não | III | C | |
| Lúpus Eritematoso Cutâneo | Anifrolumabe | Anti‐IFN‐γ | 300 mg/IV a cada quatro semanas | Sintomas cutâneos no contexto de lúpus eritematoso sistêmico | 49% dos pacientes alcançaram redução no escore CLASI ≥ 50%140 | Sim | I | A |
| Vitiligo | Ruxolitinibe | JAK 1/2 | 1,5% tópico duas vezes ao dia | <10% ASC | Melhora de 75% no VASI em 30% dos pacientes na semana 24141 | Sim | I | A |
| Tofacitinibe | Inibidor de JAK 1/3 | 2% tópico duas vezes/dia | <10% ASC | Melhora de 70% no VASI em quatro meses (áreas expostas ao sol)142 | Não | III | C | |
| Tofacitinibe | JAK 1/3 | 5 mg duas vezes/dia/VO | >10% ASC | Diminuição de 5,4% na ASC em 50% dos pacientes143 | Não | II | B | |
| Granuloma anular | Tofacitinibe | JAK 1/3 | 5 mg duas vezes/dia/VO | Refratário à esteroides | RC (apenas relatos de casos)146 | Não | III | C |
| Sarcoidose | Tofacitinibe | JAK 1/3 | 5 mg duas vezes/dia/VO | Refratária à esteroides | Melhora em séries de casos146 | Não | III | C |
| DiHS/DRESS | Tofacitinibe | JAK 1/3 | 5 mg duas vezes/dia/VO | Refratária à esteroides | RC (apenas relatos de casos)131,132 | Não | III | C |
| Etanercepte | Anti‐TNF‐α | 50 mg dose única /SC | Primeira linha | RC (apenas relatos de casos)131,132 | Não | III | C | |
| Síndrome hipereosinofílica | Tofacitinibe | JAK 1/3 | 5 mg duas vezes/dia/VO | Refratária à esteroides | RC (apenas relatos de casos)147 | Não | III | C |
| Ruxolitinibe | JAK 1/2 | 25 mg de manhã‐10 mg à noite/VO | Refratária à esteroides | RC (apenas relatos de casos)137 | Não | III | C | |
| Morfeia | Tofacitinibe | JAK 1/3 | 10 mg duas vezes/dia/VO | Refratária à esteroides | Melhora em relato de caso149 | Não | III | C |
SC, subcutânea; VO, via oral; RC, resposta completa.
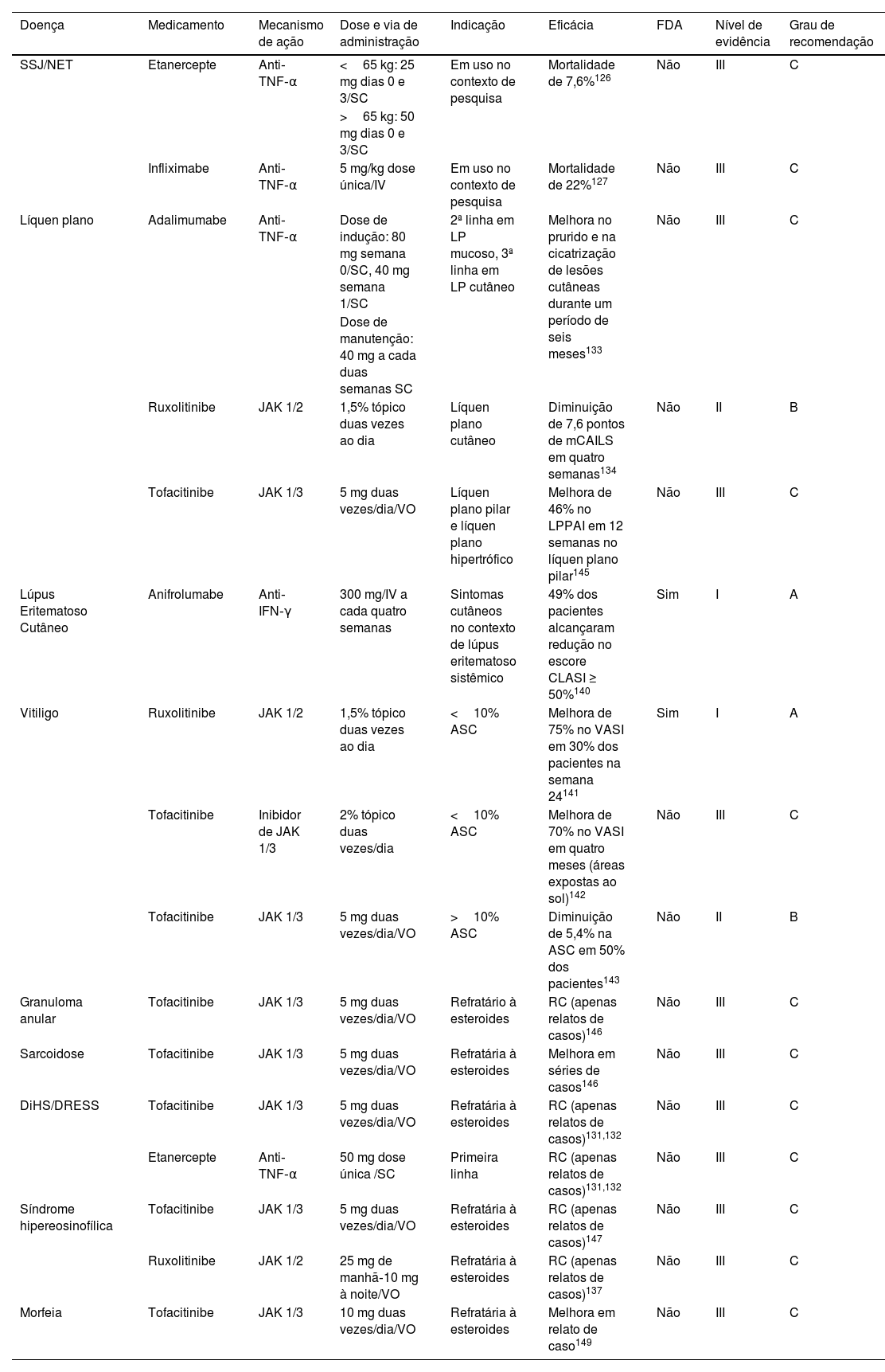
A síndrome de Stevens‐Johnson/necrólise epidérmica tóxica (SSJ/NET) é doença mucocutânea grave e rara causada pela exposição a determinados medicamentos – os mais frequentes são sulfonamidas, anticonvulsivantes, anti‐inflamatórios não esteroides, alopurinol e penicilinas.126 Em virtude de sua baixa incidência, o uso relatado de produtos biológicos nessa doença foi limitado principalmente a séries de casos e apenas dois ensaios.126–128 Com os dados atuais, a eficácia e a segurança da monoterapia biológica e da terapia combinada não podem ser determinadas de maneira conclusiva, e o papel final desses medicamentos ainda está sendo pesquisado.
O maior número de casos relatados está relacionado com o etanercepte. O regime terapêutico mais utilizado é 25mg (em crianças com peso <65kg) e 50mg (adultos ou crianças >65kg) nos dias 0 e 3. A monoterapia com etanercepte alcançou reepitelização em 13 dias e taxa de mortalidade de 7,6%, enquanto os pacientes tratados com etanercepte em combinação com corticosteroides alcançaram reepitelização em 11,1 dias e tiveram taxa de mortalidade de 7,7%.126 Wang et al.127 conduziram um ECR no qual 96 pacientes com SSJ/NET foram incluídos para comparar os efeitos do etanercepte aos corticosteroides tradicionais. O estudo demonstrou que o etanercepte diminuiu a mortalidade prevista com base no escore de gravidade específico para NET (SCORTEN) em cerca de 9,4% em comparação aos corticosteroides tradicionais.127 O infliximabe geralmente era usado na dose de 5mg/kg.126 Em relatos de casos de pacientes tratados com infliximabe em monoterapia, o número médio de dias até a reepitelização foi de 10,4 e não houve relatos de mortalidade.126 Nos relatos de casos de NET tratados com a combinação infliximabe/corticosteroides sistêmicos, o número médio de dias para reepitelização foi de 14,2 e a taxa média de mortalidade foi de 22,2%. Uma revisão Cochrane recente mostrou que o etanercepte 25mg (50mg se >65kg) duas vezes por semana até a cicatrização das lesões cutâneas pode reduzir a mortalidade específica da doença em comparação com os corticosteroides (RR=0,51; IC95% 0,16‐1,63). com possíveis benefícios e possíveis danos.129
Em relação ao uso de imunoterapia direcionada utilizada na SSJ/NET em comparação aos corticosteroides, não houve diferença estatística observada entre os dois grupos de tratamento na incidência de EA; entretanto, houve menor incidência de hemorragia gastrintestinal relatada com produtos biológicos versus corticosteroide tradicional.126,127,130
DiHS/DRESSA síndrome de hipersensibilidade induzida por medicamentos/reação a medicamentos com eosinofilia e sintomas sistêmicos (DiHS/DRESS) é uma reação medicamentosa grave com mortalidade de 10%.131 Casos de sucesso foram publicados usando terapia imunológica direcionada. Em um relato recente estudando dois casos de DRESS associado a envolvimento miocárdico, tofacitinibe 5mg duas vezes ao dia foi usado (por três anos) sequencialmente associado a corticosteroides, ciclosporina, metotrexato ou IVIg.132 Os dois casos demonstraram remissão quando o tofacitinibe foi utilizado.132
Um estudo relato de casos anterior de 10 pacientes com DRESS demonstrou tempo médio de cicatrização de 8,5 dias após injeção subcutânea de 50mg de etanercepte.131 Por fim, há um único relato de caso de paciente tratado com sucesso com mepolizumabe.133
Líquen planoO adalimumabe é a única imunoterapia direcionada recomendada pelas diretrizes internacionais para o tratamento de LP cutâneo e mucoso, em casos refratários graves.134 Seu uso melhora o prurido e obtém a cicatrização das lesões cutâneas em um período de seis meses.134 Outra imunoterapia direcionada para LP é o ruxolitinibe tópico, que está em estudos de fase 2 para tratar LP cutâneo.135 Ele foi testado como creme a 1,5% duas vezes ao dia, mostrando melhora no escore clínico e escore modificado do Composite Assessment of Index Lesion Severity (mCAILS) após quatro semanas de tratamento.135 O uso de tofacitinibe foi relatado em séries de casos em doses de 5mg (duas vezes ao dia) em períodos de seguimento variando de dois a nove meses para tratar líquen plano pilar (LPP) e LP hipertrófico, mostrando melhora clínica e no escore LPP Activity Index (LPPAI).136 O relato do uso de outros JAKis, como upadacitinibe ou baricitinibe, é escasso. Há 13 pacientes relatados em séries de casos e relatos de casos usando baricitinibe para LPP, com cinco alcançando resolução parcial, sete sem resolução e apenas um com resolução completa. Há apenas dois relatos de caso com o uso de upadacitinibe para LP, e ambos obtiveram resolução completa.137 Por fim, estudos de fase 2 estão sendo realizados atualmente com ixequizumabe (LP cutâneo, LPP) e secuquinumabe (LP cutâneo, LPP e LP oral).138
Lúpus eritematoso cutâneoA FDA aprovou o anifrolumabe para o lúpus eritematoso sistêmico (LES) em julho de 2021.139 O anifrolumabe é anticorpo monoclonal totalmente humanizado que inibe seletivamente o receptor 1 do IFN‐α.139 No ECR TULIP‐2, o anifrolumabe foi testado para o tratamento do LES, em pacientes com doença cutânea pelo menos moderadamente grave, e 49% dos pacientes obtiveram redução no escore Cutaneous Lupus Erythematosus Disease Area and Severity Index (CLASI) ≥ 50% em comparação com 25% no grupo placebo.140 O belimumabe é outro medicamento aprovado pela FDA em 2011 para tratamento do LES. Ainda não há resultados finais específicos para a pele em relação a esse medicamento no LEC.141
VitiligoPara o vitiligo, o ruxolitinibe tópico foi aprovado pela FDA em 2022 para o tratamento de doença não segmentar comprometendo <10% da ASC em pacientes adultos e pediátricos com >12 anos. Em dois ensaios de fase 3 (TRuE‐V1 e TRuE‐V2), os indivíduos foram randomizados para tratamento com ruxolitinibe creme a 1,5% ou placebo duas vezes ao dia durante duas semanas. No final do período de tratamento de 24 semanas, 30% dos pacientes que receberam ruxolitinibe tiveram pelo menos 75% de melhora no Vitiligo Area Scoring Index (VASI) facial, em comparação com 10% dos pacientes que receberam placebo.142 Também nesses estudos, o creme de ruxolitinibe mostrou melhora na pigmentação acral, o que historicamente tem sido uma área refratária à repigmentação com fototerapia, corticosteroides tópicos e tacrolimus.142 Um estudo piloto com 11 pacientes com vitiligo facial usando creme de tofacitinibe 2% em conjunto com UVB de banda estreita mostrou redução de 70% no escore VASI após dois a quatro meses.143 Por outro lado, uma série de casos de 10 pacientes em uso de tofacitinibe 5mg duas vezes ao dia por 10 meses e UVB de banda estreita ou fotoexposição obteve diminuição de apenas 5,4% na ASC (cinco pacientes) e outros cinco pacientes não alcançaram qualquer repigmentação.144
Doenças granulomatosas cutâneas (granuloma anular e sarcoidose)As doenças granulomatosas podem representar desafios terapêuticos. O manejo pode ser insatisfatório com a terapia sistêmica convencional.145 O tratamento com anti‐TNF foi tentado com resultados variáveis.146 A imunoterapia direcionada para JAKis parece ser opção promissora com base nos resultados de séries de casos recentes.147 Tofacitinibe 5mg duas vezes ao dia foi utilizado em pacientes que não responderam aos corticosteroides. Em relato de casos de apenas um paciente, a remissão completa foi obtida após quatro meses de tratamento. Para sarcoidose (três pacientes), a mesma série de casos mostrou resposta completa em dois pacientes e melhora de 96% em um paciente.147 Mais ECRs são necessários para estabelecer o valor real dos JAKis nas doenças granulomatosas.
Síndrome hipereosinofílicaUma série de casos de cinco pacientes refratários a esteroides tratados com tofacitinibe 5mg duas vezes ao dia mostrou remissão completa em três deles e remissão quase completa em outro.148 O paciente restante não conseguiu completar o tratamento com tofacitinibe por motivos relacionados ao seguro de saúde, e o tratamento foi alterado para ruxolitinibe 25mg pela manhã e 10mg à noite. Esse paciente também obteve remissão completa.148
MorfeiaHá casos de sucesso com uso de imunoterapia direcionada para casos refratários de morfeia. Em dois pacientes com morfeia profunda generalizada associada à fasciíte eosinofílica que não responderam à corticoterapia, tofacitinibe (10mg duas vezes ao dia) foi adicionado à fototerapia e ao metotrexato, proporcionando melhora clínica em ambos.149 Foi relatado que tocilizumabe (um medicamento anti‐IL‐6) é eficaz no tratamento da morfeia panesclerótica.150,151 Uma adolescente de 14 anos foi tratada com sucesso com infliximabe.150
ConclusãoMuitas terapias imunológicas direcionadas são atualmente empregadas no tratamento de doenças dermatológicas inflamatórias. Algumas dessas moléculas ganharam papel importante no tratamento de doenças cutâneas crônicas e incapacitantes que não eram anteriormente controladas com tratamentos padrão, como o anti‐IL‐4/13 na DA, o anti‐TNF‐α na HS ou os inibidores de JAK na AA, gerando mudança de paradigma no arsenal terapêutico da dermatologia.44,152,153 Além disso, os avanços na compreensão da fisiopatologia dessas doenças facilitaram abordagens terapêuticas direcionadas para vias inflamatórias, como o bloqueio de citocinas dependentes de JAK‐STAT IL‐5, IL‐6, IL‐10 e IL‐13 em DiHS/DRESS.132
Existem alguns aspectos críticos no desenvolvimento de terapias direcionadas para doenças inflamatórias da pele que devem ser considerados. A segurança em longo prazo é um aspecto relevante de todos os novos medicamentos. Alguns EA podem permanecer latentes durante os ensaios clínicos, aparecendo apenas com o uso prolongado. Outros – em muito poucos pacientes – podem surgir desde o início do tratamento, induzindo uma reação paradoxal com piora do quadro clínico sob tratamento com imunoterapia direcionada (p. ex., PG, psoríase).34,35,90 A colaboração entre agências reguladoras, profissionais de saúde e indústria farmacêutica é essencial na vigilância pós‐comercialização e nos estudos de seguimento de longo prazo para avaliar a segurança e a eficácia desses novos medicamentos.154
Para que um medicamento seja considerado viável, ele deve garantir resultados clínicos superiores em comparação com os tratamentos existentes. Isso levou os estudos a utilizarem variáveis clinimétricas cada vez melhores (p. ex., PASI‐75 vs. PASI‐90 na psoríase),12 mas não necessariamente a melhores comparações. Para comparar a eficácia entre medicamentos, os pesquisadores realizaram metanálises em rede, o que fornece algumas informações, mas tem suas limitações.44 Essa dificuldade de comparação direta com os medicamentos antigos ocorre, por exemplo, no caso de JAKi versus metotrexato na DA moderada a grave, JAKi versus NB‐UVB no vitiligo e etanercepte versus prednisona na DRESS.18,44,133,142 Faltam estudos que avaliem o impacto econômico dessas decisões e que possam ajudar a aumentar o acesso a essas novas terapias.155
Apesar da eficácia demonstrada em ensaios e estudos de evidências clínicas, as terapias direcionadas ainda são subutilizadas, especialmente em regiões de baixa ou média renda, em virtude da disponibilidade limitada e da cobertura de seguro inadequada. No Chile, por exemplo, 92% da população não têm cobertura para terapia direcionada para doenças cutâneas, o que leva a despesas pessoais.156 Situação semelhante é observada no Peru, e condições ligeiramente melhores no Brasil.156 Em uma pesquisa realizada pelo International Psoriasis Council em países com poucos recursos ou em desenvolvimento, incluindo Argentina, Brasil, Chile, Colômbia, México, Peru, China, Egito, Irã, Índia e África do Sul, os dermatologistas geralmente citaram o custo como a principal barreira ao acesso à terapia biológica para a psoríase.157
A maioria das Diretrizes de Prática Clínica (DPC) para doenças inflamatórias da pele incorpora uma estratificação lógica do manejo médico em diferentes estágios da doença.28,45,75,100,116 Essa estratificação pode não refletir com precisão as condições sociossanitárias em várias regiões do mundo. A maioria (72,1%) das DPCs dermatológicas é originária de países com alto índice sociodemográfico (ISD), enquanto apenas uma pequena proporção vem de países de médio‐alto (8,0%), médio (5,3%) e baixo ISD (1,8%).158 Geograficamente, a distribuição também não é uniforme, correspondendo a 51,8% na Europa, 21,2% na América do Norte, 15,5% na Ásia, 4,9% na América Latina e 4,4% na Australásia.158 Assim, as DPCs adaptadas às necessidades regionais nos países em desenvolvimento ainda são escassas e necessárias para melhor manejo dos pacientes que utilizam terapia direcionada para doenças inflamatórias da pele.
Esses novos moduladores imunológicos direcionados para o tratamento de doenças inflamatórias da pele estão passando pelas mesmas etapas históricas de desenvolvimento pelas quais muitos medicamentos importantes atualmente em uso passaram. Os dados apresentados e o elevado número de novos manuscritos que aparecem diariamente na literatura médica preveem um futuro promissor para a utilização desses medicamentos no tratamento de doenças crônicas da pele melhorando a qualidade de vida dos pacientes.
Suporte financeiroNenhum.
Contribuição dos autoresEdinson Lopez: Concepção e planejamento do estudo; obtenção, análise e interpretação dos dados; redação do manuscrito ou revisão crítica de conteúdo intelectual importante; revisão crítica da literatura; aprovação da versão final do manuscrito.
Raul Cabrera: Concepção e planejamento do estudo; obtenção, análise e interpretação dos dados; redação do manuscrito ou revisão crítica de conteúdo intelectual importante; revisão crítica da literatura; aprovação da versão final do manuscrito.
Cristóbal Lecaros: Concepção e planejamento do estudo; coleta, análise e interpretação dos dados; redação do manuscrito ou revisão crítica de conteúdo intelectual importante; revisão crítica da literatura; aprovação da versão final do manuscrito.
Conflito de interessesNenhum.
Como citar este artigo: López E, Cabrera R, Lecaros C. Targeted therapy for immune mediated skin diseases. What should a dermatologist know? An Bras Dermatol. 2024;99:546–67.
Trabalho realizado no Departamento de Dermatologia, Faculdade de Medicina, Universidad del Desarrollo‐Clínica Alemana de Santiago, Santiago, Chile.