O desenvolvimento de agentes imunobiológicos teve grande impacto no tratamento da psoríase. A sobrevida de droga é o período de tempo entre o início do tratamento até sua interrupção.1 Como a principal razão para a descontinuação dos medicamentos é a perda de eficácia, a sobrevida de droga pode ser considerada uma medida da probabilidade de sucesso dos agentes biológicos nos pacientes com psoríase moderada a grave.2 Estudos que avaliem a sobrevida de drogas imunobiológicas na população brasileira devem ser incentivados.
Apresentamos uma coorte retrospectiva que incluiu pacientes com psoríase que fizeram uso de agentes biológicos, no Serviço de Dermatologia do Hospital de Clínicas de Porto Alegre, de junho de 2007 a março de 2018. Prontuários eletrônicos foram revisados. Os critérios de inclusão foram: pacientes que iniciaram adalimumabe (ADA), infliximabe (IFX), etanercepte (ETN), ustequinumabe (UST) ou secuquinumabe (SEC), como primeira, segunda, terceira ou quarta linha de tratamento biológico no período observado. Ixequizumabe, guselcumabe e risanquizumabe não foram incluídos na análise pois ainda não estavam disponíveis no Brasil. Os cursos de tratamento foram considerados individualmente; pacientes que receberam mais de um imunobiológico ao longo de sua participação no registro foram incluídos mais de uma vez na análise, considerando cada agente biológico ou linha de tratamento como uma nova inclusão. Pacientes que não descontinuaram o tratamento até a finalização do estudo foram censurados.
As análises estatísticas incluíram as descontinuações de tratamento por qualquer causa; também foram feitas análises censurando as interrupções como resultado de causas que não estivessem diretamente associadas à eficácia e tolerância no tratamento (desejo do paciente, plano de gestação, interrupção de recebimento). A sobrevida dos agentes biológicos foi analisada por meio das curvas de Kaplan‐Meier e foi comparada pelo teste de log rank. Os fatores de risco para a descontinuação foram identificados por regressão de Cox. Para todos os testes, o nível de significância estipulado foi de 0,05.
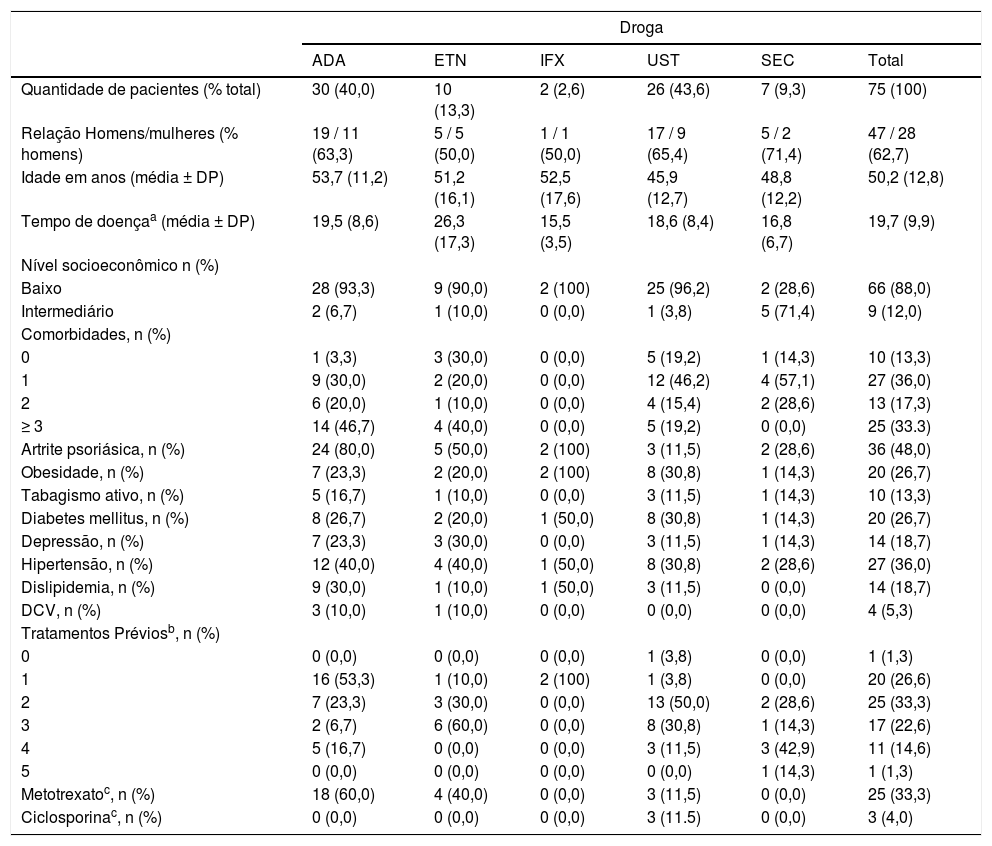
Um total de 106 cursos de tratamento com ADA (n = 36), ETN (n = 13), IFX (n = 8), UST (n = 36) e SEC (n = 13) foram administrados em 75 pacientes com psoríase moderada a grave. As características dos pacientes encontram‐se na tabela 1. Vinte e um pacientes (28,0%) fizeram uso de mais de um curso de tratamento.
Características dos pacientes com psoríase tratados com agentes imunobiológicos – primeira linha de tratamento
| Droga | ||||||
|---|---|---|---|---|---|---|
| ADA | ETN | IFX | UST | SEC | Total | |
| Quantidade de pacientes (% total) | 30 (40,0) | 10 (13,3) | 2 (2,6) | 26 (43,6) | 7 (9,3) | 75 (100) |
| Relação Homens/mulheres (% homens) | 19 / 11 (63,3) | 5 / 5 (50,0) | 1 / 1 (50,0) | 17 / 9 (65,4) | 5 / 2 (71,4) | 47 / 28 (62,7) |
| Idade em anos (média ± DP) | 53,7 (11,2) | 51,2 (16,1) | 52,5 (17,6) | 45,9 (12,7) | 48,8 (12,2) | 50,2 (12,8) |
| Tempo de doençaa (média ± DP) | 19,5 (8,6) | 26,3 (17,3) | 15,5 (3,5) | 18,6 (8,4) | 16,8 (6,7) | 19,7 (9,9) |
| Nível socioeconômico n (%) | ||||||
| Baixo | 28 (93,3) | 9 (90,0) | 2 (100) | 25 (96,2) | 2 (28,6) | 66 (88,0) |
| Intermediário | 2 (6,7) | 1 (10,0) | 0 (0,0) | 1 (3,8) | 5 (71,4) | 9 (12,0) |
| Comorbidades, n (%) | ||||||
| 0 | 1 (3,3) | 3 (30,0) | 0 (0,0) | 5 (19,2) | 1 (14,3) | 10 (13,3) |
| 1 | 9 (30,0) | 2 (20,0) | 0 (0,0) | 12 (46,2) | 4 (57,1) | 27 (36,0) |
| 2 | 6 (20,0) | 1 (10,0) | 0 (0,0) | 4 (15,4) | 2 (28,6) | 13 (17,3) |
| ≥ 3 | 14 (46,7) | 4 (40,0) | 0 (0,0) | 5 (19,2) | 0 (0,0) | 25 (33.3) |
| Artrite psoriásica, n (%) | 24 (80,0) | 5 (50,0) | 2 (100) | 3 (11,5) | 2 (28,6) | 36 (48,0) |
| Obesidade, n (%) | 7 (23,3) | 2 (20,0) | 2 (100) | 8 (30,8) | 1 (14,3) | 20 (26,7) |
| Tabagismo ativo, n (%) | 5 (16,7) | 1 (10,0) | 0 (0,0) | 3 (11,5) | 1 (14,3) | 10 (13,3) |
| Diabetes mellitus, n (%) | 8 (26,7) | 2 (20,0) | 1 (50,0) | 8 (30,8) | 1 (14,3) | 20 (26,7) |
| Depressão, n (%) | 7 (23,3) | 3 (30,0) | 0 (0,0) | 3 (11,5) | 1 (14,3) | 14 (18,7) |
| Hipertensão, n (%) | 12 (40,0) | 4 (40,0) | 1 (50,0) | 8 (30,8) | 2 (28,6) | 27 (36,0) |
| Dislipidemia, n (%) | 9 (30,0) | 1 (10,0) | 1 (50,0) | 3 (11,5) | 0 (0,0) | 14 (18,7) |
| DCV, n (%) | 3 (10,0) | 1 (10,0) | 0 (0,0) | 0 (0,0) | 0 (0,0) | 4 (5,3) |
| Tratamentos Préviosb, n (%) | ||||||
| 0 | 0 (0,0) | 0 (0,0) | 0 (0,0) | 1 (3,8) | 0 (0,0) | 1 (1,3) |
| 1 | 16 (53,3) | 1 (10,0) | 2 (100) | 1 (3,8) | 0 (0,0) | 20 (26,6) |
| 2 | 7 (23,3) | 3 (30,0) | 0 (0,0) | 13 (50,0) | 2 (28,6) | 25 (33,3) |
| 3 | 2 (6,7) | 6 (60,0) | 0 (0,0) | 8 (30,8) | 1 (14,3) | 17 (22,6) |
| 4 | 5 (16,7) | 0 (0,0) | 0 (0,0) | 3 (11,5) | 3 (42,9) | 11 (14,6) |
| 5 | 0 (0,0) | 0 (0,0) | 0 (0,0) | 0 (0,0) | 1 (14,3) | 1 (1,3) |
| Metotrexatoc, n (%) | 18 (60,0) | 4 (40,0) | 0 (0,0) | 3 (11,5) | 0 (0,0) | 25 (33,3) |
| Ciclosporinac, n (%) | 0 (0,0) | 0 (0,0) | 0 (0,0) | 3 (11.5) | 0 (0,0) | 3 (4,0) |
ADA, adalimumabe; ETN, etanercepte; IFX, infliximabe; UST, ustequinumabe; SEC, secuquinumabe; DCV, doença cardiovascular.
a Duração da psoríase em anos desde o início dos sintomas.
b Número de tratamentos sistêmicos prévios não biológicos, incluindo fototerapia.
c Uso concomitante ao biológico.
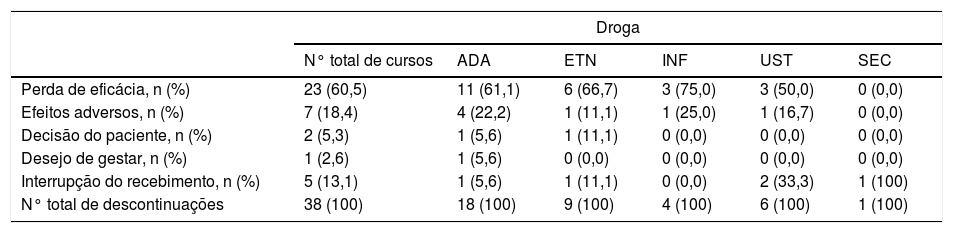
Dos 106 cursos iniciados, 38 foram descontinuados. A causa mais comum de descontinuação das terapias biológicas foi perda de eficácia (n = 23; 60,5%), seguida por descontinuação decorrente de eventos adversos (n = 7; 18,4%) e por interrupção do recebimento das medicações por questões governamentais e burocráticas (n = 5; 13,1%) (tabela 2). Dentre os efeitos adversos, o mais comum foi o desenvolvimento de quadros infecciosos (n = 4; 57%).
Razões de descontinuação de 106 cursos de tratamentos com agentes imunobiológicos para psoríase
| Droga | ||||||
|---|---|---|---|---|---|---|
| N° total de cursos | ADA | ETN | INF | UST | SEC | |
| Perda de eficácia, n (%) | 23 (60,5) | 11 (61,1) | 6 (66,7) | 3 (75,0) | 3 (50,0) | 0 (0,0) |
| Efeitos adversos, n (%) | 7 (18,4) | 4 (22,2) | 1 (11,1) | 1 (25,0) | 1 (16,7) | 0 (0,0) |
| Decisão do paciente, n (%) | 2 (5,3) | 1 (5,6) | 1 (11,1) | 0 (0,0) | 0 (0,0) | 0 (0,0) |
| Desejo de gestar, n (%) | 1 (2,6) | 1 (5,6) | 0 (0,0) | 0 (0,0) | 0 (0,0) | 0 (0,0) |
| Interrupção do recebimento, n (%) | 5 (13,1) | 1 (5,6) | 1 (11,1) | 0 (0,0) | 2 (33,3) | 1 (100) |
| N° total de descontinuações | 38 (100) | 18 (100) | 9 (100) | 4 (100) | 6 (100) | 1 (100) |
ADA, adalimumabe; ETN, etanercepte; IFX, infliximabe; UST, ustequinumabe; SEC, secuquinumabe.
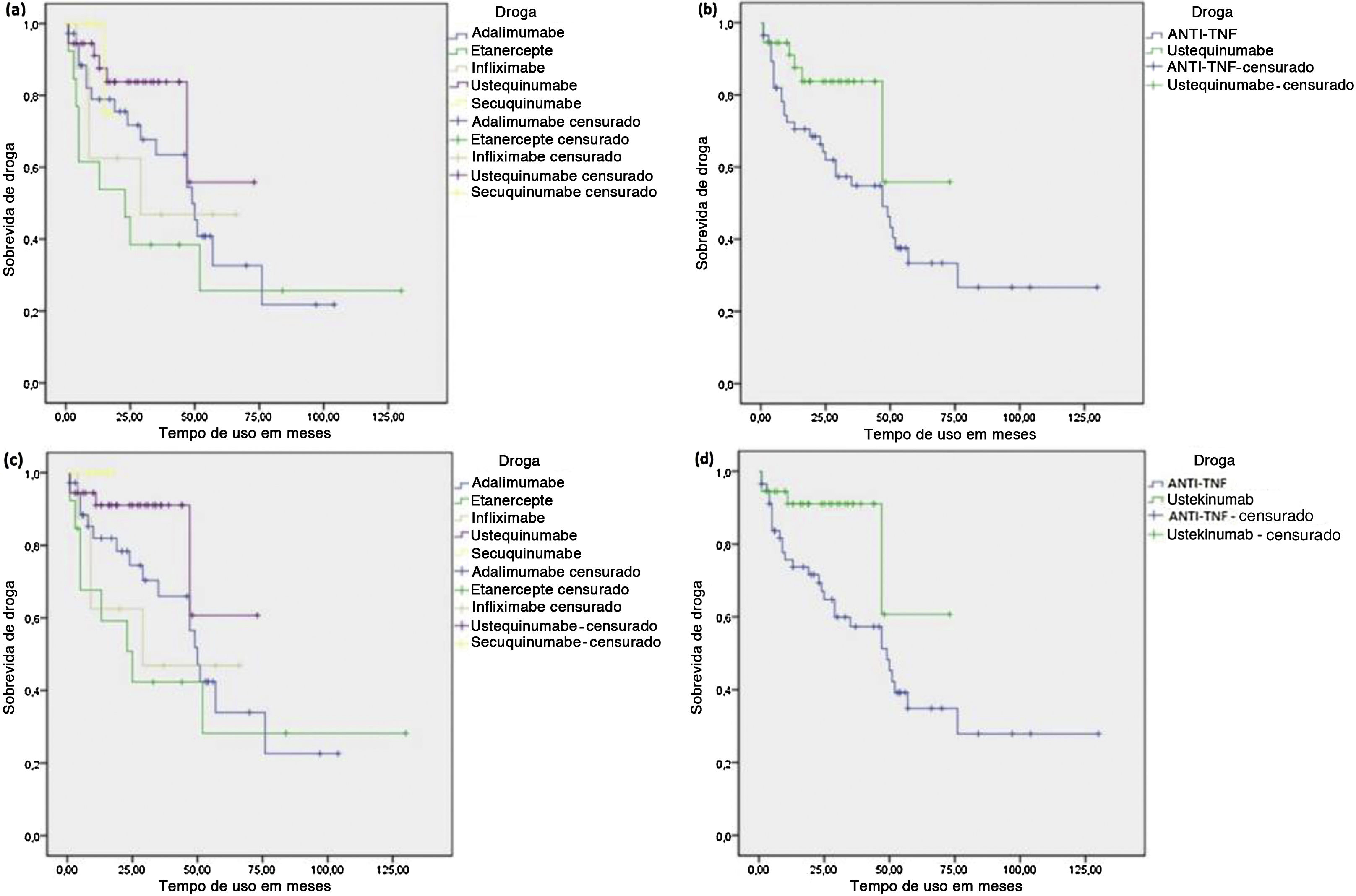
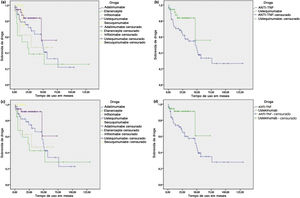
A mediana calculada de sobrevida das drogas imunobiológicas (IQ 25/75) em meses foi de 28,5 (8,0/52,0) para o ADA, 23,0 (4,5/48,0) para o ETN, 24,5 (9,0/52,0) para o IFX, 19,0 (11,0/34,0) para UST e 12,0 (8,0/15,5) para o SEC. As maiores medianas encontradas para os inibidores do fator de necrose tumoral (anti‐TNF) refletem o tempo maior que essas substâncias estão no mercado. UST e SEC tiveram menor mediana de sobrevida de droga como esperado, pois estão a menos tempo disponíveis no mercado. No entanto, apresentaram número absoluto e percentual de descontinuações de tratamento consideravelmente inferior, conforme observado na tabela 2. Contabilizando apenas as causas diretamente associadas à eficácia e tolerância no tratamento contínuo, os anti‐TNF foram responsáveis por 86,6% das descontinuações, versus 13,3% do UST e 0,0% do SEC.
O tempo até a interrupção foi maior para pacientes em uso de UST em comparação com o grupo de pacientes que utilizou anti‐TNF (teste de log rank p = 0,039) (fig. 1). Porém, quando o UST foi comparado com cada substância anti‐TNF isoladamente, houve diferença estatística apenas na comparação entre UST e ETN, com o UST apresentando maior sobrevida de droga (log rank p = 0,008). Quando as interrupções por causas não diretamente associadas à eficácia e tolerância no tratamento contínuo foram censuradas, os resultados foram semelhantes, com o UST novamente apresentando maior tempo até a interrupção em relação ao grupo combinado de anti‐TNF (log rank p = 0,037) e também em relação ao ETN isoladamente (log rank p = 0,018). No entanto, essa análise também identificou maior sobrevida do UST em relação ao IFX (log rank p = 0,045). Adicionalmente, a análise ainda mostrou que o SEC também teve maior sobrevida de droga em relação ao ETN (log rank p = 0,047) e ao IFX isoladamente (log rank p = 0,042) (fig. 1). Maior tempo até a interrupção também foi visto na análise do SEC em relação ao grupo combinado de anti‐TNF, apesar de não ter sido encontrada significância estatística (log rank p = 0,090).
Kaplan‐Meier – Análise de sobrevida de agentes biológicos na psoríase. (a) Sobrevida de droga para cada agente biológico, considerando todos os cursos de tratamento. (b) Sobrevida de droga comparando ustequinumabe (UST) e inibidores do fator de necrose tumoral (anti‐TNF), considerando todos os cursos de tratamento. (c) Sobrevida de droga para cada agente biológico, censurando interrupções por causas não diretamente associadas à eficácia e tolerância no tratamento. (d) Sobrevida de droga comparando UST e anti‐TNF, censurando interrupções por causas não diretamente associadas à eficácia e tolerância no tratamento.
Dentre as variáveis testadas por regressão de Cox, o maior número de comorbidades (HR 1,735; IC 95% 1,04‐2,28; p = 0,032) e o uso de um biológico prévio (HR 2,013; IC 95% 1,03‐2,87; p = 0,039) foram preditores positivos, estatisticamente significativos, para a probabilidade de interrupção do tratamento.
Nossos resultados confirmam observações anteriores de aumento da sobrevida de drogas imunobiológicas em pacientes tratados com UST e SEC.1–9 A menor taxa de descontinuação da medicação em comparação aos anti‐TNF é, provavelmente, atribuível a múltiplos fatores, entre eles: maior eficácia, perfil de efeito secundário favorável, intervalo de dosagem menos frequente e baixa imunogenicidade.2,10
Assim como em outros estudos independentes, a principal causa de descontinuidade durante o tratamento em longo prazo foi a perda gradual de eficácia. Eventos adversos foram mais frequentes no grupo ADA, corroborando o que foi visto em estudos prévios.1–7 E assim como em nosso estudo, o desenvolvimento de infecções também foi descrito por Gniadecki et al. como o evento adverso mais comum.6
Este estudo confirma os achados prévios de maior sobrevida dos imunobiológicos anti‐interleucinas UST e SEC em relação aos anti‐TNF no tratamento da psoríase. A presença de maior número de comorbidades e a exposição prévia a um agente biológico confirmaram, mais uma vez, serem preditores negativos para a manutenção do tratamento.3,6,7 Estudos com maior número de pacientes e maior tempo de seguimento são necessários.
Suporte financeiroNenhum.
Contribuição dos autoresElis Costa de Lima: Análise estatística; concepção e planejamento do estudo; elaboração e redação do manuscrito; obtenção, análise e interpretação dos dados; revisão crítica da literatura.
Juliana Catucci Boza: Aprovação da versão final do manuscrito; concepção e planejamento do estudo; participação efetiva na orientação da pesquisa; participação intelectual em conduta propedêutica e/ou terapêutica de casos estudados; revisão crítica do manuscrito.
Penélope Esther Palominos: Análise estatística; participação efetiva na orientação da pesquisa; revisão crítica do manuscrito.
Ricardo Machado Xavier: Revisão crítica do manuscrito.
Tania Ferreira Cestari: Participação intelectual em conduta propedêutica e/ou terapêutica de casos estudados; revisão crítica do manuscrito.
Conflito de interessesNenhum.
Como citar este artigo: Lima EC, Boza JC, Palominos PE, Xavier RM, Cestari TF. Survival of immunobiological drugs in psoriasis: preliminary data from a Tertiary Hospital experience in Southern Brazil. An Bras Dermatol. 2021;96:376–9.
Trabalho realizado no Hospital de Clínicas de Porto Alegre, Porto Alegre, RS, Brasil.