O tratamento de carcinomas basocelulares perioculares avançados é um desafio, pois a cirurgia pode envolver procedimentos altamente mutiladores. Vismodegib é o primeiro inibidor hedgehog seletivo aprovado para o tratamento de tumores localmente avançados ou doença metastática.
ObjetivoAnalisar os resultados do tratamento com vismodegib para carcinomas basocelulares perioculares avançados em um ambiente de prática clínica de um centro de referência entre 2014 e 2020.
MétodosEstudo longitudinal retrospectivo. O perfil demográfico dos pacientes, as comorbidades, as características do tumor e os resultados do tratamento foram analisados.
ResultadosForam incluídos 13 pacientes. O seguimento médio e a duração do tratamento foram de 15,9 e 10,5 meses, respectivamente. A taxa de resposta clínica objetiva foi de 76,9% – 30,8% tiveram uma resposta completa e 46,2% uma resposta parcial. A mediana da duração da resposta foi de 13 meses. Doença progressiva foi observada em 38,5% dos casos, com mediana de 19 meses após o início do tratamento. Oitenta e quatro por cento dos pacientes tiveram pelo menos um evento adverso, e 61,54% necessitaram interromper o tratamento temporária ou permanentemente para aumentar a tolerabilidade.
Limitações do estudoPor ser um estudo retrospectivo em um ambiente de prática clínica, a avaliação da resposta clínica objetiva foi condicionada pela subjetividade da análise do médico.
ConclusãoVismodegib é um tratamento seguro e eficaz para o carcinoma basocelular localmente avançado. Para prevenir recorrências, o medicamento deve ser utilizado continuamente quando tolerado. O papel do vismodegib neoadjuvante antes da cirurgia está sendo investigado e pode ser um passo importante na busca por um tratamento definitivo para esses casos.
O carcinoma basocelular (CBC) é o tipo de câncer mais comum na área periocular. É um tumor de crescimento lento, mas pode causar extensa destruição local da pele, dos músculos ou até mesmo dos ossos.1 Esses carcinomas basocelulares localmente avançados (CBCla) surgem de lesões iniciais que não foram tratadas ou de uma recorrência de subtipos agressivos de CBC. Quando localizados na área periocular, podem causar morbidade substancial. Carcinomas basocelulares metastáticos (CBCm) são extremamente raros.2,3
Na maioria dos casos, o CBC pode ser tratado com cirurgia, crioterapia ou ablação a laser. Outras terapias não cirúrgicas, como radioterapia, terapia fotodinâmica e tratamento tópico com imiquimode ou 5‐fluorouracil, podem ser utilizadas no CBC circunscrito localmente.2 O tratamento do CBCla periocular é um desafio, uma vez que cirurgia extensa e radioterapia podem determinar morbidade considerável.
A maioria dos CBC esporádicos mostra mutações que se iniciam na via sonic hedgehog e causam proliferação celular descontrolada.4 Por ser a principal condutora da patogênese e progressão do CBC, a via hedgehog representa um alvo terapêutico crítico.4 Vismodegib é o primeiro inibidor seletivo de hedgehog aprovado para o tratamento de CBCla ou CBCm em adultos que não podem ser tratados com cirurgia ou radioterapia.5
Este trabalho tem como objetivo descrever a experiência de um centro terciário de câncer utilizando vismodegib para CBCs perioculares avançados.
MétodosFoi conduzido um estudo longitudinal consecutivo retrospectivo dos pacientes que iniciaram tratamento com vismodegib (150mg/dia) para CBC periocular em um centro de câncer terciário entre julho de 2014 e janeiro de 2020. O perfil demográfico dos pacientes, os resultados do tratamento e os eventos adversos foram analisados.
O desfecho primário foi definido como uma taxa de resposta clínica objetiva (ORR, do inglês objective response rate), que era a soma da taxa de resposta completa e parcial. Resposta completa (RC) foi considerada como a ausência de tumor mensurável, e resposta parcial (RP), a diminuição do tamanho do tumor sem seu desaparecimento. Doença estável (DE) foi considerada quando o vismodegib foi capaz de interromper a progressão do tumor, mas não houve diminuição em seu tamanho. Quando o tumor apresentava características de crescimento continuado, era considerado doença progressiva (DP).
Outras variáveis avaliadas foram a duração do tratamento, a duração da resposta (DR) – o tempo desde o início da terapia até a DP, óbito ou a última data de controle quando ainda estava respondendo. O momento e a causa da morte também foram registrados.
Por último, a tolerabilidade do medicamento também foi estudada, analisando os eventos adversos de cada paciente e se os mesmos levaram à interrupção ou descontinuação do tratamento.
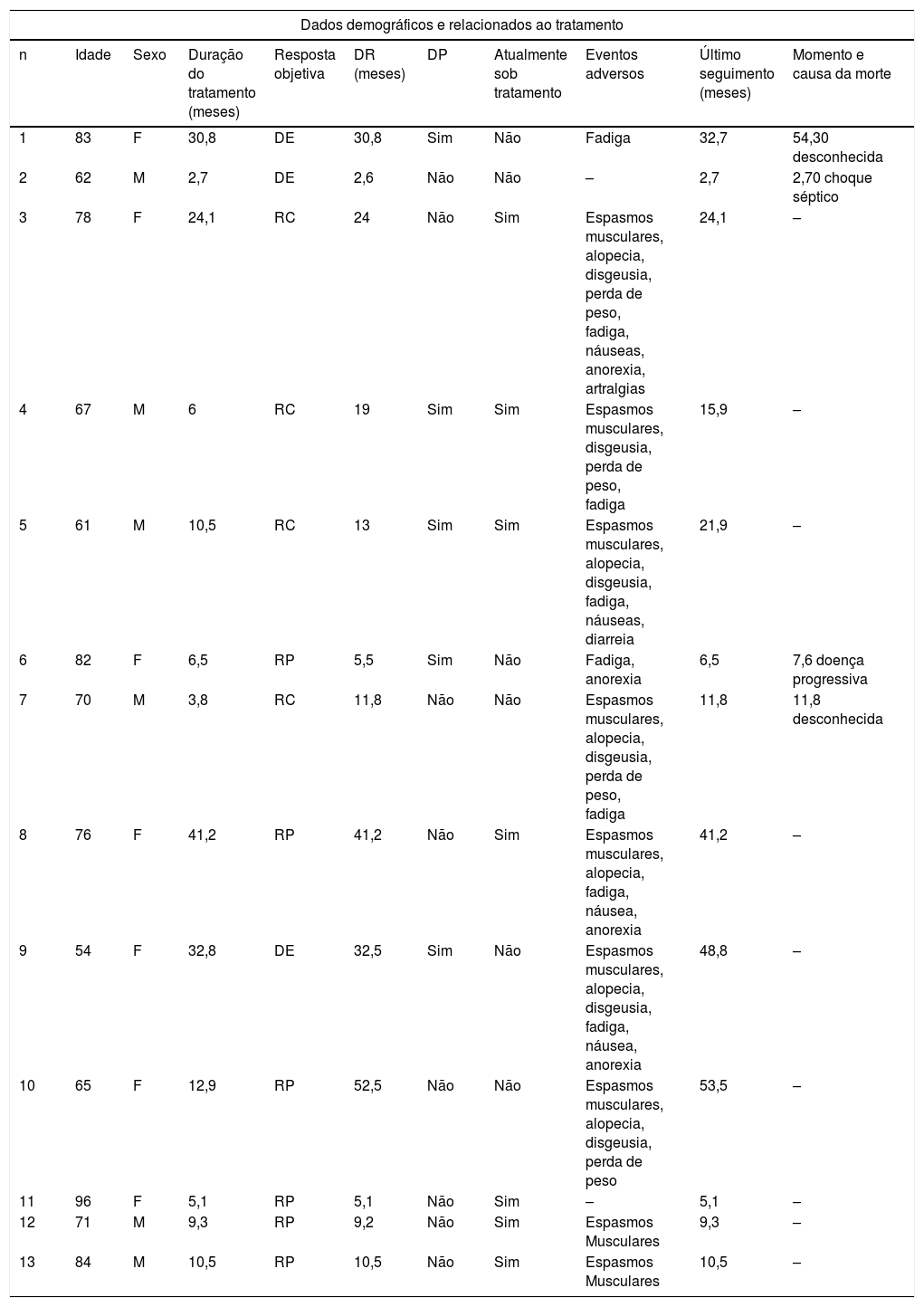
ResultadosDe um total de 26 pacientes que receberam tratamento com vismodegib, 13 apresentavam CBCla periocular e foram incluídos em nosso estudo: seis do sexo masculino e sete do feminino, com média de idade de 73 (54‐96) anos no início do tratamento (tabela 1).
Dados demográficos e relacionados ao tratamento dos pacientes incluídos nesta série de casos
| Dados demográficos e relacionados ao tratamento | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| n | Idade | Sexo | Duração do tratamento (meses) | Resposta objetiva | DR (meses) | DP | Atualmente sob tratamento | Eventos adversos | Último seguimento (meses) | Momento e causa da morte |
| 1 | 83 | F | 30,8 | DE | 30,8 | Sim | Não | Fadiga | 32,7 | 54,30 desconhecida |
| 2 | 62 | M | 2,7 | DE | 2,6 | Não | Não | – | 2,7 | 2,70 choque séptico |
| 3 | 78 | F | 24,1 | RC | 24 | Não | Sim | Espasmos musculares, alopecia, disgeusia, perda de peso, fadiga, náuseas, anorexia, artralgias | 24,1 | – |
| 4 | 67 | M | 6 | RC | 19 | Sim | Sim | Espasmos musculares, disgeusia, perda de peso, fadiga | 15,9 | – |
| 5 | 61 | M | 10,5 | RC | 13 | Sim | Sim | Espasmos musculares, alopecia, disgeusia, fadiga, náuseas, diarreia | 21,9 | – |
| 6 | 82 | F | 6,5 | RP | 5,5 | Sim | Não | Fadiga, anorexia | 6,5 | 7,6 doença progressiva |
| 7 | 70 | M | 3,8 | RC | 11,8 | Não | Não | Espasmos musculares, alopecia, disgeusia, perda de peso, fadiga | 11,8 | 11,8 desconhecida |
| 8 | 76 | F | 41,2 | RP | 41,2 | Não | Sim | Espasmos musculares, alopecia, fadiga, náusea, anorexia | 41,2 | – |
| 9 | 54 | F | 32,8 | DE | 32,5 | Sim | Não | Espasmos musculares, alopecia, disgeusia, fadiga, náusea, anorexia | 48,8 | – |
| 10 | 65 | F | 12,9 | RP | 52,5 | Não | Não | Espasmos musculares, alopecia, disgeusia, perda de peso | 53,5 | – |
| 11 | 96 | F | 5,1 | RP | 5,1 | Não | Sim | – | 5,1 | – |
| 12 | 71 | M | 9,3 | RP | 9,2 | Não | Sim | Espasmos Musculares | 9,3 | – |
| 13 | 84 | M | 10,5 | RP | 10,5 | Não | Sim | Espasmos Musculares | 10,5 | – |
M, masculino; F, feminino; DE, doença estável; DP, doença progressiva; DR, duração da resposta; RC, resposta completa; RP, resposta parcial.
O tratamento foi administrado durante uma mediana de 10,5 (2,7‐41,2) meses. A ORR foi de 76,9%: quatro (30,8%) pacientes com RC e seis (46,2%) com RP; DE foi observada em três casos (23,1%). A mediana da DR foi de 13 (2,6‐52,5) meses.
Com um tempo médio de seguimento de 15,9 (2,7‐53,5) meses, a taxa total de DP foi de 38,5% (cinco pacientes) em uma mediana de tempo de 19 (5,5‐32,5) meses após o início do tratamento com vismodegib. Dois desses casos eram pacientes com DE, com DR média de 32 meses; um deles estava sob tratamento intermitente em decorrência de baixa tolerabilidade e veio a óbito por causa desconhecida dois anos após DP. Outro caso de DP foi uma RP que apresentou uma DR de 5,5 meses. Esse paciente veio a óbito por complicações do CBC dois meses após o aparecimento da DP. Os outros dois casos com DP apresentaram RC clínica inicial, com DR média de 16 meses; DP ocorreu após a descontinuação do tratamento em decorrência de toxicidade – o vismodegib foi posteriormente reintroduzido com RP. Um desses pacientes foi submetido a uma biópsia durante a RC que não mostrou a presença de células neoplásicas.
Dos quatro casos com RC clínica, dois tiveram DP, como descrito acima, um ainda está em tratamento (após 24 meses) sem DP e o último interrompeu a medicação após cirurgia que não mostrou a presença de células neoplásicas na histopatologia. Este último veio a óbito por outras comorbidades dez meses após a interrupção do tratamento com vismodegib, sem sinais de DP.
Considerando o perfil de segurança e tolerância ao tratamento, a maioria dos pacientes (84,6%) teve pelo menos um evento adverso. Os mais comuns foram espasmos musculares (69%), fadiga (61,5%), alopecia (46,2%) e disgeusia (46,2%). Apesar de apresentar toxicidade leve na maioria dos casos, um paciente (7,68%) interrompeu o tratamento permanentemente, e sete pacientes (53,85%) precisaram interromper o uso de vismodegib para aumentar a tolerabilidade. Nenhum paciente apresentou sinais de rabdomiólise nem desenvolveu carcinoma espinocelular. Durante o seguimento, quatro pacientes faleceram, e em apenas um deles a morte foi relacionada à DP.
DiscussãoO tratamento das formas avançadas de CBC é um desafio e, até anos recentes, limitado à cirurgia e/ou radioterapia. O tratamento com vismodegib sem dúvida mudou nossa abordagem para esses casos. Dois ensaios clínicos multicêntricos internacionais mostraram ORR de 68,5% e 60,3% para CBCla4,6 com o uso desse medicamento. Esses resultados são inferiores a ORR de 76,9% relatada pelo presente grupo, que provavelmente está superestimada em razão dos critérios clínicos menos rígidos e mais subjetivos utilizados na prática clínica.
Os eventos adversos mais comuns descritos na literatura são espasmo muscular, disgeusia e alopecia,4 o que está de acordo com nossos resultados. Esses efeitos adversos foram geralmente leves, embora muito frequentes, e levaram à descontinuação do tratamento em um número não desprezível de casos.
A interrupção temporária do vismodegib (esquema de tratamento on‐off) é uma estratégia comumente utilizada que possibilita aos pacientes permancer em tratamento sem redução da eficácia.4 A análise primária do estudo MIKIE,7 que comparou dois esquemas de tratamento intermitentes com pausas de oito semanas, mostrou que a interrupção do tratamento não comprometeu a atividade de vismodegib. Ambos os esquemas controlaram a doença durante todo o período de tratamento na maioria dos pacientes.7 Uma análise exploratória do estudo STEVIE4 também demonstrou que uma interrupção maior do tratamento foi associada ao aumento da mediana de duração do tratamento e da taxa de resposta geral.4 Portanto, a interrupção do vismodegib foi incluída em uma recomendação de consenso de estratégias de tratamento em pacientes com CBC avançado.7
Observamos que 60% dos casos de DP em nosso estudo ocorreram durante períodos de interrupção do tratamento superiores a oito semanas. Concordamos que, desde que os eventos adversos sejam tolerados, o vismodegib pode ser administrado em esquema contínuo, e que os esquemas intermitentes devem limitar os intervalos sem tratamento a um máximo de dois meses, se possível. É importante ressaltar que, em casos de baixa tolerabilidade, um esquema intermitente deve ser sempre discutido antes de decidir interromper o tratamento. Acredita‐se que os presentes resultados utilizando vismodegib podem ser melhorados com um protocolo mais rígido para os casos que requeiram um esquema de tratamento intermitente.
A cura histopatológica não é garantida com a terapia com inibidor de hedgehog isoladamente, mesmo quando uma remissão clínica completa é obtida. Alguns autores sugerem que a descontinuação do medicamento sem cirurgia adicional possa deixar tumor residual ou não contíguo, potencialmente resistente ao tratamento.1 O risco de crescimento subsequente do tumor, que pode ser mais agressivo ou difícil de tratar, apoia o uso desses medicamentos em associação com outras modalidades de tratamento.1,8 Ally et al.8 mostraram que o uso de vismodegib como terapia neoadjuvante por pelo menos três meses antes da cirurgia apresentou um benefício geral na redução da área tumoral e do tamanho do defeito cirúrgico. Entretanto, se áreas aparentemente poupadas (livres de tumor) alternando com CBC clínico se desenvolverem, essa modalidade pode potencialmente levar a recorrência tardia do tumor em áreas supostamente tratadas.1,8 Isso poderia explicar a recorrência da doença no paciente desta série com RC cuja biópsia não mostrou a presença de células malignas. Esses tumores exigiriam cirurgia com ampla margem para otimizar o controle local e minimizar o risco de recorrência.1,8
ConclusãoOs presentes resultados apoiam a evidência de que o tratamento com vismodegib é seguro e eficaz para CBCla; no entanto, mais estudos são necessários para estabelecer a eficácia do vismodegib e, mais importante, seu lugar no cenário neoadjuvante. Seu papel no CBCla irressecável como uma ponte para a cirurgia parece ser um passo importante para o tratamento definitivo desses casos desafiadores.
Suporte financeiroNenhum.
Contribuição dos autoresCatarina Xavier: Aprovação da versão final do manuscrito; revisão crítica da literatura; obtenção, análise e interpretação de dados; participação efetiva na orientação da pesquisa; laboração e redação do manuscrito; análise estatística; concepção e planejamento do estudo.
Edgar Lopes: Aprovação da versão final do manuscrito; revisão crítica da literatura; obtenção, análise e interpretação de dados; participação efetiva na orientação da pesquisa; elaboração e redação do manuscrito.
Catarina Bexiga: Aprovação da versão final do manuscrito; revisão crítica da literatura; obtenção, análise e interpretação de dados; participação efetiva na orientação da pesquisa; participação intelectual em conduta propedêutica e/ou terapêutica de casos estudados; concepção e planejamento do estudo.
Cecília Moura: Aprovação da versão final do manuscrito; participação intelectual em conduta propedêutica e/ou terapêutica dos casos estudados; revisão crítica do manuscrito; concepção e planejamento do estudo.
Cecília Moura: Aprovação da versão final do manuscrito; participação intelectual em conduta propedêutica e/ou terapêutica dos casos estudados; revisão crítica do manuscrito; concepção e planejamento do estudo.
Ana Filipa Duarte: Aprovação da versão final do manuscrito; participação intelectual em conduta propedêutica e/ou terapêutica dos casos estudados; revisão crítica do manuscrito; concepção e planejamento do estudo.
Conflito de interessesNenhum.
Como citar este artigo: Xavier C, Lopes E, Bexiga C, Moura C, Gouveia E, Duarte AF. Vismodegib for treatment of periocular basal cell carcinoma – 6‐year experience from a tertiary cancer center. An Bras Dermatol. 2021;96:712–6.
Trabalho realizado no Instituto Português de Oncologia Francisco Gentil, Lisboa, Portugal.