Imunobiológicos são realidade na prática clínica atual e que, cada vez mais, tem ganhado espaço no cenário das doenças inflamatórias, sobretudo na dermatologia, com medicamentos para psoríase, dermatite atópica e hidradenite supurativa aprovados, além de muitos outros em estudo. É importante para o dermatologista ter conhecimento das medicações aprovadas em nosso país, para o melhor manejo das dermatoses, além de representar esperança de melhora para os pacientes com doenças crônicas.
São chamados medicamentos biológicos aqueles produzidos por biossíntese de células vivas. São moléculas grandes com milhares de átomos, instáveis, e que sofrem alterações com mínimas variações de armazenamento e conservação. São preferencialmente administradas por via injetável ou inalatória, pelo risco de inativação por enzimas digestivas. Compreendem classe heterogênea de produtos, desenvolvidos por engenharia genética, o que se associa a custo elevado de desenvolvimento de tecnologia e de produção, distribuição e armazenamento.1
Com o avanço do conhecimento da fisiopatogenia das doenças inflamatórias, o advento das terapias alvo‐específicas foi uma revolução no tratamento das doenças imunomediadas e câncer.1 Na história, o conceito de medicamento biológico é antigo – por exemplo com o desenvolvimento do soro contra raiva em 1885 por Pasteur; da insulina do pâncreas de animal para diabetes em 1922 por Banting e Best; a extração do hormônio de crescimento de cadáver em 1958 por Raben. Com o conhecimento do genoma em 2000, a possibilidade de manipular genes e produzir proteínas específicas tornou‐se realidade. A produção de anticorpos modificados direcionados a elementos específicos a partir da fusão de duas células (linfócito de rato imunizado e célula tumoral) em 1975, por Kohler e Milstein, foi o marco do desenvolvimento dos anticorpos monoclonais, o que possibilitou o desenvolvimento do hibridoma imortalizado, uma “célula‐mãe” de uma linhagem que pode ser mantida e expandida.1
Grupos de genes de síntese proteica conhecidos podem ser isolados, recombinados como um novo gene e transferidos para uma célula hospedeira, que passa a produzir uma proteína. Essas células hospedeiras são chamadas de sistema de expressão; um exemplo é a Escherichia coli mais simples, ou células CHO (do inglês. chinese hamster ovary), mais complexas de mamíferos geneticamente modificadas. Essas células são armazenadas a baixas temperaturas em banco genético imortalizado e alíquotas desse banco são retiradas para cultivo em reatores industriais com nutrientes para o crescimento celular e a produção da proteína. Posteriormente, dá‐se a recuperação do produto, separação e purificação.
São macromoléculas e podem ser imunogênicas, com consequências variáveis ou imprevisíveis, como reações de hipersensibilidade ao produto, diminuição da eficácia por formação de anticorpo antifármaco, perda da tolerância imunológica em síndromes lúpus‐símile.
No Brasil, vários medicamentos biológicos são registrados e reconhecidos pela ANVISA/MS: vacinas, soros hiperimunes, hemoderivados, biomedicamentos, anticorpos monoclonais, medicamentos contendo microrganismos vivos, atenuados ou mortos, probióticos e alérgenos.
Os anticorpos são grandes moléculas de proteína heterodimérica (peso molecular ∼ 150 kDa) formadas por duas cadeias leves idênticas e duas cadeias pesadas idênticas, cada uma composta por domínios diferentes. São unidas por ligações dissulfeto, formando uma estrutura em forma de Y. Existem cinco classes de anticorpos com base em suas sequências de cadeia pesada: IgM, IgD, IgG, IgE e IgA, e cada classe tem diferentes subtipos (IgG1, IgG2, IgG3 e IgG4). São naturalmente policlonais, ou seja, produzidos por vários clones de linfócitos B. Ligam‐se especificamente a proteínas estranhas para as quais foram produzidos após sensibilização. Já os anticorpos monoclonais são produzidos por um único clone de células – no caso de doenças hematológicas ou autoimunes, por exemplo, ou no caso de hibridomas manipulados geneticamente para produção de medicamentos biológicos com alvos terapêuticos específicos. Os anticorpos monoclonais produzidos para fins clínicos são IgG em virtude de sua circulação prolongada, meia‐vida mais longa e relativa facilidade de produção.1
A primeira geração de anticorpos monoclonais era derivada de camundongos, tinha menor afinidade com receptores, meia‐vida curta e eram incapazes de desativar o sistema complemento humano, causando intensas reações de hipersensibilidade.2
Os anticorpos de segunda geração podem ser quiméricos (contêm DNAc do domínio Fab murino acoplado a Fc humano, o que aumenta em cinco vezes a meia‐vida plasmática), humanizados (substitui Fab e Fc por proteínas humanas, com locais de ligação do antígeno do camundongo) ou humanos (formado por elementos recombinantes de anticorpos humanos).2
Anticorpos monoclonais podem ter várias funções, como marcar ou destruir células tumorais, inativar enzimas, estimular ou inibir receptores, ligar ou desligar funções fisiológicas. São úteis em tratamentos oncológicos e de doenças autoimunes, rejeição a transplantes, como marcadores diagnósticos, e para investigação científica.2
Quanto à nomenclatura, o sufixo em geral expressa a natureza do produto (mab: monoclonal antibody; ept: proteína de fusão). A sílaba do meio denota a fonte do anticorpo, uma ou duas letras antes do sufixo (U: humano; O: camundongo; E: hamster; I: primata; A: rato). Por exemplo, ZU: humanizado; XI: quimérico. O prefixo inicialmente denotava o alvo da doença a ser tratada, mas com a quantidade crescente de novos biológicos, essa regra deixou de ser utilizada. Por exemplo: bac (bacteriano), lim (imunomodulador), vir (viral), ci (cardiovascular), mel (melanoma), pr(o) (próstata), gov (ovário), col (colo), mar (mama), got (testículos), tum (outros tumores).2
Inibidores do fator de necrose tumoral alfa (TNF‐α)O fator de necrose tumoral é citocina que age na ativação de macrófagos, fagossomos, diferenciação de monócitos em macrófagos, recrutamento de polimorfonucleares e formação/manutenção de granuloma. É secretado pelos ceratinócitos e ativa células dendríticas, deflagrando uma resposta Th1 que resulta em produção de outras citocinas pró‐inflamatórias. É também estímulo para produção de citocinas da via Th17, como IL‐17 e IL‐23. Assim, a inibição dessa via por meio de medicações demonstrou boas respostas em doenças dermatológicas como psoríase em placas (PSO) e hidradenite supurativa (HS), além de diversas outras doenças. Os inibidores de TNF‐α modificaram a história do tratamento da psoríase, com melhora de 75% do PASI (Psoriasis Area Severity Index) por volta da semana 16 de tratamento, quando na era pré‐biológica a média era o PASI 50.3
Historicamente, imaginou‐se como molécula inibidora da caquexina para tratamento de choque e sepse, situações em que essa citocina se mostrou elevada, porém os estudos precisaram ser interrompidos pelo aumento da mortalidade. Algumas contraindicações são comuns aos inibidores do TNF‐α, como esclerose múltipla e outras doenças desmielinizantes, neurite ótica, insuficiência cardíaca classe funcional 3 ou 4, infecções ativas, tuberculose latente não tratada, linfoma prévio ou neoplasia atual, imunodeficiência congênita ou adquirida e hipersensibilidade aos componentes da fórmula.3
Assim, recomenda‐se anamnese extensa que contemple tais situações, além de screening laboratorial geral, PPD (ou teste específico, caso possível), sorologias para hepatites B e C, sífilis e HIV, radiografia de tórax e exames direcionados caso haja alguma suspeita na anamnese. É importante, também, atentar quanto à atualização da carteira vacinal, visto que vacinas com agentes vivos não podem ser usadas na vigência da terapia biológica.3
O TNF tem papel importante no combate a infecções, sejam elas virais, fúngicas ou bacterianas, e sé responsável pela estabilidade do granuloma caseoso da tuberculose, bem como pela contenção da resposta imune, razão pela qual é tão necessário afastar a possibilidade de doença ativa ou infecção latente. O mesmo vale para pacientes com antígeno de superfície para o vírus B (HbsAg) ativo, quando a possibilidade de reativação também precisa ser discutida.4
O risco de desmielinização associado ao uso de anti‐TNF foi aventado por uma medicação, não mais disponível, chamada lenercepte, que teria indicação para esclerose múltipla (EM), porém levou à exacerbação desta, e efalizumabe, medicação utilizada para psoríase que foi retirada do mercado posteriormente por casos de leucoencefalopatia progressiva. Também foram relatados 17 casos de EM induzida por etanercepte e dois por infliximabe. No caso das doenças desmielinizantes, postula‐se que haja uma ativação do poliomavírus pelo inibidor de TNF, deflagrando a doença.4
Os casos de neoplasias devem ser discutidos diretamente com a equipe assistente, a fim de tomar a melhor decisão de quando fazer a introdução. Estudos recentes mostram que em neoplasia em remissão há pelo menos cinco anos essa terapêutica pode ser considerada.
A inibição do TNF‐α pode estar associada à exacerbação da insuficiência cardíaca (IC), segundo ensaios clínicos randomizados de inibidores do TNF‐alfa como terapia potencial para melhora da função cardíaca na IC. Os dados de vigilância pós‐comercialização coletados pelo FDA demonstraram exatamente o contrário: aumento da mortalidade com deterioração da função cardíaca em 2001, agravando ICC; 38 pacientes desenvolvendo IC, e nove com piora de IC prévia.5
Como principais efeitos adversos dos medicamentos inibidores de TNF‐α, citam‐se: reações infusionais cutâneas (prurido, dor, eritema e edema locais) nos fármacos de administração subcutânea, e sistêmicas quando a via é endovenosa, com reações alérgicas agudas, anafilaxia, febre ou reações crônicas; citopenias; infecções, mais comumente de vias aéreas superiores; indução de autoimunidade; psoríase paradoxal, dentre outros.5
A seguir, discorreremos sobre os medicamentos aprovados no Brasil e de ação comprovada em dermatoses.
Etanercepte (Enbrel® e Brenzys™)Esse fármaco foi aprovado pelo FDA inicialmente para AR e AP, quando foi observada melhora das lesões cutâneas, o que permitiu estudos mais concentrados na indicação de psoríase em placas. O medicamento chegou ao Brasil em 2005 e teve seu biossimilar regulamentado pela ANVISA em 2017.6
Consiste em uma proteína de fusão recombinante que age ligada à fração p75 Fc da imunoglobulina humana G1 (IgG1), bloqueando o receptor de TNF‐α. Em razão de sua curta meia‐vida (2 a 5 dias) e por ligar‐se ao receptor, trata‐se de uma substância pouco antigênica e de rápida ação, demonstrando bom perfil de segurança. A resposta na semana 24 foi de PASI‐75 em 70% dos pacientes tratados com dose de 50mg semanal, e mantida resposta sustentada em 38% após dois anos, segundo os estudos pivotais. Os estudos pivotais não contemplam a métrica PASI‐100.7
Metanálises mostraram que o medicamento não diminui o risco de MACE (major adverse cardiovascular events – eventos adversos cardiovasculares maiores), porém leva à melhora em elementos da síndrome metabólica, com diminuição de cintura abdominal, triglicerídeos e glicemia, além de não afetar a taxa de filtração glomerular (Costa, 2014). Não há necessidade de ajuste de dose em pacientes com insuficiência renal e/ou hepática e idosos. Há ainda a apresentação em seringa de 25 mg, que pode ser utilizada tanto para a população pediátrica, para facilitar a administração da dose calculada, quanto para a população adulta, caso haja indicação de diminuição da dose semanal. Estudos mostram que a chance de mudança dessa medicação é maior por falta de resposta do que por efeitos colaterais.6
Infliximabe (Remicade® e Remsima™)Aprovado para uso na doença de Crohn (DC) pela FDA em 1998, essa substância teve aprovação no Brasil em 2005 e tem indicações formais em bula (tabela 1). A quebra da sua patente em 2015 propiciou a fabricação do primeiro biosimilar brasileiro, produzido no Bio‐Manguinhos/Fiocruz. É um medicamento que bloqueia a ação do TNF‐α circulante, fazendo com que o anticorpo ligado à citocina não consiga se ligar a seu receptor nem ativá‐lo, além de participar na lise das células que a expressam na superfície, ativando o sistema complemento.5
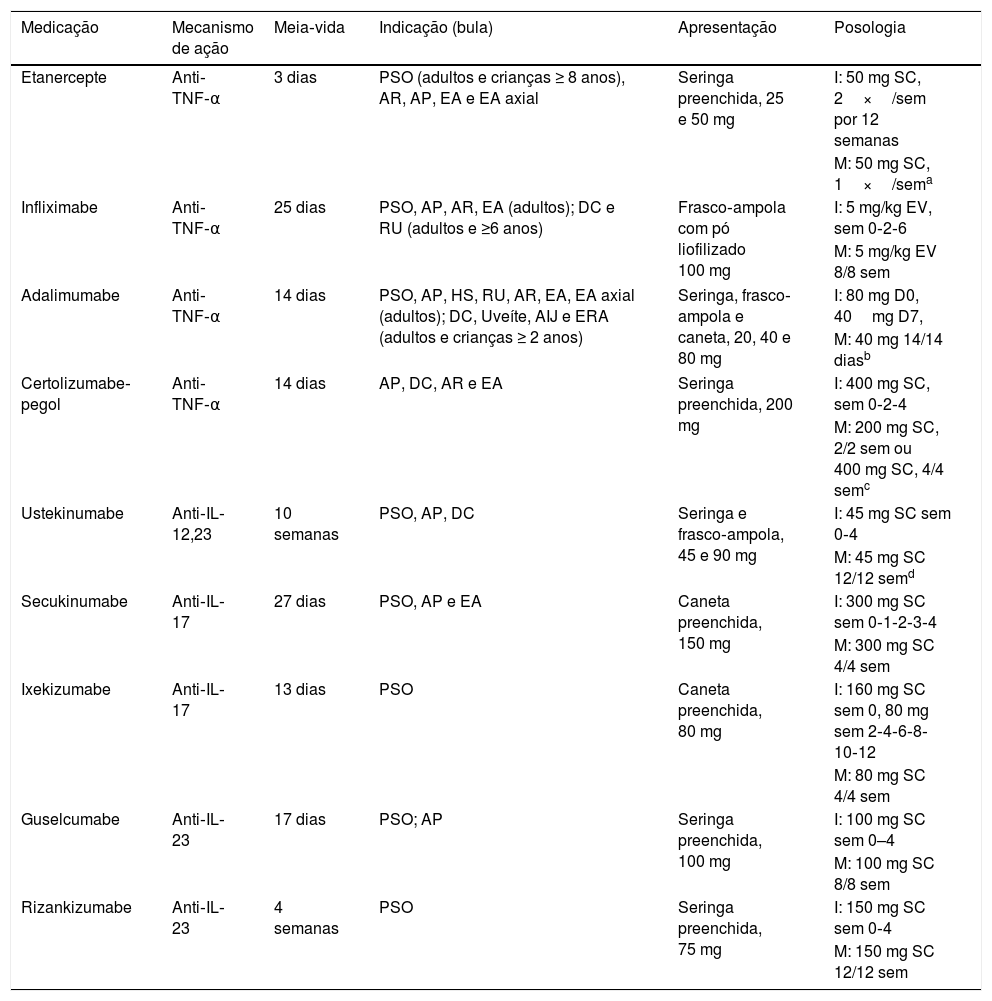
Medicações para psoríase
| Medicação | Mecanismo de ação | Meia‐vida | Indicação (bula) | Apresentação | Posologia |
|---|---|---|---|---|---|
| Etanercepte | Anti‐TNF‐α | 3 dias | PSO (adultos e crianças ≥ 8 anos), AR, AP, EA e EA axial | Seringa preenchida, 25 e 50 mg | I: 50 mg SC, 2×/sem por 12 semanas |
| M: 50 mg SC, 1×/sema | |||||
| Infliximabe | Anti‐TNF‐α | 25 dias | PSO, AP, AR, EA (adultos); DC e RU (adultos e ≥6 anos) | Frasco‐ampola com pó liofilizado 100 mg | I: 5 mg/kg EV, sem 0‐2‐6 |
| M: 5 mg/kg EV 8/8 sem | |||||
| Adalimumabe | Anti‐TNF‐α | 14 dias | PSO, AP, HS, RU, AR, EA, EA axial (adultos); DC, Uveíte, AIJ e ERA (adultos e crianças ≥ 2 anos) | Seringa, frasco‐ampola e caneta, 20, 40 e 80 mg | I: 80 mg D0, 40mg D7, |
| M: 40 mg 14/14 diasb | |||||
| Certolizumabe‐pegol | Anti‐TNF‐α | 14 dias | AP, DC, AR e EA | Seringa preenchida, 200 mg | I: 400 mg SC, sem 0‐2‐4 |
| M: 200 mg SC, 2/2 sem ou 400 mg SC, 4/4 semc | |||||
| Ustekinumabe | Anti‐IL‐12,23 | 10 semanas | PSO, AP, DC | Seringa e frasco‐ampola, 45 e 90 mg | I: 45 mg SC sem 0‐4 |
| M: 45 mg SC 12/12 semd | |||||
| Secukinumabe | Anti‐IL‐17 | 27 dias | PSO, AP e EA | Caneta preenchida, 150 mg | I: 300 mg SC sem 0‐1‐2‐3‐4 |
| M: 300 mg SC 4/4 sem | |||||
| Ixekizumabe | Anti‐IL‐17 | 13 dias | PSO | Caneta preenchida, 80 mg | I: 160 mg SC sem 0, 80 mg sem 2‐4‐6‐8‐10‐12 |
| M: 80 mg SC 4/4 sem | |||||
| Guselcumabe | Anti‐IL‐23 | 17 dias | PSO; AP | Seringa preenchida, 100 mg | I: 100 mg SC sem 0–4 |
| M: 100 mg SC 8/8 sem | |||||
| Rizankizumabe | Anti‐IL‐23 | 4 semanas | PSO | Seringa preenchida, 75 mg | I: 150 mg SC sem 0‐4 |
| M: 150 mg SC 12/12 sem |
Por tratar‐se de fármaco de administração endovenosa, os resultados podem ser atingidos mais rapidamente, porém a incidência de efeitos colaterais também é maior. Os efeitos colaterais mais comuns são relacionados e podem ocorrer até duas horas após a infusão, e devem ser monitorados em ambiente hospitalar. Com relação à eficácia, estudos mostram um PASI‐75 na semana 10 para 72% dos pacientes utilizando 3 mg/kg, e 88% para os que usaram a dose de 5 mg/kg; PASI‐90 em 58% dos indivíduos usando essa dose – quando comparado com MTX, apenas 42% atingem PASI‐75.5,6
Já os estudos de segurança após um ano de uso mostram que a administração deve ser constante e no intervalo preconizado, visto que o uso intermitente aumenta o risco de produção de anticorpos antifármaco e, por conseguinte, perda de resposta secundária.5
Nos estudos de segurança, 64% tiveram pelo menos um efeito adverso leve (conforme os destacados previamente) – reações infusionais, nasofaringite, fadiga e náusea foram os mais comuns; somente 5% dos pacientes tiveram infecções graves ou manifestações cardiovasculares. Estudos de 20 anos do uso da medicação mostram que esse perfil se manteve semelhante, porém destaca‐se maior indução à positividade do FAN e lúpus relacionado ao medicamento (9% dos casos), desencorajando seu uso em infecções crônicas, ainda que controladas.5
Adalimumabe (Humira® e Amjevita™)Dos medicamentos apresentados neste artigo, este é o que tem a maior gama de indicações, bem como o maior uso na população mundial. Foi aprovado pela ANVISA em 2008, e no ano seguinte teve a aprovação da fabricação de seu biossimilar. É, ainda, o primeiro anticorpo monoclonal totalmente humano da lista, que age bloqueando o TNF‐α circulante por meio de ligação com a região IgG1. De administração subcutânea, é até o presente momento o único fármaco com indicação formal e de bula (tabela 1) para duas dermatoses: psoríase e hidradenite supurativa – essa última, regulamentada em 2017.6
A eficácia é demonstrada com 78,3% dos pacientes tratados para psoríase em placas, atingindo PASI‐75 na semana 16, com primeiras respostas já na semana 4 e demonstração de resposta sustentada com PASI‐75 em 50,3% dos pacientes na semana 52. Os estudos pivotais não contemplam a métrica PASI‐100.7
Já com relação à hidradenite, estudos mostram melhora de 50% do HiSCR (Hidradenitis Suppurativa Clinical Response Score) em 12 semanas de tratamento, porém faltam dados sobre resposta sustentada.8
Os estudos pivotais mostram um bom perfil de segurança, com incidência de efeitos colaterais similares ao uso do placebo. A maioria é leve ou moderado, como dor ou eritema no local de injeção e infecções de vias aéreas superiores. Um caso de tuberculose foi relatado, em paciente com PPD prévio negativo, porém após ser retestado houve uma “viragem” e a medicação foi descontinuada. Insuficiência cardíaca congestiva foi demonstrada em apenas um paciente do estudo REVEAL. Apesar de utilizar doses maiores e intervalos menores, os estudos não demonstraram maior incidência de efeitos colaterais, tanto leves quanto severos, nos pacientes tratados para HS.6,8
Certolizumabe pegol (Cimzia®)Regulamentada na ANVISA em 2019, inicialmente com a indicação para AR e AP, essa medicação tem ação também na psoríase em placas e age inibindo os níves de TNF‐α circulantes. É molécula que tem a ligação covalente do antígeno ao articorpo monoclonal (fragmento Fab’) a uma molécula de polietilenoglicol. Esse processo de peguilação reduz a antigenicidade e prolonga a meia‐vida do agente. A molécula não inclui porção Fc e não induz a ativação do complemento, além de não se ligar à IgG, única citocina que cruza a barreira placentária, razão pela qual é o único medicamento biológico seguro para administração na gestação.9
Sua eficácia foi demonstrada com PASI‐75 na semana 12: 75% para os que usaram 200 mg e 83% para 400 mg. Em estudos de retratamento, os resultados na semana 12 foram semelhantes nos dois grupos. O fármaco demonstra bom perfil de segurança; infecções gastrintestinais e de via aérea superior são os efeitos adversos mais comuns. Os estudos pivotais não contemplam a métrica PASI‐100. Incidência de MACE, malignidades, infecções oportunistas ou morte foi menor que 1%, compatível com a população geral. A diferença de posologia também não pareceu influenciar em maior expressão de efeitos colaterais.10
Inibidor da interleucina 12,23 (IL‐12,23)IL‐12 e IL‐23 são citocinas heterodiméricas secretadas pelas células apresentadoras de antígenos ativadas, como macrófagos e células dendríticas. A IL‐12 estimula as células natural killer (NK), conduz a diferenciação das células T CD4+para o fenótipo de células auxiliares T1 (Th1) e estimula a produção de gamainterferona. A IL‐23 induz a via de células T17 auxiliares (Th17) e promove a secreção de IL‐17A, IL‐21 e IL‐22. Os níveis de IL‐12 e IL‐ 23 são elevados na pele e no sangue de pacientes com psoríase, e a IL12/23p40 sérica faz a distinção entre pacientes com artrite psoriásica e indivíduos sadios, implicando a IL‐12 e a IL‐23 na fisiopatologia de doenças inflamatórias psoriásicas.11
Células T responsivas para IL‐23 foram encontradas na entese em um modelo de artrite inflamatória de camundongo, onde a IL‐23 dirige a inflamação da entese. Além disso, há evidência pré‐clínica implicando a IL‐23 e vias descendentes na erosão óssea e destruição óssea por meio do aumento do ligante do receptor ativador do fator nuclear‐κ B (RANKL), que ativa os osteoclastos.12
O ustequinumabe é um anticorpo monoclonal IgG1κ completamente humano que se liga com especificidade à subunidade compartilhada proteica p40 das citocinas humanas interleucina IL‐12 e IL‐23. O ustequinumabe inibe a bioatividade da IL‐12 e da IL‐23 humanas, impedindo que a p40 se ligue ao receptor proteico IL‐12Rβ1 expresso na superfície das células do sistema imunológico.11,12
Aprovado no Brasil em 2012, o fármaco demonstra bom perfil de segurança; tem como principais efeitos adversos infecções das vias aéreas superiores, reações locais, diarreia, náuseas e prurido. Tem como contraindicação a hipersensibilidade a seus componentes, e parece não ter ação na artrite psoriásica de forma axial, porém apresenta boa resposta em dactilite e artrite periférica. A dose deve ser ajustada para 90 mg nos maiores de 100 kg.13
O medicamento mostrou resposta sustentada em um estudo de acompanhamento de cinco anos desde o primeiro estudo pivotal (PHOENIX 1 e 2), e entregou PASI‐75 em cerca de 77% dos pacientes, e PASI‐90 em 50% na semana 12. Os estudos pivotais não contemplam a métrica PASI‐100.
Porém, estudos de vida real mostram que os critérios usados nos estudos pivotais estão longe da realidade dos pacientes que usam o medicamento de fato, e que o índice de efeitos colaterais é ligeiramente maior na população real.14
Foi demonstrado um bom perfil de segurança quando comparada com metotrexate e outros medicamentos biológicas, não aumentando o risco de MACE, malignidades ou morte súbita. Há na literatura alguns relatos de caso mostrando segurança no uso em infecções crônicas concomitantes, como HIV e hepatites, sem haver reativação da replicação viral.11–13
Inibidores da IL‐17Como produto do estímulo das células dendríticas e apresentadoras de antígeno pelas citocinas pró‐inflamatórias, é deflagrada a hoje conhecida genericamente como “resposta tipo 3”, a resposta Th17, com produção da IL‐23 que, posteriormente, é transformada em IL‐17 e suas subunidades – A e F são as mais implicadas na fisiopatogenia da psoríase.
Essa citocina tem papel na produção de outras citocinas e peptídios microbianos, com recrutamento de neutrófilos e polimorfonucleares, estimulando, por meio do recrutamento dessas células, a produção de IL‐1‐β e TNF‐α, além de contribuir na resposta Th2 contra organismos extracelulares. A família da IL‐17 inclui as citocinas IL‐17A, IL‐17B, IL‐17C, IL‐17D, IL‐17E (também citada como IL‐25) e IL‐17F.15
Além do recrutamento de neutrófilos, tem grande presença mucocutânea e pode ser relacionada ao aumento de candidíase oral e genital, em sua maioria em quadros leves ou moderados. É importante a atenção com portadores de doença inflamatória intestinal (DII – Crohn e retocolite ulcerativa), visto que há relatos de piora dessas doenças na vigência do tratamento. No entanto, não há dados que permitam concluir haver indução de DII por essas substâncias.16,17
Secukinumabe (Cosentyx®)É um anticorpo monoclonal IgG1k totalmente humano, que faz a inibição seletiva da ligação das IL‐17A e F com seus receptores. Chegou ao Brasil em dezembro de 2015, inicialmente com aprovação para psoríase em placas e, posteriormente, ganhando as indicações de AP e EA também.15
Dentre os principais efeitos colaterais, cerca de 1% dos pacientes de estudos pivotais apresentaram herpes oral, nasofaringite, IVAS, diarreia e urticaria. É um medicamento com bom perfil de segurança, salvas as situações acima mencionadas.18
Os trials placebo randomizados ERASURE e FIXTURE demonstraram efetividade de secukinumabe na dose de 300 mg mensal para psoríase em placas moderada a grave, com PASI‐75 em 82% dos pacientes na semana 12, quando comparados com placebo ou com a dose menor de 150 mg mensais e PASI‐100 em 24% na semana 12.19
O estudo CLEAR, com endpoints mais ousados, partiu da comparação com ustequinumabe e demonstrou um PASI‐90 em 79% na semana 16 e 76% na semana 52.20
Em relação às áreas especiais, há estudos de vida real mostrando clareamento do índice ppPGA (para psoríase palmoplantar) e uma redução de mais de 90% do scalp PGA (área de couro cabeludo afetada). No estudo TRANSFIGURE, foi demonstrada uma redução média do NAPSI em 73,3% na semana 16, com estudos comprovando resposta sustentada por dois anos e meio para psoríase ungueal.20
Ixekizumabe (Taltz®)Aprovado pela ANVISA em 2017, é um anticorpo IgG4 humanizado que diminui os níveis de IL‐17A e F, IL‐22 e IL‐23, graças a sua alta de afinidade pela IL‐17A, ligando‐se à porção circulante.21
Seus principais efeitos colaterais relatados são reações no local da injeção, IVAS, neutropenia, candidíase e DII, tendo um bom perfil de segurança para reações mais graves, a maioria transitória e sem necessidade de descontinuação do medicamento.22
Os estudos UNCOVER 1, 2 e 3 são os estudos pivotais que compararam o ixekizumabe em duas diferentes doses com placebo e etanercepte, concluindo que a dose segura e eficaz para tratamento de psoríase em placas moderada a grave é a de 80 mg mensais, depois de uma indução com 160 mg. Foi demonstrado um PASI‐75 em 90% dos tratados à semana 12, mantendo resposta sustentada em até 74% desses na semana 60. Outros estudos demonstraram que pacientes atingiram, ao fim da semana 12, PASI‐75 em 98,7%, PASI‐90 em 83,3% dos casos e PASI‐100 em 41%.23,24
Inibidores da IL‐23A IL‐23 é responsável por inflamação, ativação imune e hiperproliferação da camada córnea. Trata‐se de um heterodímero composto por duas subunidades: p40, comum à IL‐12 na via Th1, e p19, específica apenas da IL‐23. Os níveis de RNA mensageiro tanto da subunidade p19 e da p40 para IL‐12/IL‐23 estão aumentados nas placas de psoríase e decrescem na vigência do tratamento.
A expressão dos receptores ROR (retinoic acid orfan receptors) ativa a produção de IL‐23 pelas APCs (células apresentadoras de antígenos) e células dendríticas mieloides, que vão atuar em todo o eixo Th17 e Th22, e podem se transformar em células de resposta efetora residentes naquela placa afetada, mesmo quando da resolução clínica.25
Guselkumabe (Tremfya®)É um anticorpo monoclonal IgG1λ humano que age inibindo a IL‐23 secretada e prevenindo a ligação da IL‐23 circulante em seus receptores, presentes na superfície celular, por meio do bloqueio específico da subunidade p19, levando à diminuição sérica, cutânea e articular dos níveis de IL‐17‐A.26
Trata‐se de molécula que chegou no mercado brasileiro em 2018 com a indicação de psoríase em placas, ganhando, em 2019, a indicação de artrite psoriásica também. Com bom perfil de segurança, os efeitos colaterais mais comuns são aqueles já conhecidos de outros biológicos, sem casos relatados de eventos cardiovasculares grave, neoplasias ou infecções generalizadas.27
O medicamento tem diversos estudos pivotais e head‐to‐head, destacando‐se os VOYAGE 1 e 2, que mostram a comparação com adalimumabe e com placebo, respectivamente, em que é visto, ao atingir a semana 16, PASI‐90 em 73% dos pacientes e PASI‐100 em 37,4% – essa média aumenta quando avaliada na semana 48.28
Quando comparado ao ustequinumabe, o estudo NAVIGATE mostrou uma vantagem na troca de pacientes que não respondiam ao ustequinumabe, enfim respondendo quando trocados para o guselcumabe. No estudo ECLIPSE, mostrou‐se superioridade ao secuquinumabe, demonstrando PASI‐90 em 84,5% dos pacientes tratados com guselcumabe e PASI‐100 em 58,2%, ambos na semana 48.26–29
Risankizumabe (Skyrizi®)Aprovado pela ANVISA em 2019, o Brasil teve sua aprovação simultânea a outros países desenvolvidos, como o Japão. É um anticorpo monoclonal humanizado que se liga à subunidade p19da IL‐23.30
O medicamento apresenta efeitos colaterais como reação local e IVAS, com bom perfil de segurança nos estudos pivotais, que compararam o fármaco com placebo e ustequinumabe (UltiMMa 1 e 2), ambos demonstrando PASI‐90 em 75% dos indivíduos ao fim da semana 16 e 51% obtiveram resposta PASI‐100. (GORDON 2018, AL‐JANABI 2019). O estudo de fase 3 IMMvent demonstrou a superioridade de risankizumabe ao adalimumabe, com 72% atingindo PASI‐90 contra 47% nos pacientes do braço do adalimumabe, ao fim da semana 16.31
Inibidor da interleucina 4, 13 (IL‐4, IL13)As interleucinas 4 (IL‐4) e 13 (IL‐3) são, juntamente à IL‐5, as principais efetoras da resposta imune Th2. São produzidas por células da imunidade inata e adaptativa, têm ação antiparasitária e estão envolvidas em vários processos que podem culminar em doenças alérgicas, como: a) recrutamento e ativação de células Th2, eosinófilos e mastócitos; b) switch de classe de linfócitos B para a produção de IgE; c) mecanismos envolvidos no prurido (como a produção de IL‐31 e sinalização de neurônios sensoriais); e d) remodelação tecidual, fibrose e indução de defeitos na barreira cutânea e mucosa. Entre as doenças desencadeadas por uma ativação da imunidade Th2 estão dermatite atópica (DA), asma alérgica, polipose nasal e esofagite eosinofílica.32,33
Uma parte das funções comuns da IL‐4 e IL‐13 se deve à presença da subunidade α do receptor da IL‐4 (IL4Rα), que é compartilhada pelo complexo de receptores tipo 2 (da IL‐4 e IL‐13), presentes nas células epiteliais, células musculares lisas, fibroblastos, monócitos e células B ativadas.33
O dupilumabe (Dupixent®) é um anticorpo monoclonal IgG4 totalmente humano que inibe a sinalização da IL‐4 e IL‐13 por ligar‐se à subunidade IL4Rα dos receptores tipo 1 e tipo 2 (comum às duas citocinas) (tabela 2).
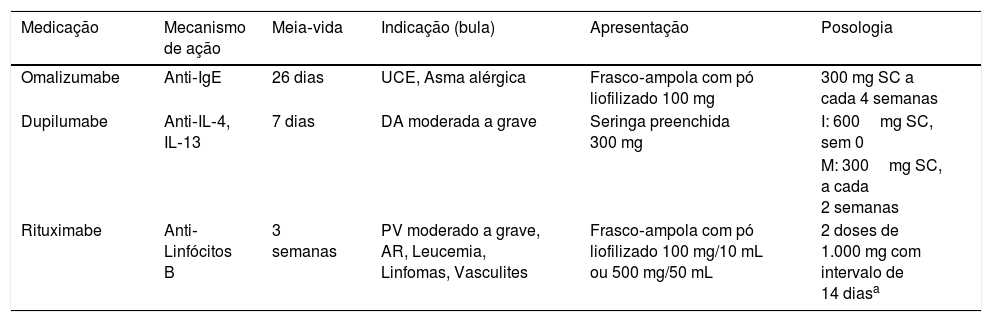
Demais medicações biológicas
| Medicação | Mecanismo de ação | Meia‐vida | Indicação (bula) | Apresentação | Posologia |
|---|---|---|---|---|---|
| Omalizumabe | Anti‐IgE | 26 dias | UCE, Asma alérgica | Frasco‐ampola com pó liofilizado 100 mg | 300 mg SC a cada 4 semanas |
| Dupilumabe | Anti‐IL‐4, IL‐13 | 7 dias | DA moderada a grave | Seringa preenchida 300 mg | I: 600mg SC, sem 0 |
| M: 300mg SC, a cada 2 semanas | |||||
| Rituximabe | Anti‐Linfócitos B | 3 semanas | PV moderado a grave, AR, Leucemia, Linfomas, Vasculites | Frasco‐ampola com pó liofilizado 100 mg/10 mL ou 500 mg/50 mL | 2 doses de 1.000 mg com intervalo de 14 diasa |
É o primeiro imunobiológico aprovado pela FDA para dermatite atópica grave em adultos (2017), seguido por sua aprovação para adolescentes entre 12 e 17 anos (2019) e crianças acimas de 6 anos (2020). A aprovação no Brasil segue as mesmas indicações. Houve melhora considerável no prurido em todos os estudos, comparável com placebo. Na semana 16, o pico de prurido foi reduzido significativamente em cerca de 1,1‐3,2 pontos do score inicial, melhorando, também, a qualidade do sono a o DLQI, além de redução expressiva dos sintomas de ansiedade e depressão.33,34
Os estudos pivotais SOLO 1 e 2 em pacientes com DA moderada sem melhora com medidas tópicas (incluindo corticoides tópicos e inibidores de calcineurina) alcançou EASI‐75 (melhora de 75% no EASI inicial – Eczema Activity Severity Index) de 48% após 16 semanas de uso. Essa porcentagem aumentou para 62% quando associado ao uso de corticoides tópicos de média potência (estudo CHRONOS), efeito mantido por 52 semanas e também visto em pacientes mais graves com indicação de ciclosporina (estudo CAFÉ). Houve melhora considerável no prurido em todos os estudos, comparável com placebo.34
Os efeitos colaterais comuns em todas as populações estudadas foram reação no sítio de injeção (a administração é subcutânea), cefaleia e conjuntivite. Estão incluídas nesse grupo as conjuntivites alérgica, viral, bacteriana e ceratoconjuntivite atópica. Importante ressaltar que conjuntivite não foi um efeito adverso visto com maior frequência em relação ao placebo nos estudos de dupilumabe em outras doenças Th2‐mediadas, como asma e rinossinusite crônica. A etiologia desse efeito adverso ainda é incerta. Houve diminuição das infecções cutâneas (com exceção do herpes simples) e dos episódios de flare da DA nos grupos com dupilumabe.35
Inibidor da imunoglobulina E (IgE) (Xolair®)O omalizumabe é um anticorpo monoclonal humanizado anti‐IgE, ligando‐se ao domínio C3da cadeia pesada da IgE e impedindo a ligação ao receptor de alta afinidade no mastócito (FcɛRI). A medicação se liga à IgE livre, promovendo uma diminuição da expressão dos receptores de IgE na superfície das células, prevenindo a degranulação mastocitária. Recebeu aprovação em 2014, com indicação para o tratamento da urticária crónica espontânea a partir dos 12 anos de idade.36
Os estudos pivotais ASTERIA I e II e GLACIAL mostraram controle da urticária (atividade da urticária em 7 dias igual a 0 e ≤ 6) em pelo menos 85% dos pacientes em comparação com placebo (uso de anti‐histamínicos em dose padrão até 4×a dose de bula) na semana 12, efeito mantido até o final do estudo (semana 24). Em relação ao prurido, principal sintoma da urticária, houve redução de 71% nos escores avaliados. Experiências de vida real em amostra brasileira alcançaram resposta completa (sem urtica e sem prurido) em 84% dos pacientes.36,37
Para avaliação da resposta do indivíduo, recomenda‐se manter o uso do omalizumabe por seis meses, visto haver respondedores rápidos e lentos. Foi observado um aumento progressivo da resposta ao tratamento até 24 semanas. O tratamento deve ser mantido até o controle completo das urticas e do prurido (UAS7=0).38
Os efeitos adversos mais frequentes correspondem a cefaleia e infecção de vias aéreas superiores, sem a necessidade de exames prévios ao tratamento. Não houve aumento de infestações ou parasitoses
Rituximabe (MabThera®; Riximyo®)Em 29/10/2019 foi aprovado pela ANVISA a indicação no uso de pênfigo vulgar (PV) moderado a grave. Rituximabe é um anticorpo monoclonal quimérico humanizado direcionado contra o antígeno CD20 dos linfócitos B. Ele age fazendo depleção dos linfócitos B da circulação por 6 a 12 meses. As indicações em bula no Brasil incluem leucemia linfoide crônica, linfoma não Hodgkin, artrite reumatoide e granulomatose com poliangeíte, nas doenças dermatológicas – portanto, seu uso é off label.
A efetividade terapêutica desse medicamento já foi avaliada em séries de casos, estudos clínicos randomizados e metanálise. Sua aplicação é intravenosa e há duas possibilidades posológicas: como utilizado na artrite reumatoide, ou seja, 1000 mg em duas doses (0 e 15 dias), além de doses de manutenção de 500 mg (meses 12 e 18), ou como utilizado no linfoma, na dose de 375 mg/m2/semana por quatro semanas, em geral associado ao uso de corticoides sistêmicos.39
No estudo RITUX 3, em que o rituximabe associado a curto ciclo de prednisona foi comparado ao uso de prednisona isoladamente como primeira linha de tratamento, foi possível demonstrar maior taxa de remissão completa fora de terapia em 24 meses (89%×34%), além de efeito poupador de corticoide com perfil de segurança favorável no grupo tratado com rituximabe. Não existe consenso sobre a dose ideal do rituximabe; um estudo do tipo coorte, retrospectivo, encontrou maior chance de remissão completa nos pacientes submetidos ao esquema usado no linfoma, porém mais estudos são necessários.40
Além disso, existem estudos em linfomas nodais que comparam o uso intravenoso de rituximabe ao seu uso subcutâneo, em que a aplicação subcutânea apresenta a mesma eficácia que a intravenosa, com maior índice de satisfação aos pacientes; seu uso em PV também é off‐label. Em geral, o rituximabe é utilizado em associação com corticoides sistêmicos.41
Outras doenças autoimunes também podem ser tratadas de forma off label com rituximabe. Uma metanálise destaca penfigoide bolhoso, crioglobulinemia e doenças relacionadas à IgG 4 como doenças autoimunes promissoras ao uso do fármaco. (Kaegi 2019) Além das doenças autoimunes, o rituximabe pode ser utilizado nos linfomas cutâneos de células B. Ainda não existem estudos randomizados publicados, as diretrizes da European Organization for Research and Treatment of Cancer (EORTC), da International Society for Cutaneous Lymphomas e da National Comprehensive Cancer Network indicam o rituximabe isolado como opção para as formas cutâneas generalizadas de linfoma centrofolicular e de zona marginal primários da pele.39
O rituximabe é contraindicado em pacientes com hipersensibilidade à substância ativa ou às proteínas murinas, em doentes com infecção ativa, grave, doentes gravemente imunocomprometidos, que apresentem insuficiência cardíaca grave (classe IV) ou cardiopatia não controlada grave. Esse medicamento não deve ser utilizado em gestantes e lactantes. Os efeitos adversos incluem reações de hipersensibilidade à infusão, eventos cardiovasculares (angina, arritmia cardíaca ou infarto do miocárdio), além de potencial risco aumentado de infecções, incluindo leucoencefalopatia multifocal progressiva e reativação de hepatite B.42
Suporte financeiroNenhum.
Contribuição dos autoresDimitri Luz Felipe da Silva: Aprovação da versão final do manuscrito; concepção e planejamento do estudo; elaboração e redação do manuscrito; obtenção, análise e interpretação dos dados; participação efetiva na orientação da pesquisa; revisão crítica da literatura; revisão crítica do manuscrito.
Elisa Nunes Secamilli: Elaboração e redação do manuscrito; obtenção, análise e interpretação dos dados; revisão crítica do manuscrito.
Mariana Valbon Beleli: Elaboração e redação do manuscrito.
Juliana Yumi Massuda: Obtenção, análise e interpretação dos dados.
Andrea F. E. C. Franca: Elaboração e redação do manuscrito; obtenção, análise e interpretação dos dados; revisão crítica da literatura.
Renata F. Magalhães: Aprovação da versão final do manuscrito; concepção e planejamento do estudo; elaboração e redação do manuscrito; obtenção, análise e interpretação dos dados; participação efetiva na orientação da pesquisa; revisão crítica da literatura; revisão crítica do manuscrito.
Conflito de interessesDimitri Luz Felipe da Silva, Juliana Yumi Massuda Andrea F. E. C. Franca e Renata F. Magalhães declaram conflito de interesse com Lilly, Novartis, Abbvie e Janssen.
A Roberta Giatti, pela ajuda na confecção deste artigo e pela dedicação ao ambulatório de psoríase da Unicamp, e a todos os residentes e assistentes do Serviço de Dermatologia da Unicamp, por fazê‐lo uma realidade.
Como citar este artigo: Silva DLF, Secamilli EN, Beleli MV, Massuda JY, Franca AFEC, Magalhães RF. Immunobiologicals in dermatology. An Bras Dermatol. 2022, https://doi.org/10.1016/j.abd.2021.05.016.
Trabalho realizado na Disciplina de Dermatologia, Hospital de Clínicas, Universidade Estadual de Campinas, Campinas, SP, Brasil.