Alopecia fibrosante frontal (AFF) é alopecia inflamatória cicatricial considerada variante do líquen plano pilar. Além das alterações foliculares, a AFF apresenta manifestações cutâneas associadas em grande parte dos pacientes, incluindo líquen plano pigmentoso, hipocromia na linha de implantação dos cabelos e pápulas na face. O objetivo do presente artigo é detalhar as manifestações clínicas cutâneas não foliculares da AFF e discutir como essas alterações podem impactar o diagnóstico e tratamento dos pacientes com essa doença.
Alopecia fibrosante frontal (AFF) é alopecia inflamatória e cicatricial histologicamente idêntica ao líquen plano pilar (LPP),1,2 considerada variante clínica desta entidade.3 Foi descrita primeiramente em 1994 na Austrália,4 e sua frequência vem aumentando em todo o mundo nas últimas décadas.5 A AFF acomete predominantemente mulheres adultas;6 não há relatos da doença em crianças até o momento.7 Não há predileção por etnia, mas a maior parte das publicações envolve caucasianas,8 pois é a etnia prevalente nos países de origem dos estudos. Embora inicialmente associada ao período pós‐menopausa, a proporção de mulheres pré‐menopausadas vem aumentando progressivamente nas séries publicadas nos últimos anos,9,10 em parte em virtude do reconhecimento mais precoce da doença.
A etiopatogênese da AFF não é totalmente esclarecida até o momento. Sua recente descrição, somada à crescente prevalência da doença em diversos países, reforça a hipótese de um desencadeante ambiental agindo sobre indivíduos geneticamente predispostos.11 Nesse sentido, a associação entre a doença e o uso frequente de cosméticos faciais encontrada em estudos caso‐controle nos últimos anos foi o dado com maior repercussão científica, mesmo sem comprovar relação de causalidade.12,15 Diversos estudos investigando a reatividade cutânea às substâncias presentes em cosméticos faciais em pacientes com AFF foram realizados e demonstraram maior prevalência de dermatite de contato alérgica nessa população,16 com especial destaque para fragrâncias e conservantes.12,17,18
A doença acomete classicamente a linha de implantação anterior do couro cabeludo, levando ao aumento lentamente progressivo do tamanho da região frontal.8 O acometimento preferencial e/ou inicial dos folículos velos dessa região é uma particularidade que auxilia na diferenciação entre a AFF e outras alopecias em faixa que podem acometer a borda anterior do couro cabeludo, fazendo com que o exame dermatoscópico seja ferramenta fundamental para o diagnóstico precoce da doença.19,20 O acometimento da borda anterior do couro cabeludo apresenta três padrões clinicamente distintos que parecem se correlacionar com diferentes prognósticos da doença. Os padrões 1 (regular) e 2 (irregular) apresentam o típico retrocesso da linha de implantação e consequente aumento da fronte, enquanto no padrão 3 (pseudofranja) a alopecia ocorre logo atrás da linha de implantação, preservando uma faixa de fios terminais que simulam o sinal da franja observado na alopecia de tração.21
Além da borda anterior do couro cabeludo, os supercílios também são afetados na maioria dos pacientes;8 a madarose é importante sinal clínico para suspeição da doença. Outras áreas do couro cabeludo, outros pelos da face e, resumidamente, qualquer pelo do corpo também pode ser afetado pela doença em proporções que variam bastante entre as séries até hoje publicadas.6,8,22
Embora muito menos ressaltado nas publicações sobre a doença, a AFF também pode acometer outras estruturas cutâneas. As alterações não foliculares da pele associadas à doença até o momento podem ser classificadas didaticamente em dois tipos: 1) alterações da interface dermoepidérmica; e 2) atrofia cutânea.
Alguns estudos sugerem que o acometimento cutâneo extrafolicular da doença pode preceder a alopecia, e seu correto reconhecimento poderia ajudar no diagnóstico mais precoce da doença. Além disso, outras possibilidades terapêuticas podem ser indicadas, considerando a doença um distúrbio não somente folicular e inflamatório. O objetivo desta revisão é detalhar as manifestações clínicas cutâneas não foliculares da AFF e discutir como essas alterações podem impactar o diagnóstico e o tratamento dos pacientes com a doença.
Alterações da interface dermoepidérmicaAs manifestações cutâneas secundárias ao acometimento da interface dermoepidérmica podem gerar quatro principais apresentações clínicas: 1.1) máculas hipercrômicas ou lesões melasma‐símile; 1.2) máculas acrômicas ou lesões vitiligo‐símile; 1.3) hipocromia na linha de implantação; e 1.4) máculas eritematosas ou lesões rosácea‐símile.
A junção dermoepidérmica (JDE) é o local onde temos maior concentração de melanócitos, e uma agressão dessa região pode afetar o funcionamento dessas células. Dependendo da quantidade e atividade dos melanócitos da camada basal da epiderme e do efeito da inflamação sobre estes, três colorações podem aparecer clinicamente na pele. Quando a quantidade de pigmento produzido na camada basal da epiderme é grande, a inflamação da JDE gera importante derrame pigmentar e, consequentemente, desenvolvem‐se máculas hipercrômicas no local. Quando essa inflamação gera redução da quantidade e/ou atividade dos melanócitos locais, alterações hipo/acrômicas serão resultantes. E quando temos apenas inflamação sob pele de cor clara, um eritema macular ou reticular pode ser visto. A coloração eritematosa pode ou não ser o quadro que antecede as demais discromias descritas.23
Máculas hipercrômicas ou lesões melasma‐símileDentre as alterações hipercrômicas, o destaque principal é para o líquen plano pigmentoso (LPPigm),9 porém lesões lentiginosas também são descritas.24
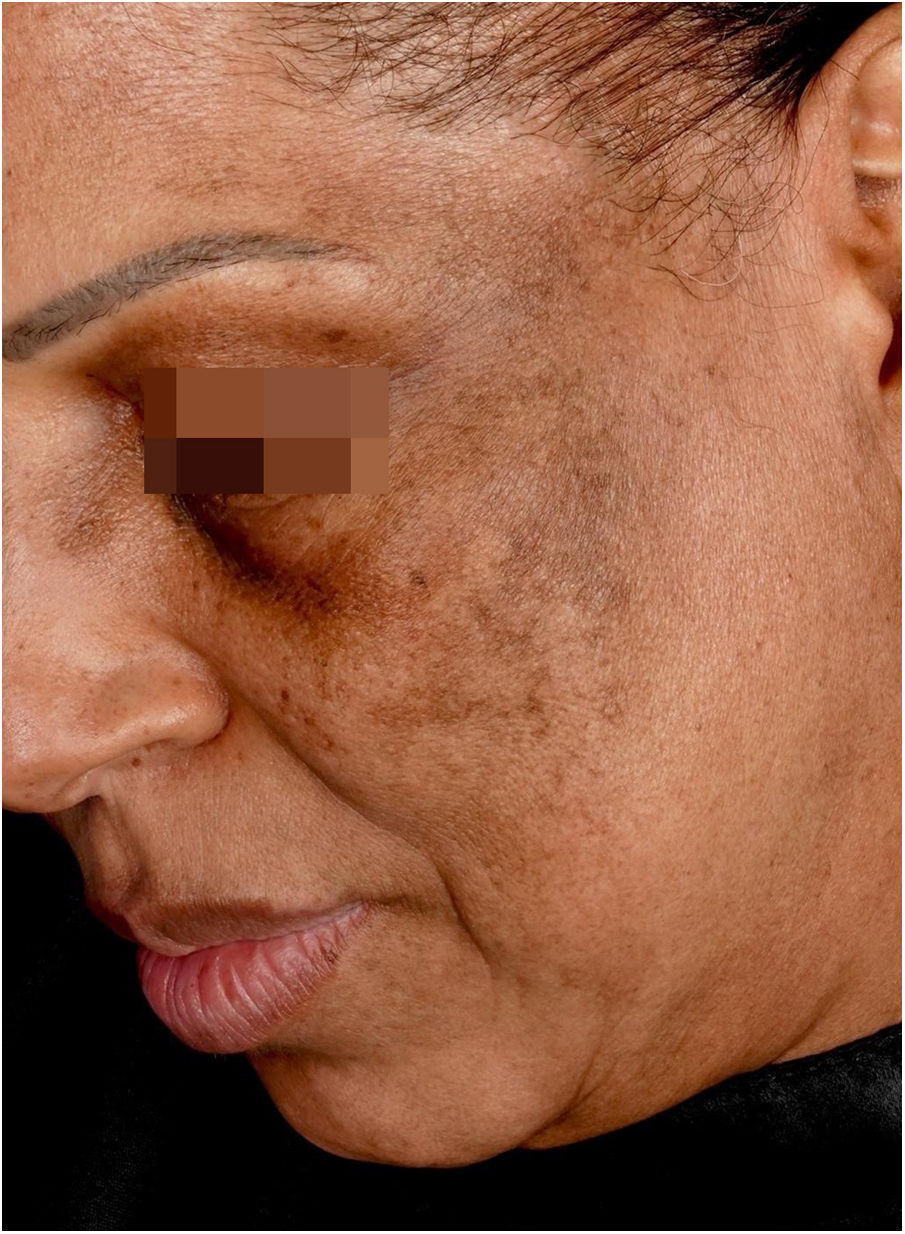
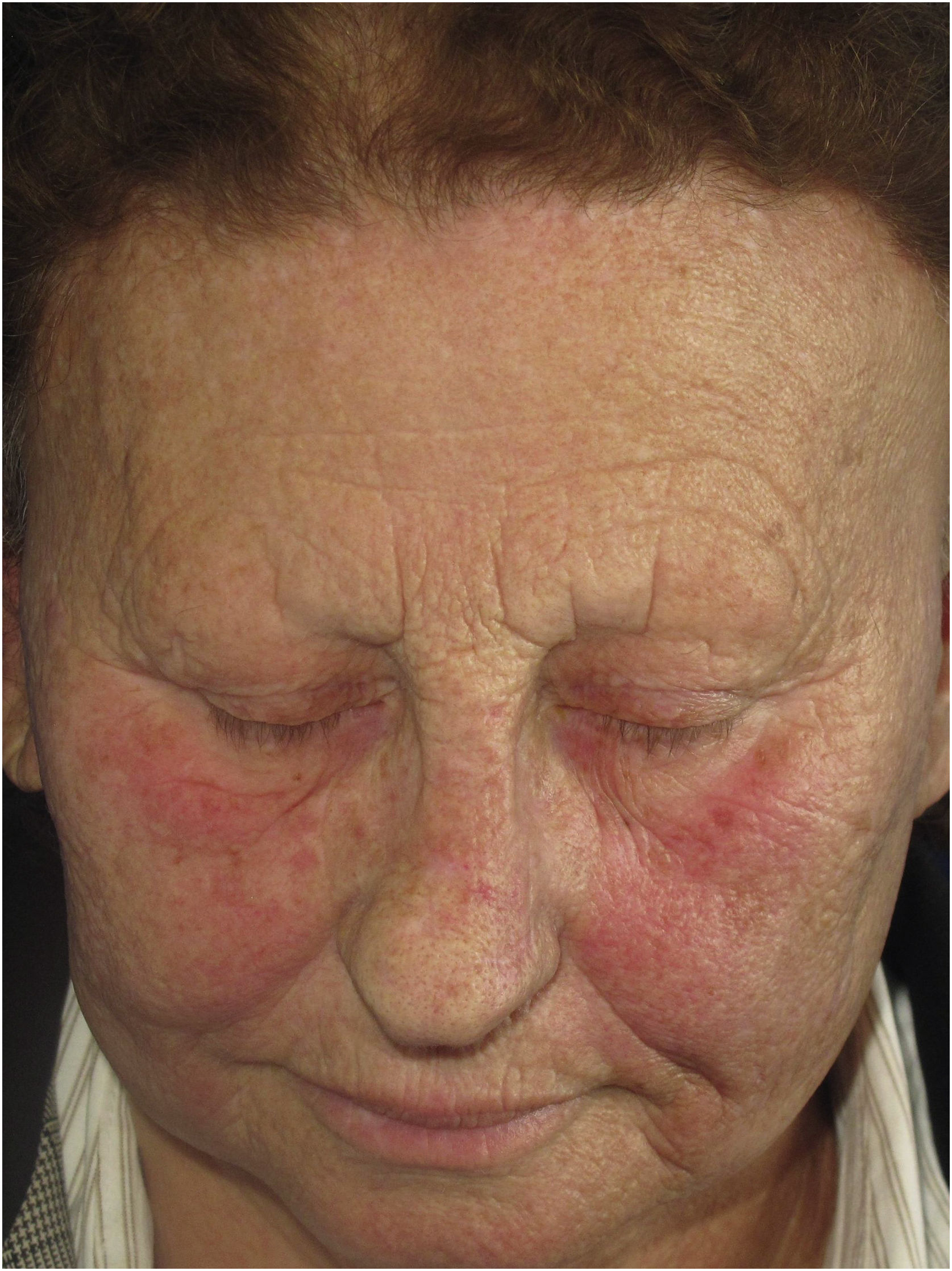
Líquen plano pigmentosoDescrição clínicaMácula reticular ou difusa de coloração variável entre marrom, preto, cinza e azul (fig. 1). O LPPigm associado à AFF apresenta extensão muito variável e é mais comum na face, mas também pode estar presente em outras áreas do corpo, como pescoço, colo e membros superiores.25 Apresenta claro predomínio em áreas fotoexpostas, assemelhando‐se clinicamente ao melasma, mas também pode acometer flexuras.9 O acometimento das pálpebras superiores é bastante sugestivo desse diagnóstico e ajuda a diferenciá‐lo do melasma.26
A dermatoscopia do LPPigm associado à AFF foi descrita em 2016 e inclui padrões variados como pseudorrede, pontos azul‐acinzentados dispostos em conformação circular ou de maneira salpicada, estruturas romboidais, pigmentação assimétrica nas aberturas foliculares e padrão pontuado – este último correspondente ao acometimento dos óstios dos ductos écrinos.27 Os pelos velos podem ou não estar reduzidos no local, demonstrando a dissociação entre o acometimento folicular e a inflamação da interface dermoepidérmica.
A semelhança do mecanismo de hipercromia do LPPigm associado à AFF com melasma dérmico e hiperpigmentação pós‐inflamatória faz com que essas entidades sejam muito semelhantes na clínica, na dermatoscopia e na histologia. Na prática, o diagnóstico dessa entidade só ocorre em pacientes que apresentem o acometimento folicular da AFF.
HistóricoA associação de AFF com LPPigm foi primeiramente descrita por Dlova, na África do Sul, em 2013.9 Nessa primeira série de casos, 54,5% dos 44 pacientes com AFF descritos apresentavam máculas hipercrômicas nas áreas fotoexpostas, cuja histologia confirmou tratar‐se de LPPigm. Vale ressaltar que o aparecimento das lesões cutâneas nesse estudo precedeu a alopecia em todos os pacientes com intervalo em média de 14 meses.9 Outro fato interessante é que no grupo de pacientes que apresentava a associação de AFF com LPPigm, a maioria das mulheres era pré‐menopausada, contrastando com todos os estudos publicados até então.28 De acordo com a autora do referido estudo, a elevada frequência de penteados com tração nessa população afrodescendente poderia justificar o desencadeamento do processo inflamatório folicular mais precocemente.9
Epidemiologia e prevalênciaA associação entre AFF e LPPigm é mais frequente em fototipos mais altos29 em virtude da maior quantidade de pigmento nesse grupo. Isso faz com que a prevalência dessa associação varie muito dependendo da etnia predominante no local de publicação do estudo. Enquanto Dlova descreveu a associação de AFF com LPPigm em 54% de seus 44 pacientes na África do Sul;9 a prevalência foi de 40% num estudo com 20 pacientes com AFF no Marrocos10 e de 20,7% num estudo com 58 pacientes na Tailândia.24 Por outro lado, na Argentina30 e na Espanha,14 onde a maioria dos pacientes apresenta fototipos baixos, duas grandes séries de casos mostraram essa associação em somente 4,5% e 3,1% dos casos, respectivamente. No Brasil, é provável que a frequência de LPPigm associado à AFF varie com o tipo de miscigenação racial das diferentes regiões do país. Em São Paulo, uma série de casos encontrou LPPigm concomitantemente em 14% dos 114 pacientes com AFF estudados.31
A frequência de LPPigm associado à AFF parece ser mais frequente em mulheres,14 e a maioria dos estudos de AFF em homens não menciona esse achado em seus resultados. Um único estudo observou correlação entre maior extensão da alopecia e a presença de máculas lentiginosas faciais (OR=5,87; 95%IC 1,15‐29,9; p=0,033), mas não encontrou correlação da extensão com LPPigm.24
Além da clara predisposição dos pacientes com AFF com fototipos mais altos em apresentar LPPigm, existe uma curiosa associação dessas lesões cutâneas com o diagnóstico da doença capilar em idades mais baixas e, consequentemente, antes da menopausa.32 Além dos dados publicados por Dlova, nos quais 64% de suas pacientes com AFF e LPPigm eram pré‐menopausadas,9 65% dos casos da série do Marrocos também não estavam na menopausa10 e 37,6% da série da Tailândia também não.24 Em contrapartida, uma revisão sistemática de 932 pacientes predominantemente brancos demonstrou que 84,1% dos casos de AFF foram diagnosticados após a menopausa.8
Um estudo interessante realizado em Miami demonstra que a população caucasiana de origem hispânica apresenta mais frequentemente a associação de LPPigm com AFF do que os caucasianos não hispânicos (22% vs. 6%, p=0,025).25 Nesse mesmo artigo, observa‐se maior prevalência de mulheres pré‐menopausadas no grupo de descendentes hispânicas (60% vs. 37%; p=0,039) e também maior frequência de LPPigm em mulheres pré‐menopausadas (23% vs. 9%; p não significante).25
Fisiopatogênese e histopatologiaA etiopatogênese do LPPigm não é totalmente conhecida, mas é possível que substâncias químicas fotossensibilizantes estejam envolvidas.33 De modo semelhante, o LPPigm associado à AFF também pode estar relacionado com produtos de aplicação tópica na pele, corroborando a associação encontrada entre AFF e o uso frequente de cremes, incluindo protetores solares.12,13
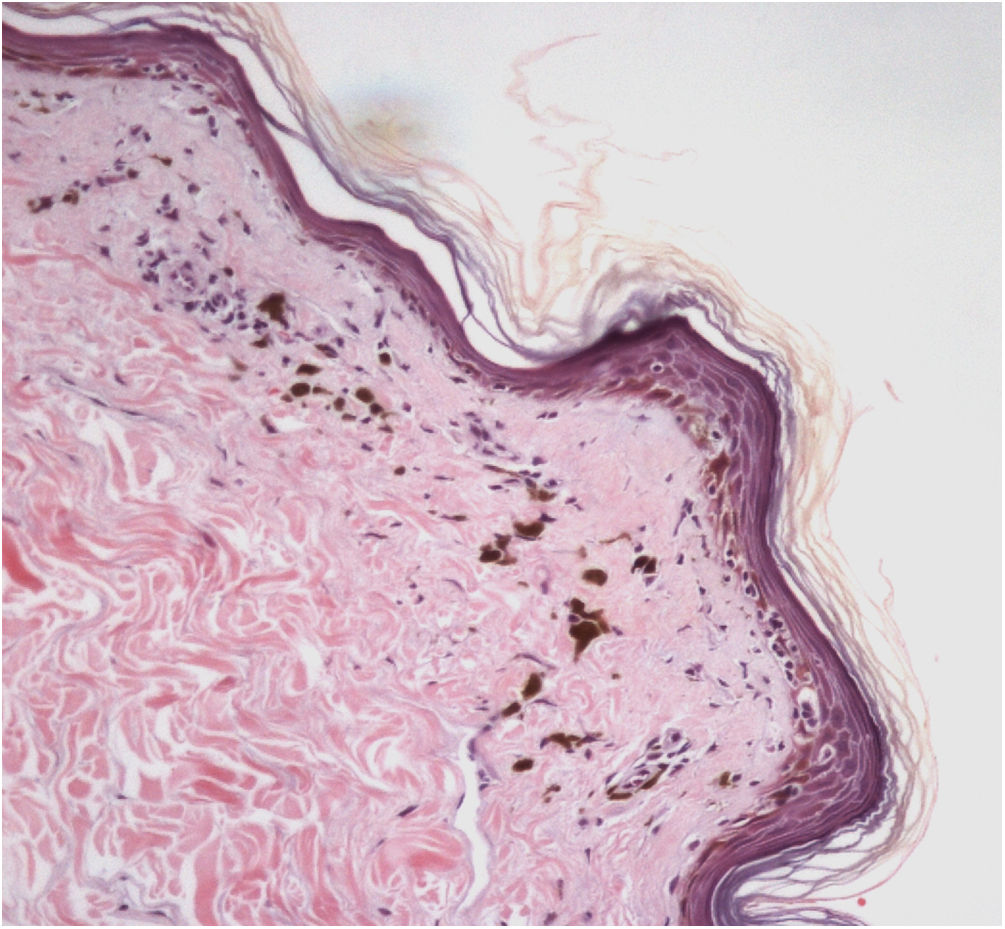
No exame histopatológico do LPPigm clássico em fase inicial, observa‐se dermatite de interface liquenoide dermoepidérmica com variados graus de derrame pigmentar (fig. 2).33 A interface com o epitélio folicular também pode estar afetada com infiltrado inflamatório perifolicular e alterações da camada basal do infundíbulo em alguns casos.33 Em estudo específico de achados histopatológicos do LPPigm associado à AFF, a presença de inflamação em glândulas sebáceas e sudoríparas também foi observada.31
Na fase residual da doença, apenas o derrame pigmentar é observado abaixo da epiderme geralmente atrófica. Nessa fase, a histologia do LPPigm é idêntica à de qualquer hiperpigmentação pós‐inflamatória e pode ser difícil diferenciá‐la de um melasma com componente dérmico.
TemporalidadeObservação muito interessante publicada por Dlova em sua primeira descrição da associação entre LPPigm e AFF é que as lesões hipercrômicas costumam preceder a alopecia.9 Naquele estudo, o intervalo entre o quadro cutâneo e o capilar variou de 6 a 36 meses, com média de 14 meses. Embora os outros estudos sobre LPPigm associado à AFF não costumem citar a relação temporal entre as duas manifestações clínicas, o fato de as séries de casos em populações de fototipos mais altos apresentarem menor idade média ao diagnóstico9,10,24 também pode ser considerado indício de que a dermatite de interface dermoepidérmica precede o envolvimento folicular.
Esse fato apresenta implicações muito relevantes para o entendimento da doença. Em primeiro lugar, reforça a hipótese de a AFF ser desencadeada por substâncias de uso tópico na pele.12,13 E em segundo lugar, sugere que grande parte das pacientes caucasianas com AFF pode ter um longo período de doença silenciosa que antecede seu diagnóstico, pois não apresentaria intensidade de derrame pigmentar suficiente para gerar lesões clinicamente visíveis com a inflamação da interface dermoepidérmica. Com isso, e somado o fato de que essa é uma doença de evolução lenta,6 qualquer estudo que vise investigar os possíveis fatores causais da AFF deveriam abranger as exposições a contactantes tópicos ocorridas muitos anos antes do diagnóstico e não depois dele.
TratamentoNão existe um consenso internacional sobre o tratamento do LPPigm, mas o entendimento da fisiopatologia da doença pode auxiliar na condução dos pacientes acometidos. Em linhas gerais, o tratamento deve considerar a fase de atividade da dermatite de interface. Na fase aguda, o tratamento deve focar o controle da inflamação, enquanto na fase residual o tratamento visa a remoção do pigmento melânico da derme. Para fase inflamatória, qualquer medicação útil para outras dermatites de interface dermoepidérmicas, como líquen plano cutâneo, lúpus eritematoso e dermatomiosite, pode ser utilizada. Nesse sentido, o uso de metotrexato parece promissor, embora não existam estudos prospectivos que comprovem sua eficácia até o momento.
Hidroxicloroquina, apesar de potencialmente eficaz como anti‐inflamatório, pode levar à piora de pigmentação preexistente34 e é prudente evitar seu uso em pacientes com AFF e lesões hipercrômicas. Como se trata de doença crônica e recidivante,33 o uso de corticoide sistêmico deve ser excepcional. À semelhança do que é sugerido para LPPigm clássico, o uso de isotretinoína oral poderia ter benefício anti‐inflamatório e de clareamento das lesões na dose de 20mg/dia,35 mas na experiência de uma das autoras esse fármaco não foi eficaz em pacientes com LPPigm associado à AFF.
Para o clareamento dos quadros residuais de LPPigm clássico, há relatos de uso de formulações tópicas contendo hidroquinona, retinoide, tacrolimus e corticoide tópico.36 Considerando que o LPPigm associado à AFF e a própria AFF podem ser causados por agente de uso tópico, sugerimos evitar o uso de formulações tópicas nesses casos. Dentre os procedimentos físicos com capacidade de clareamento cutâneo, um relato de caso submetido à dermoabrasão demonstrou melhora importante da hipercromia.37 Mesmo apresentando leve recidiva das lesões após um ano, a paciente se manteve satisfeita. Recentemente, foi publicado um trabalho demonstrando melhora importante do tamanho e intensidade da pigmentação em 10 de 13 pacientes tratadas com laser Q‐switched Nd:YAG em baixa fluência (fig. 3).38 Não há dados de seguimento pós‐tratamento desses doentes, e é possível o retorno da pigmentação caso a inflamação da interface dermoepidérmica não seja controlada. Com exceção desse último estudo sobre o laser, todos os outros tratamentos foram descritos apenas em relatos ou estudos retrospectivos.
Nos casos recidivantes, sugere‐se investigar o provável desencadeante do processo e suspendê‐lo. O uso de qualquer substância tópica que gere sintomas ou sinais inflamatórios na pele deve ser desaconselhado nesses pacientes. A suspensão indiscriminada de todos os produtos de uso tópico pode ser sugerida em casos com inflamação ativa e refratária aos tratamentos em uso.
RelevânciaA frequente associação de LPPigm com AFF deve nos deixar atentos em todos os casos de lesões tipo melasma em mulheres adultas para possível quadro indicativo de AFF inicial. De acordo com um estudo publicado em 2018, as lesões de LPPigm conferem às mulheres espanholas 5,14 vezes mais risco de ter a doença.14 Sempre que houver suspeita de LPPigm, a dermatoscopia cuidadosa de toda linha de implantação deve ser realizada e uma peça da área com ausência de velos deve ser coletada para biopsia. Embora a interface dermoepidérmica possa ser acometida antes do folículo, o diagnóstico de AFF só pode ser feito quando a alopecia já estiver presente.
O acometimento da interface dermoepidérmica amplia nosso entendimento da doença. AFF passa de condição puramente folicular, semelhante ao LPP, para doença com acometimento da interface dermoepidérmica, aproximando‐a do líquen plano cutâneo, do lúpus eritematoso e da dermatomiosite. Tratamentos eficazes para essas outras dermatites de interface dermoepidérmicas, como metotrexato, passam a ser potencialmente úteis nesses pacientes. Além disso, o fato de essas lesões antecederem a perda capilar gera implicações importantes na etiologia da doença, pois entendemos que a doença pode começar pela epiderme e o acometimento folicular pode demorar anos para acontecer e/ou se manifestar. Por um lado, isso reforça o possível envolvimento de agentes tópicos no desencadeamento do processo da AFF.12,13 Por outro, o contato com o provável desencadeante do processo deve ter ocorrido muito tempo antes do estabelecimento da alopecia e de seu diagnóstico e, consequentemente, o uso mais frequente de cremes encontrado nos pacientes de AFF nos estudos tipo caso‐controle pode ser consequência das alterações cutâneas faciais da doença que ocorreram anos antes, e não sua causa.39
Máculas acrômicas ou lesões vitiligo‐símileDescrição clínicaMáculas acrômicas de limites bem definidos. Pode apresentar‐se como lesão única de extensão variável ou múltiplas pequenas áreas acrômicas em meio à pele normal ou hipercrômica. A borda anterior do couro cabeludo é a área mais frequentemente acometida (fig. 4), mas é provável que todas as áreas acometidas pelo LPP também possam apresentar lesões vitiligoides, uma vez que advêm do mesmo evento histopatológico.
HistóricoEm 2014 foi publicado um artigo demonstrando que dermatite de interface dermoepidérmica pode ser responsável por lesões acrômicas vitiligoides em pacientes com AFF, de maneira análoga ao que é observado no lúpus eritematoso subagudo vitiligoide ou na variante melasma‐símile do líquen plano actínico. Nesse relato de caso, a localização das lesões na borda anterior do couro cabeludo e no pescoço, além do exame histopatológico com alteração da interface dermoepidérmica, indicaram que o mesmo processo responsável pelas lesões hipercrômicas publicadas como LPPigm associado à AFF no ano anterior podem, mais raramente, gerar lesões clinicamente acrômicas, ao invés de hipercrômicas.40
Existem alguns relatos de vitiligo em pacientes com AFF. Nesses casos, a histologia é fundamental para excluir a possibilidade de lesões vitiligoides decorrentes de dermatite de interface dermoepidérmica. Mesmo nesses casos em que se sugerem dois diagnósticos diferentes associados, levanta‐se a hipótese de uma via fisiopatológica comum entre as duas doenças envolvendo citotoxicidade de linfócitos T CD8+nos melanócitos e queratinócitos.41,42
Epidemiologia e prevalênciaA frequência de lesões vitiligoides associadas à AFF é provavelmente rara. Mesmo que erroneamente diagnosticadas como vitiligo, a associação das duas doenças foi encontrada em apenas 1,1% dos casos de uma revisão com 932 pacientes,8 2,4% em um grande estudo caso‐controle espanhol14 e 2,5% na maior série franco‐alemã publicada até o presente.43 Em todos relatos, a prevalência de vitiligo em pacientes com AFF ficou muito próxima do encontrado na população em geral, que é de 0,5%‐2,0%.44
As lesões acrômicas associadas à AFF podem ocorrer em pacientes de qualquer fototipo, e são mais evidentes quanto mais pigmentada for a pele.
Fisiopatogênese e histopatologiaO principal achado histopatológico das lesões vitiligoides associadas à AFF é a presença de alterações da interface dermoepidérmica, incluindo algum grau de derrame pigmentar.40 Diferentemente do LPPigm, entretanto, a quantidade de derrame pigmentar, em geral, é pequena. É provável que a fisiopatogênese desse quadro seja semelhante à do LPPigm, com participação de substâncias tópicas fotossensibilizantes.
TemporalidadeNo relato de caso que descreveu as lesões vitiligoides associadas à AFF, as lesões apareceram anos após o diagnóstico da alopecia.40 O fato de as lesões acrômicas surgirem antes do diagnóstico de AFF em alguns relatos não pode ser considerado suficiente para excluir a possibilidade de lesões vitiligoides associadas à AFF. À semelhança do que ocorre com LPPigm, a dermatite de interface epidérmica pode preceder em anos o envolvimento folicular da AFF.9
TratamentoNão existem relatos de tratamento das lesões vitiligoides associadas à AFF. Considerando sua provável etiologia inflamatória, os mesmos tratamentos propostos para vitiligo pedem ser tentados.45 Pela possibilidade do papel de substâncias tópicas e da fotossensibilidade na etiopatogênese das lesões, o uso de substâncias tópicas e fotossensibilizantes deve ser preferencialmente evitado.
RelevânciaAs lesões vitiligoides, de modo semelhante ao LPPigm, ampliam o entendimento da AFF como doença de interface dermoepidérmica e não apenas folicular.
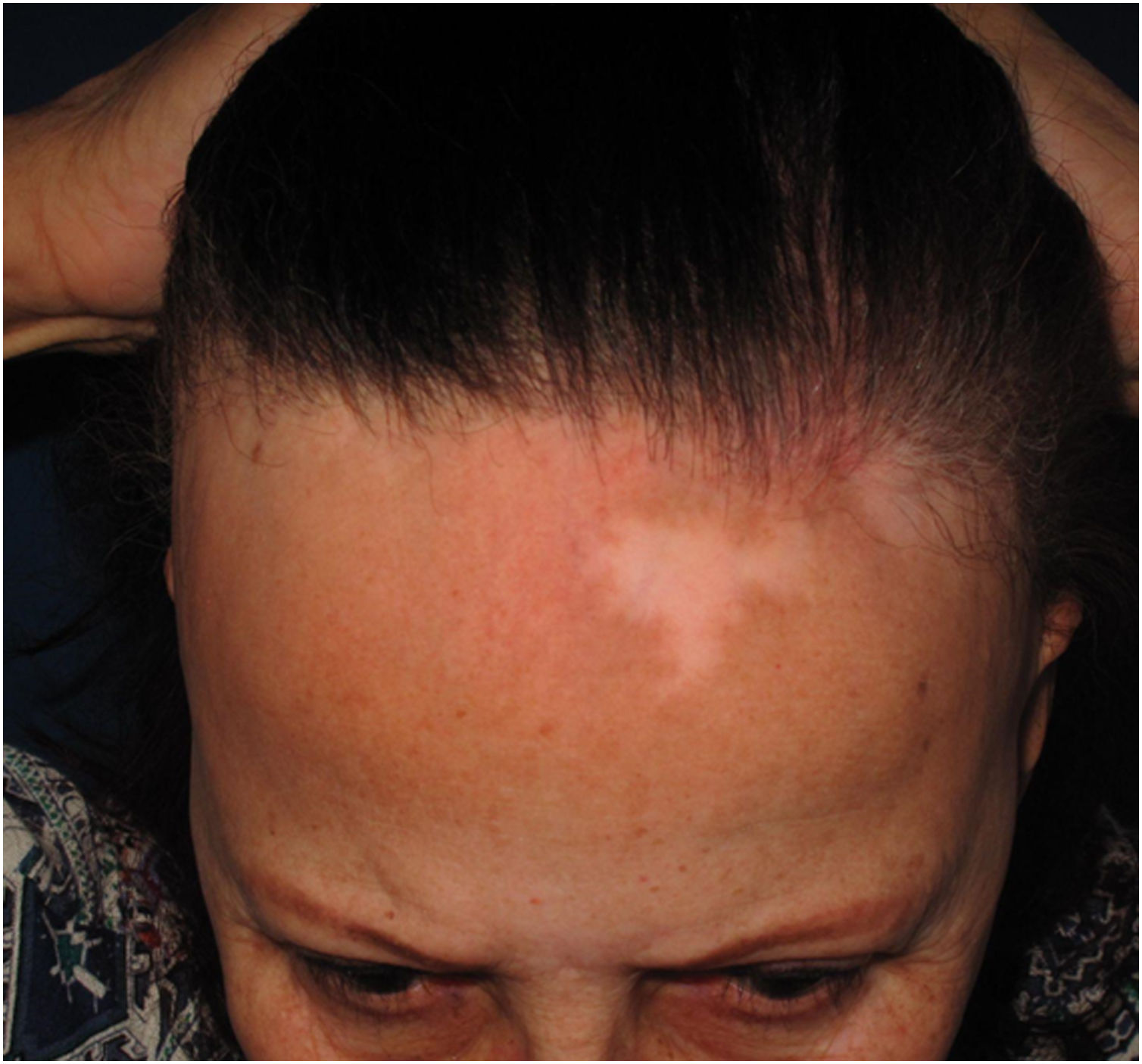
Hipocromia da linha de implantaçãoDescrição clínicaCorresponde a área hipocrômica mal delimitada na região da linha de implantação capilar afetada pela AFF (fig. 5). A região é mais visível quando a pele da face apresenta elevado grau de pigmentação e fotodano. Em pacientes de pele clara e com pouco fotodano, o uso da lâmpada de wood pode ajudar a evidenciar a hipocromia.46 Em geral, está associada à atrofia cutânea observada clinicamente como pele lisa10 e pela visualização de vasos sanguíneos de maior calibre.47
HistóricoEm sua primeira descrição da doença, em 1994, Kossard descreveu a hipocromia da linha de implantação contrastando com a pele da fronte como característica clínica da nova entidade.4 Na ocasião, a diferença de cor entre a borda afetada do couro cabeludo e a pele fotodanificada da face foi justificada como resultado da fotoproteção que os cabelos normalmente presentes teriam dado à região. Anos depois, um estudo mostrou que essa hipocromia não é resultado da falta de exposição solar, mas da redução do número de melanócitos no local.46
Epidemiologia e prevalênciaNão existem estudos sobre a frequência desse achado nos pacientes com AFF, mas na prática não é um achado incomum. Em um estudo sobre hipopigmentação na região das sobrancelhas, 84% das 20 pacientes descritas também apresentavam hipopigmentação na linha de implantação capilar, corroborando a impressão clínica de que é alteração frequente. Todas as pacientes desse estudo tinham fototipo alto, mas é provável que esse fato seja apenas um facilitador da visualização mudar para: da hipocromia.48
Fisiopatogênese e histopatologiaEstudo com biopsias de couro cabeludo publicado em 2017 demonstrou redução do número de melanócitos em cinco casos de AFF comparado com quatro casos de LPP e 10 pacientes controle.46 Além do pequeno tamanho da amostra, uma provável variação normal desse parâmetro nas diferentes regiões do couro cabeludo deve ser considerada.
Esse mesmo estudo também sugere menor espessura epidérmica nessa pequena série de pacientes de AFF,46 mas estudo posterior com microscopia confocal e comparação da mesma região do couro cabeludo apresentou resultado discordante.49 Considerando que os melanócitos estão localizados na camada basal da epiderme, sua redução também pode ser um indício do acometimento da interface dermo‐epidérmica. Recentemente um trabalho brasileiro identificou redução na contagem de melanócitos na região superior do folículo piloso em paciente com AFF, porém sem um grupo controle.50
TemporalidadeNão há dados sobre a relação temporal entre a hipocromia da linha de implantação e a alopecia.
TratamentoNenhum tratamento foi sugerido até o momento.
RelevânciaA hipocromia da borda afetada do couro cabeludo é provavelmente parte das manifestações da dermatite de interface dermoepidérmica associada à AFF. Seu reconhecimento pode ser útil para diferenciar de outras alopecias da borda anterior do couro cabeludo como fronte alta ou alopecia areata ofiásica.
Máculas eritematosas ou lesões rosácea‐símileDescrição clínicaEritema difuso ou reticulado mal delimitado, clinicamente semelhantes à rosácea eritêmato‐telangiectásica (fig. 6). Localizado em geral na região centro‐facial, eventualmente pode ocorrer na região das sobrancelhas ou acometer toda a face. É característica a exacerbação da lesão com desencadeantes como calor e consumo de bebidas alcoólicas, de maneira análoga ao observado na rosácea. Maior sensibilidade cutânea a diversos contactantes está frequentemente associada. Não há critérios claros que definam se essas alterações são apenas rosácea‐símile ou se na verdade o paciente tem a rosácea como doença cutânea associada à AFF. A dermatite de interface no exame anatomopatológico pode ser considerado critério presente nas alterações rosácea‐símile da AFF, mas não na rosácea.
HistóricoA descrição de lesões eritematosas associadas à AFF foi publicada 2015 em um estudo espanhol sobre lesões faciais associadas à AFF. Nesse artigo foram descritas sete pacientes com diagnóstico prévio de rosácea decorrente do quadro de eritema facial associado à sensação de queimação no local, mas cujas biopsias demonstraram haver dermatite de interface dermoepidérmica.23
Epidemiologia e prevalênciaNão existem dados sobre a prevalência de alterações rosácea‐símile nos pacientes com AFF. Em estudo espanhol com 103 pacientes, a rosácea foi considerada a comorbidade dermatológica mais frequentemente associada à AFF.51 Enquanto a população geral espanhola apresenta frequência de 10% de rosácea, o grupo de pacientes com AFF apresentou esse diagnóstico em 34% dos casos. Vale ressaltar que a maioria desses casos era classificada como rosácea eritêmato‐telangiectásica,51 uma forma clinicamente indistinguível das lesões eritematosas associadas à AFF. Questiona‐se se alguns desses casos descritos como rosácea poderiam ser, na verdade, lesões eritematosas associadas à AFF, uma vez que a realização de biopsia em lesões eritematosas da face é rara.
Todos os casos de AFF com lesões eritematosas descritos em 2015 eram caucasianos.23 O fototipo do paciente pode facilitar ou dificultar a visualização dessas alterações de cor. O eritema é mais fácil de visualizar em pacientes de fototipo baixo.
Fisiopatogênese e histopatologiaO mecanismo fisiopatológico das alterações rosaceiformes parece ser semelhante ao das outras manifestações clínicas resultantes da dermatite de interface dermoepidérmica associada à AFF. Da mesma maneira, os achados histopatológicos das lesões eritematosas também incluem: atrofia epidérmica, infiltrado liquenoide interfolicular, apoptose de queratinócitos e incontinência pigmentar na derme.23 A presença de dermatite de interface pode ajudar a diferenciá‐la da doença rosácea eritêmato‐telangiectásica, em que há predomínio de infiltrado inflamatório linfo‐histiocitário perivascular e dilatação de vasos superficiais no exame histopatológico.52 Existe a hipótese de que as lesões eritematosas possam ser a manifestação clínica final da dermatite de interface dermoepidérmica em pacientes com fototipo baixo ou uma fase inicial dessa dermatite que culminará com lesões hipercrômicas tipo LPPigm em pacientes com maior grau de pigmentação epidérmica.23
TemporalidadeNão há dados publicados sobre a relação temporal entre o surgimento das alterações rosácea‐símile e o início da alopecia. Na experiência dos autores, essa manifestação costuma preceder a alopecia em muitos anos, e geralmente é diagnosticada e tratada como rosácea por muito tempo.
TratamentoNão há descrição de tratamento de alterações rosácea‐símile associadas à AFF. Caso haja comprovação histológica da dermatite de interface dermoepidérmica, a mesma lógica de tratamento do LPPigm deve ser seguida. Como na maioria dos casos não se realiza biopsia na face, a presença de manifestações rosaceiformes é inicialmente abordada da mesma maneira que na rosácea clássica.53 Doxiciclina e isotretinoína oral são opções interessantes nesses, casos pois podem também ser úteis para o controle da inflamação folicular e das pápulas faciais, quando associadas. Sempre que possível, deve‐se evitar potenciais desencadeantes de crise e todos os potenciais irritantes cutâneos. Luz intensa pulsada e laser Nd:YAG podem ser usados para melhora estética de eritema e telangiectasias.
RelevânciaDeve‐se sempre lembrar que quadros de rosácea em mulheres adultas podem ser a manifestação inicial de AFF ainda subclínica. De acordo com um estudo publicado em 2018, as lesões rosácea‐símile conferem às mulheres espanholas quase duas vezes mais risco de ter a doença.14 É importante pensar em AFF em toda mulher com queixa de lesões rosaceiformes e realizar a dermatoscopia da linha de implantação à procura de áreas sem velos. É necessário comprovação por biopsia de alopecia inflamatória cicatricial na borda do couro cabeludo para fazer o diagnóstico de AFF.
Atrofia cutâneaO afinamento da pele é a alteração cutânea associada à AFF menos estudada. A atrofia cutânea se manifesta clinicamente de duas maneiras: 2.1) depressão das veias frontais; e 2.2) pápulas da face.
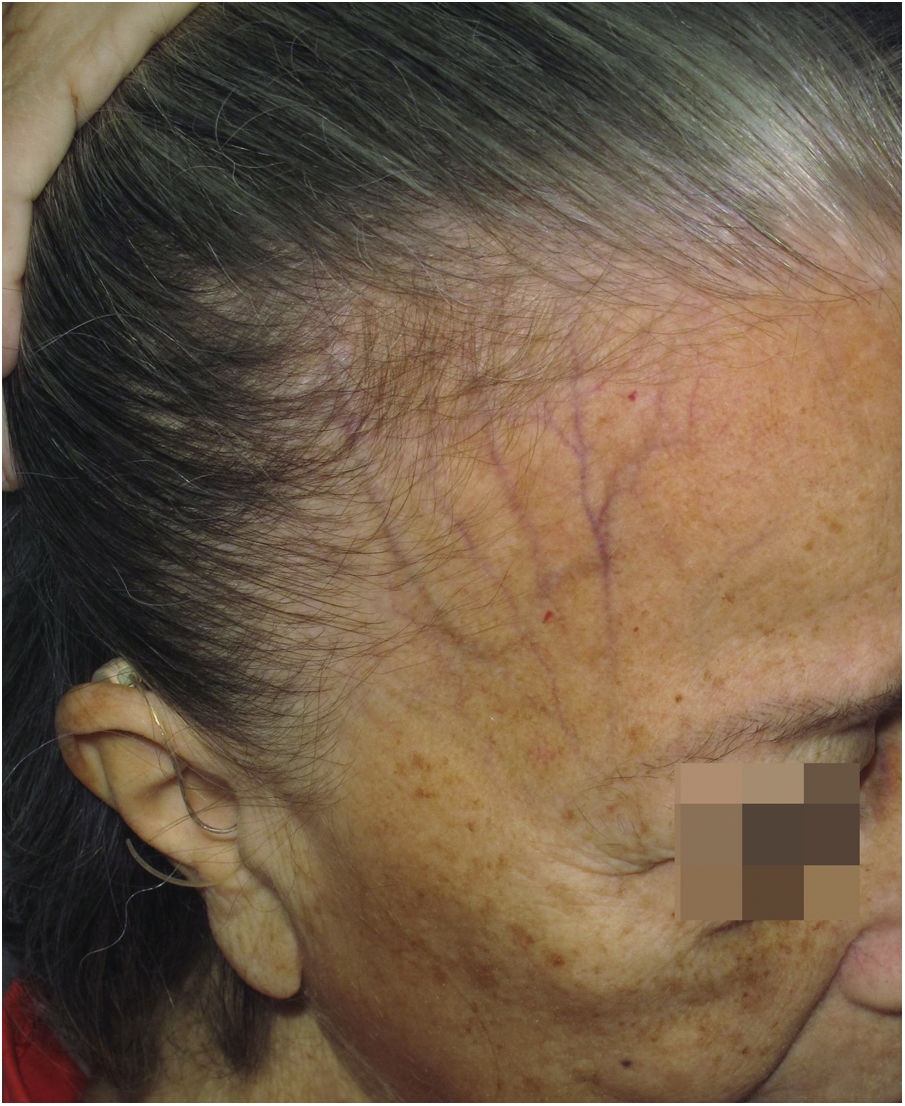
Depressão das veias frontaisDescrição clínicaAfundamento da pele observado sobre o trajeto das veias frontais. A pele da fronte é mais fina e pregueável que o habitual, assemelhando‐se à pele envelhecida.
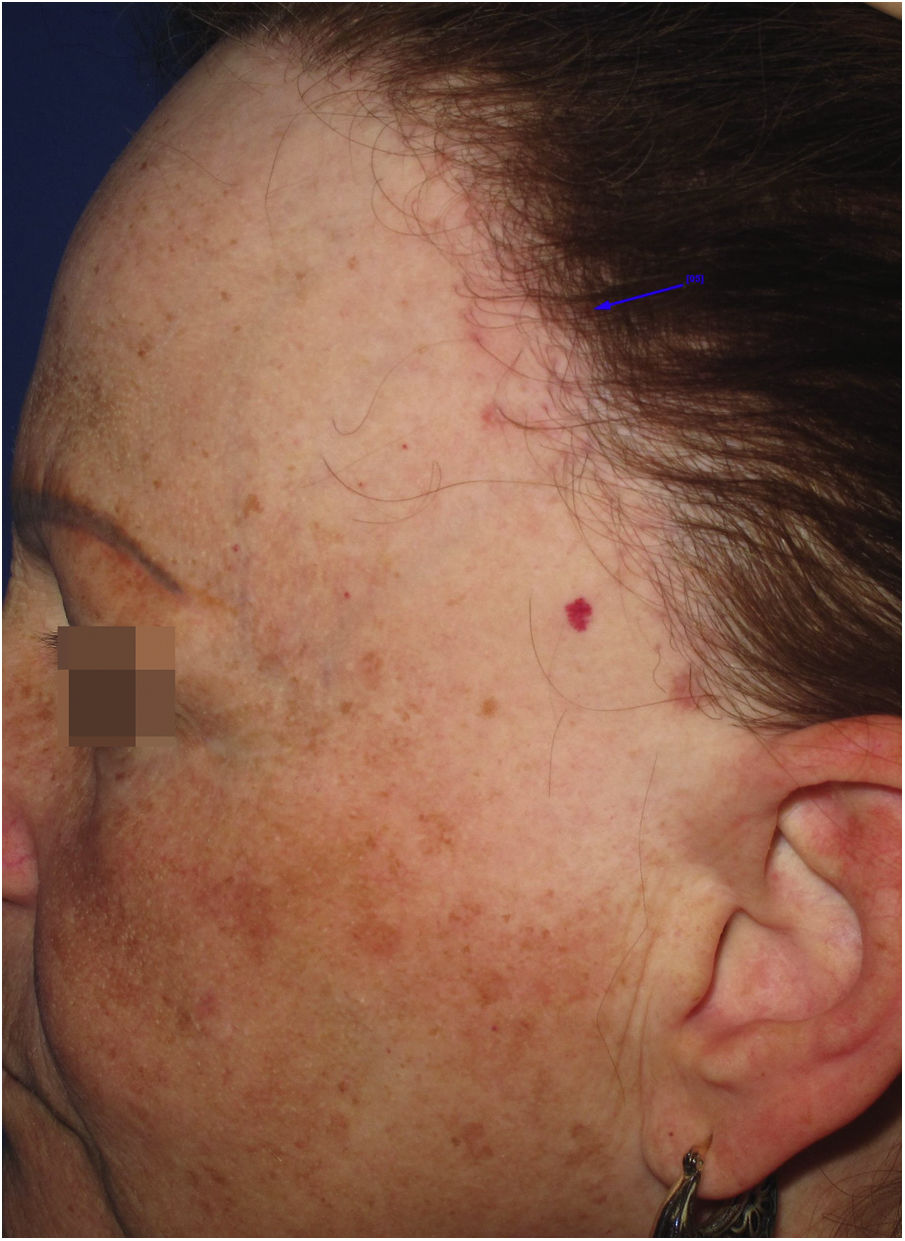
HistóricoEmbora clinicamente visível nas imagens publicadas desde os primeiros relatos da doença,4,54 a atrofia cutânea só foi postulada como manifestação clínica da AFF em 2015, em artigo que ressaltou a depressão das veias da fronte como sinal clínico da doença (fig. 7).47 É compreensível que a idade avançada das pacientes e o frequente uso de corticoides tópicos na região tenham retardado a identificação dessa característica clínica, por isso os autores que descreveram esse sinal ressaltaram que 4 das 11 pacientes relatadas não haviam usado corticoides tópicos, e as demais notaram a depressão antes do uso dessa medicação.
Epidemiologia e prevalênciaPoucas séries de casos de AFF citam a depressão das veias frontais em seus resultados. O sinal foi inicialmente descrito em pacientes caucasianas,47 mas uma série de casos de 56 pacientes tailandeses também encontrou esse achado em 7,1% dos pacientes.32 Não há dados sobre a possível correlação entre o sinal da depressão das veias frontais e a idade das pacientes, embora pareça óbvio que esse sinal deve ser mais frequente em pacientes mais velhas. Um único estudo em homens com AFF refere o achado em 12,8% dos 39 pacientes espanhóis examinados.55 Em 2017, um estudo espanhol sobre os diferentes tipos de acometimento da linha de implantação frontal constatou que a depressão das veias frontais foi observada mais frequentemente no tipo 1 (11%) do que no tipo 2 (7,3%), e não foi observada no tipo 3.21
Fisiopatogênese e histopatologiaNão se conhece o mecanismo que gera a atrofia da pele nos pacientes com AFF. Tampouco se sabe exatamente qual das camadas da pele está afinada.
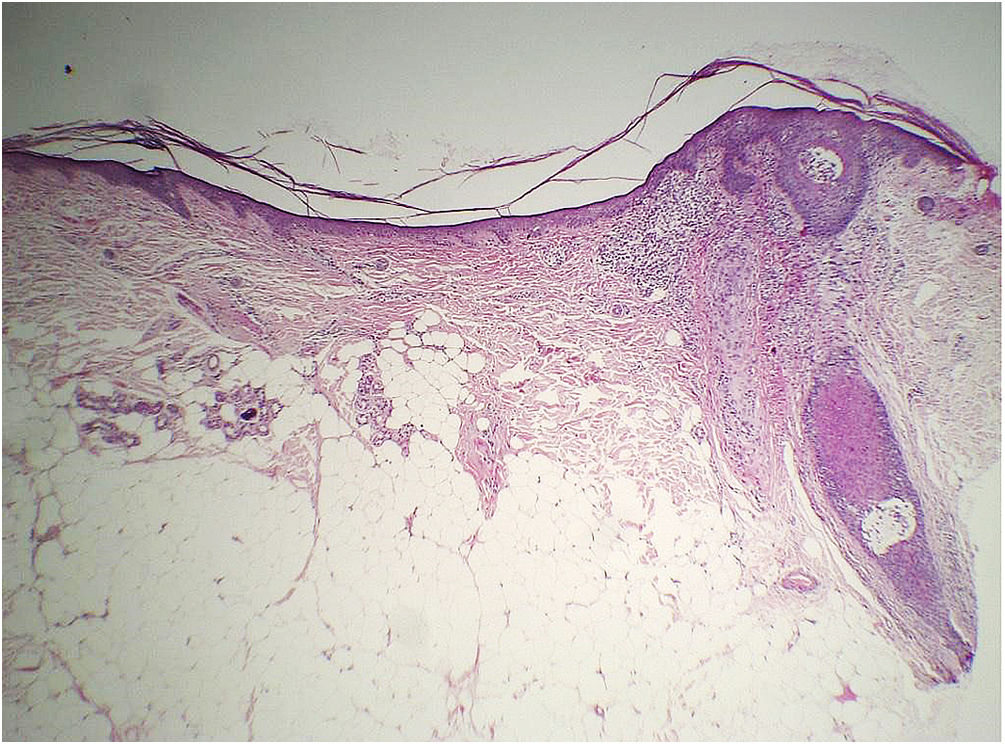
O exame histopatológico realizado em duas pacientes da descrição inicial desse sinal refere ter encontrado importante atrofia da derme (fig. 8), mas nenhum parâmetro objetivo dessa alteração foi fornecido para comprovar tal afirmação.47 Considerando que não se conhece o intervalo de normalidade da espessura dérmica da fronte para a população geral, apenas um estudo comparativo com grupo controle pareado para as principais variáveis que podem influenciar a espessura dérmica (região da fronte, idade, fototipo e fotodano) seria capaz de comprovar se há diminuição da espessura da derme e/ou de outra camada da pele relacionada à doença.
Uma vez que a coleta de material para exame histopatológico seria desaconselhável como metodologia para estudo dessa região da face, o ideal seriam métodos não invasivos de imagem para avaliação de espessura das diferentes camadas da pele. Nesse sentido, até o momento temos um estudo com microscopia confocal que demonstrou não haver afinamento epidérmico relacionado à AFF; no entanto, em virtude da pequena profundidade das imagens do aparelho utilizado, não foi possível avaliar espessura dérmica ou hipodérmica.49 Existe ainda um estudo com tomografia de coerência óptica em pacientes com AFF, porém sem avaliação da espessura cutânea.56
Futuros estudos controlados com aparelhos de imagem capazes de mensurar distâncias com precisão até a hipoderme são necessários para comprovar se há atrofia dérmica e/ou hipodérmica relacionada à doença.
TemporalidadeDe acordo com o artigo de sua descrição inicial, o sinal da depressão das veias frontais ocorre pouco tempo após o início da alopecia.47
TratamentoNenhum tratamento é sugerido para tratar a atrofia cutânea, mas entende‐se que a utilização de corticoides tópicos ou injetáveis possa agravar o quadro, devendo‐se utilizar esses medicamentos com cautela nos pacientes com AFF.47 Não se sabe se a reversão dessa atrofia teria algum impacto na evolução da alopecia.
RelevânciaA depressão das veias frontais foi o primeiro sinal sugestivo de atrofia causada pela doença. Entender que a AFF é uma doença atrofiante por natureza implica extremo cuidado com o uso de corticoides tópicos ou injetáveis nesses pacientes.
Pápulas da faceDescrição clínicaPequenas pápulas monomórficas foliculares, não inflamatórias, de superfície lisa e bordas mal definidas. Eventualmente, podem apresentar delicadas espículas foliculares, semelhantes a ceratose pilar.57 Podem acometer praticamente qualquer parte da face, mais comumente nas regiões temporais. A textura irregular ocasionada pelas pápulas eventualmente lembra pele com múltiplas cicatrizes de acne.
HistóricoAs pápulas associadas a espículas foliculares foram inicialmente descritas em 2007, comparada ao quadro da síndrome de Piccardi‐Lassueur‐Graham‐Little.57 Posteriormente, em 2011, foram descritas pápulas de superfície lisa, que são as mais frequentemente encontradas.58
Epidemiologia e prevalênciaA prevalência das pápulas da face varia muito entre as inúmeras séries de casos da doença publicadas até o momento. Na grande série espanhola de 355 pacientes publicada em 2014, 14% dos casos apresentavam pápulas da face, e foi mais frequente em homens (33%) que em mulheres (10%‐14%). Um estudo espanhol mais recente, com 75 pacientes, mostrou que a prevalência das pápulas também variou com a idade, e foi mais frequente em pacientes com menos de 55 anos (85,7%) comparado com pacientes com mais de 55 anos (22,6%; p=0,002).59 Em estudo de prevalência de lesões faciais da AFF entre as diferentes etnias, a frequência de pápulas foi muito maior no grupo de mulheres hispânicas (41%) comparado com as mulheres caucasianas (14%; p=0,003).25 A correlação entre tipo clínico e presença de pápulas foi descrita em dois estudos espanhóis, porém apresentou resultados conflitantes.21,59
Fisiopatogênese e histopatologiaInicialmente foram descritas como manifestação decorrente da inflamação dos folículos velos da face,57,58 mas desde 2017, com a descrição de biopsias de pápulas sem inflamação perifolicular e com a demonstração da eficácia da isotretinoína para o tratamento das pápulas, entendemos que as pápulas da face são manifestação indireta da atrofia cutânea associada à doença.60–62 Cada pápula corresponde a uma glândula sebácea cujo tamanho ultrapassa a espessura da derme afinada pela doença. Como nem sempre o exame histopatológico evidencia aumento de tamanho da glândula após seu processamento, alguns autores sugerem haver dilatação “in vivo” dessa estrutura, causada pela destruição da rede elástica da região. Diferentes graus de inflamação ao redor da glândula sebácea podem estar presente, mas não devem ser considerados como diagnósticos dessas lesões, uma vez que também são encontrados em pele da face normal.
Esse novo entendimento da fisiopatogênese das lesões explica a maior prevalência de pápulas no gênero masculino6 e em indivíduos mais jovens,59 uma vez que esses grupos têm maior volume de glândula sebácea que o gênero feminino e indivíduos com idade mais avançada, respectivamente. Da mesma maneira, entende‐se que o tratamento dessas lesões não é feito com anti‐inflamatórios, mas sim com retinoides, que irão reduzir o volume das glândulas sebáceas.60,62
TemporalidadeNão há dados sobre a relação temporal entre o surgimento das pápulas e o início da alopecia.
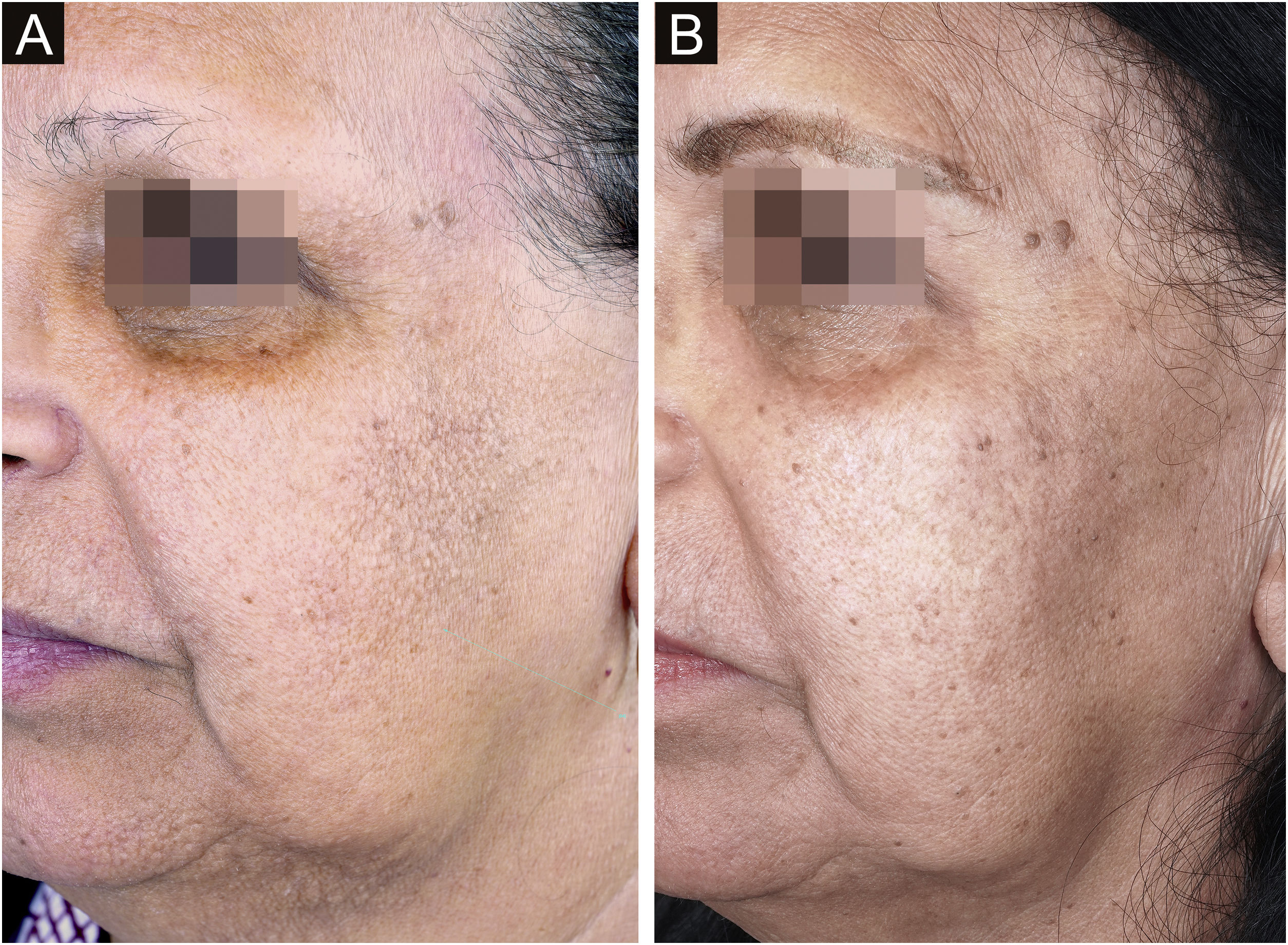
TratamentoA isotretinoína oral é o tratamento de escolha para controlar as pápulas da face. A dose descrita na literatura varia de 10mg/dia em dias alternados60 até 20mg por dia no primeiro mês seguido de 40mg/dia (0,5mg/kg/d) nos meses seguintes (fig. 9).61 O tempo para melhora das lesões é de duas semanas com o esquema de maior dose diária,63 enquanto são necessários dois meses para atingir melhora com o uso de 10mg/dia em dias alternados.60 Em virtude da maior tolerabilidade e necessidade de uso crônico, doses menores têm sido mais utilizadas na prática diária.
Alguns autores preferem o uso de retinoides tópicos para o tratamento das pápulas, por receio dos riscos da medicação sistêmica, mas não existem dados na literatura que comprovem a eficácia dessa via no tratamento das pápulas da face. Além disso, esses pacientes costumam ter a pele extremamente sensível, e o uso de qualquer tipo de substância tópica pode ser desinteressante se considerarmos a já comprovada associação da doença com o uso de cremes na face.12,13
RelevânciaAs pápulas da face são associadas com maior extensão da doença6 e maior necessidade de utilização de medicamentos sistêmicos.59
Considerações finaisA AFF é um tipo de alopecia cicatricial com importante impacto psicológico nos pacientes64 em virtude do envolvimento de áreas pilosas de difícil camuflagem. Sua evolução, em geral lenta6 e assintomática,65 faz com que os pacientes demorem a perceberem a área alopécica, retardando seu diagnóstico em muitos anos. Os medicamentos disponíveis para tratar a doença são eficazes para impedir a progressão da falha na maioria dos pacientes, mas não conseguem reverter o que já foi acometido no momento do diagnóstico.6,66,67 O transplante capilar, quando realizado, apresenta bons resultados a curto prazo, mas na maioria dos casos ocorre perda progressiva dos enxertos com o passar dos anos.68 Por tudo isso, o diagnóstico precoce da doença é fundamental para melhorar a qualidade de vida dos pacientes com AFF.
Considerando que o acometimento extrafolicular da AFF pode preceder a perda capilar da doença, o reconhecimento dessas manifestações clínicas pode facilitar e antecipar o diagnóstico da doença em muitos casos. Entretanto, até o momento não existem critérios clínicos ou histológicos que permitam o diagnóstico da AFF por meio das alterações cutâneas não foliculares da doença, e é muito importante a comprovação de uma alopecia cicatricial primária por meio de biopsia de pele nos casos muito precoces. Assim, a presença dessas manifestações deve gerar vigilância mais atenta para o couro cabeludo, com avaliação cuidadosa da densidade dos pelos velos na borda anterior do couro cabeludo, realização de biopsia de pele nos casos com diminuição dos pelos velos e acompanhamento fotográfico naqueles onde a densidade ainda não apresenta alterações.
O entendimento fisiopatogênico da doença também se modifica com o conceito de que a AFF pode se iniciar pelo acometimento extrafolicular da pele. Ao mesmo tempo que reforça o possível envolvimento de substâncias contidas em cremes faciais, questiona a relação de causalidade desses produtos, sugerida pelos estudos tipo caso‐controle.
Dada a relevância desse assunto, consideramos fundamental a realização de mais estudos com metodologias adequadas para a caracterização do envolvimento cutâneo da AFF, investigando, quando possível, a relação temporal com o acometimento folicular da doença. Além disso, são necessários estudos prospectivos controlados para avaliar a eficácia dos tratamentos atualmente propostos para as manifestações extrafoliculares da doença e seu significado prognósticos.
Suporte financeiroNenhum.
Contribuição dos autoresAline Donatti: Elaborou desenho do estudo e levantamento dos dados; Redação e revisão do artigo; Obtenção, análise e interpretação dos dados; Revisão crítica da literatura; Aprovação final da versão final do manuscrito.
Isabelle I Hue Wu: Elaborou desenho do estudo e levantamento dos dados; Redação e revisão do artigo; Obtenção, análise e interpretação dos dados; Revisão crítica da literatura; Aprovação final da versão final do manuscrito.
Conflito de interessesNenhum.
Como citar este artigo: Donati A, Wu IIH. Extra‐follicular cutaneous manifestations of frontal fibrosing alopecia. An Bras Dermatol. 2024;99:875–86.
Trabalho realizado no Ambulatório de Tricologia, Hospital do Servidor Público Municipal de São Paulo, São Paulo, SP, Brasil.