A Malassezia, um saprófito da pele, é comumente isolada de pacientes com dermatite seborreica, que é uma das dermatoses mais frequentes em pacientes infectados pelo HIV. O papel desse fungo na fisiopatologia da doença ainda não foi definido.
ObjetivoDeterminar se pacientes que vivem com HIV e dermatite seborreica têm mais Malassezia do que aqueles que não apresentam dermatite seborreica.
MétodoTrata‐se de um estudo observacional transversal descritivo e prospectivo, para o qual foram convidados todos os pacientes adultos que vivem com HIV e frequentam o ambulatório de doenças infecciosas do Hospital Geral Dr. Manuel Gea González. Pacientes com descamação e eritema foram incluídos no Grupo 1, enquanto pacientes sem eritema foram incluídos no Grupo 2. Foram coletadas amostras de todos os pacientes para esfregaço de cultura.
ResultadosIncluímos 30 pacientes em cada grupo. Todos os pacientes com dermatite seborreica apresentaram esfregaço positivo com quantidades variáveis de leveduras. No grupo controle, 36,7% dos pacientes apresentaram baciloscopia negativa. Os resultados são estatisticamente significativos, assim como o número de colônias nas culturas.
Limitações do estudoO estudo utilizou um pequeno tamanho amostral e as subespécies não foram identificadas.
ConclusõesPacientes com manifestações clínicas da dermatite seborreica apresentam maiores quantidades de Malassezia. Mais estudos precisam ser realizados para analisar se a maior quantidade está relacionada a desequilíbrios na microbiota da pele.
As leveduras Malassezia spp. são saprófitas, parte da flora normal da pele, que também podem ser identificadas em algumas condições patológicas que variam em gravidade, de micose superficial a fungemia.
A Malassezia spp. foi identificada como o agente causador de pitiríase versicolor e alguns casos de foliculite. No entanto, seu papel na dermatite seborreica (DS) permanece controverso e, apesar de muitos dados confirmarem a origem inflamatória da dermatose, sua relação com a Malassezia spp. permanece inegável e inexplicável.1
A DS é uma dermatose inflamatória que afeta principalmente o couro cabeludo e, menos frequentemente, a face e o tronco. Descamações, eritema e coceira são os achados mais comuns. Afetando cerca de 3% da população mundial, a condição predomina no sexo masculino e é muito mais frequente em associação com a doença de Parkinson e a infecção pelo HIV, com incidência de até 80%. Como é particularmente frequente em pacientes que vivem com o HIV, às vezes a DS é considerada um marcador da infecção, o que pode auxiliar no diagnóstico precoce.2
A fisiopatologia da DS ainda não foi completamente elucidada. No entanto, vários fatores têm sido considerados como possíveis desencadeadores da doença, como glândulas sebáceas andrógeno‐dependentes, sexo masculino, fatores sazonais, privação de sono, infecção e estresse. A atividade da DS é caracterizada por um comportamento cíclico de remissões e exacerbações.3
O diagnóstico é apoiado por manifestações clínicas e não são necessários biópsias nem estudos adicionais. Cultura não é um pedido rotineiro, uma vez que a Malassezia spp. não cresce facilmente em meio convencional. No entanto, o ágar Dixon modificado, uma cultura enriquecida com lipídios, permite o isolamento da levedura com uma taxa de sucesso de 90%.4
As opções de tratamento são variadas e incluem queratolíticos, esteroides e antifúngicos, todos oferecendo uma resposta aceitável. No entanto, com base na natureza recidivante da doença, não recomendamos o uso de esteroides como primeira linha de tratamento. Por outro lado, o cetoconazol tem a vantagem de ser um antifúngico que reduz a quantidade de Malassezia na pele, mas, ainda mais importante, tem um efeito anti‐inflamatório muito eficaz no controle da DS.5
O objetivo deste estudo foi quantificar as leveduras Malassezia (unidade formadora de colônias, UFC) em uma população vivendo com HIV, com e sem manifestações clínicas de DS. Acreditamos que nossos resultados contribuirão para o conjunto de conhecimentos sobre o papel que a Malasseziaspp. desempenha na DS.
MétodosTrata‐se de um estudo observacional transversal, descritivo e prospectivo. Todos os pacientes adultos que vivem com HIV e que frequentam o ambulatório de doenças infecciosas do Hospital Geral Dr. Manuel Gea González foram convidados a participar. Aqueles que aceitaram assinaram um termo de consentimento livre e esclarecido previamente aprovado pelo comitê de ética em pesquisa do hospital. Dados como idade e sexo foram registrados, e os pacientes foram examinados fisicamente em busca de sinais clínicos de DS no rosto. Pacientes que apresentavam descamação e eritema foram incluídos no Grupo 1, e pacientes sem esses sintomas foram incluídos no Grupo 2. Pacientes que receberam antifúngicos tópicos ou sistêmicos nos últimos seis meses foram excluídos do estudo.
Aplicamos uma gota de solução salina em uma lâmina de bisturi n° 20 e raspamos cuidadosamente a área glabelar, de forma atraumática, para obter uma amostra de células epidérmicas e microbiota. O material foi dividido em duas porções, metade para coloração com azul de metileno e metade para cultura em meio ágar Dixon modificado incubado a 37°C. Verificamos as culturas a cada 72 horas para o crescimento de fungos durante duas semanas. Em seguida, realizamos um exame direto com corante azul de algodão (lactofenol) para a contagem de colônias.
Para a coloração do esfregaço, a amostra foi secada em estufa e fixada com álcool etílico 96% e calor direto. Finalmente, aplicou‐se o azul de metileno por um minuto e realizou‐se posterior lavagem. Usamos óleo de imersão em um microscópio de luz 100× para observar as leveduras com uma ampliação de 40×. Os resultados foram pontuados da seguinte maneira: 1‐5 leveduras por campo = +; 6‐10 = ++; > 10 = +++.
A análise estatística foi realizada com o teste exato de Fisher e o software SPSS versão 23.2.
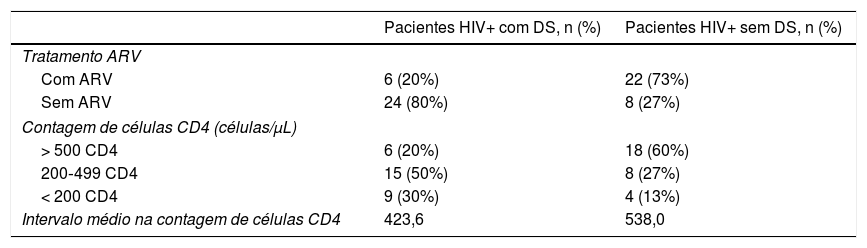
ResultadosForam incluídos em nosso estudo 60 pacientes, 30 em cada grupo. O sexo masculino predominou em ambos os grupos (90%), com faixa etária de 18?79 anos e média de 35,4 anos (± 12,4 DP). No primeiro grupo, havia 28 homens (93,4%) e duas mulheres (6,6%); a idade média foi de 32,7 anos dentro de um intervalo de 18?79 anos. No segundo grupo, 26 eram homens (86,7%) e quatro mulheres (13,3%), com idade média de 38,2 anos, dentro de um intervalo de 23?75 anos (tabela 1). No grupo com DS, 80% dos pacientes não iniciaram a terapia antirretroviral, enquanto a maioria do grupo não afetado (73%) estava sob medicação. A maioria dos pacientes com DS apresentava contagem de células CD4 entre 200 e 499, em comparação a 60% do grupo sem DS, em que a contagem de células CD4 era maior que 500 (tabela 2).
Comparação entre tratamento do HIV e contagem de células CD4 em pacientes HIV+ com e sem DS
| Pacientes HIV+ com DS, n (%) | Pacientes HIV+ sem DS, n (%) | |
|---|---|---|
| Tratamento ARV | ||
| Com ARV | 6 (20%) | 22 (73%) |
| Sem ARV | 24 (80%) | 8 (27%) |
| Contagem de células CD4 (células/μL) | ||
| > 500 CD4 | 6 (20%) | 18 (60%) |
| 200‐499 CD4 | 15 (50%) | 8 (27%) |
| < 200 CD4 | 9 (30%) | 4 (13%) |
| Intervalo médio na contagem de células CD4 | 423,6 | 538,0 |
DS, dermatite seborreica; ARV, antirretroviral; CD4, cluster de diferenciação 4.
Neste estudo, todos os pacientes com DS (Grupo 1) apresentaram resultados positivos para Malassezia spp. com as seguintes frequências: nove testes (30%) com baixa concentração de levedura (+), 14 (46,7%) com moderada concentração de levedura (++) e sete (23,3%) com elevada concentração de levedura (+++). No grupo de pacientes sem DS (Grupo 2), os resultados foram positivos para Malassezia spp. com as seguintes frequências: 10 testes (33,3%) com baixa concentração de levedura (+), sete (23,3%) com moderada concentração de levedura (++) e dois (6,7%) com elevada concentração de levedura (+++). Onze pacientes (36,7%) apresentaram resultados negativos de esfregaço para Malassezia spp. (tabela 3).
Comparação de esfregaço PAS‐positivo para Malassezia spp. entre pacientes HIV+ com e sem DS
| Esfregaço PAS‐positivo para Malassezia spp. | ||
|---|---|---|
| Pacientes HIV+ com DS, n (%) | Pacientes HIV+ sem DS, n (%) | |
| PAS + | 9 (30%) | 10 (33,3%) |
| PAS ++ | 14 (46,7%) | 7 (23,3%) |
| PAS +++ | 7 (23,3%) | 2 (6,7%) |
| PAS − | 0 (0%) | 11 (36,7%) |
DS, dermatite seborreica.
Encontramos uma diferença estatisticamente significante (p = 0,001) na quantidade de leveduras identificadas nos esfregaços corados de ambos os grupos, com predomínio em pacientes com DS.
Em relação ao crescimento de Malassezia spp., no grupo de pacientes infectados pelo HIV com manifestações de DS, 23 culturas (76,7%) foram positivas e sete (23,3%) foram negativas, com uma faixa de carga de levedura de 10‐70 UFCs. No grupo de pacientes sem DS, 15 (50%) culturas foram positivas, 15 (50%) foram negativas, com um intervalo de carga de levedura de 2‐35 UFCs.
Classificamos as culturas em quatro categorias de acordo com as UFCs: culturas negativas com 0UFC, culturas com 1‐25 UFCs, culturas com 26‐50 UFCs, culturas com 51‐75 UFCs. A ordem de frequência dos pacientes com DS foi: sete culturas (23%) com 0UFC, 11 (37%) com 1‐25 UFCs, nove (30%) com 26‐50 UFCs e três (10%) com 51‐75 UFCs. A ordem de frequência para pacientes HIV+ sem DS foi de 15 culturas (50%) com 0UFC, 13 (43%) com 1‐25 UFCs, duas (7%) com 26‐50 UFCs e nenhuma cultura (0%) com 51‐75 UFCs (tabela 4).
Comparação do crescimento de UFC de Malassezia spp. entre pacientes HIV+ com e sem DS
| Crescimento de UFC de Malassezia spp. | ||
|---|---|---|
| Pacientes HIV+ com DS, n (%) | Pacientes HIV+ sem DS, n (%) | |
| 0 UFC | 7 (23%) | 15 (50%) |
| 1‐25 UFCs | 11 (37%) | 13 (43%) |
| 26‐50 UFCs | 9 (30%) | 2 (7%) |
| 51‐75 UFCs | 3 (10%) | 0 (0%) |
DS, dermatite seborreica; UFCs, unidades formadoras de colônias.
Encontramos diferença estatisticamente significante (p < 0,001) em ambos os grupos, com predomínio em pacientes com DS.
O número médio de Malassezia spp. nos dois grupos foi: n = 37,67 em pacientes HIV+ com DS e n = 23,33 em pacientes sem DS. Após a realização do teste U de Mann‐Whitney, nossos resultados apresentaram diferença estatisticamente significante (p = 0,012) entre os dois grupos, mostrando que os pacientes HIV+ com DS apresentam um aumento na taxa de crescimento de Malassezia spp. em comparação aos pacientes HIV+ sem DS.
DiscussãoPor ser uma doença que afeta principalmente áreas visíveis, como a face e o couro cabeludo, além do desconforto causado pela coceira, o impacto social da DS é relevante e pode desempenhar um papel marcante na qualidade de vida. Também é importante lembrar que a DS, por ser considerada um sinal precoce de imunossupressão celular, pode ser considerada um marcador de doença na população infectada pelo HIV.6
Um estudo que analisou os dados de UFC em pacientes que vivem com HIV com e sem DS em comparação com controles HIV negativos não encontrou diferença no número de leveduras entre os grupos. Os autores concluíram que, aparentemente, a resposta imune individual é o que determina as manifestações clínicas.6–9
Em comparação, nossos resultados mostraram que a Malassezia spp. pode ser igualmente isolada da pele com e sem DS em pacientes que vivem com HIV, e a única diferença é a carga de levedura.
Esses resultados são semelhantes a um relato que comparou pacientes HIV positivos e negativos sem lesões de pele e encontrou uma taxa de crescimento de Malassezia de 94%. A diferença entre os grupos também foi o maior número de contagem de UFC em pacientes HIV positivos.7
Embora alguns autores ainda considerem a DS como uma doença infecciosa, sua origem inflamatória se torna mais evidente a cada dia.10
No entanto, os resultados do presente estudo e de alguns outros trabalhos relacionam fortemente a DS à presença de Malassezia spp. Provavelmente, a maior carga de levedura é secundária ao aumento da produção de sebo. Assim, uma multiplicação ativa de leveduras é facilmente observada. Como esses fungos hidrolisam o sebo humano, os metabólitos fazem com que queratinócitos liberem citocinas pró‐inflamatórias, completando o ciclo de inflamação.11
Também é possível que a superpopulação de Malassezia possa prejudicar o equilíbrio da microbiota da pele, o que poderia explicar a importância da imunidade celular na DS, mais frequente em pacientes imunocomprometidos.
ConclusãoEmbora o papel da Malassezia ainda não seja totalmente compreendido, aparentemente a quantidade dessas leveduras é relevante para o desenvolvimento da DS sintomática. Portanto, os elementos‐chave para uma investigação mais aprofundada devem incluir a quantidade e qualidade lipídica em pacientes afetados e não afetados. Além disso, uma análise metagenômica adicional da microbiota da pele saudável e com DS para a comparação das espécies (bacterianas e fúngicas) presentes nesses casos deve ser útil para melhor compreender a DS e sua patogênese.12
Mensagens principais: o que há de novo?A Malassezia spp. pode ser igualmente isolada de pacientes vivendo com HIV/AIDS com ou sem manifestações clínicas de DS.
Existe uma diferença estatística na quantidade de leveduras em pacientes com e sem dermatite seborreica.
O aumento da produção de sebo desses pacientes pode predispor a uma sobrecarga de Malassezia que posteriormente altera o equilíbrio da microbiota da pele.
Suporte financeiroNenhum.
Contribuição dos autoresGabriela Moreno‐Coutiño: Aprovação da versão final do manuscrito; concepção e planejamento do estudo; elaboração e preparação do manuscrito; participação intelectual na abordagem propedêutica e/ou terapêutica dos casos estudados.
Carlos D. Sánchez‐Cárdenas: Análise estatística.
Yesenia Bello‐Hernández: Obtenção, análise e interpretação de dados.
Ramón Fernández‐Martínez: Análise estatística.
Sara Arroyo‐Escalante: Concepção e planejamento do estudo.
Roberto Arenas: Aprovação da versão final do manuscrito.
Conflito de interessesNenhum.
Como citar este artigo: Moreno‐Coutiño G, Sánchez‐Cárdenas CD, Bello‐Hernández Y, Fernández‐Martínez R, Arroyo‐Escalante S, Arenas R. Isolation of Malassezia spp. in HIV‐positive patients with and without seborrheic dermatitis. An Bras Dermatol. 2019;94:527–31.
Trabalho realizado na Seção de Micologia do Hospital Geral Dr. Manuel Gea González, Delegación Tlalpan, Cidade do México, México.