Hemangiomas da infância (HI) ocorrem em aproximadamente 4% a 10% da população pediátrica. O reconhecimento dos subtipos clínicos e condições que indicam maior risco para complicações são essenciais para o sucesso terapêutico.
ObjetivosIdentificar os fatores de risco para complicações, recidivas e sequelas inestéticas.
MétodosCoorte retrospectiva de pacientes com hemangioma da infância em acompanhamento no Departamento de Dermatologia da Universidade Federal de Ciências da Saúde de Porto Alegre, entre 2006 e 2018.
ResultadosDos 190 pacientes incluídos, 24% tiveram alguma complicação, sendo ulceração a mais frequente e 86% necessitaram de algum tratamento. Na avaliação de correlação, ulceração esteve relacionado estatisticamente com HI misto (p=0,004), HI segmentar (p <0.01) e localização em região glútea (p=0,001). O tempo médio de tratamento com propranolol foi de 12,7 meses. Os pacientes com síndrome PHACES e hemangioma da infância segmentar requereram tempo de tratamento mais prolongado (p <0.001 e p=0.0407, respectivamente), bem como aqueles que iniciaram o tratamento depois de cinco meses de vida (p <0.0001). As recidivas ocorreram em 16,6% dos pacientes tratados, sendo todos do sexo feminino, 94% estavam localizados na cabeça e pescoço (principalmente na pálpebra superior, cyrano, segmento S3 e com acometimento da parótida); 61% e 38,8% eram subtipos misto e profundo, respectivamente. Aproximadamente 1/3 dos pacientes tiveram alguma sequela inestética.
Limitações do estudoPor se tratar de um estudo retrospectivo, houve perda de dados e fotos de alguns pacientes.
ConclusõesHemangiomas mistos e segmentares são fatores de risco para ulceração e sequelas. Recidivas ocorrem mais no sexo feminino e em hemangiomas segmentares. Hemangioma da infância segmentar e síndrome PHACES necessitam maior tempo de tratamento. Protocolos específicos são necessários para hemangiomas da infância com alto risco de recidiva.
Os hemangiomas da infância (HIs) são os tumores vasculares benignos mais comuns da infância, com ocorrência em cerca de 4 a 10% dessa população.1–6 Eles podem diferir consideravelmente em relação ao tamanho, crescimento, localização e profundidade. Na maioria dos casos, são pequenos, esporádicos e não complicam.7,8
Morfologicamente, HIs são classificados como superficial, profundo ou misto. Em termos de extensão, podem ser focal, segmentar ou multifocal.1–3,6 O subtipo focal é o mais comum, enquanto os segmentares – que ocupam uma subunidade do corpo – são frequentemente associados a complicações.3,9–11 Pacientes com lesão segmentar na face ou cervical podem apresentar síndrome PHACES, que representa espectro de anomalias associadas (malformação da fossa posterior do cérebro, hemangioma, anomalias arteriais, cardíacas, oculares e esternais).10 Denomina‐se hemangioma cyrano aqueles hemangiomas localizados na ponta nasal.
Os HIs ocorrem mais frequentemente em bebês prematuros, sexo feminino e com baixo peso ao nascer.9,10 Outros fatores de risco associados a maior incidência de HI são: idade materna avançada, etnia caucasiana, gestação múltipla, placenta prévia e pré‐eclâmpsia.3 Embora sejam geralmente esporádicos, a história familiar de HI aumenta o risco de hemangioma, sugerindo que uma predisposição genética pode estar implicada em sua patogênese.1
Em relação à história natural, em geral é dividida em fases: (1) surgimento ao nascimento ou logo após; (2) proliferação precoce; (3) proliferação tardia; (4) estabilização (platô); (5) involução.1–3 A maioria dos HIs não está presente ao nascimento, mas aparece tipicamente nas primeiras semanas de vida, enquanto alguns pacientes têm lesão precursora ao nascimento: pequena pápula vermelha, telangiectasia, mácula hipocrômica (que corresponde a um nevo anêmico) ou pseudoequimoses. Os tumores crescem rapidamente por 6 a 10 meses (fase proliferativa); a maioria atinge seu tamanho máximo entre 3 e 5 meses de idade e lentamente regridem por 7 a 10 anos (fase involutiva). A regressão completa é vista em 90% dos casos aos 4 anos de idade.6
Analisamos pacientes diagnosticados com HI em acompanhamento em hospital universitário do Sul do Brasil para entender o perfil epidemiológico, aspectos clínicos e terapêuticos desses pacientes e identificar as condições associadas com complicações, recidivas e sequela inestética.
MétodosTrata‐se de coorte retrospectiva envolvendo pacientes com HI atendidos no Departamento de Dermatologia Pediátrica da Universidade Federal de Ciências da Saúde de Porto Alegre entre 2006 e 2018. Este estudo está de acordo com os princípios da Declaração de Helsinki e foi aprovado pelo Comitê de Ética em Pesquisa sob o número 1.973,303. Termo de Consentimento Livre e Esclarecido foi obtido em todos os casos.
O diagnóstico de HI foi clínico na maioria dos casos, exceto nos HIs profundos, que requereram exame complementar como ecografia com Doppler, tomografia computadorizada (TC) ou ressonância nuclear magnética (RNM). Para síndrome SACRAL (disrafismo espinal, anomalias anogenital, cutânea, renal e urológica associado com HI em localização lombossacra), RNM de coluna e pelve foi realizada no contexto diagnóstico, enquanto pacientes com síndrome PHACE realizaram TC e/ou RNM de crânio. O diagnóstico de síndrome PHACES foi realizado conforme os critérios diagnósticos publicado por Metry et al. em 2009.12 Pacientes com HI multifocal realizaram ecografia abdominal total a fim de descartar envolvimento hepático.
As sequelas inestéticas incluídas foram anetodermia, pele redundante, tecido fibroadiposo, cicatriz atrófica e telangiectasias, enquanto as complicações incluídas foram ulceração e alteração funcional. Consideramos como recidiva recente as que ocorreram entre 11 meses de idade e 2 anos e 11 meses de vida, e como recidiva tardia as que ocorreram a partir dos 3 anos de idade.
Procedemos com a revisão de prontuários médico dos pacientes selecionados e com análise fotográfica. Qualquer variável não encontrada em prontuário médico foi questionada durante a consulta médica de rotina ou por contato telefônico. Excluímos do trabalho pacientes cujos pais/responsáveis não assinaram o Termo de Consentimento Livre e Esclarecido.
Variáveis demográficas e pré‐natais dos pacientes selecionados foram perguntadas na primeira consulta no serviço de Dermatologia da Universidade Federal de Ciências da Saúde de Porto Alegre. As variáveis clínicas, terapêuticas e de resposta ao tratamento foram analisadas durante as consultas de rotina e por meio de análise fotográfica.
As comparações dos grupos foram feitas usando os testes t de Student e Qui‐Quadrado de Pearson ou os testes de Wilcoxon‐Mann‐Whitney e exato de Fisher, quando apropriado. A associação entre o tempo de tratamento com propranolol e variáveis clínicas foi testada por meio de modelagem utilizando Generalized Estimating Equation (GEE). Para essa análise, foi escolhida uma distribuição gama com função logarítmica. Estimador robusto e método independente foram selecionados para as matrizes de covariância e correlação, respectivamente. Alpha foi estabelecido em 5%, e os dados foram analisados usando SPSS 18.0 (SPSS Inc. Chicago, IL, EUA). Para avaliação de correlação, utilizou‐se a correção de continuidade de Yates.
ResultadosEntre 2006 e 2018, incluímos 190 pacientes (72,6% feminino) diagnosticados com HI. A média de idade ao diagnóstico de HI foi, em geral, 14 dias de vida, embora 63% os casos apresentassem lesão precursora ao nascimento. A média de idade ao diagnóstico de HIs superficiais foi de 11,9 dias, 14 dias para os HIs mistos e 34 dias para os HIs profundos (p=0,0192).
HI focal foi o subtipo mais prevalente, com ocorrência em 133 pacientes (71,8%). Em relação ao subtipo morfológico, a maioria (62,5%) apresentava componente misto; 74,8% localizavam‐se em cabeça/pescoço. Dos pacientes com HI multifocal, 25% apresentavam hemangioma visceral – o fígado foi o local mais comum, com ocorrência em 75% dos indivíduos (tabela 1).
Hemagiomas infantis: perfil clínico‐epidemiológico e evolução obstétrica
| Variáveis | |
|---|---|
| Sexo – n (%) | 190 (100) |
| Feminino | 138 (72,6) |
| Masculino | 52 (27,3) |
| Subtipo morfológico – n (%) | 176 (93) |
| Superficial | 54 (30,6) |
| Misto | 110 (62,5) |
| Profundo | 12 (6,8) |
| Localização – n (%) | 187 (98) |
| Cabeça e pescoço | 140 (74,8) |
| Anogenital | 14 (7,4) |
| Outro | 75 (40,1) |
| Subtipo clínico – n (%) | 185 (97) |
| Focal | 133 (71,8) |
| Segmentar | 36 (19,4) |
| Multifocal | 16 (8,7) |
| Síndrome PHACES | 9 (4,8%) |
| Parto – n (%) | 127 (67) |
| Cesareana | 102 (80,3) |
| Vaginal | 25 (19,6) |
| História familiar de HI – n (%) | 89 (47) |
| Sim | 19 (21,3) |
| Não | 70 (78,6) |
| Prematuridade (< 37 semanas) – n (%) | 145 (76) |
| Sim | 40 (27,5) |
| Não | 105 (72,4) |
Trinta e seis pacientes (19,4%) apresentava HI segmentar e 4,8% tinham síndrome PHACES, de acordo com os critérios diagnósticos propostos por Metry et al.12 Um paciente apresentou síndrome SACRAL.
Quarenta crianças (27,5%; 40/145) foram prematuras (idade gestacional <37 semanas). Baixo peso ao nascer (< 2500g) foi evidenciado em 18% dos indivíduos; a média de peso ao nascer foi de 2980g (tabela 1).
O tempo médio de seguimento foi de 330 dias. Houve perda de seguimento (42/190; 22%), todos em casos de HI superficial pequeno e que, portanto, não necessitaram de tratamento. Complicação ocorreu em 24% dos pacientes (46/190). Desses, ulceração ocorreu em 29 pacientes (63%) e alteração funcional em 17 (36%). Considerando todas as alterações funcionais, 76,4% ocorreram em HI segmentar e 23,5% em HI focal. As alterações funcionais mais frequentes foram oclusão ocular (9/17; 52,9%) – ocasionando ambliopia ou astigmatismo – seguido por disfunção respiratória (6/17; 35,2%). Todos os HIs que causaram dificuldade respiratória estavam localizados no lábio inferior. Na avaliação de correlação, ulceração esteve relacionada estatisticamente com HI misto (p=0,004), HI segmentar (p <0,01) e localização na região glútea (p=0,001). A presença de HI superficial teve relação com a ausência de ulceração (p=0,035).
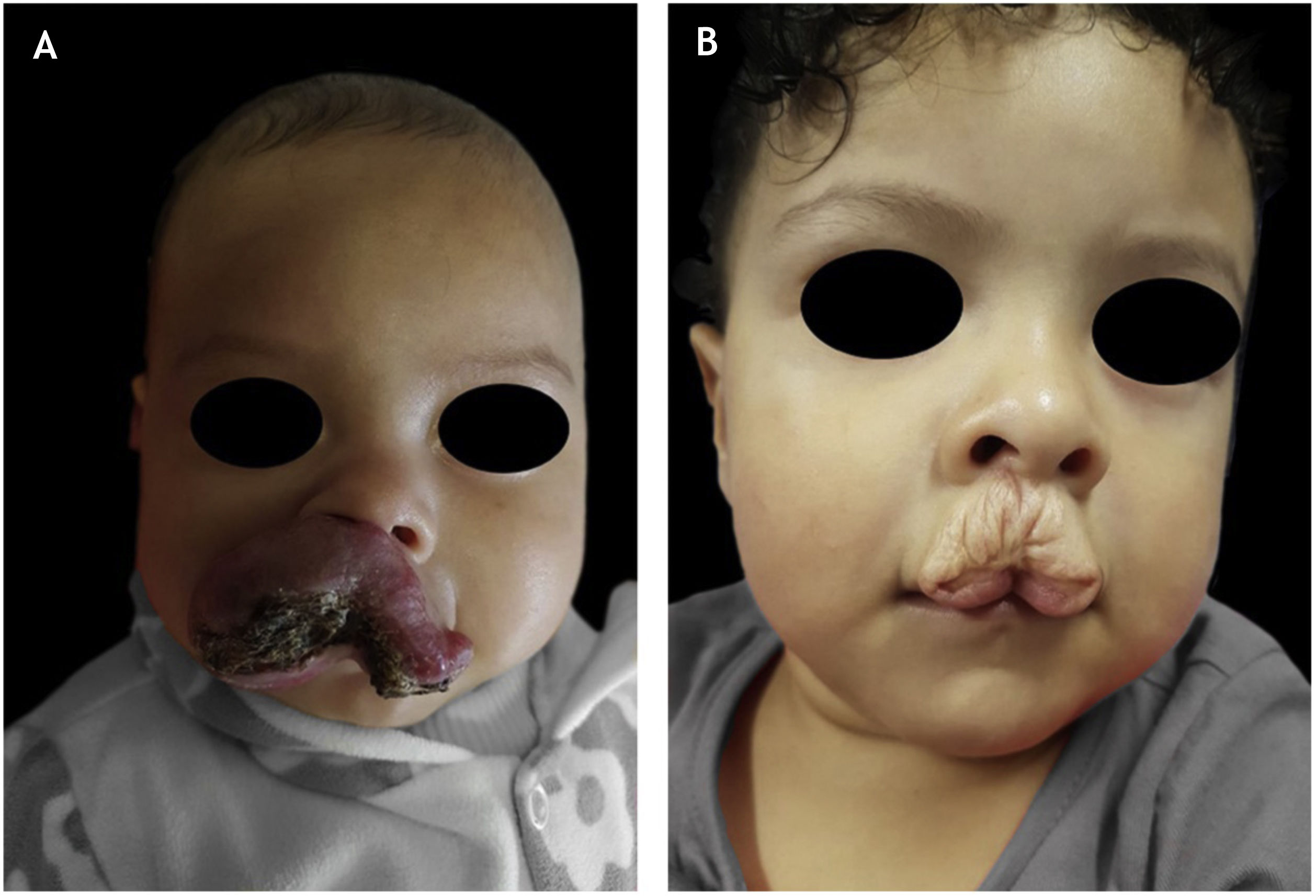
Dos pacientes tratados, 31% (51/163) tiveram alguma sequela inestética. Desses, HI misto foi o subtipo mais comum (28/51, 54,9%; p=0,004), seguido por HI profundo (12/51, 23,5%; p=0,8) e HI superficial (11/51, 21,5% – fig. 1). Alguma sequela inestética foi observada em 53% (27/51) dos HIs segmentares (p <0,01) e em seis de nove pacientes com síndrome PHACES (fig. 1).
A maioria dos pacientes necessitou de algum tratamento (163/190; 86%). Tratamento sistêmico foi necessário em 108 pacientes (56,8%). Propranolol (2 mg/kg/dia) sozinho foi utilizado em 82 casos, e propranolol combinado com prednisolona (1 mg/kg/dia), em 26 casos. Timolol 0,5% tópico foi utilizado em 55 casos (28,9%). Dos pacientes que receberam propranolol isolado ou combinado com esteroides, 90% tiveram redução de 80% ou mais no tamanho do hemangioma ao final do tratamento.
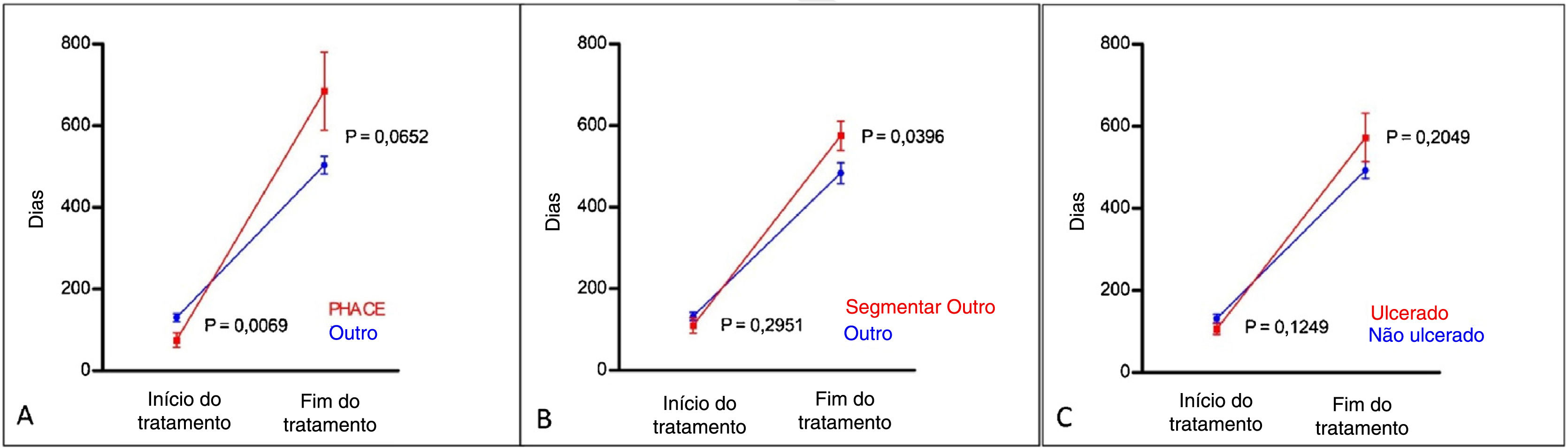
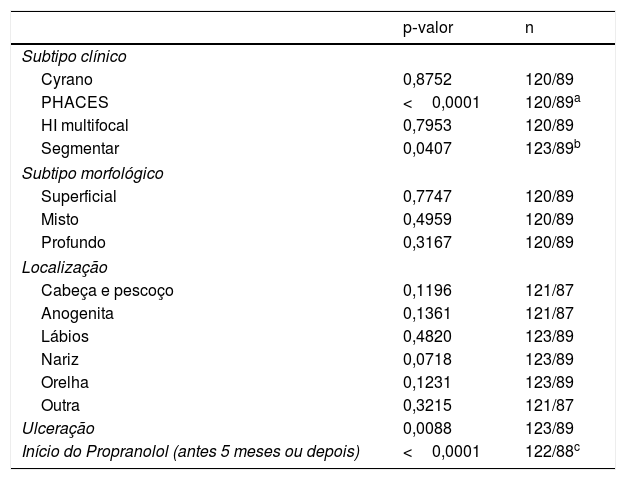
Em relação à duração do tratamento com propranolol, a média de uso foi de 13,15±7,2 meses. Não houve diferença estatística na duração do tratamento entre os diferentes subtipos morfológicos (tabela 2). Em relação aos outros subtipos clínicos (tabela 2), pacientes com síndrome PHACES requereram um tratamento mais prolongado (p <0,001), início de tratamento mais precoce (p=0,0069) e terminaram o tratamento mais tardiamente, mas sem significância estatística (p=0,0652 – fig. 2A). HIs segmentares também necessitaram de tempo de tratamento prolongado (tabela 2), embora sem significância estatística no Modelo de Equação Generalizada (EEG – p=0,0407); no entanto, com significância estatística na análise pos‐hoc tanto no início do tratamento (p=0,029) quanto no final (p=0,0396 – fig. 2B). Associação significante foi encontrada entre ulceração e duração de tratamento, com propranolol detectada com EEG modelo (p=0,0088 – tabela 2). No entanto, análise post hoc não encontrou diferença estatísticas entres os grupos ulcerado e não ulcerado (fig. 2C).
Análise estatística do tempo de tratamento com propranolol e múltiplas variáveis
| p‐valor | n | |
|---|---|---|
| Subtipo clínico | ||
| Cyrano | 0,8752 | 120/89 |
| PHACES | <0,0001 | 120/89a |
| HI multifocal | 0,7953 | 120/89 |
| Segmentar | 0,0407 | 123/89b |
| Subtipo morfológico | ||
| Superficial | 0,7747 | 120/89 |
| Misto | 0,4959 | 120/89 |
| Profundo | 0,3167 | 120/89 |
| Localização | ||
| Cabeça e pescoço | 0,1196 | 121/87 |
| Anogenita | 0,1361 | 121/87 |
| Lábios | 0,4820 | 123/89 |
| Nariz | 0,0718 | 123/89 |
| Orelha | 0,1231 | 123/89 |
| Outra | 0,3215 | 121/87 |
| Ulceração | 0,0088 | 123/89 |
| Início do Propranolol (antes 5 meses ou depois) | <0,0001 | 122/88c |
Comparações post‐hoc utilizando o modelo de Equação de Estimativa Generalizada (EEG) relativas ao tempo de tratamento com propranolol, descrito na tabela 2. (A), PHACES; (B), hemangiomas segmentares e (C), hemangiomas ulcerados.
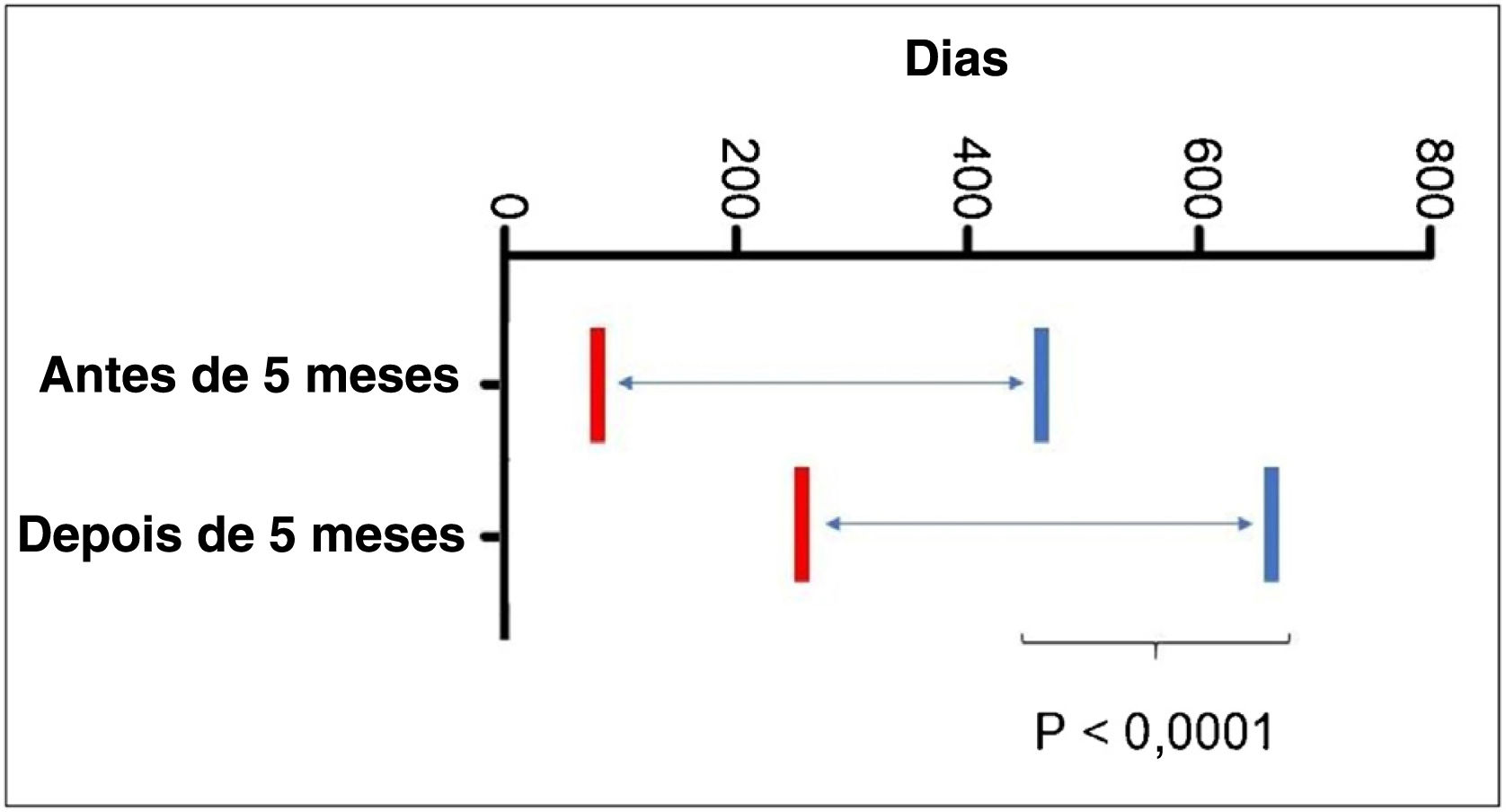
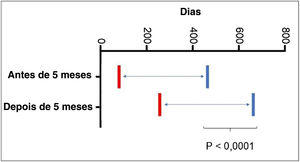
Quanto à idade de início do tratamento com propranolol, 5,68% iniciaram antes dos 30 dias; 36,58% acima de 2 meses; 53,65% acima dos 3 meses; 69,09% acima dos 4 meses, e 79,4% acima dos 5 meses. Também encontramos que pacientes que iniciaram o tratamento após os 5 meses de idade requereram tempo de tratamento prolongado (p <0001 – fig. 3).
Comparações post‐hoc utilizando o modelo de Equação de Estimativa Generalizada (EEG) descrito na tabela 2, relativas à idade de início do tratamento com propranolol.
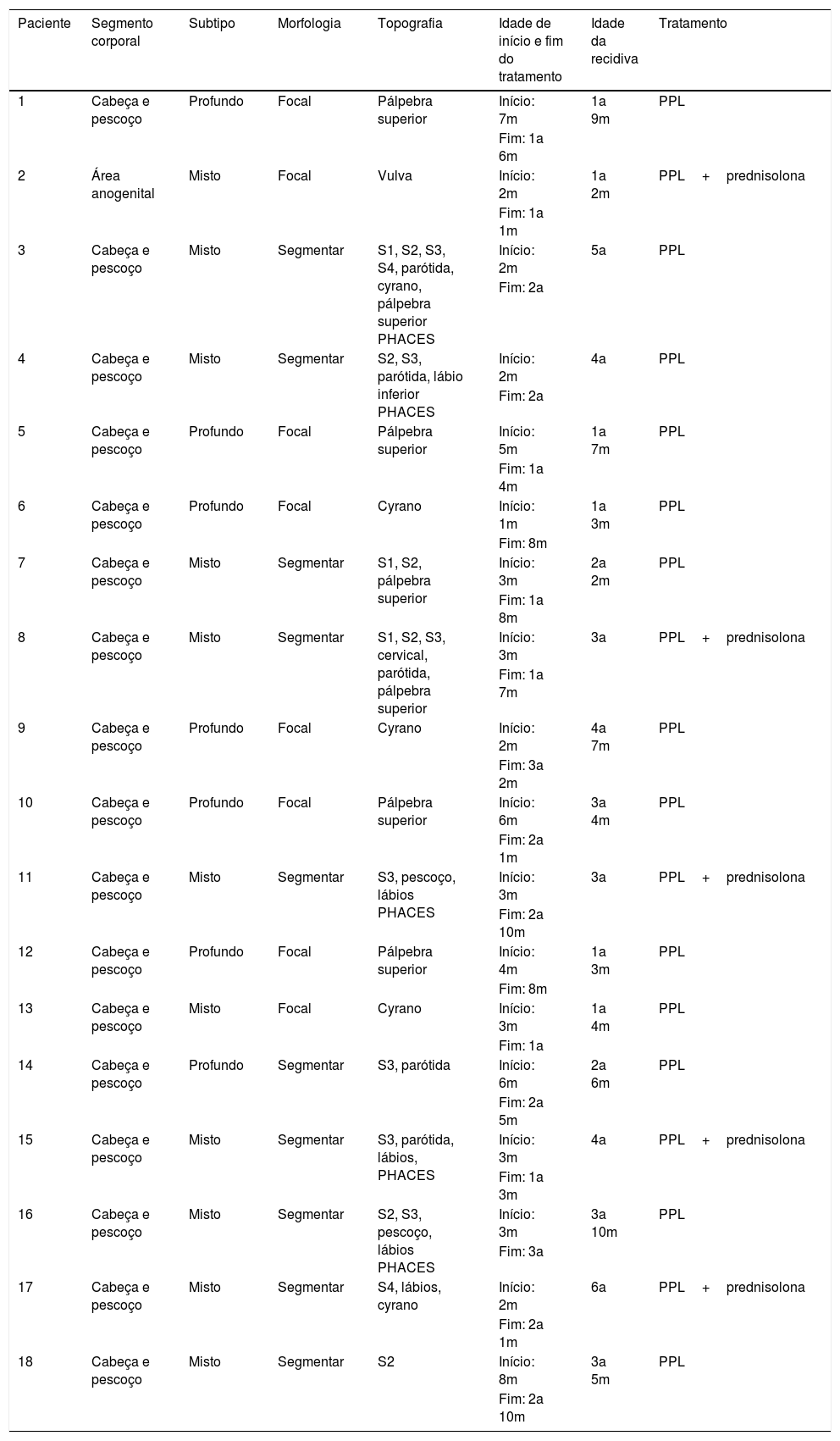
Recidivas ocorreram em 16,6% dos pacientes tratados (18/108); recidivas de pacientes utilizando apenas timolol não foram percebidas. Todos eles eram do sexo feminino (p=0,005); 11 eram HIs mistos (11/18, 61,1%; p=0,5), e sete eram HI profundo (7/18, 38,8%; p=0,37). Recidiva precoce ocorreu em oito pacientes (8/108, 7,4%), e tardia em 10 pacientes (10/108, 9,2%). Todos, exceto um, tinham HI localizado em cabeça/pescoço (17/18, 94,4%; p=0,012), e 10 eram HI segmentar (10/18, 55,5%; p=0,007). Os HIs que mais frequente recidivaram foram os que acometiam o segmento S3da face (7/18), pálpebra superior (7/18), cyrano (5/18) e os que envolviam a parótida (5/18). Em relação ao crescimento tardio, 8/10 pacientes apresentavam subtipo misto, 4/10 eram síndrome PHACES e 4/10 pacientes apresentavam múltiplos segmentos acometidos (tabela 3, figs. 4 e 5).
Hemangiomas infantis recidivantes: quadro clínico, idade da recidiva e tratamento
| Paciente | Segmento corporal | Subtipo | Morfologia | Topografia | Idade de início e fim do tratamento | Idade da recidiva | Tratamento |
|---|---|---|---|---|---|---|---|
| 1 | Cabeça e pescoço | Profundo | Focal | Pálpebra superior | Início: 7m | 1a 9m | PPL |
| Fim: 1a 6m | |||||||
| 2 | Área anogenital | Misto | Focal | Vulva | Início: 2m | 1a 2m | PPL+prednisolona |
| Fim: 1a 1m | |||||||
| 3 | Cabeça e pescoço | Misto | Segmentar | S1, S2, S3, S4, parótida, cyrano, pálpebra superior PHACES | Início: 2m | 5a | PPL |
| Fim: 2a | |||||||
| 4 | Cabeça e pescoço | Misto | Segmentar | S2, S3, parótida, lábio inferior PHACES | Início: 2m | 4a | PPL |
| Fim: 2a | |||||||
| 5 | Cabeça e pescoço | Profundo | Focal | Pálpebra superior | Início: 5m | 1a 7m | PPL |
| Fim: 1a 4m | |||||||
| 6 | Cabeça e pescoço | Profundo | Focal | Cyrano | Início: 1m | 1a 3m | PPL |
| Fim: 8m | |||||||
| 7 | Cabeça e pescoço | Misto | Segmentar | S1, S2, pálpebra superior | Início: 3m | 2a 2m | PPL |
| Fim: 1a 8m | |||||||
| 8 | Cabeça e pescoço | Misto | Segmentar | S1, S2, S3, cervical, parótida, pálpebra superior | Início: 3m | 3a | PPL+prednisolona |
| Fim: 1a 7m | |||||||
| 9 | Cabeça e pescoço | Profundo | Focal | Cyrano | Início: 2m | 4a 7m | PPL |
| Fim: 3a 2m | |||||||
| 10 | Cabeça e pescoço | Profundo | Focal | Pálpebra superior | Início: 6m | 3a 4m | PPL |
| Fim: 2a 1m | |||||||
| 11 | Cabeça e pescoço | Misto | Segmentar | S3, pescoço, lábios PHACES | Início: 3m | 3a | PPL+prednisolona |
| Fim: 2a 10m | |||||||
| 12 | Cabeça e pescoço | Profundo | Focal | Pálpebra superior | Início: 4m | 1a 3m | PPL |
| Fim: 8m | |||||||
| 13 | Cabeça e pescoço | Misto | Focal | Cyrano | Início: 3m | 1a 4m | PPL |
| Fim: 1a | |||||||
| 14 | Cabeça e pescoço | Profundo | Segmentar | S3, parótida | Início: 6m | 2a 6m | PPL |
| Fim: 2a 5m | |||||||
| 15 | Cabeça e pescoço | Misto | Segmentar | S3, parótida, lábios, PHACES | Início: 3m | 4a | PPL+prednisolona |
| Fim: 1a 3m | |||||||
| 16 | Cabeça e pescoço | Misto | Segmentar | S2, S3, pescoço, lábios PHACES | Início: 3m | 3a 10m | PPL |
| Fim: 3a | |||||||
| 17 | Cabeça e pescoço | Misto | Segmentar | S4, lábios, cyrano | Início: 2m | 6a | PPL+prednisolona |
| Fim: 2a 1m | |||||||
| 18 | Cabeça e pescoço | Misto | Segmentar | S2 | Início: 8m | 3a 5m | PPL |
| Fim: 2a 10m |
S1, segmento frontotemporal; S2, segmento maxilar; S3, segmento mandibular; S4, segmento frontonasal; PPL, propranolol.
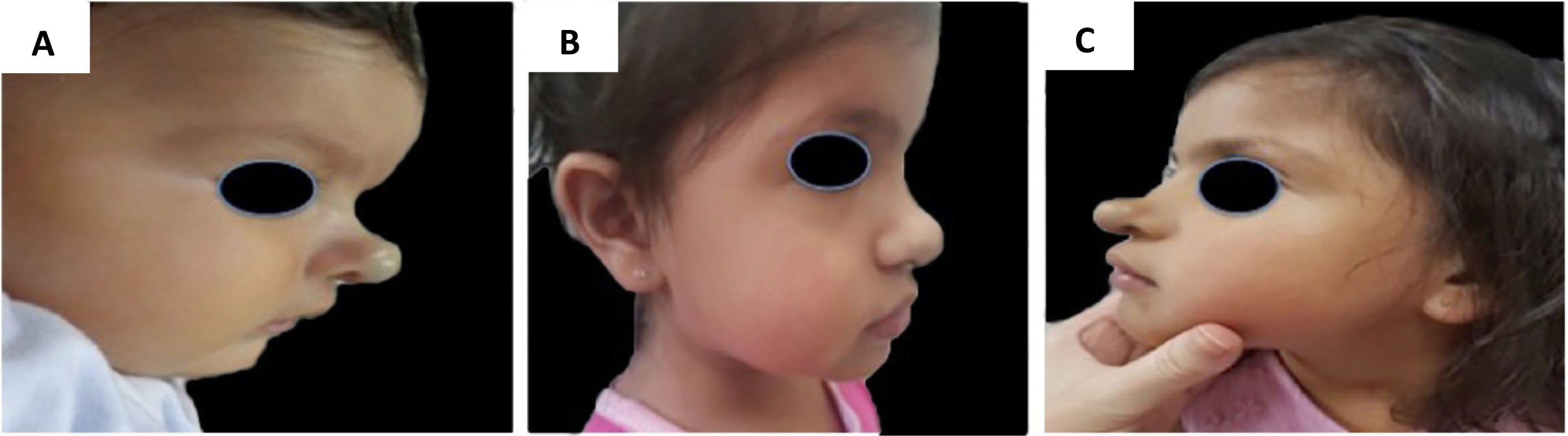
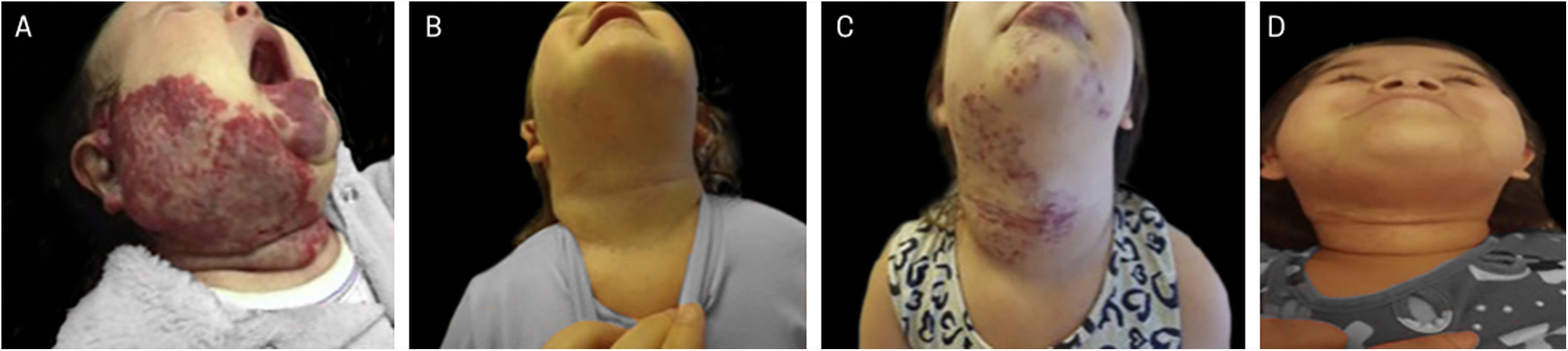
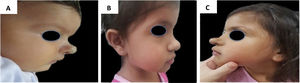
Exemplo de crescimento tardio de hemangioma da infância. (A), Perfil do paciente com hemangioma cyrano aos 2 meses de idade antes do tratamento. (B), Perfil do paciente no final do tratamento, aos 3 anos e 2 meses de idade com propranolol. (C), Perfil do paciente aos 4 anos e 7 meses, apresentando crescimento tardio.
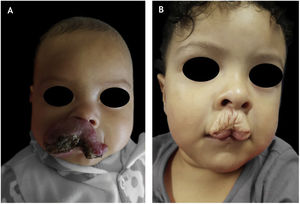
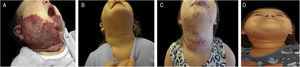
Exemplo de crescimento tardio de hemangioma da infância. (A), Paciente com síndrome PHACES aos 2 meses de idade antes do tratamento. (B), Paciente com 1 ano e 10 meses – no final do tratamento com propranolol. (C), Paciente em 4 anos e 6 meses, com crescimento tardio de hemangioma, quando o tratamento com propranolol foi reiniciado. (D), Paciente aos 6 anos de idade, mostrando regressão do hemangioma.
A classificação em relação à extensão, topografia e subtipos de HI pode predizer risco de complicação, sequelas e recidivas. Múltiplas lesões estão associadas com acometimento visceral (especialmente fígado e trato gastrintestinal).3,9,13–15 HIs segmentar e facial apresentam alto risco de sequela inestética, complicação e recidiva.9,11,13 No entanto, ainda não há diretrizes específicas para tratamento de HI localizados nessa topografia e que apresentam maior risco de recorrência. Parece óbvio pensar que para os HIs de alto risco para complicação, o tratamento com propranolol deva ser prolongado.
Sabe‐se que alguns HIs podem ter a fase de crescimento prolongada, associado com recidiva precoce, percebida após a redução da dose do propranolol ou no final do tratamento.16 Por outro lado, até o momento, não há uma explicação científica para a recidiva tardia após os 3 anos de idade. A prevalência da recidiva tardia é pouco conhecida.13,17 Dez a 30% dos hemangiomas recidivam após o uso de propranolol, e é estimado que 1% dos pacientes tem fase de crescimento tardia (acima dos 3 anos de idade). Fatores associados à recidiva são ainda incertos.13–17 Neste estudo, a frequência de crescimento tardio foi alta, o que nos leva a pensar que os casos de recidiva tardia podem estar subestimados. Novos estudos são necessários para avaliar a verdadeira prevalência da recidiva tardia. O achado mais importante deste estudo diz respeito aos fatores de risco para recidiva recente e tardia. Nossos resultados estão de acordo com os resultados do importante estudo de O’Brien et al., exceto por haver mais HI mistos com crescimento tardio em nosso estudo.13 Interessantemente, ao que parece, recidivas recentes e tardias compartilham dos mesmos fatores de risco, então esses pacientes devem ser monitorados durante toda a infância. Neste estudo, pacientes com HI segmentar e síndrome PHACES requereram tempo de tratamento prolongado. Esse achado era esperado porque esses pacientes são mais graves e recidivaram mais, o que acarretou em tempo de tratamento prolongado.
Em coorte prévia envolvendo 1096 crianças, Metry et al. encontraram do total de casos 20% de HI segmentar e 2,3% de síndrome PHACES.10 Encontramos uma frequência mais alta de síndrome PHACES e HI segmentar. Uma possível razão para esse achado é que nosso estudo foi conduzido num centro terciário, referência para casos graves.
Estima‐se que ocorra ulceração em cerca de 5 a 21% dos HIs; essa foi a complicação mais comum em estudo prospectivo, ocorrendo em 16% dos casos.18–21 Ulceração pode ocasionar dor intensa, sangramento e infecção secundária, em adição ao risco de cicatriz permanente.19
Recomenda‐se intervenção precoce e/ou referência a serviço especializado a partir da quarta semana de vida em casos de HI com alto risco de complicação (ulceração, sequela inestética ou perda funcional) com intuito de reduzir o risco de cicatriz inestética e sequelas permanentes.22 Em nosso estudo, somente metade dos pacientes iniciaram o tratamento antes dos 3 meses de idade, e isso pode ter contribuído para as sequelas inestéticas. A alta frequência de sequelas chama a atenção em nosso estudo. A dificuldade de acesso a serviço terciário e/ou a falta de informação por parte de pediatras e dermatologistas pode explicar esse atraso. Nosso estudo demonstrou que crianças que iniciaram o tratamento antes dos 4 meses de idade obtiveram melhor resposta ao tratamento, e crianças que iniciaram mais tarde necessitaram de tempo de tratamento prolongado.
As limitações deste estudo foram a falta de dados e fotos em alguns prontuários e perda de seguimento, por se tratar de um estudo retrospectivo. Por ter sido realizado em um único hospital, não representa estudo de base populacional.
ConclusãoEste é o primeiro estudo a traçar um amplo perfil epidemiológico de HI no Sul do Brasil. HIs misto, segmentar e localizados na região glútea são fatores de risco para ulceração. HIs misto, segmentar e localizados na cabeça e pescoço são fatores de risco para sequelas. Sexo feminino e HI segmentar são fatores de risco para recidivas. Além disso, HI localizado no segmento S3da face, pálpebra superior, lábios, envolvendo a parótidas e cyranos acrescentam maior risco para complicações. Este estudo consolida fatores de risco para recidivas e alerta que esses pacientes devem ser cuidadosamente monitorados, mesmo após a interrupção do tratamento. Protocolos de tratamento específicos são necessários para HI com alto risco de complicações e recidivas.
Suporte financeiroO estudo foi financiado em parte pela Coordenação de Aperfeiçoamento de Pessoal de Nível Superior – Brasil (CAPES) – Finance Code 001.
Contribuição dos autoresLetícia Gaertner Mariani: Concepção e design do estudo; aquisição de dados; esboço do manuscrito.
Lílian Moraes Ferreira: Concepção e design do estudo; aquisição de dados.
Diego Luiz Rovaris: Análise e interpretação dos dados.
Renan Rangel Bonamigo: Análise e interpretação dos dados.
Ana Elisa Kiszewski: Concepção e design do estudo; análise e interpretação dos dados; revisão crítica do manuscrito.
Conflito de interessesAna Elisa Kiszewski é consultora da Johnson & Johnson. Os demais autores declaram não ter conflitos de interesse.
Como citar este artigo: Mariani LG, Ferreira LM, Rovaris DL, Bonamigo RR, Kiszewski AE. Infantile hemangiomas: risk factors for complications, recurrence and unaesthetic sequelae. An Bras Dermatol. 2022;97:37–44.
Trabalho realizado no Ambulatório de Dermatopediatria da Universidade Federal de Ciências da Saúde de Porto Alegre, Porto Alegre, Brasil.