Criptococose é doença causada por fungos do gênero Cryptococcus, sendo reconhecidamente patogênicas as espécies Cryptococcusneoformans e Cryptococcusgattii. A criptococose cutânea pode ser classificada como “secundária”, evoluindo a partir doença sistêmica prévia ou, ao contrário, “primária”, consequente à inoculação transcutânea do agente. Ou, ainda, ser classificada como “criptococose cutânea disseminada”, quando da existência de doença sistêmica associada; ou “localizada”, quando restrita à pele. Utilizamos neste artigo a denominação de “criptococose cutânea primária”, pois é mais utilizada e já consagrada na literatura. Historicamente, o primeiro relato de possível caso de criptococose cutânea primária (CCP) ocorreu em 1950 por Gancy WM e foi publicado nos Archives of Dermatology. Os raros e esporádicos relatos nas décadas seguintes foram revistos e informados na publicação de Baes & van Cutsen de 1985. Porém, a aceitação inequívoca da existência da CCP como enfermidade distinta se deu apenas a partir de 2003, com a publicação de Neville S et al. do Grupo Francês de Estudo da Criptococose. O critério fundamental estabelecido para se considerar CCP foi a ausência comprovada de doença sistêmica, quer pulmonar, do SNC ou de outra localização no momento do diagnóstico do quadro cutâneo, caracterizado por lesão única e, majoritariamente, em área exposta. Esses e outros critérios clínicos, de comprovação diagnóstica e de escolha terapêutica, são discutidos em detalhes no texto completo.
Criptococose é doença humana e também animal, causada por fungos do gênero Cryptococcus, levedura encapsulada com várias espécies das quais as reconhecidamente patogênicas são as espécies Cryptococcus neoformans e C. gattii. Cryptococcus neoformans é fungo cosmopolita, universal, frequentemente isolado de dejetos de pombos, vegetais e frutos em decomposição e causa doença humana predominantemente em pacientes imunocomprometidos.1,2 Por outro lado, C. gattii tem distribuição mais regionalizada, prevalecendo em regiões tropicais e subtropicais, embora já isolado em regiões temperadas. Ressalte‐se que C. gattii infecta tanto pacientes imunocomprometidos como pacientes imunocompetentes.3,4Cryptococcus gattii é isolado a partir de amostras do solo, vegetais em decomposição, oco de árvores e apresenta especial associação ecológica com plantações de Eucalyptus camaldulensis.3,5 Em 2015, Hagen et al.6 publicaram artigo sobre evidências moleculares suficientes para subdividir C. neoformans em duas novas espécies e C. gattii em adicionais quatro novas espécies, a saber: C. neoformans e C. deneoformans; e as espécies C. gattii, C. deuterogattii, C. bacillosporus, C. tetragattii e C. decagattii e ainda possiblidade de espécies híbridas.6 Tal proposta, ainda que embasada em dados moleculares múltiplos, não encontrou respaldo entre experts entre eles Kwon‐Chung KJ et al.7 Esses autores, sob vários argumentos, entre eles a não associação de manifestações clínicas específicas a determinada subespécie em particular, propõem a utilização da denominação complexo C. neorformans (Cryptococcus neoformansspecies complex) e complexo C. gattii (Cryptococcus gattii species complex).7 Tal sugestão vem sendo seguida por diversos autores em relatos recentes.8–10
A criptococose cutânea pode ser classificada como “secundária” à disseminação a partir da existência de doença sistêmica prévia, ou “primária”, a partir de inoculação transcutânea do agente. Ou, ainda, classificada como “criptococose cutânea disseminada” – ou seja, produto de doença sistêmica e lesão cutânea consequência de disseminação hematogênica do fungo. Ou, ao contrário, “localizada”, quando restrita à pele.11 Utilizamos neste artigo a denominação de “criptococose cutânea primária”, seguindo o conceito de inoculação local transcutânea, pois é mais utilizada e já consagrada na literatura.12
Classicamente, na doença sistêmica, a história natural da criptococose decorre da infecção via inalatória e quadro pulmonar quase sempre assintomático ou oligossintomático. Evolutivamente, pode ocorrer imediata disseminação hematogênica ou permanência de foco quiescente pulmonar e posterior disseminação hematogênica em virtude do desequilíbrio na relação agente‐hospedeiro.11 É doença típica de imunocomprometidos e considerada, por si só, definidora de AIDS nos indivíduos HIV‐infectados, mas, também doença incidente em pacientes pós‐transplante de órgão sólidos ou em corticoterapia prolongada.13 Na criptococose do paciente imunocomprometido, o mais frequente é a afecção do sistema nervoso central (SNC), com manifestações inicialmente indolentes e evolução progressiva para meningoencefalite grave e potencialmente fatal. Manifestação clínica pulmonar isolada ou predominante não é comum, mas possível. Outros órgãos e sistemas podem ser acometidos entre eles a pele em até 15% dos casos de AIDS, portanto lesão cutânea secundária e sentinela de comprometimento sistêmico associado.11,13 A apresentação clínica dermatológica de lesão associada a foco sistêmico é distinta daquela consequente a lesão cutânea primária e, portanto, auxiliar quanto à diferenciação diagnóstica se criptococose cutânea “primária” ou “secundária”. Quando a lesão cutânea é secundária à doença sistêmica, a clínica mais frequente é de lesões múltiplas, principalmente no segmento cefálico, com possíveis lesões mucosas ainda que incomuns.11,14,15 Em contraposição, a lesão cutânea primária é única, polimórfica, mais vezes tipo placa infiltrada de variável extensão e, com tendência a necrose e não há comprometimento mucoso.11,12
Criptococose cutânea primáriaHistóricoEsporotricose e cromoblastomicose são micoses classicamente aceitas como exemplos de micoses subcutâneas de implantação e infecção primária transcutânea. Outras micoses, que classicamente são sistêmicas, e de infecção via inalatória como coccidioidomicose, blastomicose, histoplasmose e mesmo paracoccidioidomicose, excepcionalmente podem ser consequentes à inoculação transcutânea.16,17 Mas esses eventos, nessas circunstâncias, constituem‐se em casos raros, excepcionais e correspondem a clara exceção à regra. O primeiro relato de possível caso de criptococose cutânea primária (CCP) ocorreu em 1950 por Gancy WM e publicado nos Archives of Dermatology.18 Esse relato foi seguido por raras e esporádicas publicações nas décadas seguintes, sendo os casos relatados, associados ou não a pacientes imunocomprometidos.18–21 Essas publicações foram revistas e informadas em detalhes por Baes & van Cutsen em 1985.22 Contudo, a aceitação inequívoca da existência da CCP como subtipo clinico distinto da criptococose clássica e reconhecido como tal se deu a partir de 2003 com a publicação de Neville S et al.23 do Grupo Francês de Estudo da Criptococose. Nessa publicação os autores compararam dados de 28 pacientes com diagnóstico presuntivo de CCP, com aqueles de 80 casos de criptococose clássica disseminada com lesões cutâneas e ainda os dados de 1866 casos de criptococose disseminada e comprometimento de outros órgãos que não a pele.23 O critério básico para se considerar como diagnóstico presuntivo de CCP, evidentemente, foi a ausência comprovada de doença sistêmica, fosse pulmonar, do SNC ou outra localização ao momento do diagnóstico do quadro cutâneo. Entre as diversas diferenças observadas nos grupos acima estudados, distinguiram‐se o padrão semiológico e a localização das lesões. Os casos de CCP restringiram‐se a lesão única de localização majoritariamente em áreas expostas, poupando o segmento cefálico. Por outro lado, as lesões cutâneas secundárias à doença sistêmica foram quase sempre múltiplas, de padrão papulonodular, com frequência molusco contagioso‐símiles e de localização preferencialmente no segmento cefálico. Saliente‐se, do mesmo artigo, a ocorrência de casos de CCP em pacientes imunocompetentes, o que não ocorreu nos casos de doença sistêmica ali estudados. Portanto, a partir dessa demonstração explícita de se tratar de expressões clínicas distintas, consolidou‐se o conceito CCP.23 Os critérios que favorecem a suspeita e determinam o diagnóstico de certeza de uma ou outra forma da doença são didática e claramente demonstrados em tabelas presentes neste artigo de referência de Neville S et al.23
Critérios diagnósticos. História clínica e exame clínico‐dermatológicoA história clínica da doença atual na CCP é variável, de semanas a meses. Nem sempre há história de trauma precedendo a lesão, assim como nem sempre há história de exposição a dejetos de aves, morcegos ou vida rural. As lesões quase sempre se localizam em áreas expostas sujeitas a trauma, particularmente braço e antebraço. A queixa pode ser de dor e/ou calor local. Não há queixa de febre, sinais ou sintomas sistêmicos. Com frequência há antecedente de uso de medicação imunossupressora por diferentes razões: pós‐transplante de órgão sólido, corticoterapia por doença pulmonar obstrutiva crônica, doenças autoimunes, em particular doença reumatológica articular, uso de imunossupressores biológicos ou quimioterapia. Ao acometer idosos, mesmo na ausência de medicação ou causa evidente de imunocomprometimento, a imunossenescência, por si só pode ser o fator contribuinte a ser considerado.
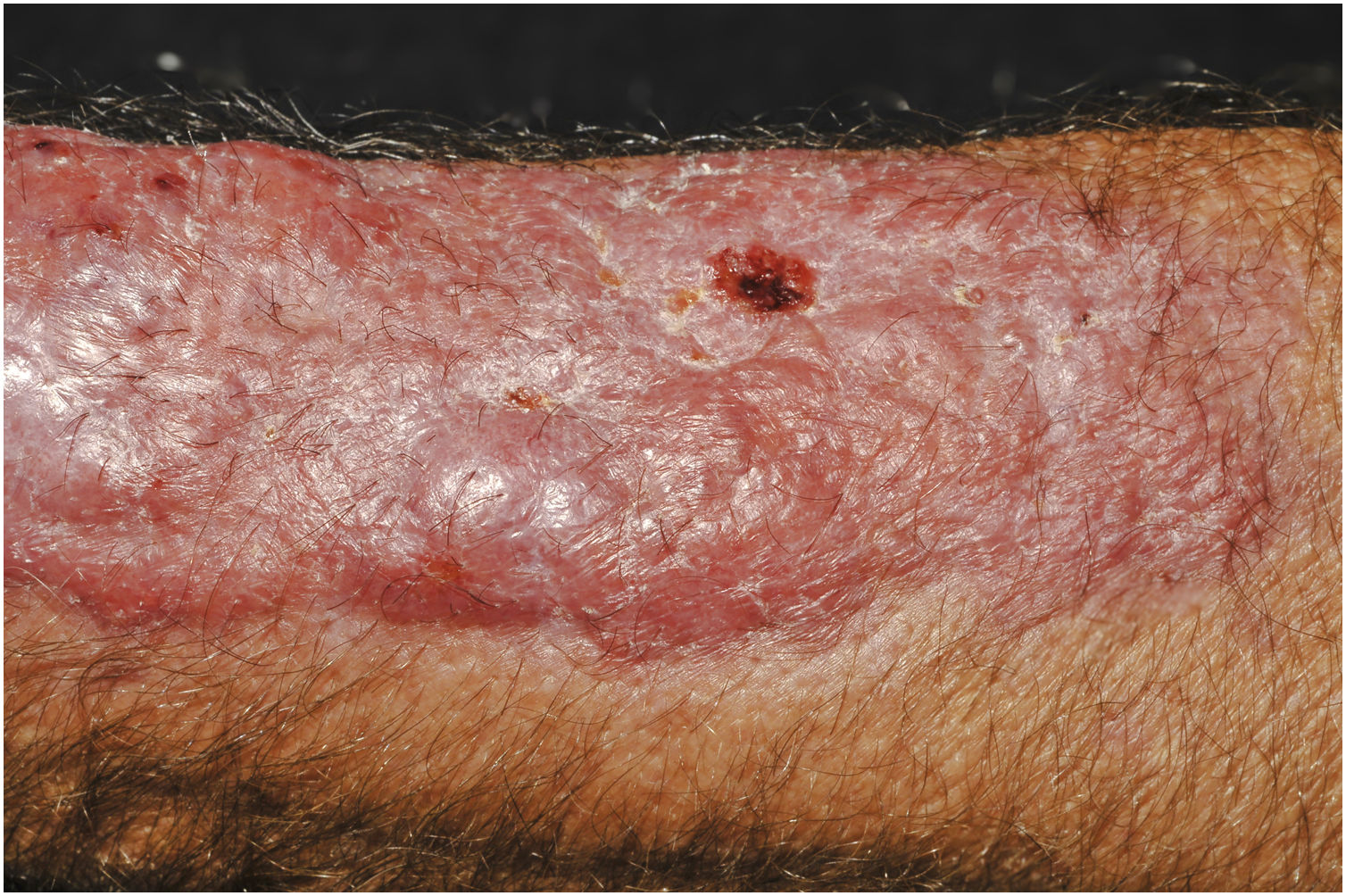
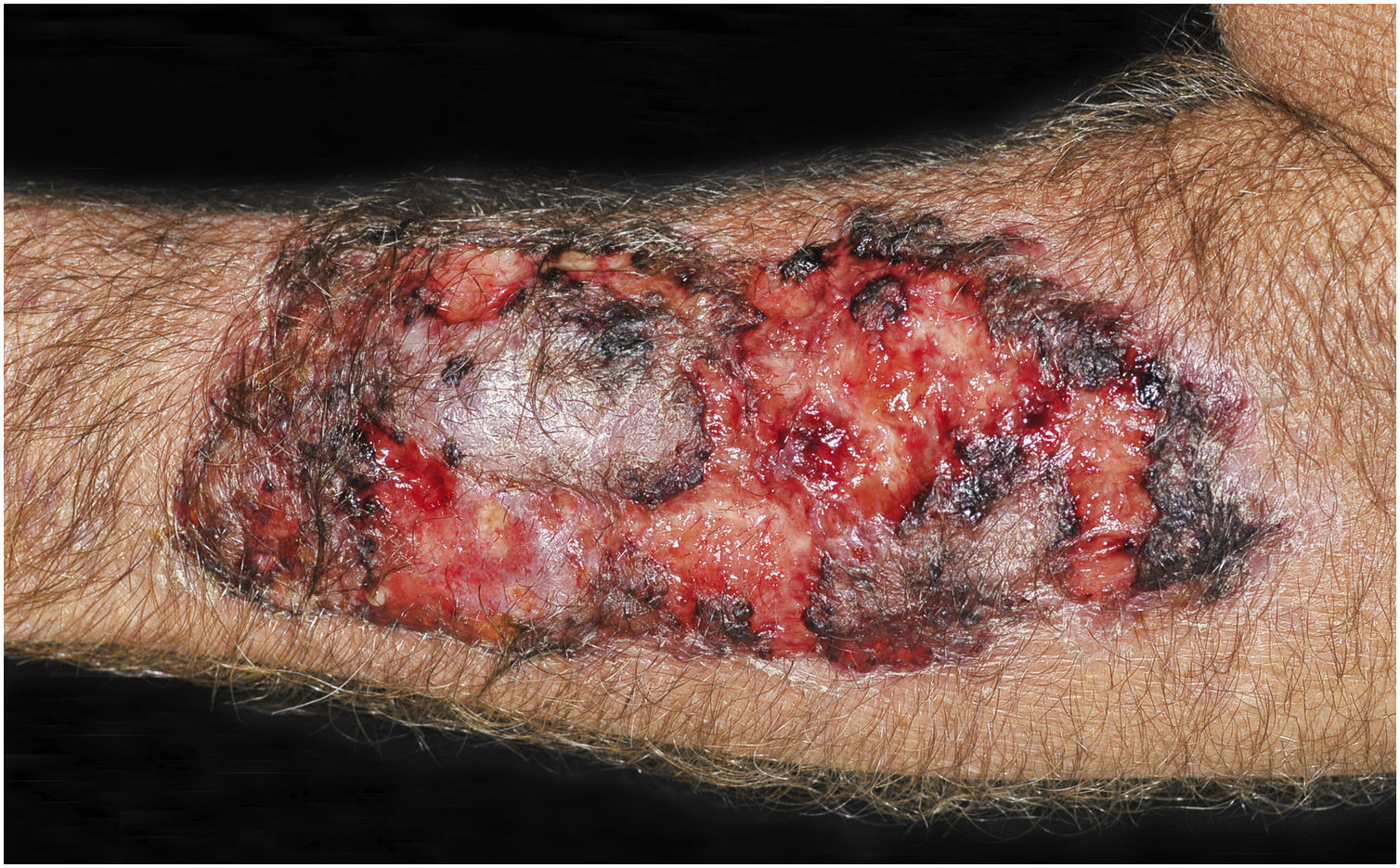
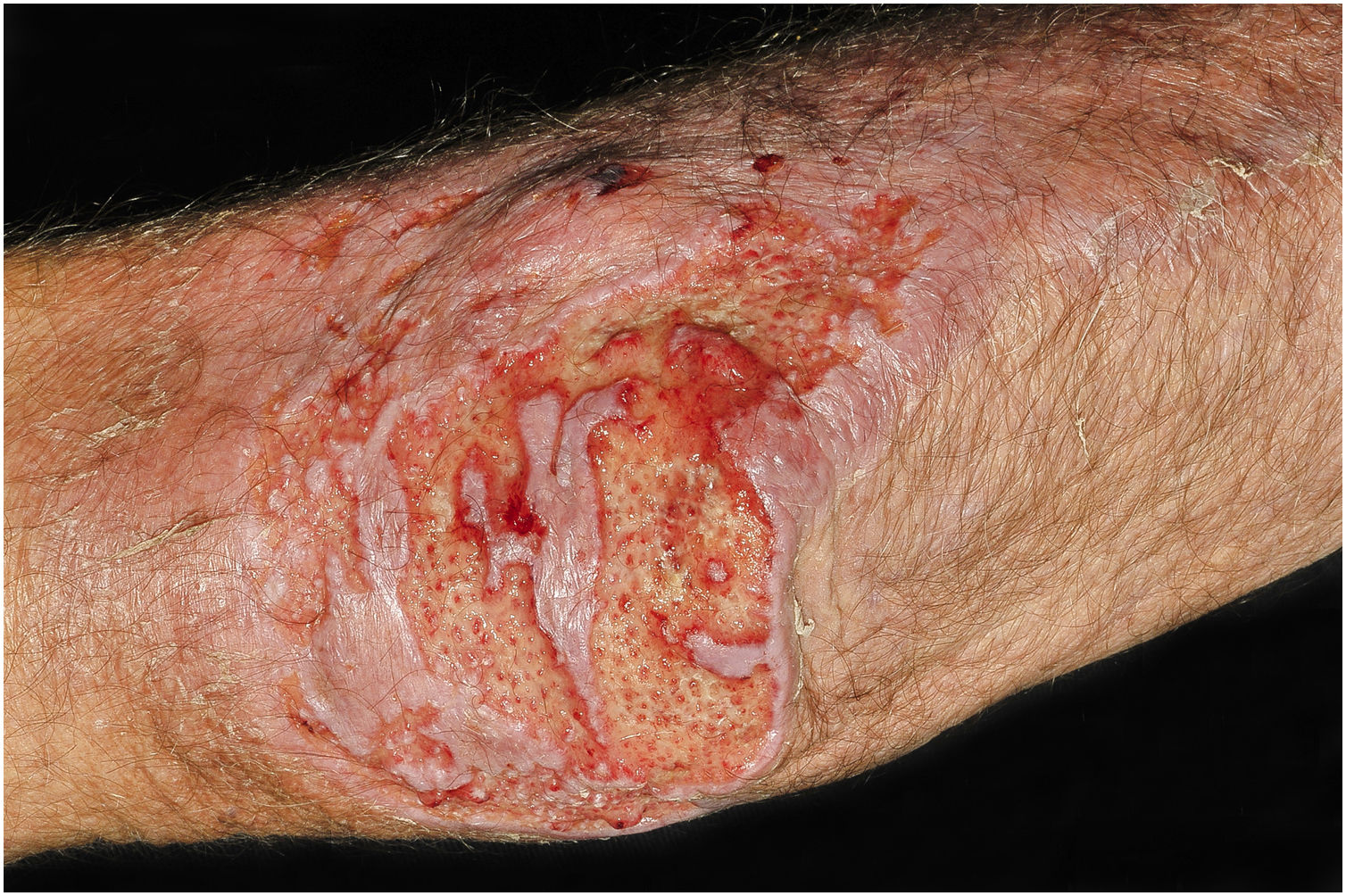
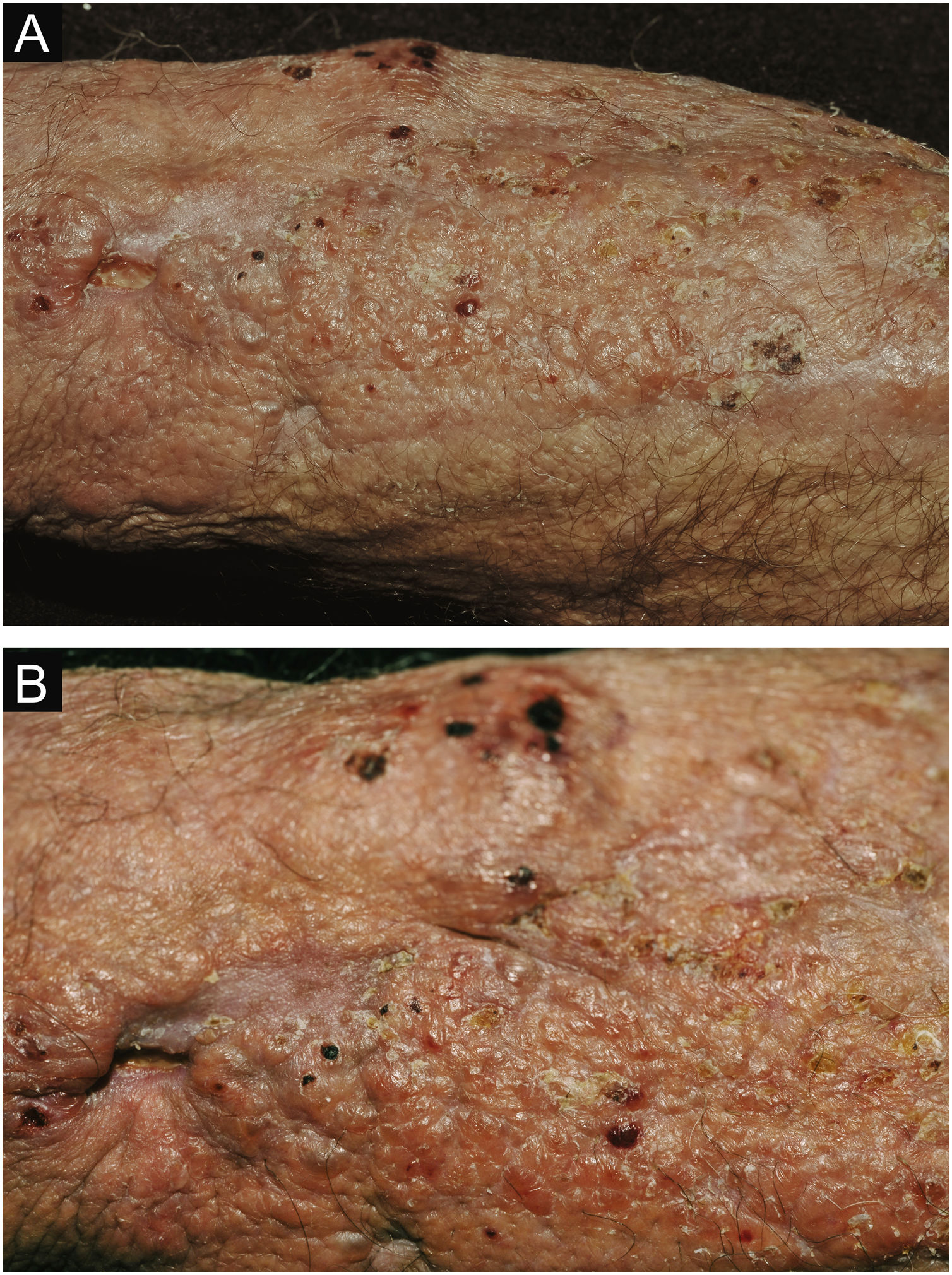
A suspeita clínica de se tratar de CCP parte de lesão cutânea única, de localização em área exposta, particularmente membros superiores, de evolução aguda ou subaguda, com clínica dermatológica compatível e sem sinais ou sintomas de doença sistêmica. Semiologicamente, a lesão é polimorfa, mais vezes de caráter infiltrativo, tumoral, ulcerada ou não, ocasionalmente leishmaniose‐símile, com pontos de necrose ou não, raramente tipo celulite. O diâmetro da lesão é variável, podendo acometer todo um segmento do membro afetado e os limites nem sempre são precisos. A coloração é eritematosa, eritemato‐violácea ou eritemato‐amarronzada. (figs. 1‐5).11,12,23–27 À palpação a consistência pode ser firme ou algo amolecida, gelatinosa, fruto da grande quantidade de elementos fúngicos, de suas cápsulas mucoides e da escassa resposta inflamatória.12 Não raramente, há coinfecção bacteriana e sinais flogísticos locais. Caso o diagnóstico seja tardio a lesão tende a evoluir para grande diâmetro e necrose da superfície cutânea (figs. 6 e 7). Os diagnósticos diferenciais são múltiplos e se recomenda utilizar o diagnóstico sindrômico PLECT (paracoccidioidomicose, leishmaniose, esporotricose, cromoblastomicose e tuberculose cutânea) como roteiro inicial. Acrescentar ao raciocínio clínico as hipóteses de pioderma gangrenoso, infecções bacterianas graves, ectima gangrenoso incluindo seus possíveis agentes causais e o herpes‐zóster com necrose, do paciente imunocomprometido. Dado o caráter agudo ou subagudo do processo as enfermidades neoplásicas não são diagnósticos diferenciais plausíveis.
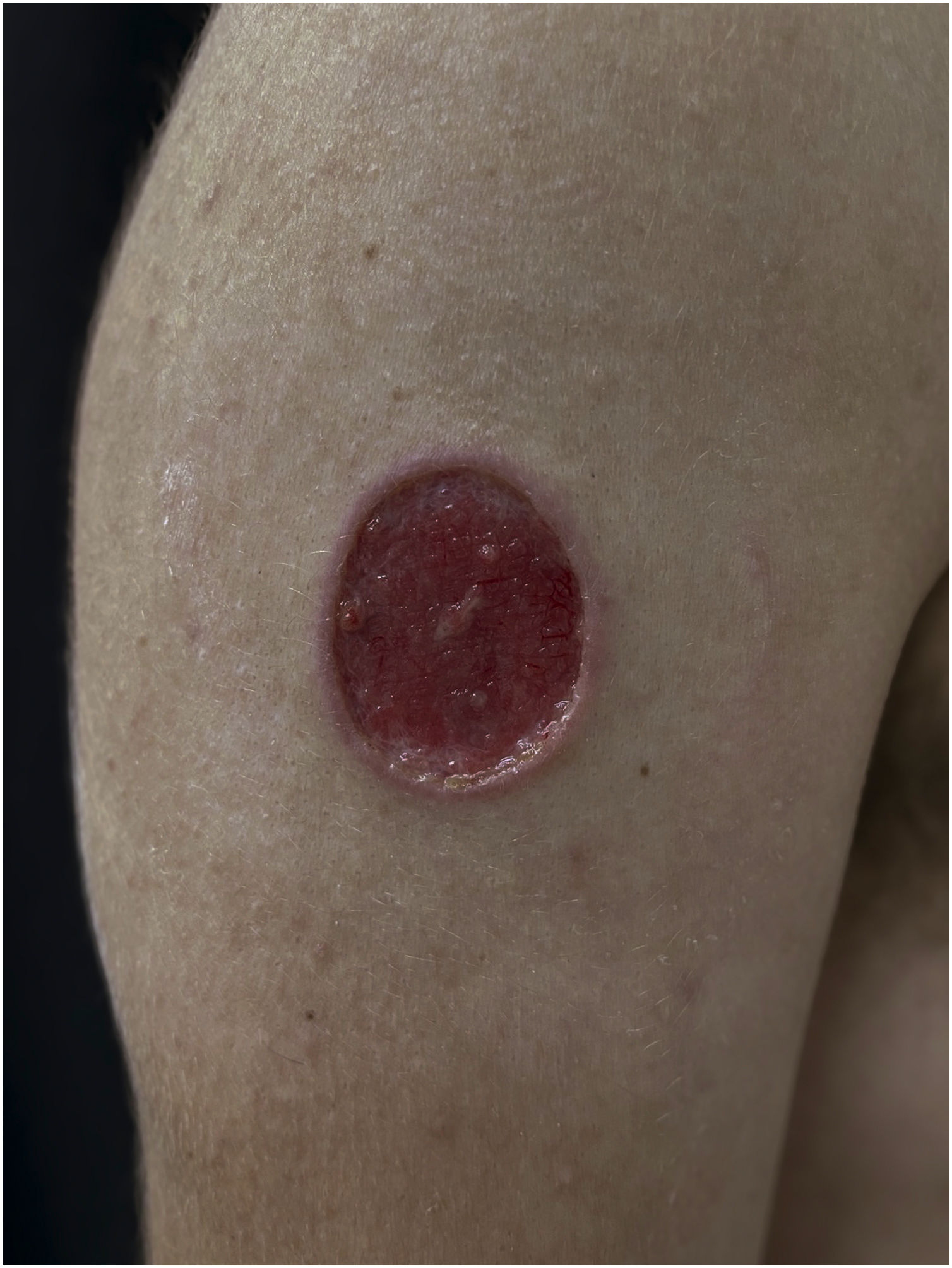
Criptococose cutânea primária: lesão ulcerada, fundo limpo, com pontilhados hemorrágicos, ilhas de tecido íntegro e bordas infiltradas. Foto pós desbridamento. Cotovelo. Paciente do sexo masculino, 74 anos. Corticoterapia 10mg/dia, irregular, DPOC. Lesão pós‐trauma quando de limpeza de sótão de igreja católica.
Criptococose cutânea primária. (A) Lesão em placa, extensa, com pontos necróticos, ulcerados, aspecto de pseudovesícula, presença de escamo‐crostas. Paciente do sexo masculino, 70 anos. Corticoterapia 5mg/dia, irregular, artrite. Residente na zona rural. (B) Detalhe: presença de lesão de aspecto tumoral e pontos necróticos e lesões satélites com aspecto de pseudovesículas.
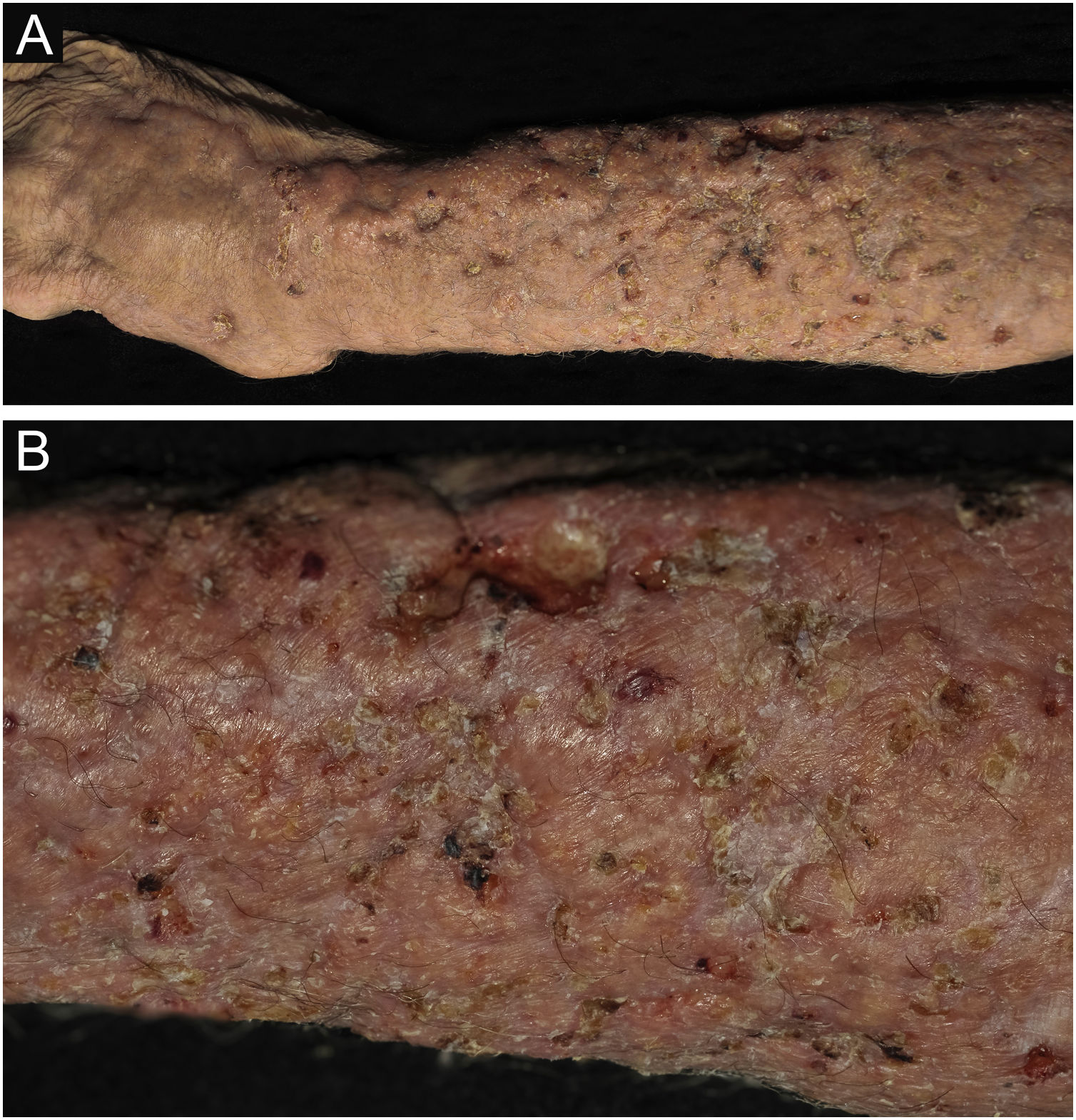
Criptococose cutânea primária. (A) Lesão infiltrada, extensa, nodulações, ulcerações, pontos necróticos, região distal do braço, antebraço e dorso da mão. Paciente do sexo masculino, 77 anos. Corticoterapia, 10mg/dia, DPOC. Residente na zona rural. (B) Detalhe: nodulações, retrações cicatriciais, pontos de ulceração e necrose.
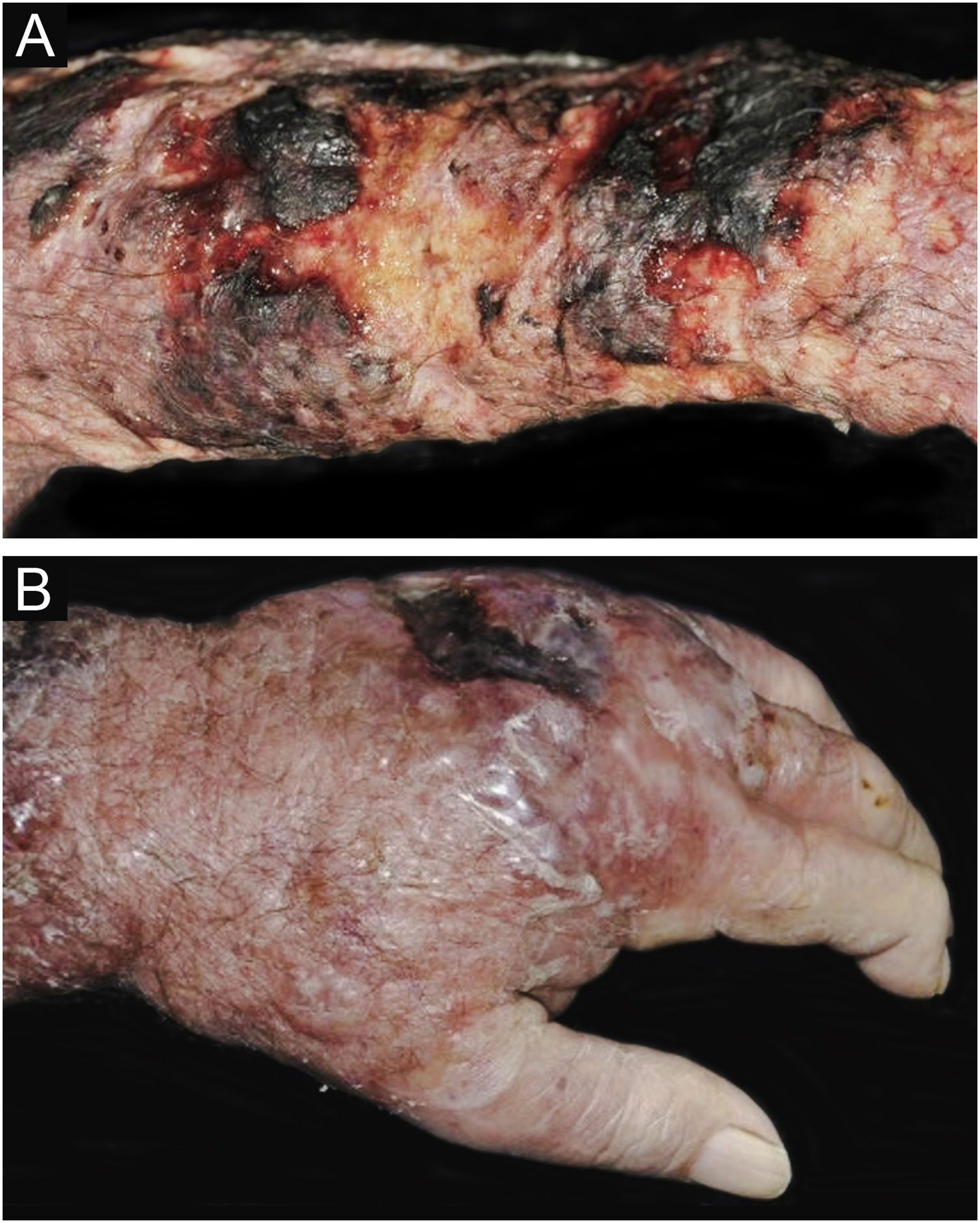
Criptococose cutânea primária. (A) Extensa lesão fagedênica e terebrante, com áreas necróticas e ulceradas, no braço, antebraço e dorso da mão. Paciente do sexo masculino, 80 anos. Corticoterapia 10mg. uso irregular por anos, por artrite. (B) Lesão eritemato‐edematosa, com vesículas e bolhas, área de necrose, dorso da mão (paciente referência #12).
Não raro, a suspeita inicial é de processo infeccioso bacteriano ou mesmo viral (herpes‐zóster) e apenas após o insucesso terapêutico com o uso de antibióticos ou de antivirais ou mesmo piora na vigência dos mesmos, é que o médico assistente submete a lesão ao exame histopatológico ou ao exame micológico direto. Definido o diagnóstico de criptococose cutânea, a confirmação se cutânea primária e da espécie infectante deve seguir os critérios e os passos academicamente bem estabelecidos, a seguir.
Confirmação diagnósticaA confirmação diagnóstica decorre da análise de diversos critérios:
- I
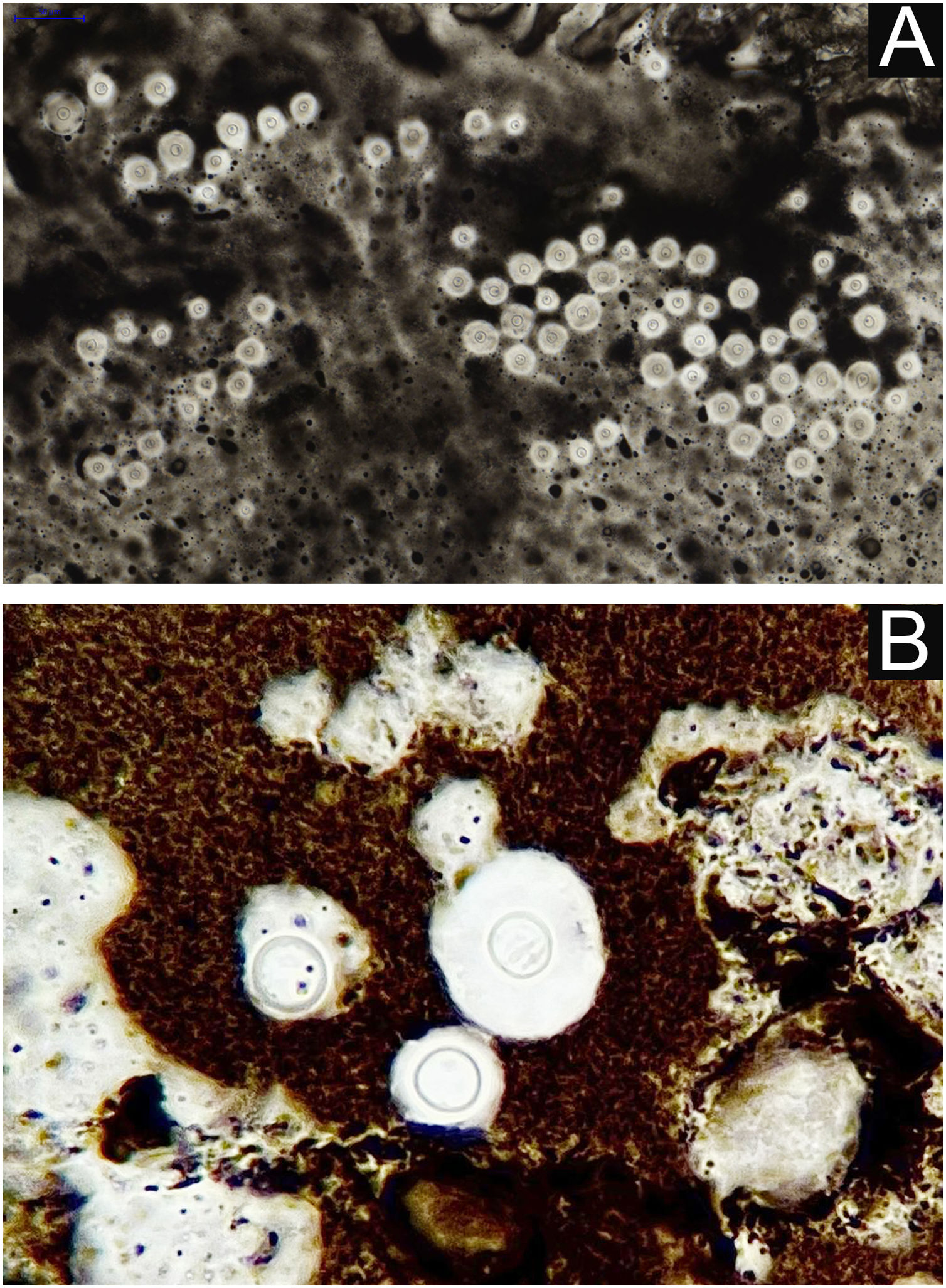
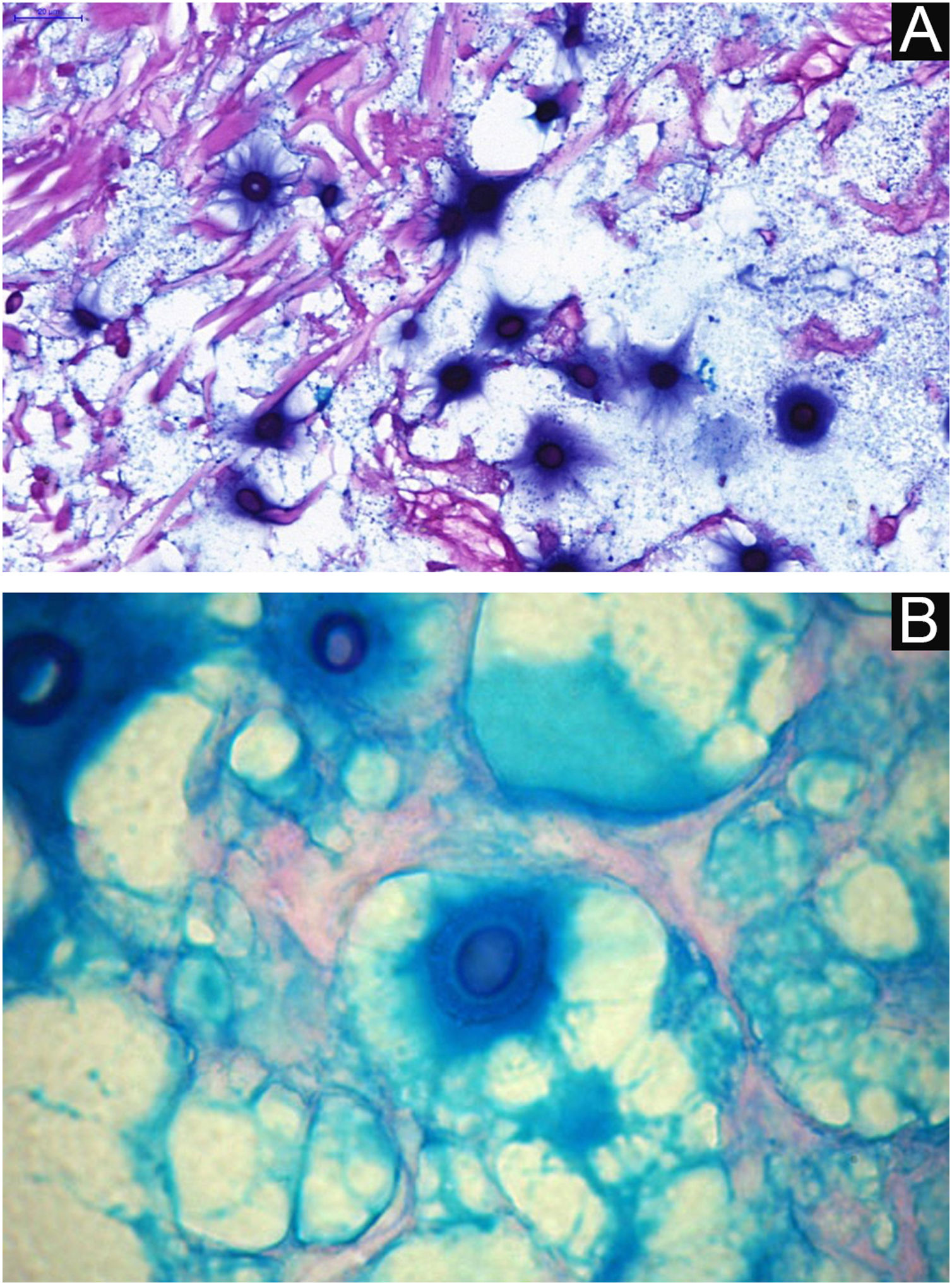
Da observação do agente no exame direto (exame micológico direto). Utiliza‐se de amostra obtida da lesão por biópsia, curetagem ou raspado com bisturi sem corte e gentil esfregaço em lâmina de hemograma, sobre a qual se adiciona gotas de tinta da China (ou tinta nanquin). Ou, mesmo na ausência da tinta da China, em esfregaço de amostragem da lesão tratada com gotas de soro fisiológico. A tinta da China ou o soro fisiológico não penetram na cápsula mucoide do Cryptococcus sp. e, em consequência, a cápsula se destaca, formando contraste em relação ao negro da tinta da china ou do róseo do meio hemorrágico (fig. 8).28
- II
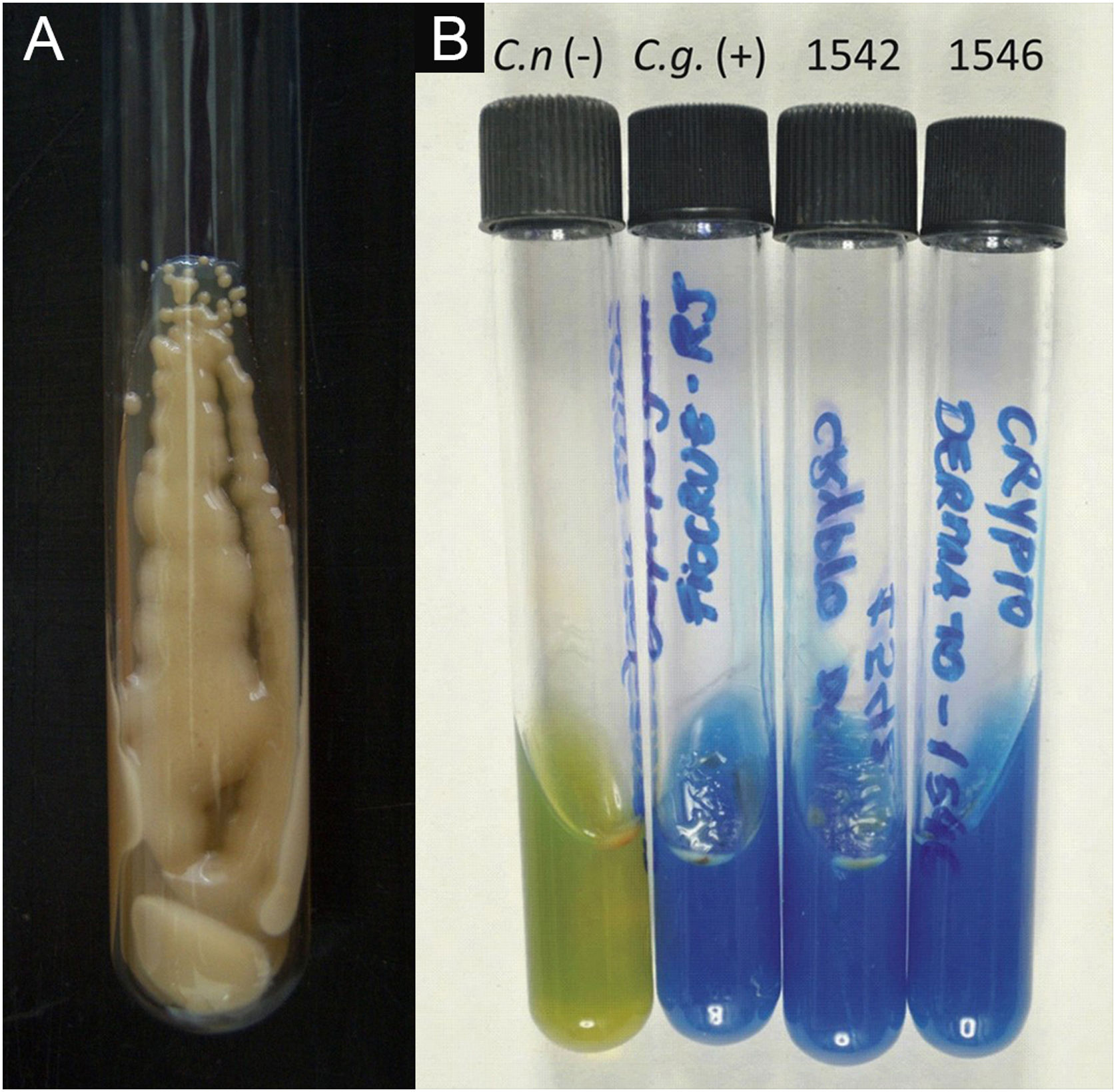
Do cultivo: com semeadura em ágar semente de Niger, ou ágar Sabouraud dextrose. O ágar Mycosel não deve ser utilizado, pois contém ciclo‐heximida (Actidione®) que inibe o crescimento de várias espécies do Cryptococcus.28,29 A amostra de fragmento de lesão para a semeadura pode ser obtida por micro biopsia ou curetagem do leito. Há que coletar a amostra com a máxima antissepsia, se possível evitando sangramento e encaminhar ao laboratório de micologia, o mais breve, em frasco estéril contendo salina. O tubo de ensaio ou a placa de Petri semeadas devem ser mantidas idealmente entre 30‐32°C, mas em condições de rotina podem ser mantidas em meio ambiente. O crescimento de Cryptococcus spp. é rápido, já visível macroscopicamente entre dois e cinco dias, com cultivo de aspecto leveduriforme, cremoso, cor branco‐creme, aspecto de leite condensado. Se semeado em meio semente de Niger, a coloração é de cor café‐amarronzada, pigmentada.28,29 Quando semeado no tubo de ensaio, imobilizado na posição vertical, o cultivo tende a “escorrer” para o fundo do tubo (fig. 9A).28
- III
A definição da espécie pode ser obtida a partir de amostra do cultivo original, primário, meio semente de Niger ou Sabouraud dextrose, e a seguir repicado em meio contendo concavalina, glicina e azul de bromotimol (ágar CGB). Nesse método, o ágar CGB original tem coloração amarelo‐verde. Quando o cultivo repicado é do complexo C. gattii, a cor do ágar muda para azul de cobalto em dois/três a cinco dias. Essa mudança de coloração se dá por degradação da creatina em amônia e mudança do pH do ágar CGB original (pH 5) para pH alcalino (pH 7). Espécies do complexo C. neoformans não produzem tais alterações e o ágar CGB permanece com a sua cor original amarelo‐verde (fig. 9B). É importante ter claro que o ágar CGB não é indicado para a obtenção do cultivo primário e apenas utilizado para se obter a distinção das espécies.30,31 Considera‐se o cultivo positivo como o padrão ouro para o diagnóstico e essencial para o uso acadêmico e de pesquisa.
- IV
Da confirmação por meio tecnologias de uso e popularização crescente como os auxanogramas automatizados, em que se utilizam amostras do cultivo primário. E ainda a utilização da técnica de identificação proteômica (MALDI Tof MS). São métodos disponíveis em laboratórios comerciais de referência e Hospitais Universitários mais bem equipados. Constituem‐se em métodos que fornecem resultados rápidos, confiáveis e identificam se espécies pertencentes aos complexos C. neoformans ou C. gattii.
- V
Do método molecular: por extração e amplificação do DNA fúngico por meio da reação em cadeia da polimerase (polymerase chain reaction ‐ PCR) e sequenciamento da internal transcribed spacer (ITS) do DNA ribossomal. A identificação da espécie, se Cryptococcus neoformanscomplex ou Cryptococcus gattiicomplex, resulta da utilização de primers específicos na amplificação e identificação de sorotipos. O método molecular, ainda que muito importante do ponto de vista acadêmico, está restrito à pesquisa e disponível em poucos laboratórios de referência.32
- VI
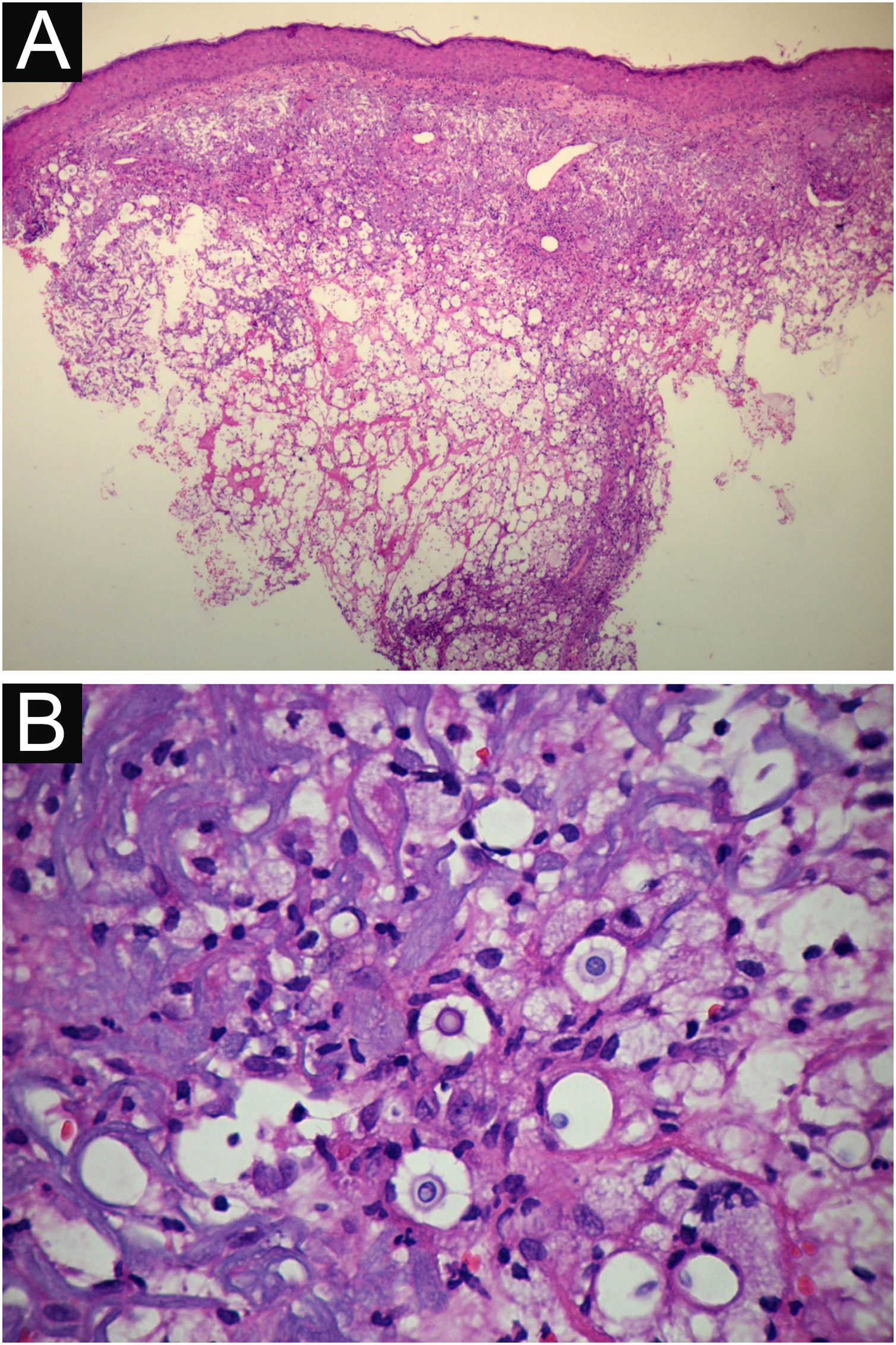
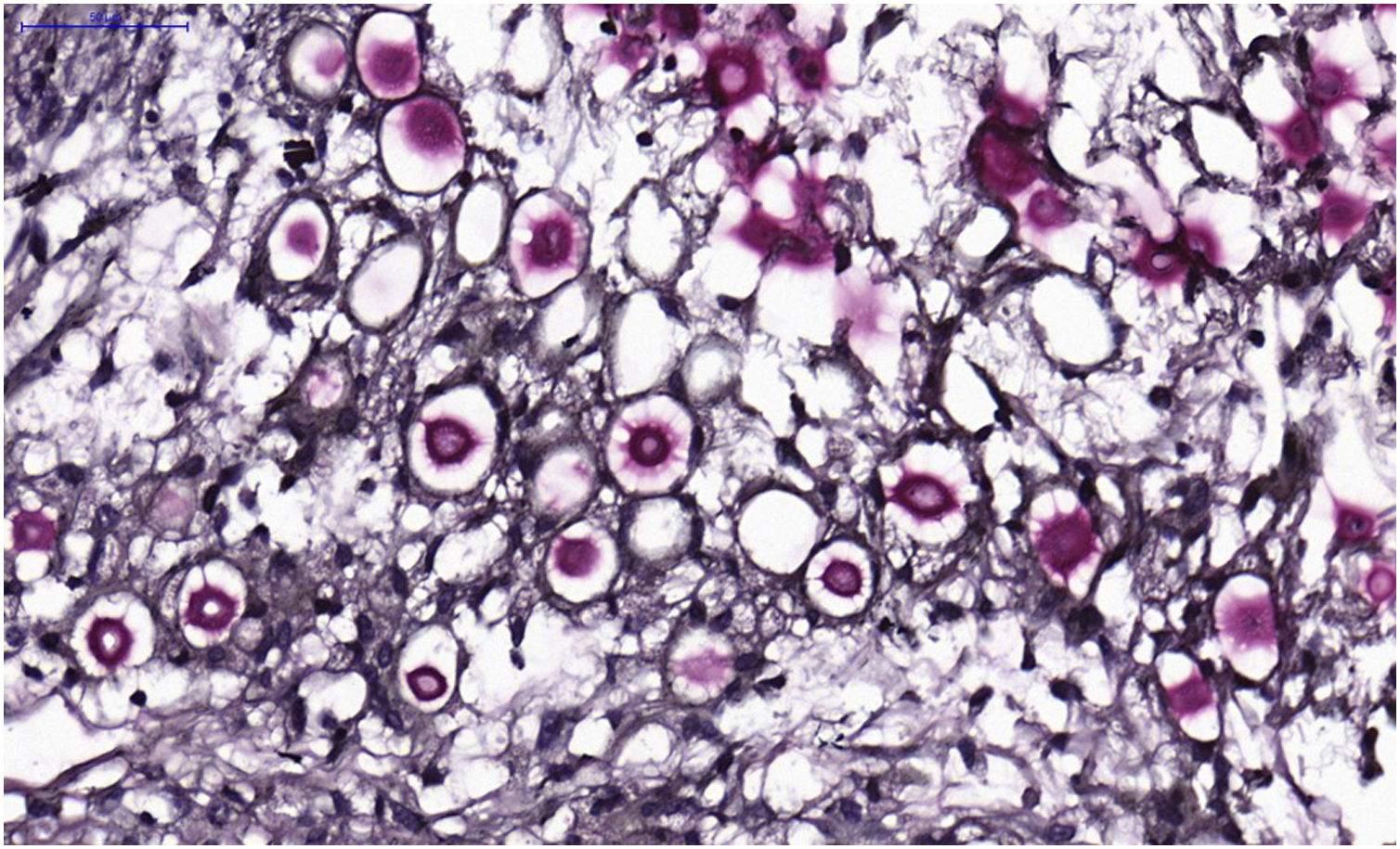
Do exame histopatológico: indica‐se biopsia com punch 5 ou minifuso com bisturi, evitando as áreas necróticas. A amostra deve ser enviada ao laboratório de patologia imersa em frasco contendo formalina tamponada a 10%. Os achados histopatológicos se caracterizam por moderada hiperplasia da epiderme, com possíveis focos de ulceração ou necrose, de escasso infiltrado inflamatório crônico dérmico. Observam‐se histiócitos e raras ou poucas células gigantes. Há presença no infiltrado de variável quantidade de linfócitos, eosinófilos e neutrófilos. Na coloração pela Hematoxilina & eosina observam‐se espaços claros na derme que correspondem a áreas ocupadas por inúmeros elementos fúngicos e formação de “massas mucoides” permeadas irregularmente pelo infiltrado inflamatório. Os fungos são visíveis desde a coloração de Hematoxilina & eosina, realçados e mais caracteristicamente reconhecidos nas colorações de mucicarmin e alcian‐blue, pois essas são capazes de corar a cápsula mucoide do fungo. Espécies do Cryptococcus também são coradas pelo periodic acid‐Schiff (PAS) e prata‐metenamina (método de Grocott‐Gomori). A coloração pelo método de Grocott‐Gomori, em particular, permite observar e estimar a grande quantidade de elementos fúngicos, caracterizados por células únicas, coradas em negro, de 5 a 15μm em diâmetro, contrastando com fundo esverdeado ou amarelado. As células fúngicas se apresentam usualmente com ausência de brotamentos ou apenas um, sendo possíveis dois brotamentos e, raramente, presença de hifas.33 As colorações de PAS e Grocott‐Gomori, ainda que reveladores da presença dos elementos fúngicos, são marcações que não permitem certeza histológica absoluta do diagnóstico de criptococose (figs. 10‐12).34,35 Há que se considerar variantes não encapsuladas ou com cápsulas exíguas, mais difíceis de serem reconhecidas, sugeridas estarem associadas a maior patogenicidade e maior intensidade da resposta inflamatória.36,37
Figura 10.Criptococose cutânea primária. (A) Exame histopatológico mostrando epiderme levemente acantótica, infiltrado inflamatório dérmico, circundando ampla área clara, na qual se observam pontos basofílicos que correspondem ao núcleo de células fúngicas. (Hematoxilina & eosina, 10×). (B) Detalhe demonstrando infiltrado histiocítico e linfocítico, degeneração basofílica do colágeno e células fúngicas com núcleo central basofílico e cápsula mucoide (Hematoxilina & eosina, 100×).
(0.72MB). - VII
Pelo método sorológico: pela aglutinação do látex para detecção de antígeno capsular polissacarídeo do Cryptococcus sp. a ser realizado em amostras de sangue, líquor, lavado broncoalveolar ou urina. Esse método, em tais amostras, apresenta sensibilidade de 95% e a especificidade de 98%, em que títulos > 1/4 sugerem infecção e> 1/8 sugerem doença ativa. Quando da suspeita de CCP, o que se objetiva é determinar que, ao menos em amostras de soro e líquor, o teste pela aglutinação do látex seja negativo, o que indicaria a ausência de comprometimento sistêmico com 98% de certeza.38 Ou ainda por meio do ensaio imunocromatográfico de fluxo lateral (CRAG – LFA) igualmente para a detecção do antígeno capsular.39
- VIII
Dos exames complementares: é mandatória a investigação de comprometimento sistêmico, mesmo na ausência de sinais, sintomas sistêmicos ou presença de sorologia negativa. Idealmente, a investigação complementar implica em avaliação clínica neurológica especializada e liquórica, se indicada. Por exames complementares como os de tomografia computadorizada do crânio, tórax e abdome. A investigação complementar laboratorial visa excluir infecção pelo HIV, HTLV‐1 e na realização dos demais exames hematológicos e bioquímicos, inclusive aqueles com finalidade de acompanhamento terapêutico
Em virtude de ser a CCP quadro incomum, não há ensaios terapêuticos que reúnam evidências a consolidar indicação de primeira ou segunda linha. Há necessidade de se identificar possíveis fatores agravantes no caso clínico em acompanhamento que direcionem a escolha do fármaco e a via de administração, utilizando‐se como parâmetros:
- I
Relacionados ao paciente de forma holística: idade, profissão, condição socioeconômica, estado nutricional, e acesso a medicações. Questionar a presença de comorbidades e quais, vigência de terapêutica imunossupressora e aquelas de uso diário, assim como questionar consumo abusivo de álcool ou de tabaco.
- II
Relativas à lesão em si: tempo de doença, extensão da lesão, presença ou não de necrose, tratamentos prévios, necessidade ou não de desbridamento ou drenagem.
- III
Informes obtidos por exames de imagem e aqueles obtidos por investigação laboratorial sorológica, hematológica e bioquímica. Com base no conjunto dos dados acima, a definição se quadro leve/moderado ou grave, segundo a percepção do médico assistente, é que vai nortear a escolha da terapêutica e a necessidade ou não de procedimentos ou mesmo de internação hospitalar. Quadros leves e moderados respondem satisfatoriamente ao uso de derivados azólicos, sendo eficaz o fluconazol na dose de 300 a 400mg/dia, por três a seis meses. Assim como o itraconazol na dose de 200 a 400mg/dia igualmente por três a seis meses.40 Os derivados azólicos atuam por inibição da enzima 14‐α demetilase CYP‐450 dependente e em consequência inibem a conversão de lanosterol em ergosterol reduzindo a formação da membrana celular externa do fungo e sua replicação.41 A resposta clinica costuma ser evidente ao final de 30 dias de tratamento e a cicatrização completa deve ocorrer em até seis meses.11,12,40 Caso a resposta seja lenta, há que se checar níveis plasmáticos dos derivados azólicos em uso e possíveis interferências na absorção. Ter em mente que os derivados azólicos são fármacos fungistáticos e que os valores de inibição de crescimento fúngico obtidos em experimentação in vitro, não necessariamente são transferíveis ao observado no paciente humano. Da mesma maneira, atentar para as possíveis interações medicamentosas; a listagem dos fármacos que interagem com os derivados azólicos não é pequena.41 O itraconazol é potente inibidor da via metabólica hepática do CYP3A4 e o fluconazol é potente inibidor da via CYP2C9 e moderadamente inibidor da via CYP3A4.41,42 A considerar, portanto, a previsível interação medicamentosa em paciente transplantados de órgãos sólidos em uso de tacrolimus, sirolimus ou ciclosporina, pacientes em uso da warfarina e igualmente levar em consideração a polifarmácia a que pacientes idosos frequentemente fazem uso.41–45 O itraconazol, em particular, tem níveis plasmáticos reduzidos se associado ao uso da rifampicina, e tal interação pode ser causa de falha terapêutica.40,41 O itraconazole, especificamente, tem absorção aumentada sob pH ácido, portanto melhor prescrito após grandes refeições e acompanhado pela ingestão de suco de frutas cítricas.43
Quadros graves e, excepcionalmente, quadros moderados, exigem tratamento com medicação intravenosa com fluconazol ou anfotericina B desoxicolato ou anfotericina B formulação lipídica. A anfotericina B é antibiótico com propriedades antifúngicas, derivado do Streptomyces nodosus, que atua sobre o ergosterol da membrana citoplasmática da célula fúngica com propriedade fungistática ou fungicida dose‐dependente.41,46 Não promove inibição sobre o citocromo P‐450, portanto a interação farmacológica é incomum. A excreção renal da anfotericina B como fármaco ativo se situa entre 2% a 5% e é fármaco dialisável, ainda que haja controvérsias.46,47 Se anfotericina B desoxicolato (anf. B clássica) a dose diária utilizada é de 0,5 a 1,0mg/kg/dia ou em dias alternados, restringindo‐se a dose diária ao máximo de 50mg/infusão, independente do peso do paciente. Para minorar o efeito pirogênico, associado à liberação de citocinas pró‐inflamatórias pela anf. B clássica, as doses iniciais devem ser menores – por exemplo: por dois dias 20mg/dia, seguida por dois dias 30mg/dia e dois dias 40mg/dia até estabilizar na dose diária prevista por quilograma de peso.48 A anf. B clássica tem efeitos adversos importantes, particularmente renais, consequente a vasoconstrição das arteríolas aferentes e isquemia renal, indução de acidose renal, de hipopotassemia e hipomagnesemia.49,50 A nefrotoxicidade é agravada por uso concomitante de fármacos de potencial nefrotóxico, em particular uso de anti‐inflamatórios não hormonais.49,50 Portanto, há que se monitorar periodicamente a função renal e de eletrólitos, na frequência que o quadro laboratorial determinar. É mandatório que, antes do início de tratamento com a anf. B clássica, pré‐definir os seguintes parâmetros: hemograma, função renal, eletrólitos, enzimas hepáticas, lipase, amilase e do ECG, além de outros parâmetros laboratoriais de interesse. Pacientes com alterações de condução cardíaca são de risco, exigindo acompanhamento com monitorização cardiológica e de eletrólitos praticamente diários. Para redução dos efeitos adversos previsíveis, a prescrição sugerida é: dose diária de anf. B clássica, com acesso venoso periférico, diluída em 500mL de soro glicosado (em dextrose 5%, pois o soro fisiológico precipita o sal da anfotericina).48 Acrescentar, diluídos a cada infusão: 50mg de hidrocortisona, utilizada para eliminar ou reduzir os efeitos pirogênicos, e 1000 unidades de heparina, esta com a finalidade de eliminar ou minorar os riscos de tromboflebite induzida pela anf. B clássica.48,51 Após correr em 6 horas esse soro assim composto, prescreve‐se fase rápida de 250‐500mL de soro fisiológico para reduzir, em parte, os efeitos da agressão renal.48,49 A reposição de potássio e magnésio (K+ e Mg+) deve ser diária, por via oral ou intravenosa, de acordo com a necessidade. Como alternativa terapêutica, apesar do alto custo, recomenda‐se a anfotericina B complexo lipídico (ABCL) que se caracteriza por boa distribuição tecidual, ou a anfotericina B lipossomal (L – AmB), esta com melhor difusão no SNC.52 Constituem‐se em formulações eficazes e indicadas pela redução dos efeitos adversos, particularmente menor nefrotoxicidade. As formulações lipídicas são utilizadas via infusão intravenosa, previamente reconstituídas em água destilada estéril e posteriormente diluídas em solução de dextrose a 5%, diária e nas doses de 3 a 5mg/kg/dia.49,50,52–54 Estratégia promissora para os diferentes tipos de anfotericina B é reduzir o tempo de uso terapêutico da anfotericina para 15 dias (como se fora tratamento de ataque) e a seguir transicionar para um derivado azólico, diário e em altas doses.52,55 Essa estratégia permite uso de doses mais altas da anfotericina B (clássica ou complexo lipídico), por menor período de tempo, sendo os efeitos adversos de menor repercussão e reduzindo o tempo de internação hospitalar. Essa sugestão terapêutica já tem sido colocada em prática no tratamento da paracoccidioidomicose e da histoplasmose.52,55 A associação de anfotericina B desoxicolato e fluconazol com o objetivo de maximizar o tratamento é possível e tem seu respaldo na literatura.56 Intervenções adjuvantes associadas, tais como desbridamento da lesão com retirada de tecido necrótico através curetagem do leito, ou esvaziamento de possível conteúdo purulento, tem sido sugerida, mas em princípio é conduta de exceção e restrita.57 Da mesma maneira, a associação de cobertura antibiótica é dependente das observações caso a caso. Se o paciente for portador de infecção pelo HIV e/ou AIDS, há que se considerar a necessidade de manutenção ou não com derivados azólicos após cicatrização e cura aparente. Em relação à histoplasmose, em paciente com AIDS, a manutenção com azóis após cura aparente pode ser descontinuada caso o paciente apresente contagem de CD4 ≥ 200 céls/mm3.58 Porém, em relação à criptococose cutânea primária, não há evidências nesse sentido na literatura.
PrognósticoEm princípio, a evolução sob tratamento correto é satisfatória e resolutiva, ainda que lenta em alguns casos. O tempo de resposta ao tratamento será individual e de acordo com os parâmetros de gravidade do caso como um todo e da medicação utilizada. Os casos tratados com anfotericina B desoxicolato ou formulação lipídica devem apresentar melhora mais rápida. O mesmo com o uso de derivados azólicos em altas doses. Há que se considerar que a depender do fármaco e das doses utilizadas, os efeitos adversos e/ou as interações medicamentosas podem se manifestar mais precocemente ou mais tardiamente.
Na literatura, há questionamentos sobre a possibilidade ou não de risco de disseminação hematogênica de Cryptococcus spp. a partir da lesão cutânea da CCP ou posteriormente ao tratamento.59 Trata‐se de pergunta válida, pois há que se levar em conta riscos associados à corticoterapia sistêmica, caso presente, que é, certamente, a iatrogenia farmacológica de maior risco a infecções oportunistas e a ela há que ter especial atenção.60 Há inúmeros relatos que transmitem segurança quanto à ausência de riscos de disseminação da doença cutânea, mesmo quando há pacientes imunocomprometidos, desde que adequadamente tratados.11,12,23,24,27,61–63Contudo, há publicação recente na literatura que relata caso de paciente de 64 anos que apresentou criptococose disseminada e fatal dois anos após tratamento de CPP diagnosticada como lesão única na região parietal pós‐trauma. Na época da lesão cutânea não se identificaram outras comorbidades e o paciente foi considerado presumivelmente imunocompetente. E, na discussão do caso, os autores relataram textualmente: “This is the first case reported of a fatal cryptococcal meningoencephalitis case developing two years after a cured primary cutaneous cryptococcal infection”.64 Porém, no relato deste caso se notam duas informações que fogem ao que se espera em casos de CCP: a primeira é que a lesão cutânea se mostrou resistente ao tratamento com até 600mg/dia com fluconazol, com MIC de 32μm/mL, o que é inusual na prática dos autores e nos relatos da literatura. Sendo que o paciente apenas respondeu à anfotericina B lipossomal 3mg/kg/dia por 1 mês. Segundo, que a investigação de doença sistêmica, quando do evento cutâneo, se resumiu à TC de tórax e abdômen, sem menção a investigação neurológica, tomográfica, liquórica ou sorológica. Esses dados põem em xeque a afirmação de que inexistia doença sistêmica, ainda não identificada quando do evento cutâneo inicial. Portanto, a afirmação dos autores de que o caso representaria doença sistêmica por reativação de foco cutâneo primário latente não é plenamente inequívoco. Caso ainda mais desafiante é o relato de Amaral et al.65 de paciente de 68 anos, ex‐alcoolista, tabagista com carga tabágica de 100 maços/ano, com queixa de cefaleia havia três dias. O paciente também apresentava lesão no antebraço havia um mês, semiologicamente plenamente superponível às lesões observadas na CCP. Quando da investigação clínica, identificou‐se líquor cefalorraquidiano (LCR) com evidências de meningite linfocítica atribuída à criptococose e sorologia específica, por aglutinação do látex, na mesma amostra de LCR com título de 1/1024., achados plenamente compatíveis com o diagnóstico de meningoencefalite por Cryptococcus spp. Portanto, quadro cutâneo CCP‐símile, confirmado por histopatologia e cultivo (Cryptococcus neoformans) e com doença neurológica específica concomitante, igualmente comprovada.65 Única discordância em relação à interpretação do caso foi se referir ao paciente como imunocompetente, quando ele fazia uso por 10 anos de inalação de corticoide em virtude de doença pulmonar obstrutiva crônica consequente ao tabagismo. Esses relatos de casos certamente nos obriga a atenção redobrada, formulando prognóstico caso a caso e avaliadas as diversas variáveis indicadas acima. De qualquer modo, esses relatos são de citação obrigatória, servem de alerta quanto ao prognóstico e são de extrema contribuição ao fundamental, que é a investigação sistêmica adequada quando de diagnóstico presuntivo de criptococose cutânea primária.
ConclusãoCCP é forma clínica incomum, emergente, com relatos em inúmeros países tropicais, subtropicais e temperados, comunicada em reuniões científicas e congressos de Dermatologia e publicada em distintos periódicos. A suspeição clínica se apoia no conhecimento de que ocorre particularmente em imunocomprometidos, mas não é exclusiva dos mesmos. Semiologicamente, é polimorfa, de consistência gelatinosa à palpação, de localização em área corporal exposta e única. Há critérios de classificação e de diagnósticos bem estabelecidos entre os quais o cultivo é o padrão ouro. Tais critérios devem ser observados fielmente e exigidos e demonstrados quando dos relatos dos casos. O tratamento é exitoso com o uso de derivados azólicos ou da anfotericina B desoxicolato ou anfotericina B formulação lipídica. O acompanhamento a longo prazo é salutar e recomendável.
Suporte financeiroNenhum.
Contribuição dos autoresSilvio Alencar Marques: Elaboração e redação do manuscrito; aprovação da versão final do manuscrito.
Rosangela Maria Pires de Camargo: Aprovação da versão final do manuscrito.
Anna Carolina Miola e Marina Dias pelo diagnóstico e atenção ao paciente correspondente à figura 5. Eliete Correa Soares pela documentação fotográfica dos casos. Mariangela E A Marques pela documentação histopatológica e diagnóstico histopatológico dos casos aqui demonstrados. Aos Chefes e Médicos Residentes da Dermatologia no cuidado a alguns dos pacientes do presente relato.
Como citar este artigo: Alencar Marques S, Camargo RMP. Primary cutaneous cryptococcosis – History, concepts, clinical and therapeutic update. An Bras Dermatol. 2025;100. https://doi.org/10.1016/j.abd.2024.07.004.
Trabalho realizado no Departamento de Infectologia, Dermatologia, Diagnóstico por Imagem e Radioterapia, Faculdade de Medicina, Universidade Estadual Paulista, Botucatu, SP, Brasil.