A rosácea é uma doença inflamatória crônica da pele, relativamente mais frequente em mulheres acima dos 30 anos, com fototipo baixo e comprovada predisposição genética. Apesar de a etiologia ser desconhecida, possivelmente multifatorial, a anormalidade imunológica associada à desregulação neurovascular e aos fatores desencadeantes são elementos importantes implicados na fisiopatologia, que levam às principais alterações de inflamação, vasodilatação e angiogênese, responsáveis pelas manifestações clínicas. A despeito da ausência de cura, inúmeras opções terapêuticas encontram‐se disponíveis, indicadas para as distintas apresentações clínicas da doença, com respostas satisfatórias.
ObjetivoDesenvolver um consenso, com recomendações de experts, sobre o manejo terapêutico da rosácea na realidade brasileira.
MétodosO estudo foi conduzido por cinco dermatologistas especialistas, de centros universitários, representantes das diversas regiões brasileiras, com experiência em rosácea, indicados pela Sociedade Brasileira de Dermatologia. A partir da metodologia DELPHI adaptada, os experts contribuíram por meio de uma revisão bibliográfica atualizada das evidências científicas, aliadas a experiências pessoais.
ResultadosO grupo de especialistas elaborou um consenso sobre os aspectos relevantes no manejo terapêutico da rosácea, fornecendo subsídios sobre epidemiologia, fisiopatologia, fatores desencadeantes, quadro clínico, classificação, qualidade de vida e comorbidades. O consenso foi definido com a aprovação de 90% do painel.
ConclusãoApesar da impossibilidade de cura, há diversas opções terapêuticas, específicas para cada paciente, que proporcionam excelentes resultados, com chances de melhoria total e longos períodos de remissão, promovendo um impacto positivo na qualidade de vida. Este consenso oferece orientações detalhadas para auxílio na prática clínica e decisões terapêuticas na rosácea.
A rosácea é uma doença inflamatória crônica da pele, de complexa etiopatogênese, envolvendo alteração imunológica e desregulação neurovascular, que apresenta fatores de risco e quadro clínico estabelecidos, os quais podem comprometer significativamente a qualidade de vida de seus portadores. Tem ampla distribuição mundial (5% de afetados, globalmente), predominando em populações de fototipos baixos (I e II na classificação de Fitzpatrick), ainda que estudos demonstrem possibilidade de afetar diferentes etnias.1–5 Um discreto predomínio feminino é observado e, apesar de também acometer crianças e idosos, a faixa etária predominante é entre 30−60 anos.1,2,6–8
A maioria dos relatos epidemiológicos é europeu e americano, embora artigos recentes descrevam a rosácea como um problema de saúde em diferentes regiões do mundo.1–5,9 A certificação de que a doença parece ser universal, e não restrita apenas a brancos, é um mérito coletivo das diferentes publicações recentes.2–6,8,9
A distribuição mundial da rosácea parece variar entre 2%−22%. As estimativas em relação às prevalências nos diferentes países são: Estônia 20%, Alemanha 12%, Suécia 10%, Rússia 5%, Estados Unidos 5%, Colômbia 3%, França 3%. Países como China, Brasil, Índia e Austrália apresentam taxas não confiavelmente reconhecidas.2–10
No Brasil, não há relatos sobre a doença que apoiem nossa heterogeneidade populacional. Estudo conduzido no Sul do país, que incluiu 62 casos e 124 controles, confirmou a faixa entre 40−50 anos e o predomínio feminino, além da ancestralidade europeia, na maioria dos casos.6 No entanto, há inúmeros casos acompanhados nos serviços de dermatologia das diversas regiões brasileiras, com pacientes de fototipos mais elevados, que precisam ser considerados.
Neste artigo serão apresentados os principais aspectos da rosácea, com objetivo de sintetizar o conhecimento e apontar direções para o melhor manejo terapêutico atual.
FisiopatologiaEmbora a patogênese da rosácea não esteja completamente esclarecida, é considerada uma doença multifatorial.11 Predisposição genética, anormalidades do sistema imunológico e desregulação neurovascular, associadas a fatores desencadeantes, são os principais elementos envolvidos na fisiopatologia da doença.12
A predisposição genética para transportar a variante polimórfica rs3733631 no gene do receptor de taquiquinina TACR3 e o polimorfismo na enzima glutationa S‐transferase (GST) estão relacionados à doença.13–15 Chang et al. identificaram que genes associados ao rs763035 são expressos em amostras de pele de rosácea e identificaram que três alelos de classe II do complexo principal de histocompatibilidade (MHC), inclusive HLA‐DRB1, HLA‐DQB1 e HLA‐DQA1, estão envolvidos.16–18
A desregulação da resposta imune inata aumenta a secreção de peptídeos antimicrobianos (PAM) e citocinas, via ativação de receptores tool‐like 2 (TLR‐2). O principal PAM é a catelicidina, clivada pela calicreína 5 (CLC‐5) no peptídeo ativo LL‐37. Esse é o mediador fundamental para a ativação e o controle de inúmeros processos; liberação de citocinas e metaloproteinases (MMP) por leucócitos, mastócitos e queratinócitos, regulação da expressão dos componentes da matriz extracelular e aumento na proliferação das células endoteliais, que provocam angiogênese. As MMP‐2 e 9 estão elevadas na pele dos pacientes, exercendo funções inflamatória, angiogênica e de desestruturação do arcabouço dérmico, além de auxiliar na ativação da CLC‐5 e realimentar o sistema. A MMP 9 é diretamente estimulada pelo ácaro Demodex folliculorum (Df).17,19–22
O comprometimento da barreira cutânea na rosácea concorre para a fisiopatologia da doença, uma vez que sua integridade é imprescindível para o sistema imunológico inato. É observado aumento na perda de água transepidérmica e pH mais alcalino, possivelmente pela ativação de proteases epidérmicas, sobretudo a CLC‐5. Importante também é o fato de Df poder levar à ruptura da barreira cutânea, causar microabrasões na pele e propiciar a hipersensibilidade na rosácea.23–27
Há predomínio de citocinas das vias Th1/Th17, na imunidade adaptativa. A IL‐17 parece induzir a angiogênese por meio do VEGF e afetar a expressão de LL‐37 nos queratinócitos.28,29 Os níveis séricos de vitamina D nos pacientes com rosácea se mostraram superiores aos do grupo controle. Provavelmente, esse hormônio esteroide influencia a via associada ao TLR‐2, CLC‐5 e LL‐37 e altera o sistema imunológico.17,23,24
Na desregulação neurovascular, os receptores vaniloides e da anquirina, presentes nos tecidos neuronais, no endotélio e nos queratinócitos, podem liberar neuropeptídeos importantes no flushing característico da rosácea e podem ser estimulados por calor, frio, álcool, alimentos picantes e produtos químicos.2,7,8,11,17,30–32
Os mecanismos fisiopatológicos, em particular os inflamatórios e os vasculares, que se potencializam no desencadeamento e na manutenção da rosácea, induzem a aceleração da proliferação e diferenciação epidérmica e a disfuncionalidade do estrato córneo, com diminuição da capacidade de atrair e reter água, o que piora o processo inflamatório e agrava o dano à barreira da pele.33
Fatores desencadeantesUma das características da rosácea é a possibilidade de os sinais e sintomas (em especial o flushing) serem desencadeados por fatores ambientais ou hábitos de vida, chamados “fatores desencadeantes”. Em 2002, a National Rosacea Society (NRS) conduziu um estudo com 1.066 pacientes portadores de rosácea para identificar os principais fatores relacionados. Os mais citados foram: exposição solar (81%), estresse emocional (79%), clima quente (75%), vento (57%), exercícios físicos intensos (56%), consumo de álcool (52%), banhos quentes (51%), clima frio (46%), alimentos condimentados (45%), umidade (44%), certos produtos para o cuidado da pele (41%), bebidas quentes (36%), certos cosméticos (27%), medicamentos (15%), condições médicas (15%), entre outros.34
Estudos posteriores relacionaram o ácaro Df como um importante fator desencadeante, apesar de não ser citado nesta pesquisa.35
Em enquetes não científicas, também conduzidas pela NRS, o controle desses fatores em pacientes com rosácea que os identificaram e evitaram resultou em melhora em graus variados de sua condição, em mais de 90% dos entrevistados.36
ClassificaçãoEm 2002, a NRS elaborou uma classificação, revisada em 2004, que forneceu critérios padronizados para pesquisas, análise de resultados e comparação de dados de diferentes fontes, servindo como referência diagnóstica na prática clínica.37,38 A rosácea foi dividida em quatro subtipos: 1) eritêmato‐telangiectásica; 2) papulopustulosa; 3) fimatosa; e 4) ocular. Apesar de excelente do ponto de vista didático, essa classificação claramente ignorava as diferenças de intensidade das manifestações clínicas, a possibilidade de progressão entre as diferentes formas e mesmo as chances de superposição de subtipos.35
A etiopatogênese da rosácea era então desconhecida e não havia marcadores histológicos ou sorológicos para a doença. O sistema foi baseado meramente na morfologia característica para fornecer uma “estrutura” que pudesse ser atualizada diante de novas descobertas. Portanto, desde a sua introdução, a classificação da NRS foi proposta como um sistema provisório, que deveria ser modificado/atualizado à medida que o conhecimento científico e a experiência da prática clínica avançassem.39
Os achados da rosácea podem abranger vários subtipos, progredir entre diferentes subtipos, demonstrar intensidades variáveis ou mesmo ser patognomônicos (p.ex., fimas).40,41 Um sistema baseado em fenótipos−características observáveis que podem resultar de influências genéticas e/ou ambientais−propicia os meios necessários para avaliar e propor tratamentos de maneira individualizada, de acordo com a apresentação de cada paciente.42
Com essa proposta, o painel Rosacea Consensus (ROSCO)−composto por dermatologistas e oftalmologistas da África, Ásia (inclusive Índia, China e Cingapura), Europa, América do Norte e América do Sul−foi o primeiro a adotar e propor uma abordagem global para abordar o diagnóstico e a classificação da rosácea. O objetivo foi estabelecer um consenso internacional sobre diagnóstico, gravidade e opções de tratamento, a fim de melhorar os resultados diagnósticos e terapêuticos.42 Em seguida, ainda em 2017, a NRS, por meio de um painel de especialistas, adotou critérios muito semelhantes aos do painel ROSCO, recomendando também a avaliação por fenótipos.39
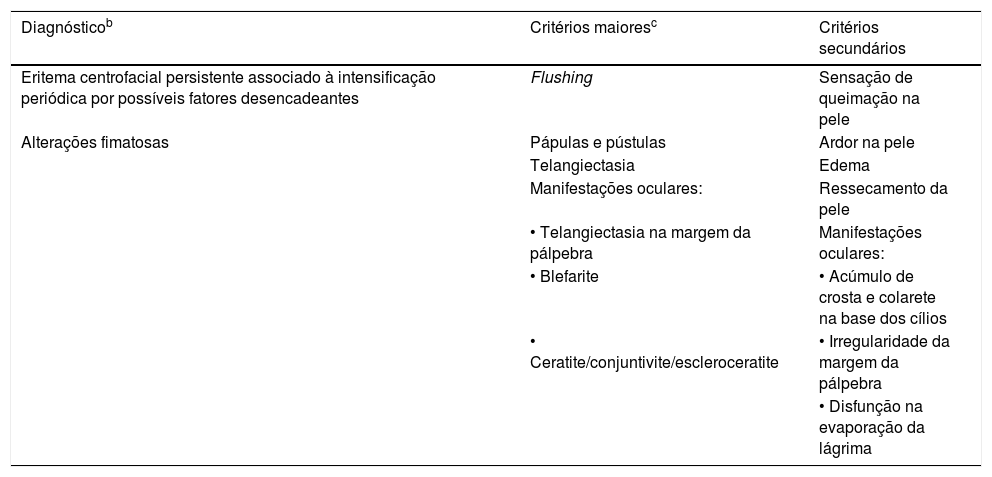
Diagnóstico e aspectos clínicosCritérios fenotípicos diagnósticosTanto a nova classificação ROSCO como a da NRS atualizada consideram duas manifestações como sinais ou critérios diagnósticos quando presentes de maneira isolada ou associados a outras manifestações (tabela 1).39,42
Fenótipos da rosácea – características diagnósticas, principais e secundáriasa
| Diagnósticob | Critérios maioresc | Critérios secundários |
|---|---|---|
| Eritema centrofacial persistente associado à intensificação periódica por possíveis fatores desencadeantes | Flushing | Sensação de queimação na pele |
| Alterações fimatosas | Pápulas e pústulas | Ardor na pele |
| Telangiectasia | Edema | |
| Manifestações oculares: | Ressecamento da pele | |
| • Telangiectasia na margem da pálpebra | Manifestações oculares: | |
| • Blefarite | • Acúmulo de crosta e colarete na base dos cílios | |
| • Ceratite/conjuntivite/escleroceratite | • Irregularidade da margem da pálpebra | |
| • Disfunção na evaporação da lágrima |
Apresenta um padrão característico que se intensifica periodicamente por fatores desencadeantes. Em pacientes com fototipos de pele Fitzpatrick I a IV, essa é a apresentação mais frequente da rosácea. O diagnóstico diferencial com lúpus eritematoso, dermatite seborreica, fotodermatoses e rosácea induzida pelo uso de esteroides precisa ser considerado. Em pacientes com fototipos V e VI, a pigmentação da pele pode dificultar a avaliação clínica; no entanto, sintomas de irritação, como queimação e pinicação, podem auxiliar o diagnóstico. Pápulas e pústulas podem ser os primeiros sinais claramente visíveis nesse fototipo.43
Alterações fimatosasNas novas classificações, esse é um achado patognomônico da rosácea.39,42 É mais frequente no sexo masculino e, apesar de poder acometer qualquer área da face, a região nasal é a mais habitual (rinofima).44 Apresenta‐se inicialmente como um espessamento da pele, com eritema e edema, visivelmente inflamatório. Progride com a proliferação de tecido fibroso e glândulas sebáceas, acentuação dos orifícios foliculares com tampões de sebo e queratina que drenam um material de odor desagradável, um quadro residual já sem inflamação evidente.45
Critérios fenotípicos maioresOs critérios fenotípicos principais da rosácea podem surgir associados ou não aos critérios diagnósticos. Se não forem associados, são necessários pelo menos dois critérios maiores para que seja considerado diagnóstico.39,42
FlushingConsiste em eritema difuso, que ocorre em surtos de duração e frequência variáveis, intensificando a vermelhidão centrofacial; surtos de longa duração são comuns. Frequentemente ocorre associado a edema de graus variáveis e pode cursar com sensações de calor, queimação e/ou dor. Em indivíduos com fototipos altos, pode ser de difícil percepção e, às vezes, não observado (apenas subjetivo). Sua ocorrência está ligada a estímulos neurovasculares desencadeados por diversos fatores.46,47
Pápulas e pústulasAs pápulas são eritematosas, dispostas predominantemente na região centrofacial, algumas maiores e mais profundas, acompanhadas ou não por pústulas. A associação com eritema e edema de graus variáveis é comum. Comedões, quando presentes, sinalizam concomitância de acne não relacionada à rosácea, e auxiliam no diagnóstico diferencial.47–49
TelangiectasiasAs telangiectasias têm localização centrofacial. Como sua presença nas asas nasais é frequente na população em geral, não são consideradas no diagnóstico. É importante excluir o uso de esteroides e o dano actínico crônico como fatores causais. Em pacientes de fototipos altos, V e VI, a dermatoscopia pode auxiliar no diagnóstico.39
Alterações ocularesPodem fazer parte dos critérios primários ou secundários e serão abordadas em tópico à parte.
Critérios fenotípicos secundáriosNas classificações do ROSCO e da NRS, as manifestações dermatológicas fenotípicas secundárias são similares e incluem sensação de queimação, de pinicação, de ressecamento e edema. A diferença das duas classificações reside apenas em critérios oftalmológicos.39,42
Ardor e queimaçãoAmbos são mais frequentes em pacientes portadores de rosácea. Lonne‐Rahm et al. avaliaram pacientes com queixa de ardor e demonstraram maior incidência nessa população, sobretudo na região malar.50 Embora possa ocorrer, o prurido não é um sintoma característico.
EdemaO edema na rosácea pode estar ligado às alterações vasculares e à inflamação; sua associação com eritema e flushing é bastante comum. Apesar de frequentemente estar associado a outras manifestações, pode ocorrer isoladamente. Pode ser depressível ou não, autolimitado ou persistente, com duração variável. Os vasos responsáveis podem ser tanto linfáticos quanto sanguíneos, e a dominância é variável.46,51,52
Ressecamento da peleA região central da face pode ser áspera e descamativa, apesar de o paciente relatar ter “pele oleosa”. A coexistência de dermatite seborreica traz maiores dificuldades diagnósticas, uma vez que a rosácea pode simular um quadro eczematoso.
Rosácea ocularA rosácea ocular é regularmente negligenciada pelos dermatologistas, que tendem a abordar unicamente as manifestações cutâneas. Conhecimento mais amplo por dermatologistas e oftalmologistas pode levar a uma melhora no diagnóstico e na condução desses pacientes.52 É importante enfatizar que essa manifestação pode se comportar de maneira independente das lesões cutâneas, pode estar presente em quadros leves, moderados, graves ou mesmo na ausência de critérios fenotípicos principais.37,39
O painel ROSCO atribui a possibilidade elevada de associação à rosácea as seguintes manifestações oculares:52
- •
Telangiectasias das margens das pálpebras: vasos visíveis ao redor das margens das pálpebras.
- •
Blefarite: inflamação da margem palpebral, mais comumente decorrente de disfunção das glândulas de Meibomius.
- •
Queratite: inflamação da córnea, que pode levar a defeitos e, nos casos mais graves, à perda de visão.
- •
Conjuntivite: inflamação da mucosa que reveste a superfície interna das pálpebras e conjuntiva bulbar. É tipicamente associada a congestão vascular e edema conjuntival.
- •
Uveíte anterior: inflamação da íris e/ou corpo ciliar.
A nova classificação da NRS inclui ainda sintomas que comumente surgem na rosácea, mas não são específicos, como queimação, pinicação, fotossensibilidade e sensação de corpo estranho.39
O diagnóstico de rosácea ocular, na maioria das vezes, é eminentemente clínico. A avaliação de telangiectasias nas margens de pálpebras, telangiectasias e eritemas conjuntivais interpalpebrais, além da inspeção das glândulas de Meibomius e do calázio, pode ser feita sem o auxílio de instrumentos e por profissionais não especializados. Há, entretanto, situações nas quais o auxílio de um oftalmologista pode ser necessário, como nas queratites, esclerites e em infiltrados com vascularização da córnea.39
MétodosEste consenso foi elaborado por cinco dermatologistas, das distintas regiões brasileiras, experientes em rosácea, indicados pela Sociedade Brasileira de Dermatologia. Foi feita uma revisão sistemática atualizada sobre o assunto, baseada em evidências científicas, aliadas a experiências pessoais. A partir da metodologia DELPHI modificada, os experts apontaram sua concordância em escala Likert, mensurada pelas variáveis: 1) concordo plenamente; 2) concordo parcialmente; 3) nem concordo, nem discordo; 4) discordo parcialmente; 5) discordo totalmente. A partir dessa resposta, foi possível descobrir diferentes níveis de intensidade de opinião sobre um mesmo assunto. Todas as resoluções foram instituídas à distância, sem reuniões presenciais, assim como todos os membros responderam a todas as perguntas. Os dados obtidos foram avaliados e o grau de concordância do painel foi maior do que 90% para todos os itens do manuscrito.
TratamentoMedidas geraisA rosácea se caracteriza por pele sensível na face, com barreira cutânea comprometida e hiper‐reatividade vascular. Muitos pacientes se queixam de sensibilidade exagerada aos agentes de limpeza e cosméticos. Portanto, orientações sobre fatores desencadeantes e agravantes e medidas gerais sobre o cuidado da pele são fundamentais em qualquer forma e gravidade para a manutenção da integridade da pele em longo prazo e para o sucesso do tratamento.
As orientações devem ser dirigidas à identificação e prevenção da exposição a fatores desencadeantes, que causam agressão à barreira cutânea e/ou vasodilatação.53–59
Os cuidados gerais devem incluir: limpeza suave, apenas uma a duas vezes ao dia, com agentes sem sabões, ou seja, loções para peles sensíveis como água micelar ou com sabonetes suaves, com pH 5,5; uso diário de hidratantes não gordurosos, com composição semelhante ao fator de hidratação natural da pele, de preferência rico em ceramidas, ácido hialurônico, glicerina, alantoína, licorice, niacinamida, óleos de plantas (triglicerídios, polifenóis, triterpenos, ácidos graxos livres, fosfolípides, antioxidantes, como tocoferol etc.) e sem alfa‐hidroxi‐ácidos.60
Como a inflamação compromete a função de barreira, aumenta a perda de água transepidérmica e deixa a pele seca e sensível, os hidratantes com função oclusiva e umectante devem ser aplicados, preferencialmente à noite, quando a recuperação da barreira epidérmica é mais lenta e a permeabilidade e a perda de água são mais elevadas. Os hidratantes para peles sensíveis são mais indicados, alguns com pigmento verde, útil para mascarar o eritema.61
A fotoproteção de amplo espectro deve ser diária, contínua, com fator de proteção superior a 30, preferencialmente contendo dimeticone, óxido de zinco ou dióxido de titânio para evitar dermatite irritativa e coloridos, que funcionam como corretivos. A camuflagem é muito útil quando existe eritema transitório ou persistente, melhora o impacto na qualidade de vida e reduz o estresse causado pela aparência da pele.
Mesmo com cuidado na escolha dos produtos a serem prescritos, sempre há riscos de eventos adversos, dada a sensibilidade da pele, e isso deve ser esclarecido aos pacientes. Devem ser evitados cosméticos à prova de água, pela dificuldade de remoção; tônicos e adstringentes que contêm álcool, mentol, cânfora, óleo de eucalipto; produtos com laurilsulfato de sódio, fragrâncias fortes, ácidos de frutas e esfoliantes.54–59
Tratamentos tópicosVisam a controlar os surtos, com opções terapêuticas que levem ao controle eficaz, boa tolerabilidade, satisfação e impacto positivo na qualidade de vida. É relevante enfatizar que, apesar de não haver tratamento de cura, existem chances de melhora total e longos períodos de remissão; nos casos leves a moderados, os tratamentos tópicos têm bom nível de evidência e podem ser suficientes.
Os tratamentos tópicos mais citados na literatura são: metronidazol a 0,75% em gel ou creme e 1% em creme; ácido azelaico 15% em gel ou 20% em creme; agonistas do receptor α‐1 adrenérgico (tartarato de brimonidina 0,5% em gel e oximetazolina 1% em creme) e ivermectina 1% em creme.53–57,59 Apesar de ainda não ser vendida no Brasil, a minociclina tópica em espuma a 4% também tem sido descrita mais recentemente.59
O metronidazol foi relatado em estudos dos anos 1990 e seus principais mecanismos de ação são o efeito anti‐inflamatório e a redução da densidade de Df.53,54 No Brasil, está disponível para venda a 0,75% em gel; as demais apresentações podem ser usadas sob manipulação.
O ácido azelaico é considerado eficaz por sua atividade anti‐inflamatória estabelecida em estudos in vitro, por meio da inibição das funções dos neutrófilos e geração de espécies reativas de oxigênio (ROS).62,63 Estudo recente demonstrou seu efeito anti‐inflamatório in vivo na acne da mulher adulta, por meio da redução significativa da expressão do TLR‐2 que também está envolvido na fisiopatologia da rosácea.64 Sua eficácia comparada ao veículo na rosácea foi demonstrada em estudo randomizado e confirmada em revisão sistemática.65,66 No Brasil, estão à disposição as apresentações do ácido azelaico a 15% em gel e a 20% em creme.
Os agonistas do receptor α‐1 adrenérgico presentes nos vasos dérmicos, particularmente nas arteríolas, determinam vasoconstrição. A brimonidina 0,5% gel foi aprovada pela Food and Drug Administration (FDA) em 2014. Houve uma grande expectativa como solução para o eritema transitório e persistente da rosácea; no entanto, foram relatados eventos adversos em aproximadamente 31% dos pacientes.67 Um estudo publicado em 2017 observou piora do eritema, flushing, rebote, dermatite de contato, prurido, queimação em cerca de 10% a 20%, com interrupção do uso por 17%. Os autores sugeriram que o seu uso poderia ser útil apenas para o eritema persistente.68 Ainda em 2017, o FDA aprovou o uso da oximetazolina 1% creme, uma vez ao dia, de manhã, para o eritema persistente. Vários autores comprovaram a eficácia desse fármaco na melhora do eritema em dois graus de acordo com a escala usada.68,69 Eventos adversos como dermatite e/ou eritema, parestesia, dor, ressecamento e prurido ocorreram em 8,2% dos pacientes, mais frequentes nos primeiros 90 dias do tratamento; apenas 3,2% dos pacientes interromperam uso, sem pioria do eritema. Houve rebote em menos de 1% dos pacientes. Evidentemente, não houve efeito sobre as telangiectasias. De qualquer modo, os autores consideram que, pelo pouco tempo de uso, não é possível assegurar a segurança, eficácia e tolerabilidade. No Brasil, só é possível o uso da brimonidina 0,5% em gel, a qual já é comercializada.
A ivermectina 1% em creme foi aprovada pelo FDA em 2017, indicada para a rosácea papulopustulosa moderada a grave, com menor eficácia na forma mais branda, com menos lesões.70 Mais recentemente, têm sido descritos seus efeitos benéficos sobre alterações oculares.71 Seu mecanismo de ação se baseia na inibição da via da catelicidina e na redução da densidade de Df que ativa o receptor TLR‐4, com liberação de mediadores inflamatórios, ou seja, atua como anti‐inflamatório, com diminuição da expressão do TNF‐α e IL‐1 beta.70 O papel de Df na rosácea ainda é controverso; no entanto, alguns autores sugerem que a demodicidose rosácea‐símile e a rosácea podem ser consideradas dois fenótipos de uma mesma doença que melhoram pela ação não só anti‐inflamatória, mas também antiparasitária da ivermectina.72 Os efeitos colaterais foram: irritação, xerose, queimação e prurido.73 Revisão sistemática publicada em 2018 confirmou a eficácia da ivermectina tópica comparada a outros tópicos, mas não foram identificados estudos comparativos com doxiciclina e isotretinoína de maneira isolada ou em associação.74 No Brasil, pode‐se usá‐la sob a forma de manipulação.
Outros agentes tópicos para o tratamento da rosácea já relatados em publicações antigas são: sulfacetamida de sódio 10%, loções de enxofre 5% ou 10%, peróxido de benzoíla 5% e os retinoides (retinaldeído 0,05%; tretinoína 0,025% ou 0,05%). Os dois últimos apresentam alto risco de causar dermatite irritativa e só têm o uso justificado se a rosácea estiver associada à acne ou fotoenvelhecimento.53,54
Tratamentos sistêmicosCasos mais graves ou refratários exigem tratamento sistêmico isolado ou, mais comumente, associado ao tópico.
As drogas de uso sistêmico são os antibióticos, especialmente do grupo das ciclinas (tetraciclina, doxiciclina e minociclina), metronidazol e isotretinoína, as quais serão detalhadas a seguir, sendo ressaltados seus eventos adversos que devem ser monitorados. Apesar de na prática ser frequente o uso da limeciclina em nosso país, não há evidências no tratamento da rosácea. Entre as medicações orais citadas, a doxicilina e a minociclina podem ser usadas no Brasil sob a forma de manipulação; as demais são comercializadas.53,54,56–59
Os antagonistas do receptor β‐adrenérgico, também chamados betabloqueadores, como carvedilol, atenolol, nadolol, propranolol, de uso sistêmico, têm propriedades vasoconstritoras no músculo liso das arteríolas dérmicas e não atuam nos capilares. O uso do carvedilol foi publicado num relato de caso de rosácea grave e refratária com alta eficácia para o eritema e poucos efeitos colaterais; no entanto, há risco elevado de hipotensão e bradicardia.75
Tratamentos de acordo com o fenótipoAbordagem global no manejo da rosácea deve ser baseada no conhecimento e na escolha das várias opções terapêuticas tópicas e sistêmicas de acordo com o fenótipo e a gravidade da doença.53,54,56,59 No fim desse consenso, serão apresentadas as sugestões de tratamento dos experts, baseadas nas manifestações fenotípicas.
Quando prevalece o eritema transitório, também conhecido por flushing, não há tratamento com evidência estabelecida. Orientam‐se medidas gerais e cuidados com a pele. Podem ser usadas máscaras calmantes com camomila, matricária, chá verde etc. Não são mais indicados os agonistas alfa‐adrenérgicos tópicos e os betabloqueadores orais.53,54,58,59 O uso da toxina botulínica, em injeções intradérmicas, foi sugerido em relatos de casos, com sucesso, podendo representar uma opção terapêutica que necessita de mais estudos.76,77
Para o eritema persistente são recomendados os agonistas alfa‐adrenérgicos, como o tartarato de bromonidina 0,5% em gel e oximetazolina 1% em creme.59,67–70 Podem ser usados laser e luz intensa pulsada (LIP).
As telangiectasias devem ser tratadas com tecnologias como a LIP, com filtros de 550 ou 600nm e laser, com sucesso amplamente documentado.78 O mecanismo de ação do laser é o da fototermólise seletiva e o cromóforo alvo é o pigmento da hemoglobina presente nos vasos sanguíneos.79 É método seguro e efetivo, com resultados secundários, como redução do eritema, melhora da textura cutânea e, às vezes, redução das pápulas e pústulas. São necessárias múltiplas sessões (até 15) com intervalos de uma a três semanas. Os parâmetros devem ser ajustados individualmente, de acordo com fototipo, gravidade e tolerância, a fim de minimizar os efeitos colaterais. Existem poucos relatos na literatura sobre o tempo de remissão da rosácea, mas acredita‐se que pode chegar a um ano.78,79 A eletrocauterização é uma opção.
Para as lesões inflamatórias, papulopustulosas, são indicados tratamentos tópico e/ou sistêmico.53–59 Para formas leves a moderadas, a ordem de preferência inclui ácido azelaico, ivermectina, metronidazol tópico e doxiciclina 40mg/dia; para formas graves, ivermectina tópica, doxiciclina 40mg/dia e isotretinoína oral em dose diária baixa, de 0,25−0,3mg/kg, em uso off label.58 Outras opções, sem evidência, são: tetraciclina, limeciclina, minociclina, azitromicina, metronidazol oral, alfa‐agonistas tópicos, sulfacetamida, inibidores da calcineurina e retinoides tópicos.
A ação anti‐inflamatória da doxiciclina foi bem documentada em artigo de revisão publicado em 2007.80 A dose de 40mg/dia combinada ao uso do metronidazol 1% em gel foi eficaz e segura.81 A dose de 40mg foi comparada à de 100mg/dia, com a mesma eficácia.82 Do mesmo modo, a eficácia foi demonstrada com o uso combinado com ivermectina 1% em creme.83 No Brasil, como ela não é comercializada, pode‐se prescrever a elaborada em farmácias de manipulação; no entanto, merece citação que a doxiciclina difere da vendida nos EUA, que apresenta liberação lenta, fator que pode acarretar alguma modificação na biodisponibilidade e farmacocinética e, consequentemente, na eficiência da substância.
A isotretinoína oral só é aprovada para acne moderada a grave, proporcionando a cura ou a remissão prolongada. Muitas indicações não aprovadas, como a rosácea, têm sido relatadas.84 A perspectiva de eficácia se relaciona à amplitude de seus mecanismos de ação, particularmente a potente inibição das glândulas sebáceas e as propriedades anti‐inflamatórias pela modulação do TLR‐2, que tem expressão aumentada nos queratinócitos na rosácea.85 A isotretinoína tem elevado grau de recomendação para rosácea papulopustulosa moderada a grave ou recidivante ou não responsiva à antibioticoterapia. Em 1994, um autor chileno relatou uma série de casos sobre o uso da isotretinoína na rosácea grave, por períodos de três a seis meses, com remissão rápida das pápulas e pústulas, melhora das manifestações oculares, poucos efeitos colaterais e manutenção dos resultados por uma média de 14,8 meses.86 Estudo multicêntrico alemão de 2010, duplo‐cego, randomizado, que incluiu 573 pacientes com rosácea papulopustulosa e fimatosa, comparou diferentes doses de isotretinoína (0,3mg/kg/dia; 0,5mg/kg/dia; 1mg/kg/dia), doxiciclina 100mg/dia por 14 dias e, depois, 50mg/dia e placebo. Observou‐se que a dose de isotretinoína de 0,3mg/kg/dia foi mais efetiva do que o placebo, apresentando eficácia igual ou mesmo superior à doxiciclina, com menos efeitos colaterais do que em doses mais elevadas.87 Para controlar melhor as recidivas, estudos sugeriram esquema de tratamento com isotretinoína 10−20mg/dia por quatro a seis meses e posteriormente manutenção com microdoses contínuas (0,03−0,17mg/kg/dia – média de 0,07mg/kg/dia) por até 33 meses, resultando em melhor opção do que múltiplos ciclos de antibioticoterapia.88 O outro estudo usou doses intermediárias, ou seja, dose diária inicial de 20mg/dia por quatro meses, com redução rápida do eritema e lesões inflamatórias e posterior redução lenta e progressiva da dose, por seis meses, até 20mg/semana, com recidiva de 45% dos casos no seguimento de 11 meses.89 A isotretinoína oral associada ao corticosteroide oral (prednisona, 40−60mg/dia) é considerada tratamento de escolha para a rosácea fulminante, variante muito grave. Recomenda‐se iniciar com dose diária baixa (0,2mg/kg a 0,5mg/kg), depois aumentada (até 0,5mg/kg a 1mg/kg) por três a quatro meses.90
Os efeitos colaterais são bem conhecidos, dose‐dependentes, previsíveis, preveníveis e controláveis com cuidados precoces. Os mais comuns são os cutaneomucosos, tais como queilite (presente em 100% dos pacientes), xeroftalmia, conjuntivite, ressecamento nasal, epistaxe e dermatite irritativa.91 Podem ocorrer alterações laboratoriais como elevação das enzimas hepáticas, dos níveis de triglicérides e do colesterol, elevação da fração LDL e diminuição da fração HDL.92,93 Depressão, ideias suicidas ou tentativa de suicídio e o desencadeamento de doença inflamatória intestinal relacionados ao uso da isotretinoína oral não tiveram associação comprovada na literatura.94‐97 O monitoramento clínico e laboratorial deve ser feito antes, repetido oito semanas após o início do tratamento e feitas reavaliações apenas para os alterados.93,98 Atenção especial deve ser dada à teratogenicidade, uma vez que a rosácea compromete, frequentemente, mulheres adultas em idade fértil.99,100
Na rosácea fimatosa, há hiperplasia de glândulas sebáceas, tecido conectivo e vasos sanguíneos. Por suprimir a atividade da glândula sebácea, a isotretinoína oral pode atrasar a progressão quando usada na fase pré‐fibrótica ou fima inflamatório. Há relatos que comprovam redução do tamanho, do número e da atividade das glândulas sebáceas; a dose de 1mg/kg/dia por 18 semanas reduziu o volume nasal de 9% a 23%. Melhores resultados são obtidos em pacientes jovens, mas há recorrência após suspensão do medicamento.101 Relato de caso demonstrou eficácia da isotretinoína 20mg/dia por seis meses, com recidiva após suspensão e manutenção do resultado com 10mg/dia por tempo prolongado.102 Outras opções são a doxiciclina 100mg/dia e a infiltração intralesional com corticoide. Fimas fibróticos ou não inflamatórios são tratados com cirurgia, laser ablativo, eletrocirurgia, dermabrasão e radiofrequência, que serão abordados posteriormente.58
O tratamento da rosácea ocular deve incluir higiene das pálpebras, uso de lágrima artificial para lubrificação ocular, óculos de sol; nos casos leves, metronidazol a 0,75%, ivermectina, ácido fusídico aplicado nas pálpebras, ciclosporina 0,05% em colírio ou emulsão, corticoides tópicos; nos casos graves, doxiciclina oral.54,55,58,103 Há poucos estudos com isotretinoína, porém a tendência é que o medicamento melhore sinais como a blefarite e conjuntivite; recomendam‐se doses diárias baixas, de 10mg/dia.54 A ivermectina tópica, empregada mais recentemente, tem mostrado resultados satisfatórios nas alterações oculares.71 Outras opções citadas são: ômega 3, eritromicina, azitromicina e corticoides orais. Tratamento de manutenção com tópicos e avaliação por oftalmologista são recomendados.
A rosácea granulomatosa é rara; as opções terapêuticas podem ser: isotretinoína, 0,7mg/kg/dia por seis meses, ciclinas, dapsona, laser, terapia fotodinâmica, brimonidina, ácido azelaico, metronidazol tópico, peróxido de benzoíla, corticoides tópico e sistêmico.104
Tratamento de manutençãoA recomendação é para uso dos tópicos, como ácido azelaico, metronidazol e ivermectina. Em casos selecionados, pode ser usada a isotretinoína em microdoses (20mg/semana), com rigoroso controle laboratorial e do risco de gravidez.
Tecnologia e cirurgiaVárias fontes de laser, luz intensa pulsada (LIP) e aparelhos emissores de luz podem ser usados no tratamento da rosácea. Radiofrequência, ultrassom, eletrocirurgia e microagulhamento também têm suas indicações.42,76,105–128
As maiores aplicações de tecnologias e dispositivos são para melhora do eritema, das telangiectasias e dos fimas.106,107
Três princípios são fundamentais no manuseio de lasers e LIP: escolher o comprimento de onda apropriado para o cromóforo alvo, escolher uma duração de pulso mais curta do que o relaxamento térmico desse cromóforo e energia suficiente para destruir o alvo em intervalo de tempo apropriado. Equipamentos novos têm capacidade de resfriamento robusta, energias altas em pulsos de curta duração e ponteiras maiores. Esses elementos representam efetividade, rapidez e segurança. Sobrepor pulsos e fazer múltiplas passadas também podem incrementar a eficácia.106,129
Luz intensa pulsada (LIP): está bem indicada no tratamento de telangiectasias. Pode ter alguma ação sobre o eritema, principalmente perilesional, nas pápulas e pústulas, dependendo do filtro de corte. Sintomas inflamatórios como prurido, edema, queimação, ardor e dor podem ser amenizados.59,106,107,111,122,130–137
O cromóforo alvo é a hemoglobina, seja a oxiemoglobina, presente em lesões de coloração vermelha, a hemoglobina desoxigenada, presente nas lesões azuladas, ou a meta‐hemoglobina. O mecanismo de ação é baseado na fototermólise ou dano térmico dos vasos, que induz coagulação intravascular.114,123,138–140
A LIP colaba vasos, remodela colágeno e reorganiza o tecido conjuntivo, ações que proporcionam longevidade dos efeitos induzidos por essa tecnologia.139,141
As lesões são tratadas com um ou dois pulsos, até o início do vasoespasmo, associado a um leve eritema e/ou edema. Não é desejada a ruptura do vaso, uma vez que isso leva à deposição de hemossiderina e possível hiperpigmentação cutânea. Telangiectasias localizadas nas asas nasais são mais resistentes e recidivantes.122,130
Sugere‐se o uso dos filtros de acordo com o fototipo. Caso não seja notada vasoconstricção, aumenta‐se a energia e em seguida, se necessário, diminui‐se a duração do pulso. Em geral, redução do spot requer aumento da energia (fluência maior) e vice‐versa. Comprimentos de onda mais longos são eficazes para o tratamento de vasos mais profundos, enquanto os mais curtos têm como alvo vasos mais superficiais. São necessárias múltiplas sessões, no mínimo de três, com intervalos de 1−3 semanas.110,142
Pulsed dye laser (PDL) (585nm ou 595nm): bem indicado no eritema e na telangiectasia. A introdução da configuração de pulsos mais longos entre 20−40ms reduziu a ocorrência de púrpura e hiperpigmentação e manteve a eficácia.110,111,133,137,143–145
ND: YAG de pulso longo (1,064nm): boa eficácia no tratamento da telangiectasia facial. Em vasos mais profundos e em telangiectasias maiores do que 1mm, mostrou‐se superior à LIP. Estudos relatam certa eficácia no tratamento de pápulas e pústulas.106,111,120,133,146–149
Potássio‐titanil‐fosfato (KTP) (532nm): são mais efetivos em telangiectasias pequenas e superficiais. Seu uso é limitado nos fototipos mais altos pelo risco de hiperpigmentação.111,143,150–155
Laser de alexandrita (755nm): são menos usados na rosácea, mas têm potencial em telagiectasias subdérmicas.111,121
Laser pro‐yellow/laser amarelo: laser 577nm emissor de energia luminosa 100% amarela. Um estudo da Turquia referiu eficácia do seu uso no tratamento do eritema e telangectasias faciais na rosácea.156
Diodo emissor de luz (LED): sua ação advém da irradiação não térmica de baixa intensidade, com modificação de atividade celular e efeito anti‐inflamatório. Tem indicação suplementar em eritema e lesões inflamatórias.111,133,157–166
Radiofrequência: faz parte do espectro eletromagnético e fornece energia na forma de eletricidade. Tem efetividade variável no tratamento do eritema facial, lesões papulopustulosas e rinofima.113,115,167,168
Ultrassom: o aparelho usado na dermatologia é similar ao usado para exame de imagem, mas sua energia é altamente convergente e tem frequências mais altas. Há relatos de melhoria do eritema e telangiectasias na rosácea.111,169,170
Eletrocirurgia: pode ser empregada em baixas configurações para tratar telangiectasias, mas existe o risco de danos térmicos, com cicatrizes pontuadas ou lineares.115
Microagulhamento: com ou sem entrega transdérmica de agentes ativos na pele através de microcanais (drug delivery), pode melhorar o eritema e telangiectasia na rosácea. A injúria deve ser leve a moderada. Os ativos mais citados são toxina botulínica e ácido tranexâmico, que age pela restauração da permeabilidade cutânea e supressão da angiogênese.125–128,171–174
Terapia fotodinâmica (TFD): estudos com múltiplas fontes de luz e laser para ativação do ácido aminolevulínico tópico na TFD para tratamento da rosácea resultaram em respostas divergentes, desde pouco significativas até eficazes.175–178
Tratamento dos fimasFimas não inflamatórios: representam um desafio terapêutico; nenhum método é adotado universalmente como padrão‐ouro.42,106,107,153,153,171,179–188
São preferidas as técnicas que causem menores danos às estruturas anexiais, juntamente com custos e tempo de cirurgia mínimos. Cada método apresenta graus variados de risco, relacionados a pouca hemostasia, retirada insuficiente de tecido e formação de cicatrizes. Os tratamentos podem ser em excisionais ou ablativos.182,183
ExcisionaisAs técnicas envolvem cirurgia convencional, com escultura dos fimas por shaving, tesoura, lâmina de bisturi e/ou eletrocoagulação, eletrocirurgia com fio em alça, radiofrequência e ablação com laser.
A excisão cirúrgica é a base do tratamento para o rinofima. Pode ser dividida em quatro etapas principais: delaminar/decorticar o excesso de tecido fimomatoso, refinar o contorno nasal, hemostasia e cuidados pós‐operatórios.42,106,182–185 Inúmeros relatos refinam a retirada de tecido fimatoso com dermoabrasão. Os principais riscos são sangramento intraoperatório, cicatrizes inestéticas e retirada demasiada de tecido.42,106,182,183,189–192
AblativosLaser CO2 (10.640nm): usado no modo ablativo convencional ou fracionado, neste caso nos fimas leves, com mais sessões para resultado satisfatório.42,106,133,182 Apesar do risco de despigmentação permanente, alterações de textura e cicatrizes, os resultados cosméticos costumam ser bons.111,114,143,182,193–195
Laser Er‐Yag (Erbium: Yttrium‐Aluminum‐Garnet) (2.940nm): como o laser CO2, induz altas temperaturas no alvo, resultando em vaporização e correção ablativa do fima.42,114
Dermoabrasão: isolada ou associada a outros métodos, promove excelente resposta.196–202
Ácido tricloroacético (30%, 50%, 70% ou 90%): isolado ou associado, geralmente com a dermoabrasão e/ou exérese tangencial proporciona resultados favoráveis.179,183,189,203,204
Criocirurgia com nitrogênio líquido: age por ação direta do congelamento e pela formação de trombos vasculares.202
Toxina botulínicaTem sido recentemente empregada no tratamento de eritema, rubor e lesões inflamatórias da rosácea, principalmente quando outras terapias são ineficazes. Sua aplicação é intradérmica para evitar disfunção muscular. Deve ser usada em diluições maiores e até o momento seu mecanismo de ação ainda é controverso.76,112,133,171,205–212
Postula‐se que ocorra a inibição da liberação de neuropeptídios associados à vasodilatação e inflamação, tais como a acetilcolina e peptídeo intestinal vasoativo, ou que a toxina impeça a liberação de neuropeptídios envolvidos na atividade sebácea, homeostase vascular e inflamação, como a substância P, calcitonina e glutamato.120,178
Os benefícios terapêuticos podem resultar de efeitos bloqueadores da acetilcolina nos músculos eretores do pelo e receptores muscarínicos das glândulas sebáceas. A melhora relatada em relação ao eritema, rubor e à inflamação decorre da interrupção da liberação da acetilcolina nos nervos periféricos autonômicos do sistema vasodilatador cutâneo, juntamente com a inibição da liberação de mediadores inflamatórios.120,213
Em 2004, em relato de caso, após falha de PDL para eritema persistente, um grupo aplicou toxina botulínica tipo A (BTX‐A) na região centrofacial, diluindo 100U em 5mL de soro fisiológico 0,9% (SF=0,9%) numa proporção de 2U por 0,1mL, em intervalos de 1cm, somando 10 U (0,5mL) em cada hemiface. O desfecho foi melhora dos sintomas.209
Dayan et al., em 2012, em estudo, injetaram toxina onabotulínica em 13 pacientes portadores de rosácea, diluíram 100U em 7mL de SF=0,9%, resultando 1,4U para cada 0,1mL. Em cada ponto de injeção, foi aplicado 0,05mL do produto, espaçados em 0,5cm, somando 8 a 12U por hemiface. Diminuição do eritema transitório, eritema persistente e inflamação foram observados já após uma semana, com resultados mantidos por três meses.112,211
Outro relato denominou Mesobotox para a técnica de microinjeção de BTX‐A e associou a LIP no tratamento da rosácea, com boa resposta. O frasco foi reconstituído em 10mL de SF=0,9%. Cada hemiface recebeu oito pontos de 0,1mL de BTX‐A (1U de BTX‐A por injeção para uma dose total de 8U), com 2cm de espaçamento. A fronte também foi inoculada com cinco pontos de 0,1mL.214
A toxina abobotulínica A e a toxina incobotulínica A já foram relatadas em estudos de tratamento da rosácea, com resultados positivos.205,206,215,216
No Brasil, em 2018, um estudo foi conduzido com melhora do eritema transitório e persistente por cerca de seis meses, com uso de BTX‐ A em diluição de 100U/para 5mL de SF 0,9%, 0,2−0,5U por ponto de aplicação. Nesse estudo foram aplicadas injeções intradérmicas nas regiões malares, com intervalo de 0,5cm por ponto de aplicação, totalizando volume que variou de 6 a 15 unidades por região malar afetada (12−30 unidades totais, equivalentes a 0,6 a 1,5mL da diluição).213 Essa diluição e aplicação é a recomendada pelos autores deste consenso.
Eficácia similar foi observada em outro estudo brasileiro, que usou toxina onabotulínica A em pacientes com rosácea que apresentavam eritema e lesões inflamatórias, com boa resposta.217
Outros autores não foram capazes de reproduzir os benefícios da BTX‐A no eritema facial. Esses resultados díspares podem ser apenas reflexo de diferentes mecanismos fisiopatológicos e vários subtipos de rosácea.207,218
Qualidade de vidaComo a rosácea afeta áreas visualmente aparentes da pele, geralmente causa um forte impacto na qualidade de vida dos pacientes, com frequência subestimado pelos dermatologistas. Estudos comprovam que a doença pode levar a depressão, ansiedade, vergonha, baixa autoestima e fobia social.219–221
O estresse pode ser um fator desencadeante, e está relacionado à desregulação vascular e à imunidade da pele resultante da liberação de neuropeptídeos após estímulos excessivos dos nervos. Portanto, o não controle dos sintomas pode agravar o estresse, resultando num ciclo vicioso.219–221
O RosaQol é um instrumento de avaliação de qualidade de vida específico para rosácea, que consiste em questionário com 21 perguntas. Alguns estudos sugerem que o RosaQol oferece alta confiabilidade e validade, além de alta consistência com o DLQI aceito internacionalmente; no entanto, outros autores não corroboram dessa afirmação.52,222 O RosaQol já foi traduzido e validado para o português do Brasil e deve ser considerado como parâmetro de eficácia em futuros estudos clínicos.223
ComorbidadesOutrora considerada como um distúrbio limitado à pele, a rosácea vem sendo descrita em associação a doenças sistêmicas.224–226
Em 2015, Hua et al., em um importante estudo, descreveram a rosácea como “doença inflamatória sistêmica”, que apresenta similaridades com a psoríase em relação ao risco de doença cardiovascular (CV), possivelmente por ambas as doenças apresentarem alteração da imunidade inata, aumento de catelicidinas e proteína C‐reativa, além de diminuição da atividade da paroxonase, que são fatores preditores de eventos CV. Concluíram que pacientes com rosácea devem ser alertados sobre possíveis comprometimentos CV, sobretudo em relação à hipertensão arterial, dislipidemia e doença coronariana.226
Mais recentemente, além das doenças CV, outras desordens têm sido descritas associadas à rosácea: doenças neurodegenerativas (doença de Parkinson, esclerose múltiplas, Alzheimer), desordens neurológicas (enxaqueca, glioma), desordens psiquiátricas (depressão, ansiedade, distúrbio obsessivo compulsivo, fobia social, estresse), doença intestinal (doença de Crohn, retocolite ulcerativa, doença celíaca, disbiose, infecção por H. pylori, supercrescimento bacteriano no intestino delgado), doenças oncológicas (câncer de tireoide, mama, hepático, tumores de pele não melanoma), doenças autoimunes (diabetes mellitus, artrite reumatoide, esclerose múltipla, alopecia frontal fibrosante), entre outras.224,224–242
Na tentativa de explicar a coexistência dessas doenças sistêmicas com a rosácea, estudos têm sido desenhados, buscando elementos afins, tais como o compartilhamento de fatores genéticos, ambientais, características imunológicas e celulares. No entanto, novas pesquisas são necessárias para a consolidação dessas associações.224,225,229,243,244
Os médicos devem estar cientes da possibilidade de comorbidades, manter‐se atentos e vigilantes, uma vez que há a possibilidade de a rosácea representar apenas a ponta do iceberg em relação ao comprometimento sistêmico do paciente.
Considerações finaisPor ser uma doença inflamatória crônica, com distintas manifestações clínicas e sem possibilidade de cura até o momento, o manejo terapêutico da rosácea representa um grande desafio.
Este consenso brasileiro, elaborado por cinco especialistas da Sociedade Brasileira de Dermatologia, visa a orientar o dermatologista na abordagem terapêutica da rosácea, fornecendo também subsídios atualizados sobre sua epidemiologia, fisiopatologia, manifestações clínicas, meios diagnósticos e comorbidades. Esses dados convergem na busca da melhora da qualidade de vida dos pacientes.
Diversos consensos, assim como revisão sistemática da biblioteca Cochrane, publicada em 2015 e atualizada em 2019, são encontrados na literatura recente sobre tratamento da rosácea. A revisão sistemática publicada em 2015 incluiu 106 estudos controlados e randomizados, com 13.631 pacientes, e a atualização em 2019 incluiu mais 46 estudos, total de 152 e 20.944 pacientes. As conclusões sobre os níveis de evidência foram: 1) alta para brimonidina e moderada para oximetazolina para redução temporária do eritema persistente; 2) baixa a moderada para laser e luz intensa pulsada para eritema e telangiectasias; 3) alta para ácido azeláico e ivermectina, moderada a alta para doxiciclina 40mg e isotretinoína, moderada para metronidazol tópico, minociclina tópica e oral (iguais à doxiciclina 40mg) e baixa para tetraciclina e minociclina em doses baixas para pápulas e pústulas; 4) moderada para ômega 3 oral e baixa para ciclosporina oftálmica em emulsão e doxiciclina para rosácea ocular; 5) associação de tratamentos tópico e sistêmico é útil; e 6) tratamento de manutenção é recomendado.245–248
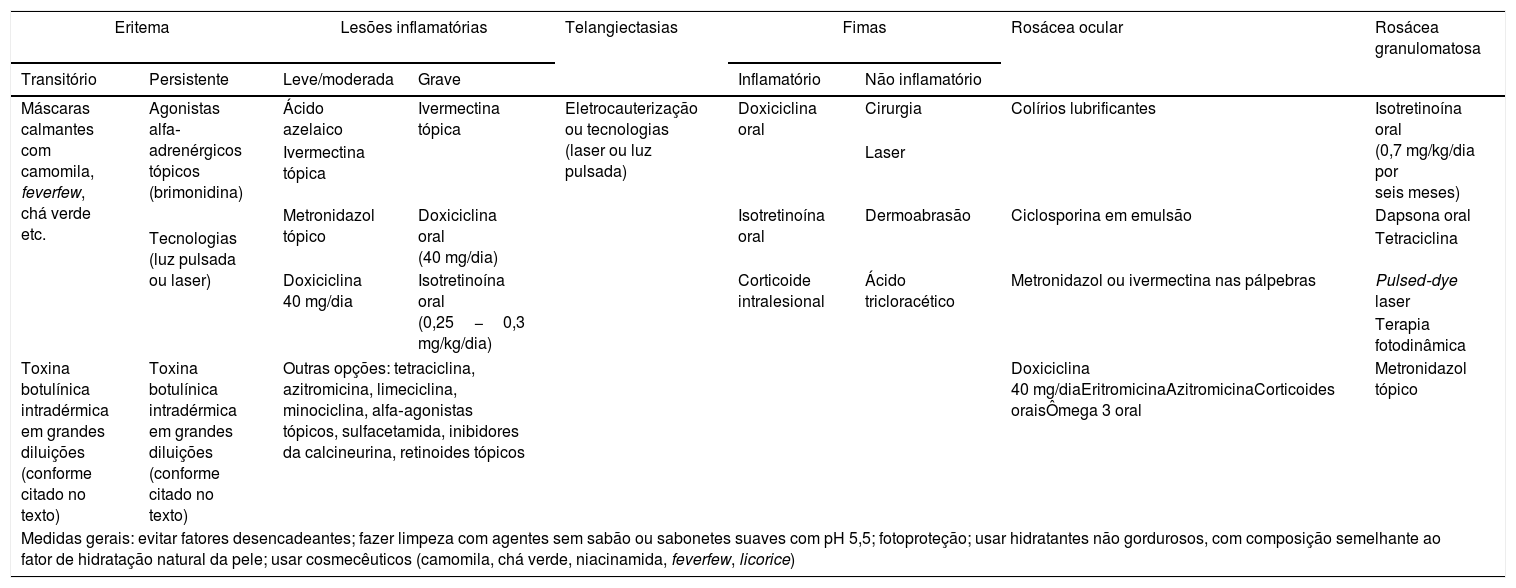
Baseados nas experiências pessoais, associadas às revisões da literatura, os autores deste consenso elaboraram uma tabela sobre as recomendações das opções de tratamento a serem usadas em cada manifestação clínica da rosácea. Essas recomendações estão resumidas na tabela 2.
Recomendações dos experts brasileiros sobre as opções terapêuticas na rosácea, de acordo com as manifestações clínicias
| Eritema | Lesões inflamatórias | Telangiectasias | Fimas | Rosácea ocular | Rosácea granulomatosa | |||
|---|---|---|---|---|---|---|---|---|
| Transitório | Persistente | Leve/moderada | Grave | Inflamatório | Não inflamatório | |||
| Máscaras calmantes com camomila, feverfew, chá verde etc. | Agonistas alfa‐ adrenérgicos tópicos (brimonidina) | Ácido azelaico | Ivermectina tópica | Eletrocauterização ou tecnologias (laser ou luz pulsada) | Doxiciclina oral | Cirurgia | Colírios lubrificantes | Isotretinoína oral (0,7 mg/kg/dia por seis meses) |
| Ivermectina tópica | Laser | |||||||
| Metronidazol tópico | Doxiciclina oral (40 mg/dia) | Isotretinoína oral | Dermoabrasão | Ciclosporina em emulsão | Dapsona oral | |||
| Tecnologias (luz pulsada ou laser) | Tetraciclina | |||||||
| Doxiciclina 40 mg/dia | Isotretinoína oral (0,25−0,3 mg/kg/dia) | Corticoide intralesional | Ácido tricloracético | Metronidazol ou ivermectina nas pálpebras | Pulsed‐dye laser | |||
| Terapia fotodinâmica | ||||||||
| Toxina botulínica intradérmica em grandes diluições (conforme citado no texto) | Toxina botulínica intradérmica em grandes diluições (conforme citado no texto) | Outras opções: tetraciclina, azitromicina, limeciclina, minociclina, alfa‐agonistas tópicos, sulfacetamida, inibidores da calcineurina, retinoides tópicos | Doxiciclina 40 mg/diaEritromicinaAzitromicinaCorticoides oraisÔmega 3 oral | Metronidazol tópico | ||||
| Medidas gerais: evitar fatores desencadeantes; fazer limpeza com agentes sem sabão ou sabonetes suaves com pH 5,5; fotoproteção; usar hidratantes não gordurosos, com composição semelhante ao fator de hidratação natural da pele; usar cosmecêuticos (camomila, chá verde, niacinamida, feverfew, licorice) | ||||||||
Nenhum.
Contribuição dos autoresClivia Maria Moraes de Oliveira Carneiro: Análise estatística; aprovação da versão final do manuscrito; concepção e planejamento do estudo; elaboração e redação do manuscrito; obtenção, análise e interpretação dos dados; participação efetiva na orientação da pesquisa; revisão crítica da literatura; revisão crítica do manuscrito.
Luiz Mauricio Costa Almeida: Aprovação da versão final do manuscrito; elaboração e redação do manuscrito; revisão crítica da literatura; revisão crítica do manuscrito.
Renan Rangel Bonamigo: Aprovação da versão final do manuscrito; elaboração e redação do manuscrito; revisão crítica da literatura; revisão crítica do manuscrito.
Carla Wanderley Gayoso de Lima: Aprovação da versão final do manuscrito; elaboração e redação do manuscrito; revisão crítica da literatura; revisão crítica do manuscrito.
Ediléia Bagatin: Aprovação da versão final do manuscrito; concepção e planejamento do estudo; elaboração e redação do manuscrito; revisão crítica da literatura; revisão crítica do manuscrito.
Conflitos de interesseOs membros desse consenso declaram que participaram de reuniões científicas, palestras e/ou receberam apoio para eventos dos seguintes laboratórios farmacêuticos: Clivia Maria Moraes de Oliveira Carneiro (Janssen, Novartis, Sanofi), Luiz Mauricio C Almeida (Galderma, Leo Pharma), Ediléia Bagatin (Leo Pharma, USK, Natura, Galderma, Pierre‐Fabre Dermo Cosmétique, Gelita, Douglas Pharmaceuticals). Renan Rangel Bonamigo e Carla Wanderley Gayoso de Lima declaram não haver conflitos de interesse.
Como citar este artigo: Oliveira CMM, Almeida LMC, Bonamigo RR, Lima CWG, Bagatin E. Consensus on the therapeutic management of rosacea – Brazilian Society of Dermatology. An Bras Dermatol. 2020;95:53–69.
Trabalho realizado na Sociedade Brasileira de Dermatologia, Rio de Janeiro, RJ, Brasil.