Esta publicação é uma atualização do “Consenso sobre o manejo terapêutico da dermatite atópica – Sociedade Brasileira de Dermatologia” publicado em 2019, considerando a aprovação de novas terapias sistêmicas direcionadas para a dermatite atópica (DA). As recomendações iniciais do consenso atual para tratamento sistêmico de pacientes com DA foram estabelecidas com base em revisão de literatura científica recente e consenso alcançado após votação. A Sociedade Brasileira de Dermatologia convidou 31 especialistas de todas as regiões do Brasil e duas especialistas internacionais em DA que contribuíram integralmente com o processo. Os métodos incluíram um estudo e‐Delphi (para evitar possível viés), pesquisa na literatura e uma reunião final de consenso. Os autores acrescentaram os novos medicamentos aprovados no Brasil, bem como a indicação de fototerapia e terapia sistêmica para DA. A resposta terapêutica ao tratamento sistêmico está documentada de maneira adequada para a prática clínica e faz parte deste manuscrito atualizado.
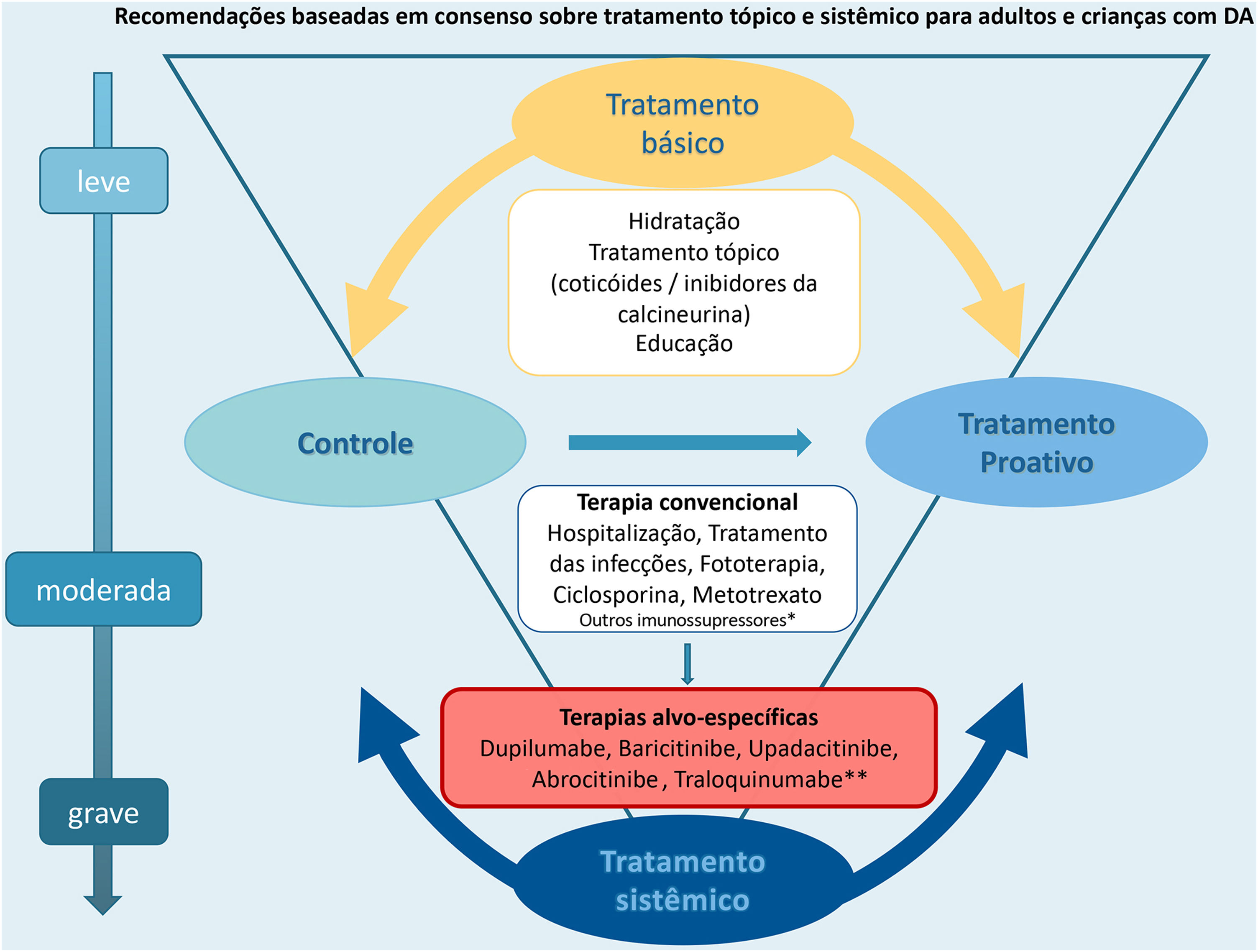
Por muitos anos, a terapia sistêmica convencional na dermatologia para tratar a dermatite atópica (DA) moderada a grave esteve limitada ao uso de ciclosporina, metotrexato, azatioprina, micofenolato de mofetila e glicocorticoides sistêmicos, com evidências insuficientes. A terapia sistêmica para DA é recomendada quando a doença não é controlada após uso de tratamento tópico com medicamentos anti‐inflamatórios, associados a medidas básicas, como a identificação de gatilhos, programas educacionais e fototerapia. Nesse contexto, devemos levar em consideração as preferências e a acessibilidade dos pacientes e dos cuidadores, avaliando o impacto da DA em sua vida pessoal, implicações financeiras e comorbidades associadas.1–4
Considerando‐se os desenvolvimentos atuais da terapia sistêmica da DA com a inclusão de terapias alvo‐específicas, a incorporação de medicamentos recém‐aprovados e atualizações sobre a indicação para a terapia sistêmica convencional, a realização deste estudo tornou‐se necessária. O objetivo deste consenso brasileiro é, portanto, fornecer orientação e recomendações sobre o manejo da fototerapia e terapia sistêmica para pacientes adultos e pediátricos com DA moderada a grave, bem como endossar a iniciativa HOME (harmonizing outcome measures for eczema),5 o COS (core outcome set) e instrumentos correspondentes de desfecho, por meio de consenso.6
MétodosA técnica Delphi é um método reconhecido e utilizado para se obter consenso entre especialistas em um campo específico, em que a opinião dos envolvidos é importante na formação de julgamentos. Essa abordagem oferece aos participantes a oportunidade de alterar sua resposta com base nas experiências de seus pares, aumentando assim a probabilidade de convergência de opinião.7,8 O processo é anônimo a fim de evitar que os participantes sejam influenciados pelas opiniões de seus colegas, evitando o viés de resposta.7,8 A técnica e‐Delphi é uma adaptação da metodologia Delphi, com inclusão de pesquisa com base na internet, o que permite ampliar a utilização dos benefícios e reduzir as limitações do Delphi tradicional.9
No consenso atual, o estudo consistiu na submissão de um questionário on‐line (com conteúdo embasado em revisão da literatura recente), seguido de uma reunião de consenso virtual, na qual as divergências finais foram resolvidas em votação, e concluído com um estágio de validação do consenso escrito por meio eletrônico.
Finalidade do consenso atualAtualização sobre o manejo da fototerapia e terapia sistêmica para DA moderada a grave (adultos e crianças)10 no Brasil.
Terminologia usadaAs recomendações utilizadas para o estudo de consenso (evidências e metas de tratamento) basearam‐se no consenso atualizado sobre terapia sistêmica para DA e as definições de metas de tratamento. As evidências para recomendações de tratamento basearam‐se no EDF (European Dermatology Forum) guidelines;11,12 Treat‐to‐Target em DA por De Bruin‐Weller M. et al.;13 NMA analysis (Systematic Review and Network Meta‐analysis) por Drucker A. M. et al.;4,14 Schünemann H. J. et al.;15 Guyatt G. H. et al.;16 iniciativa HOME5 e iniciativa International Eczema Council (IEC).17
Nomenclatura das recomendaçõesA nomenclatura das recomendações deste estudo, foi a mesma utilizada pelo Grupo GRADE15,16 e pela Diretriz Europeia sobre DA (Living EuroGuiDerm Guideline on atopic eczema) para o tratamento sistêmico do eczema atópico,11,12 com os termos: “Recomendamos” (forte recomendação para uso da intervenção; acreditamos que todas ou quase todas as pessoas informadas fariam essa escolha); “Sugerimos” (recomendação fraca para uso de uma intervenção; acreditamos que a maioria das pessoas informadas faria essa escolha, mas um número substancial não faria); “Sugerimos contra” (recomendação fraca contra o uso de uma intervenção); “Recomendamos contra” (forte recomendação contra o uso de uma intervenção). A força da recomendação é determinada pelo equilíbrio entre as consequências desejáveis e indesejáveis de estratégias alternativas de manejo, a qualidade da evidência, a variabilidade nos valores e preferências individuais.15,16
ParticipantesTrinta e um dermatologistas selecionados pela Sociedade Brasileira de Dermatologia (SBD) e dois especialistas internacionais em DA (com grande experiência em revisões sistemáticas, diretrizes internacionais e exercícios de consenso) participaram deste consenso. Os critérios de inclusão para os participantes foram certificação pela Sociedade Brasileira de Dermatologia (SBD) com experiência em DA e/ou no campo acadêmico, representando diferentes regiões do país.
Uma vez que o estudo não fazia parte de pesquisa médica envolvendo seres humanos, não houve necessidade de aprovação por Comitês de Ética.
Questionário e‐DelphiRLO, VA, DL, PS e LG elaboraram e revisaram o questionário, com base em dados científicos atuais e extensa revisão da literatura,4,5,11–16 na tentativa de preencher e atualizar possíveis lacunas do último consenso.10 O questionário consistiu de 31 perguntas (tabelas 1‐5), divididas em quatro domínios: implementação dos escores de avaliação do desfecho (core outcome set‐COS) com base em consenso internacional estabelecido pela iniciativa HOME;5 seleção de modalidades de tratamento sistêmico para pacientes com DA; necessidade de mudanças da terapia sistêmica com base nas metas de tratamento estabelecidas por um conselho internacional de eczema (Treat‐to‐Target);13,17 e introdução de terapias sistêmicas alvo‐específicas para adultos e crianças com DA moderada a grave.
Estudo e‐DelphiO estudo e‐Delphi foi realizado em duas rodadas. Na primeira rodada, os participantes votaram os questionamentos propostos. Os votos que atenderam o critério de concordância (acima de 75%) foram endossados e não foram disponibilizados para votação na rodada seguinte. As questões que não atingiram pelo menos 75% de concordância foram revisadas pelos coordenadores do projeto e reenviadas para nova rodada de votação, na qual os participantes puderam visualizar os resultados da votação da rodada anterior (de acordo com o anonimato e randomização do estudo Delphi, para evitar viés). As respostas foram pontuadas em uma escala de Likert de 1 a 9 (1 a 3: não é importante; 4 a 6: importante, mas não crítico; 7 a 9: crítico, com a opção adicional de incapacidade de avaliar), por meio da plataforma DelphiManager v5.0 (https://delphimanager.liv.ac.uk), com seleção de uma única escolha. O consenso para todas as questões foi considerado quando 75% ou mais dos participantes classificassem seu nível de concordância como 7, 8 ou 9, de acordo com a escala Likert. Para análise de dados e geração de gráficos, os autores utilizaram o software GraphPad Prism v9.1.4 (GraphPad Software, San Diego, CA, EUA).
Reunião para estabelecimento e validação do consenso escritoApós a segunda rodada, os participantes da SBD endossaram as questões que alcançaram consenso na reunião on‐line e discutiram as que não alcançaram consenso. Conforme descrito anteriormente, o consenso exigia pelo menos 75% de concordância sobre as questões propostas e todos os especialistas da SBD participaram das reuniões on‐line. Por fim, as questões do consenso, incluindo a revisão da literatura, foram compiladas na forma de manuscrito do consenso brasileiro atualizado para fototerapia e tratamento sistêmico da DA e validadas por e‐mail.
ResultadosO estudo e‐Delphi para estabelecimento de consenso, que conectou um grupo de médicos brasileiros de diferentes regiões do país com experiência consolidada no tratamento de pacientes com DA moderada a grave, chegou‐se com facilidade sobre um único conjunto de afirmações relacionadas a DA moderada a grave que requer terapia sistêmica.
Implementação de critérios diagnósticos e do core outcome set (COS) com base em consenso internacional estabelecido pela iniciativa HOMEO diagnóstico de DA é estabelecido com base em achados clínicos, de acordo com os critérios diagnósticos de Hanifin & Rajka,18 descritos na década de 1980 e amplamente reconhecidos.19 Em 1997, os critérios diagnósticos do Reino Unido foram introduzidos por Williams et al.20 como um refinamento dos critérios diagnósticos de Hanifin e Rajka para DA. Uma revisão sistemática comparando a validação de vários critérios diagnósticos para DA concluiu que os critérios diagnósticos do Reino Unido são os mais validados.19
A iniciativa HOME (www.homeforeczema.org) estabeleceu um conjunto de escores de desfechos, ou Core Outcome Set (COS), com base em consenso internacional estabelecido para ensaios clínicos: sinais relatados pelo clínico – EASI: índice de gravidade e área do eczema (escala que varia de 0 a 72, na qual 0 indica sem lesão; 0,1 a 1,0 quase sem lesão; 1,1 a 7 DA leve; 7,1 a 21 DA moderada; 21,1 a 50 DA grave;> 51 DA muito grave); sintomas relatados pelo paciente – POEM: medida de eczema orientado ao paciente, e NRS‐11: escala de avaliação numérica de pico de prurido nas últimas 24 horas; qualidade de vida – DLQI: índice de qualidade de vida em dermatologia (adultos), CDLQI (crianças) e IDQoL (lactentes) – qualidade de vida em pacientes pediátricos; controle de longo prazo – RECAP: instrumento para capturar a perspectiva do paciente sobre o controle do eczema ou ADCT: ferramenta de controle da DA. Para a prática clínica, os instrumentos recomendados para avaliar os sintomas relatados pelo paciente são: PO‐SCORAD (escore de dermatite atópica orientada para o paciente), POEM, NRS‐11 nas últimas 24 horas, questionário de prurido PROMIS® – NRS prurido média de uma semana e NRS pico de prurido de uma semana; para avaliar o controle da doença a longo prazo são: ADCT, RECAP e PGA (avaliação global do paciente).6,21 Ambos são estabelecidos com base em extensas revisões de literatura e reuniões de consenso, com participação de grupos internacionais.
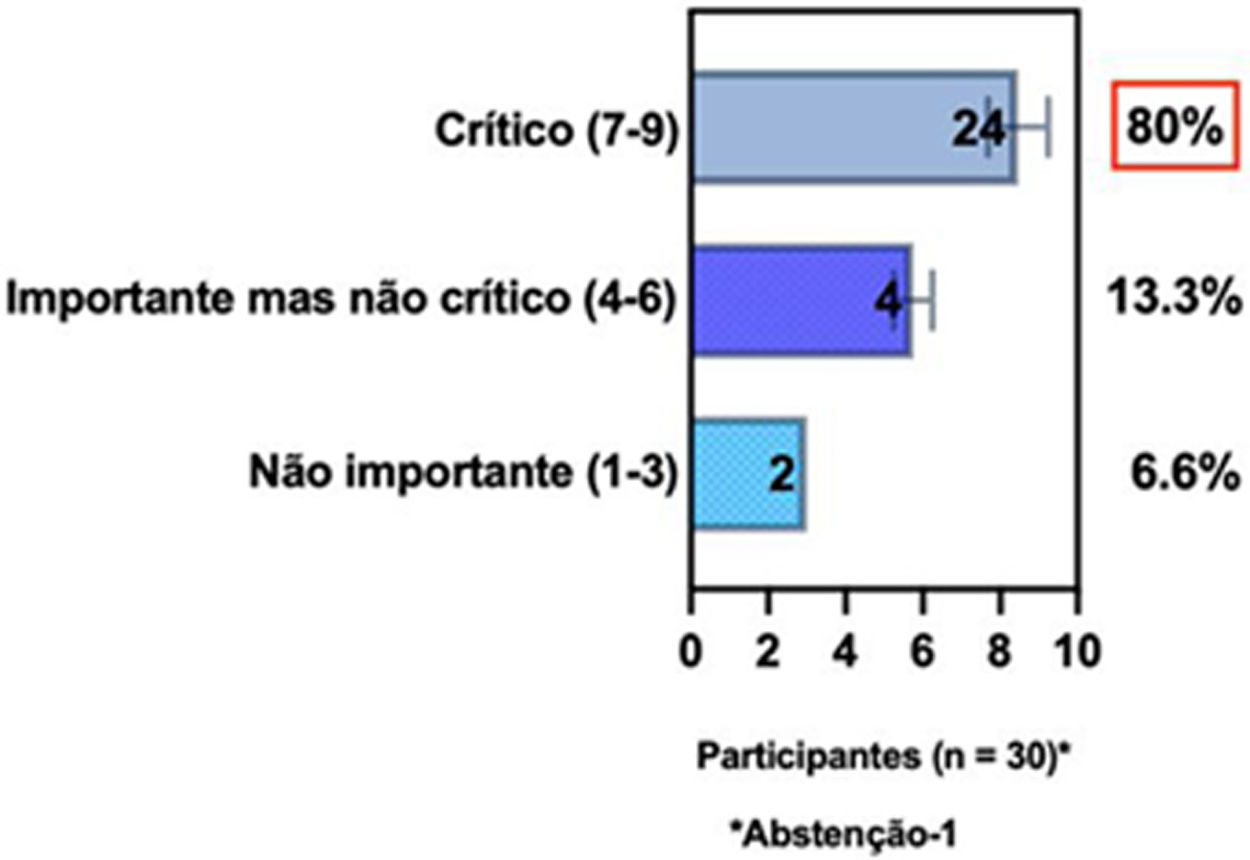
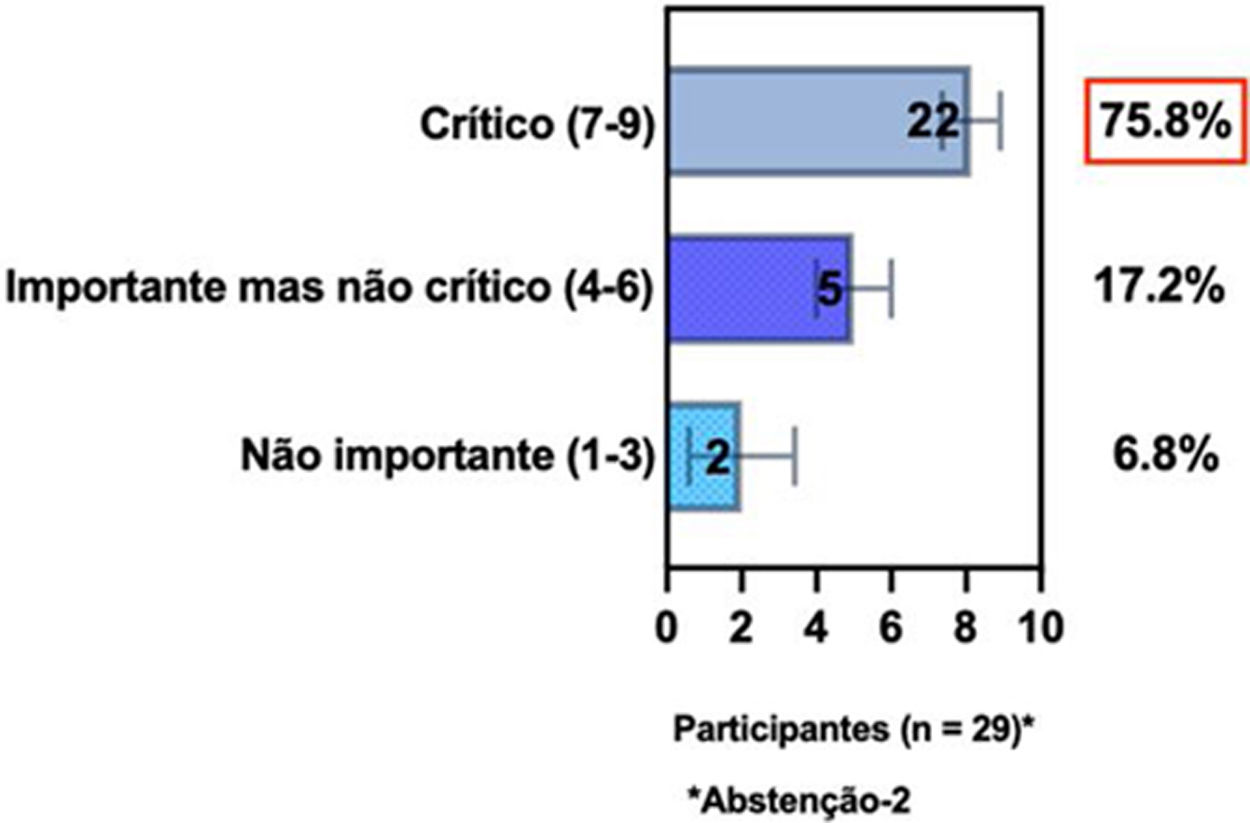
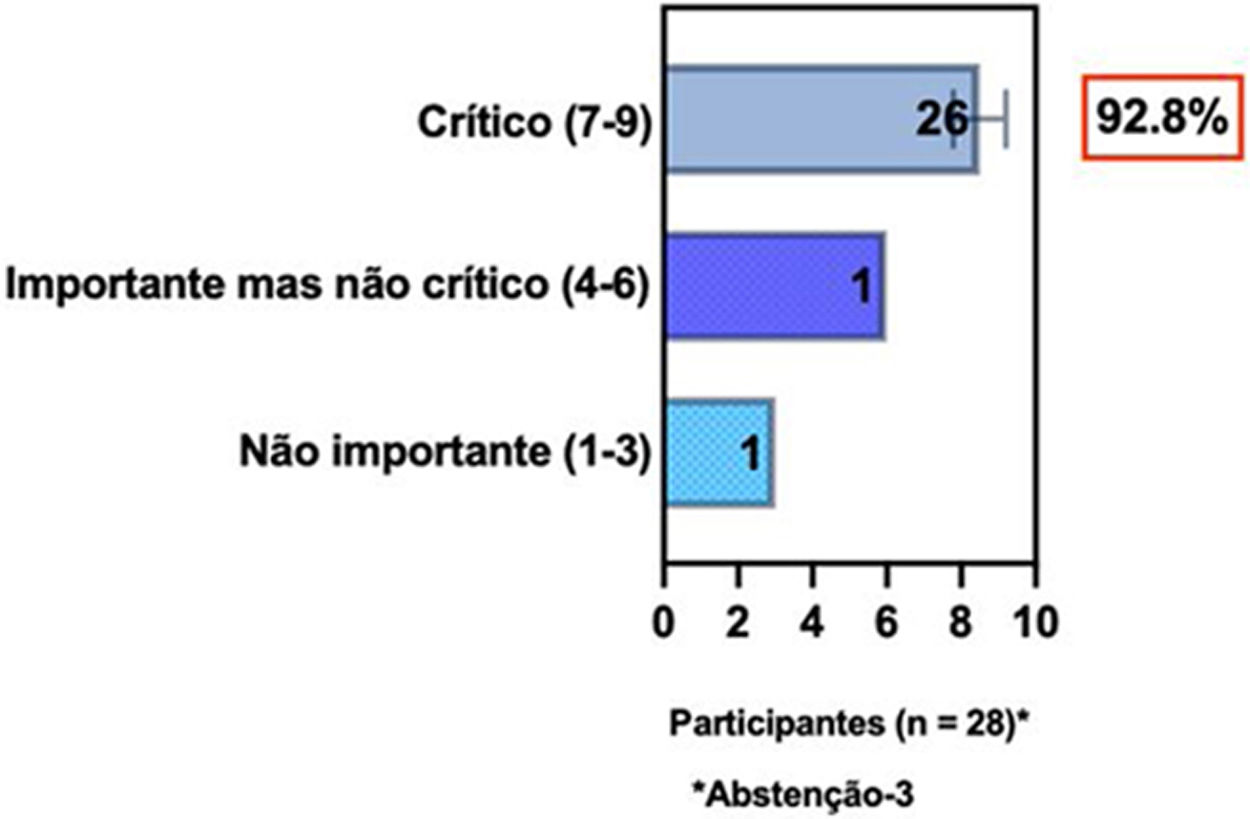
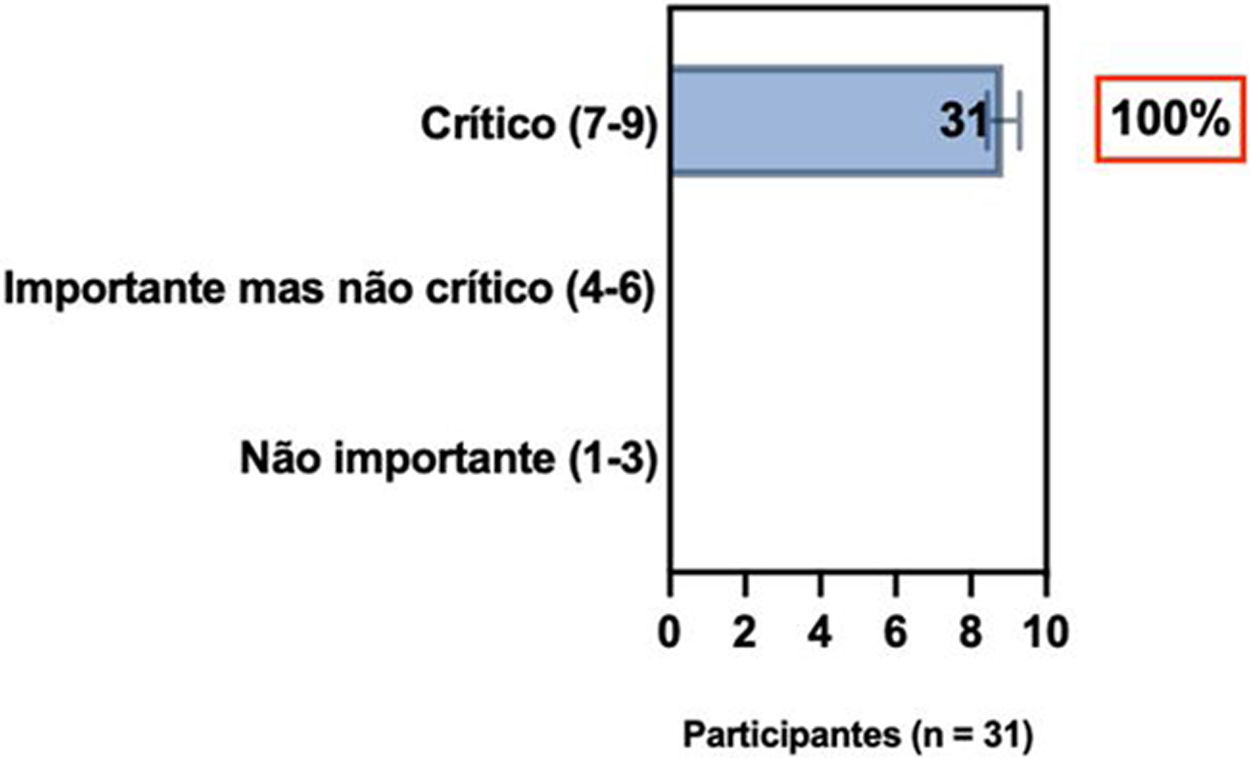
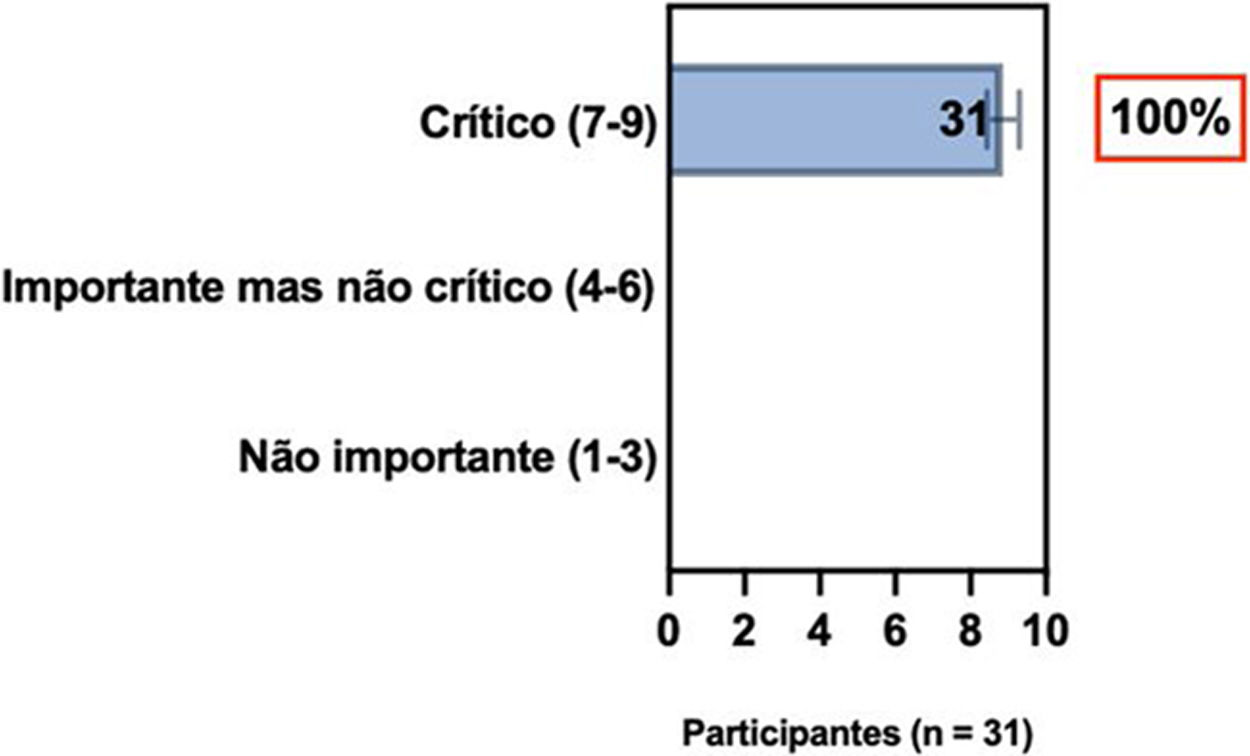
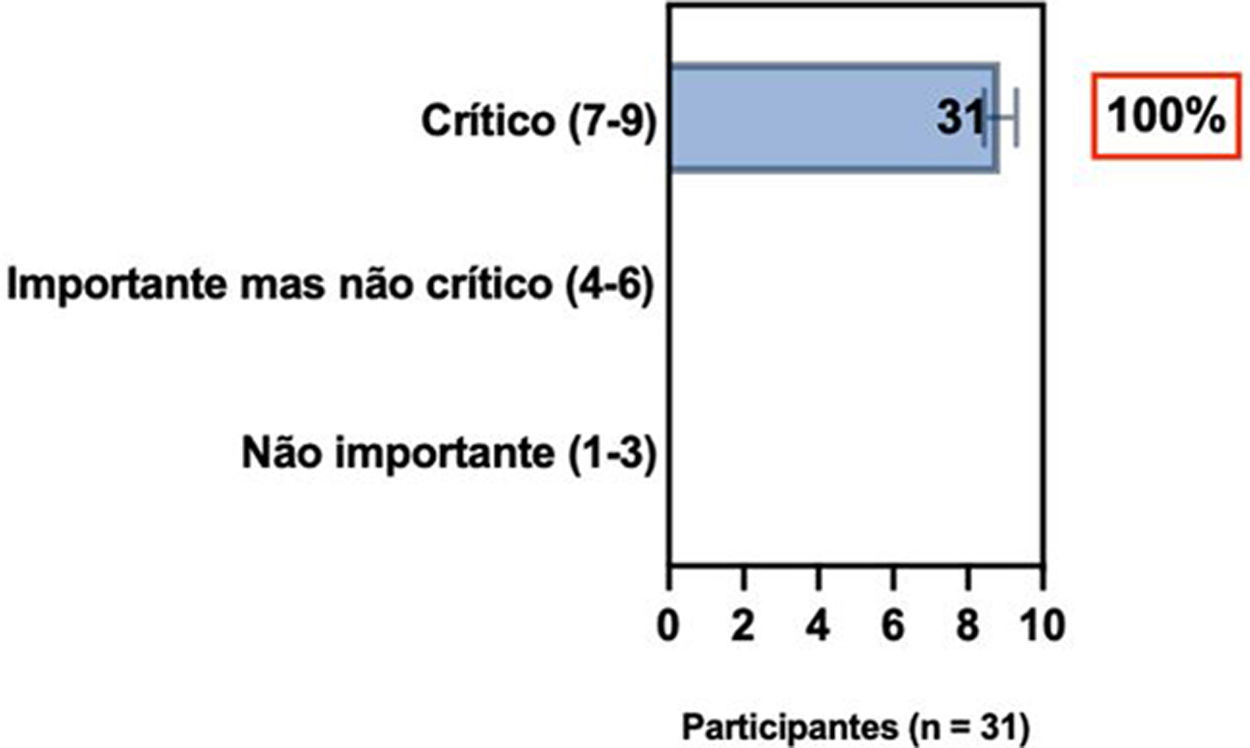
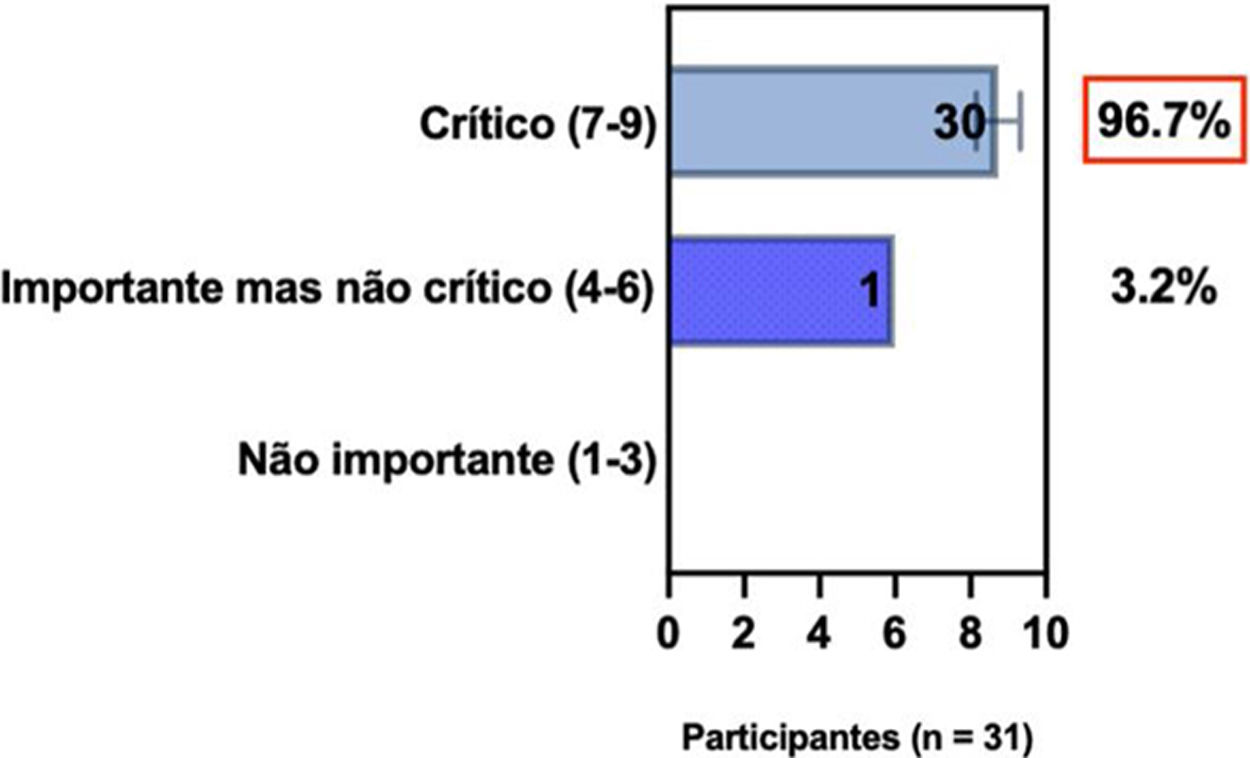
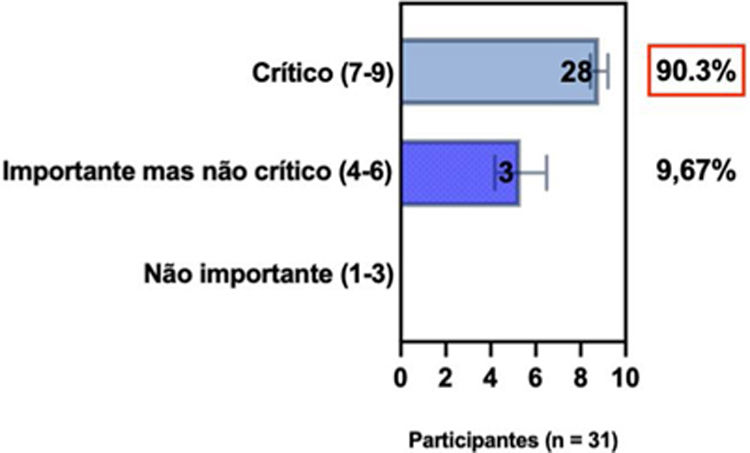
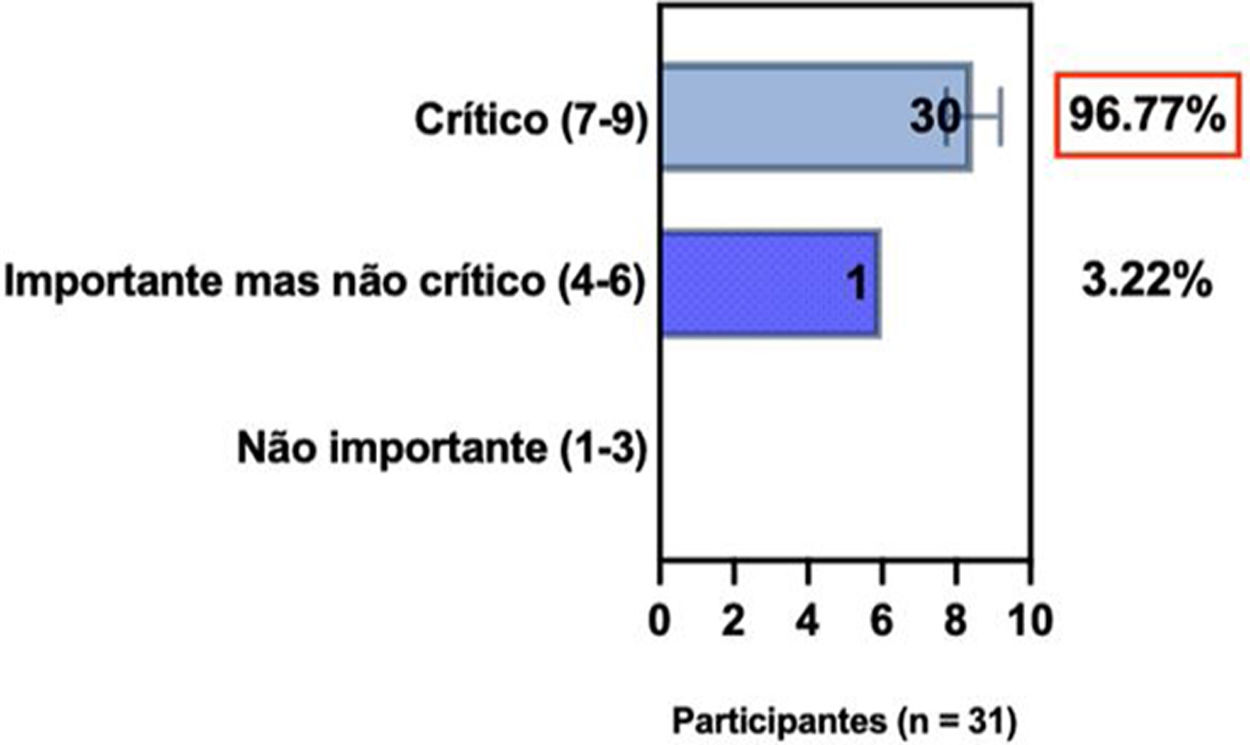
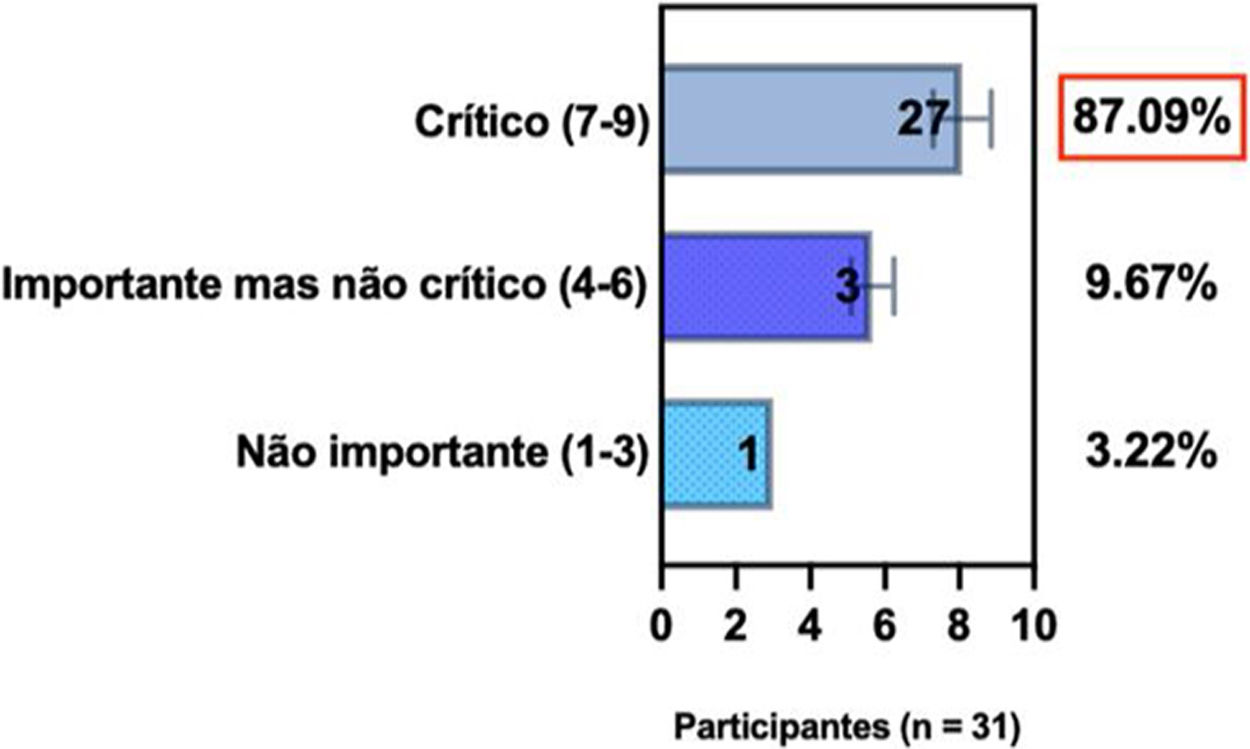
ConsensoNo atual consenso foram discutidos os dois critérios diagnósticos, e os especialistas da SBD concordaram (93,5% dos participantes) em recomendar e apoiar os dois critérios estabelecidos. Os especialistas da SBD recomendaram e apoiaram o uso do COS reconhecido pela iniciativa HOME (80% estão relacionados a instrumentos recomendados para avaliar os sintomas relatados pelo paciente e 75,8% a instrumentos para avaliar o controle da doença a longo prazo), e 92,8% para ensaios clínicos (tabela 1).5,18,20
Posição dos especialistas da SBD sobre os critérios diagnósticos da DA e sobre a implementação de conjunto de medidas baseadas em Consenso (COS) para a prática clínica e ensaios clínicos
| Questões discutidas | Votos dos especialistas da SBD |
|---|---|
| O diagnóstico de dermatite atópica (DA) será definido de acordo com critérios clínicos (Hanifin & Rajka18 ou critérios do grupo do Reino Unido – UK (Working group criteria)20 | |
| Para a prática clínica, os instrumentos recomendados para avaliar os sintomas relatados pelo paciente são: PO‐SCORAD; POEM; NRS‐11 nas últimas 24 horas; Questionário de Prurido PROMIS® –NRS prurido média de uma semana e NRS pico de prurido de uma semana5 | |
| Para a prática clínica, os instrumentos recomendados para avaliar o controle da doença a longo prazo são: ADCT, RECAP e PGA5 | |
| Os seguintes domínios e instrumentos de desfecho central devem ser avaliados e relatados em todos os estudos clínicos: sinais relatados pelo clínico – EASI; sintomas relatados pelo paciente – POEM; NRS‐11 nas últimas 24 horas; qualidade de vida – DLQI (adultos); CDLQI e IDQoL (pacientes pediátricos); controle de longo prazo – RECAP ou ADCT5 |
DA, dermatite atópica; PO‐SCORAD, dermatite atópica orientada para o paciente; POEM, medida de eczema orientado ao paciente; NRS‐11, Escala de Avaliação Numérica de Pico de Prurido; PROMIS, sistema de informação de resultados relatados pelo paciente; ADCT, ferramenta de controle da dermatite atópica; RECAP, instrumento (questionário de sete itens) para capturar a perspectiva de um paciente sobre o controle do eczema; PGA, avaliação global da gravidade da doença do paciente; DLQI, Índice de Qualidade de Vida em Dermatologia; CDLQI, Índice de Qualidade de Vida em Dermatologia Infantil; IDQol, Índice de Qualidade de Vida da Dermatite Infantil.
Uma das indicações para o tratamento sistêmico em pacientes com DA moderada a grave inclui a ausência de resposta às terapias tópicas. Antes de iniciar o tratamento sistêmico, é imprescindível evitar fatores agravantes, diagnosticar e tratar infecções secundárias e descartar possíveis diagnósticos diferenciais. A escolha da terapêutica sistêmica deve também incluir uma avaliação criteriosa sobre o impacto da doença na qualidade de vida do doente e dos riscos e benefícios da medicação escolhida, devendo ser uma decisão compartilhada entre o paciente e o médico.10,11,13,17 A escolha do manejo terapêutico sistêmico deve ser embasada de acordo com a faixa etária (lactentes, crianças, adolescentes, adultos e idosos com comorbidades associadas).3,13,22–25
As opções de terapias sistêmicas convencionais para DA incluem ciclosporina (CsA), metotrexato (MTX), azatioprina (AZA), micofenolato de mofetila (MMF) e glicocorticoides sistêmicos. Essas terapias foram discutidas no consenso brasileiro anterior.10 No presente consenso, foram atualizadas as recomendações sobre CsA, MTX e glicocorticoides sistêmicos. As recomendações para AZA e MMF permanecem conforme discutidas no último consenso10 e não serão abordadas nesta publicação em virtude da falta de atualizações recentes relacionadas a esses medicamentos.2,4,11,26
Em decorrência do desenvolvimento de novos medicamentos sistêmicos para a DA, as opções terapêuticas convencionais e fototerapia, bem como suas indicações, tiveram que ser repensadas e adaptadas para uma estratégia terapêutica individualizada para pacientes não responsivos ao tratamento convencional e/ou tópico, ou fototerapia, com enfoque na manutenção, modificação ou descontinuação do tratamento sistêmico.1,13
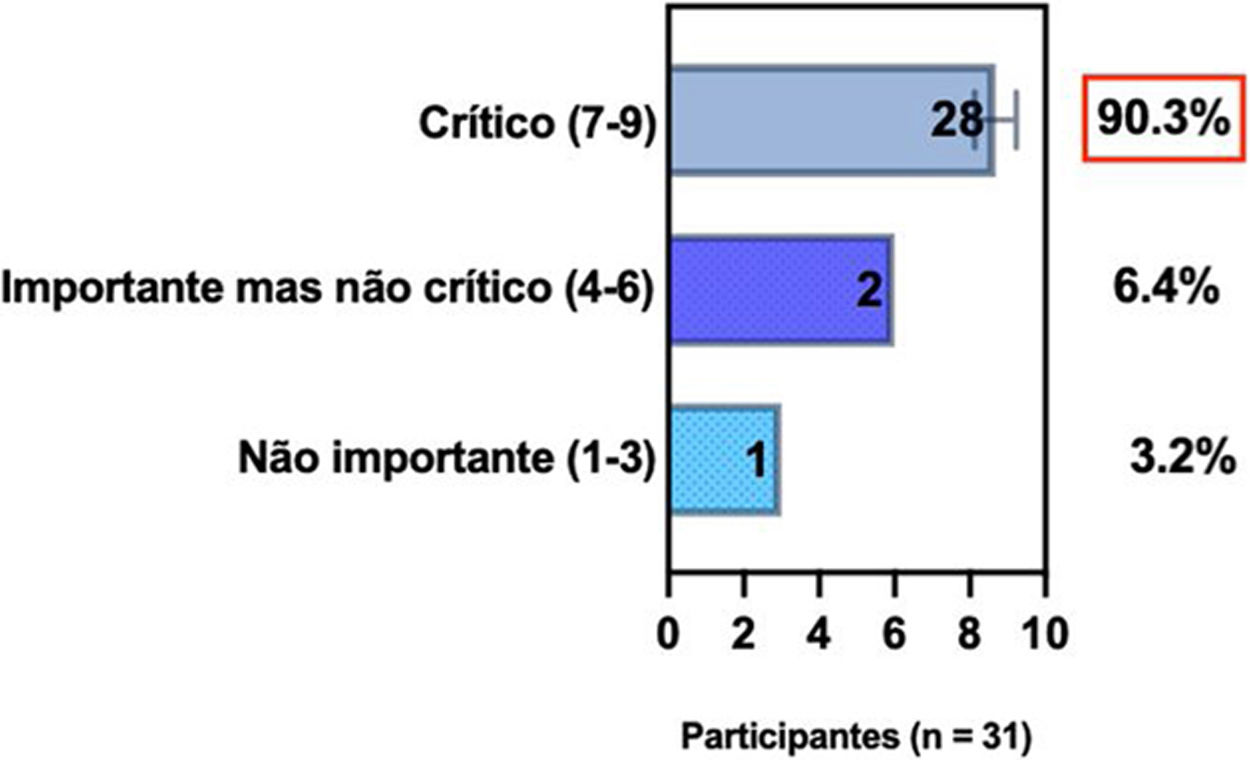
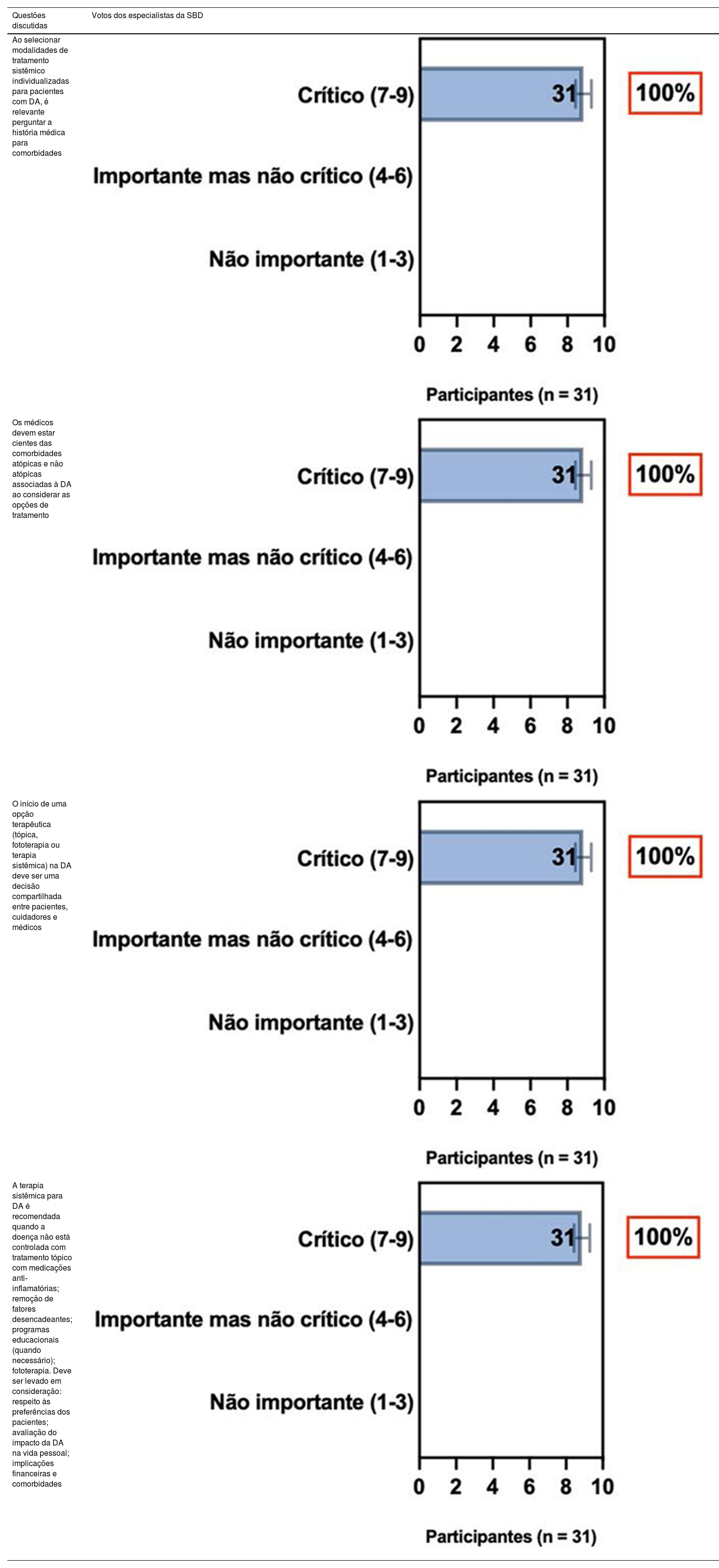
ConsensoA totalidade dos especialistas da SBD recomenda que, ao selecionar modalidades individualizadas para tratamento sistêmico de pacientes com DA, é relevante avaliar o histórico médico de comorbidades (bem como gravidez, desejo de ter filhos e idade), detectar comorbidades atópicas e não atópicas associadas à DA ao considerar opções de tratamento, e tomada de decisão compartilhada entre pacientes, cuidadores e médicos. A terapia sistêmica é recomendada quando a DA é refratária e quando há redução da qualidade de vida do paciente associada ao impacto da doença e implicações financeiras, bem como na presença de comorbidades, a despeito de adesão adequada ao tratamento tópico com anti‐inflamatórios, retirada de fatores desencadeantes, programas educacionais e fototerapia (tabela 2).
Posição dos especialistas da SBD sobre escolha de opções de tratamento sistêmico individualizadas para pacientes com DA
| Questões discutidas | Votos dos especialistas da SBD |
|---|---|
| Ao selecionar modalidades de tratamento sistêmico individualizadas para pacientes com DA, é relevante perguntar a história médica para comorbidades | |
| Os médicos devem estar cientes das comorbidades atópicas e não atópicas associadas à DA ao considerar as opções de tratamento | |
| O início de uma opção terapêutica (tópica, fototerapia ou terapia sistêmica) na DA deve ser uma decisão compartilhada entre pacientes, cuidadores e médicos | |
| A terapia sistêmica para DA é recomendada quando a doença não está controlada com tratamento tópico com medicações anti‐inflamatórias; remoção de fatores desencadeantes; programas educacionais (quando necessário); fototerapia. Deve ser levado em consideração: respeito às preferências dos pacientes; avaliação do impacto da DA na vida pessoal; implicações financeiras e comorbidades |
DA, dermatite atópica.
A fototerapia é uma opção terapêutica adjuvante, especialmente para as formas subagudas de DA. Ela é útil para o controle do prurido e melhora a condição da pele de pacientes que não respondem a medicamentos e hidratantes tópicos.27,28 A fototerapia também atua como opção terapêutica adjuvante válida, especialmente para a DA crônica, pois controla os sinais clínicos, reduz a colonização bacteriana por Staphylococcus aureus e Pityrosporum orbiculare e melhora a insônia; também é uma medida para poupar o uso de corticosteroides.27,29,30
Diferentes comprimentos de onda podem ser usados para tratar a DA: ultravioleta B (UVB), UVB de banda estreita (UVB‐NB), laser/luz Excimer (308 nm), ultravioleta A‐1 (UVA‐1 340 a 400 nm) em altas e médias doses e a combinação de psoralenos e UVA (PUVA).31‐34 UVB‐NB (311 a 313 nm) é a modalidade mais utilizada e pode ser indicada para crianças e para mulheres grávidas.35,36 UVA‐1 é útil para casos pouco responsivos e para controle de crises, mas é pouco disponível no Brasil.12,27,37
SegurançaA evidência sobre a segurança da fototerapia em pacientes com DA é modesta em virtude da escassez de dados de ensaios cínicos randomizados (ECR) ou registros com grandes coortes de pacientes ou seguimento de longo prazo.11
Os eventos adversos agudos relacionados à fototerapia são relacionados com temperatura elevada, ardor, eritema e queimaduras. Entretanto, os eventos adversos mais relevantes da fototerapia são aqueles causados pela exposição UV crônica, tais como lentigos, ceratose actínica, fotoenvelhecimento e câncer de pele.38 O acompanhamento de pacientes submetidos à UVB‐NB não conseguiu demonstrar aumento da ocorrência de câncer de pele não melanoma em comparação com a população em geral.12,37 Não há estudos descritos de acompanhamento a longo prazo relacionados ao aparecimento de neoplasias malignas após tratamentos com UVA‐1.32
Em pacientes em uso de imunossupressores sistêmicos (p. ex., CsA e AZA), a fototerapia não é recomendada em virtude do risco de carcinogênese.11,39 Também se recomenda evitar a fototerapia em pacientes com risco de infecção recorrente pelo vírus do herpes simples ou história de eczema herpético.10 A combinação de UVB‐NB com corticosteroides tópicos ou inibidores de calcineurina tópicos é considerada segura.11
EvidênciaAs indicações da fototerapia para o tratamento da DA são, em grande parte, empíricas e fundamentadas em poucos estudos baseados em evidências.1 Uma revisão sistemática incluiu 19 ECRs e sugeriu que tanto UVB‐NB quanto UVA‐1 são as opções de fototerapia mais eficazes no tratamento de pacientes com DA.27 Um estudo recente investigou a resposta ao prurido em pacientes com DA tratados com UVB‐NB e CsA, demonstrando que a UVB‐NB reduziu o prurido de maneira significante, quando comparado à CsA.28
Uma revisão da Cochrane avaliando os efeitos da fototerapia no tratamento da DA incluiu 32 estudos com 1.219 participantes randomizados. Os resultados indicaram que, quando comparado ao placebo ou a nenhum tratamento, a UVB‐NB melhorou os sinais avaliados pelo médico, os sintomas relatados pelo paciente e a IGA (avaliação global do investigador) após 12 semanas de tratamento, sem diferença nos casos de retirada em decorrência de eventos adversos. O nível de evidência para UVA‐1 em comparação com UVB‐NB ou PUVA, e UVB‐NB comparado com PUVA foi muito baixo.40
MonitoramentoO guia prático de fototerapia da SBD preconiza a indicação de avaliação oftalmológica antes do tratamento e a cada seis meses, com investigação complementar de anticorpos antinucleares (FAN) e anti‐Ro (SS‐A) antes do início do tratamento em pacientes com histórico de fotossensibilidade.41
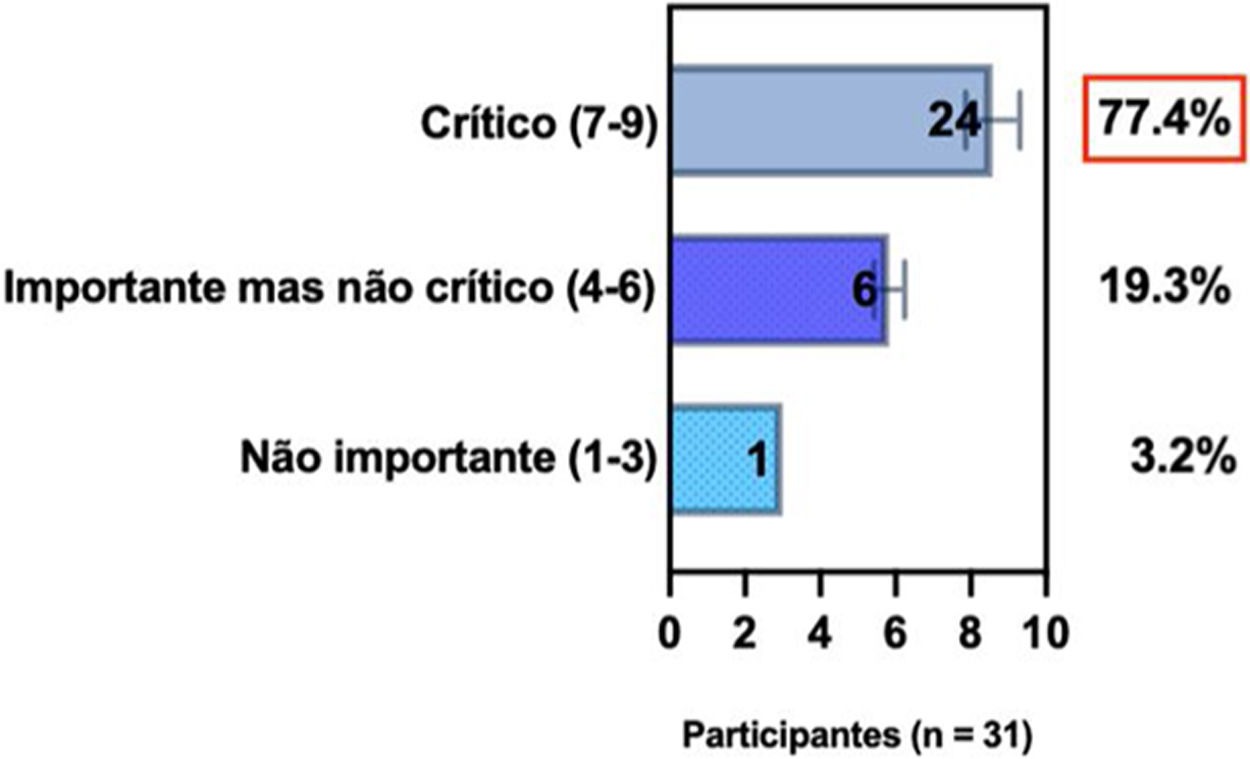
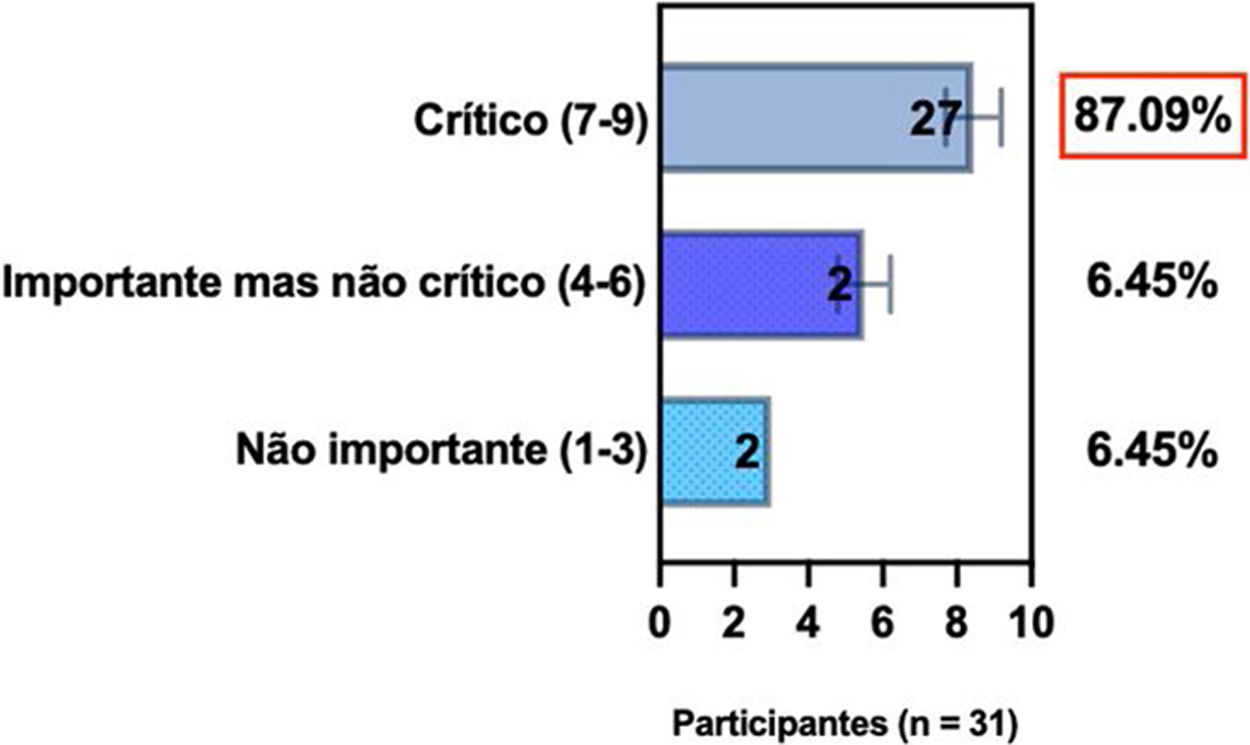
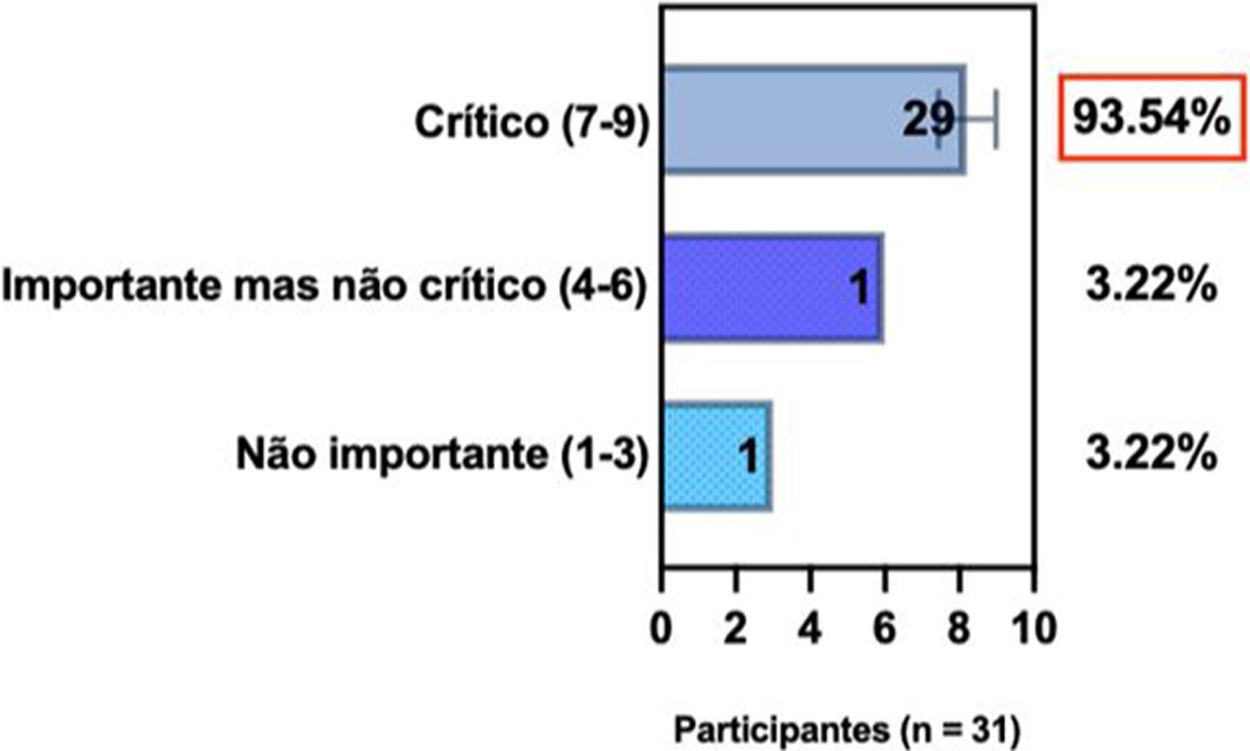
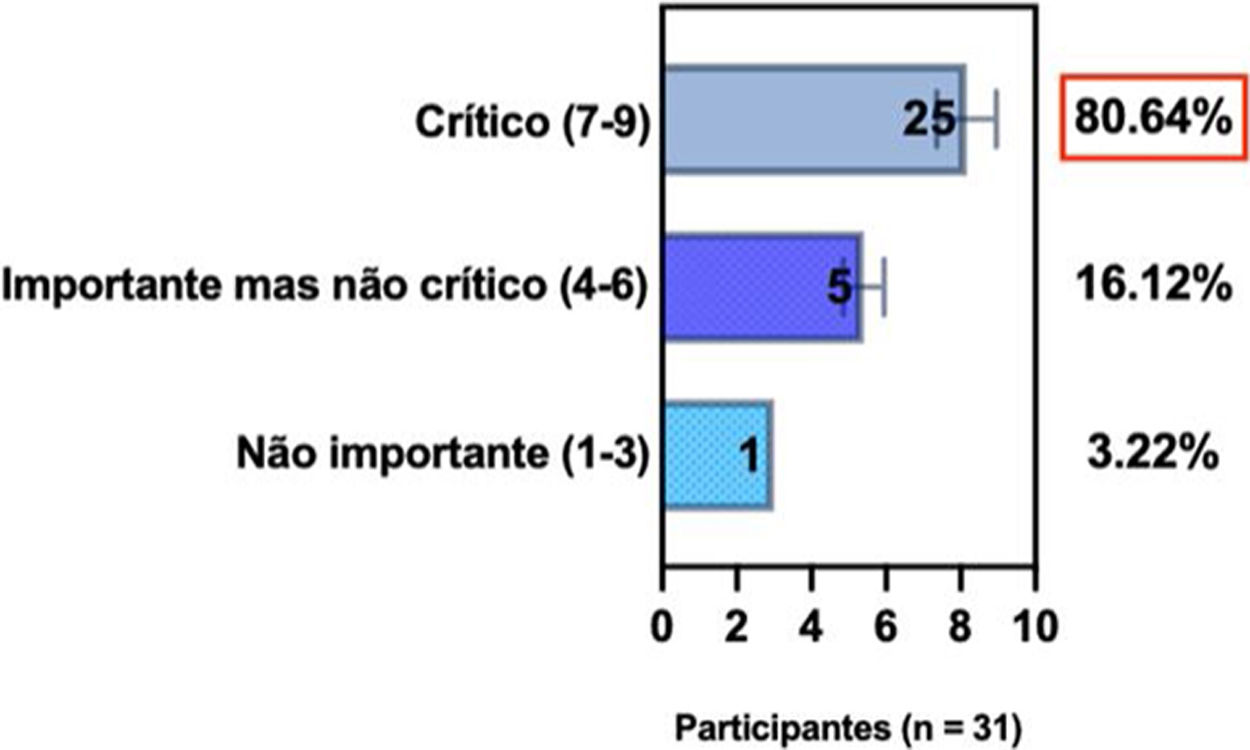
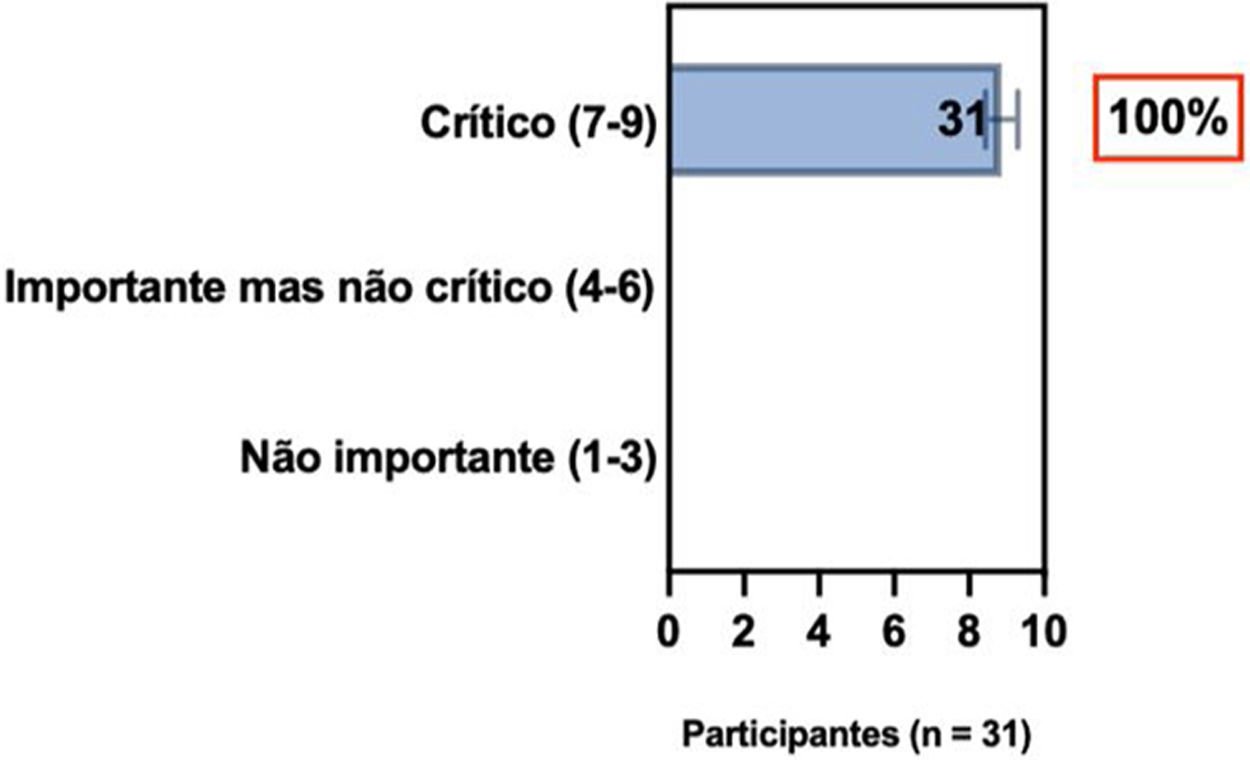
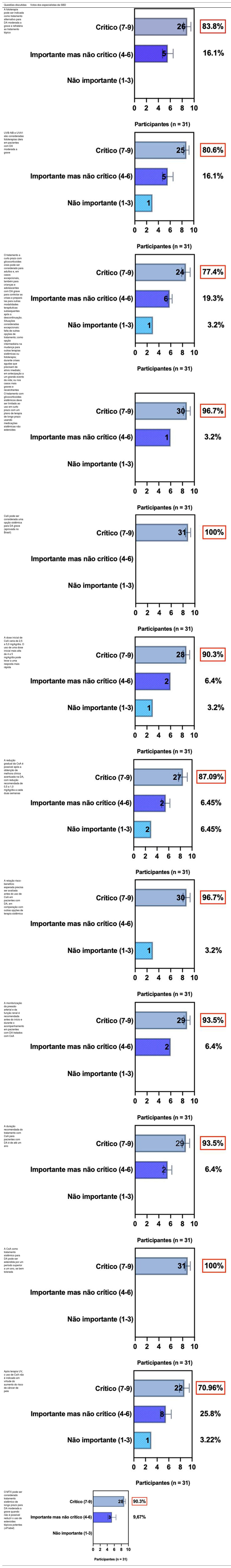
ConsensoUm total de 83,3% dos especialistas brasileiros recomedaram a fototerapia como tratamento alternativo para DA moderada a grave e refratária ao tratamento tópico, e 80,6% validaram e recomendaram NB‐UVB e UVA1 como fototerapias benéficas em pacientes com DA moderada a grave (tabela 3).
Posição dos especialistas da SBD sobre uso de fototerapia e terapia sistêmica convencional para DA
| Questões discutidas | Votos dos especialistas da SBD |
|---|---|
| A fototerapia pode ser indicada como tratamento alternativo para DA moderada a grave e refratária ao tratamento tópico | |
| UVB‐NB e UVA1 são consideradas fototerapias úteis em pacientes com DA moderada a grave | |
| O tratamento a curto prazo com glicocorticoides orais pode ser considerado para adultos e, em casos excepcionais, também para crianças e adolescentes com DA grave para controlar as crises e prepará‐las para outras modalidades terapêuticas subsequentes após a descontinuação. Situações consideradas excepcionais: falta de outras opções de tratamento; como opção intermediária na mudança para outras terapias sistêmicas ou fototerapia; durante crises agudas que precisam de alívio imediato; em antecipação a um grande evento da vida; ou nos casos mais graves e recalcitrantes | |
| O tratamento com glicocorticoides sistêmicos deve ser limitado ao uso em curto prazo com um plano de terapia de longo prazo usando medicações sistêmicas não esteroides | |
| CsA pode ser considerada uma opção sistêmica para DA grave (aprovada no Brasil) | |
| A dose inicial de CsA varia de 2,5 a 5,0 mg/kg/dia. O uso de uma dose inicial mais alta de 4 a 5 mg/kg/dia pode levar a uma resposta mais rápida | |
| A redução gradual da CsA é possível após a obtenção de melhora clínica acentuada na DA, com redução recomendada de 0,5 a 1,0 mg/kg/dia a cada duas semanas | |
| A relação risco‐benefício esperada precisa ser avaliada antes do uso de CsA em pacientes com DA, em comparação com outras opções de terapia sistêmica | |
| A monitorização da pressão arterial e da função renal é recomendada antes do início e durante o acompanhamento em pacientes com DA tratados com CsA | |
| A duração recomendada do tratamento com CsA para pacientes com DA é de até um ano | |
| A CsA como tratamento sistêmico para DA pode ser estendida por um período superior a um ano, se bem tolerada | |
| Após terapia UV, o uso de CsA não é indicado em virtude do aumento do risco de câncer de pele | |
| O MTX pode ser considerado tratamento sistêmico de longo prazo para DA moderada a grave quando não é possível reduzir o uso de esteroides tópicos potentes (off label) |
DA, dermatite atópica; NB‐UVB, ultravioleta B de banda estreita; UVA‐1, ultravioleta A‐1; CsA, ciclosporina; MTX, metotrexato.
Os glicocorticoides são hormônios esteroides que exercem importante efeito anti‐inflamatório por meio de mecanismos celulares e moleculares. A ligação do glicocorticoide a seu receptor no citoplasma da célula resulta na ativação do complexo receptor‐glicocorticoide, que por sua vez atua na regulação de genes relacionados à expressão de citocinas e à apoptose celular.42 As proteínas resultantes dessa ativação induzem a resposta aos glicocorticoides, que pode ser inibidora ou estimuladora, dependendo do gene específico e do tecido afetado. Assim, os efeitos negativos na expressão genética contribuem para a resposta anti‐inflamatória e imunossupressora dos glicocorticoides.43,44
SegurançaA terapia sistêmica com corticosteroides, especialmente em altas doses e uso prolongado, pode levar a múltiplos efeitos colaterais: supressão do crescimento em crianças, osteoporose, insuficiência suprarrenal, síndrome de Cushing, hipertensão, diabetes, gastrite, alterações de comportamento, infecções oportunistas, glaucoma, catarata, hiperlipidemia, trombose, distúrbios do sono, dentre outros.45
EvidênciasApesar do uso frequente de corticosteroides sistêmicos no tratamento da DA e da melhora a curto prazo dos sinais e sintomas clínicos, há poucos ECRs que indiquem seu uso frequente na DA.45,46 Além dos efeitos adversos causados pelo uso prolongado dos corticosteroides sistêmicos, temos que considerar o fenômeno de rebote, ou seja, o agravamento acentuado da doença após a descontinuação da terapia.11,43,47 Artigos recentes, incluindo revisão sistemática (Cochrane), entre outros, não apontam de maneira clara o uso de corticosteroides sistêmicos na DA.48,49
MonitoramentoConsiderando esse contexto e reconhecendo a cronicidade da doença, o uso de corticosteroides sistêmicos deve ocupar apenas um pequeno espaço no tratamento da DA. Os corticosteroides sistêmicos são recomendados para terapia de curto prazo como medicamento de resgate rápido ou servem de medicação de transição para a introdução de outras terapias. O uso a longo prazo deve ser evitado, e até contraindicado, pois não propicia remissão estável e segura da DA. Avaliando‐se riscos×benefícios para o paciente com DA, apresenta‐se como muito desfavorável ao paciente.45,47
ConsensoOs especialistas da SBD sugerem que o tratamento de curto prazo com glicocorticoides orais pode ser considerado para adultos e, em casos excepcionais, também para crianças e adolescentes com DA grave para controlar as crises e prepará‐los para outras modalidades terapêuticas subsequentes após a descontinuação, associado a um plano de terapia de longo prazo usando medicações sistêmicas não esteroides. Situações consideradas excepcionais: falta de outras opções de tratamento; transição para outras terapias sistêmicas ou fototerapia; uso durante crises agudas que necessitam de alívio imediato; em antecipação a um grande evento de vida; ou nos casos mais graves (tabela 3).
CiclosporinaMecanismo de açãoA CsA é um potente imunossupressor, pois inibe a síntese de IL‐2, essencial para a antecipação e ativação de linfócitos, por meio da atração da via da calcineurina.50,51 Atualmente, é considerada opção de tratamento de primeira linha para pacientes com DA grave, independentemente da idade.11
A dose inicial é de 5mg/kg/dia, dividida em duas doses por até seis semanas ou até o controle adequado da DA. Durante a manutenção, ela é reduzida para 2,5 a 3mg/kg/dia, com duração de três a 12 meses.11 Se necessário, o uso de ciclosporina pode ser estendido além de um ano, se a condição clínica do paciente permitir.52 Recomenda‐se a retirada progressiva (redução de 0,5 a 1,0mg a cada duas semanas).50 O uso intermitente de CsA pode ser alternativa de tratamento em alguns casos.2,53
SegurançaA CsA apresenta meia‐vida plasmática de 24 horas, metabolismo hepático e eliminação biliar54 e acumula‐se nos tecidos em concentrações superiores em até três a quatro vezes com relação ao plasma, permanecendo acumulada no tecido linfomieloide e na gordura mesmo após sua suspensão.50,55,56 O efeito adverso mais comum e grave é a nefrotoxicidade, seguida de hepatotoxicidade, hipertensão, anorexia, letargia, hirsutismo, tremores, parestesias, hipertrofia gengival e distúrbios gastrintestinais, sem efeito depressor da medula óssea associado.50,55
EvidênciaOs resultados de metanálise de 39 ECRs que avaliou 6.360 pacientes analisando 20 medicamentos e placebo, comparando a eficácia e a segurança dos tratamentos imunomoduladores sistêmicos para pacientes com DA indicaram que dupilumabe e CsA foram igualmente eficazes para pacientes adultos com DA por até 16 semanas de tratamento e mais eficazes do que MTX e AZA. Ensaios clínicos adicionais são necessários para se estabelecer seguimento de longo prazo superior a 16 semanas.14 Embora novas modalidades de tratamento, como o dupilumabe, demonstrem melhores perfis de segurança, baixo custo e melhor disponibilidade são algumas razões para buscar aumento no nível de evidência de terapias sistêmicas convencionais como CsA.1
MonitoramentoComo primeiro passo, os médicos devem solicitar hemograma completo e exames laboratoriais para avaliação das funções renal e hepática, no início e após as primeiras quatro semanas de terapia, e depois a cada três meses. A triagem para hepatite B/C e HIV é recomendada, e quaisquer sinais de hipertensão ou níveis séricos elevados de creatinina requerem redução da dose e monitoramento.50 A nefrotoxicidade é mais frequente em idosos, em doses superiores a 5mg/kg/dia, em uso prolongado e em pacientes com elevação da creatinina sérica.55 As contraindicações são o uso concomitante de ciclosporina com fototerapia (aumento do risco de câncer de pele) e vacinas de vírus vivos atenuados.50 A ciclosporina não deve ser utilizada como substituto do tratamento tópico.50 É permitida na gravidez, com certo risco de baixo peso ao nascer, sem risco de malformação ou morte fetal.57
AprovaçãoA ciclosporina é aprovada no Brasil para crianças≥1 ano e adultos com DA.58
ConsensoOs especialistas da SBD recomendam e CsA como opção sistêmica para DA grave. A redução gradual da ciclosporina é possível após a obtenção de melhora clínica acentuada na DA, com redução recomendada de 0,5 a 1,0mg/kg/dia a cada duas semanas. A relação risco‐benefício esperada deve ser avaliada antes da introdução da CsA em pacientes com DA, em comparação com outras alternativas terapêuticas sistêmicas. Especialistas da SBD sugerem que a duração do tratamento com ciclosporina para pacientes com DA seja de até um ano, podendo ser estendida por um período superior a um ano, se bem tolerada (tabela 3).
MetotrexatoMecanismo de açãoO MTX age ligando‐se irreversivelmente à di‐hidrofolato redutase, impedindo a síntese de purina e timidina.59 Suas propriedades anti‐inflamatórias são explicadas pelo acúmulo intracelular de 5‐amino‐1‐β‐D‐ribofuranosil‐imidazol‐4‐carboxamida (AICAR), levando ao aumento da adenosina intra e extracelular, inibindo a quimiotaxia e adesão de neutrófilos, formação de ânion superóxido e secreção de citocinas pró‐inflamatórias. O MTX converte‐se em poliglutamato intracelularmente, e esse metabólito ativo apresenta tempo de ação muito maior do que a substância original,59,60 permitindo dosagem semanal com eficácia sustentada.59,61 O MTX foi utilizado pela primeira vez na psoríase, mas consiste em terapêutica eficaz e segura em várias doenças cutâneas, incluindo DA,62 dermatomiosite e líquen plano.63
A absorção oral do MTX é semelhante à das vias subcutânea (SC) e intramuscular (IM), até a dose de 15mg; doses superiores podem levar à perda de 30%. A via SC apresenta aumento da absorção proporcional ao aumento da dose.64 O MTX tem meia‐vida de 4 a 10 horas; 50% estão ligados a proteínas circulantes, e é eliminado principalmente pelos rins (70% a 90%), bile e leite materno.65,66 MTX não é mutagênico, embora seja abortivo e teratogênico, e esteja associado à oligospermia e ginecomastia.64,65
A dose terapêutica varia de 15 a 25mg/semana para adultos e 10 a 15mg/m2/semana para crianças (oral, intravenosa, IM ou SC).10,11 A administração de ácido fólico (1 a 5mg/dia, 1 a 6×/semana, exceto no dia da dose de MTX) é recomendada para evitar alterações gástricas e hematológicas.67
SegurançaOs efeitos colaterais são hematológicos (baixa contagem de células sanguíneas), intolerância gastrintestinal, insuficiência renal e hepatotoxicidade e, mais raramente, pneumonite aguda e fibrose pulmonar.59,68–70 A toxicidade se manifesta como mucosite, diarreia, ulceração de placas de psoríase, leucopenia e trombocitopenia.59,71 Ácido folínico é indicado como antídoto para superdosagem de MTX nas 24 horas iniciais, na dose de 10mg/m2.72
EvidênciaHá um número limitado de estudos controlados com o MTX.11 Uma revisão sistemática e metanálise mostraram que a eficácia do MTX foi comparável à AZA e inferior à do dupilumabe e da ciclosporina na semana 16,14 com redução média estimada do SCORAD de mais de 40% após 12 semanas de tratamento em pacientes com DA.48 Após 24 semanas de tratamento com MTX houve redução estatisticamente significante do EASI, do SCORAD e do prurido, com redução média de 46,7%, 33,6% e 39,1%, respectivamente, quando comparados aos valores basais;62 portanto, os estudos apontam o MTX como um medicamento moderadamente eficaz, relativamente seguro e bem tolerado no tratamento da DA moderada a grave.11
A combinação de MTX com corticosteroides tópicos, inibidores de calcineurina ou fototerapia UVB‐NB é estabelecida e considerada segura para o tratamento. O uso concomitante de ciclosporina é uma contraindicação relativa. A combinação de MTX e baricitinibe na artrite reumatoide apresentou perfil seguro.11
MonitoramentoAntes de iniciar o tratamento, deve‐se solicitar acompanhamento laboratorial: hemograma completo, função hepática e β‐HCG (para mulheres), sorologia para hepatites B e C, HIV, PPD e radiografia de tórax, de acordo com a população‐alvo.73 Os exames devem ser repetidos 15 a 30 dias após a dose inicial, com intervalo de um a três meses, de acordo com as medicações e comorbidades. Em caso de alteração persistente da função hepática, a medicação deve ser suspensa e o paciente deve ser avaliado por hepatologista.73
AprovaçãoO uso de MTX é off label (não aprovado em bula) para o tratamento da DA no Brasil, mas seu uso é reconhecido mundialmente em diretrizes, consensos e protocolos internacionais.4,13,14,17
ConsensoEspecialistas da SBD recomendam o MTX como opção de tratamento sistêmico de longo prazo para pacientes com DA moderada a grave, não respondedores a opções terapêuticas tópicas (tabela 3).
Quando devemos considerar a necessidade de mudanças na decisão da terapia sistêmica?O desenvolvimento de novas terapias sistêmicas direcionadas para DA moderada a grave criou demanda por um guia atualizado e prático no Brasil, considerando os problemas do país, incluindo a cobertura de medicamentos de alto custo por seguro privado ou fornecimento gratuito pelo sistema público de saúde local. Essa necessidade não atendida gerou a criação de um consenso internacional treat‐to‐target.13
As mudanças na terapia sistêmica devem ser feitas com base em tomadas de decisão, com cumprimento de metas para o tratamento após três e seis meses a partir do início do tratamento. As tomadas de decisão devem ser embasadas na melhora da Avaliação Global do Paciente (PGA), além de contemplar ao menos um domínio de resultado clínico específico.13
Para avaliação clínica dos resultados, os objetivos iniciais do tratamento (após três meses) devem atingir pelo menos EASI‐50 ou SCORAD‐50 (redução de 50% comparado com o valor basal); pico de prurido NRS (0 a 10): uma redução de pelo menos três pontos; DLQI: redução de pelo menos quatro pontos; POEM: uma redução de pelo menos quatro pontos. Após seis meses, as metas devem atingir pelo menos EASI‐75 (redução de 75% quando comparado com o valor basal) ou EASI ≤ 7; SCORAD‐75 ou SCORAD ≤ 24; NRS de pico de prurido (0 a 10): uma pontuação absoluta ≤ 4; DLQI: escore absoluto ≤ 5; POEM: pontuação absoluta ≤ 7.13
De acordo com a perspectiva do paciente e da PGA, a meta inicial aceitável do tratamento deve atingir uma redução de pelo menos um ponto na resposta global do paciente (p. ex., avaliação global autorreferida pelo paciente da gravidade da doença – PtGA 0 a 4) após três meses, e uma pontuação absoluta de ≤ 2 após seis meses.13
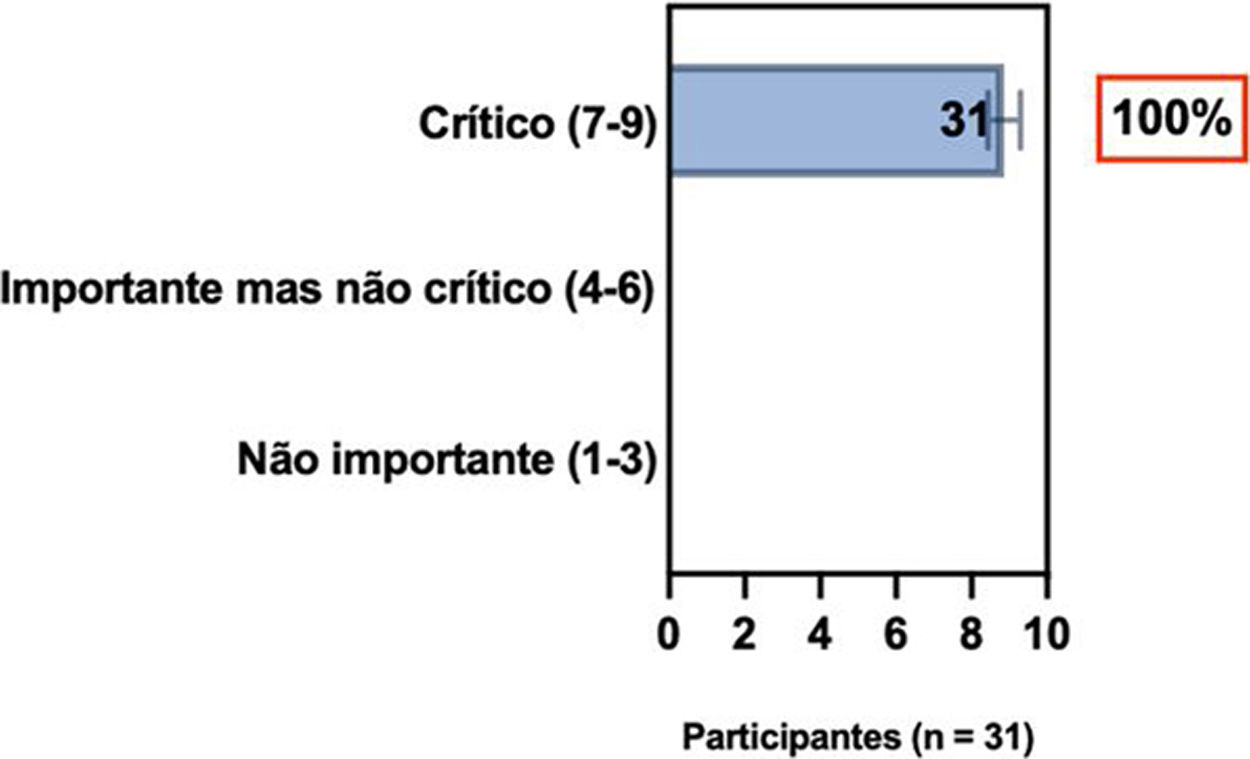
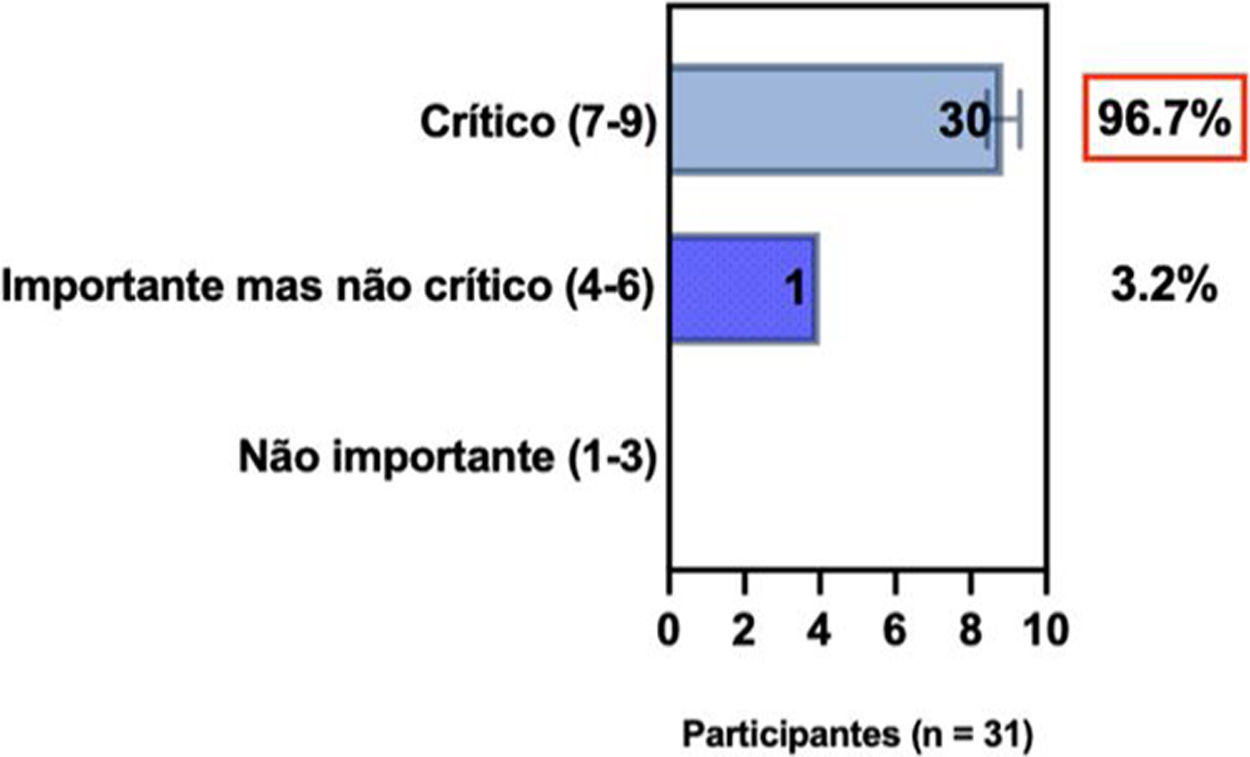
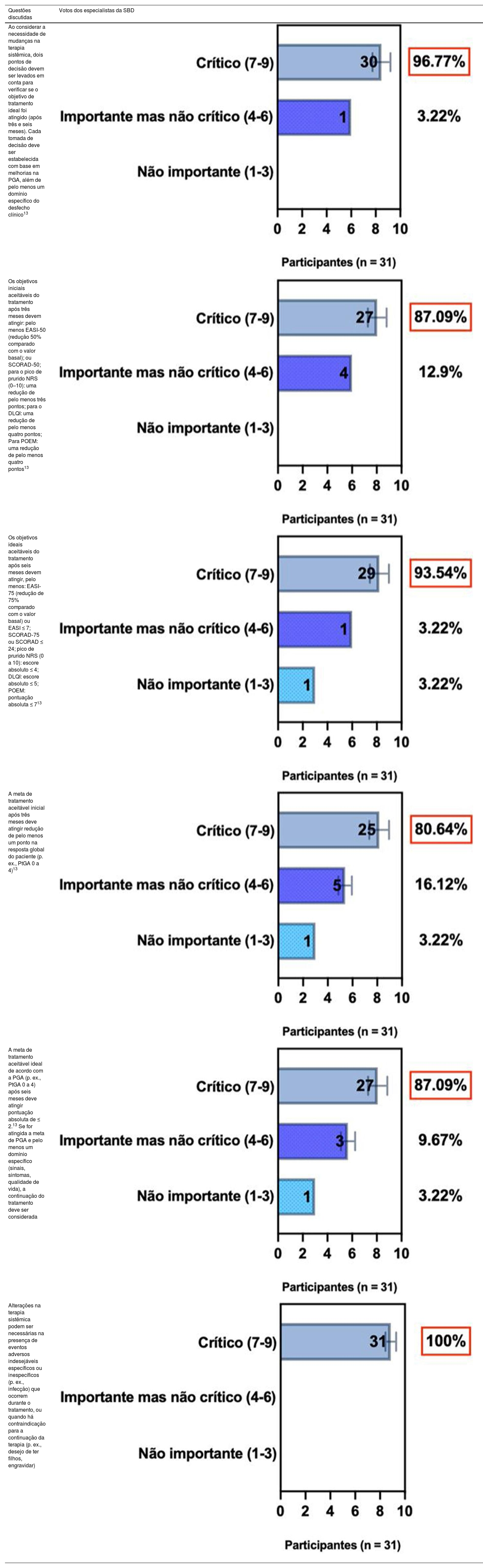
ConsensoOs especialistas da SBD recomendam e concordam com o consenso treat‐to‐target,13 conforme descrito na tabela 4,13 e sugerem que essas mudanças na terapia sistêmica também podem ser necessárias na presença de eventos adversos indesejáveis específicos ou inespecíficos (p. ex., infecção) ocorridos durante a terapia, ou quando houver contraindicação para continuar a terapia (p. ex., intenção de ter filhos; gestação).
Posição dos especialistas da SBD sobre a necessidade de mudanças na opção de terapia sistêmica para pacientes com DA
| Questões discutidas | Votos dos especialistas da SBD |
|---|---|
| Ao considerar a necessidade de mudanças na terapia sistêmica, dois pontos de decisão devem ser levados em conta para verificar se o objetivo de tratamento ideal foi atingido (após três e seis meses). Cada tomada de decisão deve ser estabelecida com base em melhorias na PGA, além de pelo menos um domínio específico do desfecho clínico13 | |
| Os objetivos iniciais aceitáveis do tratamento após três meses devem atingir: pelo menos EASI‐50 (redução 50% comparado com o valor basal); ou SCORAD‐50; para o pico de prurido NRS (0–10): uma redução de pelo menos três pontos; para o DLQI: uma redução de pelo menos quatro pontos; Para POEM: uma redução de pelo menos quatro pontos13 | |
| Os objetivos ideais aceitáveis do tratamento após seis meses devem atingir, pelo menos: EASI‐75 (redução de 75% comparado com o valor basal) ou EASI ≤ 7; SCORAD‐75 ou SCORAD ≤ 24; pico de prurido NRS (0 a 10): escore absoluto ≤ 4; DLQI: escore absoluto ≤ 5; POEM: pontuação absoluta ≤ 713 | |
| A meta de tratamento aceitável inicial após três meses deve atingir redução de pelo menos um ponto na resposta global do paciente (p. ex., PtGA 0 a 4)13 | |
| A meta de tratamento aceitável ideal de acordo com a PGA (p. ex., PtGA 0 a 4) após seis meses deve atingir pontuação absoluta de ≤ 2.13 Se for atingida a meta de PGA e pelo menos um domínio específico (sinais, sintomas, qualidade de vida), a continuação do tratamento deve ser considerada | |
| Alterações na terapia sistêmica podem ser necessárias na presença de eventos adversos indesejáveis específicos ou inespecíficos (p. ex., infecção) que ocorrem durante o tratamento, ou quando há contraindicação para a continuação da terapia (p. ex., desejo de ter filhos, engravidar) |
DA, dermatite atópica; PGA, avaliação global da gravidade da doença do paciente; EASI, área do eczema e índice de gravidade; SCORAD, SCORing Atopic Dermatitis; POEM, medida de eczema orientado ao paciente; DLQI, Índice de Qualidade de Vida em Dermatologia; PtGA, avaliação global da gravidade da doença autorreferida pelo paciente.
O arsenal de terapias sistêmicas alvo‐específicas para o tratamento da DA apresenta‐se em constante expansão. Estudo recente apresenta revisão sistemática e meta‐análise, avaliando a diferença média padronizada (SMD) de mudança nos sinais clínicos da DA. Por meio da escala SMD, o estudo permite a realização de comparações de dupilumabe e outras medicações alvo‐específicas com medicamentos sistêmicos convencionais para DA, uma vez que ainda não existem estudos head‐to‐head disponíveis.3,14
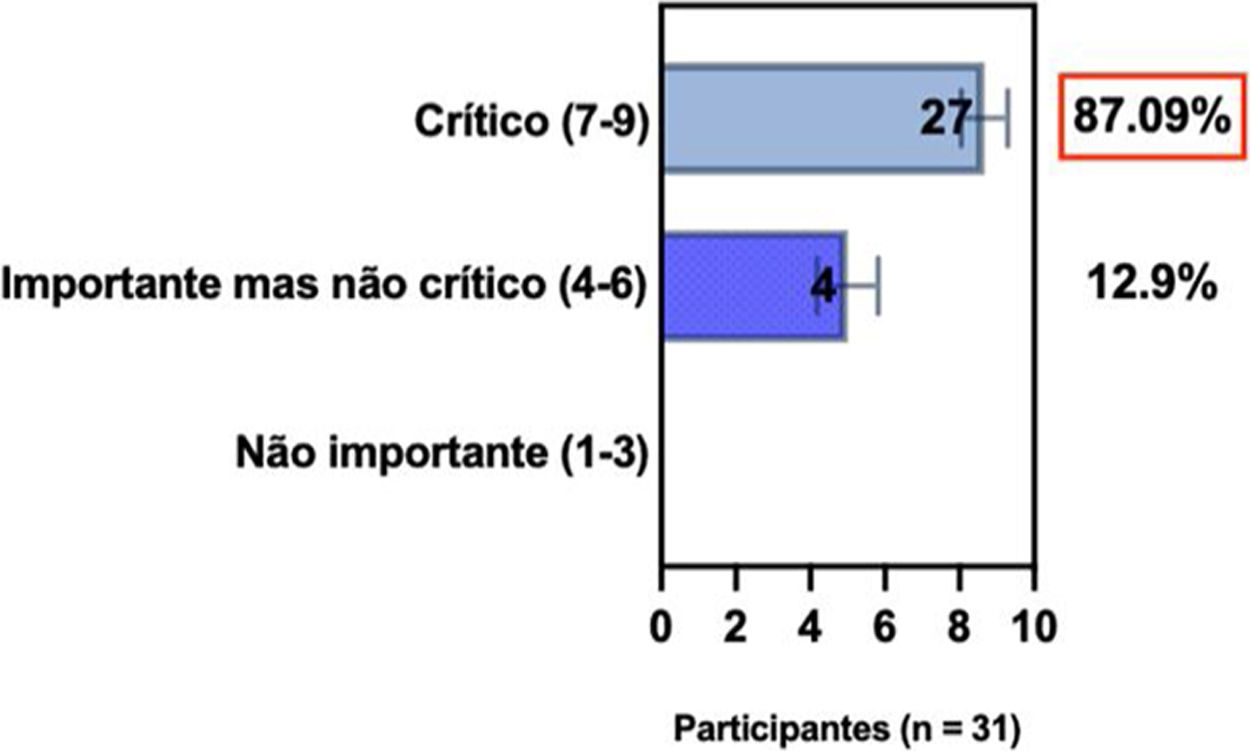
ConsensoDe acordo com diretrizes internacionais recentes,4,11–14 especialistas da SBD recomendam que, se um paciente com DA não estiver bem controlado com terapias tópicas e sistêmicas convencionais (p. ex., fototerapia, CsA ou MTX), a introdução de terapias sistêmicas direcionadas para adultos e crianças aprovadas para DA moderada a grave, como imunobiológicos e/ou inibidores da Janus‐quinase devem ser consideradas e apoiadas por qualquer uma das condições acima, exceto quando há intenção de engravidar, lactação ou gestação (tabela 5).
Posição dos especialistas da SBD sobre a introdução de terapias alvo sistêmicas para adultos e crianças com DA
| Questão discutida | Votos dos especialistas da SBD |
|---|---|
| Se o paciente não estiver bem controlado com terapias sistêmicas convencionais (p. ex., fototerapia, CsA ou MTX); deve ser considerada a introdução de terapias alvo sistêmicas aprovadas para DA moderada a grave em crianças e adultos, como imunobiológicos e/ou inibidores da Janus‐quinase; endossado por qualquer uma dessas condições, exceto para o desejo de engravidar, lactantes e gravidez | |
| Dupilumabe deve ser opção sistêmica alvo‐específica para adultos com DA (inicialmente 600mg SC dia 1, seguido de 300mg a cada 2 semanas); para adolescentes/crianças de 6 a 17 anos: 15 a <30kg, dosagem inicial e subsequente de 300mg a cada quatro semanas, 1×300 mg; 30kg a <60 kg: inicialmente 400mg SC no dia 1, seguido de 200mg a cada duas semanas; ≥ 60 kg: inicialmente 600mg SC no dia 1, seguido de 300mg a cada duas semanas; de 6 meses a 5 anos: 15 a <30kg, dosagem inicial e subsequente de 300mg a cada quatro semanas, 1×300 mg; 5 a <15kg, dosagem inicial e subsequente 200mg a cada quatro semanas, 1×200mg (aprovado no Brasil) | |
| O baricitinibe pode ser opção de terapia alvo sistêmica para adultos com DA (4 mg/dia; possível reduzir para 2 mg/dia; dependendo da resposta ao tratamento). (Aprovado no Brasil) | |
| O upadacitinibe pode ser opção de terapia alvo sistêmica para adultos: 15 ou 30 mg/dia; idade ≥ 65 anos: 15 mg/dia e adolescentes com DA (idade 12 a 17 ≥ 30kg de peso corporal: 15 mg/dia). (Aprovado no Brasil; em análise para ≤ 12 anos) |
CsA, ciclosporina; MTX, metotrexato; DA, dermatite atópica; SC, via subcutânea.
Dupilumabe (DUPI) é um anticorpo monoclonal humano recombinante do tipo IgG4 que inibe a sinalização da IL‐4 e IL‐13. DUPI inibe a sinalização de IL‐4 por meio do receptor tipo I (IL‐4R/c) e a sinalização de IL‐4 e IL‐13 por meio do receptor tipo II (IL‐4R/IL‐13R).74
SegurançaConjuntivite é o evento adverso mais comum (superior a 30%), na maioria dos casos de grau leve ou moderado, sem haver necessidade de suspensão do tratamento, e facilmente manejável com colírios anti‐inflamatórios tópicos.11,75–78 Reações no local da injeção, infecção oral por herpes simples e eritema facial persistente também são descritos como eventos adversos, porém menos comuns, sem risco aumentado de desenvolvimento de eczema herpético sob tratamento com DUPI.2,79 A terapia combinada de DUPI com corticosteroides tópicos, inibidores de calcineurina tópicos e tratamento com fototerapia está bem estabelecida e é considerada segura.11 De acordo com a bula, recomenda‐se a não utilização do DUPI concomitante ao uso de vacinas de vírus vivos.80
EvidênciaDupilumabe – adultos e adolescentesEstudos fase 3 com monoterapia, randomizados, duplo‐cegos, controlados por placebo, mostraram que 38% (SOLO 1) e 36% (SOLO 2) dos pacientes adultos alcançaram o objetivo primário (IGA 0/1) usando DUPI com uma primeira dose de 600mg SC, seguido de 300mg a cada duas semanas, comparados com placebo (10% e 8%, respectivamente). A redução do EASI de 75% e 90% também foi significantemente melhor nos grupos DUPI em comparação com o placebo.81 O estudo CHRONOS avaliou a eficácia por um período de 52 semanas, mostrando taxas de melhora duradouras, bem como a manutenção dos critérios de segurança.82 O estudo LIBERTY AD CAFÉ avaliou a eficácia e a segurança do DUPI 300mg SC semanalmente ou a cada duas semanas mais corticosteroide tópico concomitante em adultos com DA e resposta inadequada ou intolerância à CsA. Redução de 75% no EASI na semana 16 (59,1% e 62,6% respectivamente, contra 29,6% no grupo placebo que usou apenas corticosteroides tópicos).83 Um ensaio clínico randomizado de fase 3 para avaliar a eficácia da monoterapia com DUPI em adolescentes (12 a 17 anos) com DA moderada a grave inadequadamente controlada resultou em melhora do EASI‐75 na semana 16 em 41,5% a cada duas semanas.84 Uma revisão sistemática com metanálise evidenciou que, em comparação com DUPI, abrocitinibe (200mg diários) e upadacitinibe (30mg diários) demonstraram reduções nos escores EASI.4 Da mesma maneira, a comparação com upadacitinibe (15mg diários) foi associada a reduções semelhantes, e traloquinumabe (300mg a cada duas semanas) e baricitinibe (2 e 4mg diários) foram associados a reduções menores dos escores do EASI.4
Dupilumabe – população pediátricaUm ensaio duplo‐cego, de 16 semanas, randomizado, de fase 3, em crianças entre 6 e 11 anos, com DA grave, estudou a eficácia e a segurança no uso concomitante de 300mg de DUPI a cada quatro semanas, DUPI a cada duas semanas de acordo com o peso (< 30kg – 100mg a cada duas semanas,≥ 30kg – 200mg a cada duas semanas) ou placebo, com corticosteroide tópico de média potência. Ambos os grupos resultaram em melhora clínica e estatisticamente significante nos sinais, sintomas e qualidade de vida versus placebo, bem como redução nas infecções de pele. A obtenção da Avaliação Global do Investigador (pontuações de 0 ou 1), EASI≥ 75% e redução da pontuação de prurido foram superiores nos grupos de DUPI a cada quatro semanas e a cada duas semanas do que no grupo placebo. Esse estudo corrobora que as doses ideais de DUPI com base na eficácia e segurança foram 300mg a cada quatro semanas em crianças<30kg e 200mg a cada duas semanas em crianças≥ 30kg. Os efeitos colaterais mais comuns detectados foram conjuntivite e reações no local da injeção.85
Outro estudo duplo‐cego, controlado por placebo, de grupos paralelos, randomizado, de fase 3 foi realizado em população pediátrica, com idade entre 6 meses e 6 anos, com DA moderada a grave. A dosagem de DUPI de acordo com o peso corporal (≥ 5kg a <15kg: 200mg; ≥ 15kg a <30kg: 300mg) a cada quatro semanas foi associada a um corticosteroide tópico de baixa potência – acetato de hidrocortisona 1% creme – por 16 semanas. Os resultados confirmaram melhora da doença no grupo DUPI, bem como diminuição de infecções secundárias associadas, com resultados comparáveis a estudos com crianças maiores.86
MonitoramentoO tratamento é geralmente bem tolerado, não havendo necessidade de exames laboratoriais antes do início do tratamento e durante o seguimento, tais como sorologia de hepatite, HIV, dentre outros.11,75–78
AprovaçãoDUPI é a primeira terapia biológica para o tratamento da DA. Foi aprovado pela agência reguladora brasileira (ANVISA) em 2017 para uso em adultos, e em 2019 houve a extensão do uso para pacientes a partir de 12 anos com DA moderada a grave cuja doença não é controlada adequadamente com tratamentos tópicos e imunossupressores sistêmicos ou quando esses tratamentos não são recomendados, como em casos de nefropatia e hepatopatia.80 A dosagem para adultos é inicialmente de 600mg SC no dia 1, seguido de 300mg a cada duas semanas. Para 12 a 17 anos de idade: 30kg a <60kg: inicialmente, 400mg SC no 1, seguido de 200mg a cada duas semanas, quando ≥ 60kg: inicialmente 600mg SC no dia 1, seguido de 300mg a cada duas semanas.47
Desde 12 de agosto de 2022, DUPI também é aprovado pela ANVISA para uso em pacientes com DA grave com idade entre 6 meses e 11 anos cuja doença não é controlada adequadamente com tratamentos tópicos ou quando os mesmos não são recomendados.87 A dosagem para a idade de 6 meses a 5 anos é: 15 a <30kg, dosagem inicial e subsequente de 300mg a cada quatro semanas, 1×300mg; 5 a <15kg, dosagem inicial e subsequente 200mg a cada quatro semanas, 1×200mg.87
ConsensoOs especialistas da SBD recomendam o uso de DUPI para DA moderada a grave em adultos (acima de 18 anos), adolescentes (de 12 a 17 anos) e crianças (de 6 meses a 11 anos) com doença refratária ao uso de agentes tópicos, fototerapia ou terapias sistêmicas convencionais (p. ex., CsA ou MTX) – tabela 5.
Inibidores da Janus‐quinaseA via de sinalização Janus‐quinase (JAK) e do ativador da transcrição (JAK‐STAT) está ligada a receptores de citocinas tipo I/II.88 A família JAK tem quatro membros (JAK1, JAK2, JAK3 e TYK2) e, quando ativada, ocorre a fosforilação de proteínas STAT (sete membros), seguida de dimerização e translocação para o núcleo, visando a transcrição gênica. Na DA, a via JAK‐STAT parece exercer papel relevante na redução da inflamação, prurido e regulação da expressão da filagrina;89,90 IL‐4, IL‐5, IL‐13, IL31, IL‐22 e linfopoietina estromal tímica (TSLP) ligam‐se a receptores dependentes de JAK‐STAT, ativando a cascata JAK‐STAT (via JAK1‐3 e TYK2), aumentando a expressão das citocinas pro‐inflamatórias.11,91 A inibição da via JAK‐STAT provou ser um alvo terapêutico eficaz em doenças inflamatórias, e os inibidores orais de JAK podem exercer bloqueio seletivo, rápido e reversível da citocina Th2 e dos mecanismos de células B envolvidos na DA. Os inibidores de JAK sistêmicos aprovados para DA têm alta seletividade, como anti‐JAK1 (abrocitinibe ou ABRO; upadacitinibe ou UPA); anti‐JAK1/2 (baricitinibe ou BARI) e anti‐JAK1/3 (tofacitinibe ou TOFA).11,88
A mesma triagem inicial e monitoramento do tratamento são recomendados para todos os inibidores de JAK: hemograma completo, perfil renal, hepático e lipídico, níveis de creatininofosfoquinase, triagem para hepatite e tuberculose (TB) e radiografia de tórax.11 Recomenda‐se cautela em pacientes com DA com idade superior a 65 anos e avaliação da vacinação; a vacinação contra herpes‐zóster, quando possível, é indicada para pacientes em uso de inibidores de JAK.11
BaricitinibeMecanismo de açãoO baricitinibe (BARI) é inibidor oral de pequenas moléculas da JAK1 e JAK2, que têm sido implicados na patogênese da DA.11,92
SegurançaNasofaringite, foliculite, herpes oral, infecção do trato respiratório superior, acne, diarreia e dor nas costas foram os efeitos adversos mais frequentemente relatados. Foram descritos sete eventos cardiovasculares adversos maiores, três embolias pulmonares e 14 neoplasias malignas, excluindo o câncer de pele não melanoma. Não foram relatadas trombose venosa profunda ou tuberculose.93
EvidênciaOs estudos de fase 3 de BARI foram denominados BREEZE e avaliaram sua eficácia em pacientes adultos com DA moderada a grave como monoterapia ou em combinação com corticosteroides tópicos. As doses utilizadas nos ensaios clínicos foram 1mg, 2mg e 4mg/dia. Em estudos de monoterapia, a dose de 4mg/dia mostrou percentagem de doentes que atingiram EASI‐75 e EASI‐90 de 24,8% e 16,0% (BREEZE AD‐1) e 21,1% e 13% (BREZZE AD‐2), respectivamente.94 No estudo em combinação com corticosteroides tópicos (BREEZE AD‐7), a porcentagem de pacientes que atingiram EASI‐75 e EASI‐90 foi de 48% e 24%, respectivamente, mostrando que o uso de corticosteroides tópicos potencializa sua ação.92,95 BARI alcançou melhora significante e/ou clinicamente relevante em várias medidas de gravidade da doença, prurido, dor na pele, distúrbios do sono e qualidade de vida relacionada à saúde (HR‐QOL) ao longo de 16 semanas, e sua eficácia geralmente foi sustentada ao longo do tempo maior de duração do tratamento (≤ 68 semanas).92 Uma metanálise, incluindo vários ensaios clínicos de fase 3, evidenciou padrão consistente nos principais desfechos clínicos (EASI, POEM, DLQI, PP‐NRS), com BARI, 2 e 4mg/dia, associado a escores de índice ligeiramente piores quando comparados com DUPI.4
MonitoramentoHemograma completo, perfil renal, hepático, lipídico e níveis de creatininofosfoquinase, triagem para hepatite B, C e HIV, triagem de TB, incluindo radiografia de tórax, PPD ou QuantiFERON. Repetir o hemograma completo, perfil renal, hepático e lipídico, bem como os níveis de creatininofosfoquinase após quatro semanas de tratamento e, em seguida, repetir a cada três meses durante a terapia.11
AprovaçãoEmbora tenha sido o primeiro inibidor de JAK aprovado no Brasil para o tratamento da DA moderada a grave em adultos,96 sua eficácia é inferior à do DUPI e dos demais inibidores de JAK.97 A dose recomendada para BARI é de 4mg/dia, podendo ser reduzida para 2mg/dia, dependendo da resposta ao tratamento.
ConsensoOs especialistas da SBD recomendam o uso de BARI para DA moderada a grave, em pacientes elegíveis para terapia sistêmica e com resposta inadequada a outras terapias (tabela 5).
UpadacitinibeMecanismo de açãoUpadacitinibe (UPA) é inibidor oral altamente seletivo da JAK, com maior potência contra JAK1, com menor especificidade contra JAK2, JAK 3 ou TYK2.11,88,89,97
SegurançaO bloqueio da via JAK‐STAT pode levar a anormalidades hematológicas, como anemia, neutropenia ou trombocitopenia. O evento adverso mais comum foi acne (15,8%).98–100 Eczema herpético, herpes‐zóster e alterações laboratoriais foram descritos em pacientes com DA sob terapia com UPA.101
Relatos sobre o uso de UPA com outras terapias sistêmicas em pacientes com DA ainda são escassos, mas há relatos de terapia combinada com MTX (15mg) na artrite reumatoide.
EvidênciaEstudos controlados por placeboUPA demonstrou superioridade contra placebo em estudos controlados. Um estudo de fase 2, incluindo 167 adultos, investigou três diferentes regimes de dosagem de UPA (30, 15 e 7,5mg/dia durante 16 semanas) para DA em comparação com placebo. A variação média (DP) do UPA EASI foi superior ao placebo para todos os grupos de dosagem: 74% (6,1%) para 30mg, 62% (6,1%) para 15mg, 39% (6,2%) para 7,5mg e 23% (6,4%) para placebo (p=0,03; <0,001; <0,001; respectivamente).102
Os estudos Measure Up‐1 e Measure Up‐2 foram estudos multicêntricos de fase 3, randomizados, duplo‐cegos, controlados por placebo replicados, que incluíram 1.609 pacientes, adolescentes (12 a 18 anos) e adultos (18 a 75 anos) e compararam UPA 30mg vs. 15mg vs. placebo uma vez ao dia por 16 semanas. Os endpoints coprimários foram pontuação EASI‐75 e vIGA‐AD (avaliação global do investigador validada para dermatite atópica) de 0 ou 1. Em ambos os estudos Measure Up‐1/2, o EASI‐75 estava presente em 71,3%/60,4% (UPA 15mg), 81,6%/74,4% (UPA 15mg) e 17,1%/13,9% (placebo). vIGA 0 ou 1 foi alcançado em 49,5%/39,3% (UPA 15mg); 64,4%/53,4% (UPA 30mg) e 9,3%/5,2% (placebo).98 Durante o acompanhamento prolongado dos estudos Measure Up‐1/2 até a semana 52, houve eficácia sustentada: EASI‐75 foi alcançado em 69%/68,8% (15mg) e 74,5%/71,5% (30mg).99 Estudos com UPA em combinação com corticosteroides mostraram resultados semelhantes aos estudos Measure Up‐1/2.103
UPA e DUPI. O estudo Heads‐Up comparou adultos com DA grave em uso de UPA 30mg por via oral uma vez ao dia (até a semana 24) versus DUPI subcutâneo 300mg a cada duas semanas (dose de indução de 600mg, começando na semana 2, e até a semana 22). O endpoint primário foi EASI‐75 na semana 16. UPA (n=348) foi superior ao DUPI (n=344) (71% vs. 61,1% na semana 16 [p=0,006]) e demonstrou superioridade nos endpoints secundários (EASI‐90, EASI‐100 e melhora do prurido). Após 16 semanas, 245 pacientes mudaram para UPA e se inscreveram no estudo aberto (OLE). Os pacientes que não atingiram EASI‐75 com DUPI e mudaram para UPA alcançaram essa pontuação na semana 4 (75%) e na semana 16 (87,5%), respectivamente, após a mudança para UPA.100
Uma metanálise demonstrou que UPA (30mg diários) estava mais relacionado com EASI reduzido do que DUPI (600mg, depois 300mg a cada duas semanas) até 16 semanas de tratamento em adultos com DA.4
MonitoramentoAntes do tratamento, hemograma completo, perfil renal, hepático, perfil lipídico e níveis de creatininofosfoquinase, triagem para hepatite B, C e HIV, triagem de TB, incluindo radiografia de tórax, PPD ou QuantiFERON.11
Durante a terapia com UPA: repetir o hemograma completo, perfil renal, hepático e lipídico, bem como os níveis de creatininofosfoquinase após quatro semanas de tratamento e, em seguida, repetir a cada três meses durante a terapia.11
AprovaçãoUPA foi aprovado para tratar DA grave em pacientes acima de 12 anos76 nos EUA, Europa, Reino Unido, Japão89 e Brasil (ANVISA, 2022).104
ConsensoOs especialistas da SBD recomendam o uso de UPA para pacientes com DA moderada a grave, elegíveis para terapia sistêmica (tabela 5).
AbrocitinibeMecanismo de açãoAbrocitinibe (ABRO) é inibidor oral, seletivo e potente da JAK1, com dose recomendada de 100 ou 200mg uma vez ao dia.91 O mecanismo de ação com inibição da via JAK1 modula várias citocinas envolvidas na fisiopatologia da DA, incluindo IL‐4, IL‐13, IL‐31, IL‐22 e IFN‐γ e TSLP.91–105
SegurançaOs principais eventos adversos relacionados ao ABRO foram: náusea (com a dose de 200mg/dia) e nasofaringite e exacerbação da DA (com a dose de 100mg/dia), quando comparado ao placebo.106,107 Outros eventos adversos relacionados à dose foram dor de cabeça, acne e aumento de infecções por herpes simples e herpes‐zóster.11
EvidênciaEstudos de fase 2 mostraram resultados favoráveis com doses de 100mg e 200mg, com redução da gravidade da doença e do prurido.108 Estudos de fase 3 denominados JADE avaliaram pacientes com DA moderada e grave com diferentes objetivos. JADE MONO‐1 e JADE MONO‐2 – ABRO 100 e 200mg em comparação com placebo em adultos e adolescentes com mais de 12 anos. ABRO foi mais eficaz que o placebo, melhor com a dose de 200mg. Redução rápida do prurido após 24 horas da primeira dose. JADE TEEN – ABRO 100mg, 200mg e placebo combinado com terapia tópica (corticosteroide, inibidor de calcineurina ou inibidor de fosfodiesterase‐4) em adolescentes de 12 a 17 anos, mostrou eficácia e segurança semelhantes aos estudos JADE MONO‐1 e 2.109JADE REGIMEN avaliou a terapia de manutenção em adultos e adolescentes com mais de 12 anos. Foi realizado estudo com fase de indução aberta com ABRO 200mg em monoterapia por 12 semanas; na fase de manutenção, os pacientes com DA foram randomizados para ABRO 200mg, ou redução da dose para 100mg ou placebo, por 40 semanas, indicando que a indução do tratamento com ABRO 200mg seguido de 100mg pode ser uma estratégia viável. Houve menos eventos adversos com ABRO 100mg em comparação com 200mg na manutenção.110JADE EXTEND analisou a fase de extensão, com o objetivo de avaliar a eficácia e segurança do ABRO 100 ou 200mg em pacientes que já haviam feito uso de DUPI. Mostrou bons resultados mesmo em pacientes com uso prévio do imunobiológico.111 Em conclusão, esses estudos (JADE) mostraram que o ABRO é eficaz e seguro para tratar a DA moderada a grave.
MonitoramentoA mesma triagem inicial é recomendada para todos os inibidores de JAK: hemograma completo, perfil renal, hepático e lipídico, bem como níveis de creatininofosfoquinase e rastreamento de hepatite e TB, incluindo radiografia de tórax.11 A recomendação para o monitoramento é hemograma completo, perfil renal, hepático e lipídico, bem como nível de creatininofosfoquinase após quatro semanas de tratamento e, em seguida, a cada três meses durante a terapia ABRO.11
AprovaçãoEm setembro de 2021, ABRO recebeu aprovação no Reino Unido e no Japão para o tratamento de adolescentes (> 12 anos) e adultos com DA moderada a grave, elegíveis para terapia sistêmica e com resposta inadequada a outras terapias. Em dezembro de 2021, foi aprovado na União Europeia para adultos; em janeiro de 2022, pelo FDA (EUA) para o tratamento da DA refratária moderada a grave acima de 18 anos, e em fevereiro de 2023, para adolescentes (de 12 a 17 anos).11,112,113 No Brasil, recebeu aprovação em junho de 2023, para adolescentes (> de 12 anos) e adultos com DA moderada a grave.114
ConsensoABRO em dose inicial de 200mg uma vez ao dia é recomendado para adultos com DA. Após resposta satisfatória, a dose pode ser reduzida para 100mg/dia. Em pacientes com idade≥ 65 anos e adolescentes, recomenda‐se dose inicial de 100mg uma vez ao dia.4 Estudo recente em DA mostrou melhores resultados com uso de ABRO 200mg por dia em comparação com DUPI.115
Os especialistas da SBD endossam o uso do ABRO para DA moderada a grave, elegíveis para terapia sistêmica e com resposta inadequada a outras terapias (tabela 5).
Terapias‐alvo sistêmicas para pacientes com DA (em análise para aprovação no Brasil)TraloquinumabeMecanismo de açãoTraloquinumabe (TRALO) é anticorpo monoclonal totalmente humano do tipo IgG4 que se liga especificamente à IL‐13 e inibe sua interação com os receptores de IL‐13.116,117
SegurançaOs principais eventos adversos foram infecção das vias aéreas superiores e conjuntivite (relativamente menos frequente do que com o uso de DUPI).118
EvidênciaEm estudos de fase 3 (ECZTRA), pacientes adultos com DA moderada e grave estavam em monoterapia com TRALO 300mg SC a cada duas semanas, em comparação com placebo.118,119 O medicamento foi mais eficaz do que o placebo com redução do prurido, melhora da qualidade do sono, da qualidade de vida e dos escores de gravidade da doença. Os resultados foram IGA 0 ou 1, EASI‐75 na semana 16, e a maioria dos respondedores manteve boa resposta na semana 52.118
TRALO foi testado com o uso concomitante de corticosteroides tópicos. Adultos com DA moderada a grave atingiram IGA 0/1 e EASI‐75; resultado melhor do que o grupo placebo. Noventa por cento dos respondedores mantiveram a resposta na semana 32.119
MonitoramentoMonitoramento laboratorial não é necessário.119
AprovaçãoTRALO obteve aprovação para o tratamento da DA moderada a grave em 22 de junho de 2021 pela EMA na Europa e em 27 de dezembro do mesmo ano pelo FDA (EUA). No Brasil, encontra‐se em fase de aprovação.
ConsensoA dose inicial recomendada de TRALO para pacientes com idade igual ou superior a 12 anos é de 600mg (quatro injeções de 150mg) e sua dose de manutenção recomendada é de 300mg (duas injeções de 150mg) administradas a cada duas semanas.11 A critério do prescritor, a dosagem a cada quatro semanas pode ser considerada para pacientes que apresentarem pele limpa ou quase limpa após 16 semanas de tratamento.11
Especialistas da SBD endossam o uso de TRALO para DA moderada a grave elegíveis para terapia sistêmica e com resposta inadequada a outras terapias, após aprovação pela agência reguladora brasileira.
A figura 1 resume as opções terapêuticas básicas e sistêmicas para DA em crianças e adultos discutidas neste consenso atualizado.
Acreditamos que este estudo possa contribuir para as indicações práticas de uso e prescrição da fototerapia e terapias sistêmicas para pacientes com DA, incluindo o uso do conjunto de instrumentos e escores de avaliação da DA, adicionando e unificando instrumentos e relatos de desfechos de ensaios clínicos e prática clínica para os especialistas brasileiros. Limitações de uso nas diferentes faixas etárias, variações étnico‐raciais ou acessibilidade à medicação sistêmica, quer seja convencional ou alvo‐específica, são fatores a serem considerados na indicação das opções de tratamento sistêmico para DA.
Suporte financeiroSociedade Brasileira de Dermatologia.
Contribuição dos autoresCoordenadores do projetoRaquel Leao Orfali: Coordenação do projeto; concepção e o desenho do estudo; levantamento dos dados; análise estatística; redação do artigo e revisão crítica do conteúdo; obtenção, análise e interpretação dos dados; revisão crítica da literatura; aprovação final da versão final do manuscrito.
Valeria Aoki: Coordenação do projeto; concepção e o desenho do estudo; levantamento dos dados; análise estatística; redação do artigo e revisão crítica do conteúdo; obtenção, análise e interpretação dos dados; revisão crítica da literatura; aprovação final da versão final do manuscrito.
Daniel Lorenzini: Coordenação do projeto; concepção e o desenho do estudo; levantamento dos dados; análise estatística; redação do artigo e revisão crítica do conteúdo; obtenção, análise e interpretação dos dados; revisão crítica da literatura; aprovação final da versão final do manuscrito.
Phyllis I. Spuls: Concepção e o desenho do estudo; revisão crítica do conteúdo; revisão crítica da literatura; aprovação final da versão final do manuscrito.
Louise A. A. Gerbens: Concepção e o desenho do estudo; Revisão crítica do conteúdo; Revisão crítica da literatura; aprovação final da versão final do manuscrito.
Contribuição de autoria dos demais especialistas brasileiros participantes
Aline Bressan: Redação do artigo e revisão crítica do conteúdo; aprovação final da versão final do manuscrito.
Anber Ancel Tanaka: Redação do artigo e revisão crítica do conteúdo; aprovação final da versão final do manuscrito.
Ana Maria Mósca de Cerqueira: Redação do artigo e revisão crítica do conteúdo; aprovação final da versão final do manuscrito.
André da Silva Hirayama: Redação do artigo e revisão crítica do conteúdo; aprovação final da versão final do manuscrito.
Andréa Machado Coelho Ramos: Redação do artigo e revisão crítica do conteúdo; aprovação final da versão final do manuscrito.
Carolina Contin Proença: Redação do artigo e revisão crítica do conteúdo; aprovação final da versão final do manuscrito.
Claudia Marcia de Resende Silva: Redação do artigo e revisão crítica do conteúdo; aprovação final da versão final do manuscrito.
Cristina Marta Maria Laczynski: Redação do artigo e revisão crítica do conteúdo; aprovação final da versão final do manuscrito.
Francisca Regina Carneiro: Revisão crítica do conteúdo; aprovação final da versão final do manuscrito.
Gleison Duarte: Redação do artigo e revisão crítica do conteúdo; aprovação final da versão final do manuscrito.
Gunter Hans Filho: Redação do artigo e revisão crítica do conteúdo; aprovação final da versão final do manuscrito.
Heitor de Sá Gonçalves: Revisão crítica do conteúdo; aprovação final da versão final do manuscrito.
Ligia Pessoa de Melo: Revisão crítica do conteúdo; aprovação final da versão final do manuscrito.
Luna Azulay‐Abulafia: Revisão crítica do conteúdo; aprovação final da versão final do manuscrito.
Magda Blessmann Weber: Redação do artigo e revisão crítica do conteúdo; aprovação final da versão final do manuscrito.
Maria Cecília Rivitti‐Machado: Redação do artigo e revisão crítica do conteúdo; aprovação final da versão final do manuscrito.
Mariana Colombini Zaniboni: Redação do artigo e revisão crítica do conteúdo; aprovação final da versão final do manuscrito.
Marília Ogawa: Redação do artigo e revisão crítica do conteúdo; aprovação final da versão final do manuscrito.
Mario Cezar Pires: Redação do artigo e revisão crítica do conteúdo; aprovação final da versão final do manuscrito.
Mayra Ianhez: Redação do artigo e revisão crítica do conteúdo; aprovação final da versão final do manuscrito.
Paulo Antonio Oldani Felix: Redação do artigo e revisão crítica do conteúdo; aprovação final da versão final do manuscrito.
Renan Bonamigo: Revisão crítica do conteúdo; aprovação final da versão final do manuscrito.
Roberto Takaoka: Redação do artigo e revisão crítica do conteúdo; aprovação final da versão final do manuscrito.
Rosana Lazzarini: Redação do artigo e revisão crítica do conteúdo; aprovação final da versão final do manuscrito.
Silmara Cestari: Redação do artigo e revisão crítica do conteúdo; aprovação final da versão final do manuscrito.
Silvia Assumpção Soutto Mayor: Redação do artigo e revisão crítica do conteúdo; aprovação final da versão final do manuscrito.
Tania Cestari: Redação do artigo e revisão crítica do conteúdo; Aprovação final da versão final do manuscrito.
Zilda Najjar Prado de Oliveira: Revisão crítica do conteúdo; aprovação final da versão final do manuscrito.
Conflito de interessesRaquel Leao Orfali: Participação em ensaios clínicos da Sanofi e Lilly, e como consultora da Bayer e Abbvie.
Daniel Lorenzini: Participação nos ensaios clínicos da Lilly, consultor da Sanofi, Abbvie e Pfizer.
Valeria Aoki: Participação em ensaios clínicos da Sanofi e Lilly, e como consultora da Abbvie e Pfizer.
Phyllis I. Spuls: Recebeu bolsas de pesquisa independentes departamentais de indústrias farmacêuticas desde dezembro de 2019 para o registro TREAT NL, está envolvido na realização de ensaios clínicos com muitas indústrias farmacêuticas que fabricam medicamentos usados para o tratamento de, por exemplo, psoríase e DA, para o qual a compensação financeira é paga ao departamento/hospital, e é Investigador Principal (PI) do registo nacional TREATMENT of ATopic eczema (TREAT) (TREAT NL) e da força‐tarefa internacional (TREAT Registry Taskforce) sobre fototerapia e terapia sistêmica em adultos e crianças com DA.
Louise A. A. Gerbens: Membro da diretriz europeia (EuroGuiDerm) sobre tratamento da DA, membro da diretriz holandesa sobre tratamento da DA, um dos investigadores do registro nacional TREATMENT of ATopic eczema (TREAT) (TREAT NL) e da força‐tarefa internacional (TREAT Registry Taskforce) em fototerapia e terapia sistêmica em adultos e crianças com DA.
Aline Bressan: Palestrante para Janssen e Abbvie.
Anber Ancel Tanaka: Consultor e palestrante para Abbvie, Lilly, Janssen, Sanofi Novartis, Leo Pharma.
Ana Maria Mósca de Cerqueira: Conselho consultivo para L’Óreal, Sanofi, Pierre‐Fabre Medihealt, Pfizer, Lilly; palestrante para L’Óreal, Mustela, Theraskin, Pfizer, Conatec, Aché, Bagó, Johnson & Johnson.
André da Silva Hirayama: Palestrante e consultor Janssen, Abbot/Abbvie, Leo Pharma, Boehringer Ingelheim, Novartis; participação em estudos clínicos: Janssen, Abbot/Abbvie, Boehringer Ingelheim, Novartis, Roche, Lilly, Allergan.
Andréa Machado Coelho Ramos: Nenhum.
Carolina Contin Proença: Nenhum.
Claudia Marcia de Resende Silva: Nenhum.
Cristina Marta Maria Laczynski: Consultor e palestrante para Abbvie; palestrante para Leo Pharma, Libbs, Sanofi, Theraskin e Pfizer; participação em estudo clínico para Lilly e Mantecorp.
Francisca Regina Carneiro: Nenhum.
Gleison Duarte: Conselho consultivo e palestrante da Abbvie, Lilly, Janssen, Galderma, Sanofi, Novartis, UCB, Leo Pharma. Participação em ensaio clínico Amgen, Novartis e Sanofi.
Gunter Hans Filho: Participação em estudo clínico Sanofi, Principia Biopharma; palestrante Galderma.
Heitor de Sá Gonçalves: Nenhum.
Lígia Pessoa de Melo: Consultora e palestrante para Galderma, Sanofi e Abbvie.
Luna Azulay‐Abulafia: Consultora Galderma; participação em estudos clínicos Pfizer e Lilly.
Magda Blessmann Weber: Palestrante para Lilly e Abbvie; pesquisador clínico da Lilly e da Sanofi.
Maria Cecília Rivitti‐Machado: Conselho consultivo, consultoria e palestrante para Abbvie, Novartis, Pfizer, Sanofi, Janssen, Mantecorp.
Mariana Colombini Zaniboni: Nenhum.
Marília Marufuji Ogawa: Nenhum.
Mario Cezar Pires: Conselho consultivo, consultoria e palestrante para Abbvie, Sanofi, Pfizer, Janssen‐Cilag, Ely‐Lilly, Novartis, UCB, LeoPharma, Amgen, Sandoz.
Mayra Ianhez: Participação como palestrante da Sanofi, Abbvie, Janssen, Novartis, Galderma, Theraskin, Pfizer e em conselhos consultivos da Sanofi, Abbvie, Jannsen, Novartis e Galderma.
Paulo Antônio Oldani Félix: Consultor e palestrante para Abbvie, Sanofi, Pfizer, Janssen‐Cilag, Ely‐Lilly, Novartis, UCB, LeoPharma, Amgen, Sandoz.
Renan Bonamigo: Nenhum.
Roberto Takaoka: Consultor da Pfizer e Johnson & Johnson.
Rosana Lazzarini: Nenhum.
Silmara Cestari: Conselho consultivo e palestrante da Abbvie, Biolab, Grupo L’Oreal, Johnson & Johnson, Leo Pharma, Libbs, Mustela‐Expanciense, Sanofi, Pfizer.
Silvia Assumpção Soutto Mayor: Conselho consultivo para Sanofi e palestrante para Abbvie, Pfizer, Sanofi, Libbs, Mustela‐Expanciense
Tania Cestari: Nenhum.
Zilda Najjar Prado de Oliveira: Nenhum.
AgradecimentosAo Prof. Bernardo Gontijo (in memoriam), por toda uma vida dedicada à Dermatologia brasileira, e por todo auxílio e apoio no consenso anterior sobre o manejo terapêutico da dermatite atópica, da Sociedade Brasileira de Dermatologia.
Como citar este artigo: Orfali RL, Lorenzini D, Bressan A, Tanaka AA, Cerqueira AMM, Hirayama AS, et al. Consensus on the therapeutic management of atopic dermatitis – Brazilian Society of Dermatology: an update on phototherapy and systemic therapy using e‐Delphi technique. An Bras Dermatol. 2023;98:814–36.
Trabalho realizado na Sociedade Brasileira de Dermatologia, Rio de Janeiro, RJ, Brasil.