Muitos nevos melanocíticos congênitos (NMC) carregam a mutação somática V600E no oncogene BRAF. Porém, as características histopatológicas detalhadas e a atividade proliferativa do NMC com mutação V600E no gene BRAF não foram sistematicamente documentadas.
ObjetivoIdentificar a atividade proliferativa e as características histopatológicas correlacionadas com o estado de mutação V600E no gene BRAF em NMC.
MétodosNMC foram identificados retrospectivamente a partir do sistema de resultados laboratoriais. As mutações foram determinadas por sequenciamento de Sanger. Os NMC foram divididos em grupo mutante e grupo controle, de acordo com a presença ou não da mutação no gene BRAF, e foram rigorosamente pareados quanto ao gênero, idade, tamanho e localização do nevo. Foram realizadas: análise histopatológica, análise da expressão de Ki67 por imuno‐histoquímica e microscopia confocal de fluorescência a laser.
ResultadosAs diferenças no índice Ki67, na extensão em profundidade das células do nevo e no número de ninhos de células névicas entre o grupo mutante e o grupo controle foram estatisticamente significantes, com valores de p de 0,041, 0,002 e 0,007, respectivamente. Em comparação com os nevos BRAF V600E negativos, os nevos BRAF V600E positivos frequentemente exibiam melanócitos intraepidérmicos predominantemente em ninhos, ninhos juncionais maiores, mas a diferença nesse conjunto de dados não foi estatisticamente significante. O número de ninhos (p=0,001) correlacionou‐se positivamente com a proporção de células Ki67 positivas.
Limitações do estudoFoi incluída pequena amostra de pacientes e não houve seguimento.
ConclusõesAs mutações V600E no gene BRAF foram associadas com alta atividade proliferativa e características histopatológicas distintas em NMC.
Os nevos melanocíticos congênitos (NMC), definidos por sua presença ao nascimento ou nas primeiras semanas de vida, são originários de proliferações de células melanocíticas benignas derivadas da crista neural. As características clínicas do NMC são diversas, como localização no corpo, espectro mais diversificado de cores e alterações topográficas da superfície. As complicações potenciais dos NMC incluem desenvolvimento de melanoma e envolvimento do sistema nervoso central denominado melanose neurocutânea (MNC).
A classificação dos NMC tem sido historicamente definida apenas pelo tamanho. Recomendações recentes foram publicadas com base no consenso de especialistas, utilizando categorias de tamanho adulto previsto (PAS; do inglês, predicted adult size), número de NMC acompanhantes, localização anatômica e vários descritores topográficos. Um NMC pequeno é definido como tendo menos de 1,5cm de PAS, e o médio até 20cm de PAS (M1: 1,5‐10cm, M2:> 10‐20cm). NMC grandes e gigantes são classificados quando o PAS está entre 20 e 40cm (L1:> 20‐30cm, L2:> 30‐40cm) e maiores que 40cm (G1:> 40‐60cm, G2:> 60cm), respectivamente.1
NMC pequenos e médios são relatados em aproximadamente 1:100 nascimentos,2 enquanto NMC grandes e gigantes têm prevalência estimada de 1:20.000 a 1:50.000 nascimentos e 1:200.000 a 1:500.000 nascimentos, respectivamente.3–5
NMC abrigam predominantemente mutação somática NRAS ou BRAF pós‐zigótica. No entanto, diferentes mutações geralmente dependem do tamanho do nevo. Na grande maioria dos casos, NMC pequenos e médios são observados com mais frequência como tendo mutação V600E no gene BRAF, enquanto nevos grandes/gigantes abrigam mutações NRAS (Q61) com mais frequência.6–8 NMC geralmente são neoplasias melanocíticas benignas, mas às vezes é difícil diferenciar o NMC do melanoma, especialmente no estágio inicial do melanoma. Portanto, biópsias ou cirurgia são necessárias para realizar exame histopatológico suplementar. A mutação V600E no gene BRAF é o driver genético mais comum no melanoma e codifica uma serina/treonina quinase na via RAS/mitogen‐activated protein kinase (MAPK).9–12
Notavelmente, mais de 80% dos nevos melanocíticos abrigam mutações no gene BRAF,10,13 incluindo os nevos melanocíticos que são precursores do melanoma.14
No melanoma, a presença da mutação V600E no gene BRAF está correlacionada com certas características histopatológicas, incluindo dispersão ascendente intraepidérmica de melanócitos, formação de ninhos de melanócitos intraepidérmicos, espessamento da epiderme e células tumorais maiores.15 Da mesma maneira, os nevos melanocíticos com mutação V600E no gene BRAF estão associados a padrão dermatoscópico globular e padrão de crescimento histológico predominantemente dérmico.13,16 Esses resultados sugerem que a mutação V600E no gene BRAF pode afetar as características e o comportamento dos nevos.
Mutações no gene BRAF (homólogo B do oncogene viral do sarcoma murino v‐raf) foram detectadas com alta frequência em NMC, especialmente em NMC pequenos e médios.17 Entretanto, que seja do conhecimento dos autores, não há relatos relevantes sobre o efeito da mutação V600E no gene BRAF na atividade proliferativa e na histopatologia dos NMC. Como tal, o estudo da biologia do NMC pode aprofundar a compreensão das vias que levam ao melanoma.
Neste estudo, o objetivo primário foi determinar a atividade proliferativa (pelo Ki67) e o padrão histopatológico em NMC com mutação V600E no gene BRAF.
Materiais e métodosEste estudo foi aprovado pelo conselho de revisão institucional do Capital Institute of Pediatrics (SHERLL2020054) e foi realizado de acordo com a Declaração de Helsinque.
Desenho e pacientes do estudoOitenta e quatro crianças com NMC foram recrutadas nas clínicas dermatológicas entre maio de 2016 e outubro de 2020. Nevos presentes ao nascimento ou até um mês após o nascimento foram incluídos. Os critérios de exclusão foram diagnóstico de nevo azul, nevo Spitz, nevo presente após um mês do nascimento ou com tempo de início incerto. Antes de participar do estudo, o consentimento informado foi dado pelos pais.
Todos os 84 NMC foram completamente removidos cirurgicamente e cortados ao meio; metade do tecido foi fixada em formalina e teve diagnóstico histopatológico realizado por patologista certificado (P.X) sendo avaliada de acordo com o método adaptado de Marchetti et al.17 A segunda metade dos 84 NMC foi congelada rapidamente a−80°C. A extração de DNA foi realizada como descrito anteriormente,8 utilizando o QIAamp DNA Mini Kit (QIAGEN, Hilden, Alemanha; n=24) de acordo com o protocolo do fabricante. O teste de mutação genética foi realizado nos genes BRAF e NRAS.
Todos os 84 NMC incluídos no estudo foram geneticamente testados e 12 deles apresentaram a mutação V600E no gene BRAF, enquanto os demais foram negativos. Doze crianças sem a mutação V600E no gene BRAF foram selecionadas aleatoriamente como grupo controle; idade, sexo, tamanho do nevo e localização anatômica foram pareados com o grupo de estudo.
Todas as amostras de tecido do arquivo haviam sido emblocadas em parafina. Cortes histológicos foram corados pela Hematoxilina & eosina (HE) e revisados para confirmar o diagnóstico.
BRAF éxon 15 e sequenciamento NRASAs amostras de tecido foram tratadas utilizando o kit QuickExtractTM FFPE DNA Extraction com protocolos padrão. Os primers usados para amplificação por PCR do éxon 15 do BRAF foram:
Forward: 5’‐TCATAATGCTTGCTCTGATAGGA‐3’.
Reverse: 5’‐GGCCAAAAATTTAATCAGTGGA‐3’.
Ou forward (amplicon mais curto): 5’‐TGTTTTCCTTTACTTACTACACCTC‐3’.
Reverse: 5’‐TAATCAGTGGAAAAATAGCCTC‐3’.
Os primers de PCR para o éxon 1 do gene NRAS foram:
Forward: 5’‐ CGC CAA TTA ACC CTG ATT ACT‐3’.
Reverse: 5’‐ CAC TGG GCC TCA CCT CTA‐3’.
Os primers de PCR para o éxon 2 do gene NRAS foram:
Forward: 5’‐GATTCTTACAGAAAACAAGTG‐3’.
Reverse: 5’‐ATGACTTGCTATTATTGATGG‐3’.
A amplificação bem‐sucedida da respectiva região foi confirmada pela análise de 5μL dos produtos de PCR em gel de agarose a 2% contendo GelRed™ Nucleic Acid Gel Stain. Os produtos de PCR foram limpos usando USB® ExoSAP‐IT® PCR Product Cleanup (Affymetrix®, Santa Clara, CA), e o sequenciamento de Sanger foi realizado usando os respectivos primers empregados na PCR.18
Análise histopatológicaBlocos e lâminas histológicas corados pela hematoxilina e eosina (HE) estavam disponíveis para 24 casos. As lâminas coradas pela HE foram revisadas por dois dermatopatologistas certificados (P.T e G.L.Z) antes da disponibilidade dos resultados da imunomarcação com Ki67. A análise histopatológica sem conhecimento dos resultados da mutação genética também foi realizada pelos dois dermatopatologistas certificados (P.T e G.L.Z) em cortes histológicos corados pela HE para quantificar os seguintes parâmetros: 1) classificação histopatológica (juncional, composto ou intradérmico); 2) padrão de crescimento microanatômico predominante; 3) formação de ninhos juncionais de melanócitos; 4) extensão das células névicas em profundidade: (1) Dentro da epiderme, (2) Na derme superficial, (3) Na derme média, (4) Na derme profunda, (5) No tecido subcutâneo; 5) características arquitetônicas e atipias citológicas. O padrão de crescimento microanatômico foi qualificado como: a) predominantemente epidérmico, b) componentes epidérmico e dérmico quase equivalentes, e c) predominantemente dérmico. A presença de alterações arquitetônicas e/ou atipias citológicas foi classificada como ausente ou presente.
Avaliação imuno‐histoquímica da atividade proliferativa das células névicasBlocos de parafina de 24 lesões de NMC foram recuperados e foi realizada a detecção imuno‐histoquímica (IHQ) do Ki67. O anticorpo era o anticorpo monoclonal de camundongo (Clone OTI8H5, ZSBG‐Bio, China) anti‐humano. O número de células névicas imunorreativas com Ki67 foi contado em campo de 400×de aumento (a área de superfície real coberta pelo campo era de 0,11mm2). As células imunorreativas com Ki67 podem ser diferenciadas dos queratinócitos epidérmicos em razão da formação de ninhos pelas células névicas na junção dermoepidérmica. Dez campos foram selecionados aleatoriamente para registrar o número de células névicas imunorreativas. O número médio de células imunorreativas indicou a taxa de positividade, e foram avaliados também a localização e o padrão de distribuição das células imunorreativas.
Os estudos de IHQ foram realizados em cortes histológicos de 5μm de espessura de tecido fixado em formalina e emblocado em parafina. Todas os cortes histológicos foram incubados com proteína Ki67 pelo método imuno‐histoquímico pv‐9000 de duas etapas nas mesmas após serem rotineiramente desparafinizados e hidratados, e incubados em câmara de alta pressão com adição de bloqueador de peroxidase endógena. Foram então incubados em temperatura ambiente por 10 minutos, lavados com água destilada, imersos em PBS e lavados em três banhos de 5 minutos. O anticorpo primário Ki67 (clone OTI8H5, ZSBG‐Bio, China, diluição 1:100) foi acrescentado e incubado a 37°C por 1 hora. Os cortes histológicos foram imersos em PBS e em três banhos de 5 minutos com controles positivos e negativos apropriados. A presença ou ausência de imunorreatividade Ki67 foi identificada com concordância de consenso de 100% (P.T e G.L.Z).
Microscopia de fluorescência confocal a laser (MFCL)Se houvesse muitas partículas de melanina na amostra, que afetasse a avaliação dos resultados, a microscopia de fluorescência confocal a laser (MFCL) era utilizada para esclarecer o diagnóstico. Os cortes histológicos foram desparafinizados em xileno e reidratados com etanol 100%, 95%, 85% e 75% por 5 minutos, respectivamente, e enxaguadas com solução salina tamponada com fosfato por 5 minutos por três vezes. Após a recuperação do epítopo induzida por calor no microondas por 15 minutos e bloqueio com soro normal de cabra a 5% por 1 hora em temperatura ambiente, os cortes histológicos foram incubados com anticorpo monoclonal anti‐humano de camundongo para melanina A e anticorpo monoclonal de coelho Ki‐67 anti‐humano (Abcam, Cambridge, MA, EUA) em albumina de soro bovino a 5%/solução salina tamponada com Tris. Para a detecção, anticorpos anticamundongo marcados com Alexa Fluor 488 e anticorpos anticoelho de cabra marcados com Alexa Fluor 595 (Abcam, Cambridge, MA, EUA) e 4’,6‐diamino‐2‐fenilindol (DAPI) foram utilizados. Para análise de colocalização, as células foram simultaneamente marcadas com anticorpos de camundongo antimelanina A e anticorpos de coelho anti‐Ki‐67 e detectadas com anticorpos anticamundongo de cabra marcados com Alexa Fluor 594 ou anticorpos anticoelho de cabra marcados com Alexa Fluor 488. O procedimento foi realizado manualmente. Controles positivos e negativos foram incluídos em cada processamento de amostras. A porcentagem de células imunomarcadas foi contada sob grande aumento (fig. 1).
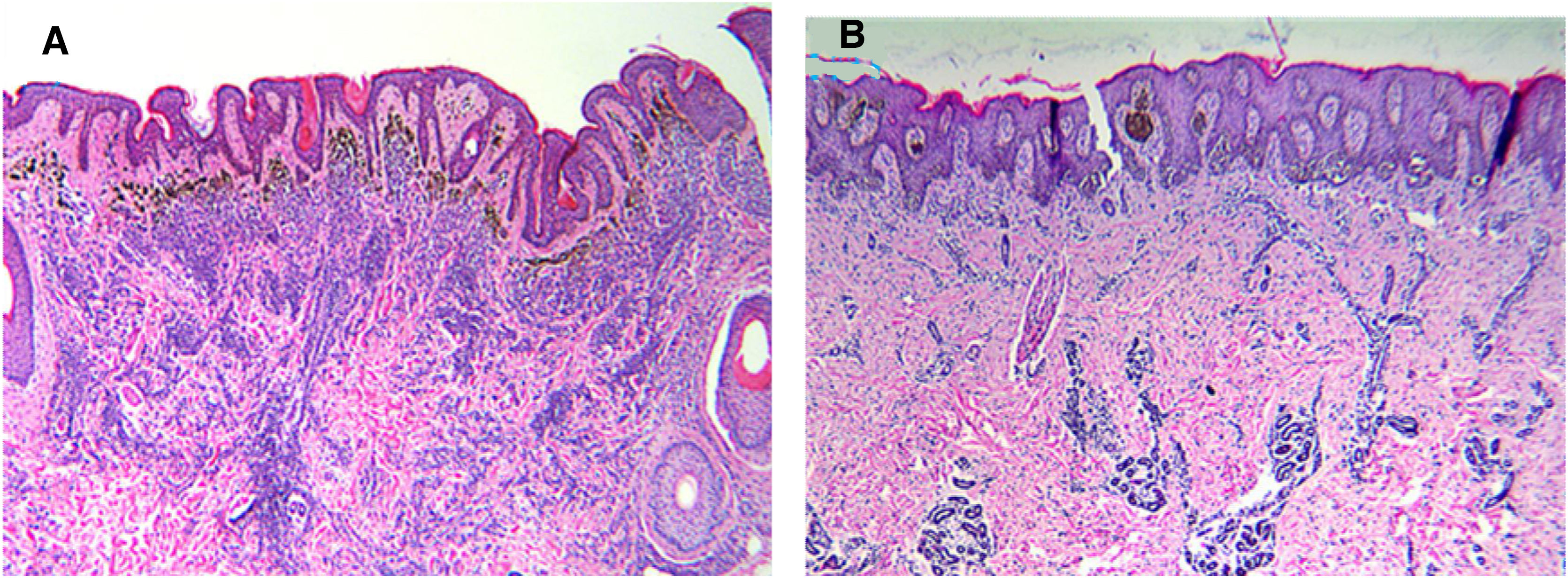
Características histomorfológicas do nevo melanocítico congênito. Padrão de crescimento congênito com as células névicas circundando estruturas anexiais e envolvimento de células do nevo em torno de vasos e disseminação de melanócitos entre os feixes de colágeno. Os nevos com a mutação V600E no gene BRAF (A) se estendem mais profundamente na derme do que os nevos do tipo selvagem (B). (A‐B, coloração pela Hematoxilina & eosina, 40×).
A análise estatística foi realizada no programa SPSS v. 22. As estatísticas descritivas foram estratificadas pelo status da mutação V600E no gene BRAF, com média e desvio padrão (DP) para variáveis contínuas. O teste t pareado foi utilizado para comparar médias de dados contínuos. Foram realizados os testes de significância de correlação e coeficientes de correlação parcial entre uma característica histopatológica binária e o índice Ki67. Todos os valores de p fornecidos são bicaudais, e um valor de p <0,05 foi considerado estatisticamente significante.
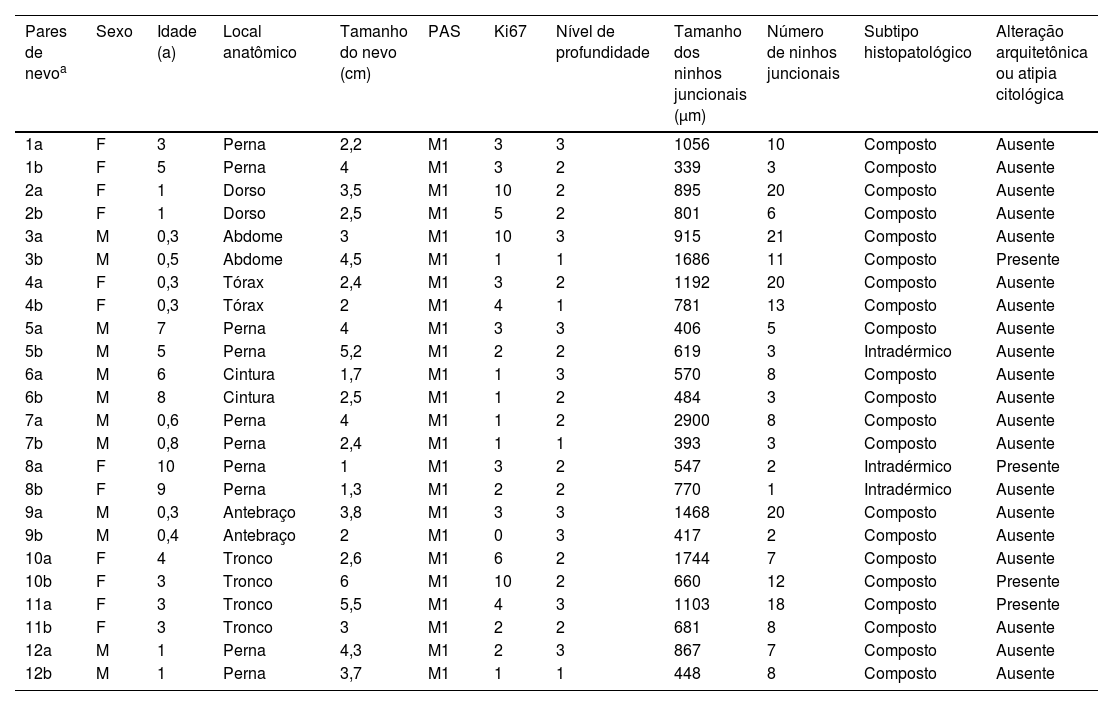
ResultadosOs dados dos 12 pares combinados incluindo pacientes (n=24) e nevos (n=24) são apresentados na tabela 1. Em relação às características dos NMC nos grupos de mutação e controle, os grupos eram muito parecidos em relação a idade, sexo e localização. Não houve diferenças estatisticamente significantes em termos de idade, sexo, história de melanoma e história de câncer de pele não melanoma entre os grupos com mutação e o grupo controle.
Características dos nevos nos grupos mutante e controle
| Pares de nevoa | Sexo | Idade (a) | Local anatômico | Tamanho do nevo (cm) | PAS | Ki67 | Nível de profundidade | Tamanho dos ninhos juncionais (μm) | Número de ninhos juncionais | Subtipo histopatológico | Alteração arquitetônica ou atipia citológica |
|---|---|---|---|---|---|---|---|---|---|---|---|
| 1a | F | 3 | Perna | 2,2 | M1 | 3 | 3 | 1056 | 10 | Composto | Ausente |
| 1b | F | 5 | Perna | 4 | M1 | 3 | 2 | 339 | 3 | Composto | Ausente |
| 2a | F | 1 | Dorso | 3,5 | M1 | 10 | 2 | 895 | 20 | Composto | Ausente |
| 2b | F | 1 | Dorso | 2,5 | M1 | 5 | 2 | 801 | 6 | Composto | Ausente |
| 3a | M | 0,3 | Abdome | 3 | M1 | 10 | 3 | 915 | 21 | Composto | Ausente |
| 3b | M | 0,5 | Abdome | 4,5 | M1 | 1 | 1 | 1686 | 11 | Composto | Presente |
| 4a | F | 0,3 | Tórax | 2,4 | M1 | 3 | 2 | 1192 | 20 | Composto | Ausente |
| 4b | F | 0,3 | Tórax | 2 | M1 | 4 | 1 | 781 | 13 | Composto | Ausente |
| 5a | M | 7 | Perna | 4 | M1 | 3 | 3 | 406 | 5 | Composto | Ausente |
| 5b | M | 5 | Perna | 5,2 | M1 | 2 | 2 | 619 | 3 | Intradérmico | Ausente |
| 6a | M | 6 | Cintura | 1,7 | M1 | 1 | 3 | 570 | 8 | Composto | Ausente |
| 6b | M | 8 | Cintura | 2,5 | M1 | 1 | 2 | 484 | 3 | Composto | Ausente |
| 7a | M | 0,6 | Perna | 4 | M1 | 1 | 2 | 2900 | 8 | Composto | Ausente |
| 7b | M | 0,8 | Perna | 2,4 | M1 | 1 | 1 | 393 | 3 | Composto | Ausente |
| 8a | F | 10 | Perna | 1 | M1 | 3 | 2 | 547 | 2 | Intradérmico | Presente |
| 8b | F | 9 | Perna | 1,3 | M1 | 2 | 2 | 770 | 1 | Intradérmico | Ausente |
| 9a | M | 0,3 | Antebraço | 3,8 | M1 | 3 | 3 | 1468 | 20 | Composto | Ausente |
| 9b | M | 0,4 | Antebraço | 2 | M1 | 0 | 3 | 417 | 2 | Composto | Ausente |
| 10a | F | 4 | Tronco | 2,6 | M1 | 6 | 2 | 1744 | 7 | Composto | Ausente |
| 10b | F | 3 | Tronco | 6 | M1 | 10 | 2 | 660 | 12 | Composto | Presente |
| 11a | F | 3 | Tronco | 5,5 | M1 | 4 | 3 | 1103 | 18 | Composto | Presente |
| 11b | F | 3 | Tronco | 3 | M1 | 2 | 2 | 681 | 8 | Composto | Ausente |
| 12a | M | 1 | Perna | 4,3 | M1 | 2 | 3 | 867 | 7 | Composto | Ausente |
| 12b | M | 1 | Perna | 3,7 | M1 | 1 | 1 | 448 | 8 | Composto | Ausente |
F, feminino; M, masculino; PAS, do inglês predicted adult size; M1, 1,5‐10 cm; nível de profundidade: (1) Dentro da epiderme, (2) Na derme superficial, (3) Na derme média.
Havia 21 nevos compostos no presente estudo (21 de 24; 87,5%). No entanto, havia apenas um nevo intradérmico no grupo mutação (8,3%), enquanto havia dois no grupo controle (16,6%).
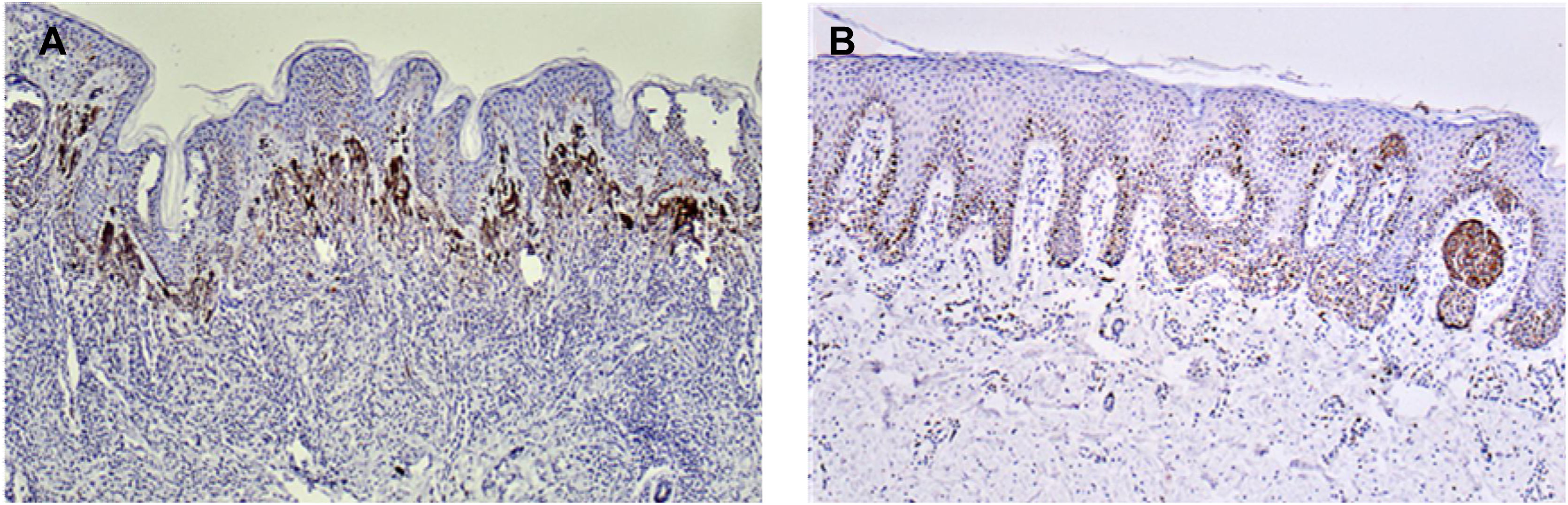
A imunorreatividade com Ki67 foi restrita ao núcleo de células positivas em um padrão granular distinto de coloração e muitas vezes não era homogênea. Ocasionalmente, a região nucleolar foi marcada de maneira proeminente. Não foi observada coloração citoplasmática. Imunorreatividade mais frequente foi observada na junção dermoepidérmica (figs. 2 e 3).
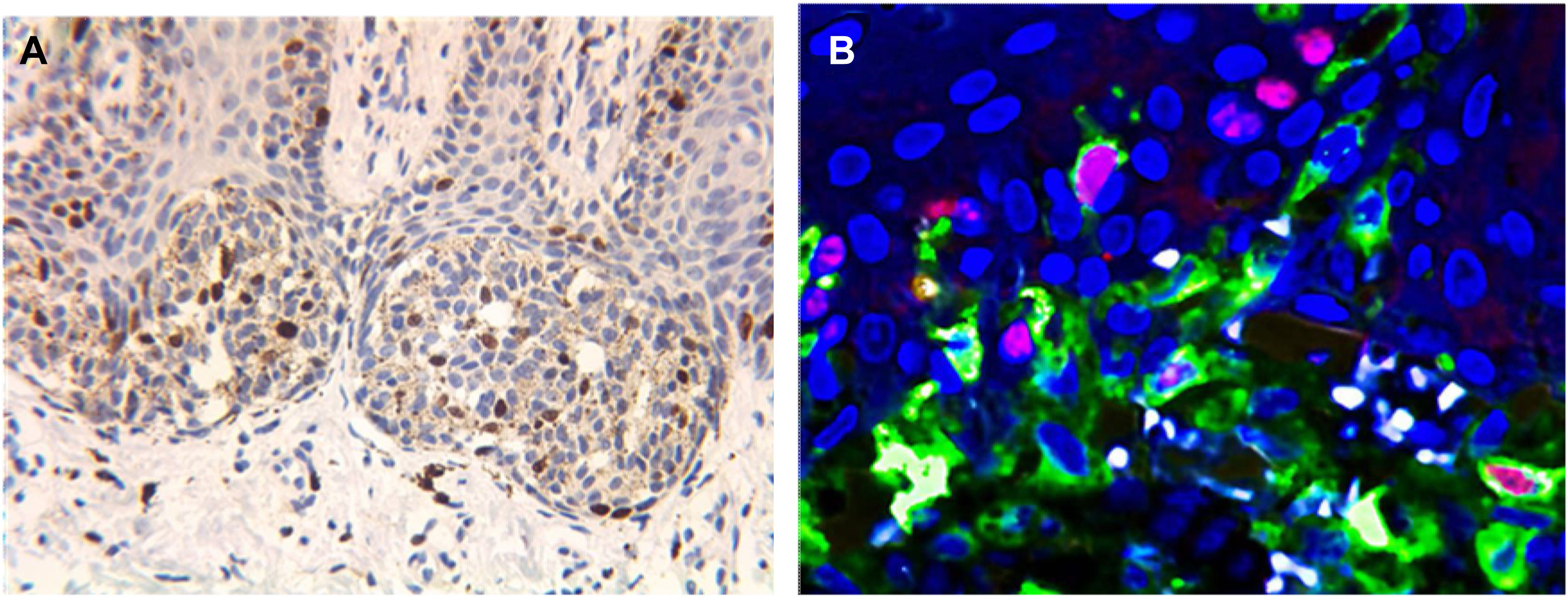
Os núcleos corados em marrom indicam expressão positiva de Ki67 (A, 400×). A microscopia confocal de fluorescência a laser pode facilmente eliminar a interferência dos grânulos de melanina. Células com fluorescência vermelha no centro e fluorescência amarela ao redor são células imunorreativas com Ki67 (B, 600×).
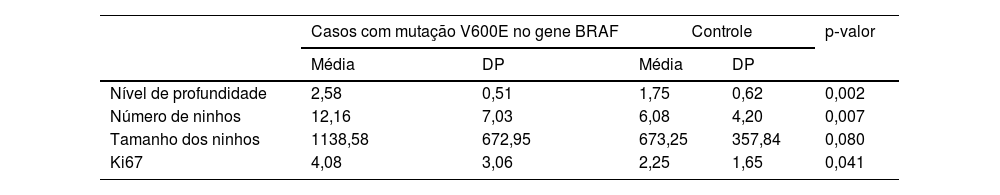
A tabela 2 mostra a proporção de células imunorreativas com Ki67 em cada par de nevos. Diferenças estatisticamente significantes foram detectadas entre o grupo com mutação e o grupo controle (p=0,041).
Características estatísticas dos nevos nos grupos mutante e controle
| Casos com mutação V600E no gene BRAF | Controle | p‐valor | |||
|---|---|---|---|---|---|
| Média | DP | Média | DP | ||
| Nível de profundidade | 2,58 | 0,51 | 1,75 | 0,62 | 0,002 |
| Número de ninhos | 12,16 | 7,03 | 6,08 | 4,20 | 0,007 |
| Tamanho dos ninhos | 1138,58 | 672,95 | 673,25 | 357,84 | 0,080 |
| Ki67 | 4,08 | 3,06 | 2,25 | 1,65 | 0,041 |
DP, desvio‐padrão.
As diferenças na extensão das células névicas em profundidade e no número de ninhos de células névicas entre o grupo com mutação e o grupo controle foram estatisticamente significantes, com valores de p=0,002 e 0,007, respectivamente, enquanto a diferença no tamanho dos ninhos de células névicas entre os dois grupos não foi estatisticamente significante (tabela 2).
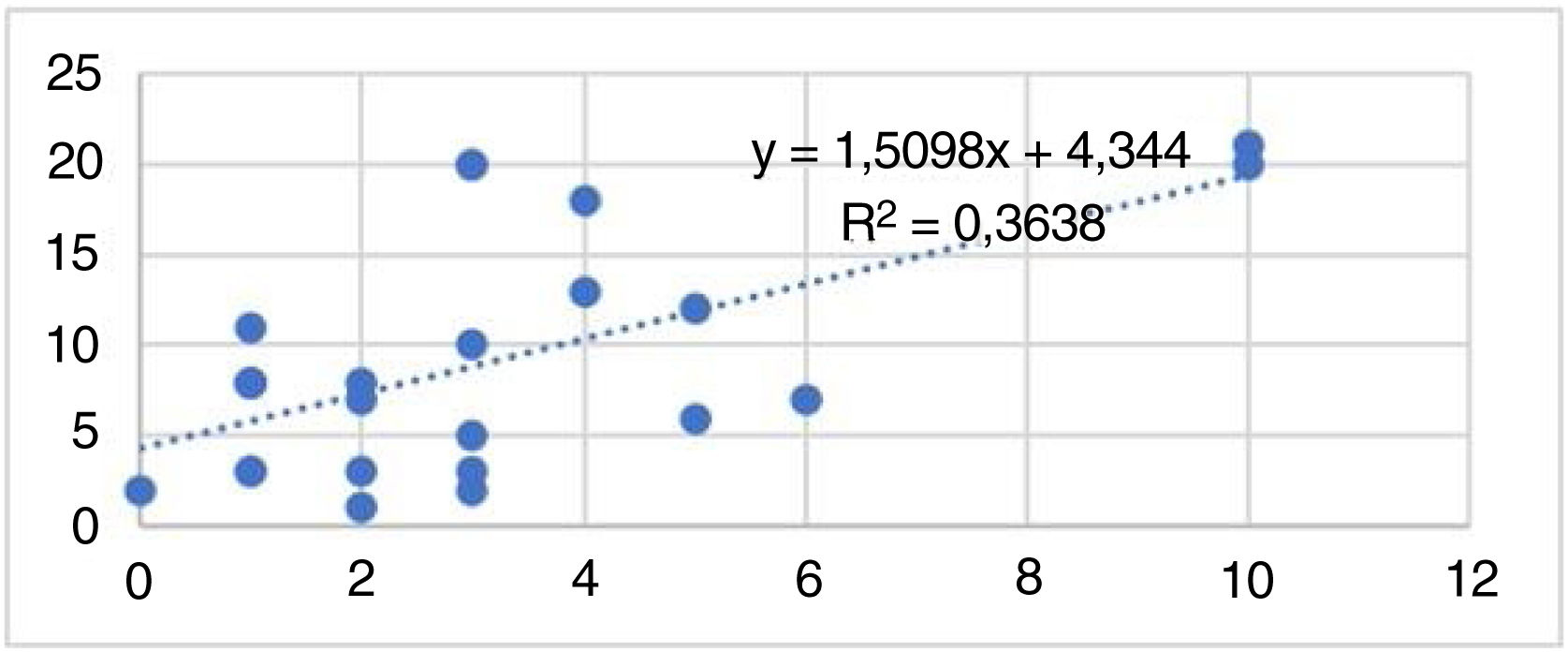
Entre os casos, a correlação entre o número de ninhos de células névicas e a taxa de positividade para Ki67 é mostrada na figura 4. O número de ninhos de células névicas (análise de regressão linear, coeficientes de correlação de Spearman: coeficiente=0,603; p=0,001; fig. 1) foram fortemente correlacionados com a proporção de células imunorreativas com Ki‐67. No entanto, a imunorreativa com Ki‐67 não apresentou correlação significante com a extensão das células névicas em profundidade, tamanho dos ninhos de células névicas e tamanho do nevo, e os coeficientes de correlação foram 0,11, 0,15 e 0,01, respectivamente.
A avaliação IHQ do gene BRAF foi realizada em 10 casos de maneira cega (sem conhecimento dos resultados do sequenciamento do gene antes da análise dos dados da avaliação). Todos os sete nevos sem imunorreatividade para a mutação V600E no gene BRAF eram negativos para a mutação BRAF, e todos os três nevos com imunorreatividade para a mutação V600E no gene BRAF tinham a mutação V600E no gene BRAF. Nenhuma outra mutação somática recorrente foi identificada.
DiscussãoNo momento, há poucos relatos na literatura sobre a associação de mutação genética com a histopatologia e atividade proliferativa de NMC.13,19,20 Esses relatos foram estudos holísticos e não diferenciaram entre nevos congênitos e adquiridos. Que seja de conhecimento dos autores, este é o primeiro estudo a demonstrar a relação entre a mutação no gene BRAF e a atividade proliferativa e aspectos histopatológicos de NMC.
De acordo com as características histopatológicas, os NMC podem ser juncionais, compostos ou exclusivamente intradérmicos. As características histopatológicas estão relacionadas principalmente com o tamanho do nevo.21 Quase todos os nevos incluídos neste estudo eram compostos (21 de 24; 87,5%) e as características histopatológicas foram consistentes com o padrão congênito, como simetria, boa circunscrição, ninhos uniformes na epiderme equidistantes uns dos outros, ninhos de melanócitos e melanócitos individuais na derme que diminuem de tamanho a medida que se aprofundam na derme, células névicas dispostas ao redor dos vasos e estruturas anexiais e dispersas entre os feixes de colágeno.22 É digno de nota que a diferença na profundidade do nevo foi significante entre os dois grupos pareados. As células névicas no grupo de mutação no gene BRAF se estendem mais profundamente do que no grupo sem mutação. Esse fenômeno pode ser causado pelo aumento da atividade proliferativa das células névicas após a mutação no gene BRAF. A profundidade da infiltração do nevo também foi positivamente correlacionada com o tamanho do nevo.21 Em razão do exposto, pode‐se chegar a uma conclusão preliminar de que a profundidade da infiltração do nevo não está relacionada apenas com o tamanho do mesmo, mas também com a mutação V600E no gene BRAF no NMC. Além disso, os achados deste estudo ampliam o conhecimento da correlação genótipo‐fenótipo em NMC.
O anticorpo monoclonal Ki‐67 tem sido amplamente utilizado em histopatologia e mostrou ser de grande valor para a classificação de tumores e na correlação com a sobrevida de pacientes em muitas neoplasias malignas humanas.23 Porém, os dados sobre a expressão do marcador de atividade proliferativa Ki67 em NMC são limitados. Soyer incluiu nevos melanocíticos benignos em seu estudo e encontrou diferenças significantes na expressão do antígeno Ki‐67 entre nevos, melanoma primário e metastático.24
A mutação V600E no gene BRAF é observada em nevos com alta frequência10 e é uma mutação condutora na patogênese do melanoma.25 A mutação V600E no gene BRAF ativa temporariamente a proliferação de melanócitos névicos e induz a expressão de p16 que, em resposta, interrompe a proliferação de melanócitos.26 Mas a parada é reversível, pois alguns nevos acabam se transformando em melanomas cutâneos.27 Há um equilíbrio dinâmico entre a hiperplasia e a inibição dos nevos e, se esse equilíbrio for rompido, é provável que evolua para melanoma.
No presente estudo, houve diferença estatisticamente significante na atividade de proliferação entre os nevos com mutação V600E no gene BRAF e o grupo controle. Assim, com a mutação V600E no gene BRAF, o NMC pode ter maior atividade proliferativa e talvez ser mais suscetível a outros fatores irritantes, como exposição solar e fricção, e eventualmente progredir para melanoma.
Que seja de conhecimento dos autores, foi demonstrado que a atividade proliferativa de NMC está positivamente correlacionada com o número de ninhos de células névicas, mas não com o tamanho dos ninhos. Portanto, o número de ninhos pode ser um índice de atividade proliferativa e pode ser usado em estudos futuros.
A pesquisa é preliminar, e os resultados terão que ser validados em escala maior em outras pesquisas. Estudos adicionais de nevos prometem aumentar a compreensão dos mecanismos da nevogênese e da transição de neoplasia benigna para maligna.
ConclusãoO presente estudo demonstra que a mutação V600E no gene BRAF pode aumentar a atividade proliferativa e afetar as características histopatológicas dos NMC em crianças. Por outro lado, as características histopatológicas de um NMC podem fornecer informações relevantes sobre seu background molecular, incluindo a presença da mutação V600E no gene BRAF, que é a causa mais comum de tumores melanocíticos e a alteração com alvo terapêutico mais comum no melanoma. Maior compreensão da correlação genótipo‐fenótipo em NMC pode facilitar um diagnóstico mais preciso e um manejo mais adequado desses tumores melanocíticos humanos extremamente comuns.
Suporte financeiroEste trabalho recebeu suporte financeiro da Research Foundation of the Capital Institute of Pediatrics (número do projeto: LCPY‐2021‐04).
Contribuição dos autoresJianyou Chen: Aprovação da versão final do manuscrito; concepção e planejamento do estudo; elaboração e redação do manuscrito; obtenção, análise e interpretação dos dados; participação efetiva na orientação da pesquisa; revisão crítica da literatura; revisão crítica do manuscrito.
Gaolei Zhang: Aprovação da versão final do manuscrito; concepção e planejamento do estudo; elaboração e redação do manuscrito; revisão crítica da literatura.
Xiaoyan Liu: Aprovação da versão final do manuscrito; obtenção, análise e interpretação dos dados; participação efetiva na orientação da pesquisa.
Ping Tu: Análise estatística; aprovação da versão final do manuscrito; obtenção, análise e interpretação dos dados; participação efetiva na orientação da pesquisa; revisão crítica da literatura; revisão crítica do manuscrito.
Conflito de interessesNenhum.
Os autores agradecem à Research Foundation of the Capital Institute of Pediatrics pelo apoio a este trabalho. Os autores gostariam de agradecer aos técnicos dos departamentos da instituição, especialmente Ping Xiao, por sua produção diligente de lâminas e colorações. Também agradecem ao Prof. Liangyu Liu, por disponibilizar o microscópio de fluorescência confocal a laser. Também gostariam de agradecer ao Prof. Jie Gong, por seus conselhos e ajuda no manuseio de amostras e métodos utilizados nos testes genéticos.
Como citar este artigo: Chen J, Zhang G, Liu X, Tu P. The association of BRAF V600E gene mutation with proliferative activity and histopathological characteristics of congenital melanocytic nevi in children. An Bras Dermatol. 2023;98:498–505.
Trabalho realizado no Peking University First Hospital e Children's Hospital Affiliated to Capital Institute of Pediatrics.