A verruga anogenital é a principal infecção sexualmente transmissível de atendimento em clínicas especializadas. Pode se apresentar por quadros frustros a exuberantes, conforme a interação do vírus com a imunidade do hospedeiro. A imunidade celular é a principal forma de defesa do epitélio contra o vírus, com participação ativa das células de Langerhans e citocinas pró‐inflamatórias como o TNF‐α.
ObjetivoAvaliar a resposta imune epitelial de verrugas anogenitais de homens, de acordo com o número de lesões apresentadas.
MétodosEstudo transversal prospectivo feito no ambulatório de dermatologia de hospital terciário. Foram incluídos pacientes do sexo masculino acima de 18 anos sem comorbidades, com condilomas anogenitais sem tratamentos prévios. Para avaliação da imunidade epitelial local as lesões foram quantificadas e, após removidas, submetidas a exame de imuno‐histoquímica de CD1a para morfometria e morfologia das células de Langerhans, além de reação de TNF‐α, para avaliação da impregnação dessa citocina no tecido.
ResultadosForam incluídos no estudo 48 pacientes. Não houve diferença estatisticamente significante ao se comparar o número de lesões à morfometria das células de Langerhans, nem à morfologia dessas células e à presença de TNF‐α nas lesões. Entretanto, notou‐se que pacientes com maior número de células de Langerhans nas lesões tinham suas células com morfologia estrelada e dendrítica, enquanto os com menos células apresentavam morfologia arredondada e sem dendritos (p <0,001).
Limitações do estudoNúmero reduzido de pacientes analisados.
ConclusõesNão houve diferença na imunidade epitelial entre os pacientes com poucas e muitas lesões de condilomas anogenitais, aferida pela morfologia e morfometria das células de Langerhans e positividade de TNF‐α. Estima‐se que essa avaliação por meio de outros marcadores de imunidade possa mostrar algum resultado.
As verrugas anogenitais, também conhecidas como condilomas acuminados (CA), são infecções sexualmente transmissíveis (IST) causadas pelo papilomavírus humano (HPV). São consideradas a IST mais frequente nos países em desenvolvimento e, atualmente, podem ser classificadas como uma epidemia global. As verrugas anogenitais podem ser causadas por diversos sorotipos de HPV, são mais frequentemente causadas pelos HPV de baixo risco dos tipos 6 e 11.1 Podem causar sofrimento psicológico e fazer com que os pacientes se sintam envergonhados e menos atraentes, o que reduz a qualidade de vida. Tem sido demonstrado que alto nível de ansiedade, raiva e depressão está associado ao diagnóstico e tratamento das verrugas genitais e aproximadamente dois terços dos pacientes fazem mudanças no estilo de vida em relação às relações sexuais, além de o prazer sexual e a atividade também serem afetados negativamente.2
A evolução das lesões HPV induzidas têm correlação com tipo viral, fatores genéticos, fatores ambientais e principalmente à imunidade do hospedeiro.3,4 Participam dessa defesa imune do epitélio as células dendríticas, que na pele são representadas pelas células de Langerhans (CL), e os próprios queratinócitos.5 Como o principal alvo do HPV, o queratinócito desempenha um papel importante durante o início da infecção pelo vírus e, posteriormente, torna‐se um elo para promover resposta imune adaptativa eficaz. Os queratinócitos atuam como células apresentadoras de antígenos e são capazes de induzir a expressão de citocinas: expressam receptores toll‐like (TLRs), que, ao reconhecer padrões moleculares associados a patógenos (PAMPs), são ativados e iniciam vias de sinalização que resultam em respostas imunes inatas e adaptativas.6 A ativação desses receptores promove assim a produção de citocinas, cria um poderoso ambiente pró‐inflamatório, em particular a ativação de TLR‐9, e estimula o queratinócito a produzir TNF‐α.6–8
As células de Langerhans são células dendríticas, geralmente encontradas na camada espinhosa da epiderme, cuja distribuição pelo corpo humano varia de 200 células/mm2 na região palmoplantar e genital a cerca de 1.000/mm2 na cabeça, pescoço, tronco e membros.1 Têm papel importante na resposta imune da pele pela sua capacidade de captura e apresentação de antígenos aos linfócitos T. A maturação da CL também é papel fundamental para a indução eficiente de respostas de células T, tais sinais de maturação são provenientes da comunicação da CL com o tecido circundante através das citocinas pró‐inflamatórias derivadas de tecidos, como o TNF‐α.8,9
Entretanto, o HPV pode modular essa adesão e migração das CL, além de poder afetar o número de CL presente no epitélio infectado. Morelli et al.10 constataram que as CL estavam significativamente diminuídas nos tratos genitais infectados por HPV masculino e feminino, enquanto Banchereau et al.11 também relataram morfologia anormal e distribuição de CL em lesões de condilomas acuminados.5 Acreditamos que o número de lesões condilomatosas que os pacientes desenvolvem poderiam ter correlação com a presença de uma imunidade efetiva. Até o momento, há poucos estudos relacionados que avaliam tal correlação.
O presente estudo se propõe a avaliar a imunidade epitelial de verrugas anogenitais de homens atendidos em ambulatório de dermatologia, correlacionar a apresentação clínica das verrugas (número de lesões) à imunidade local, medida por meio da quantificação (morfometria) e aspectos morfológicos das células de Langerhans nelas, bem como correlacionar o número de lesões à presença ou ausência de marcação de TNF‐α nelas.
Material e métodosFizemos estudo transversal prospectivo no Ambulatório de Infecções Sexualmente Transmissíveis da Clínica de Dermatologia de Hospital Terciário da cidade de São Paulo de janeiro de 2015 a dezembro de 2017. O projeto de pesquisa foi submetido ao e aceito pelo comitê de ética em pesquisa da instituição (CAAE n° 40848115.4.0000.5479).
O cálculo amostral foi obtido sobre um nível de significância de 5%, com poder de teste de 80%, a partir de uma fórmula calculada em comparação de proporções em que os inputs do cálculo vieram dos resultados obtidos em estudo piloto de 24 pacientes. A partir desse cálculo chegou‐se a um número de 48 pacientes.
Foram incluídos neste estudo pacientes do sexo masculino, a partir de 18 anos, atendidos no referido ambulatório que apresentassem verrugas anogenitais de qualquer localização e que concordassem em participar do estudo e assinassem o Termo de Consentimento Livre e Esclarecido (TCLE). Foram incluídos independentemente do número e do tamanho das verrugas. No entanto, as verrugas deveriam ter aparecido há mais de um mês. Foram excluídos do estudo os pacientes que apresentavam imunocomprometimento sistêmico (transplantados, soropositivos para o vírus da imunodeficiência humana [HIV] ou portadores de síndrome da imunodeficiência adquirida [Aids], pacientes oncológicos); que faziam uso de medicamento imunossupressor sistêmico (corticoterapia, imunoterapia, quimioterapia); que fizeram qualquer tratamento tópico prévio ou atual da lesão (medicamentoso ou não); que apresentavam lesão que não pudesse ser submetida à exérese cirúrgica.
Todos os pacientes que aceitaram participar do estudo foram submetidos a anamnese clínica e com contagem do número e localização dos condilomas. As lesões foram removidas em sua totalidade por meio do procedimento padrão do serviço, que é a exérese cirúrgica. Pacientes com mais de uma lesão foram submetidos a exérese de todos os condilomas em um mesmo tempo cirúrgico. Para todos os blocos de parafina com amostras de condilomas foram feitos dois processos de reação imuno‐histoquímica: um com anticorpo CD1a para se analisarem as células de Langerhans e outro com TNF‐α para se avaliar a positividade de impregnação da citocina na epiderme.
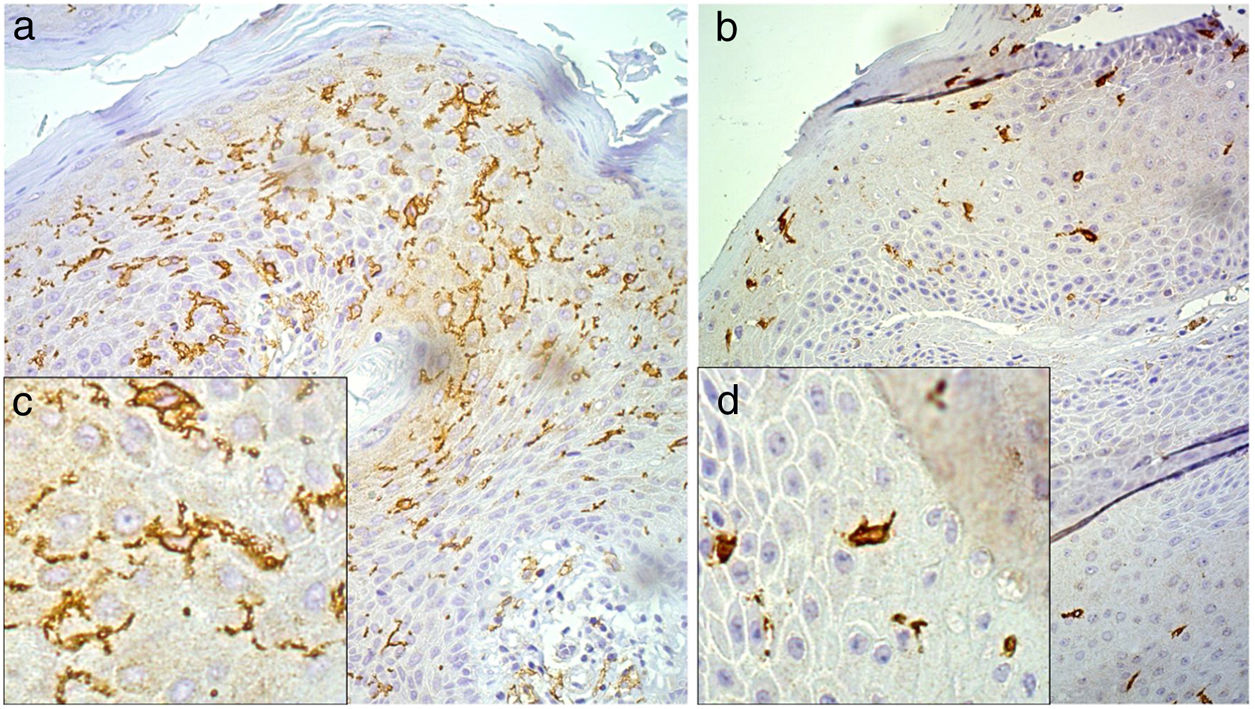
Após a imuno‐histoquímica para CD1a, as lâminas foram submetidas à morfometria para células de Langerhans (CL) pela técnica descrita por Campaner e Galvão.12 A morfometria das CL foi obtida no aumento de 200×com auxílio da câmara de Neubauer, contabilizados 10 campos aleatórios de cada lâmina, e seu resultado quantificado por milímetro quadrado. Para a análise de morfologia das CL, as células foram avaliadas e apresentavam na amostra aspecto estrelado com dendritos longos e bem definidos ou aspecto arredondado sem dendritos ou com dendritos curtos (fig. 1).
Morfologia das células de Langerhans pelo exame imuno‐histoquímico CD1a, com aumento 200×(A e B) e zoom digital 32.000×(C e D), identifica as células de Langerhans em coloração marrom. A e C, células com projeções dendríticas evidentes. B e D, células arredondadas e com poucas ou sem projeções dendríticas.
As lâminas submetidas à imuno‐histoquímica para TNF‐α foram consideradas positivas as amostras que apresentaram impregnação marrom na membrana citoplasmática das células da epiderme, conforme padrão apresentado em manual do fabricante do reagente, e negativas as que não apresentavam tal impregnação.
Foram feitas as comparações entre número de lesões, número de células de Langerhans, morfologia de célula de Langerhans e análise de TNF‐α. Quanto ao número de lesões, os pacientes foram categorizados em dois grupos: até cinco lesões e acima de cinco lesões.
ResultadosNo período do estudo foram atendidos 492 pacientes com hipótese clínica de condiloma acuminado anogenital. Desses pacientes, 443 foram excluídos do estudo pelas seguintes razões: por serem do sexo feminino, por apresentarem idade inferior a 18 anos, por apresentarem imunossupressão associada (infecção pelo vírus HIV, transplantados etc.), por terem feito tratamento prévio para a(s) lesão(ões) referida(s) ou por não confirmação do diagnóstico de condiloma anogenital. Restaram dessa maneira 49 pacientes que preencheram os critérios de inclusão/exclusão. Um paciente foi excluído posteriormente após os exames de imuno‐histoquímica, visto que o material não foi representativo (material insuficiente). Assim, o número final de pacientes analisados no estudo foi de 48, número esse compatível ao cálculo amostral apresentado anteriormente.
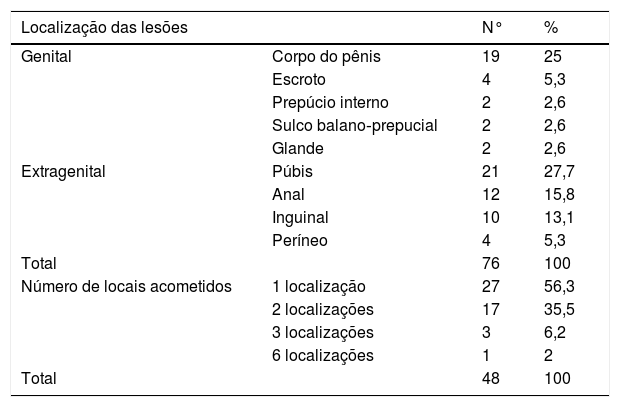
Entre os 48 pacientes avaliados, as lesões acometiam preferencialmente as regiões extragenitais, com 47 casos (61,9%), seguido das localizações genitais em 29 casos (38,1%); 27 dos 48 pacientes (56,3%) apresentavam verrugas em apenas uma localização, enquanto que 21 pacientes (43,7%) apresentavam lesões em diversos locais (tabela 1).
Localização das lesões condilomatosas retiradas dos 48 pacientes
| Localização das lesões | N° | % | |
|---|---|---|---|
| Genital | Corpo do pênis | 19 | 25 |
| Escroto | 4 | 5,3 | |
| Prepúcio interno | 2 | 2,6 | |
| Sulco balano‐prepucial | 2 | 2,6 | |
| Glande | 2 | 2,6 | |
| Extragenital | Púbis | 21 | 27,7 |
| Anal | 12 | 15,8 | |
| Inguinal | 10 | 13,1 | |
| Períneo | 4 | 5,3 | |
| Total | 76 | 100 | |
| Número de locais acometidos | 1 localização | 27 | 56,3 |
| 2 localizações | 17 | 35,5 | |
| 3 localizações | 3 | 6,2 | |
| 6 localizações | 1 | 2 | |
| Total | 48 | 100 |
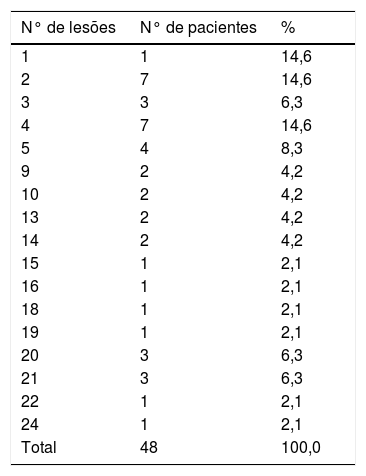
Em relação ao número de lesões, os homens apresentavam um número que variou entre um e 20, com média de 8,4±7,5 lesões e mediana de 4,5. Esses dados são representados na tabela 2. A distribuição do número de lesões foi variável, o que não permitiu uma representatividade com amostra satisfatória de pacientes em cada grupo de número de lesões. Os 48 pacientes se distribuíram dentre 17 grupos com número de lesões que variou de um a 20. Esse fato não permite uma correlação válida a cada variável do estudo, como, por exemplo, o número de células de Langerhans e impregnação de TNF‐α. Frente a essa situação, os 48 pacientes foram divididos por número de lesões em dois grupos: até cinco lesões e acima de cinco lesões. O primeiro grupo contém 28 pacientes (58,3%), enquanto o segundo, 20 (41,7%). Essa divisão em dois grupos permitiu uma representatividade mais equivalente dos 48 pacientes do estudo, tornou‐se mais adequada a comparação do número de lesões aos demais fatores pesquisados. O número de cinco lesões para divisor dos grupos foi escolhido frente a uma aplicabilidade prática da abordagem terapêutica dos condilomas anogenitais: opta‐se na prática dermatológica por se usarem procedimentos destrutivos, como, por exemplo, exérese cirúrgica ou eletrocauterização das lesões sob anestesia infiltrativa, nos casos com menos lesões, e por procedimentos não destrutivos, como uso de substâncias tópicas (ex.: podofilina, imiquimode, 5‐fluoracil) para redução das lesões e terapias destrutivas em um segundo momento, nos casos de pacientes portadores de diversas lesões.13
A morfometria das células de Langerhans variou de 18 a 245 células/mm2, com média de 138,75±65,16 células e mediana de 196 células/mm2. Quanto à morfologia das células de Langerhans, observaram‐se apenas dois tipos de apresentações: células estreladas e com dendritos finos e compridos ou células arredondadas com dendritos curtos e/ou ausentes (fig. 1). Dos 48 pacientes estudados, 22 (45,8%) apresentavam células de Langerhans arredondadas, enquanto 27 (56,3%) apresentavam estreladas. O TNF‐α foi positivo em 27 (56,3%) e negativo em 21 (43,8%) das 48 amostras.
Comparando‐se o número de células de Langerhans por milímetro quadrado ao número de lesões apresentadas pelos pacientes, verificou‐se que não houve diferença estatisticamente significante entre os grupos (t‐teste; p=0,784). A comparação entre a morfologia das células de Langerhans e o número de lesões apresentadas pelos dois grupos também não resultou em diferença estatisticamente significante (teste qui‐quadrado; p=0,922). Após as correlações histológicas analisadas pelas células de Langerhans, seguiu‐se a uma análise da correlação entre a positividade de TNF‐α aos grupos de poucas e muitas lesões. Nessa comparação, não foi observado um resultado estatisticamente significativo (teste qui‐quadrado; p=0,302).
Ao se correlacionar a morfologia à morfometria das células de Langerhans, foi observado que as células estreladas e com dendritos estavam mais presentes nas lesões com maior número de células e as células de Langerhans ovaladas e sem ou com poucos dendritos estavam mais presentes nas lesões com menor número de células. A comparação entre esses dois grupos evidenciou alteração estatisticamente significativa, com p <0,001 pelo teste de Mann‐Whitney (fig. 1).
DiscussãoSegundo a Organização Mundial de Saúde (OMS), nos países em desenvolvimento as infecções sexualmente transmissíveis e suas complicações estão entre as cinco principais categorias de enfermidades para as quais os adultos procuram cuidados de saúde. Nos Estados Unidos considera‐se que o condiloma anogenital afete cerca de 1% da população, com 500.000 novos casos por ano e 300.000 consultas médicas por ano.4 Para o Brasil, a OMS estima o aparecimento anual de 684.400 novos casos.14 Fagundes et al. conduziram no Brasil um estudo epidemiológico em clínica de referência de IST que contabilizou em 10 anos 4.128 pacientes atendidos.15 Desses pacientes, a maioria foi do sexo masculino (76%) e a principal doença diagnosticada foi o condiloma acuminado (29%). Esse estudo também evidenciou 7,9% de indivíduos diagnosticados com soropositividade para o HIV. Desses, 90,8% do sexo masculino com razão H:M de 9,9:1.15
O parasitismo do HPV na região anogenital do homem pode levar, desde ao aparecimento de condilomas e lesões precursoras de câncer a neoplasias agressivas, mutilantes e fatais.3,14,16 Entre essas lesões, o câncer e suas lesões precursoras são raras, com aumento da incidência do câncer anal principalmente em pacientes homens que fazem sexo com homens (HSH).17 Apesar de o condiloma ser uma lesão de caráter benigno, apresenta uma considerável incidência na população e promove uma repercussão psicológica no portador da verruga que pode ser devastadora em diversos campos psicossociais.2 Dessa maneira, o melhor entendimento da imunologia da infecção pelo HPV seria de extrema valia na programação terapêutica e prognóstica das lesões.
Sabe‐se que a resposta imune ao HPV se baseia no reconhecimento pelas células dendríticas, na epiderme representadas pelas células de Langerhans. Elas atuam como células apresentadoras de antígenos (APC) que absorvem e processam o antígeno epicutâneo, migram para os linfonodos regionais e, em seguida, apresentam o antígeno processado às células‐T virgens, iniciam respostas imunológicas primárias.7,9,18 Essas células‐T sensibilizadas pela apresentação de antígeno retornam ao epitélio infectado, combatem através de produção de citocinas a infecção viral. Embora seja bem conhecido que a migração de LC é necessária para a apresentação de antígenos, pouco se sabe sobre os mecanismos moleculares envolvidos. Estudos indicam que citocinas pró‐inflamatórias como a IL‐1 e TNF‐α estimulam essa migração, enquanto citocinas como IL‐10 a inibem.6–9,18
No presente estudo tentamos correlacionar o numero de lesões à imunidade local, postulamos que quanto maior o numero de lesões apresentado pelo paciente, pior seria a sua resposta imunológica. Evidências sobre a correlação entre o condiloma acuminado e a imunidade local aferida pela morfometria e morfologia das CL já foram reportados, indicaram que pacientes portadores das lesões apresentam um número inferior de CL em comparação aos pacientes sem condilomas.5 Feng et al. pesquisaram através de exame imuno‐histoquímico CD1a a morfometria das CL em lesões de condilomas e encontraram um número estatisticamente menor (26,31±8,84) em comparação aos controles de pele sã (72,00±27,20) (p <0,001).5 Evidenciaram também nessa mesma pesquisa grânulos de Birbek reduzidos nas CL de lesões pela microscopia eletrônica em comparação aos controles normais, corresponderam a alterações degenerativas das CL nos condilomas.5 Em outro estudo mais antigo de Mc Ardle et al., foi feita a quantificação das CL no tecido através de imuno‐histoquímica com S100 e também evidenciado que pacientes com condiloma apresentavam número reduzido de células em comparação ao epitélio normal.19 Acreditamos que haja duas possibilidades para interpretar o menor número de CL nas lesões condilomatosas em comparação à pele sã: ou por já ter ocorrido a migração ao linfonodo no momento da biópsia ou pelas CL terem sido suprimidas pela infecção viral. Não foram encontrados na literatura trabalhos que fizesse a comparação das CL entre pacientes com muitas e poucas lesões de condiloma, como feito no presente estudo.
No nosso estudo foi correlacionado o número de verrugas ao número de CL e à marcação no tecido pelo TNF‐α e observamos não haver significância estatística entre a morfologia e morfometria das CL nos grupos de poucas e de muitas lesões. Esses achados foram contrários ao que esperávamos, visto que acreditávamos que quanto maior o número de lesões, menor o número de células. A análise do TNF‐α foi feita a fim de se avaliar se a morfometria das CL se correlacionaria com essa citocina estimuladora de migração das células. Entretanto, não se observou correlação entre a marcação de TNF‐α e a morfometria ou morfologia das CL, o que nos impediu de fazer qualquer afirmação sobre a interação desses fatores.
Um achado positivo relevante do nosso estudo foi a presença de correlação entre o número de CL com a morfologia delas. Amostras com maior número de células de Langerhans apresentavam células estreladas com dendritos longos, múltiplos e evidentes, enquanto amostras com menor número de CL apresentavam células arredondadas, com poucos ou nenhum dendrito. Na interpretação dos autores, esse achado parece indicar que o epitélio sensibilizado com o início imunológico de apresentação de antígeno às CL apresenta menor número de células pela provável migração ao linfonodo e as poucas células ainda presentes no tecido já retraído e preparado para dar sequência na cascata imunológica que está por vir, enquanto que no epitélio com muitas células de Langerhans que se apresentam estreladas ainda não se iniciou a sensibilização das CL com sua respectiva alteração morfológica e migração ao linfonodo.
ConclusãoAcreditamos que a imunidade epitelial de verrugas anogenitais é processo complexo e multifatorial. A falta de correlação estatística entre as características estudadas das CL aos números de lesões dos pacientes levanta a possibilidade de haver possível subgrupos divididos por outras variáveis que apresentem uma correlação estatisticamente significante. Esse fato foi o que motivou os autores a incluir nesta pesquisa a análise de TNF‐α nas variáveis de avaliação da imunidade epitelial dos condilomas, mas que não apresentou correlação aos índices analisados. Acreditamos que mais estudos sobre a imunidade epitelial dos condilomas anogenitais devam ser feitos para se elucidarem com maior propriedade os aspectos imunológicos envolvidos e assim compreender melhor sua etiopatogenia e ampliar as possibilidades terapêuticas das lesões.
Suporte financeiroNenhum.
Contribuição dos autoresJohn Verrinder Veasey: Análise estatística; aprovação da versão final do manuscrito; concepção e planejamento do estudo; elaboração e redação do manuscrito; obtenção, análise e interpretação dos dados; participação efetiva na orientação da pesquisa; participação intelectual em conduta propedêutica e/ou terapêutica de casos estudados; revisão crítica da literatura; revisão crítica do manuscrito.
Adriana Bittencourt Campaner: Aprovação da versão final do manuscrito; concepção e planejamento do estudo; elaboração e redação do manuscrito; participação efetiva na orientação da pesquisa; revisão crítica da literatura; revisão crítica do manuscrito.
Rute Facchini Lellis: Obtenção, análise e interpretação dos dados.
Conflitos de interesseNenhum.
Como citar este artigo: Veasey JV, Campaner AB, Lellis RF. Aspects of Langerhans cells and TNF‐α in the cutaneous immunity of anogenital warts. An Bras Dermatolo. 2020;95:144–149.
Trabalho realizado na Clínica de Dermatologia, Santa Casa de São Paulo, Vila Buarque, SP, Brasil.