O estresse oxidativo está fortemente associado com a senescência celular. Vários estudos indicaram que os microRNAs (miRNAs) desempenham papel crítico na senescência celular. Foi relatado que o miR‐181a induz a senescência celular; entretanto, o mecanismo potencial do miR‐181a na senescência celular induzida por peróxido de hidrogênio (H2O2) permanece obscuro.
ObjetivoInvestigar o papel e o mecanismo regulador do miR‐181a na senescência celular induzida por H2O2.
MétodosFibroblastos de prepúcio humano (FPH) transfectados com inibidor de miR‐181a/miR‐NC com ou sem tratamento com H2O2 foram divididos em quatro grupos: controle+miR‐NC/ inibidor de miR‐181a, H2O2+miR‐NC/ inibidor de miR‐181a. O ensaio CCK‐8 foi utilizado para avaliar a viabilidade dos FPH. RT‐qPCR foi usada para medir a expressão de miR‐181a e seus genes alvo. Os níveis da proteína dissulfeto isomerase família A membro 6 (PDIA6) e marcadores de senescência foram avaliados por Western blotting. A coloração para β‐galactosidase associada à senescência (SA‐β‐gal) foi empregada para detectar a atividade de SA‐β‐gal. As atividades de SOD, GPx e CAT foram detectadas pelos kits de ensaio correspondentes. A relação de ligação entre PDIA6 e miR‐181a foi identificada pelo ensaio relator de luciferase.
ResultadosA inibição do MiR‐181a suprimiu o estresse oxidativo induzido por H2O2 e a senescência celular em FPH. PDIA6 foi alvo de miR‐181a e pouco expressa em FPH tratados com H2O2. O knockdown de PDIA6 reverteu o impacto supressivo mediado pela inibição do miR‐181a no estresse oxidativo induzido por H2O2 e na senescência celular em FPH.
Limitações do estudoAs vias de sinalização que podem ser mediadas pelo eixo miR‐181a/PDIA6 não foram investigadas.
ConclusãoO miR‐181a sub‐regulado atenua o estresse oxidativo induzido por H2O2 e a senescência celular em FPH atuando sobre PDIA6.
A senescência celular é um processo que consiste em uma parada de crescimento irreversível, considerada uma das características do envelhecimento.1 A senescência celular na pele leva ao envelhecimento cutâneo, que pode ser induzido por fatores extrínsecos e intrínsecos.2,3 Células senescentes podem ser detectadas por meio de muitas características, como atividade aumentada da β‐galactosidase associada à senescência (SA‐β‐gal), níveis elevados do supressor tumoral p53, do inibidor de quinase dependente de ciclina (CDK) p21 e da proteína marcadora de senescência 30 (SMP30).4,5 Vários estudos indicaram que o estresse oxidativo contribui para o envelhecimento da pele e danos dérmicos.6 O estresse oxidativo é um processo fisiológico resultante de espécies reativas de oxigênio (ROS, reactive oxygen species), ou de espécies reativas de nitrogênio, incluindo o peróxido de hidrogênio (H2O2) e o ânion superóxido (O2−).7 A pele tem um sistema de defesa antioxidante, incluindo os antioxidantes enzimáticos como superóxido dismutase (SOD), glutationa peroxidase (GPx) e catalase (CAT), que ajudam a eliminar o excesso de ROS.8 O SOD converte O2– em H2O2, enquanto GPx e CAT convertem H2O2 em água.9,10
Já foi elucidado que os microRNAs (miRNAs), RNAs não codificantes endógenos de 18 a 24 nucleotídeos, estão implicados em uma variedade de processos biológicos.11,12 Os miRNAs podem se ligar a regiões não traduzidas em 3’ (3’UTRs) do RNA mensageiro (mRNA) e regulam a expressão gênica pós‐transcricional.13 Múltiplos miRNAs têm sido indicados como desempenhando papel importante na senescência celular cutânea. Por exemplo, o miR‐217 facilita a senescência em fibroblastos da pele humana ligando‐se à DNA metiltransferase 1 (DNMT1).14 O miR‐20a‐3p é superexpresso em fibroblastos senescentes e leva à senescência celular ao ter como alvo HAS2.15 É importante ressaltar que o miR‐181a também demonstrou estar envolvido na senescência celular. Por exemplo, o miR‐181a é sobrerregulado durante a senescência de fibroblastos dérmicos humanos, o que subsequentemente induz a senescência celular em células de passagem inicial.16 Além disso, o miR‐181a sub‐regulado demonstrou atenuar o estresse oxidativo na lesão miocárdica pela interação com XIAP.17 Entretanto, o mecanismo potencial do miR‐181a na senescência celular induzida por H2O2 não está esclarecido.
A proteína dissulfeto isomerase família A membro 6 (PDIA6, também conhecida como P5) catalisa o enovelamento de proteínas e exibe atividades de isomerase e chaperona.18 Curiosamente, um estudo anterior demonstrou que PDIA6 é sub‐regulada durante a senescência celular em células‐tronco mesenquimais da medula óssea (CTMMO).19 Além disso, a PDIA6, localizada nas mitocôndrias, demonstrou inibir a morte celular causada pelo estresse oxidativo.20 No entanto, ainda é desconhecido se a PDIA6 exerce efeito na senescência celular induzida por H2O2 em fibroblastos do prepúcio humano (FPH).
No presente estudo, os autores objetivam explorar o papel e o mecanismo do miR‐181a subjacente ao estresse oxidativo induzido por H2O2 e à senescência celular em FPH. Os resultados podem ajudar a desenvolver uma nova perspectiva para melhorar o envelhecimento da pele.
Materiais e métodosCultura de célulasFPH obtidos do banco de células da Chinese Academy of Sciences (Xangai, China) foram incubados em meio de Eagle modificado por Dulbecco (DMEM, Invitrogen, Carlsbad, CA, EUA) contendo 10% de soro fetal bovino (FBS; Gibco, Grand Island, NY, EUA) e piruvato de sódio a 1% (Invitrogen) em incubadora umidificada a 37°C com 5% de CO2. Após crescerem até 80% de confluência, as células na fase logarítmica de crescimento foram inoculadas em placas de 96 poços (104 células/poço) e cultivadas por mais 24 horas. Em seguida, o meio de cultura foi removido e substituído por DMEM contendo 1% de FBS. Após 24 horas de incubação, 0 ou 200μM de H2O2 foi adicionado ao meio e mantido por 6h para estabelecer FPH de controle ou FPH induzidos por H2O2. Todos os experimentos foram realizados em triplicata.
Transfecção de célulasO inibidor de miR‐181a e o miR‐NC foram adquiridos da GenePharma (Xangai, China) e foram transfectados em FPH (50nM) para inibir o miR‐181a. RNA de hairpin curto atuando especificamente sobre a PDIA6 (sh‐PDIA6) e sh‐NC de controle também adquiridos da GenePharma foram transfectados em FPH (2μg/μL) para sub‐regulação de PDIA6. A transfecção celular foi realizada com lipofectamina 2000 (Invitrogen) seguindo as recomendações do fabricante. Após 48 horas, a eficiência de transfecção foi avaliada por RT‐qPCR. Todos os experimentos foram realizados em triplicata.
Ensaio de Contagem de células kit‐ 8(CCK‐ 8)Após tratamento com H2O2 e/ou indicação de transfecção, 10μL de solução de CCK‐8 (Dojindo, Kumamoto, Japão) foram adicionados ao meio e os FPH foram cultivados a 37°C por mais 2 horas. Em seguida, um leitor de microplacas (Molecular Devices, Xangai, China) foi utilizado para medir a absorbância em 450nm de acordo com as instruções do fabricante. Todos os experimentos foram realizados em triplicata.
Reação em cadeia da polimerase via transcriptase reversa quantitativa (qRT‐PCR)O RNA total foi isolado de FPH usando reagente TRIzol (Invitrogen). A síntese de cDNA foi alcançada por transcrição reversa de RNA total usando o kit de reagentes PrimeScriptTM RT (Takara, Dalian, China). A RT‐qPCR foi realizada utilizando SYBR® Premix Ex Taq™ II (Takara) em sistema de tempo real CFX96™ (Bio‐Rad, Hercules, CA, EUA). Os níveis de expressão relativa de miR‐181a e seus alvos downstream foram calculados com o método 2–ΔΔCt, com U6 e GAPDH como normalização, respectivamente. Todos os experimentos foram realizados em triplicata. As sequências de primers estão listadas na tabela 1.
Sequências de primers utilizadas na RT‐qPCR
| Gene | Sequência (5’-->3’) |
|---|---|
| hsa‐miR‐181a‐5p forward | ACACTCCAGCTGGGAACATTCAACGCTGTCGG |
| hsa‐miR‐181a‐5p reverse | TGGTGTCGTGGAGTCGA |
| PDIA6 forward | TCCTGCCCACTCCCTATCAA |
| PDIA6 reverse | GAACTGTATCCTCCGCTCCG |
| TNPO1 forward | GACGCGCCTACGGGA |
| TNPO1 reverse | TGTTGCACGGTTCTCTGGA |
| HMGB2 forward | GCCAACAGGCTCAAAGAA |
| HMGB2 reverse | CACACATTCCACACGCA |
| CBX4 forward | TGGAGTATCTGGTGAAATGGA |
| CBX4 reverse | ACGACGGGCAAAGGTAGGCAC |
| GAPDH forward | TGCACCACCAACTGCTTAGC |
| GAPDH reverse | GGCATGGACTGTGGTCATGAG |
| U6 forward | CTCGCTTGGGCAGCACA |
| U6 reverse | AACGCTTCACGAATTTGCGT |
Os FPH foram lisados em tampão RIPA (Cell Signaling, Danvers, MA, EUA) e a concentração de proteínas foi medida por um kit BCA (Bio‐Rad). Amostras de proteína (20μg) foram separadas por gel SDS‐PAGE a 10%, transferidas para membranas de fluoreto de polivinilideno (PVDF; Millipore, Billerica, MA, EUA) e bloqueadas com leite desnatado a 5%. Em seguida, as membranas foram incubadas a 4°C durante a noite com anticorpos primários da seguinte forma: anti‐p21 (ab109520, 1:1000), anti‐p53 (ab32389, 1:10000), anti‐SMP30 (ab233007, 1:400), anti‐beta‐actin (ab115777, 1:200), anti‐PDIA6 (ab154820, 1:1000); todos da Abcam, Cambridge, MA, EUA) seguido de incubação com anticorpo secundário (ab97080, Abcam) por 1 hora em temperatura ambiente. A beta‐actina foi usada como controle de carga. As proteínas foram analisadas com um sistema ECL (Bio‐Rad) e quantificadas pelo software ImageJ (National Institutes of Health, Bethesda, MD, EUA). Todos os experimentos foram realizados em triplicata.
Coloração de SA‐β‐galOs FPH foram lavados com PBS, fixados em formaldeído a 3% na temperatura ambiente por 15 minutos. Após a lavagem com PBS duas vezes, os FPH foram incubados durante a noite a 37°C com os corantes para β‐galactosidase (1mg/mL X‐gal, 2mM MgCl2, 150mM NaCl, pH 6,0, 5mM de ferrocianeto de potássio, 5mM de ferricianeto de potássio e 40nM de ácido cítrico/fosfato de sódio: Beyotime, Xangai, China). Subsequentemente, os FPH corados foram observados em um microscópio óptico (Nikon, Tóquio, Japão) com aumento de 50×e a porcentagem de células positivas foi determinada com o software Image‐Pro Plus 6.0 (Media Cybernetics, Silver Spring, MD, EUA). Todos os experimentos foram realizados em triplicata.
Detecção de atividades de SOD, GPx e CATAs atividades de SOD, GPx e CAT foram medidas conforme descrito anteriormente.21 Resumidamente, uma unidade de SOD foi definida como a quantidade de enzima que suprimiu 50% do formazan/min. A xantina e a xantina oxidase foram utilizadas para produzir ânions superóxido. A reação entre ânions superóxido e cloreto tetrassódico formou formazan amarelo, cuja absorção foi avaliada em 450nm. Para GPx, as reações enzimáticas em tubos contendo glutationa reduzida, glutationa redutase e NADPH, foram iniciadas pela adição de hidroperóxido de cumeno. A atividade de GPx foi medida em comprimento de onda de 340nm. Para a atividade de CAT, uma unidade de CAT foi definida como a quantidade de enzima que decompôs 1M de H2O2/min. A taxa de decomposição de H2O2 foi avaliada a 570nm. Os kits de ensaio SOD, GPx e CAT (Jiancheng Bioengineering Institute, Nanjing, China) foram usados para detectar espectrofotometricamente as atividades enzimáticas que foram expressas em U/mg de proteína. Todos os experimentos foram realizados em triplicata.
Ensaio relator de luciferaseO sítio de ligação complementar de miR‐181a em PDIA6 3’UTR foi previsto pelo TargetScan (http://www.targetscan.org/vert_71/). As sequências de tipo selvagem ou mutantes de PDIA6 3’UTR foram subclonadas em vetores pmirGLO (Promega, Madison, WI, EUA) para estabelecer PDIA6‐Wt/Mut. Posteriormente, esses vetores foram cotransfectados em FPH com inibidor de miR‐181a ou miR‐NC usando Lipofectamine 2000 (Invitrogen). Após 48 horas de transfecção, a atividade da luciferase foi avaliada utilizando‐se um kit relator dual‐luciferase (Promega), normalizado para a atividade da luciferase Renilla. Todos os experimentos foram realizados em triplicata.
Análise estatísticaO software SPSS 18.0 (SPSS, Chicago, IL, EUA) foi utilizado para a análise estatística. Os dados são apresentados como média±desvio padrão. As diferenças entre dois grupos foram analisadas pelo teste t de Student, enquanto aquelas entre mais de dois grupos foram avaliadas pela análise de variância (ANOVA) seguida pela análise post‐hoc de Tukey. Cada experimento foi repetido pelo menos três vezes. O valor de p<0,05 foi considerado significativo.
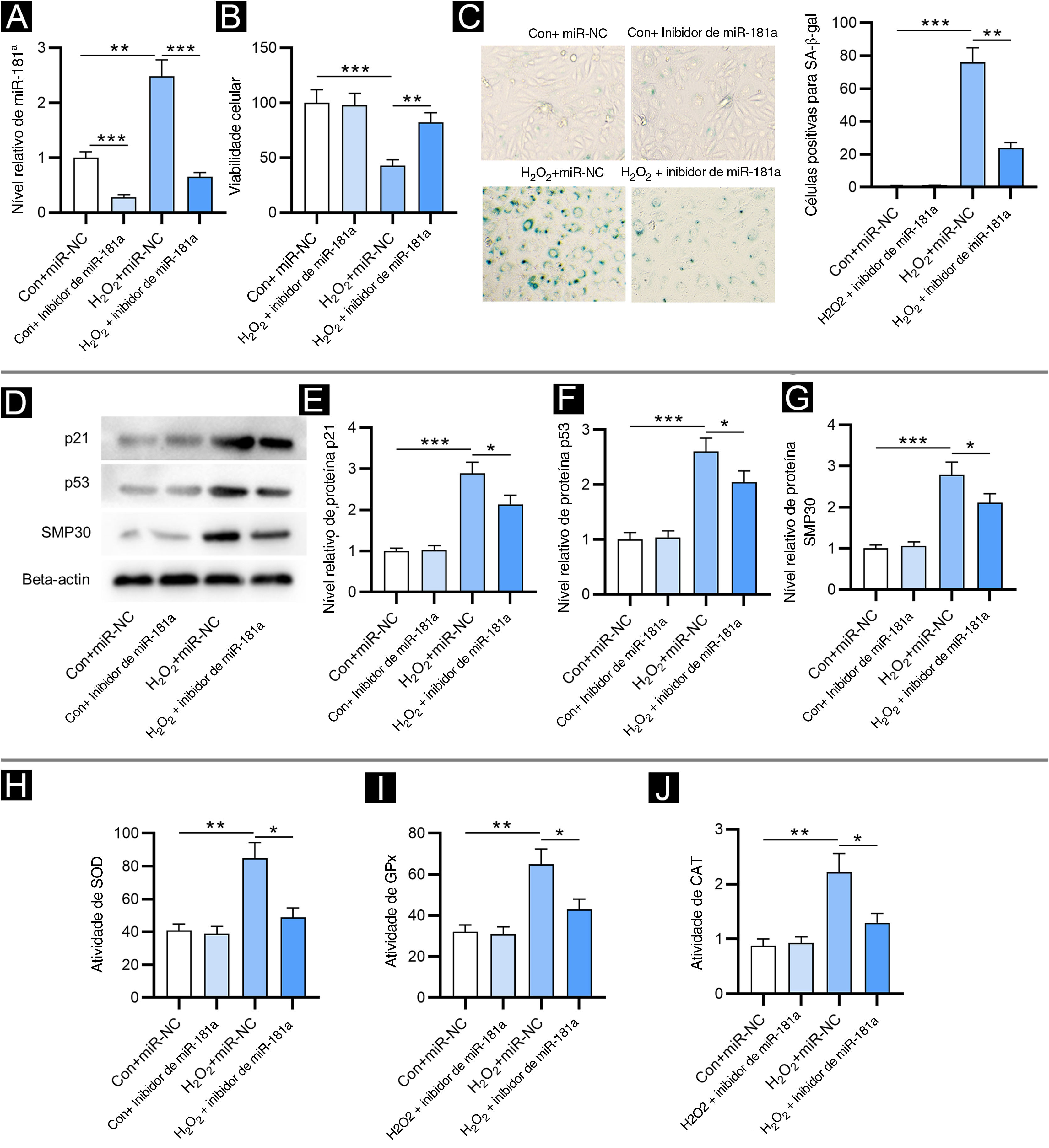
ResultadosA sub‐regulação do miR‐181a atenua a senescência celular induzida por H2O2 e o estresse oxidativoPrimeiro, foi detectado o nível de miR‐181a em FPH por RT‐qPCR. Em relação ao grupo controle, o nível de miR‐181a estava aumentado em FPH tratados com H2O2 e estava reduzido após a transfecção do inibidor de miR‐181a (fig. 1A). Em seguida, foi avaliado o impacto de miR‐181a na viabilidade dos FPH. Como revelado pelo ensaio CCK‐8, o tratamento com H2O2 reduziu acentuadamente a viabilidade dos FPH, enquanto a depleção de miR‐181a atenuou esse efeito (fig. 1B), sugerindo que miR‐181a sub‐regulado pode proteger FPH contra danos celulares induzidos por H2O2. Além disso, a detecção da atividade de SA‐β‐gal mostrou que a inibição de miR‐181a levou a uma redução no aumento da porcentagem de células positivas para SA‐β‐gal induzido por H2O2 (fig. 1C). Tendência semelhante foi observada nos resultados de Western blotting. Os níveis de proteína dos marcadores de senescência (p21, p53 e SMP30) foram significativamente aumentados pelo tratamento com H2O2 em FPH em comparação com os grupos controle e foram então diminuídos pelo inibidor de miR‐181a (fig. 1D?G). Os resultados acima indicaram que miR‐181a sub‐regulado atenua a senescência celular induzida por H2O2 em FPH. Posteriormente, foi testado se o miR‐181a tem impacto no estresse oxidativo induzido por H2O2. Como mostrado na figura 1H–J, o tratamento com H2O2 elevou acentuadamente as atividades de SOD, GPx e CAT, que foram parcialmente revertidas após a sub‐regulação de miR‐181a em FPH. Os resultados sugeriram que as enzimas antioxidantes respondem ativamente ao estresse oxidativo e a inibição do miR‐181a pode aliviar o estresse oxidativo induzido por H2O2.
A depleção de MiR‐181a atenua a senescência celular induzida por H2O2 e o estresse oxidativo. Os ensaios foram conduzidos em FPH com diferentes tratamentos (com ou sem H2O2; transfecção de miR‐NC ou inibidor de miR‐181a). (A) Análise de RT‐qPCR do nível de miR‐181a. (B) Ensaio CCK‐8 para avaliar a viabilidade celular. (C) Coloração para SA‐β‐gal para avaliar a atividade de SA‐β‐gal. As imagens das células foram fotografadas com aumento de 50×. (D–G) Western blotting foi utilizado para medir os níveis de proteínas dos marcadores de senescência. (H–J) Mensuração das atividades de SOD, GPx e CAT nos FPH. *p<0,05, **p<0,01, ***p<0,001.
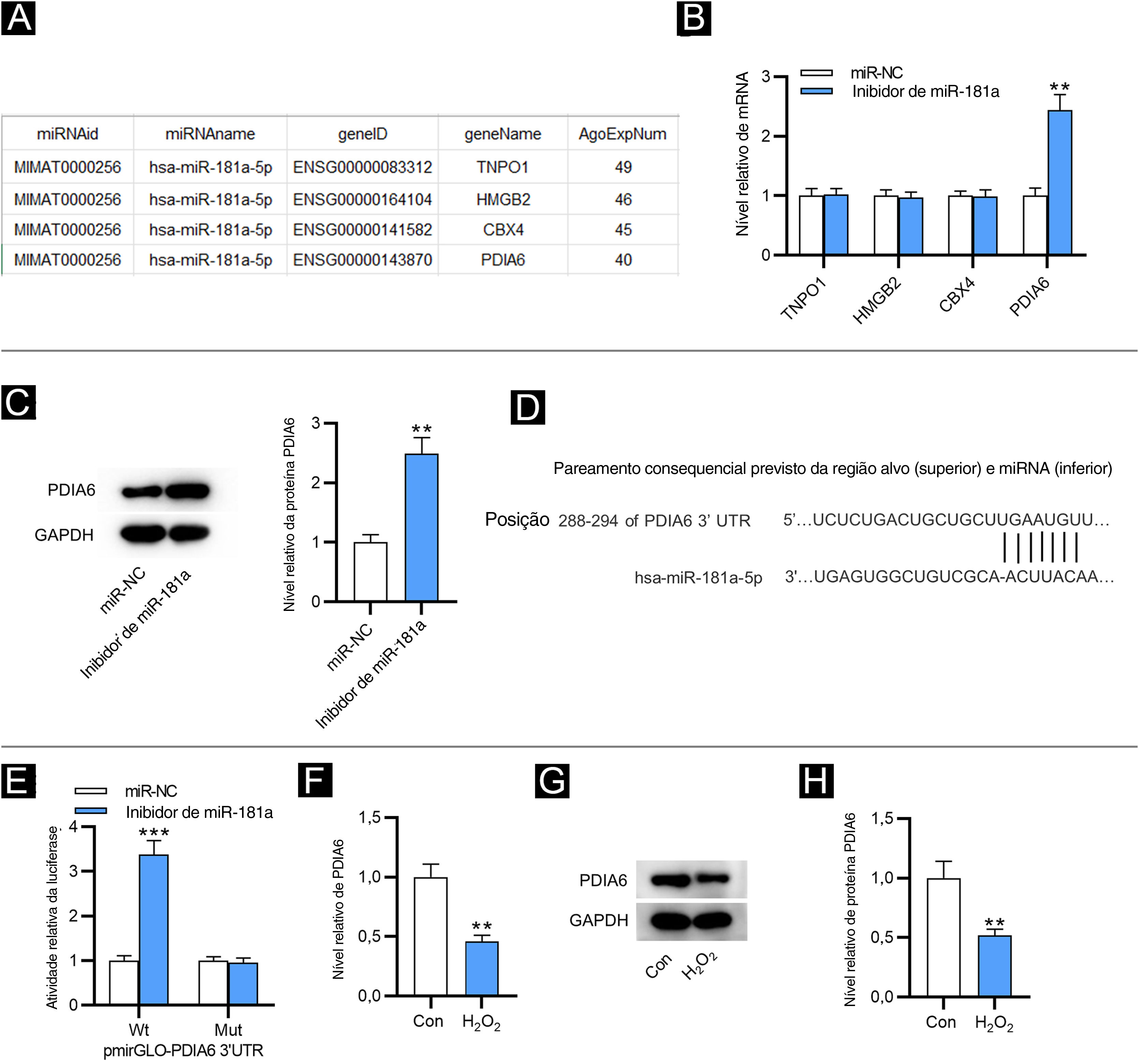
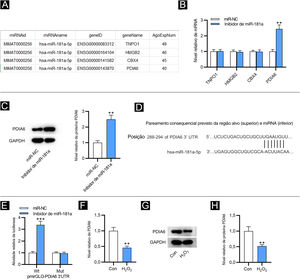
Como mostrado na figura 2A, quatro alvos downstream de miR‐181a foram selecionados pela ferramenta de bioinformática ENCORI (https://starbase.sysu.edu.cn/) com a condição de número de experimentos AGO CLIP‐seq suportados (AgoExpNum) ≥ 40. Os resultados da RT‐qPCR mostraram que após a inibição de miR‐181a em FPH, apenas o nível de PDIA6 foi significativamente aumentado (fig. 2B). Da mesma maneira, Western blotting mostrou que o inibidor de miR‐181a aumentou o nível de proteína de PDIA6 em FPH (fig. 2C). A existência de um sítio putativo complementar entre miR‐181a e PDIA6 foi prevista por TargetScan (fig. 2D). Além disso, a atividade de luciferase de PDIA6‐Wt foi sobrerregulada em FPH após a transfecção do inibidor de miR‐181a, enquanto a de PDIA6‐Mut não foi significativamente influenciada, como mostrado pelo ensaio relator de luciferase (fig. 2E). Notavelmente, a RT‐qPCR e o Western blotting demonstraram que o mRNA e a expressão de proteína de PDIA6 foram acentuadamente sub‐regulados em FPH tratados com H2O2 em comparação com o grupo controle (fig. 2F–H). Coletivamente, PDIA6 é um alvo para miR‐181a em FPH.
MiR‐181a liga‐se a PDIA6. (A) Quatro alvos downstream de miR‐181a previstos pela ferramenta de bioinformática ENCORI. (B) Análise de RT‐qPCR para avaliar esses níveis de mRNA em FPH transfectados com inibidor de miR‐181a. (C) Western blotting da expressão da proteína PDIA6 em FPH transfectados com inibidor de miR‐181a. (D) O sítio de ligação de miR‐181a na 3’UTR de PDIA6 previsto pelo TargetScan. (E) Ensaio relator de luciferase para elucidar a relação de ligação entre PDIA6 e miR‐181a. (F) Análise de RT‐qPCR do nível de PDIA6 em FPH tratados com H2O2. (G‐H) Western blotting do nível de proteína PDIA6 em FPH tratados com H2O2 e grupo controle. **p<0,01, ***p<0,001.
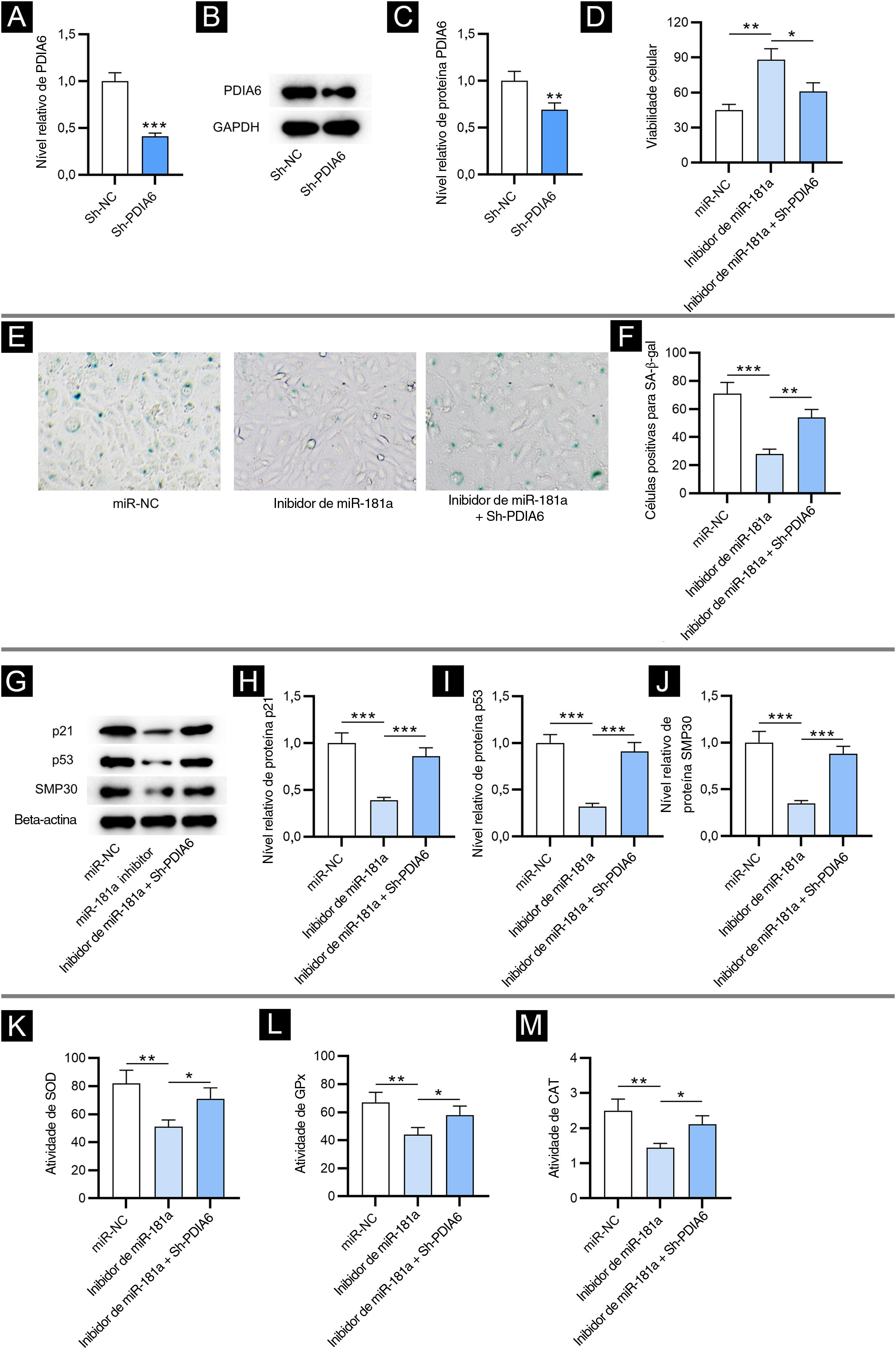
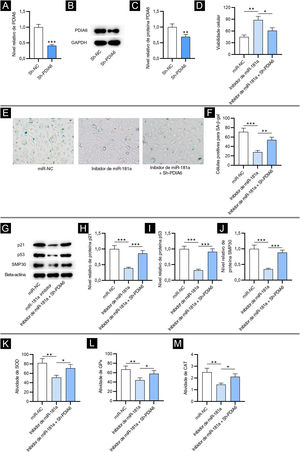
Para investigar o impacto de PDIA6 na senescência celular em FPH, primeiro os autores transfectaram sh‐PDIA6 em FPH. Os níveis de mRNA e de expressão da proteína PDIA6 foram diminuídos em FPH transfectados com sh‐PDIA6, como demonstrado por RT‐qPCR e Western blotting, respectivamente (fig. 3A–C). O ensaio CCK‐8 revelou que o inibidor de miR‐181a promoveu a viabilidade de FPH enquanto a cotransfecção de sh‐PDIA6 atenuou esse efeito (fig. 3D). Além disso, os resultados da coloração para SA‐β‐gal mostraram que a depleção de miR‐181a reduziu significativamente a porcentagem de células positivas para SA‐β‐gal, que foi parcialmente revertida pelo knockdown de miR‐181a e PDIA6 simultaneamente (fig. 3E–F). Isso foi consistente com o Western blotting, que mostrou que o knockdown de PDIA6 resgatou a redução nos níveis de proteína marcadora de senescência causada pelo inibidor de miR‐181a em FPH (fig. 3G–J). Assim, foi sugerido pelos resultados acima que miR‐181a sub‐regulado atenua a senescência celular mediada por H2O2, tendo como alvo PDIA6.
O knockdown de PDIA6 reverte o impacto supressivo mediado pelo inibidor de miR‐181a na senescência celular e no estresse oxidativo. (A) Análise de RT‐qPCR da expressão de PDIA6 em FPH transfectados com sh‐PDIA6. (B–C) Western blotting da expressão da proteína PDIA6 em FPH transfectados. (D) Ensaio CCK‐8 para avaliar a viabilidade de FPH com transfecção de inibidor de miR‐181a, inibidor de miR‐181a+sh‐PDIA6 ou miR‐NC. (E–F) Coloração para SA‐β‐gal para avaliar a porcentagem de células de FPH positivas para SA‐β‐gal com a transfecção acima. As imagens das células foram fotografadas com aumento de 50×. (G–J), Western blotting para detectar a concentração de marcadores de senescência em FPH com a transfecção acima. (K–M), Mensuração das atividades de SOD, GPx e CAT em FPH transfectados com inibidor de miR‐181a, inibidor de miR‐181a+sh‐PDIA6 ou miR‐NC. *p<0,05, **p<0,01, ***p<0,001.
Em seguida, os autores testaram se o miR‐181a exerce sua influência no estresse oxidativo regulando PDIA6. Como demonstrado pelos resultados, o knockdown de PDIA6 atenuou o efeito supressor nas atividades de SOD, GPx e CAT em FPH resultante do inibidor de miR‐181a (fig. 3K–M). Isso revelou que o miR‐181a sub‐regulado atenua o estresse oxidativo induzido por H2O2 tendo como alvo PDIA6.
DiscussãoO dano resultante da diminuição da capacidade antioxidante e do desequilíbrio do sistema oxidativo é denominado estresse oxidativo.22 Evidências emergentes têm sugerido que o estresse oxidativo na pele é uma causa chave da senescência celular, consequentemente levando ao envelhecimento cutâneo.23,24 Estudos anteriores elucidaram o fato de que o envelhecimento e a exposição a ultravioleta B (UVB) estão fortemente correlacionados com alto risco de câncer de pele.25,26 Sugere‐se que uma quantidade aumentada de fibroblastos senescentes na pele geriátrica cause o silenciamento da expressão do fator de crescimento semelhante à insulina 1 (IGF‐1, insulin‐like growth factor 1) na pele.27 O silenciamento do IGF‐1 em fibroblastos senescentes resulta em uma resposta UVB inadequada e proliferação de queratinócitos contendo danos no DNA, o que acaba levando à fotocarcinogênese.26 Assim, encontrar uma abordagem eficaz para atenuar a senescência celular pode ajudar a reduzir o risco de câncer cutâneo.
Vários estudos demonstraram os efeitos significativos de miRNAs envolvidos no estresse oxidativo e senescência celular, como miR‐1445‐5p, miR‐570 e miR‐93‐5p.28–30 Estudos anteriores verificaram que miR‐181a desempenha um papel crucial na senescência celular.31 Foi relatado que o miR‐181a exibe expressão elevada em queratinócitos durante a senescência replicativa, sugerindo que o miR‐181a superexpresso pode desempenhar um papel promotor na senescência celular.32 No presente estudo, os autores avaliaram o papel do miR‐181a em FPH tratados com H2O2. As células senescentes são caracterizadas por interrupção do crescimento celular e expressão gênica anormal.33 Assim, o papel do miR‐181a em FPH tratados com H2O2 foi identificado pela detecção de sua influência na viabilidade celular, coloração para SA‐β‐gal e níveis de expressão de marcadores de senescência. Foi revelado que o miR‐181a sub‐regulado poderia aumentar a viabilidade celular e suprimir a senescência celular causada por H2O2 em FPH. Além disso, para detectar o impacto do miR‐181a no estresse oxidativo induzido por H2O2, foram avaliadas as atividades dos antioxidantes (SOD, GPx e CAT) que são os principais reguladores do sistema oxidativo. Verificou‐se que a inibição de miR‐181a diminuiu significativamente as habilidades antioxidantes em FPH tratados com H2O2, indicando que o knockdown de miR‐181a é capaz de suprimir o estresse oxidativo induzido por H2O2.
Os miRNAs são conhecidos por modular a expressão de alvos downstream por pareamento de bases nas sequências de mRNA 3’UTRs.34 Para descobrir como o miR‐181a exerce sua influência no estresse oxidativo e na senescência celular, a ferramenta de bioinformática ENCORI foi utilizada para rastrear os alvos downstream do miR‐181a. Entre os mRNAs selecionados, finalmente identificou‐se PDIA6 como o gene alvo do miR‐181a. PDIA6, um membro da família dissulfeto isomerase, está implicado em várias doenças humanas, como diabetes mellitus, fibrose hepática e vários tipos de câncer.35,36 Além disso, estudo anterior sugeriu que PDIA6 está intimamente relacionada à senescência celular em CTMMO humanas.19 No presente estudo, PDIA6 apresentou expressão diminuída em FPH tratados com H2O2 em comparação ao grupo controle. Curiosamente, a inibição de miR‐181a aliviou o estresse oxidativo induzido por H2O2 em FPH e a senescência celular, enquanto o knockdown de PDIA6 reverteu o impacto inibitório na senescência celular e no estresse oxidativo mediado por miR‐181a sub‐regulado. Isso sugeriu que o silenciamento do miR‐181a atenuou a senescência celular e o estresse oxidativo induzidos por H2O2 ao atuar sobre PDIA6, e a PDIA6 pode proteger os FPH contra a senescência celular induzida por H2O2.
ConclusãoO papel em potencial e o mecanismo do miR‐181a na regulação do estresse oxidativo induzido por H2O2 e a senescência celular em FPH foram investigados. Os resultados revelaram que o miR‐181a sub‐regulado pode atenuar o estresse oxidativo induzido por H2O2 e a senescência celular em FPH através da regulação da PDIA6. Os achados do presente estudo podem ajudar a desenvolver uma nova perspectiva para melhorar o envelhecimento da pele e os distúrbios associados à senescência.
Suporte financeiroO estudo recebeu suporte financeiro do Projeto de Pesquisa em Ciências Médicas da Wuhan Municipal Health Commission (concessão n° WX20Q03).
Contribuição dos autoresYan Huang: Revisão crítica da literatura; obtenção dos dados; participação efetiva na orientação da pesquisa; participação intelectual em conduta propedêutica e/ou terapêutica de casos estudados; revisão crítica do manuscrito; elaboração e redação do manuscrito; análise estatística; concepção e planejamento do estudo; aprovação da versão final do manuscrito.
Huimin Yan: Revisão crítica da literatura; obtenção, análise e interpretação dos dados; participação efetiva na orientação da pesquisa; participação intelectual em conduta propedêutica e/ou terapêutica de casos estudados; revisão crítica do manuscrito; elaboração e redação do manuscrito; análise estatística; concepção e planejamento do estudo; aprovação da versão final do manuscrito.
Yanqing Yang: Obtenção, análise e interpretação dos dados; aprovação da versão final do manuscrito.
Jinfei Zhou: Obtenção, análise e interpretação dos dados; aprovação da versão final do manuscrito.
Qijun Xu: Participação efetiva na orientação da pesquisa; análise estatística; aprovação da versão final do manuscrito.
Meng Hu: Revisão crítica da literatura; obtenção, análise e interpretação dos dados; participação efetiva na orientação da pesquisa; participação intelectual em conduta propedêutica e/ou terapêutica de casos estudados; revisão crítica do manuscrito; elaboração e redação do manuscrito; análise estatística; aprovação da versão final do manuscrito.
Conflito de interessesNenhum.
Como citar este artigo: Huang Y, Yan H, Yang Y, Zhou J, Xu O, Hu M. Downregulated miR‐181a alleviates H2O2‐induced oxidative stress and cellular senescence by targeting PDIA6 in human foreskin fibroblasts. An Bras Dermatol. 2023;98:17–25.
Trabalho realizado no Wuhan Third Hospital, Wuhan, China.