A síndrome de hipersensibilidade induzida por medicamentos, também conhecida como síndrome DRESS, é reação grave e potencialmente fatal que ocorre como resposta ao uso prolongado (geralmente entre 14 e 60 dias) de certos fármacos e que não apresenta predileção por gênero ou faixa etária. Acredita‐se que a síndrome DRESS tenha base genética e resulte da interação entre metabólitos de certos grupos farmacológicos, reativação de vírus latentes (especialmente da família Herpesviridae) e resposta imune celular. A manifestação clássica da síndrome DRESS inclui erupção cutânea generalizada acompanhada de febre, eosinofilia, linfadenopatia e envolvimento sistêmico, como hepatite, nefrite ou pneumonite. Com o aumento contínuo da disponibilidade de medicamentos e o envelhecimento da população, há um cenário propício para o desenvolvimento de reações adversas a medicamentos. O médico deve estar atento ao diagnóstico precoce da síndrome DRESS, identificação e suspensão imediata do fármaco envolvido, além de gerenciar o envolvimento sistêmico, que pode exigir terapia imunossupressora prolongada. Este estudo fornece atualização dos aspectos clínicos, fisiopatológicos e terapêuticos da síndrome DRESS.
A síndrome conhecida sob o acrônimo DRESS (drug reaction with eosinophilia and systemic symptoms), também denominada DIHS (drug‐induced hypersensitivity syndrome), constitui reação adversa medicamentosa com acometimento sistêmico. Trata‐se de emergência clínico‐dermatológica, potencialmente fatal, que se apresenta com uma constelação de sintomas e sinais, os quais incluem erupção cutânea (especialmente do tipo exantema), que pode ser acompanhada por febre, linfadenomegalia, hepatite, alterações hematológicas (especialmente linfócitos atípicos e eosinofilia), renais, cardíacas, pulmonares e pancreáticas.1
O termo DRESS foi proposto inicialmente por Bocquet et al., em 1996, em artigo de revisão de síndrome de hipersensibilidade medicamentosa, a qual foi anteriormente descrita sob vários termos ou sinonímias distintas, tais como síndrome da dapsona, síndrome de hipersensibilidade à anticonvulsivante, síndrome da hidantoína, síndrome de hipersensibilidade ao alopurinol, dependendo do agente farmacológico com a qual foi relatada, ao longo do século XX.2
A primeira descrição de caso compatível com DRESS foi relatado por Myers et al., em 1937. Um homem com gonorreia, tratado com sulfanilamida, em Detroit (EUA), apresentou exantema morbiliforme pruriginoso, que evoluiu para dermatite esfoliativa. Subsequentemente, desenvolveu febre, icterícia e eosinofilia progressiva. No relato, citam‐se quadros semelhantes de dermatite esfoliativa, com leucocitose, hepatite e eosinofilia em pacientes tratados com compostos arsenicais.3
Em 1938, Merritt & Puttman relataram seus resultados em 142 pacientes, portadores de doenças convulsivas, tratados com difenil‐hidantoína. Eventos adversos sérios como púrpura e dermatite foram observados em 5% deles; um paciente de 55 anos, do gênero masculino, desenvolveu dermatite esfoliativa 14 dias após o uso da medicação, porém sem febre.4
Na década de 1940, descreveram‐se vários casos de linfadenopatia associada ao uso de anticonvulsivantes, e foi o primeiro caso acompanhado de erupção cutânea intensa e febre, pelo uso de difenil‐hidantoína.5
A primeira fatalidade com esse tipo de reação foi descrita em 1946, após uso de tridione, associado com fenil‐hidantoína, em um adolescente.6
A primazia da observação de um caso sem erupção cutânea, porém com constelação de sintomas e sinais da síndrome DRESS e eosinofilia periférica, coube a Saltztein et al., em 1958, que descreveram um menino de 7 anos que utilizava a etilfenil‐hidantoína. A criança foi internada com linfadenopatia cervical, sete semanas após introdução do anticonvulsivante, porém havia sido tratado previamente com metarbital e mephobirtal. Não havia erupção cutânea; contudo, o paciente apresentava hepatoesplenomegalia e eosinofilia (15%), além de febre. As alterações clínicas e laboratoriais regrediam após quatro meses da retirada do fármaco.7
Em 1950, descreveu‐se um adulto com epilepsia que, após 17 dias do uso de difenil‐hidantoína sódica, apresentou mal‐estar, anorexia, náuseas e dores musculares generalizadas, e subsequentemente desenvolveu icterícia, febre, exantema que progrediu para dermatite esfoliativa pruriginosa e linfadenopatia com dor abdominal. O hemograma demonstrou linfocitose (43%), com 24% de linfócitos atípicos e 6% de eosinófilos que, no quarto dia de internação, evoluíram para 20% de eosinofilia periférica. Na época, os autores observaram que, enquanto a atipia linfocitária diminuía no hemograma, a eosinofilia progressivamente aumentava, configurando evolução hematológica característica do que hoje denominamos de síndrome DRESS.8
Em 1949, Lowe e Smith foram os primeiros a publicar o que se chamaria de síndrome de hipersensibilidade à dapsona ou síndrome da sulfona, quando notaram a incidência de 2% do desenvolvimento de dermatite esfoliativa entre pacientes que recebiam dapsona para tratamento da hanseníase.9 Em 1951, a síndrome da sulfona foi descrita como síndrome mononucleose‐símile caracterizada pela ocorrência de dermatite esfoliativa, hepatomegalia, icterícia, esplenomegalia, linfadenomegalia e predomínio de células mononucleares no sangue periférico, em pacientes tratados por menos de dois meses com o fármaco. Entre 153 casos de hanseníase tratados com dapsona na Nigéria, em 1951, observaram‐se sete casos (4,5%) da síndrome da sulfona dentro de dois meses do início do tratamento.10
Com o passar das décadas, tornou‐se evidente uma plêiade de medicações envolvidas no desencadeamento da síndrome DRESS, em especial antiepilépticos, antibióticos, antituberculosos, anti‐inflamatórios não hormonais (AINHs), entre outros. Além disso, a letra “R” de “reaction” do acrônimo DRESS foi, por muitos autores, substituída por “rash”, o que pode ser inadequado, uma vez que, ocasionalmente, pode‐se manifestar acometimento visceral sem sintomas tegumentares.11,12
Esta é uma revisão narrativa com o uso dos termos: “DRESS syndrome”, “anticonvulsant syndrome”, “hydantoin syndrome”, “DRESS” and “DRESS syndrome”, “Drug‐Induced Hypersensitivity Syndrome”, “Dapsone Syndrome”, “DRESS and Delayed‐Hypersenstivity Syndrome”, no período compreendendo 01/01/2011 a 01/11/2023, utilizando‐se o filtro de dados de “texto completo”, nas seguintes bases de dados: PubMed/Medline e LILACS, obtendo‐se 2.635 artigos, entre os quais foram selecionados 85 para compor esta revisão.
EpidemiologiaComo não é notificado compulsoriamente, a real incidência da DRESS não é conhecida. Da mesma maneira, a ocorrência da DRESS depende do tipo de medicação e do estado imune do paciente. Muitos casos são subdiagnosticados ou não tratados e não registrados em sistemas de farmacovigilância. A imprevisibilidade da reação em associação com sua potencial gravidade justifica o amplo conhecimento médico da afecção.
Estima‐se que ocorra um caso de DRESS para cada 10.000 exposições a medicamentos, particularmente anticonvulsivantes como a carbamazepina.11,12 Entre as medicações antituberculosas, a DRESS ocorre em 1,2% dos pacientes.13 Em um estudo retrospectivo envolvendo 1.253 pacientes adultos recebendo antituberculosos entre os anos de 2006 a 2010, foram observados 15 casos (1,2%) de DRESS, com idade média de 65 anos (48‐74), 53,3% homens; o etambutol foi o agente mais usado (53,5%), seguido por rifampicina (26,5%), pirazinamida (20,0%), estreptomicina (13,3%) e isoniazida (6,7%), com período de latência média de 42 dias para desenvolver sintomas e sinais da DRESS.14
Não há clara predileção por gênero entre os casos de síndrome DRESS, porém Kardaum et al. descreveram leve predominância de casos em mulheres (taxa homens: mulheres 0,80).15
De acordo com informações do grupo de estudo RegiSCAR16, em 2011 houve maior frequência de história prévia de doença reumatológica ou doença vascular do tecido conectivo em 8,5% dos pacientes com DRESS. Entre pacientes japoneses, em aproximadamente metade deles houve histórico de infecção tipo influenza‐símile, dentro do período de um mês, antecedendo a DRESS.12
A taxa de mortalidade específica da DRESS varia de 3% a 20%, configurando‐se urgência dermatológica.15–17 Aproximadamente 94% dos pacientes necessitam de internação hospitalar, com custo econômico estimado, ao sistema de saúde americano, de pelo menos US$ 17.000 por paciente.16,18 No estudo de Wolfson et al., que analisou os dados de registros hospitalares de alergia nos EUA entre 1980 e 2016, os autores concluíram que a prevalência de DRESS foi 2,18 casos para cada 100.000 pacientes internados.18
PatogêneseOs mecanismos patogênicos envolvidos na ocorrência da DRESS ainda são controversos. Provavelmente, isso se relaciona à variedade de fármacos implicados em desencadear essa reação adversa e a interação de elementos como suscetibilidade genética, capacidade de metabolização do fármaco, interações com infecções precedentes ou ativação de vírus latentes.12,17
Mais de 60 medicamentos foram associados à DRESS.11 Os mais implicados são os anticonvulsivantes aromáticos (fenitoína, carbamazepina, oxicarbazepina, fenobarbital, primidona, lamotrigina); as sulfonamidas; sulfonas (dapsona); AINHs (piroxicam, ibuprofeno, diclofenaco, paracetamol); antibióticos beta‐lactâmicos, vancomicina e minociclina; alopurinol e os antiretrovirais. Antibióticos, como a amoxicilina, podem causar DRESS; no entanto, na maioria dos casos, essa medicação atua como fator agravante na DRESS induzida por outros medicamentos. Na tabela 1 são descritas as principais medicações listadas como potenciais desencadeantes da DRESS.11,17,19,20
Medicamentos associados ao desencadeamento da DRESS
| Grupos farmacológicos | Medicamentos | |
|---|---|---|
| Anticonvulsivantes | Aromáticos | Fenitoínaa, carbamazepinaa, primidona, oxacarbazepina, fenobarbitala, lamotriginaa |
| Não aromáticos | Lamotrigina, etosuximida, valproato de sódio ou ácido valproico, zonisamida, mexletina, levetiracetama, benzodiazepínicos, gabapentina | |
| Antibióticos | Sulfonamidasa, sulfamatoxazol‐trimetropima, sulfona (dapsona)a, sulfassalazinaa, salazosulfapiridinaa, rifampicinaa, etambutol, pirazinamida, isoniazida, estreptomicina, minociclinaa, azitromicina, ampicilina, ampicilina/sulbactam, cefitriaxona, cefepime, clindamicina, vancomicinaa, espiramicina, metronidazol, amoxicilina, amoxicilina/clavulanato, piperaciclina‐tazobactam, augumetin, levofloxacina, teicoplanina, benxnidazolea, linezolida | |
| Inibidores da enzima conversora da angiotensina | Enalapril, captopril | |
| Antidepressivos – inibidores da recaptação da serotonina | Fluoxetina, bupropiona | |
| Antidepressivos clássicos | Desipramina, amitriptilina, clomipramina | |
| Antifúngico | Terbinafina, voriconazol | |
| Antipsicótico | Olanzapina, quetiapina | |
| Antimalárico | Hidroxicloroquina | |
| Anti‐inflamatórios não esteroidais | Ácido acetilsalicílico (AAS), celecoxibe, diclofenaco, ibuprofeno, piroxicam, dipirona (metamizole), fenilbutazona, dexcetoprofeno, codeína | |
| Antivirais | Inibidor de protease | Telaprevir, boceprevir |
| Inibidores da integrase do HIV | Abacavira; raltegravir | |
| Inibidores não nucleosideos da transcriptase reversa | Nevirapinaa; zalcitabina | |
| Inibidores da transcriptase reversa | Abacavir | |
| Imunomoduladores | Lenalidomida; leflunomida; talidomida; mesalazina; teriflunomida | |
| Inibidores das quinases | Vemurfenibe; sorafenibe; imatinibe; pazopanibe | |
| Inibidores da xantina oxidase | Alopurinola; febuxostat | |
| Inibidores do checkpoint imune | Nivolumabe; ipilumabe | |
| Antineoplásicos | Gemcitabina, azatioprina, clorambucil, amlodipina, diltiazem, espironolactona, vismodegibe, efalizumabe, bortezomibe, alecitinibe | |
| Outras categorias | Omeprazol, propiltiouracil, temozolomida, furosemida, atorvastatina, Medicina Chinesa Tradicional, quinina, mexiletine, esomeprazol, ranelato de estrôncio, eritropoietina alfa, ranitidina, tiamina, cianamida, complexo B12, sitagliptina, tribenoside, radiocontrastes iodado, rivaroxabana, vacina AstraZeneca contra a COVID‐19, contraste com gadolínio, trimetazidina, sildenafila, denosumab, daclizumab, pirfenidone, metformina | |
A compreensão da patogênese da DRESS foi construída ao longo de décadas e vem sendo aperfeiçoada conforme avança o conhecimento genético, das vias metabólicas, do sistema imune e das reativações de vírus latentes no organismo. Atualmente, a DRESS é considerada reação medicamentosa adversa grave, idiossincrásica, mediada especialmente por células T, classificada como reação de hipersensibilidade do tipo IVb (às vezes IVc), pela classificação de Gel & Coombs, ampliando por Pichler.21 Assim, o conceito atual é que a DRESS constitui o resultado da interação complexa entre a exposição a medicamento (ou vacina imunizante, ou imunobiológico), predisposição genética e reativação de vírus latentes, particularmente da família Herpesviridae.20
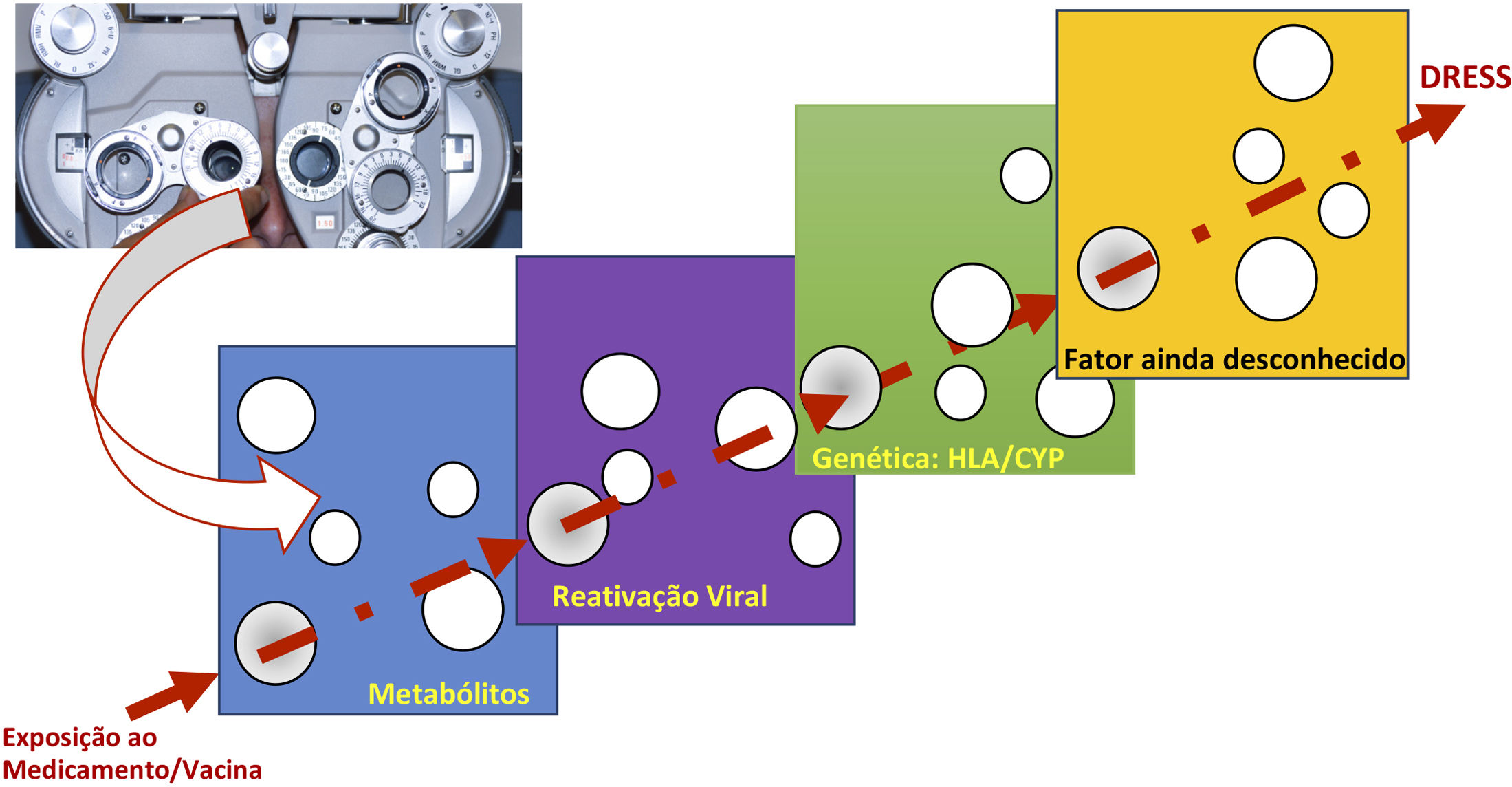
A razão que explica o porquê de alguns indivíduos desenvolverem essa reação adversa, enquanto outros não, apesar de expostos ao mesmo medicamento, parece resultar do efeito cumulativo da conjunção de riscos, que se alinham por meio de modelo causal sucessivo único, em cujo sentido final, em linha reta, é a DRESS (fig. 1).20
Modelo de conjunção de fatores de risco para a ocorrência de evento de DRESS, em modelo semelhante ao encontro perfeito dos fatores de risco, como em um orifício de mesma posição em diferentes fatias de queijo suíço, ou em analogia ao encontro das lentes perfeitas, durante a refração em exame oftalmológico. A substância, ou vacina, precisa encontrar um sistema metabólico, no ser humano, que gere determinado intermediário metabólico, em geral que se acumula em excesso, em um mesmo paciente, no qual esse metabólito estimula a proliferação do sistema monocítico‐macrofágico, que leva à ativação de vírus latentes incorporados ao DNA do hospedeiro. Esse hospedeiro humano deve ter determinadas características genéticas (HLA ou mutações de ganho ou perda de função do citocromo P450‐CYP), as quais conduzem a um tipo específico de resposta imune capaz de gerar a resposta clínica da DRESS.
O mecanismo exato da reação adversa denominada DRESS é complexo e ainda não completamente esclarecido.11,19,20 No entanto, há três componentes essenciais que devem ser considerados em sua patogênese: i) presença de suscetibilidade genética em relação a determinados alelos do antígeno leucocitário humano (HLA); ii) ocorrência de alterações nas vias de metabolismo de fármacos (drogas), especialmente em relação aos anticonvulsivantes aromáticos; e iii) reativação de vírus da família Herpesviridae, em particular o herpes vírus humano 6 (HHV6), o que conduz a resposta inflamatória mediada por linfócitos T que resulta em dano tecidual variado.11
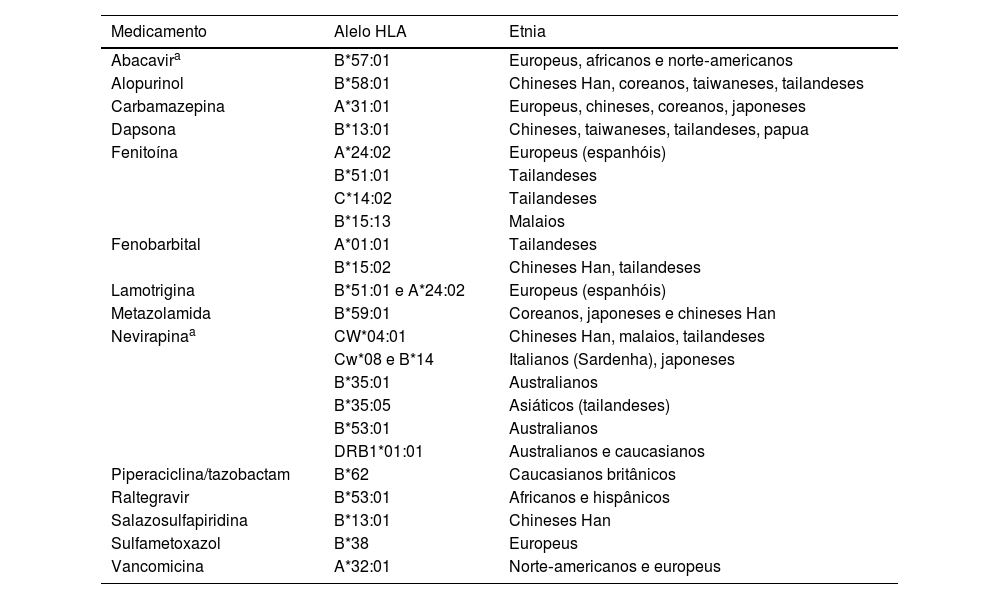
Sistema HLAOs alelos do HLA constituem um dos mais relevantes fatores de risco ao desenvolvimento da DRESS. Apesar de sua importância, há que se ressaltar que os alelos de risco são específicos para determinadas substâncias, em etnias específicas, sugerindo que sua ocorrência no hospedeiro seja necessária, mas não por si só suficiente para promover uma resposta imune completa.11,19
Um exemplo de estudo farmacogenômico, no qual se associa um haplótipo HLA e suscetibilidade à DRESS, é a associação entre o uso do abacavir, na terapia antiretroviral (TARV) e o risco aumentado de se desenvolver DRESS, se o paciente for caucasiano ou afro‐americano e portador do HLA‐B*5701. Já o mesmo haplótipo, no grupo étnico chinês Han, constitui fator de risco elevado para a ocorrência, com o uso de alopurinol, de outras reações como a síndrome de Stevens‐Johnson (SSJ), necrólise epidérmica tóxica (NET) e síndrome DRESS.11 Assim, os mesmos alelos do HLA podem causar diferentes reações adversas com a mesma medicação, em etnias distintas de doentes, ou com medicamentos diferentes, em uma mesma população (tabela 2).
Associação de alelos do HLA, de acordo com a medicação e etnia
| Medicamento | Alelo HLA | Etnia |
|---|---|---|
| Abacavira | B*57:01 | Europeus, africanos e norte‐americanos |
| Alopurinol | B*58:01 | Chineses Han, coreanos, taiwaneses, tailandeses |
| Carbamazepina | A*31:01 | Europeus, chineses, coreanos, japoneses |
| Dapsona | B*13:01 | Chineses, taiwaneses, tailandeses, papua |
| Fenitoína | A*24:02 | Europeus (espanhóis) |
| B*51:01 | Tailandeses | |
| C*14:02 | Tailandeses | |
| B*15:13 | Malaios | |
| Fenobarbital | A*01:01 | Tailandeses |
| B*15:02 | Chineses Han, tailandeses | |
| Lamotrigina | B*51:01 e A*24:02 | Europeus (espanhóis) |
| Metazolamida | B*59:01 | Coreanos, japoneses e chineses Han |
| Nevirapinaa | CW*04:01 | Chineses Han, malaios, tailandeses |
| Cw*08 e B*14 | Italianos (Sardenha), japoneses | |
| B*35:01 | Australianos | |
| B*35:05 | Asiáticos (tailandeses) | |
| B*53:01 | Australianos | |
| DRB1*01:01 | Australianos e caucasianos | |
| Piperaciclina/tazobactam | B*62 | Caucasianos britânicos |
| Raltegravir | B*53:01 | Africanos e hispânicos |
| Salazosulfapiridina | B*13:01 | Chineses Han |
| Sulfametoxazol | B*38 | Europeus |
| Vancomicina | A*32:01 | Norte‐americanos e europeus |
Em termos de mecanismo, acredita‐se que o fármaco implicado interaja com seu HLA específico para formar um complexo hapteno‐HLA, que é então apresentado às células T naïves (TH0), por meio de um receptor de células T (TCR) a fim de estimular uma resposta imune.19
É importante ressaltar que as associações entre o risco de determinada substância e um HLA específico têm elevado valor preditivo negativo e valores preditivos positivos (VPP) moderados a baixos. Até o momento, o VPP mais elevado conhecido é de aproximadamente 50% para casos de DRESS induzidos por abacavir. Em outras palavras, o baixo VPP das associações de alelos do HLA com exposição a medicamentos específicos sugere que fatores adicionais contribuam para o desencadeamento e aparecimento clínico da DRESS. Além disso, as frequências alélicas variam muito entre diferentes etnias, tornando importante que as recomendações sejam feitas não apenas com base no medicamento a ser empregado, mas também na origem étnica do indivíduo a ser tratado com ela.19
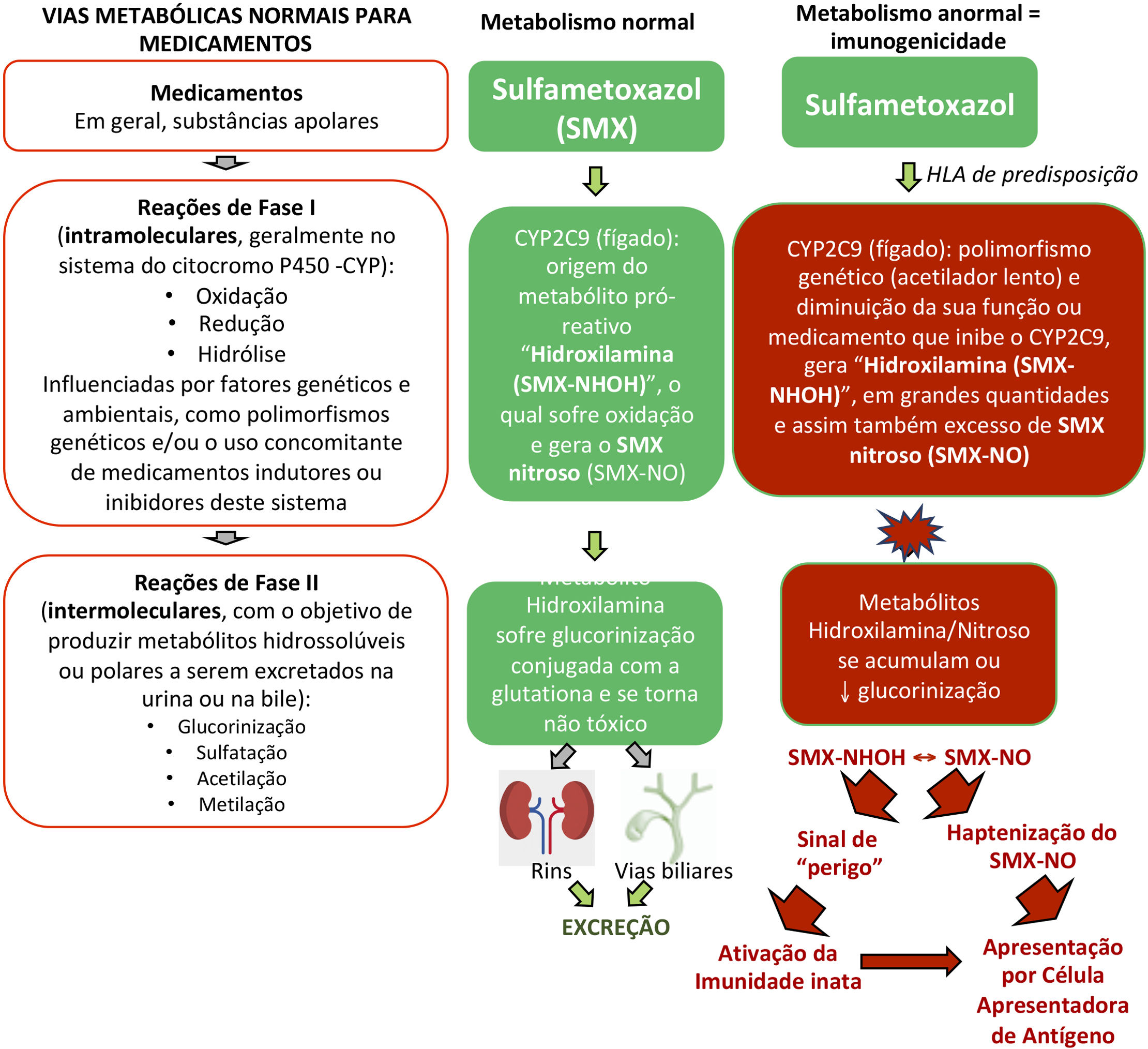
Vias metabólicas dos medicamentosMutações em várias enzimas de detoxificação das drogas foram ligadas aos casos de DRESS. Por exemplo, os anticonvulsivantes aromáticos são metabolizados pelo CYP (citocromo P450 ‐ fase I do metabolismo de fármacos) em metabólitos areno‐óxidos, normalmente detoxificados nas vias de conjugação (fase II do metabolismo de fármacos) pela epóxido hidrolase ou pela glutationa transferase em metabólitos inativos. No caso de deficiência dessas enzimas (por polimorfismos gênicos, ou adquiridas por eventos como infecções virais, como na infecção pelo HIV), esses intermediários areno‐óxidos acumulados atuam como haptenos estimulando a resposta imune ou se ligando a macromoléculas teciduais e causando dano celular direto (fig. 2).19
Vias metabólicas normais para eliminação de medicamentos e exemplo do metabolismo anormal da sulfametoxazol (SMX) em pacientes com HLA de predisposição e alterações de perda de função (LOF, loss‐of‐function) de enzimas metabólicas como as do citocromo P450 (CYP) e/ou das reações de fase II (intermoleculares) como defeitos na glucorinização gerando metabólitos hidroxilamina/nitroso em excesso que podem gerar sinais de “perigo” ao sistema imune, com dano celular direto e ativação da imunidade inata e/ou serem apresentados como hapteno às células apresentadoras de antígenos.
Demonstrou‐se que pacientes com DRESS relacionada às sulfonamidas apresentam, em muitos casos, elevada incidência de estado de portador de acetiladores lentos (baixa N‐acetilação), o que determina deficiência da N‐acetil‐transferase, formando excessiva quantidade de metabólitos hidroxilamina, os quais atingem níveis tóxicos e são capazes de causar dano celular e ativação imune.19
Nas populações taiwanesa, japonesa e malaia, encontra‐se frequentemente uma variante gênica CYP2C9*3 (capaz de reduzir a excreção da fenitoína) e que se associa especialmente com DRESS desencadeada por essa medicação. Também parece que o sinergismo entre predisposição a determinado alelo do HLA e o polimorfismo no metabolismo dos medicamentos é necessário para desencadear a DRESS; como no caso de pacientes com aumento de risco à reação que são expostos ao alopurinol, expressam HLA‐B*58:01 e apresentam função renal diminuída, o que leva a aumento sérico nos níveis do alopurinol ou de seus metabólitos tóxicos.19
Vias imunológicasHá vários modelos pelos quais o medicamento pode estimular a resposta imune e causar a DRESS: i) modelo hapteno, onde a célula apresentadora de antígeno (APCs) e seu HLA apresenta um neoantígeno ao TCR de uma célula T naïve por meio de uma forte ligação covalente; ii) o modelo proposto de “interação‐farmacológica (conceito PI)” no qual o medicamento ou metabólito + peptídeo endógeno ocupam o espaço entre o HLA da APC e o TCR de um linfócito T naïve, com uma ligação não covalente, temporária e ocorrem interações independentemente do processamento da medicação pela APC, induzindo diretamente a ativação da célula T; ou iii) por meio do modelo de “repertório de autopeptídeos alterados”, no qual um medicamento ligado a um peptídeo endógeno alterado liga‐se, por sua vez, a um HLA ou TCR, mudando a conformação de ligação e são reconhecidos como imunogênicos, sem processamento da medicação.22
Por meio de interações entre células, acredita‐se que as APC ativem células T específicas ao medicamento, com auxílio de moléculas coestimuladoras como a OX40, que evitam que as células T sejam inibidas pelas células T reguladoras (Tregs).23 As células Th2 ativadas liberam citocinas, incluindo IL‐4, IL‐13 e IL‐5, induzindo eosinofilia nos tecidos e no sangue periférico.23
Além disso, a eotaxina produzida pelos queratinócitos e o TARC (thymus and activation‐regulated chemokine), produzido pelas células dendríticas (DC), promovem o acúmulo nocivo de eosinófilos na pele e em outros órgãos internos. Também a IL‐33, que é produzida pelos macrófagos na pele nos pacientes com DRESS, atrai linfócitos tipo 2da imunidade inata (ILC2 ‐ células linfoides inatas tipo 2), por meio do receptor ST2, promovendo a eosinofilia tecidual.24
As células Th2 interagem com as células dendríticas dérmicas por meio das moléculas coestimuladoras CD40L e CD40. O receptor coestimulador OX40 (CD134) é membro da superfamília dos receptores do fator de necrose tumoral (TNFRSF), que é expresso em células T CD4+ e CD8+ ativadas, neutrófilos e células natural killer (NK).23 A OX40 tem funções relevantes coestimuladoras na ativação, sobrevivência e expansão das células T CD4+ e CD8+, e sua ligação com o seu ligante (OX40L) as torna menos responsivas aos sinais inibidores das células Tregs.23 Na DRESS, as células mononucleares do sangue periférico (PBMCs) expressam também OX40L, e a porcentagem de células T CD4+ expressando OX40 correlaciona‐se com o padrão de respostas imunes Th2 mediadas.25
Os pacientes com DRESS, na fase aguda da reação, demonstram aumento do número de Tregs, da contagem das células T CD4+ totais no sangue, quando comparados com controles sadios, o que não se observa na NET ou nas outras erupções medicamentosas maculopapulosas. Uma grande proporção dessas Tregs tem habilidade de migrar para a pele, de modo que há aumento de células T FOXP3+ na pele de pacientes com DRESS em comparação com pacientes que desenvolvem SSJ/NET. Na fase aguda da DRESS, as Tregs expandem‐se em número e, posteriormente, diminuem durante sua resolução.25
Células TCD8+ são atraídas para a derme e causam apoptose de queratinócitos pela liberação de granulolisinas. Juntamente com os níveis elevados de citocinas pró‐inflamatórias, incluindo a interferona‐gama (INF‐γ), fator de necrose tumoral (TNF), IL‐6 e IL‐15, essas citocinas promovem a inflamação sistêmica caracterizada como DRESS.25
A DRESS é caracterizada por uma variedade de anormalidades hematológicas que incluem leucocitose, linfócitos atípicos circulantes e eosinofilia periférica. Enquanto a eosinofilia não é encontrada universalmente em todos os doentes, uma reação Th2 mediada é observada nos tecidos, com abundância de IL‐4, IL13 e IL‐5.26 Linfócitos Th2 polarizados são recrutados pela TARC/CCL17 para os locais de inflamação, porém também são encontradas outras citocinas além das já citadas – a IL‐2 e granulolisinas. Na fase tardia da DRESS, ocorre aumento do número dos linfócitos T CD*+ e células Th1, frequentemente de maneira concomitante com a exacerbação da doença, com a piora da hepatite e elevação de anticorpos contra HHV6.19
A reativação de infecções virais latentes ao longo das reações de hipersensibilidade medicamentosa tipo tardia é considerada característica específica da síndrome DRESS. A infecção reativada mais prevalente é pelo HHV6, o qual pode ser encontrado no sangue periférico, na pele, linfonodos e tecido renal. Além disso, subsequentemente, pode haver a reativação de outros vírus da família Herpesviridae, como o HHV7, o Epstein‐Barr vírus (EBV) e, por fim, o citomegalovírus (CMV).27 A reativação do HHV6 requer imunossupressão, o que é demonstrada com os níveis séricos decrescentes de imunoglobulinas, incluindo IgG, IgM e IgA, além de células B circulantes no início da síndrome DRESS.24
A depleção na circulação e nas lesões cutâneas da DRESS dos monócitos pró‐inflamatórios CD14dimCD16+(pMOs) capazes de mediar funções antivirais, em conjunto com a expressiva expansão das células Treg CD4+FOXP3+ na fase aguda da DRESS, a fim de conter a ativação de células T efetoras específicas ao medicamento (Teffs), poderiam exercer papel relevante em inibir os linfócitos T antivirais e favorecer a reativação dos vírus latentes.12,24
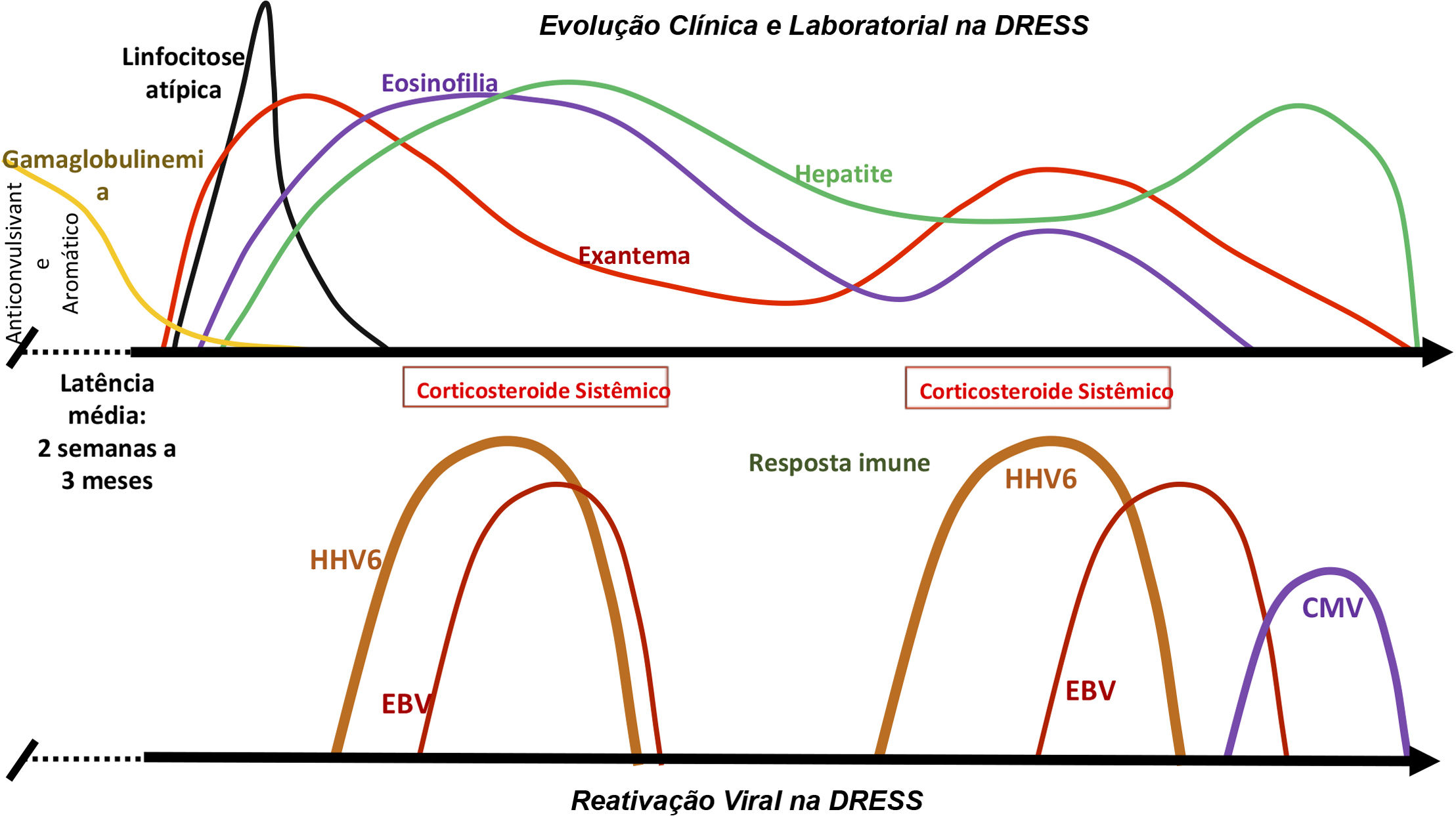
Em alguns pacientes com DRESS, são detectados no sangue e em alguns tecidos humanos os vírus HHV6 e HHV7, EBV, CMV – além de, em alguns casos, o vírus da varicela zóster (VZV). Entre 76% e 80% dos pacientes com DRESS são positivos para testagem do HHV6, HHV7 ou EBV, sugerindo que a reativação viral contribua para o curso da doença.16 Essa reativação viral é geralmente detectada entre duas e quatro semanas após o início da DRESS, o que pode estar associado à recidiva dos sintomas após a melhora inicial demonstrada pelo paciente (fig. 3).
Evolução clínica e laboratorial do DRESS. Reativação sequencial da família Herpesviridae, após hipogamaglobulinemia progressiva, já classicamente demonstrada em pacientes em uso de anticonvulsivantes aromáticos, contribuindo para a recrudescência das manifestações clínicas e laboratoriais, mesmo após a retirada do medicamento desencadeador da DRESS.
Recentemente, foi evidenciada a reativação da via de sinalização da JAK‐STAT em paciente com síndrome DRESS refratária, desencadeada pelo uso de sulfametoxazol‐trimetoprim. Entre tantos circuitos de resposta inflamatória tipo 2 na DRESS, a IL‐5 possivelmente desempenha papel crítico na patogênese da doença. Aproximadamente 30% dos pacientes com síndrome DRESS desenvolvem complicações, incluindo infecções, doenças inflamatórias e autoimunes.16,28,29
Apesar de a contribuição da família Herpesviridae na patogênese da DRESS ainda não ser definitiva, a reativação viral pode ocorrer sem terapias imunossupressoras e o surgimento de linfócitos T CD8+ específicos ao vírus sugere que a reativação do herpes vírus é componente integral do processo patogênico da DRESS. Em suma, na DRESS, as células T na pele e no sangue demonstram proliferação não clonal, expressão distinta de receptores de quimiocinas, moléculas coestimuladoras e regulação gênica positiva na via de sinalização JAK‐STAT.28,29
Manifestações clínicasA síndrome DRESS é caracterizada pelo envolvimento gradual de múltiplos órgãos, que pode incluir pele, sistemas hematológicos e órgãos sólidos.19 As manifestações clínicas são percebidas, em geral, duas semanas a dois meses após o início de um medicamento.22
A DRESS inicia com pródromos de mal‐estar semelhante ao da gripe, faringite, febre e linfadenopatia.30 A evolução pode ser lenta e com a associação de vários sintomas; febre (≥ 38,5°C) ocorre em 75%‐100% dos pacientes e, geralmente, precede a erupção cutânea em vários dias.15,16,19
Antibióticos ou meios de radiocontraste podem deflagrar a reação em períodos aproximados a 14 dias de exposição, enquanto antiepiléticos e alopurinol tendem a ter períodos de latência mais longos e podem estar relacionados a formas mais graves da doença.26,31
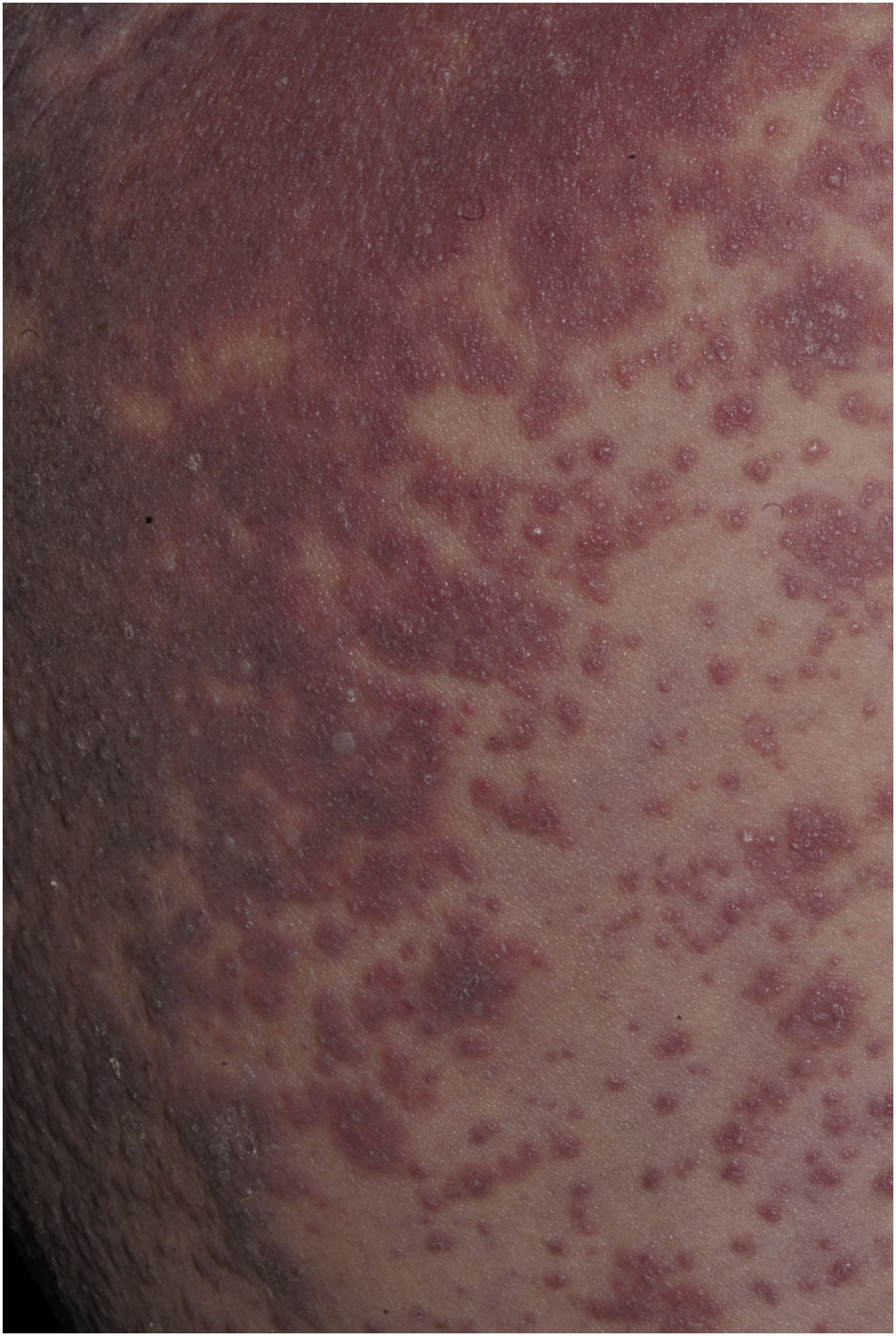
Manifestações cutâneasApesar de as manifestações dermatológicas serem variadas e acometerem mais de 50% da superfície corporal, em sua maioria, as lesões mais características da fase inicial são o edema periorbital e facial (76% dos casos) com micropústulas.15,17,26,32,33
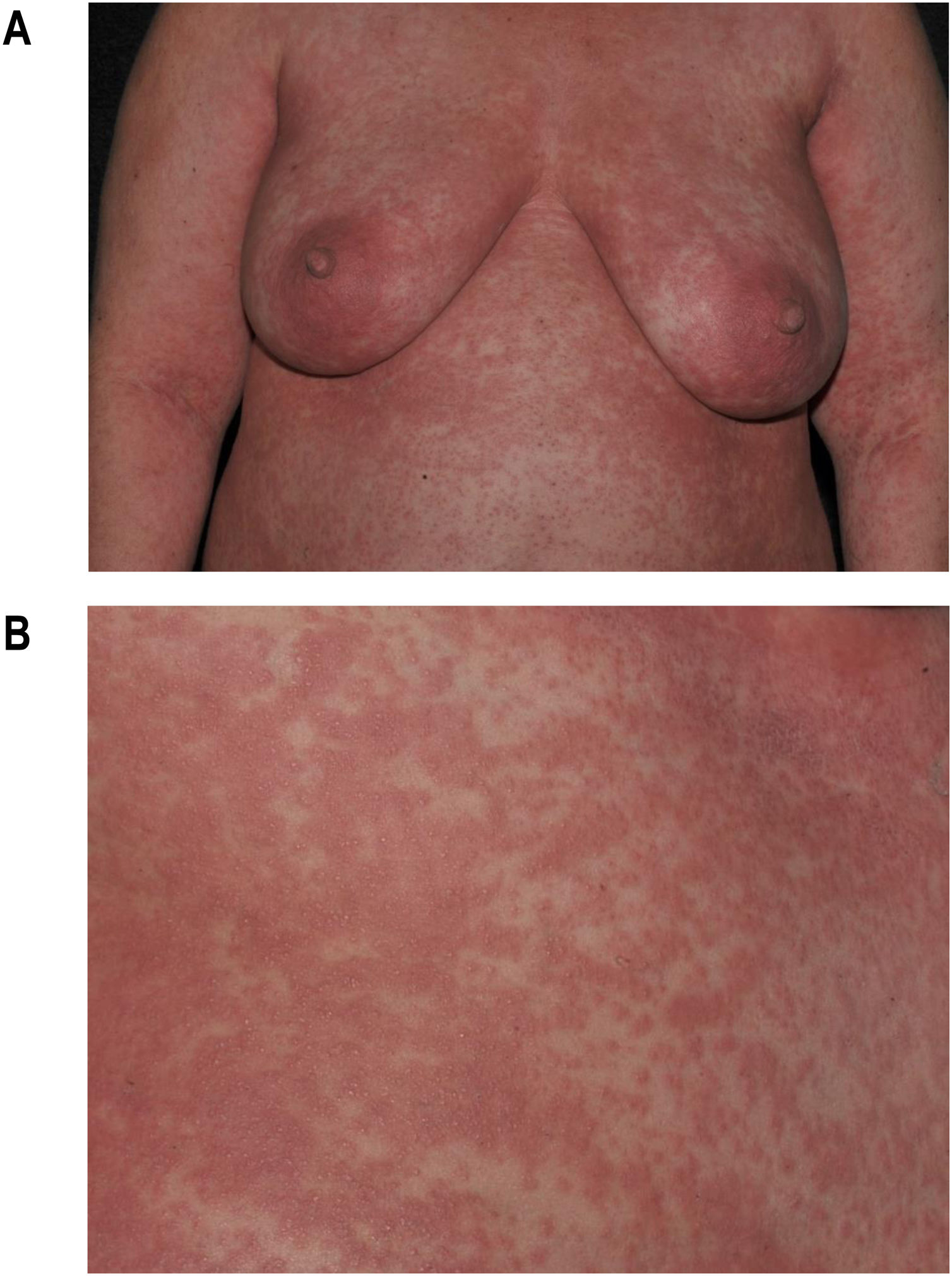
O exantema maculopapular é o sinal clínico mais comum, apresentando‐se em 99%‐100% dos pacientes, poupando as palmas e plantas, com progressão craniocaudal (fig. 4).
Prurido é usual e pode haver dor tipo queimação.34 O envolvimento da mucosa pode ser observado em até 56% dos pacientes; porém, é tipicamente leve e não hemorrágico, distinguindo‐o da SSJ/NET.15,33 As crianças são mais propensas ao exantema morbiliforme, febre e linfadenopatia, e menos propensas a ter edema facial.35
A forma eritrodérmica da DRESS é considerada rara, enquanto o exantema morbiliforme afeta mais de 80% dos pacientes. A eritrodermia ocorre em apenas 7,4% dos casos.2,36
Lesões vesiculosas e bolhosas podem ser induzidas pelo edema dérmico na DRESS; como não ocorre extensa necrose na epiderme, as bolhas são diferentes das visualizadas no SSJ/NET, mas o diagnóstico diferencial é, potencialmente, difícil e o exame histopatológico é indicado.37,38
Pacientes com DRESS podem apresentar ainda pústulas perifoliculares, estéreis, assim como pequenas pústulas não foliculares, simulando a pustulose exantemática generalizada aguda (PEGA) (fig. 5).2
Manifestações extracutâneasO sinal de alarme para a DRESS deve ser o acometimento sistêmico com envolvimento dos órgãos internos, que pode ocorrer em até 91% dos pacientes; acometimento hepático é o mais comum, seguido dos rins e pulmões.15 Linfadenopatia ocorre em 50%‐75% dos pacientes.34
Em até 97% dos casos há acometimento hepático pela DRESS; sua manifestação visceral é a mais comum. O achado mais comum é a elevação das enzimas hepáticas (colestáticas, mistas e hepatocelulares). Em alguns casos, pode ocorrer insuficiência hepática fulminante. A hepatite é tipicamente anictérica, e a elevação das enzimas hepáticas pode levar meses para resolver completamente.15,30,33
O segundo órgão mais envolvido é o rim, ocorrendo desde lesão renal aguda (LRA) leve a nefrite intersticial grave, resultando em doença renal permanente de estágio terminal. Os pacientes mais propensos ao risco de insuficiência renal por DRESS são os idosos, com doença renal preexistente e DRESS causada pelo alopurinol.15,30,39
O pulmão é o terceiro órgão mais frequentemente comprometido; pneumonite intersticial é a manifestação mais comum.39 A associação com minociclina pode levar a maior incidência de pneumonite.40
O acometimento cardíaco manifesta‐se tipicamente como mio ou pericardite e, em média, 70 dias após os sintomas iniciais. Os sinais e sintomas mais comuns de DRESS cardíaco são dispneia, choque cardiogênico, dor torácica e taquicardia.41
Pacientes com DRESS podem evoluir, com menos frequência, com pancreatite, colite, colangite, encefalite/meningoencefalite, síndrome hemofagocítica e tireoidite. Além disso, há relatos de acometimento do baço, estômago e sistema nervoso central.24,30,40
Os casos pediátricos não parecem diferir dos adultos. O tempo médio da ingestão da medicação e manifestações clínicas foi de 18,9 dias, e a recidiva do DRESS ocorreu em 4,8% dos casos. Onze por cento das crianças podem apresentar sequelas a longo prazo, como doenças autoimunes – mais comumente hipotireoidismo (3,8%).27,42
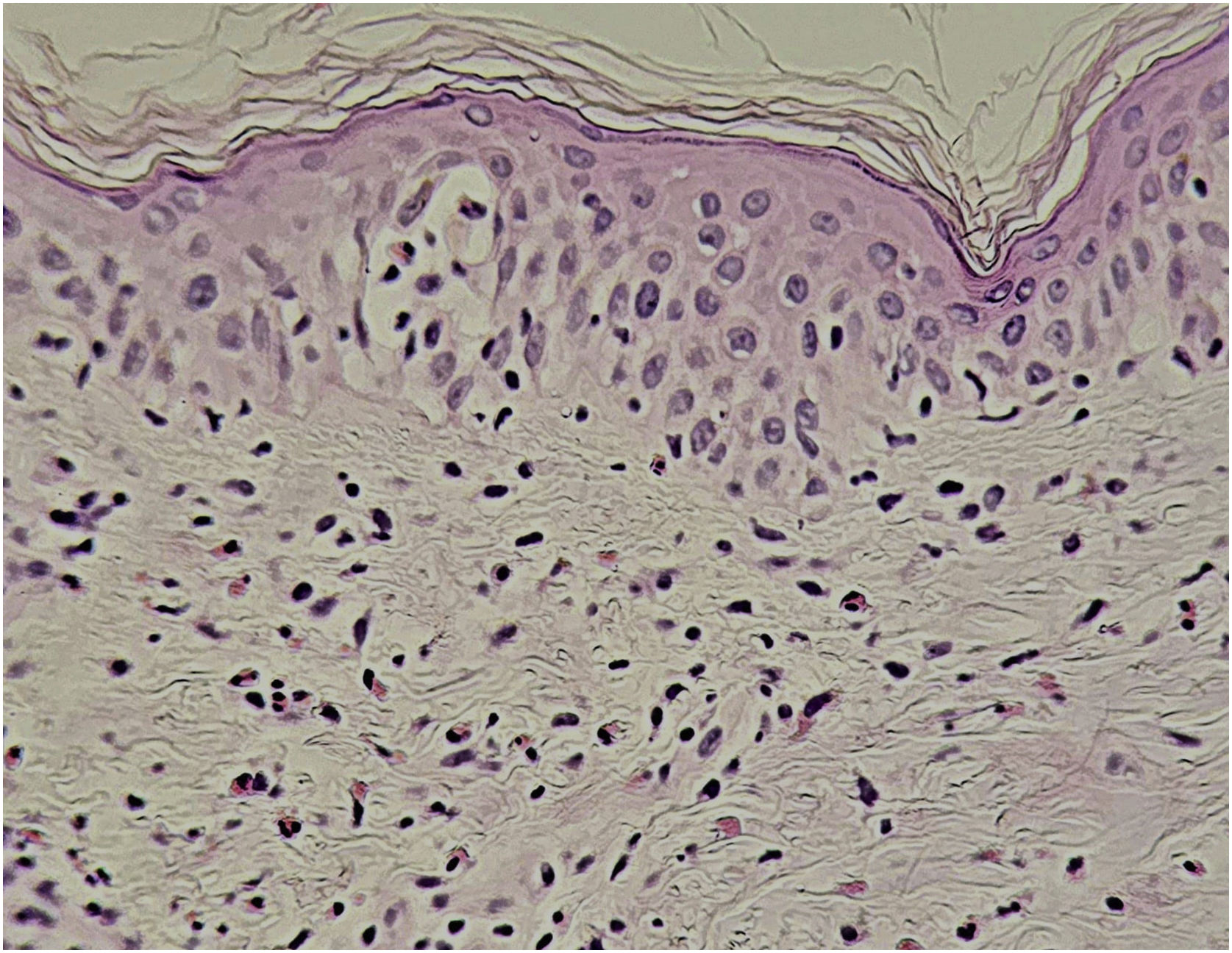
Alterações histopatológicasA histopatologia do DRESS é variável conforme a fase da doença e as manifestações clínicas e, não havendo elementos patognomônicos, demanda a correlação com critérios clínicos e laboratoriais para seu diagnóstico definitivo. Entretanto, a biopsia cutânea é recomendada para diferenciar de outras dermatoses.43
Os achados histológicos podem ser polimorfos, sendo usuais a vacuolização da camada basal, exocitose de linfócitos, necrose de queratinócitos, com infiltração linfocitária perivascular e/ou difusa, com frequentes eosinófilos (fig. 6). Edema dérmico e extravasamento de eritrócitos, podem estar presentes, assim como espongiose, reação pseudolinfomatosa e necrose focal da epiderme.43,44
Alterações laboratoriaisA eosinofilia, em vários graus, é uma das características da síndrome estando presente em até 95,5% dos casos, em alguma fase da doença, podendo se estender após a normalização das enzimas hepáticas.32,45
Várias citocinas estão envolvidas na ativação e recrutamento de eosinófilos, porém, acredita‐se que os níveis de TARC/CCL17 (thymus and activation‐regulated chemokine) estão mais elevados na DRESS em relação às outras reações graves a medicamentos e ocorrem na fase aguda da doença, sendo responsável pela eosinofilia.11,32,45 TARC é uma potente quimiocina que recruta eosinófilos e aumenta a atração linfocitária cutânea por meio do endereçamento das células T CD4+ e CD8+ para a pele, promovendo a produção de IL‐5 e eotaxina.11,32,45 A IL‐5 por sua vez é uma citocina crucial para o desenvolvimento, ativação e sobrevivência dos eosinófilos.19,22
A contagem de eosinófilos e os níveis de TARC estão associados a maior gravidade da doença, ao acometimento de múltiplos órgãos e sistemas, assim como à intensidade da resposta imunológica desencadeada pela célula T ativada, em resposta à exposição ao medicamento, bem como pela reativação viral da família dos herpes vírus humanos, especialmente HHV6.11,22,45
Outras alterações hematológicas são verificadas na DRESS. Leucocitose com linfócitos atípicos em variados graus de intensidade são características únicas da fase inicial da doença, embora a leucopenia possa ocasionalmente preceder a leucocitose.19,22 Leucocitose com neutrofilia precoce e monocitose tardia é, após a eosinofilia, a alteração hematológica mais comum, seguida por linfocitose atípica em 27%–67% dos pacientes.15,44 Outros achados menos frequentes incluem linfopenia, leucopenia, trombocitopenia, trombocitose e pancitopenia, os quais estão associados a prognóstico mais grave.15,33,46
A leucocitose se deve, em grande parte, ao aumento de linfócitos decorrente da ativação maciça dos linfócitos CD4+ e CD8+, inicialmente pelo medicamento e após sua retirada, pela reativação de infecção viral latente.19,23 Linfocitose atípica é resposta inespecífica a provável estímulo antigênico (vírus, fármaco, reação enxerto versus hospedeiro), em que ocorre produção rápida e liberação precoce de linfócitos imaturos, que são posteriormente removidos da circulação antes da mitose.47 Portanto, alto percentual de linfócitos atípicos pode ser um reflexo da estimulação mais intensa pelo antígeno (fármaco e/ou infecção).23,47 Leucocitose pode também ser induzida pela corticoterapia, na fase de tratamento.
Nas fases iniciais da DRESS (primeiros 10 dias) ocorre diminuição na contagem das células NK e células B, além do aumento de monócitos e das células Tregs. Na fase subaguda, as células Tregs perdem progressivamente sua função após a resolução clínica, com suas contagens retornando aos níveis basais.32,45
Os marcadores laboratoriais de inflamação incluem a proteína C reativa (PCR) elevada e contagens de leucócitos. A PCR é produzida pelo fígado, em resposta ao aumento da IL‐6, e tem efeitos pró‐inflamatórios na mediação da via das células efetoras humorais e celulares do sistema imunológico inato. No entanto, a inflamação não bacteriana pode causar elevação igualmente acentuada na PCR. Um marcador mais específico de infecção bacteriana é a procalcitonina (PCT). Seu valor se correlaciona com a gravidade da infecção.
Os valores da PCR e da PCT foram encontrados elevados em estudo observacional retrospectivo de 94 casos possíveis, prováveis e confirmados da síndrome DRESS, mesmo nos quais foi excluída infecção concomitante. Os valores da PCR foram significantemente maiores entre os pacientes com possíveis causas adicionais de inflamação, como infecção. Adicionalmente, um valor da PCT acima do ponto de corte normal, altamente sugestivo de infecção bacteriana, pode resultar apenas do estado inflamatório associado à síndrome DRESS. Avaliar os valores da PCR e da PCT à luz desses resultados pode ajudar os médicos a distinguir entre casos de síndrome DRESS com e sem infecção concomitante, ou outras causas de inflamação. Isso pode ajudar ainda mais na tomada de decisão sobre o melhor plano de tratamento em casos individuais.48
A elevação das enzimas hepatocelulares ocorre em até 70% dos pacientes com DRESS na fase aguda, podendo variar desde duas até mais de cinco vezes seus níveis normais. Sua normalização ocorre tanto na melhora da doença, como pode ocorrer após necrose hepática maciça, o que demanda sua monitorização cuidadosa e constante. O desenvolvimento de hepatite grave com icterícia aumenta o risco de mortalidade. Esses casos graves cursam também com alargamento no tempo de protrombina, e posterior hipoalbuminemia.11,24,32
Grau variável de envolvimento renal pode ser observado, com aumento de ureia, creatinina e proteinúria. Níveis acima de 1,5 vez o valor normal deve ser cuidadosamente monitorado.24 Os níveis de creatinina podem chegar a três vezes os valores normais, compatíveis com insuficiência renal aguda nos casos mais graves.
De modo geral, a mortalidade específica do DRESS depende tanto do grau de envolvimento renal quanto do envolvimento hepático.24 O envolvimento de outros órgãos e sistemas deve orientar a alteração de outros exames complementares. A tabela 3 lista exames laboratoriais de apoio a serem solicitados no paciente com suspeita de DRESS.
Exames laboratoriais sugeridos para um paciente com suspeita de DRESS segundo o consenso espanhol de manejo da doença24
| Hemograma com avaliação de linfócitos atípicos |
|---|
| Marcadores inflamatórios: |
| Proteína C‐reativa (PCR) |
| Procalcitonina (PCT) |
| Exames hepáticos (periódicos, se envolvimento hepático): |
| Aspartato aminotransferase (AST) |
| Alanina aminotransferase (ALT) |
| Gama‐glutamiltransferase (GGT) |
| Fosfatase alcalina |
| Bilirrubina total e frações |
| Tempo de protrombina (INR) |
| Função renal (periódicos, se envolvimento renal): |
| Creatinina sérica |
| Ureia sérica |
| Razão albumina/creatinina na urina ou razão proteína/creatinina, sedimento urinário, proteínas e células na urina |
| Proteinograma, imunoglobulinas séricas e sorologias: |
| Sorologias (IgM e IgG) para vírus herpes e reação em cadeia da polimerase (PCR) para os vírus HHV‐6, HHV‐7, EBV e CMV |
| Outros: |
| Desidrogenase láctica (DHL) |
| Lipase, amilase |
| Creatino fosfoquinase (CPK) |
| Troponina I |
| Eletrólitos sanguíneos: sódio, potássio |
| Exclusão de diagnósticos diferenciais: |
| Sorologia para Mycoplasma, Chlamydia, HAV, HBV, HCV, parvovírus B19, vírus do herpes simples 1 e 2 (erupção variceliforme de Kaposi) |
| Hemoculturas |
| Anticorpos antinucleares |
Face à complexidade clínica e heterogeneidade das manifestações, assim como a possibilidade de superposição com outras doenças, vários sistemas de critérios diagnósticos já foram propostos para a DRESS. Os critérios mais utilizados são o de Bocquet et al., o europeu RegiSCAR (Registry of Severe Cutaneous Adverse Reactions), e a versão japonesa do SCAR (Severe Cutaneous Adverse Reaction), o J‐SCAR. A reativação de vírus da família Herpesviriadae (HHV‐6, HHV‐7, CMV e EBV) não é considerada nos dois primeiros critérios, somente no J‐SCAR.2,15,32,49
Os critérios de Bocquet (1996) são os mais fáceis de serem aplicados, uma vez que compreendem a presença de três parâmetros: i) lesões cutâneas; ii) eosinofilia sanguínea (≥ 1,5 × 103/μL) ou presença de linfócitos atípicos; e iii) envolvimento sistêmico, incluindo linfadenopatia (≥ 2cm de diâmetro), hepatite (elevação de transaminases superior a duas vezes o limite da normalidade), nefrite intersticial, pneumonia intersticial ou cardite.2 No entanto, esse sistema é menos sensível no diagnóstico de casos menos exuberantes, quando comparado ao RegiSCAR. Kim et al. propõem que esses dois sistemas sejam utilizados de maneira complementar.49
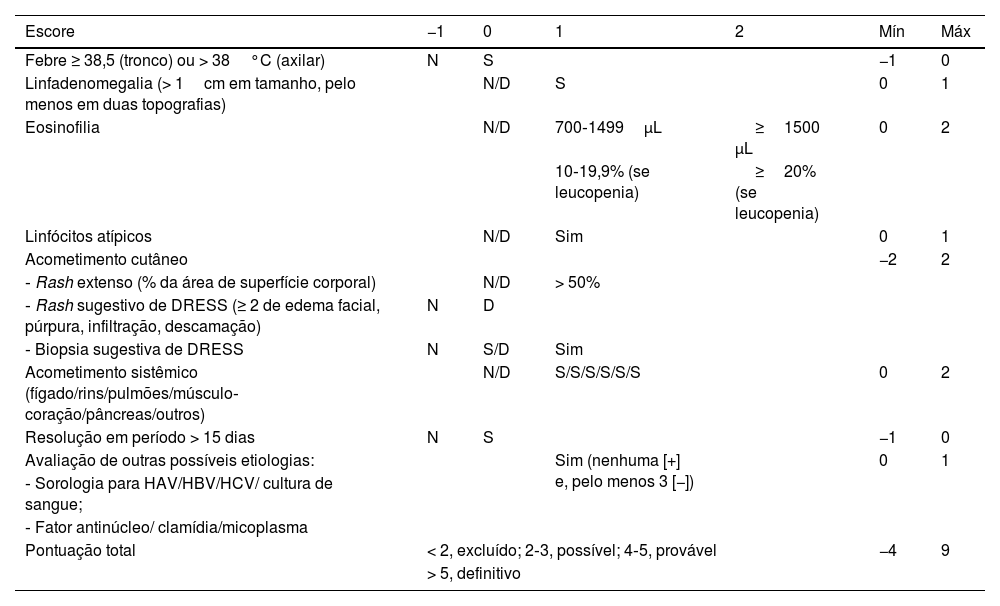
O sistema de critérios RegiSCAR é o mais detalhado (tabela 4). São considerados casos prováveis de DRESS aqueles com pontuação entre dois e três; casos possíveis, os que somarem quatro a cinco pontos; e diagnóstico definitivo quando a pontuação for acima de cinco.15 O sistema RegiSCAR é o mais usado, principalmente no meio acadêmico e o recomendado para uso, na rotina clínica, pelas diretrizes espanholas para o diagnóstico da DRESS.24,50
Critérios diagnóstico para DRESS: RegiSCAR15,24
| Escore | −1 | 0 | 1 | 2 | Mín | Máx |
|---|---|---|---|---|---|---|
| Febre ≥ 38,5 (tronco) ou > 38°C (axilar) | N | S | −1 | 0 | ||
| Linfadenomegalia (> 1cm em tamanho, pelo menos em duas topografias) | N/D | S | 0 | 1 | ||
| Eosinofilia | N/D | 700‐1499μL | ≥1500 μL | 0 | 2 | |
| 10‐19,9% (se leucopenia) | ≥20% (se leucopenia) | |||||
| Linfócitos atípicos | N/D | Sim | 0 | 1 | ||
| Acometimento cutâneo | −2 | 2 | ||||
| ‐ Rash extenso (% da área de superfície corporal) | N/D | > 50% | ||||
| ‐ Rash sugestivo de DRESS (≥ 2 de edema facial, púrpura, infiltração, descamação) | N | D | ||||
| ‐ Biopsia sugestiva de DRESS | N | S/D | Sim | |||
| Acometimento sistêmico (fígado/rins/pulmões/músculo‐coração/pâncreas/outros) | N/D | S/S/S/S/S/S | 0 | 2 | ||
| Resolução em período > 15 dias | N | S | −1 | 0 | ||
| Avaliação de outras possíveis etiologias: | Sim (nenhuma [+] e, pelo menos 3 [−]) | 0 | 1 | |||
| ‐ Sorologia para HAV/HBV/HCV/ cultura de sangue; | ||||||
| ‐ Fator antinúcleo/ clamídia/micoplasma | ||||||
| Pontuação total | < 2, excluído; 2‐3, possível; 4‐5, provável | −4 | 9 | |||
| > 5, definitivo | ||||||
N, não; S, sim; D, desconhecido.
O J‐SCAR define que, para o diagnóstico de DRESS típico, todos os sete critérios descritos devem estar presentes, incluindo a reativação do HHV‐6 (tabela 5). Deve ser salientado que tal sistema só considera alguns fármacos como potenciais causadores de DRESS. Casos atípicos de DIHS podem ser diagnosticados com a presença dos critérios um a cinco.51,52
Critério diagnóstico para DRESS: J‐SCAR.[51] Sete critérios presentes: DRESS típico, critérios 1 a 5 presentes: DRESS atípico
| 1 | Rash maculopapular iniciado mais de três semanas após o início de terapia com determinadas substâncias (carbamazepina, fenitoína, fenobarbital, mexiletina, sulfassalazina, alopurinol e minociclina) |
| 2 | Persistência dos sintomas clínicos duas semanas após a descontinuação da substância causativa |
| 3 | Febre (> 38°C) |
| 4 | Alterações hepáticas (ALT > 100/L) |
| 5 | Alterações dos leucócitos (pelo menos uma): |
| a) Leucocitose (> 11 × 109/L) | |
| b) Linfocitose atípica (> 5%) | |
| c) Eosinofilia (> 1,5 × 109/L) | |
| 6 | Linfadenopatia |
| 7 | Reativação de HHV‐6 |
Recentemente, estudo retrospectivo mostrou que o RegiSCAR foi mais acurado no diagnóstico da DRESS, classificando mais de 98% dos casos incluídos como “provável” ou “definitivo”, enquanto o J‐SCAR foi menos sensível.49,53
Ainda, Sasidharanpillai et al. sugerem que a reativação do HHV‐6, bem como do CMV, EBV e HHV‐7, sejam utilizados como indicadores prognósticos e não diagnósticos.53
Identificação do medicamento etiológico do DRESSA identificação do medicamento causador da reação é de extrema importância, não apenas para interromper a reação, mas para evitar a reexposição ao fármaco e prevenir novos episódios da DRESS, possibiltando a orientação das medicações permitidas, após o episódio agudo da síndrome.
Ao longo dos anos, foram desenvolvidos vários métodos para avaliar a causalidade, incluindo julgamento de especialistas ou introspecção global, algoritmos operacionais e abordagens probabilísticas. Infelizmente, não há algoritmo específico para a causalidade dos medicamentos de DRESS como existe para SSJ/NET.44
A história clínica detalhada sobre todos os medicamentos utilizados, incluindo os de venda livre, bem como o consumo de produtos fitoterápicos ou homeopáticos, e informações sobre retirada ou reintrodução (se disponíveis) constitui o principal instrumento de investigação etiológica. Todos os medicamentos tomados durante os períodos de exposição devem ser registrados (incluindo a cronologia do consumo do medicamento, dose, indicação e evolução clínica após a interrupção).24,44
Kardaun et al. recomendam uma série de passos para excluir medicamentos improváveis: i) medicamentos utilizados por mais de três meses; ii) medicamentos interrompidos há mais de duas semanas antes do dia do início do quadro; e iii) medicamentos iniciados menos de três dias antes do provável dia do início da DRESS. Em seguida, pode se classificar os medicamentos como “muito prováveis”, “prováveis”, “possíveis” e “indeterminados”, hierarquizando‐os de acordo com a probabilidade relatada na literatura.15,44
Não se recomenda a reexposição ao fármaco como estratégia para confirmação do diagnóstico etiológico da DRESS; entretanto, testes específicos podem fornecer algum subsídio na identificação de substâncias associadas ao risco de DRESS.54
Teste de Contato de Leitura Tardia (TCLT)O teste de contato (do inglês, patch testing) in vivo é considerado teste seguro até mesmo na investigação de reações graves e potencialmente fatais mediadas por células T, como é o caso da DRESS. Nesse contexto, é essencial ter em mente que sempre existe a possibilidade de que o TCLT com medicamentos possa desencadear exacerbação da erupção cutânea induzida pelo medicamento, embora tais casos sejam raros. O paciente deve ser informado adequadamente e deve‐se obter o termo de consentimento antes da realização do teste. Também é importante salientar que o teste pode resultar em outras lesões dermatológicas além de pápulas, vesículas e bolhas.55
O método consiste em ocluir o medicamento, previamente diluído em um meio (vaselina, água), na pele, juntamente com o veículo sozinho usado como controle.55–57 Na Europa, Canadá e Estados Unidos já existem mais preparações comercialmente disponíveis para o teste de medicamento. No Brasil, grande parte das substâncias é testada conforme as diretrizes europeias: i) testando o medicamento comercializado diluído a 30%; ou ii) preferencialmente, a substância pura a 10%, a não ser que haja informação de concentração específica para a substância disponível na literatura.55–57
Não há estudo publicado no qual os medicamentos suspeitos de causar DRESS tenham sido testados com diferentes concentrações e veículos no TCLT, em número considerável de pacientes e com os resultados completamente especificados.55–57 A literatura também não fornece indicação das concentrações e veículos ótimos ou preferidos para o TCLT com medicamentos específicos.56 Nas preparações endovenosas, recomenda‐se o uso do pó da medicação não diluída, para se fazer a preparação para o teste. Algumas substâncias, como aciclovir e carbamazepina, podem causar reações mesmo em baixas concentrações; recomenda‐se iniciar com concentrações bem mais baixas, como 0,1% a 1% e, se o teste for negativo, aumentá‐la para 10%.15
O TCLT pode ser aplicado no dorso, como os testes de contato comuns, porém, por sua baixa positividade, pode ser realizado na pele previamente acometida no episódio agudo do DRESS, pois existe maior concentração de células inflamatórias e de memória.15 A exemplo da erupção fixa medicamentosa, as leituras podem ser mais precoces (6–24 horas), mas é importante a leitura entre 72‐*96 horas e pode‐se acrescentar outra leitura após sete dias.
De Groot realizou revisão sobre a positividade do TCLT em pacientes com DRESS. Dos 437 pacientes com teste de contato positivo encontrados na literatura, 75 tiveram reações a dois ou mais medicamentos. Em seis casos, os medicamentos eram da mesma classe química/estrutural. Nos outros 69 indivíduos (16% do total da população de pacientes), os medicamentos eram de classes diferentes, indicando hipersensibilidade a múltiplas substâncias. As classes de medicamentos mais frequentemente implicadas foram os anticonvulsivantes (30%), antibióticos betalactâmicos (22%), agentes antituberculose (18%) e antibióticos não betalactâmicos (11%).58
O TCLT deve ser realizado entre seis semanas a até seis meses após a resolução da DRESS, e um mês após qualquer tratamento imunossupressor. Infelizmente, não há evidências suficientes sobre a influência dos medicamentos imunossupressores em seus resultados.15,59,60 Um estudo duplo‐cego randomizado revelou que 20mg/dia de prednisona oral suprimiam a reatividade ao TCLT em pacientes com sensibilidade ao níquel.59 Um estudo prospectivo relatou reações positivas ao TCLT em pacientes sob uso de azatioprina, ciclosporina, micofenolato de mofetila, metotrexato, infliximabe, adalimumabe, etanercepte e tacrolimo.60
O valor preditivo positivo do TCLT na DRESS varia muito nos estudos e guias de manejo, sendo positivo em até 80% dos casos entre os pacientes com DRESS, após o uso de carbamazepina, mas apenas em 20% para a exposição ao fenobarbital.58,61
Testes Intradérmicos (TID)Os testes intradérmicos (TID) podem ser usados tanto para identificar reações de hipersensibilidade imediata como tardia a medicamentos. Até recentemente, eram geralmente considerados contraindicados nas reações graves a medicamentos, porém, há autores que adicionam esses testes para melhora da acurácia no diagnóstico da medicação desencadeante da DRESS, considerando‐os potencialmente úteis e seguros quando realizados por especialistas.58,62
Deve‐se salientar que, apesar das pequenas doses utilizadas, em concentrações menores que o teste de contato, reações graves e até fatais ocorreram e as diretrizes europeias ainda o contraindicam.63 Portanto, a indicação do TID deve ser cuidadosamente avaliada e tem grande importância nas reações causadas por antibióticos, pela possibilidade de reação cruzada entre eles.58,62
Certos cuidados são importantes para realização do TID em pacientes com DRESS: i) testes com medicamentos devem ser realizados em ambiente hospitalar (sob supervisão) e só podem ser feitos com medicamentos disponíveis comercialmente na forma injetável; ii) nas reações adversas graves a medicamentos, como a DRESS, os TIDs não devem ser realizados com os medicamentos altamente suspeitos; iii) o volume recomendado para a injeção é de 0,02mL; iv) o diâmetro da pápula da injeção deve ser medido imediatamente após a injeção (T0) e após 20 minutos (T20); nesse momento, o TID é considerado positivo se o diâmetro da pápula for maior ou igual ao diâmetro do T0+3mm, e se houver eritema este deve ser medido; v) no caso de DRESS, os TIDs podem se tornar positivos nas leituras tardias, ou seja, após 24 e 48 horas.62,63
Teste de Proliferação Linfocitária (TPL)Apesar de pouco disponíveis, os testes de diagnóstico in vitro têm a vantagem de ser absolutamente seguros. Eles são baseados na propriedade das células T específicas para antígenos serem ativadas ao serem estimuladas com o antígeno nominal, em pacientes sensibilizados.24
Não devem ser realizados antes de intervalo mínimo de quatro a oito semanas após a reação e, pelo menos, quatro semanas após a interrupção do tratamento com corticosteroides sistêmicos. Após os primeiros seis meses a um ano, pode haver diminuição da positividade, embora os resultados dos testes realizados após esse tempo possam ser positivos.24,64
O método do TLP baseia‐se na avaliação da proliferação de linfócitos T, marcados com 3H‐timidina, em resposta a medicamento após incubação.64 Há grande variação na positividade, que é maior para os antibióticos betalactâmicos. Não há ainda padronização completa do método e só está disponível em centros de pesquisa.15,24,65 Recentemente, tem se tentado o uso de citocinas ou estímulo dos receptores Toll‐like (TLR) para aumento da sensibilidade e especificidade desses testes.65
Diagnósticos diferenciaisFormas típicas de DRESS com erupção morbiliforme, linfadenopatia, febre e eosinofilia que se iniciam semanas após o início de um medicamento não impõem dificuldade diagnóstica.
Algumas dermatoses podem ser confundidas com a DRESS, como SSJ, NET, eritema multiforme extenso, PEGA, síndrome da pele escaldada estafilocócica e exantemas medicamentosos febris.66–68
As principais doenças infecciosas que podem levar à confusão diagnóstica são: infecção pelo EBV (mononucleose infecciosa), CMV, vírus da hepatite A, hepatite B e infecção aguda pelo HIV, COVID‐19, parvovírus B19, Mycoplasma pneumoniae, Zika, dengue, e sífilis secundária.69
As principais doenças autoimunes ou autoinflamatórias são: lúpus eritematoso sistêmico, doença de Still do adulto, síndrome de Schnitzler e doença de Kawasaki.
Diversas doenças hematológicas são incluídas no diagnóstico diferencial da DRESS: síndrome de ativação macrofágica/hemofagocitose, linfoma/leucemia de células T do adulto de padrão eritrodérmico (associado ao HTLV‐1), pseudolinfomas, e síndromes hipereosinofílicas. A linfadenopatia reacional na DRESS pode apresentar características histopatológicas de: linfoma de células T angioimunoblástico, padrão doença de Hodgkin‐símile, linfoma de células T, linfadenite necrotizante (doença de Kikuchi‐símile) com ou sem vasculite.70,71
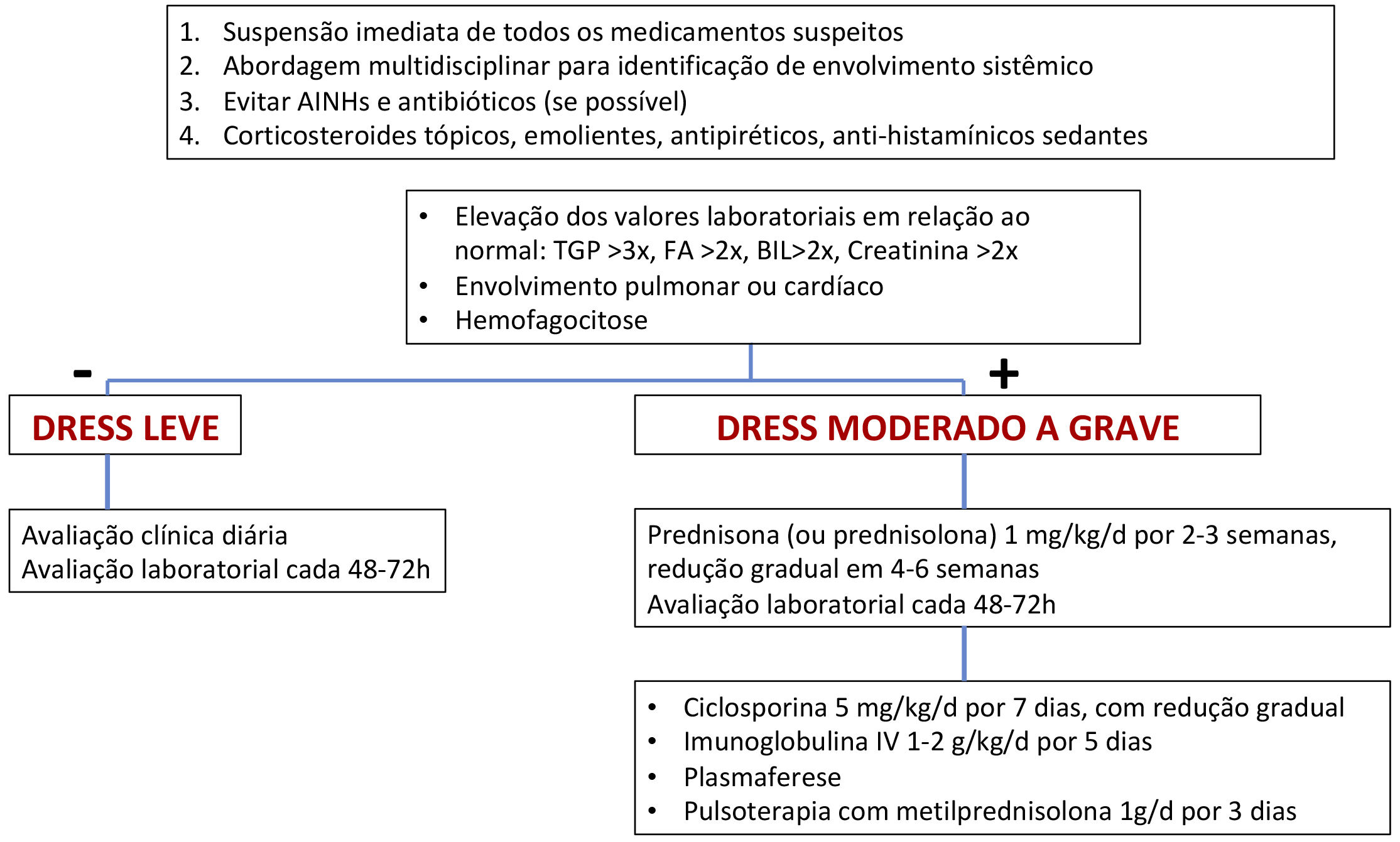
TratamentoO reconhecimento precoce do diagnóstico de DRESS e a suspensão imediata do medicamento causal são elementos essenciais para o sucesso terapêutico e mitigação dos danos sistêmicos. Tratamentos sintomáticos como antipiréticos, anti‐histamínicos, emolientes e corticoides tópicos devem ser o ponto de partida do cuidado com o paciente.11 Deve‐se evitar, na prescrição, o uso de AINHs e antibióticos, sem necessidade.11
O tratamento da DRESS depende de sua gravidade. Casos mais leves seriam aqueles nos quais, levando em consideração os valores laboratoriais referenciais normais superiores: as transaminases, especialmente TGP, não ultrapassam três vezes, ou a fosfatase alcalina não ultrapassa duas vezes, e as bilirrubinas não ultrapassam duas vezes. O paciente também não apresentaria acometimento de nenhum órgão. Nesses casos, o tratamento com corticoides tópicos, emolientes e anti‐histamínicos pode ser considerado.11,23
Porém, quando há envolvimento moderado a grave de órgãos, tais como transaminases acima de cinco vezes o valor superior referencial, ou aumento acima de duas vezes da fosfatase alcalina e de bilirrubinas, com acometimento renal agudo (creatinina > 2‐2,9 vezes acima do basal ou débito urinário <0,5mL/kg/h r > 12 horas, hemofagocitose, envolvimento pulmonar ou cardíaco), o tratamento deve conter, além das medidas citadas para os casos leves, o corticoide sistêmico na dose de 1mg/kg/dia (prednisona ou prednisolona) por duas a três semanas com redução gradual em quatro a seis semanas.11,23
Nos casos em que ocorrem sinais de alerta, tais como hemofagocitose, insuficiência medular, encefalite, insuficiência hepática ou respiratória, ou quando há falta de controle ou contraindicação aos corticoides, pode‐se utilizar a ciclosporina na dose de 4‐5mg/kg/dia por cinco a sete dias (com diminuição progressiva), imunoglobulina endovenosa (1‐2g/kg/d) por cinco dias ou plasmaférese.11,23
Casos de DRESS que evoluem com eritrodermia esfoliativa devem ser considerados de maior gravidade pelo risco de desequilíbrio hidroeletrolítico, perda energético‐proteica, maior risco de infecção e de eventos cardiovasculares. Monitoração intensiva e medidas de suporte são essenciais para mitigar as complicações decorrentes do envolvimento cutâneo extenso.72–74
Corticosteroides sistêmicos são a terapêutica de escolha no DRESS, em doses equivalentes a 1‐1,5mg/kg/dia de prednisona, havendo gradual melhora dos sintomas sistêmicos e dos parâmetros laboratoriais, que podem permanecer alterados por mais de quatro semanas. É essencial que a regressão da corticoterapia seja realizada de maneira lenta, demandando um a dois meses para a suspensão completa do tratamento. A interrupção abrupta do tratamento, mesmo na ausência de sintomas sistêmicos ou de alterações laboratoriais, pode levar à recidiva do quadro.17,75 Em casos com mínimos sintomas sistêmicos, terapia sintomática e corticosteroides tópicos de média potência podem ser utilizados.76
Quadros refratários à corticoterapia podem ser tratados com pulsoterapia intravenosa com metilprednisolona (1g/d, por três dias consecutivos). Entretanto, apesar da potência imunossupressora, esse regime pode levar à reativação do CMV, com maior mortalidade específica.77,78
Outros agentes imunossupressores são propostos como poupadores de corticoides ou seus substitutos, em casos de contraindicação.
A ciclosporina oral promove rápido controle das lesões cutâneas, dos sintomas e dos parâmetros laboratoriais. Apesar do maior risco de nefrotoxicidade associada ao medicamento, um estudo retrospectivo observou menor taxa de recidiva quando comparado com metilprednisolona intravenosa, além de o curso terapêutico ser mais breve.79,80
Outros tratamentos descritos incluem imunoglobulina intravenosa, mepolizumabe, dupilumabe e plasmaferese, cujo sucesso baseia‐se em relatos de poucos casos.27 O tratamento específico antiviral (p.ex., ganciclovir) é assunto controverso, e apesar de não recomendado por alguns autores,75 na suspeita de sinais e sintomas com confirmação de reativação viral, imunoglobulinas específicas e antivirais devem ser tentados
O acometimento sistêmico deve ser abordado por equipe multidisciplinar, especialmente hepatologistas, nefrologistas e pneumologistas, uma vez que não há paralelismo entre as manifestações cutâneas e o acometimento de outros órgãos.
A figura 7 apresenta uma proposta de fluxograma de tratamento proposto de acordo com a gravidade da DRESS.11,75,81
Prognóstico e considerações finaisO prognóstico e a resposta terapêutica são mais favoráveis em jovens que em idosos.27,75
A reexposição à substância implicada no DRESS, ou a outros fármacos com estrutura aromática, pode provocar a recidiva do quadro, de modo que o paciente deve ser informado, por escrito, desse risco especialmente ligado aos anticonvulsivantes aromáticos, alopurinol e sulfonamidas.
Os casos de DRESS apresentam gravidade variável e prognóstico pouco previsível. Complicações graves, relacionadas ou não à reativação do CMV, constituem causa altamente provável de morte.22
Pacientes idosos, com comorbidades, com a saúde debilitada, em que as manifestações sistêmicas sejam mais evidentes, em que o medicamento causador tenha sido perpetuado por mais tempo ou que tenha sido adiado o tratamento específico tendem a apresentar pior prognóstico e recuperação mais lenta.82–85
Sequelas autoimunes sistêmicas podem aparecer meses e até anos após sua resolução, tais como tireoidite autoimune, diabetes tipo I fulminante, anemia hemolítica autoimune e alopecia. Isso sugere fortemente a necessidade de acompanhamento longo, mesmo após a resolução clínica da fase aguda do DRESS.22
O envelhecimento da população mundial está associado à maior frequência de comorbidades e uso concomitante de diferentes medicamentos. Some‐se a isso ao número de novas moléculas que está se somando na farmacopeia. Esses elementos alertam para provável aumento da incidência de DRESS e à importância de seu reconhecimento e tratamento precoces.
Suporte financeiroNenhum.
Contribuição dos autoresHélio Amante Miot: Idealização do estudo, escrita e aprovação do texto final.
Roberta Fachini Jardim Criado: Idealização do estudo, escrita e aprovação do texto final.
Carolina Talhari: Idealização do estudo, escrita e aprovação do texto final.
Paulo Ricardo Criado: Idealização do estudo, escrita e aprovação do texto final.
Paulo Müller Ramos: Idealização do estudo, escrita e aprovação do texto final.
Mayra Ianhez: Idealização do estudo, escrita e aprovação do texto final.
Conflito de interessesPaulo Ricardo Criado: Advisory board ‐ Pfizer, Galderma, Takeda, Hypera, Novartis, Sanofi; Pesquisa clínica ‐ Pfizer, Novartis, Sanofi, Amgen e Lilly; Palestrantre: Pfizer, Abbvie, Sanofi‐Genzyme, Hypera, Takeda, Novartis.
Roberta Fachini Jardim Criado: Advisory board ‐ Pfizer, Takeda, Hypera, Novartis, Sanofi; Pesquisa clínica ‐ Pfizer, Novartis, Sanofi e Lilly; Palestrantre: Pfizer, Abbvie, Sanofi‐Genzyme, Hypera, Takeda, Novartis.
Hélio Amante Miot: Advisory Board – Johnson & Johnson, L’Oréal, Theraskin, Sanofi e Pfizer; pesquisa clínica Abbvie, Galderma e Merz.
Mayra Ianhez: Advisory Board‐ Galderma, Sanofi, Pfizer, Novartis, Abbvie, Janssen; Speaker ‐ Galderma, Sanofi, Pfizer, Theraskin, Novartis, Abbvie, Janssen, Leopharma, FQM.
Paulo Müller Ramos: Speaker e Advisory Board – Pfizer.
Carolina Talhari: Nenhum conflito de interesses.
Como citar este artigo: Criado PR, Ianhez M, Miot HA, Criado RFJ, Talhari C, Müller Ramos P. DRESS syndrome: an interaction between drugs, latent viruses, and the immune system. An Bras Dermatol. 2024;99. https://doi.org/10.1016/j.abd.2023.12.010.
Trabalho realizado na Faculdade de Medicina, Universidade Estadual Paulista, Botucatu, SP, Brasil.