As rosetas são pequenas estruturas brancas visíveis à dermatoscopia de luz polarizada e de correlação morfológica exata ainda não definida. Essas pequenas estruturas brilhantes foram encontradas em diversas condições como cicatriz, dermatofibroma, molusco contagioso, carcinoma espinocelular, carcinoma basocelular, melanoma, nevo melanocítico, lúpus eritematosos discoide e rosácea papulopustulosa. Neste relato inédito, descrevemos a presença de rosetas em uma lesão de pseudolinfoma de células T.
Rosetas são pequenas estruturas brancas agrupadas em formato de trevo de quatro folhas, visíveis apenas à dermatoscopia de luz polarizada. Apesar da existência de algumas teorias, sua correlação morfológica exata ainda não está definida. Inicialmente, a presença de rosetas corroborava o diagnóstico de ceratose actínica e carcinoma espinocelular; posteriormente, essas estruturas também foram descritas em diversas outras condições.1,2 Neste relato, ampliamos o número de enfermidades associadas às rosetas ao encontrá‐las em pseudolinfoma de células T.
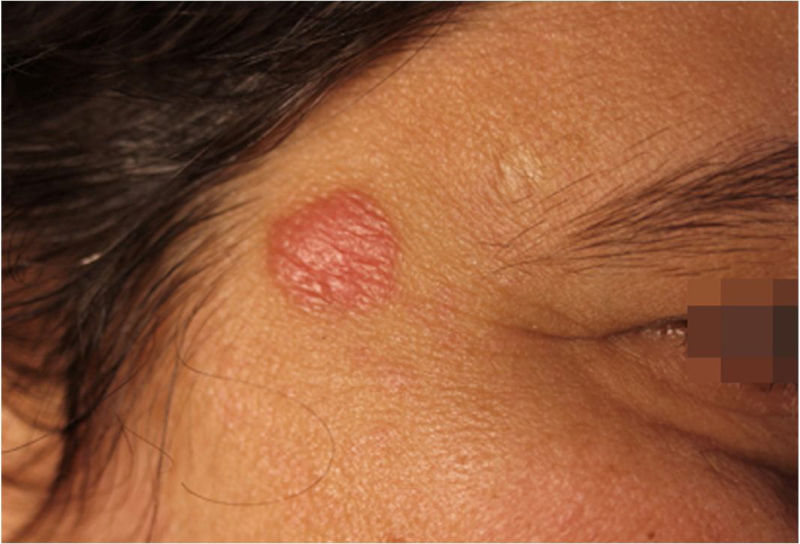
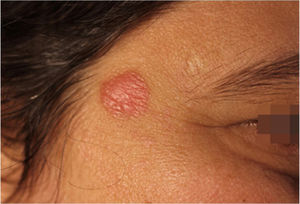
Relato do casoPaciente do sexo feminino, 42 anos de idade, em seguimento com equipe de genética e neurologia por hipótese de síndrome de Angelman. Fazia uso de lamotrigina 50 mg/dia havia dois anos e clonazepam 1 mg/dia. Relatava história de aparecimento de lesão na região temporal direita havia seis meses, de crescimento progressivo, indolor, sem prurido e sem relato de picada de inseto no local (fig. 1).
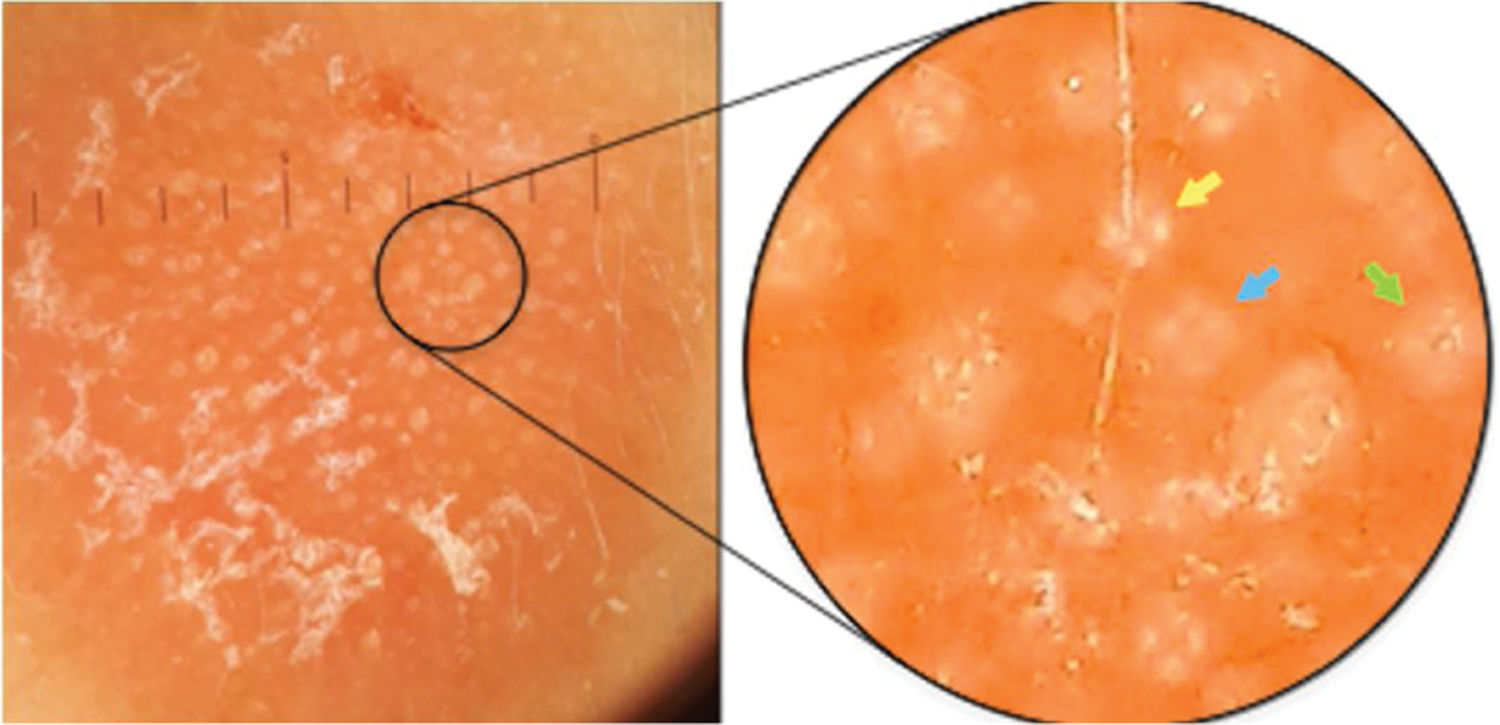
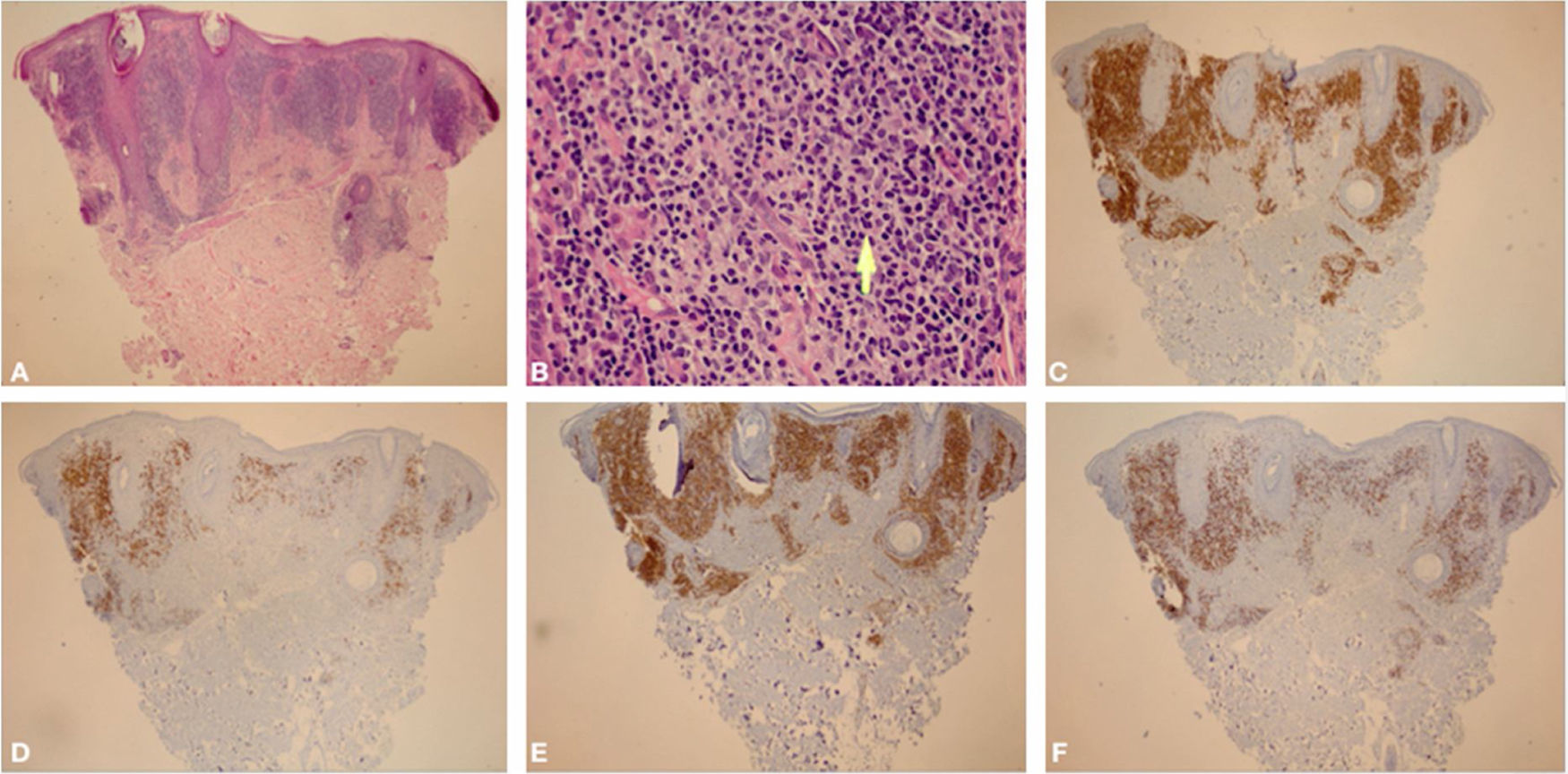
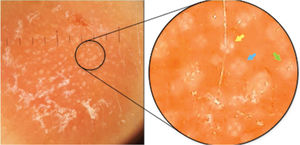
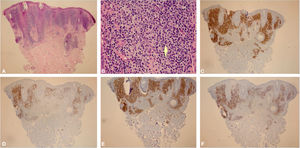
Ao exame clínico, apresentava placa circular de bordas nítidas medindo 1,2cm de diâmetro, com superfície lisa, na região temporal direita. O exame dermatoscópico de contato com luz polarizada, sem imersão, mostrou fundo de cor salmão, descamação discreta, com pontos brancos entremeados por agrupamentos de rosetas de cerca de 0,2mm, orientadas no mesmo sentido (fig. 2). Foi então realizada biópsia do centro da lesão com punch de 4mm. O exame histológico mostrou proliferação linfoide atípica, com intenso infiltrado linfocitário preenchendo a derme papilar e reticular superficial, notadamente em sua porção superior, com predomínio de linfócitos pequenos de núcleos irregulares e de volume aumentado (fig. 3 A‐B). O exame imuno‐histoquímico revelou predomínio de linfócitos T marcados por CD3, CD4 e menor expressão de CD8, com imunoexpressão de linfócitos B em parte do infiltrado (fig. 3 C‐F) e CD30 negativo. Esse padrão favorece o diagnóstico de pseudolinfoma de células T.
(A), Biópsia de pele apresentando intenso infiltrado linfocitário preenchendo a região intersticial da derme papilar e parte da reticular superficial, predominantemente na parte alta da derme (Hematoxilina & eosina, 40×). (B), Em detalhe, observa‐se predomínio de linfócitos pequenos com discretas atipias nucleares (discreto aumento do volume nuclear e discreta irregularidade nos contornos nucleares) além de áreas contendo plasmócitos e histiócitos (Hematoxilina & eosina, 400×). (C), Exame imuno‐histoquímico demonstrando predomínio de linfócitos T pelo marcador CD3 (CD3, 40×). (D), Exame imuno‐histoquímico apresentando imunoexpressão de linfócitos B em parte do infiltrado pelo marcador CD20 (CD20, 40×). E, Nota‐se discreto predomínio de linfócitos T CD4 no infiltrado (CD4, 40×). F, Marcador CD8 exibindo menor imunoexpressão que o CD4 (CD8, 40×).
As rosetas podem ser encontradas na dermatoscopia com luz polarizada em lesões melanocíticas e não melanocíticas, mas não são patognomônicas de nenhuma dermatose.3,4 As rosetas foram descritas em 2009, inicialmente associadas a ceratose actínica, ceratose líquen plano símile e carcinoma espinocelular.1 Em uma série de 6.108 dermatoscopias ex vivo, verificou‐se presença de rosetas em diversas condições, como cicatrizes (6,4%), dermatofibroma (6%), molusco contagioso (5,9%), carcinoma espinocelular (4,0%), carcinoma basocelular (1,7%), melanoma (1,4%) e nevos (0,7%).2 Há também relatos isolados da presença de rosetas em lesão de lúpus eritematoso discoide e rosácea papulopustulosa.5,6 Até onde temos conhecimento, este é o primeiro relato da presença de rosetas em pseudolinfoma de células T, mas esse achado pode não ser reprodutível em outros casos semelhantes.
Ao contrário de outras estruturas cristalinas, as rosetas não apresentam realce ângulo‐dependente; portanto, ao rotacionar o dermatoscópio sobre seu eixo central, a roseta mantém‐se estática e não acompanha a rotação do instrumento. As rosetas não são todas do mesmo tamanho – as pequenas (0,1‐0,2mm) parecem corresponder à dispersão da luz polarizada ao entrar em contato com aberturas foliculares alternadamente preenchidas por material opaco ou mesmo com ductos écrinos ao nível do infundíbulo.7 Já as rosetas maiores (0,2‐0,5mm) seriam consequência de fibrose concêntrica ao redor dos folículos.2 Essa diversidade em tamanho pode ser encontrada em uma mesma lesão, e é comum encontrar diversos white dots de permeio.5
Os white dots foram descritos por Kossard e Zagarella em 1993 na dermatoscopia de contato com imersão sem luz polarizada do couro cabeludo de paciente com hipótese de pseudopelada ou líquen plano pilar.8 Eles postularam que white dots seriam consequência de uma diminuição focal da melanina epidérmica subjacente a tratos fibrosos. Posteriormente, esses achados foram relacionados com diversas outras condições, inclusive com linfocitoma cútis.9,10 Acreditamos que rosetas e white dots façam parte de um espectro de um mesmo processo, como sugere a figura 2, em que há mistura de rosetas bem formadas que transitam para o aspecto de white dots. Postulamos também que muitos dos white dots descritos sem luz polarizada são na verdade rosetas, que poderiam ser vistas numa análise minuciosa com dermatoscopia de luz polarizada. No entanto, essa observação clínica ainda carece de confirmação histológica.
Os achados dermatoscópicos de linfomas cutâneos primários de células B não são específicos. Em estudo observacional de Geller et al. (2017), foram avaliadas 58 imagens dermatoscópicas de linfoma cutâneo primário de células B; fundo salmão foi observado em 79,3% das imagens, e vasos proeminentes foram identificados em 77,2%. Mascolo et al. (2016) encontraram estruturas circulares brancas em 90% dos casos (n total=10).
Os linfomas cutâneos primários de células T representam mais de 75% dos linfomas cutâneos. Os achados dermatoscópicos estão mais bem definidos nos casos de micose fungoide (MF). Em estudos de Bosseila et al. (2015), pequenos vasos lineares foram encontrados em 93% dos casos de MF, além de vasos em ponto em 55% e áreas laranja‐amareladas. Lallas et al. (2012) também encontraram esses achados, além de estruturas vasculares com formato semelhante ao de espermatozoides, com alta especificidade para MF ao comparar com dermatoscopia de lesões de dermatite crônica.
Já os estudos sobre dermatoscopia dos pseudolinfomas se resumem a relatos de casos, como a descrição feita por Namiki et al. (2016) de vasos lineares através de linhas reticulares esbranquiçadas no linfocitoma cútis. Vasos arboriformes e múltiplos pontos amarelados foliculares e perifoliculares foram descritos por Fujimura et al. (2012) em casos de foliculite pseudolinfomatosa. Em caso de angioceratoma acral pseudolinfomatoso, vasos lineares irregulares foram descritos, além de áreas brancas e rosa com padrão em arco‐íris na periferia (Pinus et al., 2017). Em estudos observacionais como o de Navarrete‐Dechent et al. (2019), os achados dermatoscópicos de pseudolinfomas foram analisados em conjunto com os de linfomas cutâneos primários; sugere‐se que ambos compartilham semelhanças dermatoscópicas como fundo alaranjado (71,4%), plugs foliculares (85%) e vasos lineares (78,5%).
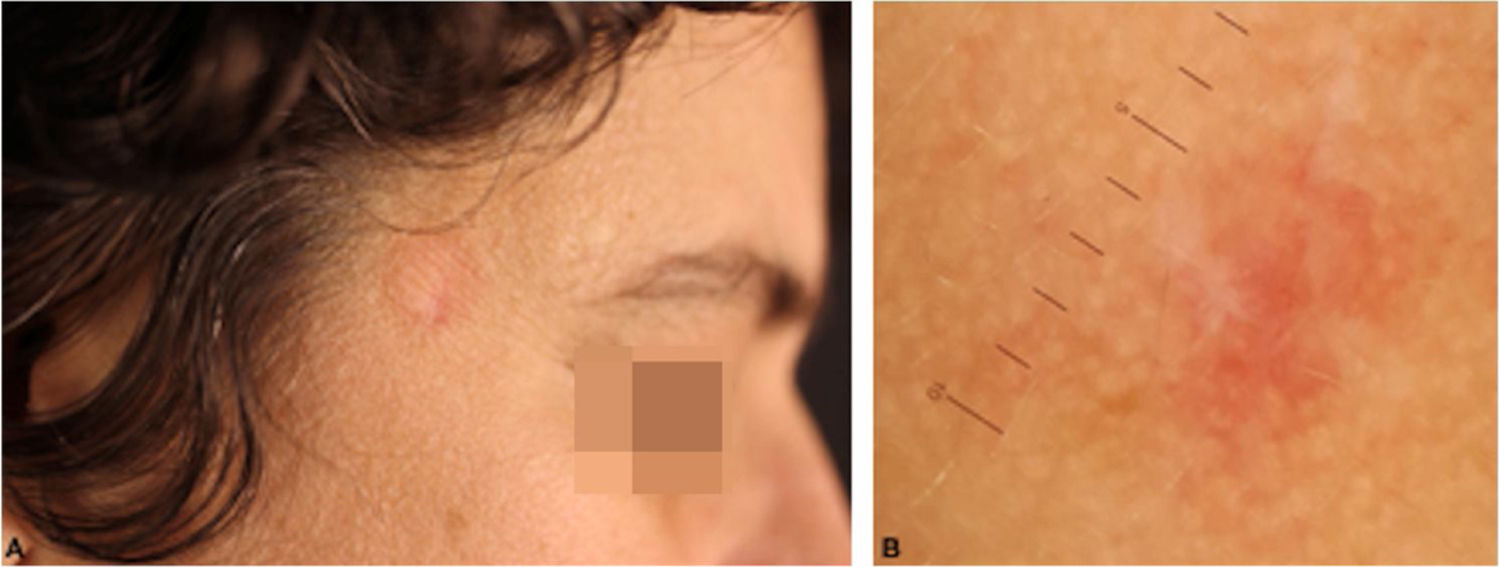
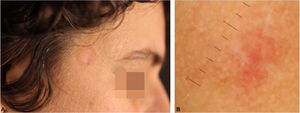
Os pseudolinfomas de células T têm curso indolente, podendo ter resolução espontânea após biópsia. No caso deste relato, optamos pelo uso de corticoide tópico de alta potência sobre a lesão, com evolução favorável após três semanas (fig. 4).
Suporte financeiroNenhum.
Contribuição dos autoresRodrigo Gomes Alves: Elaboração e redação do manuscrito; revisão crítica da literatura; revisão crítica do manuscrito.
Patricia Mayumi Ogawa: Aprovação da versão final do manuscrito; concepção e planejamento do estudo; elaboração e redação do manuscrito; revisão crítica da literatura; revisão crítica do manuscrito.
Mílvia Maria Simões e Silva Enokihara: Obtenção, análise e interpretação dos dados; participação intelectual em conduta propedêutica e/ou terapêutica de casos estudados.
Sergio Henrique Hirata: Aprovação da versão final do manuscrito; concepção e planejamento do estudo; obtenção, análise e interpretação dos dados; participação efetiva na orientação da pesquisa; participação intelectual em conduta propedêutica e/ou terapêutica de casos estudados.
Conflito de interessesNenhum.