Porocarcinoma écrino (PCE) é neoplasia cutânea rara, comumente derivando de um tumor benigno, o poroma écrino (PE), mas com diferenças clinicopatológicas entre eles necessitando de melhor compreensão.
ObjetivosEste estudo teve como objetivo identificar as características clinicopatológicas do PE e do PCE, comparar os dois grupos e descrever os fatores que podem estar associados à transformação maligna do PE.
MétodosUm total de 37 casos de PE e 22 casos de PCE diagnosticados entre janeiro de 2017 e junho de 2023 foram revisados retrospectivamente, e as características clínicas e histopatológicas foram comparadas usando métodos estatísticos.
ResultadosDados clínicos e histopatológicos, como idade, gênero, local, apresentação clínica e características histopatológicas, foram coletados. O grupo PCE foi mais comum em faixa etária mais avançada, com mais casos localizados nas áreas expostas, apresentando lesões maiores e maior incidência de ulceração. As características histopatológicas mostraram diferenças significantes entre os dois grupos na arquitetura do tumor, na ocorrência de ulceração e na presença de diferenciação escamosa, de células fusiformes, de necrose central e de infiltração inflamatória difusa.
Limitações do estudoEste estudo tem limitações em virtude do número reduzido de casos com potencial viés experimental.
ConclusãoAs características clinicopatológicas do PE e PCE foram comparadas neste estudo. Os resultados do presente estudo podem auxiliar os médicos no diagnóstico e tratamento e também podem ajudar a identificar fatores potenciais implicados na transformação maligna do PE.
O porocarcinoma écrino (PCE), também conhecido como poroma écrino maligno, é tumor anexial maligno raro da pele, originário da glândula écrina. Essa neoplasia foi reconhecida pela primeira vez por Pinkus & Mehregan em 1963 como “carcinoma écrino epidermotrópico”1 e é responsável por 0,005% a 0,01% de todas as neoplasias cutâneas malignas.2,3 Embora raro, é o tumor maligno mais frequente da glândula écrina.4 Estudos demonstraram que alguns PCE se desenvolvem a partir de um tumor benigno preexistente, o poroma écrino (PE).5–7 A etiologia e patogênese exatas do PCE ainda são desconhecidas, e os fatores que estão associados à transformação maligna do PCE ainda não foram identificados.8,9 Além disso, o PCE é, em geral diagnosticado incorretamente clinicamente. O diagnóstico diferencial do PCE na histopatologia é extenso, e às vezes a diferenciação entre o PE e o PCE não é simples. Para esclarecer isso, os autores apresentam uma série de casos e destacam as principais características dessas duas neoplasias raras. Além das características citológicas de malignidade, o estudo se concentra em características patológicas sutis e menos comumente encontradas no PCE versus PE.
Materiais e métodosMateriaisFoi realizada revisão retrospectiva de 37 casos de PE e 22 casos de PCE diagnosticados clinicopatologicamente entre janeiro de 2017 e junho de 2023 no Departamento de Dermatologia do First Affiliated Hospital da Chongqing Medical University. O diagnóstico de PE foi feito com base na histopatologia caracterizada por aglomerados tumorais compostos por células de poroma conectadas à epiderme e apresentando lúmens ductais. As células de poroma são monomórficas, pequenas, cuboidais com núcleos redondos basofílicos, nucléolos discretos e citoplasma eosinofílico compacto. O diagnóstico de PCE foi estabelecido com base em aglomerados de células tumorais anaplásicas exibindo pleomorfismo nuclear e citoplasmático, hipercromasia nuclear e atividade mitótica. Os cortes histológicos corados pelo método da hematoxilina & eosina (H&E) foram obtidos do Departamento de Dermatologia do First Affiliated Hospital da Chongqing Medical University. Os dados clínicos foram coletados de prontuários médicos de internação e formulários de solicitação de histopatologia. A aprovação ética foi concedida pelo Comitê de Ética do First Affiliated Hospital da Chongqing Medical University (protocolo K2023‐351); o consentimento por escrito não foi necessário, porque apenas informações não identificadas foram utilizadas para análise.
MétodosOs arquivos de histopatologia de biopsias de pele contendo os termos “poroma écrino” e “porocarcinoma écrino” no diagnóstico final foram pesquisados. As lâminas histológicas dos casos que preencheram os critérios de inclusão foram revisadas de maneira independente por três dermatopatologistas experientes. Um total de 37 casos de PE e 22 casos de PCE foram incluídos no grupo. As seguintes características histopatológicas foram examinadas para o poroma écrino e o porocarcinoma écrino: padrão de crescimento (infiltrativo, in situ); arquitetura tumoral (simétrica, assimétrica); presença de ulceração; demarcação nítida entre queratinócitos normais e células de poroma; presença de diferenciação escamosa, de células fusiformes, de necrose central, e o padrão de infiltração inflamatória (difusa, focal); presença de estroma fibrovascular delicado, presença de secreção por decapitação e diferenciação sebácea. Dados clínicos incluindo gênero, idade, localização anatômica, tamanho e presença de ulceração foram analisados. Foi realizada uma comparação das características clinicopatológicas dos dois grupos.
Análises estatísticasTodos os dados descritivos, incluindo os dados clínicos e histopatológicos, foram gerados para todas as variáveis. O gerenciamento de dados e as análises estatísticas foram realizados utilizando o software SPSS (versão 23.0). A idade foi expressa como a média (variação) de idade e foi comparada usando o teste t de Student. O teste χ2 e o teste exato de Fisher foram conduzidos para avaliar a associação entre as variáveis categóricas, como gênero ou localização do tumor; valores de p<0,05 foram considerados estatisticamente significantes.
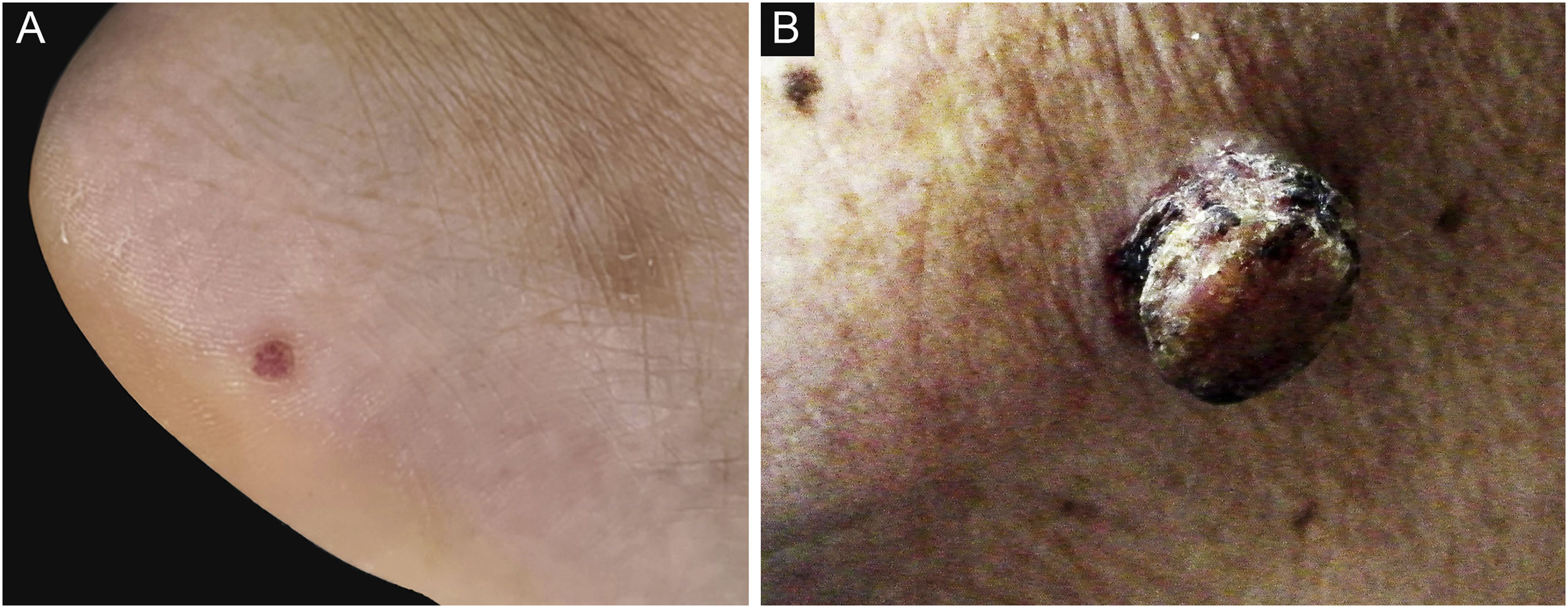
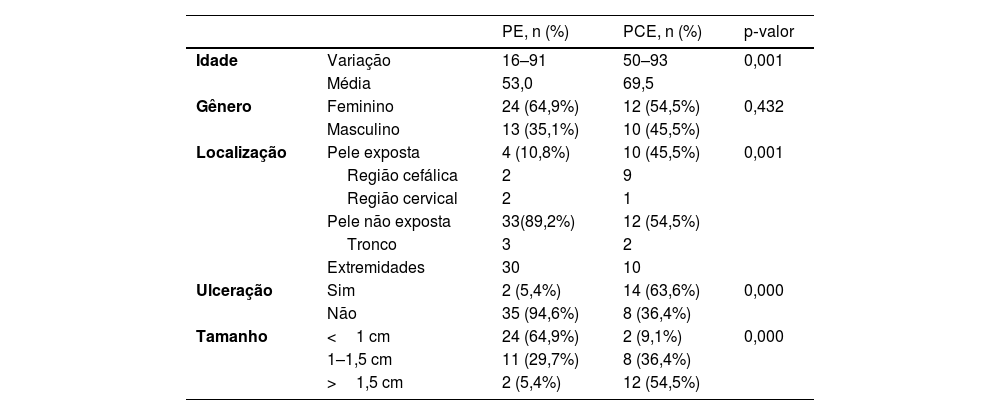
ResultadosCaracterísticas demográficas e clínicasA média de idade no diagnóstico foi de 53,0 anos para PE e 69,5 anos para PCE, 37 pacientes com PE e 22 pacientes com PCE analisados. A idade dos pacientes com PE variou de 16 a 91 anos e a idade dos pacientes com PCE variou de 50 a 93 anos. Houve diferença significante entre as idades (p=0,001). Dos 37 pacientes no grupo PE, 13 (13/37, 35,1%) eram masculinos e 24 (24/37, 64,9%) femininas; dos 22 pacientes no grupo PCE, dez (10/22, 45,5%) eram masculinos e 12 (12/22, 54,5%) femininas. Não houve diferença significante em relação ao gênero (p>0,05). Os dados clínicos dos pacientes são apresentados na tabela 1. Em relação à localização, 45,5% dos PCE estavam localizados em área exposta, dez casos na cabeça e pescoço, enquanto no grupo PE apenas 10,8% estavam localizados em área exposta, dois no couro cabeludo e dois na face (fig. 1). No grupo PCE, 14 pacientes (14/22, 63,6%) apresentaram ulceração, enquanto apenas dois (2/22, 5,4%) no grupo PE. O tamanho da lesão foi categorizado como<1cm, 1–1,5cm, >1,5cm, com pacientes com PE representando 64,9%, 29,7% e 5,4% e pacientes com PCE representando 9,1%, 36,4% e 54,5% respectivamente. Diferenças significantes foram encontradas entre os dois grupos em relação à localização da lesão, presença de ulceração e tamanho da lesão.
Características demográficas e características clínicas de pacientes com PE e PCE
| PE, n (%) | PCE, n (%) | p‐valor | ||
|---|---|---|---|---|
| Idade | Variação | 16–91 | 50–93 | 0,001 |
| Média | 53,0 | 69,5 | ||
| Gênero | Feminino | 24 (64,9%) | 12 (54,5%) | 0,432 |
| Masculino | 13 (35,1%) | 10 (45,5%) | ||
| Localização | Pele exposta | 4 (10,8%) | 10 (45,5%) | 0,001 |
| Região cefálica | 2 | 9 | ||
| Região cervical | 2 | 1 | ||
| Pele não exposta | 33(89,2%) | 12 (54,5%) | ||
| Tronco | 3 | 2 | ||
| Extremidades | 30 | 10 | ||
| Ulceração | Sim | 2 (5,4%) | 14 (63,6%) | 0,000 |
| Não | 35 (94,6%) | 8 (36,4%) | ||
| Tamanho | <1 cm | 24 (64,9%) | 2 (9,1%) | 0,000 |
| 1–1,5 cm | 11 (29,7%) | 8 (36,4%) | ||
| >1,5 cm | 2 (5,4%) | 12 (54,5%) | ||
PE, poroma écrino; PCE, porocarcinoma écrino.
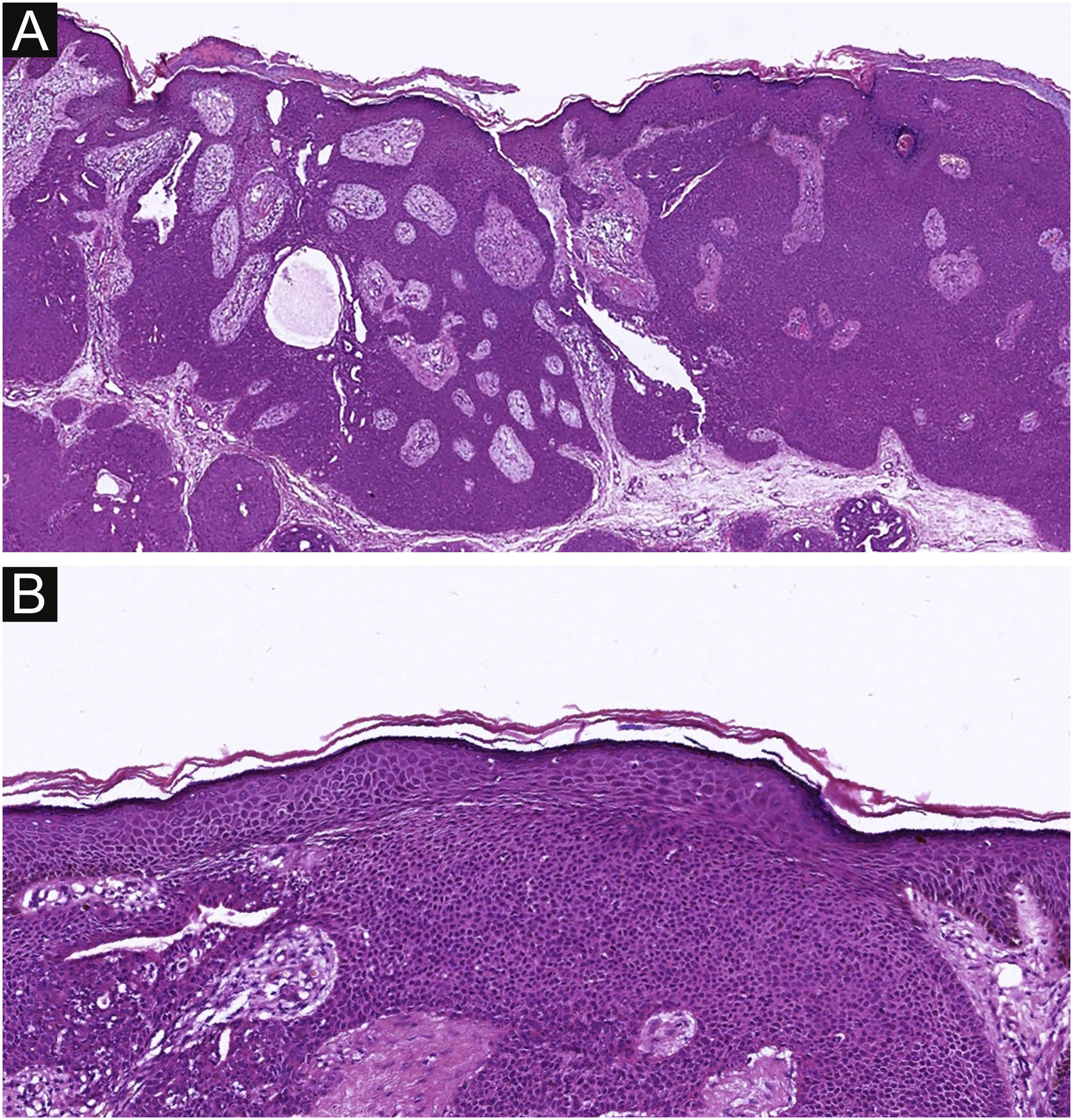
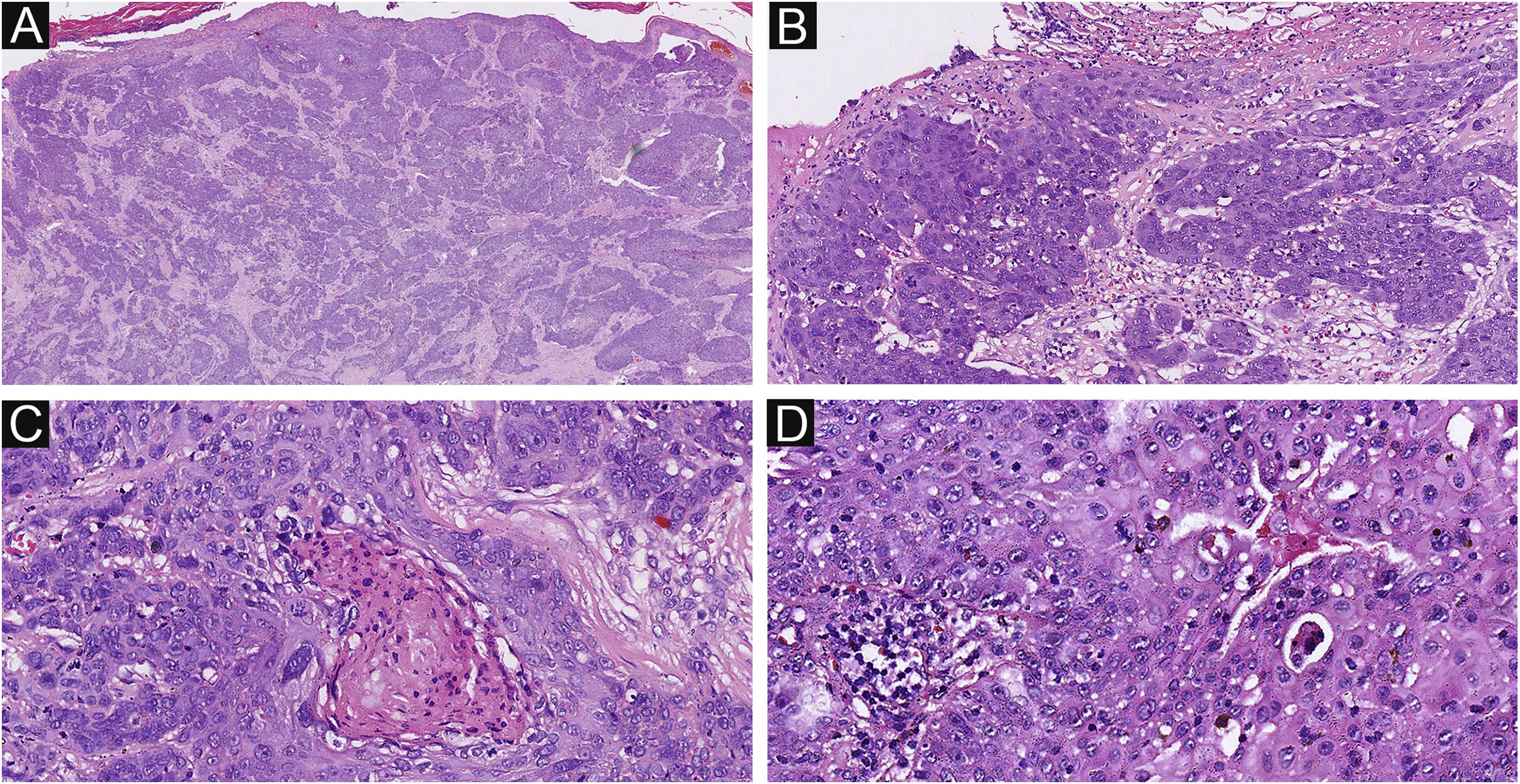
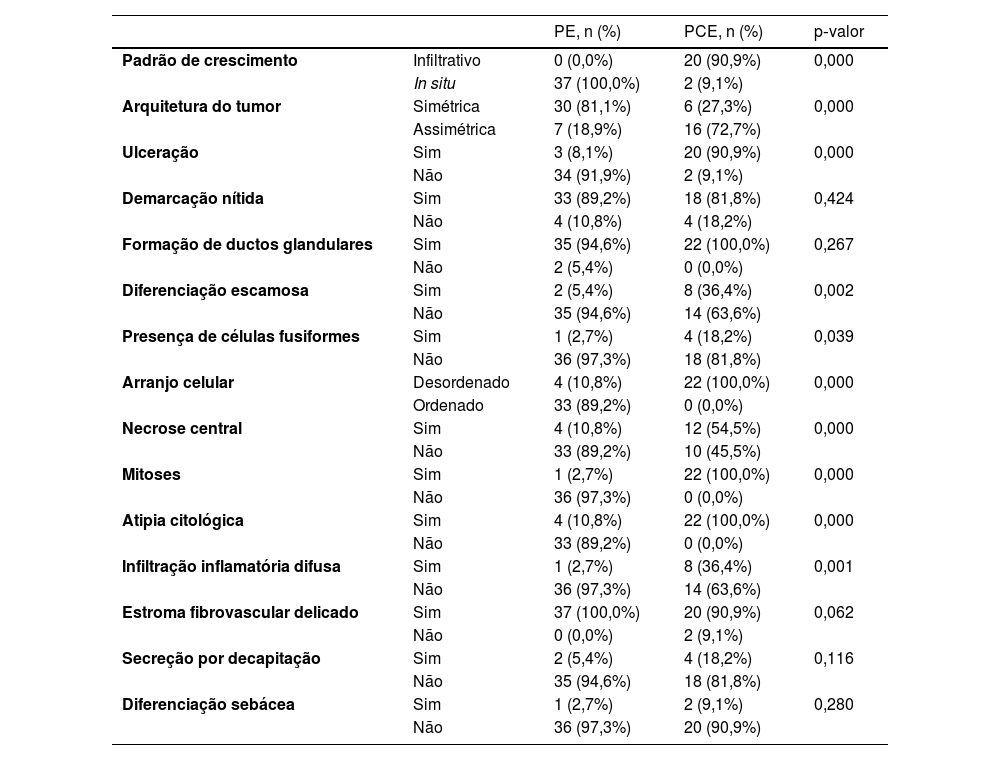
Dos 37 pacientes com PE, nenhum apresentou padrão de crescimento infiltrativo, enquanto 30 pacientes (30/37, 81,1%) apresentaram arquitetura tumoral simétrica (fig. 2). Em contraste, 20 dos pacientes com PCE apresentaram padrão de crescimento invasivo; dois eram carcinoma in situ e 16 pacientes (16/22, 72,7%) apresentaram neoplasias assimétricas (fig. 3A). Entre os pacientes com PE, três (3/37, 8,1%) apresentaram ulceração, enquanto 20 pacientes (20/22, 90,9%) mostraram ulceração no grupo PCE (fig. 3B). “Necrose central” refere‐se ao material necrótico na parte central do tumor. Quatro pacientes (4/37, 10,8%) com PE e 12 (12/22, 54,5%) com PCE apresentaram necrose central (fig. 3C e 3D). No presente estudo, as células tumorais no grupo PCE apresentaram diferenciação escamosa e morfologia fusiforme em oito e quatro casos, respectivamente (fig. 4), enquanto essas alterações foram menos frequentes no grupo PE (dois e um caso, respectivamente). Além disso, infiltrados inflamatórios difusos foram significantemente mais prevalentes no grupo PCE, com oito pacientes (8/22, 36,4%), em comparação com apenas um paciente (1/37, 2,7%) no grupo PE. Além disso, diferenças histopatológicas bem estabelecidas entre os dois grupos foram significantemente diferentes no presente estudo. Elas incluíram arranjo celular, presença de mitoses e atipia citológica.
Histopatologia do PCE. (A) Neoplasia com padrão de crescimento infiltrativo. (B) As células malignas têm núcleos hipercromáticos, desordenados atípicos e com mitoses. Notar estruturas ductais e ulceração. (C) Lesão mostrando área de necrose central e atipia citológica. (D) Necrose celular, arranjo desordenado e mitoses estão presentes. Ampliações originais (A, 20×; B, 100×; C, 200×; D, 200×).
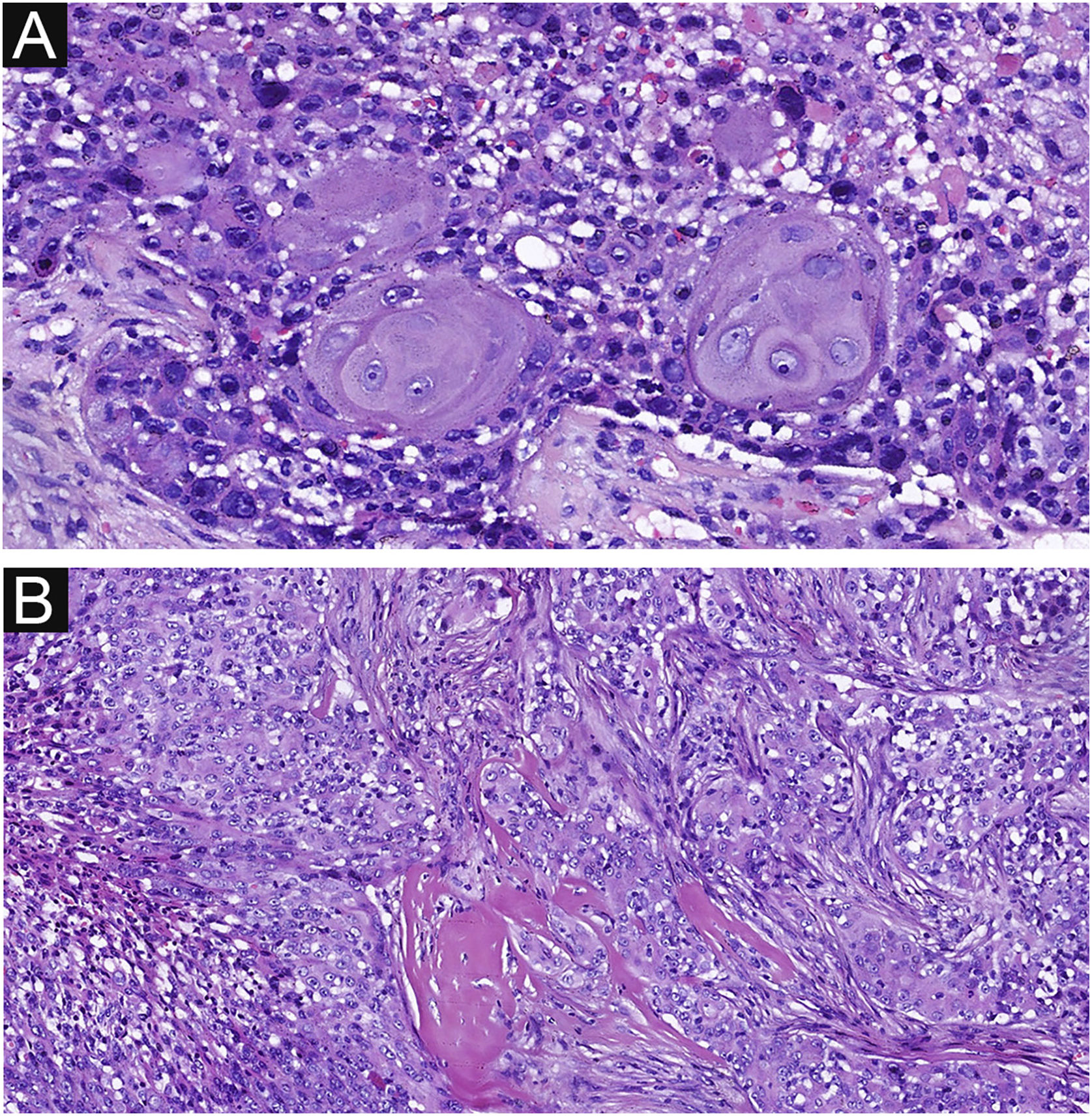
Estroma fibrovascular delicado e demarcação nítida entre queratinócitos normais e células de poroma são características histopatológicas importantes do poroma, vistas em 37 e 33 casos, respectivamente, no presente estudo (fig. 5A–B). Essas características também foram comuns em PCE, vista em 20 e 18 casos, respectivamente (fig. 5C–D), sem diferença significante entre os dois grupos. A secreção por decapitação e a diferenciação sebácea são características pouco frequentes do PE. Nenhuma diferença significante foi encontrada entre os dois grupos em termos de diferenciação sebácea e secreção por decapitação no presente estudo. Existem dois tipos de poroma e porocarcinoma: écrino e apócrino. Apenas poromas e porocarcinomas apócrinos apresentam diferenciação sebácea e secreção por decapitação (tipo apócrino) porque essas glândulas estão relacionadas à unidade pilo‐sebácea‐apócrina. A localização dos tumores em áreas de glândulas apócrinas pode ser indicação de diferenciação apócrina. Os achados histopatológicos são mostrados na tabela 2.
Estroma fibrovascular delicado e demarcação nítida do PE e PCE. (A) Queratinócitos normais e células de poroma bem formadas são vistos neste campo microscópico, com demarcação clara entre eles no PE. (B) Estroma fibrovascular delicado no PE. (C) Lesão mostrando demarcação nítida entre queratinócitos normais e células do poroma com pleomorfismo nuclear e hipercromatismo no PCE. (D) Estroma fibrovascular delicado no PCE. Ampliações originais (A, 100×; B, 200×; C, 100×; D, 200×).
Características histopatológicas de PE e PCE
| PE, n (%) | PCE, n (%) | p‐valor | ||
|---|---|---|---|---|
| Padrão de crescimento | Infiltrativo | 0 (0,0%) | 20 (90,9%) | 0,000 |
| In situ | 37 (100,0%) | 2 (9,1%) | ||
| Arquitetura do tumor | Simétrica | 30 (81,1%) | 6 (27,3%) | 0,000 |
| Assimétrica | 7 (18,9%) | 16 (72,7%) | ||
| Ulceração | Sim | 3 (8,1%) | 20 (90,9%) | 0,000 |
| Não | 34 (91,9%) | 2 (9,1%) | ||
| Demarcação nítida | Sim | 33 (89,2%) | 18 (81,8%) | 0,424 |
| Não | 4 (10,8%) | 4 (18,2%) | ||
| Formação de ductos glandulares | Sim | 35 (94,6%) | 22 (100,0%) | 0,267 |
| Não | 2 (5,4%) | 0 (0,0%) | ||
| Diferenciação escamosa | Sim | 2 (5,4%) | 8 (36,4%) | 0,002 |
| Não | 35 (94,6%) | 14 (63,6%) | ||
| Presença de células fusiformes | Sim | 1 (2,7%) | 4 (18,2%) | 0,039 |
| Não | 36 (97,3%) | 18 (81,8%) | ||
| Arranjo celular | Desordenado | 4 (10,8%) | 22 (100,0%) | 0,000 |
| Ordenado | 33 (89,2%) | 0 (0,0%) | ||
| Necrose central | Sim | 4 (10,8%) | 12 (54,5%) | 0,000 |
| Não | 33 (89,2%) | 10 (45,5%) | ||
| Mitoses | Sim | 1 (2,7%) | 22 (100,0%) | 0,000 |
| Não | 36 (97,3%) | 0 (0,0%) | ||
| Atipia citológica | Sim | 4 (10,8%) | 22 (100,0%) | 0,000 |
| Não | 33 (89,2%) | 0 (0,0%) | ||
| Infiltração inflamatória difusa | Sim | 1 (2,7%) | 8 (36,4%) | 0,001 |
| Não | 36 (97,3%) | 14 (63,6%) | ||
| Estroma fibrovascular delicado | Sim | 37 (100,0%) | 20 (90,9%) | 0,062 |
| Não | 0 (0,0%) | 2 (9,1%) | ||
| Secreção por decapitação | Sim | 2 (5,4%) | 4 (18,2%) | 0,116 |
| Não | 35 (94,6%) | 18 (81,8%) | ||
| Diferenciação sebácea | Sim | 1 (2,7%) | 2 (9,1%) | 0,280 |
| Não | 36 (97,3%) | 20 (90,9%) | ||
PE, poroma écrino; PCE, porocarcinoma écrino.
PCE é neoplasia cutânea maligna relativamente rara que surge das glândulas sudoríparas. Como correspondente maligno do PE, sua taxa de incidência foi de cerca de 1,866 por 100.000 de acordo com estudo anterior.10 Nos últimos anos, a taxa de incidência de PCE tem sido relatada como aumentando gradualmente. No presente estudo, o PCE foi responsável por cerca de 0,008% de todos os tumores de pele; essa incidência pode ter sido influenciada por casos de consulta que podem ter aumentado seu valor. Recorrências locais e metástases para linfonodos são vistas em cerca de 17% dos casos, e 8% dos pacientes podem morrer por disseminação da doença.10 De acordo com estudos anteriores, embora o PCE possa ser primário, a maioria é derivada de PE, e os fatores associados a essa transformação ainda não estão claros. A proporção de casos de PCE que se desenvolvem a partir de PE variou em relatos anteriores. Nesta série de casos, quatro pacientes (4/22, 18,2%) apresentaram início súbito de ulceração, hemorragia ou aumento em lesões preexistentes, enquanto seis pacientes (6/22, 27,3%) apresentavam focos residuais de lesões écrinas benignas. Esses achados sugerem que esses casos de PCE possam ter se originado de PE preexistentes. Entretanto, alguns casos podem ter se desenvolvido ao longo de um período mais longo, dificultando a detecção dos elementos de transição. Por outro lado, quatro pacientes (4/22, 18,2%) com PCE no presente estudo desenvolveram metástases, em concordância com relatos anteriores.
Estudos anteriores descobriram que a exposição crônica à luz solar é fator de risco para o desenvolvimento de PCE.5–7 Isso pode estar relacionado ao seu efeito na regulação do sistema imunológico. A UVB induz e ativa células T reguladoras imunossupressoras, reduz o número e a função das células de Langerhans e aumenta a liberação de mediadores imunossupressores.8 Relatos recentes debateram a localização comum dos PCE. Alguns estudos demonstraram que a localização mais comum dos PCE são os membros inferiores, mas outros sugeriram que as localizações mais comuns sejam: a região cefálica, a região cervical e o tronco.5,11–13 Os resultados do presente estudo mostraram que os PCE estavam predominantemente localizados em área exposta. Esse achado apoia a ideia de que a exposição crônica à luz solar é um dos possíveis fatores associados à transformação maligna. A diferença na média de idade entre os dois grupos sugere que tumores em idosos são mais propensos a sofrer uma transformação maligna, o que pode ser decorrente da vigilância imunológica reduzida. Alguns relatos de casos anteriores sugerem que os PCE podem estar associados a tamanho maior, dano actínico e idade avançada, e o presente estudo fornece evidências adicionais nesse sentido.
Diferenças estatisticamente significantes foram observadas em relação a arranjo celular desordenado, mitoses e atipia citológica de acordo com os critérios para diagnóstico e inclusão de PCE neste estudo. Além das características citológicas malignas, o estudo se concentrou na avaliação de características histopatológicas menos comumente encontradas em PCE versus PE. Padrão de crescimento infiltrativo e arquitetura tumoral assimétrica foram significantemente mais comuns no grupo PCE, semelhante às diferenças entre a maioria dos tumores benignos e malignos. Alguns pesquisadores acreditam que o comportamento biológico agressivo associado à ulceração posa ser consequência de uma propriedade biológica intrínseca do tumor, que favorece sua disseminação e se manifesta localmente pela ausência de integridade epidérmica.14 Os presentes dados corroboram esse achado; a ulceração foi mais comum no grupo PCE. Achados semelhantes foram relatados em carcinoma espinocelular cutâneo e melanoma.14–17 Necrose central refere‐se à morte de células neoplásica na porção central da lesão, circundadas por inflamação e restos celulares assemelhando um comedão.5 Foi observado padrão de necrose central em 54,5% dos casos de PCE, que é maior do que os 32% e 45% observados por pesquisadores anteriores.5,12 Essa alteração pode ser decorrente de isquemia localizada e necrose no tumor maligno, levando à morte celular e formando uma zona necrótica central. No grupo PCE, foi observada incidência significantemente maior de infiltração inflamatória difusa da derme do que no grupo PE. A inflamação associada ao tumor é uma característica essencial das neoplasias malignas e pode ter função de promoção do tumor.18,19 Isso pode ser decorrente da natureza altamente ativa e invasiva do tumor, levando a resposta inflamatória aumentada no tecido circundante.
No grupo PCE, foi identificada diferenciação escamosa em 36,4% dos tumores, semelhante aos achados de Riera‐Leal et al.12 A presença de diferenciação escamosa em PCE tem sido assunto de interpretações variadas, pois alguns estudiosos a consideram um subtipo histopatológico distinto de PCE, enquanto outros a consideram como variante do carcinoma espinocelular.12,20 Há também a opinião de que representa apenas achado incidental com significância limitada.21 Nesse contexto, os autores concordam com o ponto de vista que a considera um subtipo histopatológico distinto de PCE. Isso pode representar um padrão de transformação maligna em PE, mas os mecanismos exatos por trás disso requerem mais pesquisa e investigação. Semelhante à diferenciação escamosa, os autores também observaram diferenças estatisticamente significantes na presença de células fusiformes. Em contraste com os 4% relatados em estudo anterior, foi observada prsença das células fusiformes em 18,2% dos casos do presente estudo.5 Robson et al. consideraram esse tipo de PCE como variante de células fusiformes do porocarcinoma e propuseram que pode existir um espectro entre o porocarcinoma de células fusiformes puro e tumores com morfologia mais clássica.5 Esse tipo de PCE pode expressar alto grau de heterogeneidade e malignidade.22
Também se suspeita que tumores que apresentam diferenciação de glândulas apócrinas com componentes mais complexos, incluindo pelos, são mais suscetíveis à transformação maligna. Nesses casos foi observado secreção por decapitação e diferenciação sebácea. Entretanto, não foram encontradas diferenças significantes para apoiar essa hipótese. Estroma fibrovascular delicado e demarcação nítida entre queratinócitos normais e células de poroma são características histopatológicas importantes do poroma e também foram comuns no grupo PCE no presente estudo, sem diferença significante entre os dois grupos.
Em conclusão, o presente estudo destaca diferenças nas características clinicopatológicas entre pacientes com PE e PCE. O PCE ocorre com mais frequência em pacientes mais velhos e em pele exposta, e tem maior probabilidade de apresentar ulceração e tamanho maior. Na histopatologia, foram encontrados padrões de crescimento infiltrativo, arquitetura tumoral assimétrica, ulceração, necrose central, diferenciação escamosa, presença de células fusiformes e infiltração inflamatória difusa significantemente mais frequentes no grupo PCE. Os achados do presente estudo podem ajudar a identificar fatores potencialmente associados à transformação maligna de PE e auxiliar os médicos no diagnóstico e tratamento.
Suporte financeiroNenhum.
Contribuição dos autoresQin‐Xiao Wang: Concepção e planejamento; curadoria de dados; metodologia; análise formal; visualização; validação; redação e rascunho do manuscrito original.
Si‐Yu Luo: Curadoria de dados; investigação; visualização.
Kai‐Yi Zhou: Curadoria de dados; administração do projeto; validação.
Xiao Shen: Recursos; Supervisão; redação, revisão e edição do manuscrito.
Sheng Fang: Concepção e planejamento; metodologia; recursos; supervisão; redação, revisão e edição do manuscrito.
Conflito de interessesNenhum.
Como citar este artigo: Wang QX, Luo SY, Zhou KY, Shen X, Fang S. Eccrine poroma versus eccrine porocarcinoma: a comparative study of clinicopathological features. An Bras Dermatol. 2025;100. https://doi.org/10.1016/j.abd.2024.04.010
Trabalho realizado no The First Affiliated Hospital of Chongqing Medical University, Chongqing, China.