Doenças autoimunes cutâneas existem em um espectro biológico. Uma condição conceitualmente desafiadora é o líquen plano penfigoide (LPP), cujos casos parecem compartilhar características de penfigoide bolhoso e líquen plano. Aqui os autores apresentam três casos recentes e enfatizam que a classificação como LPP pode ser feita utilizando características clínicas em conjunto com achados histopatológicos e de imunofluorescência. Mais especificamente, a classificação como LPP pode ser feita no contexto de: 1) lesões liquenoides, clínica e histopatologicamente; 2) deposição linear ao longo da zona da membrana basal (ZMB) de IgG e/ou C3 em exame de imunofluorescência; e 3) ausência de evidências para apoiar outro diagnóstico específico.
As descrições clínicas de LPP geralmente incluem lesões semelhantes a líquen plano com o achado adicional de bolhas tensas.1 A histopatologia é considerada semelhante à do líquen plano. Imunofluorescência positiva mostrando deposição ao longo da junção dermoepidérmica é considerada característica essencial. Vários estudos descobriram que o autoantígeno é direcionado contra o subdomínio NC16A do colágeno do tipo XVII (BP180).2 Entretanto, heterogeneidade significante em antígeno(s) alvo‐específico(s) foi documentada.3–6
Os critérios de classificação são usados para ajudar a agrupar as doenças e facilitar seu estudo.7 Eles não devem servir como critérios diagnósticos, mas são frequentemente utilizados a nível prático, enfatizando características importantes da doença. Particularmente, como os critérios diagnósticos tem limitações devido a características inerentes de sensibilidade e especificidade, os critérios de classificação são publicados pelo American College of Rheumatology enquanto os critérios diagnósticos não são. Dada a controvérsia histórica associada ao LPP, essa é uma doença para a qual diretrizes semelhantes a critérios de classificação seriam clinicamente úteis.
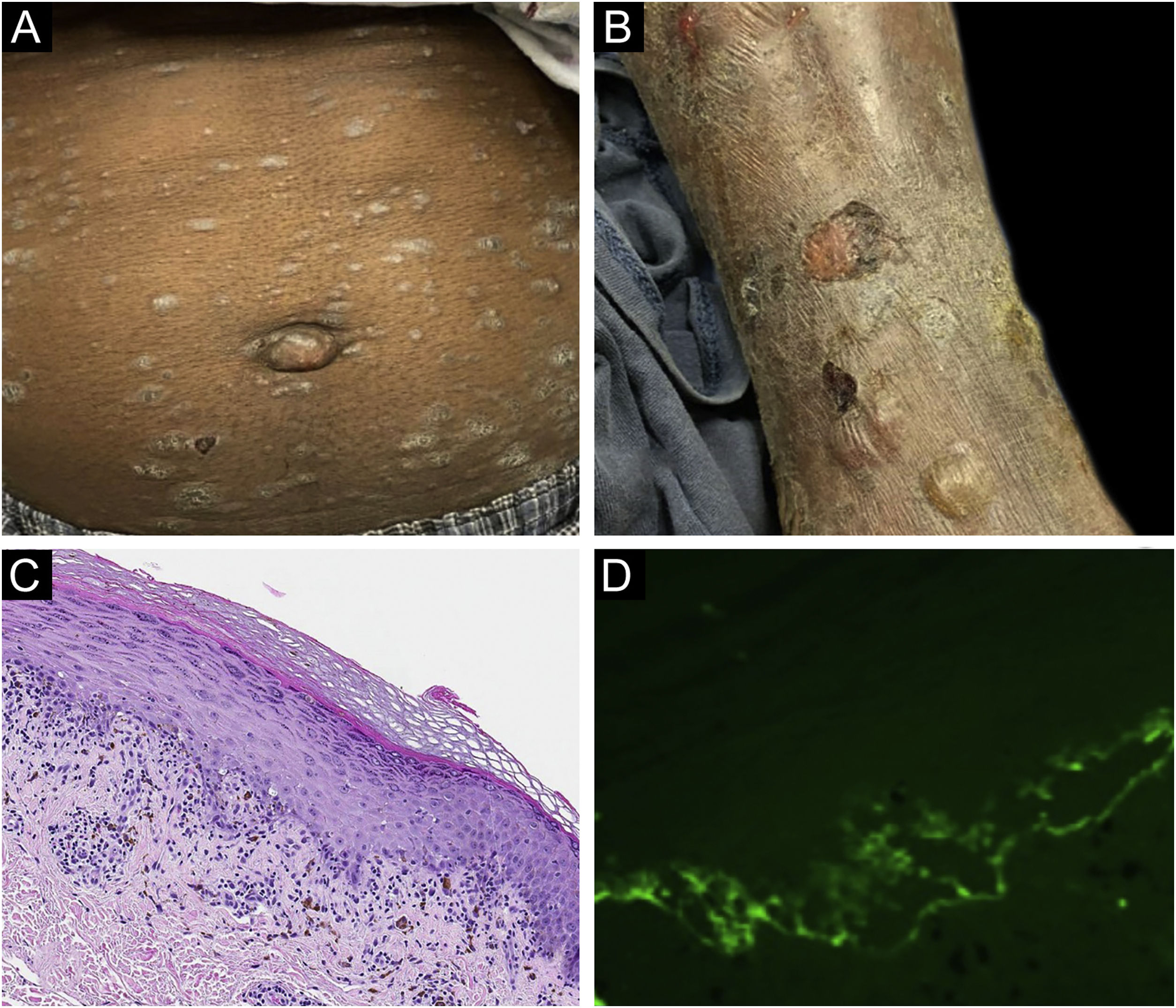
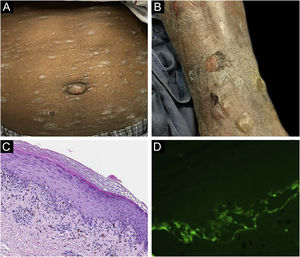
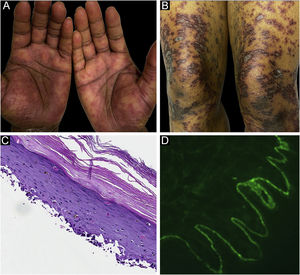
O caso 1 era um paciente do sexo masculino, de 55 anos, com adenocarcinoma de cólon não tratado que apresentava erupção pruriginosa consistindo em pápulas e placas descamativas, violáceas, envolvendo as extremidades e o tronco há vários meses, com formação de bolhas mais recente (fig. 1A‐B). A biópsia de uma lesão liquenoide representativa revelou dermatite de interface liquenoide ativa, histopatologicamente consistente com líquen plano (fig. 1C). Biópsia perilesional para imunofluorescência direta (IFD) revelou deposição linear de C3 sem acompanhamento de IgG (fig. 1 D), corpos citoides e deposição de fibrinogênio em padrão fibrilar emaranhado na ZMB. O paciente apresentou melhora com prednisona, sem recidiva após sua redução.
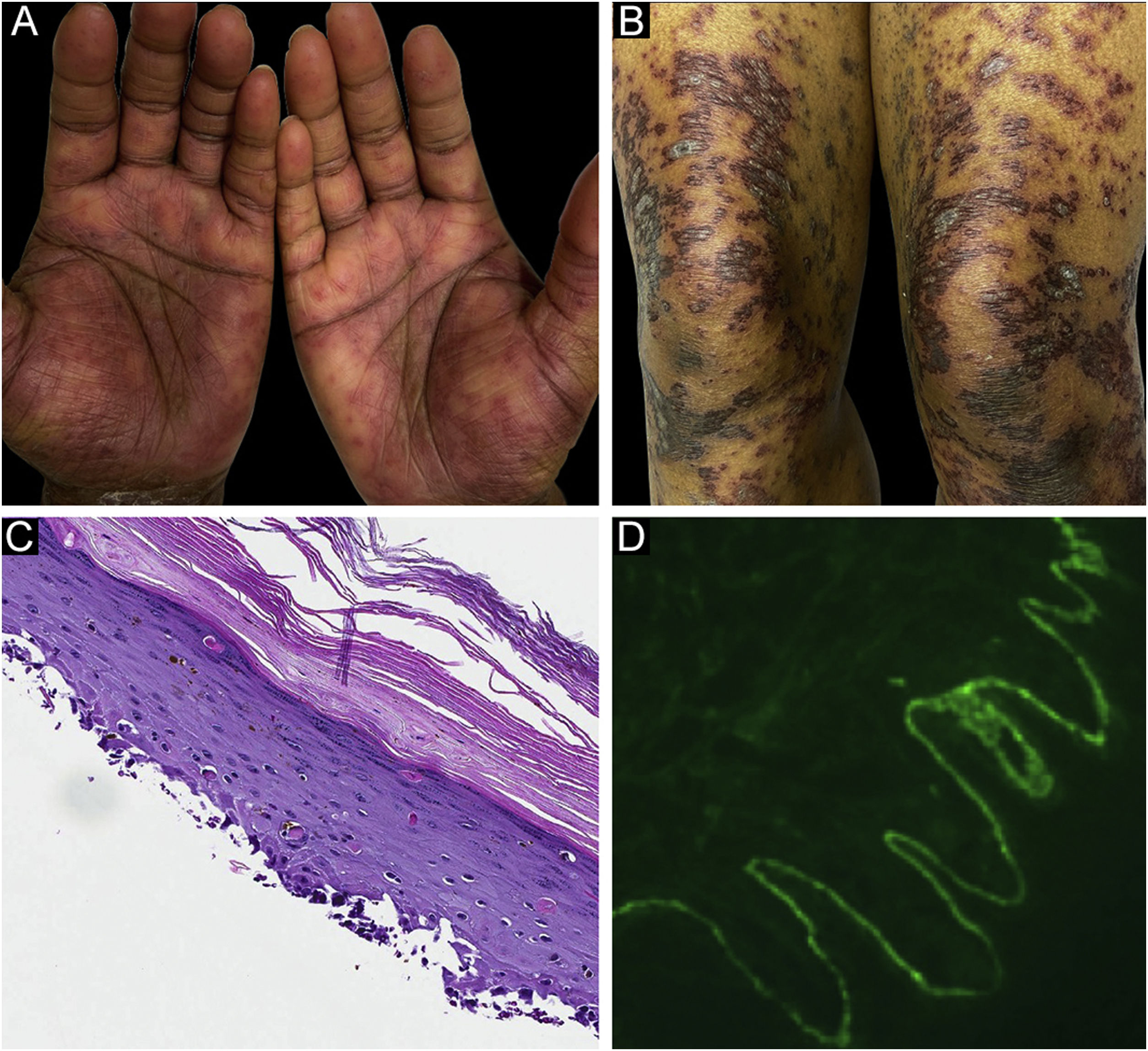
O caso 2 era uma paciente do sexo feminino, de 29 anos, com história de seis meses de pápulas e placas liquenoides, diagnosticadas presumidamente como líquen plano. Na apresentação, também apresentava vesículas e bolhas espalhadas sobre a pele não afetada e pele liquenoide, distribuídas nas extremidades e no tronco (fig. 2A‐B). A pesquisa de autoanticorpos foi negativa, e nenhum sintoma sistêmico estava presente. A biópsia revelou dermatite de interface de grau acentuado com características de líquen plano. Entretanto, em contraste com o LP típico, a epiderme estava completamente destacada da derme subjacente, formando uma fenda observada na histopatologia (fig. 2C). A IFD mostrou IgG linear fraca, mas forte deposição linear de C3 (fig. 2D) e fibrinogênio ao longo da ZMB com presença de corpos citoides juncionais. A paciente iniciou tratamento com prednisona e metotrexato, com bom controle da doença no seguimento.
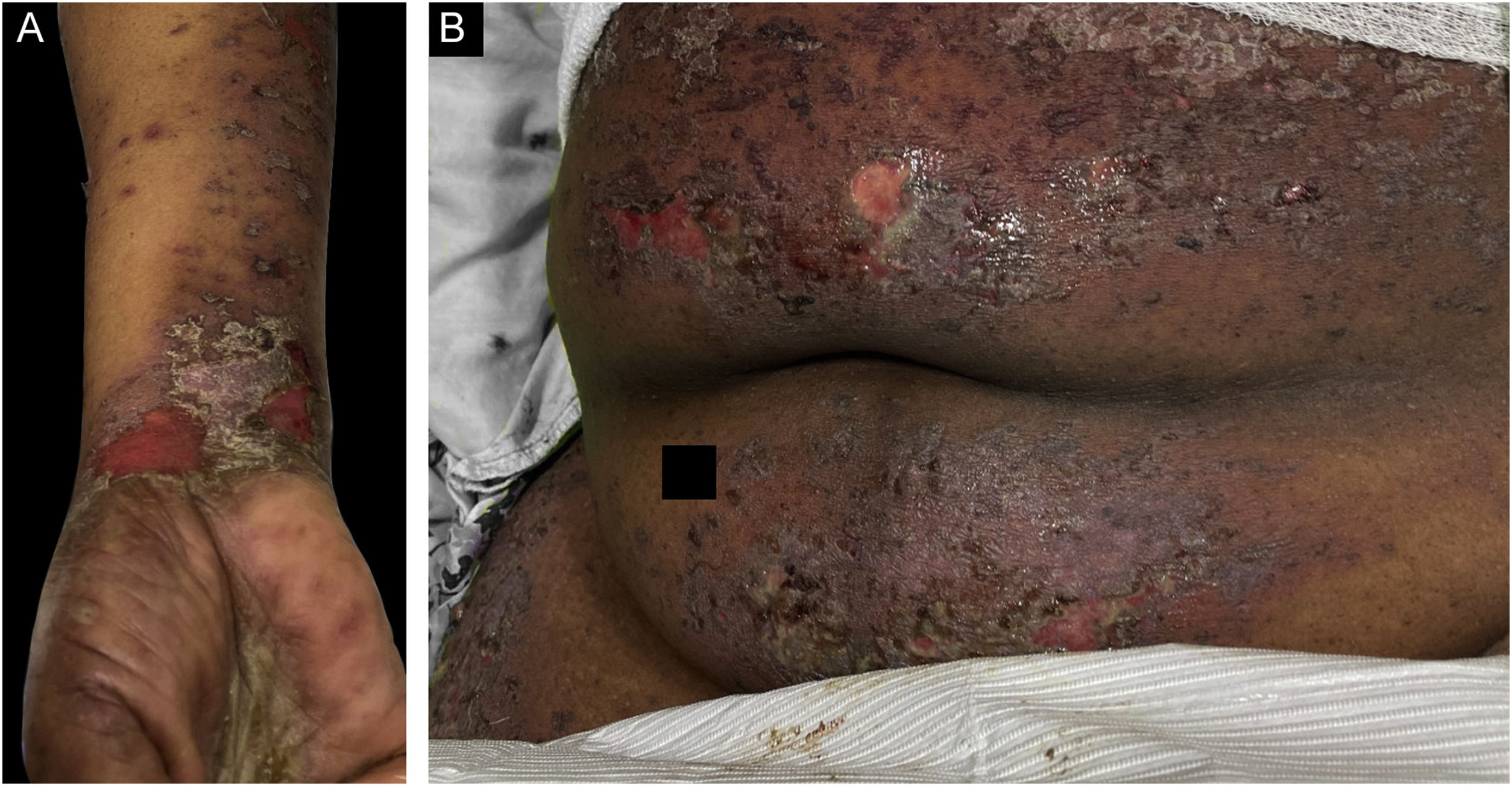
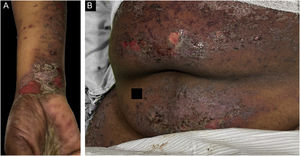
O caso 3 era uma paciente do sexo feminino, de 68 anos, que apresentava história de dois meses de erupção cutânea pruriginosa descamativa. Biópsia realizada em outra instituição no início da erupção cutânea havia revelado infiltrado linfocitário em faixa na derme papilar com alteração vacuolar da camada basal e queratinócitos necróticos, histopatologicamente consistente com líquen plano. Uma semana antes da apresentação na clínica dos autores, a paciente desenvolveu bolhas nas extremidades superiores e no tronco (fig. 3A‐B). A IFD revelou deposição linear de C3 na ZMB sem IgG. A imunofluorescência indireta utilizando a técnica de salt‐split skin foi positiva em padrão linear com IgG no lado epidérmico da clivagem, em título de 1:1280. A paciente foi tratada com compressas de triancinolona, prednisona e imunoglobulina intravenosa com melhora.
Nos três casos foi possível excluir líquen plano tradicional em decorrência dos achados da imunofluorescência. O penfigoide bolhoso tradicional foi excluído em decorrência dos achados liquenoides na histopatologia e clínica. Nenhum dos casos apresentou outras evidências de lúpus eritematoso (LE) ou LE bolhoso.
Doenças autoimunes existem em espectro biológico e muitas vezes nenhum teste isoladamente tem especificidade absoluta. No passado, autores observaram casos que compartilhavam características tanto do líquen plano quanto do penfigoide bolhoso, e denominaram esses casos de LPP.
De acordo com nosso conceito da doença e com a revisão da literatura, enfatizamos as seguintes diretrizes de classificação: 1) lesões liquenoides observadas clínica e histopatologicamente, impossibilitando a classificação como líquen plano ou penfigoide bolhoso clássicos; 2) deposição linear ao longo da ZMB de IgG e/ou C3 em exame de imunofluorescência; 3) ausência de achados para outro diagnóstico específico, como por exemplo lúpus eritematoso.
Notavelmente, essas diretrizes omitem a necessidade de testes auxiliares mais sofisticados, como ensaio de imunossorvente ligado a enzima ou subtipagem de antígeno.
O termo “diretrizes de classificação” foi escolhido na tentativa de fazer um paralelo com outras doenças reumatológicas. Os desafios na classificação estão refletidos na publicação dos critérios de classificação do American College of Rheumatology, com base no reconhecimento de que as doenças reumáticas “tendem a ser heterogêneas em sua apresentação, curso e desfecho, e não têm uma única característica clínica, laboratorial, histopatológica ou radiológica que poderia servir como ‘padrão ouro’…”7
O LPP não é um diagnóstico frequente. Zaraa et al. publicaram a maior revisão de casos.8 Eles conceitualizaram os casos como uma combinação entre líquen plano e penfigoide bolhoso e enfatizaram a importância da correlação clínicopatológica. Hubner et al. também enfatizaram a importância da correlação clínicopatológica cuidadosa, especialmente para excluir outras doenças.1
Ao lidar com casos semelhantes, alguns clínicos podem ter dificuldade na classificação nosológica. No entanto, os autores acreditam que a utilização desses critérios possa ajudar os médicos a fazer o diagnóstico de LPP corretamente.
Suporte financeiroNenhum.
Contribuição dos autoresReed Maggard: Aprovação da versão final do manuscrito; revisão crítica da literatura; revisão crítica do manuscrito; elaboração e redação do manuscrito.
Donna A. Culton: Aprovação da versão final do manuscrito; revisão crítica da literatura; obtenção, análise e interpretação dos dados; participação intelectual e/ou conduta terapêutica de casos estudados; revisão crítica do manuscrito; concepção e planejamento do estudo.
Amy Blake: Aprovação da versão final do manuscrito; participação intelectual e/ou conduta terapêutica de casos estudados; obtenção, análise e interpretação dos dados.
Paul Googe: Aprovação da versão final do manuscrito; obtenção, análise e interpretação dos dados; participação intelectual e/ou conduta terapêutica de casos estudados.
Jayson Miedema: Aprovação da versão final do manuscrito; revisão crítica da literatura; participação intelectual e/ou conduta terapêutica de casos estudados; elaboração e redação do manuscrito; revisão crítica do manuscrito.
Conflito de interessesNenhum.
Como citar este artigo: Maggard R, Culton DA, Blake A, Googe P, Miedema J. What is Lichen planus pemphigoides? A highlight of three cases with discussion of differential diagnosis and suggestion of simple classification guidelines. An Bras Dermatol. 2023;98:379–82.
Trabalho realizado na University of North Carolina at Chapel Hill; Chapel Hill, EUA.