Dados primários do mundo real sobre o tratamento da psoríase são escassos, especialmente no que diz respeito ao papel dos biomarcadores solúveis como preditores de resultados.
ObjetivoFoi avaliada a utilidade das citocinas séricas Th1/Th17 juntamente com as características clínicas como preditores de sobrevida de medicamentos no tratamento da psoríase.
MétodosForam incluídos consecutivamente participantes com psoríase moderada a grave que foram acompanhados por seis anos. Níveis basais de interferon‐α, fator de necrose tumoral‐α e interleucina (IL)‐2, IL‐4, IL‐6, IL‐10 e IL‐17A foram medidos utilizando matriz de esferas citométricas; dados clínicos foram avaliados. Foram calculadas as taxas de risco (HR, do inglês hazard ratios) para a sobrevida de medicamentos usando modelo de risco proporcional de Cox.
ResultadosForam incluídos 262 pacientes, a maioria em uso de imunossupressores sistêmicos ou biológicos. No modelo multivariado, qualidade de vida ruim medida pelo Dermatology Life Quality Index (HR=1,04; IC95% 1,01–1,07; p=0,012) e IL‐6 basal elevada (HR=1,99; IC95% 1,29–3,08; p=0,002) estavam associados à interrupção do tratamento.
Limitações do estudoA principal limitação de qualquer estudo de coorte é a presença de fatores de confusão que não puderam ser detectados na avaliação clínica.
ConclusõesA má qualidade de vida e o nível sérico basal elevado de IL‐6 previram a interrupção do tratamento em pacientes com psoríase moderada a grave. Embora a IL‐6 não seja o mediador mais importante da via inflamatória no ambiente cutâneo, é um biomarcador candidato interessante para prever a resposta ao tratamento da psoríase.
A psoríase é doença crônica que afeta entre 1% e 3% da população global.1,2 A revolução no desenvolvimento de novos medicamentos biológicos e pequenas moléculas é apoiada por ensaios clínicos de alta qualidade.3,4 Esses medicamentos agem por meio do bloqueio modulado de citocinas envolvidas na patogênese da psoríase, reduzindo a ocorrência de eventos adversos e alcançando resultados melhores em comparação aos imunossupressores clássicos.5,6 Como novos medicamentos estão constantemente sendo lançados no mercado, a necessidade de dados direcionados à farmacovigilância de imunossupressores para o tratamento da psoríase está sendo constantemente enfatizada.7,8 O número de registros ativos para monitoramento de eventos adversos ainda é insuficiente.9,10
A psoríase é doença que afeta a pele e outros órgãos por meio de inflamação sistêmica.11‐13 A doença também tem impacto significante na qualidade de vida do paciente.14 Em geral, os dados de farmacovigilância são escassos nos países em desenvolvimento.15 O Sistema Único de Saúde (SUS) brasileiro é responsável pela prestação de cuidados de saúde e assistência farmacêutica a mais de 200 milhões de pessoas;16 portanto, o SUS brasileiro constitui cenário privilegiado para a farmacovigilância.17 O protocolo nacional referente à sequência de medicamentos utilizados na psoríase não é diferente da maioria das recomendações internacionais.18
O objetivo do presente estudo foi avaliar a sobrevida de medicamentos na psoríase moderada a grave, além de avaliar se as citocinas séricas podem ser utilizadas para prever a falha terapêutica na psoríase e a ocorrência de infecção grave.
MétodosDe janeiro de 2016 a dezembro de 2017, foram incluídos consecutivamente pacientes atendidos no Ambulatório de Psoríase do Hospital Universitário de Brasília, Universidade de Brasília, Brasil. Esse principal hospital de referência atende uma área urbana com mais de três milhões de habitantes em Brasília. Essa estratégia garantiu a validação interna das frequências. Avaliações adicionais, incluindo preditores e efeitos de risco, foram implementadas de acordo com estratégia post‐hoc.
Critério de inclusãoForam incluídos pacientes com diagnóstico de psoríase moderada a grave estabelecido por meio de avaliação clínica por dois dermatologistas certificados. Sempre que necessário, foram realizadas biópsias de pele. Foram excluídos pacientes com diagnóstico concomitante de artrite psoriásica ou outras doenças autoimunes.
Avaliação basalTodos os pacientes foram submetidos a avaliação inicial composta por formulário padronizado para informações demográficas, informações sobre o tratamento atual e sobre tratamentos anteriores. De acordo com a literatura atual e a classificação internacional de doenças, os pacientes que apresentavam o padrão mais comum de psoríase em placas, associado ou não a lesões palmoplantares, ungueais ou no couro cabeludo, foram classificados como portadores de psoríase em placa. Os pacientes classificados como psoríase do couro cabeludo, psoríase ungueal, psoríase pustulosa palmoplantar, psoríase gutata e psoríase invertida apresentavam lesões exclusivamente nessas localizações. Os medicamentos utilizados no momento da inclusão foram considerados como os medicamentos basais. O Índice de Área e Gravidade da Psoríase (PASI, Psoriasis Area and Severity Index), a área de superfície corporal (ASC), o Índice de Qualidade de Vida em Dermatologia (DLQI, Dermatology Life Quality Index) e o Índice de Gravidade da Psoríase Ungueal (NAPSI, Nail Psoriasis Severity Index) foram avaliados sempre que possível. Dados retrospectivos sobre medicamentos e histórico de doenças antes da inclusão apresentaram perdas importantes, e essas informações foram retiradas da avaliação dos resultados.
O sangue total foi coletado por venopunção cubital. O soro de cada paciente foi isolado, e Interleucina‐2 (IL‐2), IL‐4, IL‐6, IL‐10, IL‐17A, interferon (IFN)‐γ e fator de necrose tumoral (TNF)‐α foram medidos usando o BD™ Cytometric Bead Array (CBA) Human Th1/Th2/Th17 Cytokine Kit (Becton Dickinson, Franklin Lakes, EUA) com citômetro de fluxo FACSVerse (Becton Dickinson). Todas as análises foram feitas em triplicata, e os valores foram normalizados e comparados com os obtidos de 47 controles saudáveis (média de idade=42 anos e 3 meses, 18 homens e 29 mulheres recrutados na mesma instituição).
Consultas de seguimentoOs pacientes foram acompanhados até dezembro de 2021 (até seis anos) por dermatologista por meio de consulta clínica a cada três a seis meses.
Desfecho primárioA sobrevida do medicamento foi medida de acordo com o tempo de interrupção da medicação basal (mudança ou suspensão). O desfecho primário foi considerado a ocorrência de interrupção do medicamento.10
Desfechos secundáriosComo desfechos secundários, foram consideradas as ocorrências de falha terapêutica ou infecção grave. A falha terapêutica foi definida como a necessidade de modificação do tratamento em decorrência do mau controle da doença (escores PASI, ASC, DLQI e NAPSI acima de 10). Infecção grave foi definida como qualquer infecção que levasse à suspensão do tratamento clínico por mais de um mês. A incidência de desfechos adicionais, como reações adversas, também foi avaliada.
PreditoresAs características basais clínicas e laboratoriais relevantes que foram avaliadas como candidatos a preditores de sobrevida do medicamento incluíram sexo, idade, tabagismo e abuso de álcool, bem como citocinas pró‐inflamatórias (IL‐2, IL‐6, IL‐17A, IFN‐γ TNF‐α) e anti‐inflamatórias (IL‐4, IL‐10). Na linha basal, os pacientes que estavam em uso apenas de biológicos e que nunca haviam utilizado outros medicamentos biológicos foram classificados como “naïve”.
Análise estatísticaOs preditores foram avaliados utilizando testes de log‐rank. A censura de dados foi definida para ocorrer quando os pacientes fossem perdidos no seguimento. As variáveis numéricas não foram categorizadas na análise univariada. Para a análise ajustada, os níveis de citocinas foram categorizados de acordo com o valor mediano da população global ou como positivo/negativo se mais de 30% dos pacientes apresentassem resultados negativos. As demais variáveis numéricas foram categorizadas apenas para geração de gráficos. Os valores de PASI e ASC foram calculados apenas para pacientes com psoríase em placas. Os dados ausentes não foram substituídos, e os pacientes com dados ausentes foram excluídos de análises específicas.
Para o desfecho primário, foi utilizado modelo multivariado ajustado. Preditores que atingiram baixo limiar de evidência (p ≤ 0,100) com base na análise univariada foram incluídos. Foram calculadas as taxas de risco (HRs, do inglês hazard ratios) utilizando modelo de risco proporcional de Cox. Todas as suposições foram cuidadosamente avaliadas. Foram utilizados os pacotes survival e survminer do R Studio (R Studio, Viena, Áustria). Para desfechos secundários, foi utilizada uma estratégia de análise de subgrupo. A comparação gráfica dos níveis de citocinas foi realizada usando GraphPad Prism versão 8.0.0 para Windows (GraphPad Software, San Diego, EUA). A significância estatística foi definida por valor de p<0,05 e um intervalo de confiança de 95% (IC95%) apropriado.
ÉticaO presente estudo foi aprovado pelo Comitê de Ética da Faculdade de Medicina da Universidade de Brasília. Todos os pacientes foram incluídos após a assinatura do termo de consentimento informado.
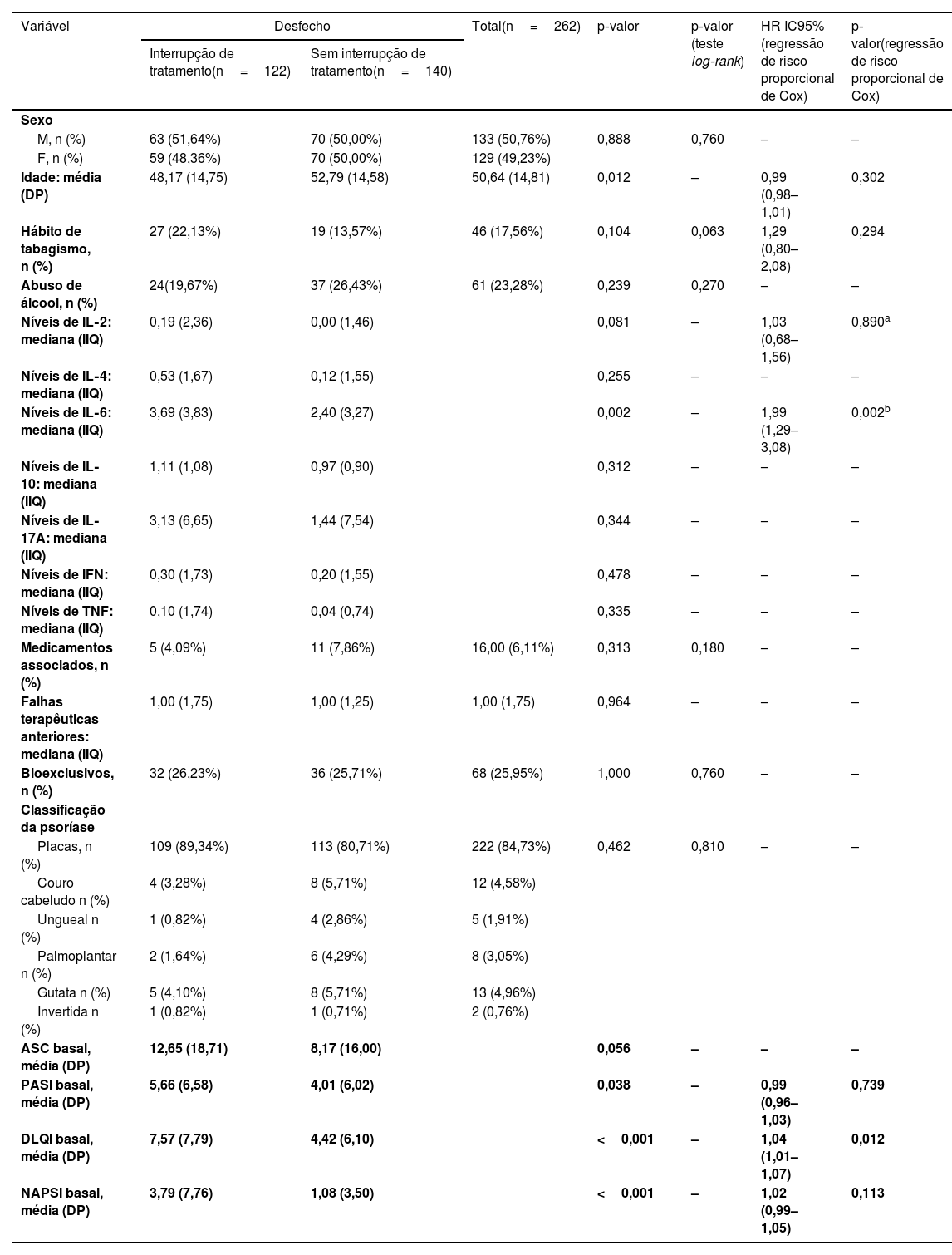
ResultadosForam acompanhados 262 pacientes com psoríase; 133 (50,76%) do sexo masculino e 129 (49,24%) do sexo feminino. A maioria dos pacientes apresentava psoríase em placas (n=222; 84,73%). Também foram incluídos pacientes com psoríase do couro cabeludo (n=12; 4,58%), ungueal (n=5; 1,91%), pustulosa palmoplantar (n=8; 3,05%), gutata (n=13; 4,96%) e psoríase invertida (n=2; 0,76%; tabela 1).
Análise univariada e multivariada para preditores de interrupção de medicamento no tratamento da psoríase
| Variável | Desfecho | Total(n=262) | p‐valor | p‐valor (teste log‐rank) | HR IC95% (regressão de risco proporcional de Cox) | p‐valor(regressão de risco proporcional de Cox) | |
|---|---|---|---|---|---|---|---|
| Interrupção de tratamento(n=122) | Sem interrupção de tratamento(n=140) | ||||||
| Sexo | |||||||
| M, n (%) | 63 (51,64%) | 70 (50,00%) | 133 (50,76%) | 0,888 | 0,760 | – | – |
| F, n (%) | 59 (48,36%) | 70 (50,00%) | 129 (49,23%) | ||||
| Idade: média (DP) | 48,17 (14,75) | 52,79 (14,58) | 50,64 (14,81) | 0,012 | – | 0,99 (0,98–1,01) | 0,302 |
| Hábito de tabagismo, n (%) | 27 (22,13%) | 19 (13,57%) | 46 (17,56%) | 0,104 | 0,063 | 1,29 (0,80–2,08) | 0,294 |
| Abuso de álcool, n (%) | 24(19,67%) | 37 (26,43%) | 61 (23,28%) | 0,239 | 0,270 | – | – |
| Níveis de IL‐2: mediana (IIQ) | 0,19 (2,36) | 0,00 (1,46) | 0,081 | – | 1,03 (0,68–1,56) | 0,890a | |
| Níveis de IL‐4: mediana (IIQ) | 0,53 (1,67) | 0,12 (1,55) | 0,255 | – | – | – | |
| Níveis de IL‐6: mediana (IIQ) | 3,69 (3,83) | 2,40 (3,27) | 0,002 | – | 1,99 (1,29–3,08) | 0,002b | |
| Níveis de IL‐10: mediana (IIQ) | 1,11 (1,08) | 0,97 (0,90) | 0,312 | – | – | – | |
| Níveis de IL‐17A: mediana (IIQ) | 3,13 (6,65) | 1,44 (7,54) | 0,344 | – | – | – | |
| Níveis de IFN: mediana (IIQ) | 0,30 (1,73) | 0,20 (1,55) | 0,478 | – | – | – | |
| Níveis de TNF: mediana (IIQ) | 0,10 (1,74) | 0,04 (0,74) | 0,335 | – | – | – | |
| Medicamentos associados, n (%) | 5 (4,09%) | 11 (7,86%) | 16,00 (6,11%) | 0,313 | 0,180 | – | – |
| Falhas terapêuticas anteriores: mediana (IIQ) | 1,00 (1,75) | 1,00 (1,25) | 1,00 (1,75) | 0,964 | – | – | – |
| Bioexclusivos, n (%) | 32 (26,23%) | 36 (25,71%) | 68 (25,95%) | 1,000 | 0,760 | – | – |
| Classificação da psoríase | |||||||
| Placas, n (%) | 109 (89,34%) | 113 (80,71%) | 222 (84,73%) | 0,462 | 0,810 | – | – |
| Couro cabeludo n (%) | 4 (3,28%) | 8 (5,71%) | 12 (4,58%) | ||||
| Ungueal n (%) | 1 (0,82%) | 4 (2,86%) | 5 (1,91%) | ||||
| Palmoplantar n (%) | 2 (1,64%) | 6 (4,29%) | 8 (3,05%) | ||||
| Gutata n (%) | 5 (4,10%) | 8 (5,71%) | 13 (4,96%) | ||||
| Invertida n (%) | 1 (0,82%) | 1 (0,71%) | 2 (0,76%) | ||||
| ASC basal, média (DP) | 12,65 (18,71) | 8,17 (16,00) | 0,056 | – | – | – | |
| PASI basal, média (DP) | 5,66 (6,58) | 4,01 (6,02) | 0,038 | – | 0,99 (0,96–1,03) | 0,739 | |
| DLQI basal, média (DP) | 7,57 (7,79) | 4,42 (6,10) | <0,001 | – | 1,04 (1,01–1,07) | 0,012 | |
| NAPSI basal, média (DP) | 3,79 (7,76) | 1,08 (3,50) | <0,001 | – | 1,02 (0,99–1,05) | 0,113 | |
ASC, área de superfície corporal; PASI, Psoriasis Area and Severity Index; DLQI, Índice de Qualidade de Vida em Dermatologia.
No presente estudo, 71 (27,10%) pacientes não faziam uso de imunossupressores sistêmicos [nove (3,44%) estavam sem nenhum tratamento, cinco (1,91%) faziam fototerapia isolada, 50 (19,08%) faziam uso de corticoide tópico e sete (2,67%) faziam uso de acitretina]; 96 (36,64%) pacientes utilizavam imunossupressores clássicos [94 (35,88%) utilizavam metotrexato e dois (0,76%) corticoides sistêmicos]; 75 pacientes (28,63%) faziam uso de biológicos anti‐TNF [22 (8,39%) usavam adalimumabe, 29 (11,07%) usavam etanercepte e 24 (9,16%) usavam infliximabe]; e 20 pacientes (7,63%) faziam uso de medicamentos anti‐IL [nove (3,44%) utilizavam ustequinumabe e 11 (4,19%) secuquinumabe].
O tempo médio de seguimento foi de 4,88 anos (intervalo=1‐6 anos). Interrupção da medicação antes do final do tempo de seguimento do estudo foi identificada em 122 (46,56%) pacientes; 88 (33,58%) pacientes tiveram falha terapêutica isolada identificada, e 18 (6,87%) tiveram infecção grave isolada que levou à suspensão do tratamento. Dezesseis pacientes (6,11%) interromperam o tratamento por infecção grave simultânea e falha terapêutica. No total, 34 (12,97%) pacientes apresentaram infecções graves (25 tiveram infecções de vias aéreas superiores não identificadas, oito pacientes tiveram diagnóstico de COVID‐19 e um paciente teve infecção gastrintestinal grave). Além disso, os dados de apenas cinco pacientes foram censurados (considerados perda de seguimento) em decorrência de outros eventos adversos relatados. Esses eventos foram avaliados apenas de maneira descritiva em virtude do baixo número de eventos. Um paciente desenvolveu hidradenite supurativa durante o tratamento com acitretina, dois pacientes apresentaram sinais de neuropatia durante o uso de metotrexato, um paciente apresentou dispneia durante o uso de metotrexato e um paciente apresentou sinais de insuficiência renal inicial durante o uso de infliximabe.
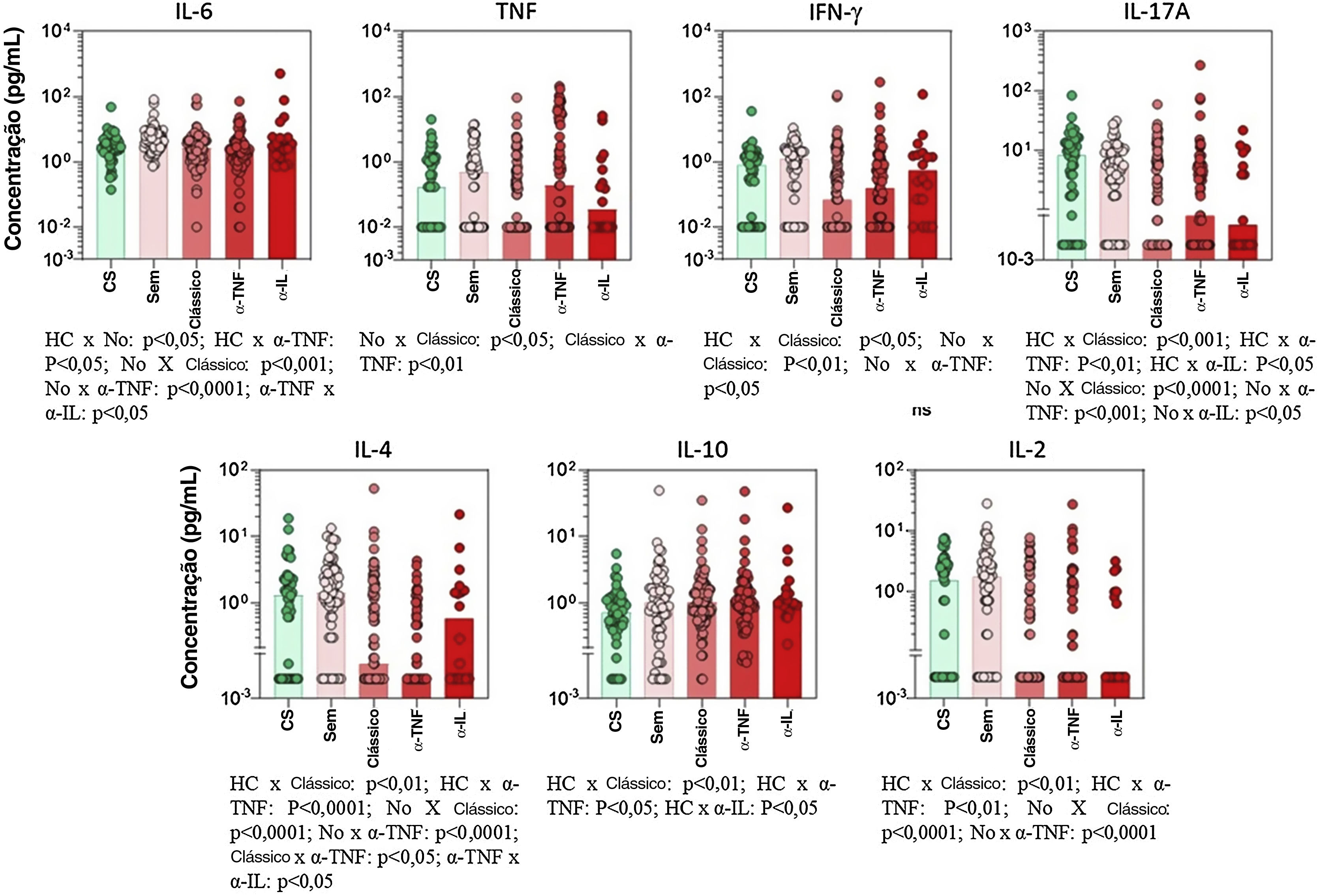
Perfil de citocinasO uso de imunossupressores clássicos, principalmente o metotrexato, foi associado a importante supressão de citocinas pró‐inflamatórias (fig. 1). Para alguns mediadores, como IL‐17 e TNF‐α, o efeito supressor do metotrexato foi ainda maior do que o observado em pacientes em uso de biológicos anti‐TNF ou anti‐IL. Os níveis basais de IL‐6 aumentaram significantemente em pacientes com taxas de sobrevida da medicação mais baixas (fig. 2).
Níveis séricos de citocinas em pacientes com psoríase de acordo com o tipo de terapia imunossupressora basal no momento da inclusão. Os dados são mostrados como distribuição de dispersão de valores individuais em gráficos de barras representando níveis de medianas de cada citocina. IL, interleucina; TNF, fator de necrose tumoral; IFN, interferon; CS, controles saudáveis; Sem, pacientes com psoríase sem uso de imunossupressores sistêmicos; Clássico, pacientes com psoríase em uso de imunossupressores clássicos; α‐TNF, pacientes com psoríase em uso de agentes antifator de necrose tumoral; α‐IL, pacientes com psoríase em uso de agentes anti‐IL. Os valores de p para todos os grupos que apresentaram diferença significante são mostrados na parte inferior de cada gráfico. Valores de p não significantes (> 0,05) não são representados.
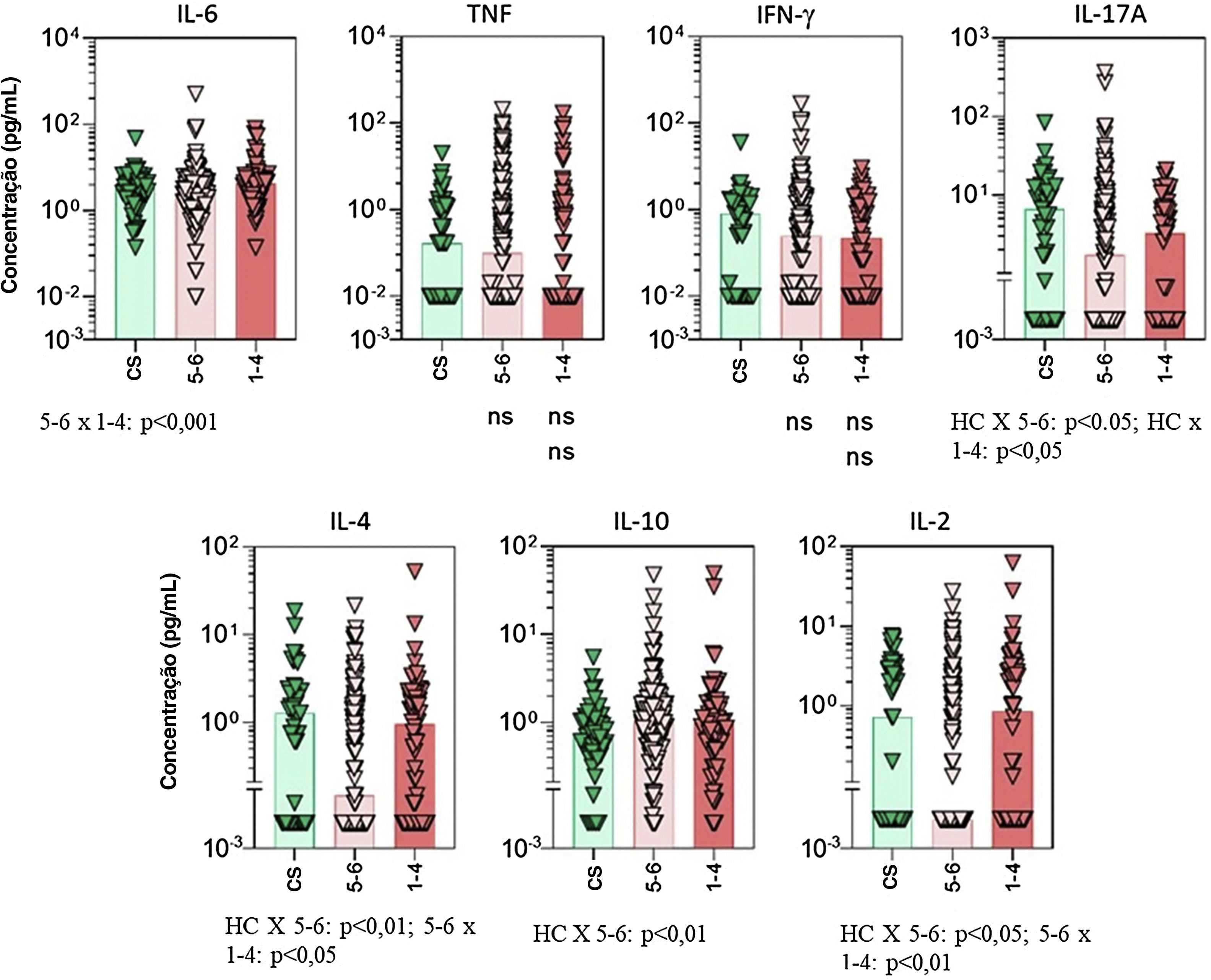
Níveis séricos de citocinas em pacientes com psoríase de acordo com a sobrevida do medicamento estratificada por 1 a 4 anos e 5 a 6 anos. Os dados são mostrados como distribuição de dispersão de valores individuais em gráficos de barras representando níveis médios de cada citocina. IL, interleucina; TNF, fator de necrose tumoral; IFN, interferon; CS, controles saudáveis. Os valores de p para todos os grupos que apresentaram diferença significante são mostrados na parte inferior de cada gráfico. Valores de p não significantes (> 0,05) não são representados.
A análise univariada (tabela 1) mostrou que os valores basais de PASI (p=0,038), DLQI (p<0,001) e NAPSI (p<0,001) foram significantemente maiores nos pacientes que interromperam o tratamento sistêmico. A IL‐6 foi o único marcador inflamatório significantemente elevado nos pacientes que interromperam a medicação basal (p=0,002).
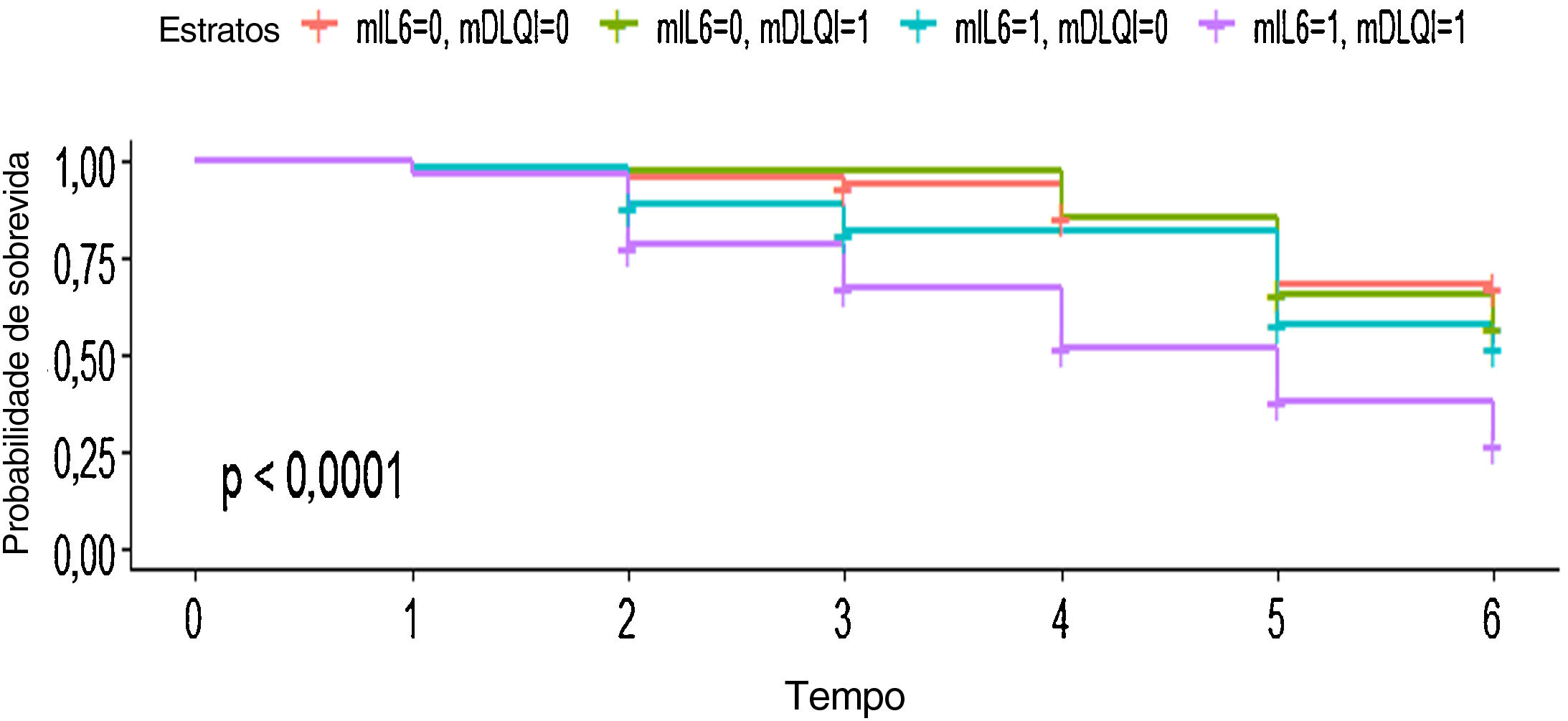
No presente modelo multivariado, foi observado que cada elevação de um ponto no escore de DLQI elevou a chance de mudança de tratamento em 1,04 vezes com IC95% muito estreitos (HR=1,04; IC95% 1,01–1,07; p=0,012). Além disso, pacientes que apresentavam níveis basais de IL‐6 iguais ou acima do valor mediano da população total tiveram chance quase duas vezes maior de interromper o tratamento sistêmico do que pacientes com níveis mais baixos do marcador pró‐inflamatório (HR=1,99; IC95% 1,29–3,08; p=0,002; fig. 3). Informações detalhadas relacionadas à análise de subgrupos podem ser encontradas no Arquivo Suplementar 1 (tabelas A e B).
Curva de sobrevida mostrando o efeito conjunto dos dois principais preditores de interrupção da medicação: a interleucina (IL)‐6 e o Índice de Qualidade de Vida em Dermatologia (DLQI). Pode‐se observar que os pacientes com níveis mais elevados de DLQI e IL‐6 tiveram quase 75% de chance de mudança do tratamento sistêmico no período de seguimento. mIL6, escores medianos de IL‐6da população atual (0=abaixo do valor mediano; 1=acima do valor mediano). mDLQI, escore DLQI da população atual; 0=abaixo de 5; 1=acima ou igual a 5.
A psoríase é doença inflamatória complexa.19 É didático considerar que o início da cascata inflamatória é causado conjuntamente por estímulos de fatores ambientais associados à suscetibilidade genética.20,21 Esses estímulos ativam células apresentadoras de antígenos, macrófagos e células dendríticas para produzir citocinas coordenadoras (TNF, IL‐23, IFN).20 Subsequentemente, a ativação das vias Th1 e Th17 resulta na ativação de citocinas finais, como IL‐17.22 Por fim, queratinócitos inflamados também expressam mediadores inflamatórios.19
A utilidade de medir citocinas no sangue de pacientes com doenças da pele está em debate. Embora a maioria dos estudos destaque os efeitos autócrinos e parácrinos desses mediadores na psoríase, praticamente todas as citocinas envolvidas têm efeito semelhante ao endócrino.23,24 Cataldi et al. descobriram que os mediadores plasmáticos da via Th17 eram significantemente maiores em uma população de 70 pacientes com psoríase do que em um grupo de controle.25
No presente estudo, a elevação de IL‐6 foi o marcador pró‐inflamatório mais consistente para interrupção do tratamento. Embora a IL‐6 seja um mediador pró‐inflamatório, o uso de tocilizumabe, um biológico humanizado recombinante anti‐IL‐6, levou a resultados imprevisíveis na psoríase.26,27 Estudos que avaliaram o ambiente inflamatório da pele não incluíram a expressão da IL‐6 na principal via patogênica da psoríase. Nakajima et al., em 2010, descobriram que a IL‐6 não era crucial para o desenvolvimento de dermatite semelhante à psoríase independente de células T em um modelo murino.28 O mesmo resultado foi encontrado para IL‐17, um dos principais alvos modernos para o tratamento da psoríase, mostrando que o perfil inflamatório humano pode ser imprevisível.28
Curiosamente, em concordância com os achados do presente estudo, dados anteriores que avaliaram populações menores reforçam o papel da IL‐6 circulante na previsão da resposta ao tratamento na psoríase. Zalewska et al. descobriram que os níveis plasmáticos de IL‐6 eram consistentemente elevados em 106 pacientes com psoríase não tratados e que níveis elevados desses mediadores estavam relacionados a uma resposta insatisfatória ao tratamento.29 Além disso, vários estudos relacionaram os níveis de IL‐6 circulante ao perfil de inflamação sistêmica de pacientes com psoríase, incluindo a ocorrência de artrite psoriásica e dislipidemia.30‐37
É possível que a IL‐6 não seja muito importante para desencadear a cascata inflamatória da psoríase no ambiente cutâneo, mas seu efeito supressor nas células T reguladoras pode explicar por que esse mediador é um marcador muito importante para a resposta ao tratamento.38 Além disso, estudos anteriores mostraram que a IL‐6 é um dos mediadores inflamatórios com os efeitos sistêmicos mais importantes.23 A modulação conjunta de IL‐6 e outras citocinas, como a obtida por inibidores de Janus quinase, pode ser estratégia interessante para casos refratários, como demonstrado por ensaios clínicos de fase dois.39
Os medicamentos clássicos, principalmente o metotrexato, foram associados a níveis mais baixos de TNF e IL‐17 (figs. 1 e 2). Considerando que o metotrexato é clinicamente menos eficaz do que os biológicos, levantou‐se a hipótese de que uma supressão intensa dos dois principais mediadores da psoríase não está diretamente correlacionada com as respostas ao tratamento. Por outro lado, pacientes que respondem ao metotrexato podem apresentar quadros mais leves de psoríase e, consequentemente, níveis mais baixos de TNF e IL‐17. Infelizmente, no presente estudo não foram medidas as citocinas inflamatórias em diferentes momentos. A avaliação seriada de longo prazo desses marcadores pode oferecer melhores pistas para à patogênese da psoríase.
Além disso, no presente estudo, escores ruins de marcadores clínicos tradicionais, incluindo PASI, DLQI e NAPSI, foram significantemente relacionados à redução da sobrevida do medicamento. Esse resultado era esperado, uma vez que esses parâmetros são preditores internacionalmente reconhecidos de troca de medicamentos. O índice de qualidade de vida (DLQI) teve a maior influência na sobrevida medicamentosa entre os escores clínicos avaliados. A principal limitação de qualquer estudo de coorte é a presença de fatores de confusão que não podem ser tratados por randomização. Entretanto, os resultados de IL‐6 foram consistentes na análise laboratorial, na análise univariada e no modelo multivariado. Esse resultado também representa uma reprodução de estudos anteriores em populações menores.31 Além disso, o objetivo do presente estudo foi apenas medir os níveis basais de citocinas como marcadores de longo prazo para a gravidade da psoríase. Múltiplas medidas em diferentes momentos podem ajudar a elucidar o papel dos marcadores séricos na evolução da psoríase e seu tratamento.
ConclusãoO presente estudo mostrou que a qualidade de vida reduzida e os níveis séricos elevados de IL‐6 foram preditores da baixa sobrevida de medicamento em pacientes com psoríase moderada a grave. Também pode‐se concluir que, embora a IL‐6 não seja o mediador mais importante da via inflamatória no ambiente cutâneo, é um biomarcador candidato interessante para predizer a resposta sistêmica ao tratamento da psoríase.
Suporte financeiroA pesquisa recebeu suporte financeiro da Fundação de Apoio à Pesquisa do Distrito Federal (FAP‐DF); Números de concessão: FINATEC 7044 e 7155; e da Fundação La Roche Posay.
Contribuição dos autoresNatália Ribeiro de Magalhães Alves: Investigação, redação – rascunho original, redação – revisão e edição.
Patrícia Shu Kurizky: Investigação, redação – rascunho original, redação – revisão e edição, administração do projeto, supervisão.
Licia Maria Henrique da Mota: Investigação, redação – revisão e edição, supervisão.
Cleandro Pires de Albuquerque: Investigação, redação – revisão e edição.
Juliana Tomaz Esper: Investigação.
Aridne Souza Costa Campos: Investigação.
Vitória Pereira Reis: Investigação.
Henrique Metzker Ferro: Investigação.
Natalia Gil‐Jaramillo: Investigação.
Joaquim Pedro Brito‐de‐Sousa: Investigação.
Luana Cabral Leão Leal: Investigação.
Otávio de Toledo Nóbrega: Investigação, redação – revisão e edição, supervisão.
Carla Nunes de Araújo: Investigação, redação – rascunho original, supervisão.
Agenor de Castro Moreira dos Santos Júnior: Investigação, redação – rascunho original.
Gladys Aires Martins: Investigação, supervisão.
Olindo Assis Martins Filho: Investigação, redação – rascunho original, redação – revisão e edição, supervisão.
Ciro Martins Gomes: Investigação, redação – revisão e edição, administração do projeto, obtenção de financiamento.
Conflito de interessesNenhum.
Os autores agradecem a todos os funcionários da Universidade de Brasília pelo apoio incondicional à equipe de pesquisa.
Como citar este artigo: Alves NR, Kurizky PS, da Mota LM, de Albuquerque CP, Esper JT, Campos AS, et al. Elevated serum IL‐6 levels predict treatment interruption in patients with moderate to severe psoriasis: a 6‐year real‐world cohort study. An Bras Dermatol. 2024;99:34–42.
Trabalho realizado no Serviço de Dermatologia, Hospital Universitário de Brasília, Brasília, DF, Brasil; Instituto René Rachou, Fundação Oswaldo Cruz, Fiocruz Minas, Belo Horizonte, MG, Brasil.