Investigar a associação entre vitiligo e síndrome metabólica (SM).
MétodosEstudo transversal prospectivo realizado entre 2014 e 2016. Os grupos estudo (n=155) e controle (n=155) foram avaliados quanto à SM de acordo com os critérios do Painel de Tratamento do Adulto III do Programa Nacional de Educação sobre Colesterol (NCEP‐ATP III) e os critérios da Federação Internacional de Diabetes (IDF). O grupo de estudo foi subdividido em três grupos, de acordo com o índice de área comprometida pelo vitiligo e os valores do índice de atividade da doença vitiligo (Grupo 1: 6,89 para índice de área comprometida pelo vitiligo, Grupo A: –1–0, Grupo B: 1–2 e Grupo C: 3‐4 para índice de atividade da doença vitiligo, respectivamente). As taxas de SM de acordo com ambos os critérios foram comparadas entre os grupos de índice de atividade da doença vitiligo e de índice de área comprometida pelo vitiligo.
ResultadosAs taxas de SM foram de 37,4% e 40% no grupo de estudo e 19,4% e 26,5% no grupo controle, de acordo com os critérios NCEP‐ATPIII e IDF, respectivamente (p<001 e p=0,011). A SM foi mais frequentemente observada nos grupos 2 de 3 de índice de área comprometida pelo vitiligo em comparação com grupo 1, bem como no grupo C de índice de atividade da doença vitiligo em comparação com os grupos A e B.
Limitações do estudoExperiência em um único centro, ausência de marcadores de estresse oxidativo mais específicos e falta de seguimento de longo prazo dos pacientes.
ConclusõesA frequência de SM foi maior em pacientes com vitiligo não segmentar e a taxa foi maior na forma ativa/grave da doença.
O vitiligo é distúrbio adquirido e progressivo da pigmentação, caracterizado pelo desenvolvimento de máculas brancas bem definidas na pele.1 É a causa mais frequente de despigmentação, com prevalência estimada de 0,1 a 2% em adultos e crianças.2 Homens e mulheres são afetados igualmente, sem diferenças étnicas, raciais ou socioeconômicas relevantes.3 O vitiligo pode ocorrer em qualquer faixa etária, desde a primeira infância até o fim da idade adulta; observa‐se um pico de incidência na segunda e terceira décadas de vida.4
Embora muitas teorias sobre a etiologia do vitiligo tenham sido propostas, a causa exata ainda é desconhecida. Predisposição genética, autoimunidade, substâncias bioquímicas, infecção viral, autodestruição de melanócitos, estresse oxidativo, destruição de células neurais e melanocitorragia são as hipóteses mais comuns apresentadas na literatura.5 O curso clínico do vitiligo é variado: as lesões podem permanecer estáveis ou progredir lentamente por anos.1 O índice de área comprometida pelo vitiligo (vitiligo area severity index [VASI]) e o índice de atividade da doença vitiligo (vitiligo disease activity score [VIDA]) podem ser usados para a avaliação da gravidade e atividade da doença.6 Apesar de não haver cura para o vitiligo, existem algumas modalidades de tratamento que podem interromper a progressão das lesões e induzir graus variados de repigmentação. Deve ser implantada uma abordagem individualizada com base na idade do paciente, tipo de pele, extensão, localização e grau de atividade da doença, bem como do impacto do vitiligo na qualidade de vida.7
A síndrome metabólica (SM) é problema de saúde alarmante que afeta aproximadamente um quarto da população adulta mundial.8 A presença de SM aumenta de maneira proeminente o risco de diabetes tipo 2 e doenças cardiovasculares que levam a complicações graves, como infarto do miocárdio, acidente vascular cerebral e morte.9 Por outro lado, é notável o aumento dramático de doenças autoimunes nos países ocidentais após o surto de obesidade.10 Além disso, a SM é considerada um estado inflamatório crônico de baixa intensidade, que pode resultar em níveis aumentados de mediadores pró‐inflamatórios, como fator de necrose tumoral alfa (TNF??), interleucina‐1 (IL‐1), interleucina‐6 (IL‐6), inibidor do ativador plasminogênico‐1 (PAI‐1) e proteína C reativa (PCR).9 Assim, a relação entre SM e doenças autoimunes tem sido investigada em muitos estudos.10 A literatura também apresenta publicações que investigaram a associação entre SM e doenças dermatológicas como vitiligo e psoríase.11–17 Além disso, o papel do metabolismo da vitamina B12 no vitiligo foi avaliado em alguns estudos.18–20
O presente estudo teve como objetivo investigar a associação entre vitiligo e SM.
MétodosInscrição de pacientes e controlesEstudo transversal prospectivo, conduzido no Departamento de Dermatologia e Venereologia da Universidade de Hacettepe entre outubro de 2014 e março de 2016. Foram incluídos no estudo 310 participantes (n=155 no grupo de estudo e n=155 no grupo controle). Os critérios de inclusão para o grupo de estudo foram: 1) Pacientes com diagnóstico de vitiligo 2) ≥ 18 anos. O grupo controle foi constituído por 155 indivíduos pareados por sexo e idade internados na clínica de dermatologia por outras queixas que não doenças inflamatórias da pele. Os critérios de exclusão foram: 1) presença de gravidez ou lactação; 2) pacientes que usaram medicamentos que podem afetar a situação metabólica (como esteroides sistêmicos ou ciclosporina). O estudo foi aprovado pelo comitê de ética da Universidade Hacettepe (GO 14/338‐03) e todos os pacientes assinaram o termo de consentimento livre e esclarecido.
Investigação para SMOs grupos de estudo e controle foram avaliados quanto aos critérios de SM. Idade média, sexo, frequência de fatores de risco para SM (presença de diabetes melito, tireoidite de Hashimoto, hipertensão, hiperlipidemia, obesidade, taxa de tabagismo e consumo de álcool), resultados de exames laboratoriais (níveis de glicemia plasmática em jejum [FPG], lipoproteína de alta densidade [HDL], lipoproteína de baixa densidade [LDL], colesterol total, triglicerídeos [TG], PCR e vitamina B12), taxas de deficiência/reposição de vitamina B12 (porcentagem de pacientes com níveis de vitamina B12 inferiores aos intervalos de referência e/ou em reposição de vitamina B12 durante o período do estudo), pressão arterial, circunferência da cintura e o índice de massa corporal (IMC) foram comparados entre os grupos. Os pacientes com vitiligo também foram avaliados quanto à frequência dos subtipos de vitiligo e duração média da doença. Além dos fatores de risco mencionados, os resultados dos exames laboratoriais e critérios de SM foram comparados entre os subtipos de vitiligo (vitiligo segmentar e não segmentar). Amostras de sangue venoso foram coletadas dos participantes após 12 horas de jejum.
Pacientes com valores de IMC ≥ 30kg/m2 foram classificados como obesos. A SM foi definida como a presença de três das cinco características a seguir: 1) circunferência da cintura ≥ 102cm em homens e ≥ 88cm em mulheres; 2) TG sérico ≥ 150mg/dL ou tratamento medicamentoso para TG elevado; 3) HDL sérico<40mg/dL em homens e<50mg/dL em mulheres ou tratamento medicamentoso para HDL reduzido; 4) Pressão arterial ≥ 130/85mmHg ou tratamento medicamentoso para pressão arterial elevada; 5) FPG ≥ 100mg/dL ou tratamento medicamentoso para glicemia elevada, de acordo com o Painel de Tratamento do Adulto III do Programa Nacional de Educação sobre Colesterol de 2004 (National Cholesterol Education Program Adult Treatment Panel III [NCEP‐ATP III]).21 No entanto, a Federação Internacional de Diabetes (International Diabetes Federation [IDF]) usa a circunferência da cintura como um elemento essencial na definição, com diferentes limites estabelecidos para diferentes grupos étnicos.22 No presente estudo, ambos os critérios foram usados para que fosse possível comparar objetivamente os resultados aqui observados com o descrito em vários estudos da literatura. O diagnóstico de vitiligo foi feito por dermatologistas com base nos achados clínicos. Os índices VASI e VIDA foram usados para a avaliação da gravidade e atividade da doença.6 Além disso, os pacientes com vitiligo foram divididos em três subgrupos, de acordo com os valores do índice VASI. Primeiramente, os índices VASI foram calculados para todos os 155 pacientes do grupo de estudo. Em seguida, esses índices foram ordenados de forma crescente e, subsequentemente, foram divididos em três subgrupos, de acordo com o número de pacientes em cada subgrupo (subgrupo 1=52, subgrupo 2=52 e subgrupo 3=51). O primeiro subgrupo incluiu pacientes com índice VASI<1,94, o segundo subgrupo, pacientes com índice VASI entre 1,94 e 6,89 e o terceiro subgrupo, pacientes com índice VASI >6,89. Além disso, o grupo de estudo foi dividido em três subgrupos de acordo com os valores do índice VIDA (Grupo A: ‐1–0, Grupo B: 1–2 e Grupo C: 3–4). As taxas de SM de acordo com os critérios NCEP‐ATP III e IDF foram comparadas entre os grupos VIDA e VASI. Os índices VASI e VIDA também foram comparados por subtipo de vitiligo. Além disso, os valores médios de PCR foram comparados entre os grupos do índice VIDA. Por fim, também foram comparadas as taxas de SM entre os grupos de estudo e controle, após exclusão dos pacientes com obesidade, diabetes melito, tireoidite de Hashimoto, deficiência de vitamina B12 e consumo de álcool.
Análise estatísticaAs análises estatísticas foram feitas com o programa SPSS (IBM SPSS Statistics for Windows, versão 22.0. Armonk, NY: IBM Corp.). O teste de Kolmogorov‐Smirnov foi usado para avaliar a distribuição normal dos dados. Os dados normalmente distribuídos foram apresentados como média e desvio‐padrão, enquanto os dados não paramétricos foram apresentados como mediana (intervalo). O teste t para amostras independentes e o teste U de Mann‐Whitney foram usados para comparar as variáveis paramétricas e não paramétricas entre os grupos, respectivamente. As variáveis categóricas foram comparadas pelo teste do qui‐quadrado. Um valor‐p<0,05 foi considerado estatisticamente significativo.
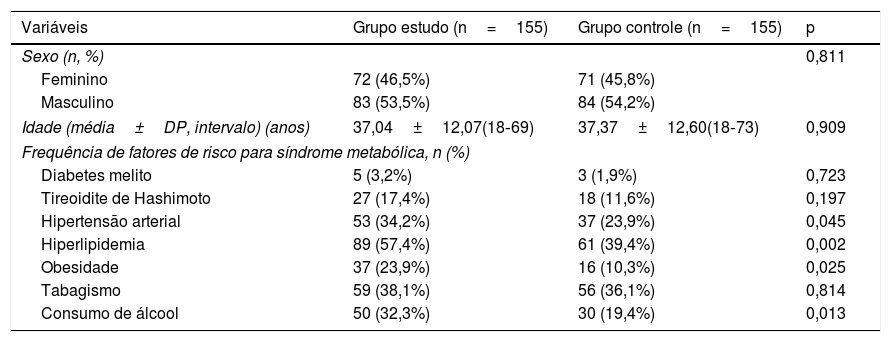
ResultadosCaracterísticas demográficas e clínicasAs características demográficas e clínicas dos grupos de estudo e controle foram mostradas na tabela 1. Não foi observada diferença estatisticamente significativa entre os grupos quanto a gênero, idade média, diabetes melito, tireoidite de Hashimoto e tabagismo (p=0,811, 0,909, 0,723, 0,197 e 0,814, respectivamente). Já as taxas de hipertensão, hiperlipidemia, obesidade e consumo de álcool foram estatisticamente diferentes entre os grupos (p=0,045, 0,002, 0,025 e 0,013, respectivamente). Pacientes com vitiligo apresentaram maiores taxas de hipertensão (34,2% vs. 23,9%), hiperlipidemia (57,4% vs. 39,4%), obesidade (23,9% vs. 10,3%) e consumo de álcool (32,3% vs. 19,4%) em comparação ao grupo de controle.
Características demográficas e clínicas dos pacientes dos grupos estudo e controle
| Variáveis | Grupo estudo (n=155) | Grupo controle (n=155) | p |
|---|---|---|---|
| Sexo (n, %) | 0,811 | ||
| Feminino | 72 (46,5%) | 71 (45,8%) | |
| Masculino | 83 (53,5%) | 84 (54,2%) | |
| Idade (média±DP, intervalo) (anos) | 37,04±12,07(18‐69) | 37,37±12,60(18‐73) | 0,909 |
| Frequência de fatores de risco para síndrome metabólica, n (%) | |||
| Diabetes melito | 5 (3,2%) | 3 (1,9%) | 0,723 |
| Tireoidite de Hashimoto | 27 (17,4%) | 18 (11,6%) | 0,197 |
| Hipertensão arterial | 53 (34,2%) | 37 (23,9%) | 0,045 |
| Hiperlipidemia | 89 (57,4%) | 61 (39,4%) | 0,002 |
| Obesidade | 37 (23,9%) | 16 (10,3%) | 0,025 |
| Tabagismo | 59 (38,1%) | 56 (36,1%) | 0,814 |
| Consumo de álcool | 50 (32,3%) | 30 (19,4%) | 0,013 |
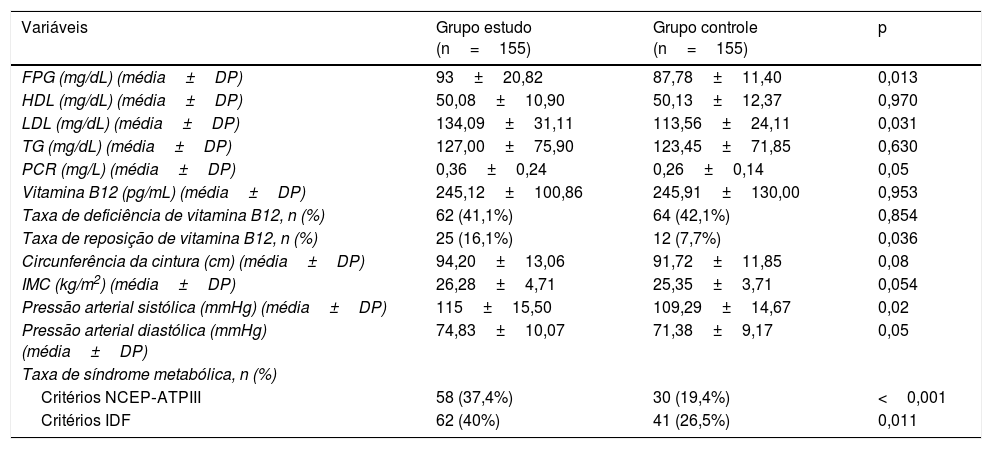
A tabela 2 apresenta a comparação dos resultados dos exames laboratoriais, circunferência da cintura, IMC, pressão arterial e taxas de SM entre os grupos estudo e controle. Não foi observada diferença estatisticamente significativa entre os grupos quanto aos valores médios de HDL, TG, vitamina B12, circunferência da cintura e IMC (p=0,970, 0,630, 0,953, 0,08 e 0,054, respectivamente). No entanto, foram observadas diferenças estatisticamente significativas entre os grupos quanto aos valores médios de FPG, LDL, PCR, pressão arterial sistólica (PAS) e pressão arterial diastólica (PAD; p=0,013, 0,031, 0,05, 0,02 e 0,05, respectivamente). O grupo de estudo apresentou maior FPG (93 ±20,82 vs. 87,78 ±11,40), colesterol LDL (134,09±31,11 vs. 113,56±24,11), PCR (0,36±0,24 vs. 0,26±0,14), PAS (115±15,50 vs. 109,29±14,67) e PAD (74,83±10,07 vs. 71,38±9,17) quando comparados ao grupo controle. Além disso, as taxas de deficiência de vitamina B12 foram semelhantes entre os grupos (41,1% vs. 42,1%, p=0,854). Já as taxas de terapia de reposição de vitamina B12 e SM (de acordo com NCEP‐ATPIII e IDF) foram significativamente diferentes entre os grupos. A taxa de terapia de reposição de vitamina B12 foi de 16,1% no grupo de estudo e 7,7% no grupo de controle (p=0,036). A taxa de SM foi de 37,4% no grupo de estudo e 19,4% no grupo de controle, de acordo com os critérios do NCEP‐ATPIII (p <001). Além disso, a taxa de SM foi de 40% no grupo de estudo e 26,5% no grupo de controle de acordo com os critérios da IDF (p=0,011).
Comparação dos resultados dos exames laboratoriais, circunferência da cintura, IMC, pressão arterial e taxas de síndrome metabólica entre os grupos estudo e controle
| Variáveis | Grupo estudo (n=155) | Grupo controle (n=155) | p |
|---|---|---|---|
| FPG (mg/dL) (média±DP) | 93±20,82 | 87,78±11,40 | 0,013 |
| HDL (mg/dL) (média±DP) | 50,08±10,90 | 50,13±12,37 | 0,970 |
| LDL (mg/dL) (média±DP) | 134,09±31,11 | 113,56±24,11 | 0,031 |
| TG (mg/dL) (média±DP) | 127,00±75,90 | 123,45±71,85 | 0,630 |
| PCR (mg/L) (média±DP) | 0,36±0,24 | 0,26±0,14 | 0,05 |
| Vitamina B12 (pg/mL) (média±DP) | 245,12±100,86 | 245,91±130,00 | 0,953 |
| Taxa de deficiência de vitamina B12, n (%) | 62 (41,1%) | 64 (42,1%) | 0,854 |
| Taxa de reposição de vitamina B12, n (%) | 25 (16,1%) | 12 (7,7%) | 0,036 |
| Circunferência da cintura (cm) (média±DP) | 94,20±13,06 | 91,72±11,85 | 0,08 |
| IMC (kg/m2) (média±DP) | 26,28±4,71 | 25,35±3,71 | 0,054 |
| Pressão arterial sistólica (mmHg) (média±DP) | 115±15,50 | 109,29±14,67 | 0,02 |
| Pressão arterial diastólica (mmHg) (média±DP) | 74,83±10,07 | 71,38±9,17 | 0,05 |
| Taxa de síndrome metabólica, n (%) | |||
| Critérios NCEP‐ATPIII | 58 (37,4%) | 30 (19,4%) | <0,001 |
| Critérios IDF | 62 (40%) | 41 (26,5%) | 0,011 |
FPG, glicose plasmática em jejum; HDL, lipoproteína de alta densidade; IDF, Federação Internacional de Diabetes; IMC, índice de massa corporal; LDL, lipoproteína de baixa densidade; NCEP‐ATPIII, Painel de Tratamento do Adulto III do Programa Nacional de Educação sobre Colesterol; PCR, proteína C reativa; TG, triglicerídeos.
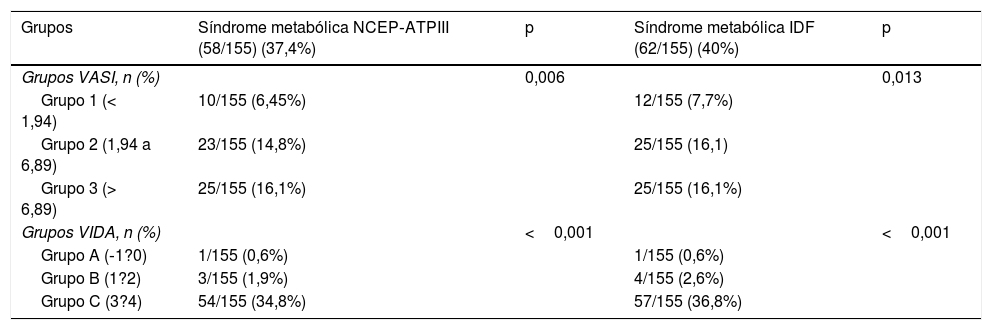
No presente estudo, o vitiligo não segmentar foi o subtipo mais frequente, observado em 144 pacientes (92,9%). Vitiligo segmentar foi observado nos 11 pacientes restantes (7,1%). A duração média do vitiligo foi de 121,20±115,04 meses. Além disso, o índice VASI médio foi de 4,054±5,54 (0,093 a 43,3) e a mediana do índice VIDA foi de 3 (‐1 a 4). A tabela 3 apresenta as taxas de SM para os grupos VASI e VIDA de acordo com os critérios NCEP‐ATPIII e IDF. Ao comparar os grupos de pacientes com vitiligo de acordo com o índice VASI em termos de taxas de SM (com ambos os critérios, NCEP‐ATPIII e IDF), foi observada uma diferença estatisticamente significativa entre os grupos (p=0,006 para os critérios NCEP‐ATPIII e p=0,013 para os critérios IDF). Com ambos os critérios, a SM foi mais frequente nos grupos 2 e 3 do que no grupo 1 (6,45%, 14,8% e 16,1% de acordo com os critérios do NCEP‐ATPIII, 7,7%, 16,1% e 16,1% de acordo com os critérios da IDF para os grupos 1, 2 e 3, respectivamente). Da mesma forma, foi observada uma diferença estatisticamente significativa entre os grupos de acordo com os índices VIDA (p <0,001 para ambos os critérios). As taxas de SM foram mais frequentes no grupo C do que nos grupos A e B de acordo com os dois critérios usados (0,6%, 1,9% e 34,8% de acordo com os critérios do NCEP‐ATPIII e 0,6%, 2,6% e 36,8% de acordo com os critérios da IDF). Além disso, os valores médios de PCR foram significativamente diferentes entre os grupos VIDA (p=0,006). O valor médio da PCR no grupo C foi superior aos valores médios nos grupos A e B (0,20±0,08, 0,22±0,07 e 0,48±0,26 para os grupos A, B e C, respectivamente). A tabela 4 apresenta as taxas de SM segundo os critérios NCEP‐ATPIII e IDF entre os grupos de estudo e controle após a exclusão dos pacientes com obesidade, diabetes melito, tireoidite de Hashimoto, deficiência de vitamina B12 e consumo de álcool. De acordo com os dois critérios, a SM foi estatisticamente significativamente mais frequente no grupo de estudo do que no grupo controle (39,5% vs. 8,7% para os critérios NCEP‐ATPIII e 40,7% vs. 15,6% para os critérios de IDF, respectivamente; p <0,001 para ambos os critérios).
Taxas de síndrome metabólica para os grupos VASI e VIDA de acordo com os critérios NCEP‐ATPIII e IDF
| Grupos | Síndrome metabólica NCEP‐ATPIII (58/155) (37,4%) | p | Síndrome metabólica IDF (62/155) (40%) | p |
|---|---|---|---|---|
| Grupos VASI, n (%) | 0,006 | 0,013 | ||
| Grupo 1 (< 1,94) | 10/155 (6,45%) | 12/155 (7,7%) | ||
| Grupo 2 (1,94 a 6,89) | 23/155 (14,8%) | 25/155 (16,1) | ||
| Grupo 3 (> 6,89) | 25/155 (16,1%) | 25/155 (16,1%) | ||
| Grupos VIDA, n (%) | <0,001 | <0,001 | ||
| Grupo A (‐1?0) | 1/155 (0,6%) | 1/155 (0,6%) | ||
| Grupo B (1?2) | 3/155 (1,9%) | 4/155 (2,6%) | ||
| Grupo C (3?4) | 54/155 (34,8%) | 57/155 (36,8%) | ||
IDF, Federação Internacional de Diabetes; NCEP‐ATPIII, Painel de Tratamento do Adulto III do Programa Nacional de Educação sobre Colesterol; VASI, índice da área acometida pelo vitiligo; VIDA, índice de atividade da doença vitiligo.
Taxas de síndrome metabólica segundo os critérios NCEP‐ATPIII e IDF entre os grupos de estudo e controle após a exclusão dos pacientes com obesidade, diabetes melito, tireoidite de Hashimoto, deficiência de vitamina B12 e consumo de álcool
| Grupo | Síndrome metabólica NCEP‐ATPIII | Síndrome metabólica IDF | p |
|---|---|---|---|
| Grupo Estudo, n (%) | 34/86 (39,5%) | 35/86 (40,7%) | p <0,001 |
| Grupo Controle, n (%) | 10/115 (8,7%) | 18/115 (15,6%) | p <0,001 |
IDF, Federação Internacional de Diabetes; NCEP‐ATPIII, Painel de Tratamento do Adulto III do Programa Nacional de Educação sobre Colesterol.
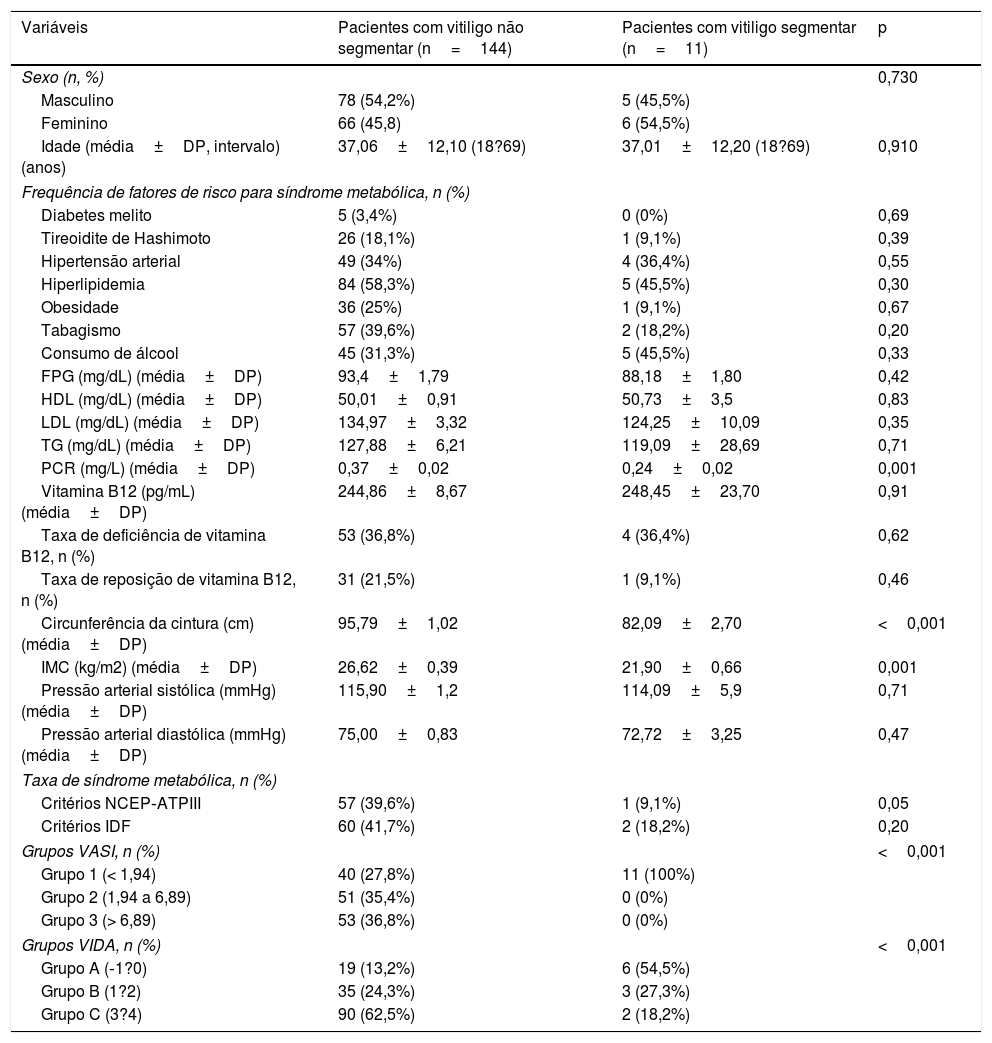
A tabela 5 apresenta a comparação das características demográficas, clínicas, exames laboratoriais, componentes da SM e os índices VASI e VIDA entre os pacientes com vitiligo segmentar e não segmentar. A maioria dos parâmetros era comparável entre os pacientes. No entanto, foram observados valores significativamente mais altos de PCR, circunferência da cintura, IMC, taxa de obesidade segundo os critérios NCEP‐ATPIII e índices VASI e VIDA nos pacientes com vitiligo não segmentar (0,001, <0,001, 0,001, 0,05, <0,001 e <0,001, respectivamente).
Comparação de características demográficas, características clínicas, exames laboratoriais, componentes da síndrome metabólica e índices VASI e VIDA entre pacientes com vitiligo segmentar e não segmentar
| Variáveis | Pacientes com vitiligo não segmentar (n=144) | Pacientes com vitiligo segmentar (n=11) | p |
|---|---|---|---|
| Sexo (n, %) | 0,730 | ||
| Masculino | 78 (54,2%) | 5 (45,5%) | |
| Feminino | 66 (45,8) | 6 (54,5%) | |
| Idade (média±DP, intervalo) (anos) | 37,06±12,10 (18?69) | 37,01±12,20 (18?69) | 0,910 |
| Frequência de fatores de risco para síndrome metabólica, n (%) | |||
| Diabetes melito | 5 (3,4%) | 0 (0%) | 0,69 |
| Tireoidite de Hashimoto | 26 (18,1%) | 1 (9,1%) | 0,39 |
| Hipertensão arterial | 49 (34%) | 4 (36,4%) | 0,55 |
| Hiperlipidemia | 84 (58,3%) | 5 (45,5%) | 0,30 |
| Obesidade | 36 (25%) | 1 (9,1%) | 0,67 |
| Tabagismo | 57 (39,6%) | 2 (18,2%) | 0,20 |
| Consumo de álcool | 45 (31,3%) | 5 (45,5%) | 0,33 |
| FPG (mg/dL) (média±DP) | 93,4±1,79 | 88,18±1,80 | 0,42 |
| HDL (mg/dL) (média±DP) | 50,01±0,91 | 50,73±3,5 | 0,83 |
| LDL (mg/dL) (média±DP) | 134,97±3,32 | 124,25±10,09 | 0,35 |
| TG (mg/dL) (média±DP) | 127,88±6,21 | 119,09±28,69 | 0,71 |
| PCR (mg/L) (média±DP) | 0,37±0,02 | 0,24±0,02 | 0,001 |
| Vitamina B12 (pg/mL) (média±DP) | 244,86±8,67 | 248,45±23,70 | 0,91 |
| Taxa de deficiência de vitamina B12, n (%) | 53 (36,8%) | 4 (36,4%) | 0,62 |
| Taxa de reposição de vitamina B12, n (%) | 31 (21,5%) | 1 (9,1%) | 0,46 |
| Circunferência da cintura (cm) (média±DP) | 95,79±1,02 | 82,09±2,70 | <0,001 |
| IMC (kg/m2) (média±DP) | 26,62±0,39 | 21,90±0,66 | 0,001 |
| Pressão arterial sistólica (mmHg) (média±DP) | 115,90±1,2 | 114,09±5,9 | 0,71 |
| Pressão arterial diastólica (mmHg) (média±DP) | 75,00±0,83 | 72,72±3,25 | 0,47 |
| Taxa de síndrome metabólica, n (%) | |||
| Critérios NCEP‐ATPIII | 57 (39,6%) | 1 (9,1%) | 0,05 |
| Critérios IDF | 60 (41,7%) | 2 (18,2%) | 0,20 |
| Grupos VASI, n (%) | <0,001 | ||
| Grupo 1 (< 1,94) | 40 (27,8%) | 11 (100%) | |
| Grupo 2 (1,94 a 6,89) | 51 (35,4%) | 0 (0%) | |
| Grupo 3 (> 6,89) | 53 (36,8%) | 0 (0%) | |
| Grupos VIDA, n (%) | <0,001 | ||
| Grupo A (‐1?0) | 19 (13,2%) | 6 (54,5%) | |
| Grupo B (1?2) | 35 (24,3%) | 3 (27,3%) | |
| Grupo C (3?4) | 90 (62,5%) | 2 (18,2%) | |
FPG, glicose plasmática em jejum; HDL, lipoproteína de alta densidade; IDF, Federação Internacional de Diabetes; IMC, índice de massa corporal; LDL, lipoproteína de baixa densidade; NCEP‐ATPIII, Painel de Tratamento do Adulto III do Programa Nacional de Educação sobre Colesterol; PCR, proteína C reativa; TG, triglicerídeos; VASI, índice de gravidade do vitiligo por área; VIDA, escore de atividade da doença vitiligo.
O vitiligo é um distúrbio pigmentar adquirido, de origem desconhecida, e é o distúrbio despigmentante mais comum em todo o mundo.1,2 Ele pode ter um importante impacto psicossocial nos pacientes e diminuir sua qualidade de vida.23 No entanto, como a causa exata da doença ainda não foi descoberta, nenhum tratamento curativo está disponível no momento.7 Assim, os protocolos de manejo da doença são em sua maioria conservadores e se concentram em preocupações cosméticas.7 Entretanto, estudos recentes destacaram um perigo muito maior para a saúde: a associação entre vitiligo e SM.11,13,17 Como Pietrzak et al. afirmaram, se for comprovada a existência de distúrbios metabólicos no vitiligo, o manejo futuro desses pacientes será alterado.11 A SM aumenta em cinco vezes o risco de desenvolver diabetes melito tipo 2 e em duas vezes o risco de desenvolver doença cardiovascular nos próximos cinco a dez anos.9 Além disso, pacientes com SM apresentam risco duas a quatro vezes maior de AVC, três a quatro vezes maior de infarto do miocárdio e duas vezes maior de morrer por esses eventos em comparação com a população sem SM, independentemente de uma história prévia de eventos cardiovasculares.9 Portanto, é crucial evitar as graves complicações da SM com a adoção de mudanças no estilo de vida e o controle dos fatores de risco. Além disso, o manejo ideal da SM pode melhorar o curso clínico do vitiligo.
Acredita‐se que alterações nas concentrações de citocinas, autoimunidade e predisposição genética sejam os principais fatores na patogênese do vitiligo.13,17 Além disso, o vitiligo não afeta apenas a pele, apresenta várias manifestações sistêmicas.13,17 Alguns estudos apontam que a produção de autoanticorpos no vitiligo também pode causar o desenvolvimento de comorbidades autoimunes, como alopecia areata, doença autoimune da tireoide, doença de Addison, anemia perniciosa, diabetes melito tipo I e miastenia gravis.5,11 Além disso, níveis aumentados de citocinas pró‐inflamatórias, como TNF‐α, IL‐1 e IL‐6, podem levar à resistência a insulina e aterosclerose.11 Em seu estudo, Karadag et al. afirmaram que a resistência a insulina e alterações no perfil lipídico (níveis reduzidos de colesterol HDL e aumento dos níveis de colesterol LDL e resistência à insulina) podem ocorrer em pacientes com vitiligo.24 Além disso, em outro estudo, Karadag et al. observaram níveis mais altos de homocisteína em pacientes com vitiligo em comparação com os controles.18 A homocisteína inibe a tirosinase, uma enzima que participa da síntese de melanina e é um marcador de doenças cardiovasculares.18 Além disso, Silverberg et al. descobriram que pacientes com vitiligo apresentam maiores concentrações de homocisteína e menores concentrações séricas de vitamina B12.25 Segundo estudos recentes, os melanócitos estão presentes não apenas na pele e nos folículos pilosos, mas também nas células do epitélio pigmentado da retina, em algumas células do ouvido interno, em algumas partes do sistema nervoso central e no tecido adiposo.11,26,27 Acredita‐se que os melanócitos no tecido adiposo participem de reações anti‐inflamatórias e na redução ou ligação de espécies reacionais de oxigênio. 11,26,27 Randhawa et al. observaram taxas mais altas de melanogênese em pacientes obesos.27 Hoggard et al. e Hoch et al. encontraram níveis mais altos de hormônio estimulante de alfa‐melanócitos (α‐MSH), que se ligam ao receptor de melanocortina 1 (MC1R) em adipócitos humanos e estimulam a melanogênese.28,29 Assim, Pietrzak et al. concluíram que a redução do número de melanócitos juntamente com a redução da melanogênese no tecido adiposo pode ser a causa comum subjacente ao estresse oxidativo, tanto no vitiligo quanto na SM.11 Page et al. sugeriram que agonistas da produção de melanina devem ser testados para prevenir o desenvolvimento de SM.26 Da mesma forma, em seu relatos de caso, Noel et al. indicaram estatinas como medicamentos imunomoduladores para o tratamento do vitiligo.30 Após a publicação do artigo de Pietrzak et al., a associação entre vitiligo e SM atraiu a atenção de mais pesquisadores.13,17 Atas et al. demonstraram que pacientes com vitiligo estão em maior risco de desenvolver MS e apontaram que características clínicas negativas da doença, como maior atividade da doença, maior área, vitiligo segmentar e de maior duração são preditores independentes do desenvolvimento de SM.13 Além disso, Sharma et al. observaram uma presença significativa de SM em pacientes com vitiligo. No entanto, eles não demonstraram uma associação entre SM e gravidade/atividade do vitiligo.17
No presente estudo, foram observadas taxas mais altas de hipertensão arterial, hiperlipidemia, obesidade, consumo de álcool, reposição de vitamina B12 e SM (segundo ambos os critérios) em pacientes com vitiligo em comparação aos controles. Os níveis médios de FPG, LDL, PCR, PAS e PAD foram estatisticamente significativamente maiores no grupo de estudo. Além disso, observou‐se um aumento da frequência de SM à medida que a gravidade/atividade do vitiligo aumentava. As taxas de SM, de acordo com os critérios NCEP‐ATPIII e IDF, foram estatisticamente maiores no grupo de estudo, mesmo após a exclusão dos pacientes com obesidade, diabetes melito, tireoidite de Hashimoto, deficiência de vitamina B12 e consumo de álcool. Além disso, o valor médio da PCR no grupo C foi superior aos valores médios nos grupos A e B, o que provavelmente ocorreu devido ao aumento das taxas de inflamação sistêmica com a atividade da doença. Os presentes achados são quase consistentes com os achados dos estudos feitos por Atas et al. e Sharma et al.13,17 No entanto, ao contrário do estudo de Sharma et al., foi observada uma relação significativa entre a gravidade do vitiligo e a presença de SM.17 A maior taxa de reposição de vitamina B12 em pacientes com vitiligo observada no presente estudo foi consistente com os achados do estudo de Karadag et al.18 O vitiligo não segmentar pode estar mais associado à inflamação crônica e à SM, de acordo com os achados desse estudo. Da mesma forma, a literatura indica que o vitiligo segmentar está principalmente associado a fatores genéticos e autoimunes, enquanto a SM foi relatada como mais frequente em pacientes com vitiligo não segmentar.1,3,5,13 Além disso, os índices mais altos de VASI e VIDA nos pacientes com vitiligo não segmentar indicaram uma doença mais extensa e ativa, o que poderia ser outra razão para a coexistência de inflamação crônica nesses pacientes.1,3,5,13
Os principais aspectos positivos do presente estudo foram seu desenho prospectivo, número relativamente grande de pacientes incluídos, alto número de parâmetros e homogeneidade dos resultados dos exames laboratoriais. Por outro lado, suas principais limitações foram a experiência em um único centro, ausência de marcadores de estresse oxidativo mais específicos, pequeno número de pacientes no grupo vitiligo segmentar e falta de seguimento de longo prazo dos pacientes. Tanto a SM quanto o vitiligo são síndromes dinâmicas com alteração da gravidade ao longo dos anos; o presente estudo teve apenas como objetivo demonstrar a associação transversal da gravidade da doença com a presença de características da SM. Estudos prospectivos adicionais podem ser feitos para confirmar os resultados do presente estudo.
A frequência da SM foi maior em pacientes com vitiligo não segmentar e a taxa foi maior na forma ativa/grave da doença. Assim, controlar os fatores de risco, promover mudanças no estilo de vida e adotar uma abordagem multidisciplinar para a SM podem ser benéficos em pacientes com vitiligo. Terapias específicas para o tratamento da inflamação sistêmica e do estresse oxidativo devem ser os alvos dos médicos que tratam pacientes com vitiligo.
Suporte financeiroNenhum.
Contribuição dos autoresEfsun Tanacan: Análise estatística; aprovação da versão final do manuscrito; concepção e planejamento do estudo; elaboração e redação do manuscrito; obtenção, análise e interpretação dos dados; participação efetiva na orientação da pesquisa; participação intelectual em conduta propedêutica e/ou terapêutica de casos estudados; revisão crítica da literatura; revisão crítica do manuscrito.
Nilgun Atakan: Aprovação da versão final do manuscrito; concepção e planejamento do estudo; participação efetiva na orientação da pesquisa; revisão crítica da literatura; revisão crítica do manuscrito.
Conflitos de interesseNenhum.
Como citar este artigo: Tanacan E, Atakan N. Higher incidence of metabolic syndrome components in vitiligo patients: a prospective cross‐sectional study. An Bras Dermatol. 2020;95:165–172.
Trabalho realizado no Departamento de Dermatologia e Venereologia, Hacettepe University Hospital, Ancara, Turquia.