As enfermidades bacterianas graves aqui discutidas serão aquelas que cursam com lesões dermatológicas em suas manifestações iniciais e, portanto, com frequência o dermatologista é chamado para opinar ou até mesmo é o primeiro médico a examinar o paciente. Demos prioridade nesta revisão àquelas que evoluem com necrose cutânea no decorrer de sua história natural, ou seja, a fasciíte necrosante, a gangrena de Fournier e o ectima gangrenoso. Observem os leitores que usamos a terminologia mais didática, individualizamos cada enfermidade, em vez de nos referir a elas pelo termo genérico “infecções necrosantes dos tecidos moles”. Acrescentamos nesta discussão, por sua relevância e frequência crescente, as infecções por Staphylococcus aureus meticilina resistente (MRSA, methicillin‐resistant S. aureus), mais especificamente os abcessos, furúnculos e antraz e suas potenciais etiologias por MRSA. O enfoque será dado à epidemiologia, manifestações clínicas dermatológicas, métodos de diagnóstico e tratamento de cada uma das enfermidades citadas.
Este artigo objetiva rever quadros infecciosos graves causados por bactérias que, quer pelo comprometimento cutâneo como manifestação primordial, quer pela manifestação cutânea que expressa e que sinaliza (como sentinela) o comprometimento sistêmico grave, tornam‐se de conhecimento obrigatório para o dermatologista, independentemente de sua área de atuação principal. Modernamente, diversos autores, particularmente da área de infectologia e cirurgia, preferem usar a terminologia necrotizing soft tissue infections (NSTIs), que engloba as diversas infecções que evoluem para necrose cutânea, tais como fasciíte necrosante, gangrena de Fournier, gangrena sinérgica (pós‐operatória) de Meleney, gangrena gasosa, celulite necrosante e mionecrose.1–3 No entanto, do ponto de vista didático e de maior prevalência, os autores privilegiarão e preservarão, neste artigo, a terminologia clássica de fasciíte necrosante, gangrena de Fournier, e incluirão o ectima gangrenoso e as infecções cutâneas causadas por MRSA com ênfase na furunculose e abscessos. A revisão dos mecanismos de defesa do hospedeiro, de resistência bacteriana aos antibióticos, de virulência e de microbioma, foge do escopo deste texto e, portanto, apenas serão incluídos e discutidos mecanismos essenciais à compreensão da etiologia e fisiopatogênica da enfermidade em discussão.
Fasciíte necrosanteA fasciíte necrosante (FN) é um processo infeccioso incomum, agudo, de rápida progressão e que cursa com necrose da fáscia muscular superficial e mesmo profunda, do tecido celular subcutâneo, da derme e epiderme, pode evoluir para sepse, choque e óbito em até 40% dos casos.4,5 Sob a denominação de gangrena hospitalar, o quadro era conhecido desde o século XIX. Em 1871, o médico cirurgião Joseph Jones, do Exército Confederado, publicou 2.642 casos por ele observados durante a guerra civil americana, citado por Farelas et al.3 Em 1952, o cirurgião americano B. Wilson usou o termo necrotizing fasciitis, atualmente de uso universal, para designar os processos infecciosos que progridem através do plano da fáscia muscular superficial e com evolução para necrose dos tecidos subcutâneos até a epiderme e mesmo para a fáscia profunda e plano muscular.6
Na absoluta maioria dos casos a FN inicia‐se por inoculação do patógeno ou patógenos através de lesão de continuidade da pele consequente a trauma, ferimentos perfurantes, mordedura humana ou de animais, picada de inseto, pequenos procedimentos, inserção de cateter, injeção de drogas lícitas ou ilícitas, complicação pós‐varicela, entre outros, incluída a contusão sem solução de continuidade da pele.7–11 A localização topográfica mais comum da FN são os membros inferiores, mas envolvimento de membros superiores, incluídas as mãos e, ainda, segmento cefálico e tronco, não são excepcionais.11–15 Não há predileção por sexo ou idade, pode ocorrer em crianças e jovens, mas é mais frequente em adultos e idosos. Os fatores predisponentes principais são senioridade, diabetes melittus, obesidade, alcoolismo, desnutrição, imunossupressão, doença renal ou hepática crônica, doença vascular periférica e uso crônico de drogas ilícitas, pode ocorrer até mesmo em indivíduos aparentemente sadios.10–12 Recentemente, a FN tem sido relatada em associação ao uso de terapêuticas‐alvo, como inibidores da tirosina quinase; porém, a relação causa‐efeito nos casos relatados torna‐se difícil de ser definida dada a existência de diversos possíveis cofatores nos pacientes envolvidos.16 Do ponto de vista etiopatogênico, o quadro evolui rapidamente por ação de endo e exotoxinas produzidas pela espécie bacteriana infectante, ou espécies infectantes, com evolução para endarterite obliterante, trombose da microcirculação local e necrose.4,7,12 Não tratada, tratada tardiamente ou apenas clinicamente, a evolução possível é para toxemia, sepse, coagulação intravascular disseminada, falência de múltiplos órgãos e óbito.7,11,12
Uma classificação de fasciíte muito usada é a que designa como tipo I aquela causada por associação sinérgica de bactérias aeróbicas ou anaeróbicas, portanto fasciíte necrosante polimicrobiana, em que se incluem Streptococcus do Grupo A, Staphylococcus aureus ou outras espécies de estafilococos, Escherichia coli, Klebsiella spp. e outras bactérias Gram‐ menos frequentemente.4,7,17 A frequência estimada desse tipo I é de 70% a 80%.4 A fasciíte necrosante tipo II, monomicrobiana, é também denominada “celulite gangrenosa estreptocócica” e é causada por estreptococos beta‐hemolíticos do Grupo A, também referidos como flesh‐eating bacteria, estimada entre 20% a 30% dos casos de FN.7,18,19 A espécie de Streptococcus mais frequente é a S. pyogenes, sorotipos M1e M3, que apresenta capacidade de modificar a resposta fagocítica de defesa do hospedeiro, produzir hemolisinas e exotoxinas com propriedades de superantígenos e, consequentemente, induzir proliferação excessiva de linfócitos T e liberação de citocinas pró‐inflamatórias.7,20 Essas atuam como gatilhos da síndrome do choque tóxico estreptocócico, que pode ocorrer em até 14% das infecções estreptocócicas graves e está associada a alta mortalidade.7,19 Relembrar que o choque séptico é quadro sindrômico desencadeado por infecção grave, quer por bactérias Gram+, quer Gram‐, e que resulta na liberação de mediadores pró‐inflamatórios, inclusive TNF‐alfa, produzidos por monócitos, neutrófilos e macrófagos, que induzem vasodilatação, extravasamento de plasma a partir dos vasos, mau funcionamento cardíaco, imunossupressão e falência de múltiplos órgãos.7,20 Não raramente, o Staphylococcus aureus ou outras espécies de estafilococos podem estar associadas à infecção estreptocócica e potenciar os efeitos deletérios dela.21
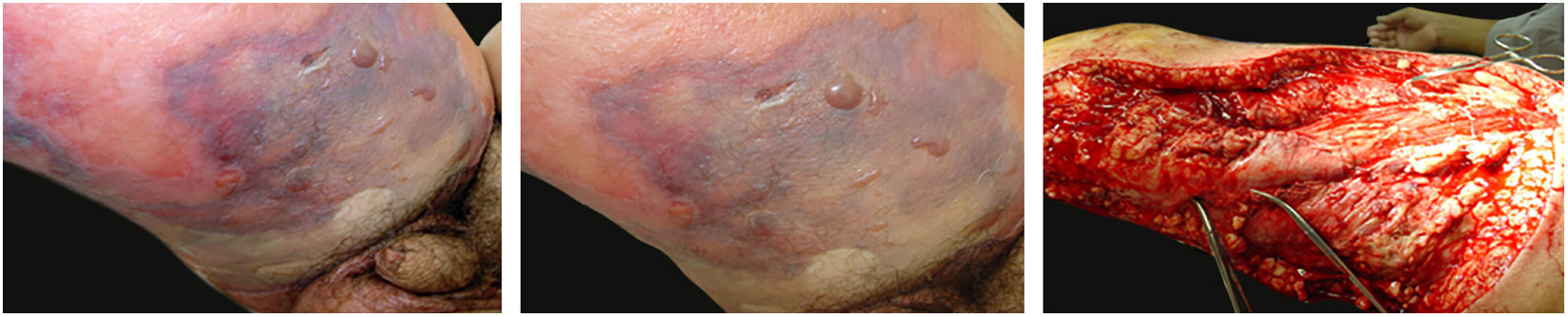
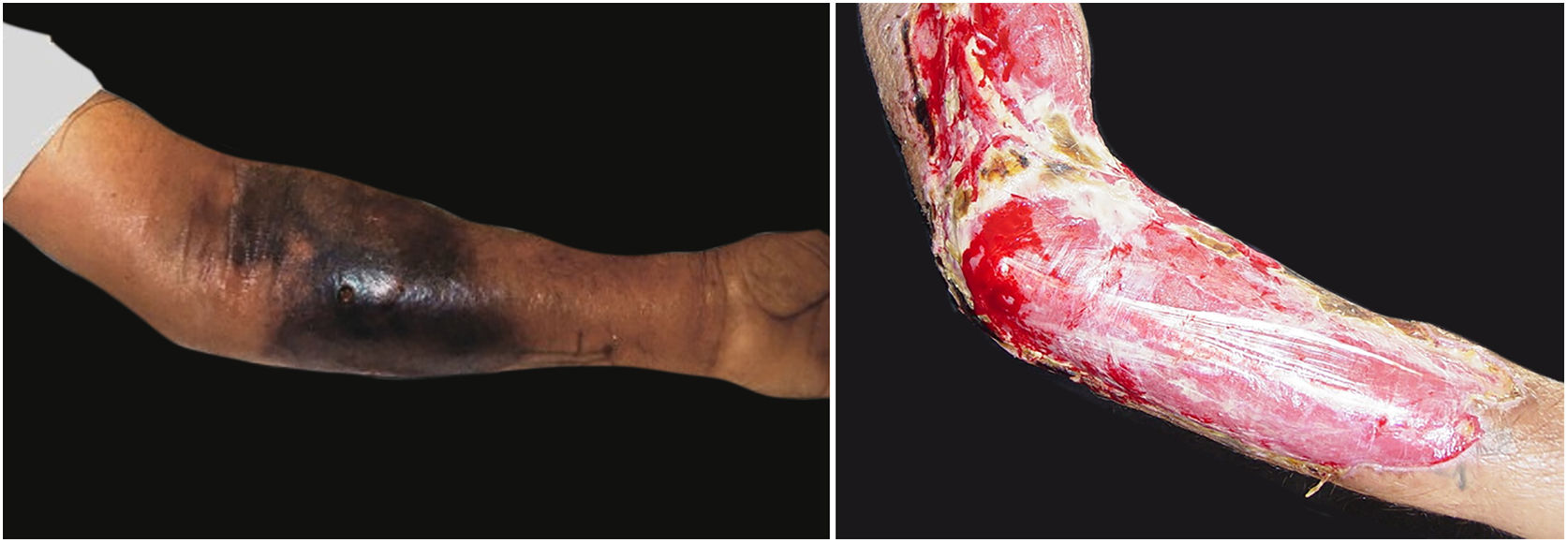
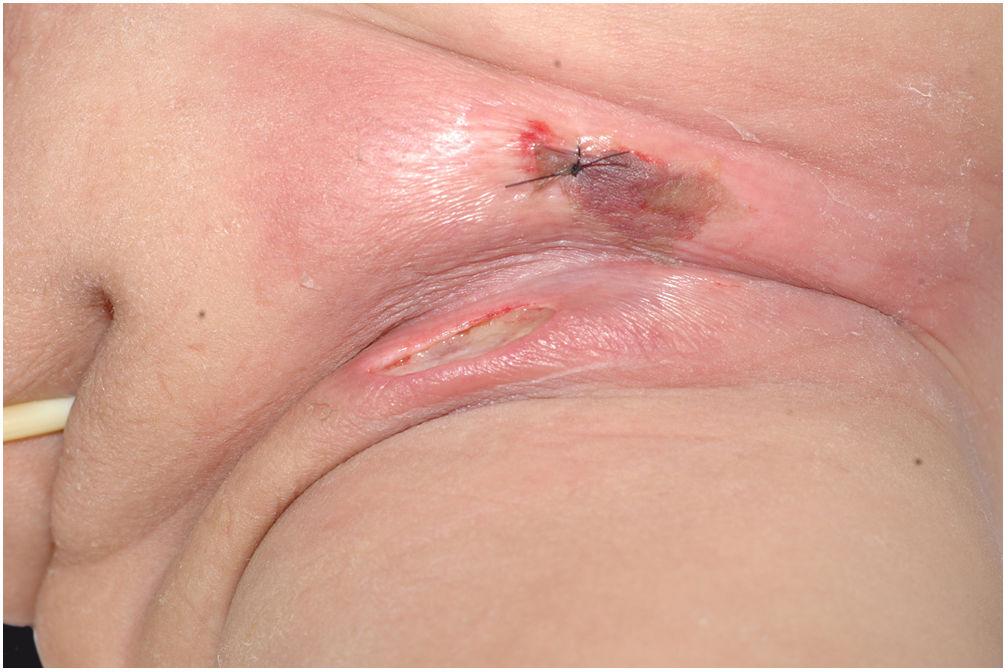
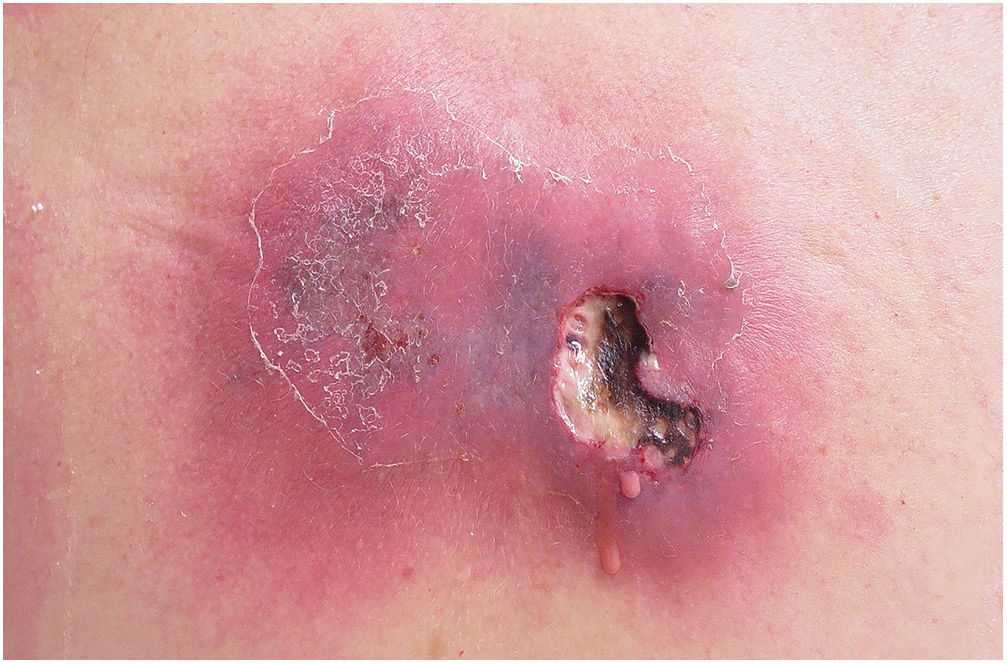
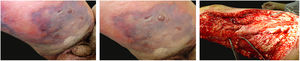
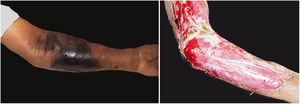
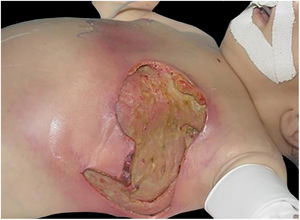
A manifestação clínica inicial pode ser sutil e discreta, com eritema, edema, calor local que sugere quadro de erisipela ou celulite, o que retarda a suspeição diagnóstica relativa à gravidade. Chama a atenção, contudo, a dor desproporcional à aparente benignidade do quadro. Porém, pela regra, há evolução rápida em 24‐72 horas para quadro eritemato‐violáceo; os limites da lesão se perdem, há aparecimento de vésico‐bolhas de conteúdo hemorrágico, infiltração identificada por induração firme do tecido, edema e dor além dos limites perceptíveis de eritema (figs. 1 e 2). Na sequência, aparecem áreas de palidez e a dor desaparece ou reduz pronunciadamente em consequência da necrose dos filetes nervosos locais. A esses sinais dermatológicos se somam, em variável intensidade, sinais gerais de febre, letargia, confusão mental, toxemia e, potencialmente, sepse e choque. Durante o procedimento de biópsia ou incisão cirúrgica exploratória local praticamente não se observa sangramento, consequência do tromboembolismo da microcirculação local/regional (fig. 3). A depender do momento no tempo de história clínica, pode haver sinais de enfisema cutâneo e saída de secreção com odor fétido quando do procedimento, indicadores de necrose tecidual. A tomografia computadorizada (TC) ou a ressonância magnética (RM) são úteis para demonstrar a presença de edema subcutâneo, espessamento da fáscia, coleção de material purulento e mesmo presença de gases, evidência da gravidade e que distingue a FN da celulite grave.22–24 Biópsia incisional profunda, até a fáscia, ou cortes submetidos a congelamento para rápida análise, podem igualmente ser úteis ou decisivos. Porém, encaminhar e aguardar tais procedimentos envolve tempo gasto que pode ser crucial para o caso. Se não se reconhece o diagnóstico, ou se intervenções adequadas não são instituídas, os sinais de sepse se manifestam entre o quarto e sexto dia de infecção, podendo se antecipar ou postergar. Portanto, a suspeição diagnóstica a partir de dados de história e exame clínico e dermatológico deve ser a mais precoce possível, com tomada de decisão no sentido de ampla cobertura antibiótica e indicação do desbridamento cirúrgico.
Fasciíte necrosante. (A) visão geral mostra a extensão do comprometimento e diferentes estádios clínicos. (B) Detalhe de área desvitalizada, pálida; eritemato‐violácea e em sofrimento; bolha de conteúdo hemorrágico e eritema marginal na área ainda viável. (C) Demonstração da amplitude necessária do desbridamento cirúrgico.
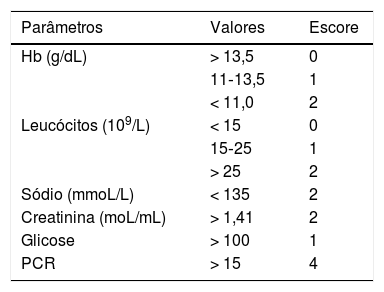
O denominado indicador laboratorial de risco para fasciíte necrosante (LRINEC, do inglês laboratory risk indicator for necrotising fasciitis), proposto por Wong et al. em 2004, é um sistema de escore que pode ser auxiliar diagnóstico útil, ainda que não exista consenso sobre sua especificidade. O LRINEC usa dados de PCR, leucograma, hemoglobina, sódio sérico, creatinina e glicemia, coletados quando do primeiro atendimento ou da primeira suspeita, e que recebem “notas” segundo a intensidade da alteração laboratorial detectada. O escore final 6 equivaleria a risco intermediário de se tratar de FN; escore ≥ 8 seria indicativo de alto risco de diagnóstico de FN (tabela 1).25,26 A esses dados laboratoriais podem‐se somar informações obtidas de manipulação da lesão por cirurgião no sentido de preliminarmente incisar e expor o tecido e avaliar se há necrose visual da fáscia e se há fácil descolamento da fáscia de seus planos superiores. É preciso sempre ter em mente que, frente à suspeita, torna‐se necessário fazer a coleta de fragmento de tecido por biópsia para cultura e coleta de hemocultura em mais de uma oportunidade.
Dados laboratoriais indicativos de risco para diagnóstico de fasciíte necrosante (LRINEC – no original)
| Parâmetros | Valores | Escore |
|---|---|---|
| Hb (g/dL) | > 13,5 | 0 |
| 11‐13,5 | 1 | |
| < 11,0 | 2 | |
| Leucócitos (109/L) | < 15 | 0 |
| 15‐25 | 1 | |
| > 25 | 2 | |
| Sódio (mmoL/L) | < 135 | 2 |
| Creatinina (moL/mL) | > 1,41 | 2 |
| Glicose | > 100 | 1 |
| PCR | > 15 | 4 |
A soma dos escores < 5, ≤ 50% de risco (baixo risco); entre 6‐7 = risco intermediário; > 8 = 75% risco (alto risco). Adaptado de Wong et al., 2004.
O diagnóstico diferencial inclui os processos infecciosos da pele, subcutâneo e músculo, inclusive erisipela e celulite grave, bolhosa, abscessos, hematoma infectado, pioderma gangrenoso, piomiosite, gangrena gasosa e infecção pós‐operatória ou pós‐procedimento. O conhecimento semiológico, peculiaridades de clínica dermatológica e história clínica auxiliada por dados de laboratório, segundo a tabela 1, tornam possível a suspeita diagnóstica ou o diagnóstico clínico de certeza.
A cobertura antibiótica deve ser instituída de imediato frente à suspeita; não há que se esperar definição diagnóstica. A antibioticoterapia deve ser capaz de cobrir, ainda que empiricamente, a FN polimicrobiana, portanto contra germes Gram+, Gram‐ e anaeróbios. Tentativa de análise por meio de revisão sistemática pela metodologia adotada pela Cochrane não resultou em informações definitivas relativas à terapêutica antibiótica nas infecções necrosantes que acometem tecidos moles.27 Em síntese, os autores concluíram que: “Não há terapêutica antimicrobiana empírica validada por ensaio clínico. (...) tópicos (itens) devem ser considerados, entre os quais a estratégia antimicrobiana em pacientes com ou sem comorbidades e em pacientes com fator de risco para infecção por MRSA”.27
As sugestões que se seguem, fruto de dados de literatura e da vivência pessoal dos autores, é o uso de um dos seguintes esquemas: 1) piperacilina sódica + tazobactan sódico (ativa contra Gram+, mesmo que produtores de β‐lactamases, ativa contra Gram‐, não é ativa contra MRSA), + vancomicina (ativa contra MRSA) + clindamicina (ativa contra bactérias Gram+ aeróbias e anaeróbias);7,9,11,17–19,21 2) imipenen/meropenen (da classe dos carbapenêmicos e ativo contra Gram+ mesmo que produtores de β‐lactamases, ativo contra Gram‐, não é ativo contra MRSA) + vancomicina + clindamicina; ou 3) cefepima (da classe das cefalosporinas, de quarta geração, ativa contra Gram+, mesmo que produtores de β‐lactamases, ativa contra Gram‐, não é ativa contra MRSA), + vancomicina + clindamicina. Os resultados obtidos de cultura/hemocultura e antibiograma podem implicar ajustes nessas propostas, particularmente na avaliação da necessidade de se associar ao esquema um antibiótico da classe dos aminoglicosídeos. Se necessário ou conveniente, a clindamicina pode ser substituída por metronidazol, 1,0g 12/12 horas – intravenoso. Importante ressaltar que vários desses fármacos exigem correção pelo clearance de creatinina quando indicado, assim como devem ser ajustadas as doses em crianças com menos de 40kg ou neonatos.
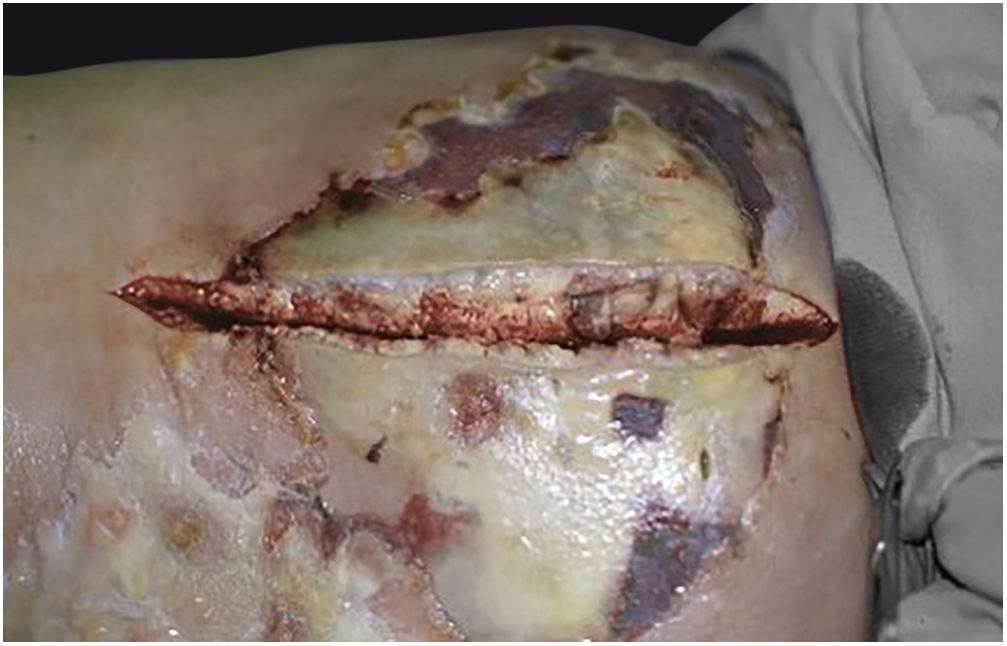
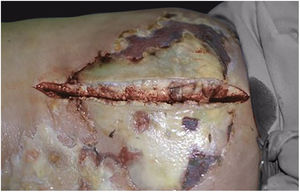
Associado ao tratamento antibacteriano é também emergencial e essencial o desbridamento cirúrgico (figs. 1C e 2B). Não raro, o dermatologista tem que convencer os colegas cirurgiões da emergência da indicação do procedimento. O desbridamento deve ser amplo, excisar todo o tecido subcutâneo necrótico, inclusive a fáscia, indo além do visível como margem de segurança (fig. 4).1,2,7,11,17 Há que se avaliar a existência de mionecrose associada e ter claro se há ou não necessidade de amputação do membro acometido. A ferida cirúrgica deve permanecer aberta e reavaliada em 24 horas e a excisão deve ser ampliada, se necessário, pois não raro o processo infeccioso e a trombose da microcirculação local progridem, a despeito da antibioticoterapia.
Como tratamento coadjuvante à antibioticoterapia de largo espectro e ao desbridamento cirúrgico, há relatos de uso de imunoglobulina intravenosa (IGIV), oxigenoterapia hiperbárica e terapia por pressão negativa (TPN). A IGIV é citada como terapia nos casos associados a choque séptico devido à possibilidade de neutralização à formação dos superantígenos.28 Entretanto, em estudo de coorte retrospectivo com 164 pacientes concluiu‐se que a IGIV não teve impacto aparente na mortalidade ou no tempo de internação além do alcançado com desbridamento e antibióticos.29 Quanto à oxigenoterapia hiperbárica, revisão sistemática da Cochrane não conseguiu demonstrar evidências clínicas relevantes para apoiar ou refutar a eficácia dessa terapia na FN.30 Em relação à TPN, método usado para acelerar a cicatrização, existem muitos artigos, principalmente relato de casos e séries de casos, sobre seu uso na FN; entretanto, faltam estudos tipo ensaios clínicos randomizados para atestar sua validade.31,32 Importante ressaltar que medidas de suporte e de cuidados intensivos devem estar disponíveis e devem ser usadas, sem reserva, segundo o indicado. Com a recuperação do paciente, a reparação da ferida cirúrgica pode ser feita por enxertia local quando o leito estiver limpo e com granulação do tecido, ou mesmo por cicatrização por segunda intenção.17 As eventuais sequelas estéticas, funcionais ou sociais merecem igual esforço no sentido de ser equacionadas ou minoradas da melhor maneira possível.
Gangrena de FournierEm 1883, o dermatologista francês Jean‐Alfred Fournier (1832‐1914), chefe do serviço de Dermatologia e Sifilografia do Hôpital Saint Louis de Paris, relatou quadro de infecção e rápida evolução para necrose da região do períneo e escroto em cinco pacientes. O quadro infeccioso foi por ele denominado gangrène foudroyante de la verge, ou seja, gangrena evolutiva e rápida do pênis.33,34 Atualmente, é reconhecido como variante da fasciíte necrosante de localização inicial e específica da região do períneo, genitália ou perianal e conhecido como gangrena de Fournier.34 É enfermidade de ocorrência incomum, com índices de mortalidade entre 7,5% a 22,5% dos casos em diferentes séries.34–36 Pode ser confinada ao escroto ou se estender ao períneo, pênis, púbis e parede abdominal. Embora mais frequente no sexo masculino, entre 52% a 100% dos casos em diferentes séries, pode também comprometer o sexo feminino.34–36 A faixa de idade mais acometida é aquela acima dos 50 anos, mas casos em crianças e adolescentes, embora muito raros, são possíveis.34–36 Em estudo de revisão de 40 casos diagnosticados no Brasil, os autores identificaram como comorbidades principais o diabetes mellitus, presente em 70% dos pacientes, hipertensão arterial sistêmica (35%), cardiopatia (15%), dislipidemia e obesidade (7,5%).37 O consumo abusivo de álcool e a desnutrição são também citados como fatores predisponentes. Os fatores desencadeantes são os mais variáveis; infecção prévia do trato urinário, infecção perianal, manipulação cirúrgica, inclusive postectomia, prótese peniana, trauma genital, inclusive preenchimento para aumento do pênis, ou trauma escrotal são listados como os mais importantes e frequentes.34–39 No sexo feminino são citados traumas, microtraumas relacionados à depilação, episiotomia e infecção da região vulvar e perineal.34,35
A etiologia é polimicrobiana na maioria dos casos, varia entre 54%‐80% em diferentes séries. O agente infeccioso mais comum é a Escherichia coli, porém são também comuns bactérias do gênero Streptococcus, Bacteroides, Enterobacter, Staphylococcus, incluído MRSA, Enterococcus, Pseudomonas, Corynebacterium, Klebsiella ou até mesmo Candida albicans. Tais agentes podem atuar isoladamente ou em associação.35,40–42
A gangrena de Fournier progride através dos planos superficiais e profundos da fáscia da região urogenital e anogenital.34 A sequência de eventos espelha aquela da fasciíte necrosante cutânea clássica: infecção, oclusão vascular, infarto e necrose do tecido. O quadro progride de maneira muito rápida no sexo masculino, pois a fáscia de Colles do períneo, a fáscia de Dartos do pênis e escroto e a fáscia de Scarpa da parede anterior do abdome compõem um continuum, facilitando que a infecção progrida por esses planos.7,34
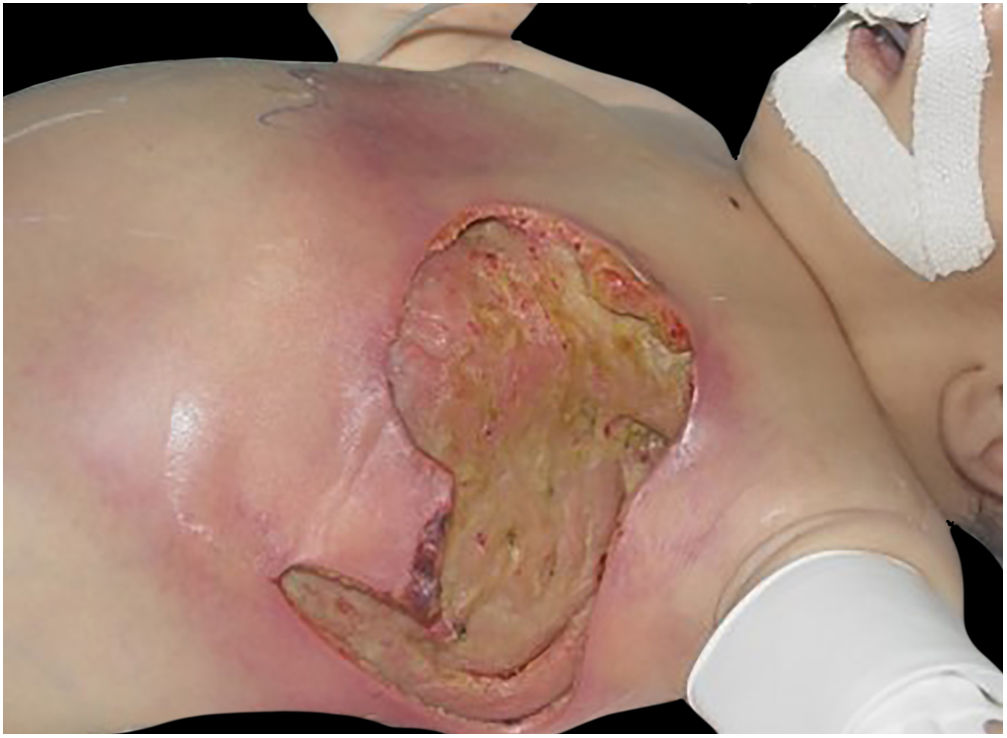
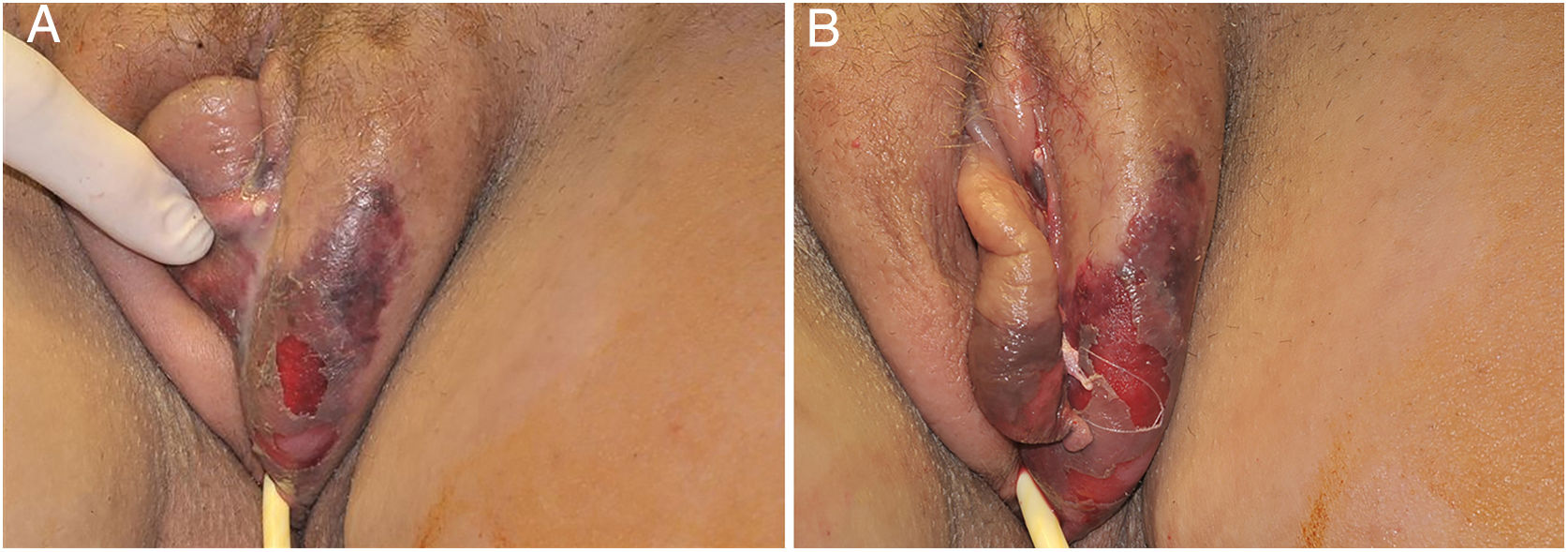
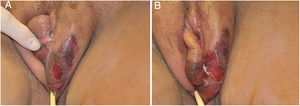
O quadro inicial é de eritema e edema com aumento de volume e, como na FN clássica, é acompanhado de dor desproporcional à aparência clínica.34,35,37 A sequência de sinais dermatológicos pode ser descrita como edema, aumento de volume, eritema mal delimitado, eritemato‐violáceo e por fim palidez e aspecto de necrose cutânea, também identificado quando de lesão vulvar (fig. 5).
A avaliação clínica e a suspeita diagnóstica hão de ser o mais precoce possível e a intervenção não pode aguardar a comprovação histológica ou microbiológica. Embora o encaminhamento diagnóstico possa ser dermatológico, a intervenção é urológica, ginecológica, cirúrgica, com o objetivo de remoção de todo o tecido desvitalizado, associada à cobertura antibiótica tendo em mente os patógenos descritos.35,40–42 A prescrição antibiótica não pode ser tímida – deve ser intravenosa e ser resumida, como já citada para a FN, nas opções: 1) piperacilina sódica + tazobactan sódico + vancomicina + clindamicina; ou 2) imipenen/meropenen + vancomicina + clindamicina; ou 3) cefepima + vancomicina + clindamicina. Tal qual em relação à FN, a clindamicina pode ser igualmente substituída por metronidazol. Tais medidas, evidentemente, associadas à analgesia, ao suporte e aos cuidados em regime de terapia intensiva. O prognóstico é variável. Na série de 40 casos, no Brasil, a mortalidade foi de 22,5% e se correlacionou fortemente com presença de sepse na admissão hospitalar e com o tempo de permanência em UTI. Esses resultados foram muito semelhantes aos observados em recente trabalho da Coreia, com 41 pacientes avaliados, em que a taxa de mortalidade foi de 22,0%.37,41 Em ampla revisão de literatura, que compilou 1.726 casos, os índices de mortalidade observados estiveram entre 3%‐45%, com mediana de 16%, e majoritariamente associados à sepse e ao diabetes.35 Tais dados mostram a extrema importância do diagnóstico precoce, da intervenção especializada e do suporte em unidade de terapia intensiva.
Ectima gangrenosoAs primeiras informações relativas ao ectima gangrenoso (EG) surgiram em 1897, em artigo de LF Barker sobre manifestações clínicas relacionadas à infecção causada pelo Baccilus pyocyaneus, nome à época usado para a atual Pseudomonas aeruginosa.43 A denominação “ectima gangrenoso”, surgida em 1951 em publicação de RH Broughton, desde então é de uso universal e implica, conceitualmente, estado de sepse pela P. aeruginosa.44 Com o evoluir dos conhecimentos, o EG passou a ser associado também a outras bactérias Gram‐, Gram+ e até mesmo a fungos, em especial dos gêneros Candida e Fusarium.7,45 Alguns autores se referem aos casos não P. aeruginosa como ectima gangrenoso‐símile, mas a mensagem principal é que a manifestação dermatológica é praticamente idêntica e, à suspeita diagnóstica, a intervenção primeira deva ser direcionada à P. aeruginosa enquanto se investiga a etiologia do caso.45,46
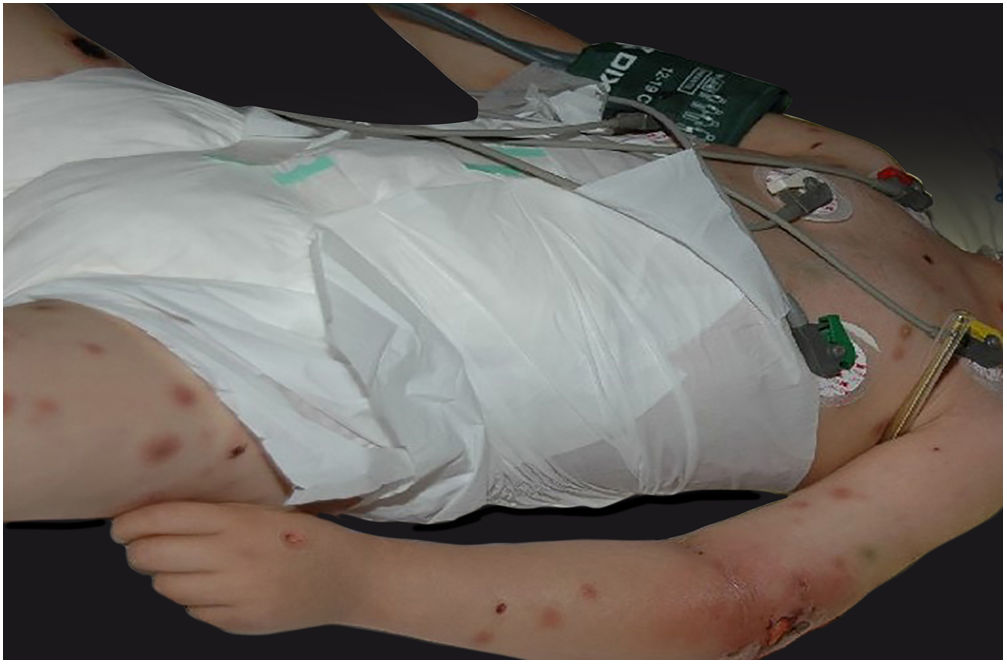
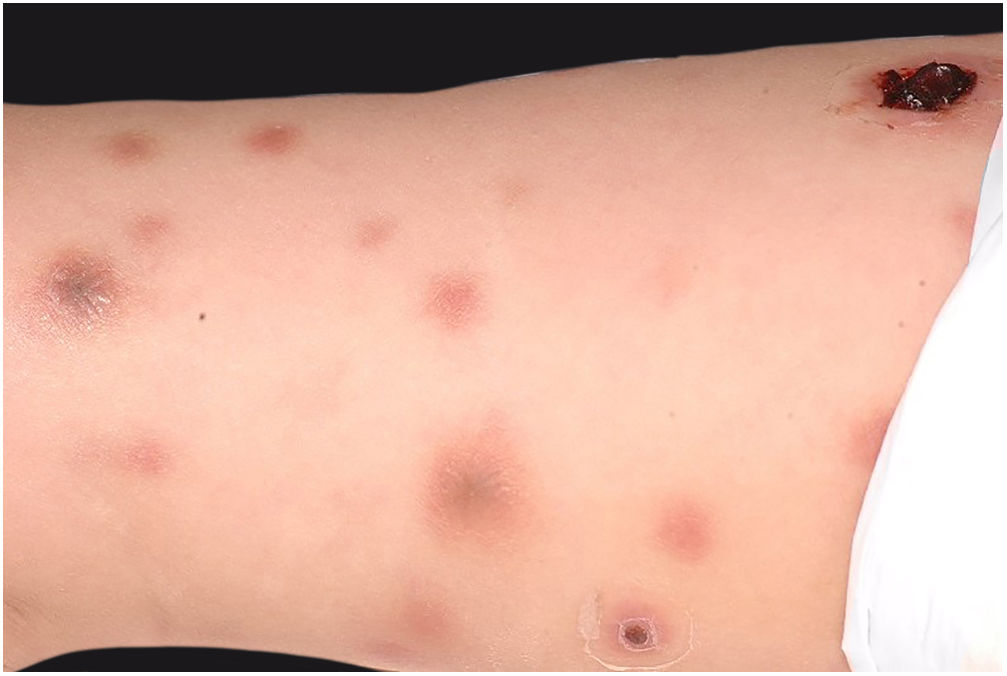
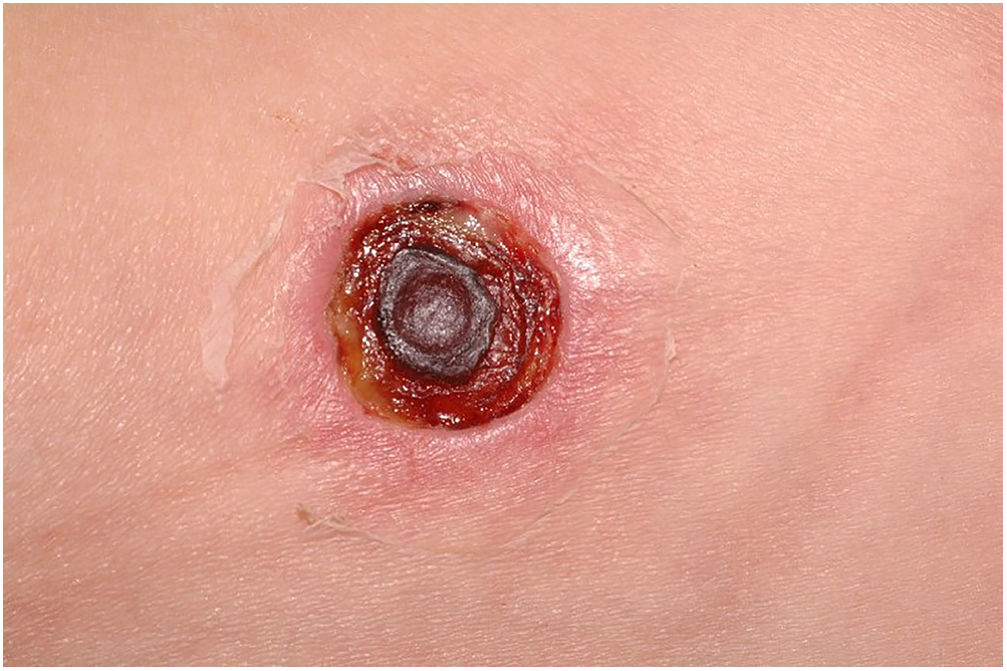
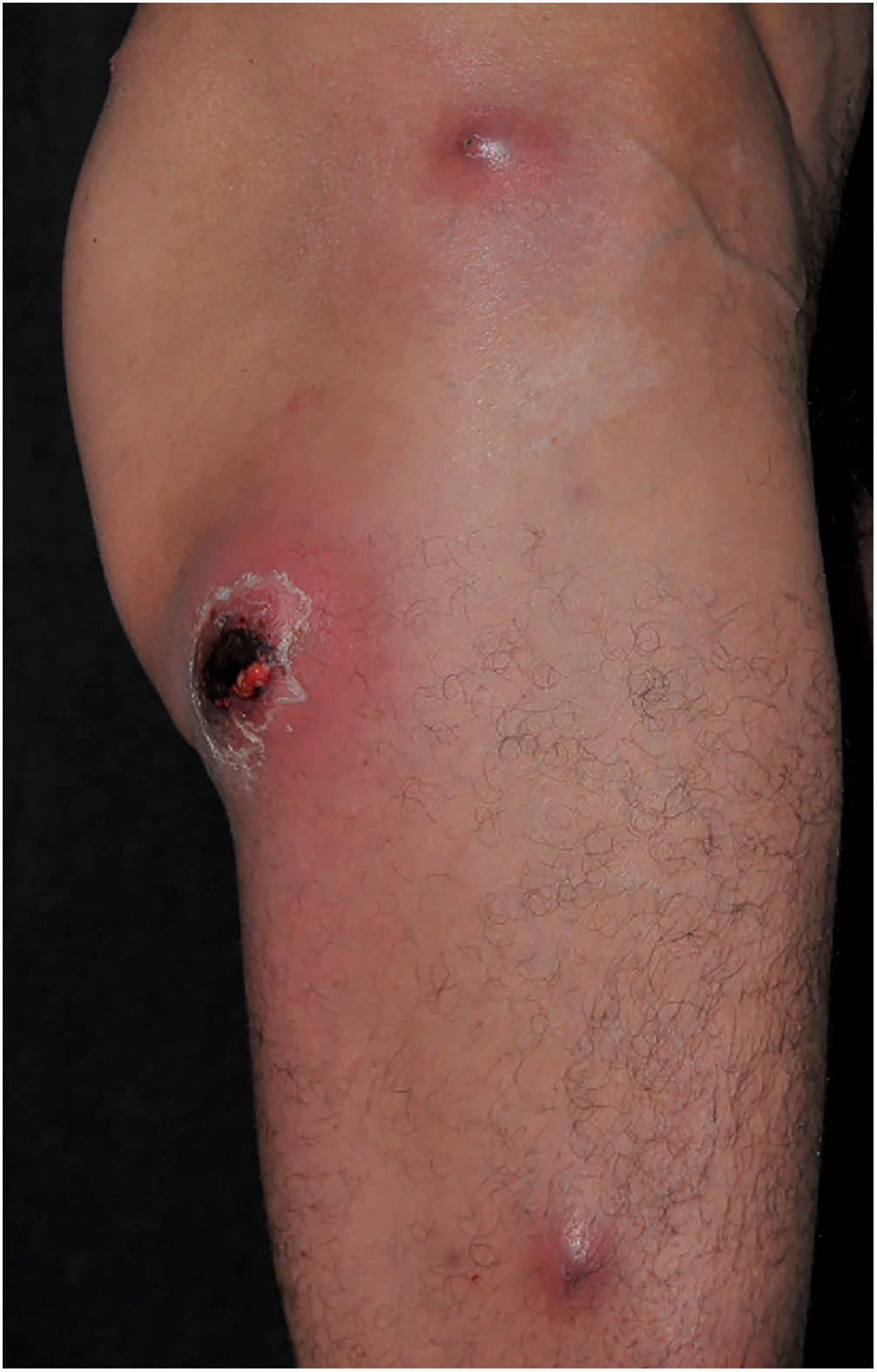
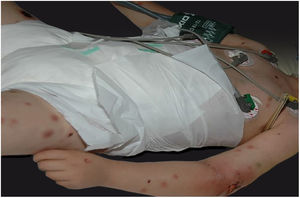
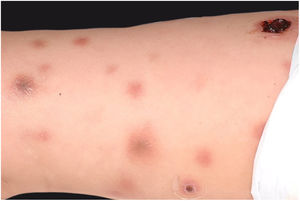
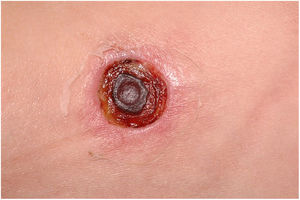
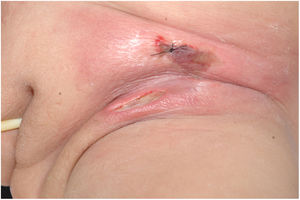
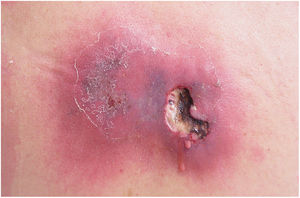
Clinicamente, o EG se caracteriza por rápida evolução de lesão localizada, inicialmente vesicobolhosa ou papulonodular, em leito eritematoso, edematoso, com substituição em 12‐24 horas por sinais locais de necrose cutânea e lesão ulceronecrótica.45–49 Essas manifestações clínico‐dermatológicas correspondem à invasão das vênulas pelo agente infeccioso com consequente lesão da parede vascular, indução de trombose nas arteríolas, processo inflamatório, edema e obstrução vascular e necrose cutânea localizada. As lesões são em geral em pequeno número, mas podem ser múltiplas e em diferentes estádios de evolução (figs. 6‐8). As localizações preferenciais são a região do períneo, glúteos, dobra inguinocrural (fig. 9), interglúteos e extremidades distais, mas as lesões podem acometer qualquer área, incluído o segmento cefálico.45,48–51 O quadro clínico geral associado às lesões cutâneas pode já demonstrar o estado febril, de toxemia, sepse, ou mesmo ocorrer em paciente previamente assintomático ou oligossintomático.52,53 O diagnóstico diferencial das lesões cutâneas deve incluir lesões de vasculite leucocitoclástica de pequenos vasos de natureza grave, lesões cutâneas da sepse, coagulação vascular disseminada e de êmbolos sépticos associados à endocardite. Embora meningococcemia seja citada na literatura como diferencial de EG, as lesões tipo púrpura fulminante são distintas, pois purpúricas, tipo rash retiforme e não formam bolhas.54,55
Em estudo de revisão de 167 casos de EG relatados na literatura e pertencentes a artigos identificados em busca no PubMed, Medline e Science Direct entre 1975 e 2014, os autores identificaram que em 73,6% do total de casos o agente foi a P. aeruginosa, em 17,3% outra bactéria, e em 9% a etiologia foi fúngica. Chama a atenção que, dos casos em que o agente foi a P. aeruginosa, em apenas 58,5% deles o EG foi manifestação de sepse.45 Esses dados são relevantes, pois demonstram que é correto o início do tratamento empírico com vistas à Pseudomonas enquanto se busca a real etiologia e que o EG pode ser manifestação de bacteremia associada a quadro clínico ainda estável.
O EG acomete qualquer faixa etária, mas a infância como um todo merece particular atenção, uma vez que a gravidade do prognóstico é maior quanto menor é a idade do paciente.45,47,49
Com frequência, o fator predisponente é a imunossupressão e/ou a neutropenia, primária ou secundária à quimioterapia. Nos portadores de enfermidades linfoproliferativas e em quimioterapia, a etiologia por fungos deve ser pensada com certa prioridade.45,49–51 No geral, as enfermidades de base ou situações clínicas mais prevalentes foram: leucemia/linfoma, outras malignidades, queimaduras graves, transplantados e pacientes em terapia imunossupressora.45,49–51 Em mais de uma oportunidade, o EG foi sinal revelador de infecção por P. aeruginosa grave em contexto de neutropenia primária até então oculta.47,49
Frente à suspeita clínica, o diagnóstico etiológico se vale da hemocultura e do cultivo para bactérias e fungos em fragmento de biópsia da lesão, esta praticada na borda da úlcera ou em área não necrótica. O antibiograma é obrigatório e deve ser valorizado. Paralelamente, busca‐se eventual foco emissor da bacteremia com especial atenção aos pulmões.
O tratamento deve de imediato visar à etiologia mais provável, ou seja, cobertura antibiótica intravenosa contra a P. aeruginosa, com uso de aminoglicosídios, preferencialmente a amicacina na dose de 7,5 a 15mg/kg/dia IV ou IM, dividida em duas ou três infusões/aplicações.45,48 Em crianças, dose de 15 a 20mg/kg dia, com dose máxima de 1,5g, subdividida em infusões IV a cada 8 horas ou IM a cada 12/12 horas. Há necessidade de ajuste da dose em situações de clearance de creatinina alterado. Outra opção são os carbapenêmicos. Se a escolha for pelo imipenem, a dose usada é de 1 a 2g/dia IV com infusão a cada 6 horas. Em crianças com peso menor do que 40kg, a dose de 15 a 25mg/kg/dia IV, dividida em infusões a cada 6 horas, com dose total máxima de 2g/dia. O tratamento com imipenem em pacientes com insuficiência renal implica correção da dose quando o clearance da creatinina estiver abaixo de 50mL/min. O meropenem é o carbapenêmico mais usado e preconizado na dose de até 6g/dia, IV, dividida em infusões a cada 6 horas. O mesmo para criança com menos de 40kg em que a dosagem é limitada a 20‐40mg/kg a cada infusão de 8/8 horas. Nos pacientes com insuficiência renal, a dose deve ser igualmente corrigida de acordo com o clearance da creatinina. De possíveis efeitos adversos, há que se ressaltar o potencial de nefrotoxicidade e ototoxicidade associado aos aminoglicosídios em geral.
O desbridamento cirúrgico da lesão é método adjuvante útil no EG, mas não se reveste da essencialidade que existe na FN e na gangrena de Fournier.45
O prognóstico do EG depende das condições gerais do paciente, do estado imunológico, da doença de base e, nos casos de sepse concomitante, do possível atraso do diagnóstico antes do início do tratamento. EG em pacientes não sépticos apresenta menor taxa de mortalidade (16%), quando comparada aos pacientes sépticos (38%‐96%).56
Infecções cutâneas causadas por Staphylococcus aureus resistente à meticilina (MRSA, methicillin‐resistant S. aureus)Alexander Ogston, na década de 1880, detectou pela primeira vez o Staphylococcus aureus a partir de exsudato purulento de abscesso localizado na perna de um paciente e, em 1884, Friedrich Julius Rosenbach formalmente isolou essa bactéria.57. O S. aureus é uma bactéria coccus Gram+ e está bem adaptada ao hospedeiro humano e ao ambiente de cuidados de saúde. Faz parte da microbiota humana normal e é frequentemente encontrada na pele, especialmente axila, região inguinal e na cavidade nasal, com prevalência em torno de 25%‐30%. É um dos principais agentes causadores de endocardite, bacteremia, pneumonia, osteomielite e infecções de pele e partes moles (IPPM), desencadeia quadros de gravidade leve a fatal.58
A S. aureus tornou‐se rapidamente uma das principais causas de infecções relacionadas a ambientes hospitalares. Inicialmente bactéria sensível à penicilina, a resistência surgiu na década de 1940 mediada pelo gene β‐lactamase blaZ. Em 1960, as primeiras penicilinas semissintéticas antiestafilocócicas foram desenvolvidas e cepas de MRSA foram observadas dentro de um ano de seu primeiro uso clínico.59,60
Até a década de 1980, as infecções por MRSA ocorriam em pacientes que apresentavam fatores predisponentes reconhecidos, tais como hospitalização, presença de dispositivo invasivo, história de cirurgia, hemodiálise, imunossupressão ou residência em lar de idosos. Na sequência, surgiram os relatos de infecções por MRSA em populações saudáveis sem os fatores de riscos, ou seja, sem história recente de contato com hospitais ou serviços de saúde, com intensificação do número de relatos nos anos 2000.61 As cepas desses MRSA que causavam infecções em pacientes sem os fatores de riscos previamente descritos mostraram‐se diferentes daquelas dos hospitais, e surgiu o termo community‐associated MRSA (CA‐MRSA).62 Para diferenciar as cepas hospitalares, acrescentou‐se o termo healthcare‐associated ou hospital‐acquired MRSA (HA‐MRSA), para aquelas relacionadas aos serviços de assistência em saúde.63
Resistência à meticilina ocorre devido aos segmentos cromossômicos presentes em algumas cepas do S. aureus que transportam o gene de resistência à meticilina (mecA), denominados SCCmec (Staphylococcal chromosome cassette mec); são distintos no HA‐MRSA (SCCmec tipos I, II e III) e nos CA‐MRSA (SCCmec tipos IV a XI).64 A expressão de mecA conferiu resistência aos antibióticos β‐lactâmicos disponíveis, enquanto a resistência aos antibióticos não β‐lactâmicos comumente associada ao HA‐MRSA é devida a uma variedade de mecanismos.63 Os primeiros relatos de CA‐MRSA isolados na América Latina foram informados em 2002 e 2003, no sul do Brasil.65
Basicamente, as infecções por CA‐MRSA diferem daquelas por HA‐MRSA por três características principais: primeiro, as populações afetadas são mais jovens e geralmente mais saudáveis, sem fatores de risco previamente definidos; segundo, presença de clones epidêmicos, classificados como USA300 ou USA400; terceiro, clones de CA‐MRSA contêm um mecanismo de resistência produzida via SCCmec IVa (presente em 84% das cepas de CA‐MARS) com produção de leucocidina de Panton‐Valentine (PVL), a qual determina grande destruição tecidual, leva a quadros de IPPM graves e de pneumonia necrosante.66–69 Importante destacar que a via SCCmec IV promove resistência aos antibióticos β‐lactâmicos em geral, mas não a outros antibióticos, difere das infecções por HA‐MRSA, que geralmente apresentam resistência a várias classes de antibióticos.70
Embora a infecção por CA‐MRSA não esteja associada aos fatores de risco do HA‐MRSA, há grupos de maior risco para desenvolver infecção por tal agente bacteriano, tais como adultos jovens, pessoas em sistemas carcerários, americanos negros, usuários de drogas ilícitas, atletas, indígenas, pessoas com HIV/Aids e homens que fazem sexo com homens.71
CA‐MRSA está predominantemente relacionado à IPPM de diferentes graus de gravidade, mas às vezes causa pneumonia, infecções ósseas e articulares graves e fatais.58,72
O termo IPPM é genérico e pode ser aplicado a uma ampla variedade de infecções, inclusive impetigo, foliculite, furunculose, celulite e abscesso. O foco desta revisão será para os quadros de furunculose e abscessos, devido à característica de formação de coleções e exsudação purulenta, os quais são frequentemente causados por MRSA.73
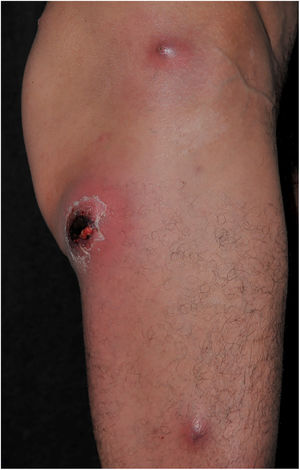
O furúnculo acomete principalmente áreas ricas em folículos pilosos, como axilas e região glútea, com formação de abcessos na hipoderme. Os folículos pilosos são a porta de entrada para S. aureus, favorecem seu desenvolvimento. Geralmente se apresenta como nódulo eritematoso, doloroso e flutuante, com pústulas na superfície e ponto de drenagem. Podem ocorrer uma única ou múltiplas lesões concomitantes (fig. 10).
Antraz corresponde à coalescência de dois ou mais furúnculos no mesmo lócus, com múltiplos tratos sinusais de drenagem, e tende a se estender mais profundamente na hipoderme (fig. 11). Sintomas sistêmicos geralmente estão presentes e pode ocorrer linfadenopatia regional. O antraz pode surgir em qualquer local com pelos; entretanto, é mais comum na região cervical posterior, dorso e coxas.74 São considerados fatores predisponentes para desenvolvimento de furúnculos, inclusive de repetição: eczema, diabetes mellitus, etilismo, desnutrição, imunodeficiência, obesidade, má higiene, colonização crônica por MRSA, hiperidrose e anemia.75
Abscessos cutâneos são coleções focais de pus localizado na derme e hipoderme, que geralmente se apresentam como nódulos ou nodosidades dolorosas, eritematosas, muitas vezes encimados por pústula e com borda eritemato‐edematosa. Muitas vezes se apresentam com pontos de flutuação ou sinais de drenagem espontânea. Nas fases iniciais e quando mais profundos, podem não apresentar o sinal clássico de flutuação. Associadamente, pode ocorrer celulite que se estende radialmente a partir do foco purulento.73 O S. aureus é isolado em cerca de 60% a 75% dos casos de abscessos cutâneos não complicados, dos quais 50% a 70% são MRSA. Staphylococcus coagulase‐negativo é a próxima espécie mais isolada, seguida por uma variedade de espécies estreptocócicas β‐hemolíticas.76 São considerados fatores de risco para abscessos recorrentes: injeções intramusculares; depilação das pernas, axilas e púbis e couro cabeludo; e colonização ou infecção prévia com CA‐MRSA.
O diagnóstico de furunculoses e abscesso é basicamente clínico, mas a ultrassonografia pode ser complemento útil nos casos de abscesso em que a flutuação está ausente ou difícil de localizar.77 Quando possível, deve‐se fazer realizar a coleta do exsudato purulento para cultura e antibiograma com a finalidade de melhor orientar a conduta.
O tratamento de furúnculos isolados e pequenos pode ser feito com antibióticos tópicos, ácido fusídico ou mupirocina, três vezes ao dia por 7 a 10 dias. Deve‐se evitar a expressão precoce da lesão; entretanto, a drenagem cirúrgica deve ser feita na fase de flutuação. Já para furúnculos maiores, antraz e abscessos, está fortemente recomendada a incisão e drenagem quando estão na fase de flutuação.78 A incisão e a drenagem envolvem uma única incisão linear seguida de dissecção sem corte. Aspiração por agulha demonstrou ser geralmente inferior à incisão e drenagem dos abscessos. No entanto, a aspiração por agulha pode ser preferida na face em razão dos melhores resultados cosméticos. Antibioticoterapia sistêmica está indicada como terapia adjuvante e obrigatória quando há halo eritematoso ≥ 2cm ao redor do furúnculo e em casos de antraz. Como já mencionado, o CA‐MRSA é resistente aos antibióticos β‐lactâmicos, como as penicilinas, cefalosporinas de primeira a quarta gerações, carbapenêmicos e monobactans. A resistência às cefalosporinas é relevante para a prática clínica, pois estão entre os antimicrobianos mais usados para tratamento de IPPM e pneumonias adquiridas na comunidade. Portanto, infecções por CA‐MRSA podem não ser tratáveis por grande parte dos esquemas terapêuticos empiricamente usados para tais infecções79. Os antibióticos indicados são aqueles com ação contra MRSA, como sulfametoxazol + trimetoprim ou clindamicina por pelo menos 7 dias nos casos não complicados, e vancomicina ou daptomicina nos casos complicados – ou seja, com comprometimento extenso, toxicidade e imunocomprometidos.78,80,81
Comentário finalDo exposto, saliente‐se que o treinamento semiológico e o conhecimento prático e teórico de enfermidades aqui descritas e de outras que possam ser consideradas como diferenciais faz do dermatologista elemento chave na suspeita, no diagnóstico precoce e no tratamento/encaminhamento de IPPM potencialmente graves e mesmo fatais.
Suporte financeiroNenhum.
Contribuição dos autoresSilvio Alencar Marques: Concepção e planejamento do estudo; elaboração e redação do manuscrito; revisão crítica da literatura; revisão crítica do manuscrito; aprovação da versão final do manuscrito.
Luciana Patrícia Fernandes Abbade: Elaboração e redação do manuscrito; revisão crítica da literatura; revisão crítica do manuscrito; aprovação da versão final do manuscrito.
Conflitos de interesseNenhum.
A Eliete Correia Soares, fotógrafa da Disciplina de Dermatologia da FMB‐Unesp, pela documentação de vários dos casos demonstrados neste artigo. Ao Dr. Hamilton Ometto Stolf, pela atenção médica compartilhada a casos citados neste artigo e por seu entusiasmo no estudo das emergências clínico‐cirúrgicas em dermatologia.
GABARITO Síndrome pós‐finasterida. An Bras Dermatol. 2020;95(3):271‐277.