Os imunobiológicos são terapia cada vez mais importante no contexto das doenças inflamatórias, principalmente na dermatologia, com inúmeros medicamentos aprovados.1,2 Entretanto, o uso desses agentes está associado a efeitos imunossupressores e, consequentemente, aumenta o risco de reativação de infecções latentes, como a tuberculose (TB).2
Diretrizes recentes recomendam a realização de triagem para TB antes do início do tratamento com qualquer agente imunobiológico, utilizando o teste tuberculínico (TT) ou o ensaio de liberação de interferon‐gama (IGRA, do inglês interferon‐gamma release assay), e deve ser repetido anualmente em pacientes de alto risco. Nos pacientes que não são considerados de alto risco, essa triagem é particularmente importante para aqueles que recebem agentes anti‐fator de necrose tumoral (TNF).3 Apesar da recomendação, isso não é feito com frequência na prática. O objetivo do presente estudo foi avaliar a prevalência de infecção por TB (avaliada por TT) em pacientes recebendo terapia imunobiológica para psoríase.
Este estudo foi realizado no Hospital Regional de Presidente Prudente, SP, Brasil, e foi iniciado após a aprovação do projeto pelo Comitê de Ética em Pesquisa da Universidade do Oeste Paulista (Protocolo: 65581122.0.0000.5515 – 18 de dezembro de 2023); apenas aqueles que assinaram o termo de consentimento livre e esclarecido foram incluídos. Foram incluídos pacientes com 18 anos ou mais, com diagnóstico de psoríase, que estavam em uso de imunobiológicos há pelo menos seis meses e que haviam realizado TT antes do início do tratamento. Foram excluídos pacientes com doenças imunossupressoras ou histórico de TB.
O resultado do TT foi considerado negativo quando não houve formação de induração ou se esta foi <5mm. A presença de induração com diâmetro ≥ 5mm quando o TT anterior foi 0 ou um aumento de 10mm ou mais em relação ao valor do TT anterior, quando positivo, foi considerado indicativo de resultado positivo. Esses valores foram utilizados com base nas diretrizes do Ministério da Saúde do Brasil.4,5 Embora o IGRA seja um teste com maior especificidade no diagnóstico da infecção latente por tuberculose (ILTB), ele tem alto custo e atualmente está disponível no Brasil pelo Sistema Único de Saúde (SUS) apenas para algumas condições selecionadas.6
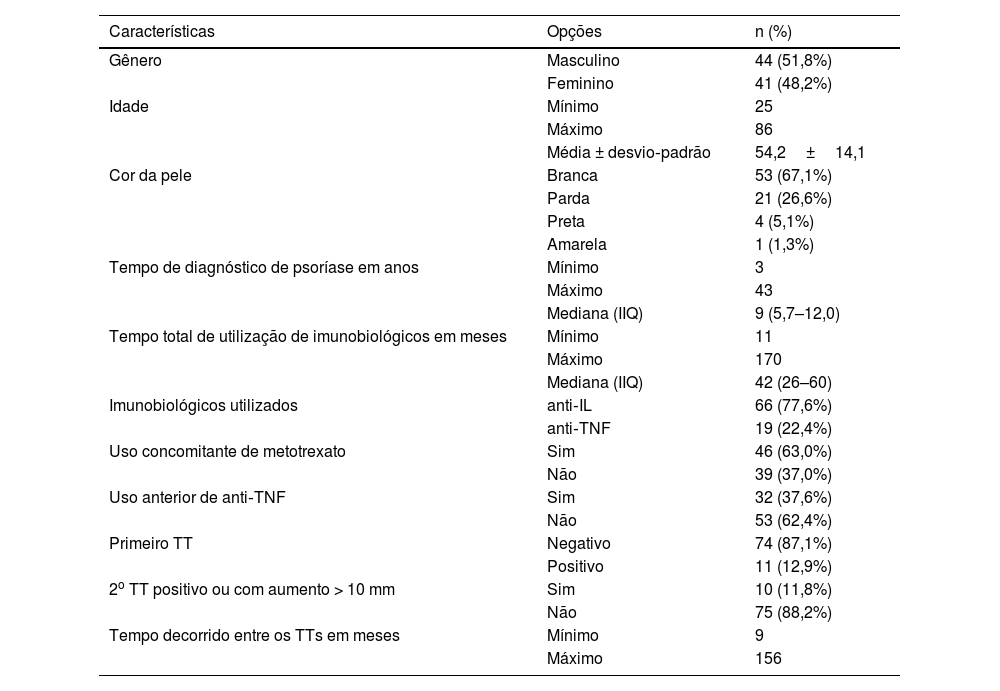
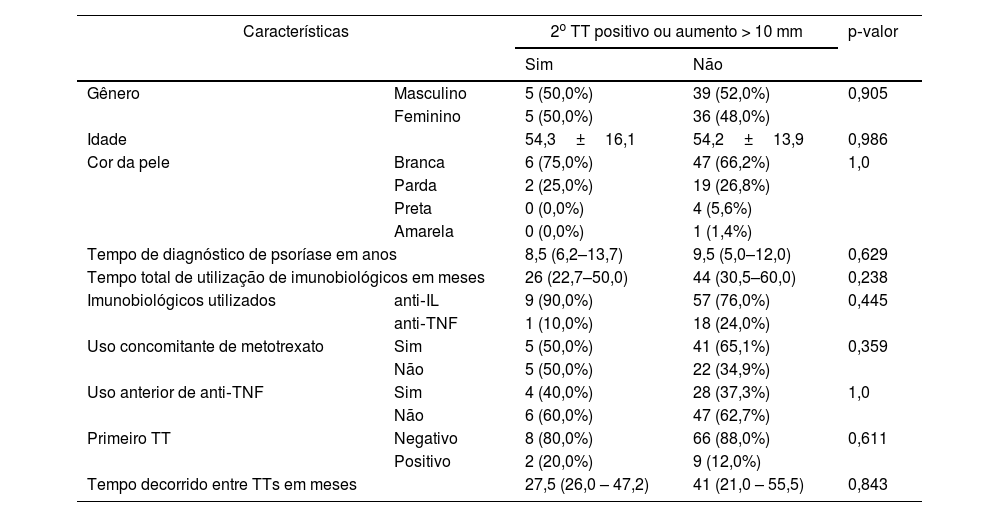
Foram avaliados 85 pacientes com psoríase. Os imunobiológicos utilizados foram agentes anti‐interleucina (IL) (77,6%), com 25 pacientes em uso de ustequinumabe, 30 em uso de secuquinumabe e 11 em uso de risanquizumabe, e agentes anti‐TNF (22,4%), com 18 pacientes em uso de adalimumabe e um paciente em uso de etanercepte. Em 46 pacientes (63%) houve uso concomitante de metotrexato. A tabela 1 apresenta as características demográficas e clínicas dos pacientes com psoríase. A tabela 2 apresenta os dados sobre as características dos pacientes com resultados positivos para o segundo TT. Não foram observadas associações estatisticamente significantes para nenhuma das características avaliadas.
Características demográficas e clínicas de pacientes com psoríase em uso de imunobiológicos
| Características | Opções | n (%) |
|---|---|---|
| Gênero | Masculino | 44 (51,8%) |
| Feminino | 41 (48,2%) | |
| Idade | Mínimo | 25 |
| Máximo | 86 | |
| Média ± desvio‐padrão | 54,2±14,1 | |
| Cor da pele | Branca | 53 (67,1%) |
| Parda | 21 (26,6%) | |
| Preta | 4 (5,1%) | |
| Amarela | 1 (1,3%) | |
| Tempo de diagnóstico de psoríase em anos | Mínimo | 3 |
| Máximo | 43 | |
| Mediana (IIQ) | 9 (5,7–12,0) | |
| Tempo total de utilização de imunobiológicos em meses | Mínimo | 11 |
| Máximo | 170 | |
| Mediana (IIQ) | 42 (26–60) | |
| Imunobiológicos utilizados | anti‐IL | 66 (77,6%) |
| anti‐TNF | 19 (22,4%) | |
| Uso concomitante de metotrexato | Sim | 46 (63,0%) |
| Não | 39 (37,0%) | |
| Uso anterior de anti‐TNF | Sim | 32 (37,6%) |
| Não | 53 (62,4%) | |
| Primeiro TT | Negativo | 74 (87,1%) |
| Positivo | 11 (12,9%) | |
| 2o TT positivo ou com aumento > 10 mm | Sim | 10 (11,8%) |
| Não | 75 (88,2%) | |
| Tempo decorrido entre os TTs em meses | Mínimo | 9 |
| Máximo | 156 |
TT, teste tuberculínico; IIQ, intervalo interquartil.
Nota: Valores apresentados na forma de frequências simples e porcentagens para variáveis categóricas, e para variáveis quantitativas como média±desvio padrão para aquelas que apresentaram normalidade e mediana (IIQ) para aquelas que não apresentaram normalidade. Porcentagens e medidas de resumo calculadas para o total de respostas válidas para cada variável.
Associação entre o resultado positivo do 2° teste tuberculínico ou aumento > 10mm com características demográficas e clínicas de pacientes com psoríase em uso de imunobiológicos
| Características | 2o TT positivo ou aumento > 10 mm | p‐valor | ||
|---|---|---|---|---|
| Sim | Não | |||
| Gênero | Masculino | 5 (50,0%) | 39 (52,0%) | 0,905 |
| Feminino | 5 (50,0%) | 36 (48,0%) | ||
| Idade | 54,3±16,1 | 54,2±13,9 | 0,986 | |
| Cor da pele | Branca | 6 (75,0%) | 47 (66,2%) | 1,0 |
| Parda | 2 (25,0%) | 19 (26,8%) | ||
| Preta | 0 (0,0%) | 4 (5,6%) | ||
| Amarela | 0 (0,0%) | 1 (1,4%) | ||
| Tempo de diagnóstico de psoríase em anos | 8,5 (6,2–13,7) | 9,5 (5,0–12,0) | 0,629 | |
| Tempo total de utilização de imunobiológicos em meses | 26 (22,7–50,0) | 44 (30,5–60,0) | 0,238 | |
| Imunobiológicos utilizados | anti‐IL | 9 (90,0%) | 57 (76,0%) | 0,445 |
| anti‐TNF | 1 (10,0%) | 18 (24,0%) | ||
| Uso concomitante de metotrexato | Sim | 5 (50,0%) | 41 (65,1%) | 0,359 |
| Não | 5 (50,0%) | 22 (34,9%) | ||
| Uso anterior de anti‐TNF | Sim | 4 (40,0%) | 28 (37,3%) | 1,0 |
| Não | 6 (60,0%) | 47 (62,7%) | ||
| Primeiro TT | Negativo | 8 (80,0%) | 66 (88,0%) | 0,611 |
| Positivo | 2 (20,0%) | 9 (12,0%) | ||
| Tempo decorrido entre TTs em meses | 27,5 (26,0 – 47,2) | 41 (21,0 – 55,5) | 0,843 | |
TT, teste tuberculínico.
Nota: Valores apresentados como média±desvio padrão para a variável idade, mediana (IIQ) para as demais características quantitativas e frequências simples (%) para as variáveis categóricas. Valores de p referentes ao teste Qui‐quadrado ou exato de Fisher (quando apropriado) para variáveis categóricas, teste de Mann‐Whitney para comparação entre medianas e teste t de Student para idade.
O segundo TT foi positivo, com diagnóstico de ILTB em 10 pacientes (11,7%), dos quais nove usavam um agente anti‐IL (cinco secuquinumabe, três ustequinumabe e um risanquizumabe) e apenas um paciente usava um agente anti‐TNF (adalimumabe). Apesar de a maior prevalência de ILTB ser observada em pacientes em uso de anti‐ILs, não houve significância estatística, provavelmente porque a grande maioria dos pacientes incluídos no estudo estava em uso de anti‐ILs. Esse resultado é semelhante ao observado em outro estudo também realizado no Brasil com pacientes reumatológicos em uso de anti‐TNF, no qual o TT tornou‐se positivo em 12,3% dos pacientes.7
Entre os 10 pacientes que apresentaram resultado positivo no segundo TT, oito apresentaram resultado negativo no primeiro TT, sugerindo que eles podem ter adquirido a infecção durante o uso de imunobiológicos. Isso provavelmente se deve ao fato de que a região onde o estudo foi realizado apresenta alta taxa de prevalência de TB. Entre os nove pacientes positivos que usaram anti‐ILs, quatro já haviam usado um agente anti‐TNF (um infliximabe e três adalimumabe), o que torna impossível inferir qual medicamento foi responsável pela positividade ou se isso ocorreu em virtude da soma dos efeitos das duas terapias. É importante enfatizar que nenhum dos pacientes desenvolveu TB ativa.
O TT tem certas limitações e pode apresentar resultados falso‐positivos em virtude da vacinação com BCG e da exposição a micobactérias não tuberculosas. Os efeitos da vacinação com BCG nos resultados do TT são menores após 15 anos. Portanto, um teste fortemente positivo, com induração ≥ 15mm, tem maior chance de indicar infecção tuberculosa do que ser observado em decorrência da vacina.8 Como a vacina BCG no Brasil é administrada no primeiro ano de vida e os pacientes incluídos neste estudo tinham mais de 18 anos, a positividade observada no TT deve ser entendida como infecção tuberculosa latente real. Além disso, a maioria dos pacientes apresentou resultados > 15mm, o que também reforça que a positividade do teste foi decorrente de infecção real. Resultados falso‐negativos também podem ocorrer em virtude de problemas com o reagente, a administração ou interpretação imprecisa do teste ou ainda anergia tuberculínica em crianças e pacientes imunocomprometidos, incluindo aqueles que usaram metotrexato.5 Entretanto, essas possibilidades foram consideradas remotas, pois os kits PPD foram utilizados dentro do prazo de validade e mantidos em ambiente adequado, o teste foi realizado por profissional treinado e a única causa de imunossupressão nesses pacientes era o uso prévio ou atual de metotrexato e imunobiológicos.
Uma limitação significante deste estudo é o fato de ele ter sido realizado em uma única instituição e com pequeno tamanho amostral. Outras limitações decorrem de que alguns pacientes utilizaram concomitantemente metotrexato ou usaram agentes anti‐TNF anteriormente, o que pode influenciar o resultado da ILTB.
Em conclusão, o presente estudo demonstra o desenvolvimento de ILTB em importante proporção de pacientes que receberam imunobiológicos. Em contrapartida, nenhum paciente desenvolveu TB ativa, o que pode demonstrar a possível segurança desse grupo de imunobiológicos. Ressalta‐se a necessidade de avaliação periódica da TB durante o tratamento imunobiológico, especialmente em países endêmicos, como os da América Latina, para realizar a detecção precoce e evitar a doença ativa.
Suporte financeiroNenhum.
Contribuição dos autoresMariana Baptista Angeluci: Concepção e desenho do estudo; levantamento, análise e interpretação dos dados; redação do artigo; revisão crítica da literatura; aprovação da versão final do manuscrito.
Marilda Aparecida Milanez Morgado de Abreu: Concepção e desenho do estudo; redação do artigo; obtenção, análise e interpretação dos dados; participação efetiva na orientação da pesquisa; aprovação da versão final do manuscrito.
Ana Cláudia Cavalcante Esposito Lemos: Concepção e o desenho do estudo; participação efetiva na orientação da pesquisa; aprovação da versão final do manuscrito.
Eduardo Vinicius Mendes Roncada: Levantamento de dados; participação efetiva na orientação da pesquisa; aprovação da versão final do manuscrito.
Cristhiana Kise Saito: Análise e interpretação dos dados; redação do artigo; aprovação da versão final do manuscrito.
Felipe Puga Barbosa: Levantamento de dados; análise estatística; aprovação da versão final do manuscrito.
Conflito de interessesNenhum.
Como citar este artigo: Angeluci MB, Abreu MAMM, Lemos ACCE, Roncada EVM, Saito CK. Barbosa FP. Latent tuberculosis infection in patients with psoriasis using immunobiologicals: an observational study. An Bras Dermatol. 2025;100. https://doi.org/10.1016/j.abd.2024.09.011
Trabalho realizado no Departamento de Dermatologia, Hospital Regional de Presidente Prudente, Universidade do Oeste Paulista, Presidente Prudente, SP, Brasil.