A talidomida é a medicação de escolha para o tratamento de reações hansênicas tipo 2 e frequentemente é associada aos corticosteroides. O uso dessas medicações no mieloma múltiplo está associado a risco de eventos cardiovasculares, porém há escassez de estudos que avaliem esse risco em pacientes hansenianos.
ObjetivoAvaliar a ocorrência de eventos cardiovasculares em pacientes com hanseníase multibacilar e sua relação com o uso de talidomida e prednisona.
MétodosEstudo transversal analítico envolvendo todos os pacientes com diagnóstico de hanseníase multibacilar atendidos no serviço de Dermatologia entre os anos 2012 e 2022, por meio de prontuário eletrônico. Foram considerados eventos vasculares tromboembólicos tanto arteriais quanto venosos, incluindo infarto agudo do miocárdio. A variável independente principal foi o uso concomitante de talidomida e prednisona durante o seguimento.
ResultadosForam incluídos 89 pacientes, dos quais 19 utilizaram talidomida e prednisona concomitantemente. Houve cinco eventos (26,3%) cardiovasculares, três deles foram trombose venosa profunda. O uso combinado dos dois medicamentos esteve associado aos eventos (RP=6,46 [3,92–10,65]; p<0,01).
Limitações do estudoNúmero reduzido de eventos, estudo monocêntrico retrospectivo.
ConclusãoCorrobora‐se a hipótese de associação entre eventos cardiovasculares e o uso concomitante de talidomida e prednisona, contudo há necessidade de estudos prospectivos mais robustos para melhor esclarecimento.
A hanseníase é doença infectocontagiosa causada por Mycobacterium leprae, com evolução crônica frequentemente interrompida por períodos de agudização de sintomas, denominados reações hansênicas. A doença apresenta espectro variado de manifestações clínicas dependendo do padrão de resposta imune predominante do hospedeiro contra o bacilo. As reações hansênicas do tipo 2, ou eritema nodoso hansênico, ocorrem em pacientes com a forma multibacilar da doença e podem persistir ou recorrer por vários anos após o término do tratamento antimicrobiano.1,2
Atualmente, a talidomida é um dos medicamentos mais utilizados para essa condição, por ser efetiva e apresentar menores efeitos adversos em longo prazo, quando comparada aos corticosteroides ou outros imunossupressores.3 Por outro lado, o uso dessa medicação e seus similares no tratamento do mieloma múltiplo, principalmente quando associada a corticosteroides e quimioterápicos, demonstrou risco aumentado para eventos vasculares tromboembólicos.4
Até recentemente, atribuía‐se esse risco à doença hematológica de base; por outro lado, principalmente nas últimas duas décadas, diversos relatos de eventos tromboembólicos em pacientes utilizando talidomida e corticosteroides em associação com outras condições que não mieloma múltiplo foram publicados, ressaltando‐se diversos casos em pacientes de hanseníase.5–7
Recentemente, um estudo transversal realizado no estado de Minas Gerais evidenciou a prevalência de trombose venosa profunda (TVP) em 10% dos casos de efeitos adversos à talidomida. Dos dez pacientes que sofreram o efeito tromboembólico, nove fizeram uso concomitante de prednisona.8
A fim de explorar essa associação, realizamos estudo transversal analítico incluindo todos os pacientes de hanseníase multibacilar atendidos no Serviço de Dermatologia do Hospital das Clínicas da Faculdade de Medicina de Botucatu ‐ UNESP e seguidos por pelo menos quatro meses, visto que as reações hansênicas tipo 2 e o uso da talidomida normalmente se iniciam após o início da poliquimioterapia e os fenômenos trombóticos foram relatados ocorrerem em média 45 a 90 dias após o uso da medicação em pacientes oncológicos.9
MétodosOs dados foram obtidos entre fevereiro de 2020 e janeiro de 2022 por meio de pesquisa em prontuário eletrônico de pacientes atendidos no ambulatório de hanseníase do respectivo serviço de dermatologia entre os anos de 2012 e 2021, após aprovação do Comitê de Ética em Pesquisa (CAAE: 57896422.6.0000.5411 | Parecer 5.410.411). Foram excluídos pacientes com seguimento curto (menos de quatro meses) e paucibacilares, assim como aqueles sem diagnóstico estabelecido para hanseníase. Foram considerados os eventos cardiovasculares (ECV) tanto arteriais quanto venosos. O tempo de seguimento foi definido até o final do acompanhamento dermatológico com alta ambulatorial, ou até a ocorrência de um evento tromboembólico. Os dados coletados foram sexo, idade ao início do tratamento, tempo de seguimento, ocorrência de evento, tipo de evento, uso de talidomida durante o seguimento associada ou não a corticosteroides, relato de hipertensão arterial sistêmica (HAS), diabetes mellitus (DM) ou tabagismo durante o seguimento.
ResultadosForam incluídos no estudo 89 pacientes multibacilares, com idade média de 55 (±14) anos, dos quais 68,5% eram homens, acompanhados por período mediano de 39 (1 q‐3 q: 19‐70) meses; 22,5% dos pacientes eram tabagistas, sem associação com sexo (p=0,59). Durante o período estudado, 19 pacientes apresentaram eritema nodoso hansênico em atividade e foram tratados com talidomida e corticosteroide concomitantemente. Desses pacientes, cinco sofreram algum ECV (tabela 1).
Quadro descritivo dos pacientes que sofreram eventos cardiovasculares no período relatado, durante o uso concomitante de talidomida e prednisona*
| Sexo | Idade | Evento | Tabagista | HAS | DM | Tempo de seguimento | Tempo de uso TH |
|---|---|---|---|---|---|---|---|
| Feminino | 38 | TVP ilíaco‐femoral | Não | Sim | Não | 9 m | 2 m |
| Masculino | 45 | TVP membro inferior D | Sim | Não | Não | 70 m | 10 m |
| Masculino | 49 | Infarto esplênico e trombose mural aórtica | Não | Não | Não | 39 m | 6 m |
| Masculino | 54 | IAM | Sim | Sim | Sim | 56 m | 11 m |
| Masculino | 68 | TVP ilíaco‐femoral | Sim | Sim | Não | 74 m | 12 m |
Ocorreram três episódios de trombose venosa profunda (TVP) nos membros inferiores, um infarto agudo do miocárdio e um infarto esplênico com trombose mural aórtica. Todos os eventos observados ocorreram durante o uso combinado das medicações (tabela 2). Nenhum ECV ocorreu no grupo de pacientes que não recebeu as medicações concomitantemente.
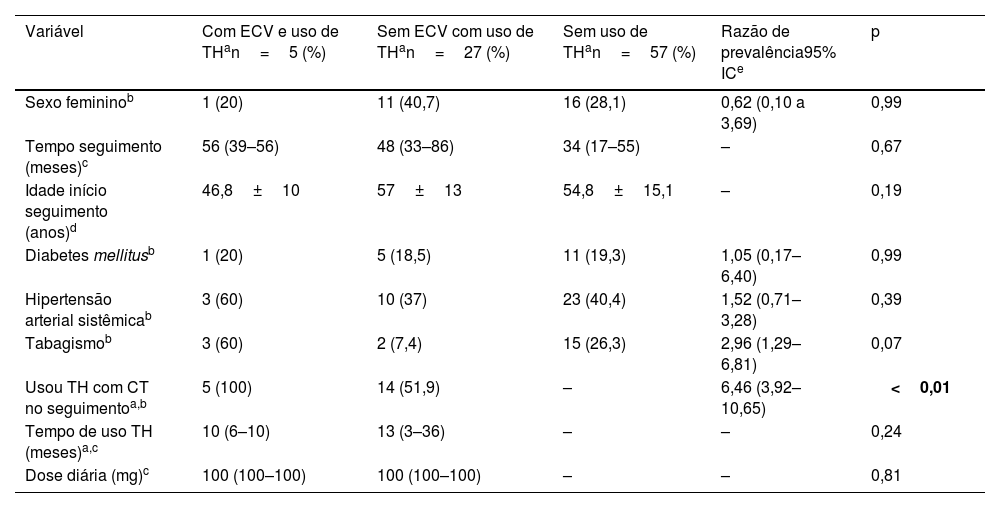
Características dos pacientes hansênicos com ou sem eventos cardiovasculares durante o seguimento no serviço de Dermatologia do Hospital das Clínicas da Faculdade de Medicina de Botucatu – UNESP entre os anos 2012 e 2021
| Variável | Com ECV e uso de THan=5 (%) | Sem ECV com uso de THan=27 (%) | Sem uso de THan=57 (%) | Razão de prevalência95% ICe | p |
|---|---|---|---|---|---|
| Sexo femininob | 1 (20) | 11 (40,7) | 16 (28,1) | 0,62 (0,10 a 3,69) | 0,99 |
| Tempo seguimento (meses)c | 56 (39–56) | 48 (33–86) | 34 (17–55) | – | 0,67 |
| Idade início seguimento (anos)d | 46,8±10 | 57±13 | 54,8±15,1 | – | 0,19 |
| Diabetes mellitusb | 1 (20) | 5 (18,5) | 11 (19,3) | 1,05 (0,17–6,40) | 0,99 |
| Hipertensão arterial sistêmicab | 3 (60) | 10 (37) | 23 (40,4) | 1,52 (0,71–3,28) | 0,39 |
| Tabagismob | 3 (60) | 2 (7,4) | 15 (26,3) | 2,96 (1,29–6,81) | 0,07 |
| Usou TH com CT no seguimentoa,b | 5 (100) | 14 (51,9) | – | 6,46 (3,92–10,65) | <0,01 |
| Tempo de uso TH (meses)a,c | 10 (6–10) | 13 (3–36) | – | – | 0,24 |
| Dose diária (mg)c | 100 (100–100) | 100 (100–100) | – | – | 0,81 |
Além disso, ressalta‐se a alta prevalência de tabagismo nos casos de ECV, que apesar de elevada não foi estatisticamente significante (p=0,07). Por outro lado, entre os usuários de talidomida, o tabagismo esteve associado à ocorrência de ECV (60%×7,4%; p=0,02 – teste exato de Fisher).
DiscussãoNo presente estudo, identificamos taxa de 26,3% (5/19) de ECV e 15,8% (3/19) de TVP em pacientes hansenianos que receberam talidomida e prednisona conjuntamente; no entanto, considerando todos os usuários de talidomida, as taxas foram de 15,6% (5/32) e 9,4% (3/32), respectivamente. Também devemos observar que muitos desses pacientes eram tabagistas. Por outro lado, em pacientes de mieloma múltiplo recebendo talidomida e dexametasona o risco de TVP sem profilaxia foi relatado em até 25%, o que se aproxima de nossos resultados.4
Nas últimas décadas, acumularam‐se relatos de casos de eventos vasculares tromboembólicos durante o uso concomitante das medicações estudadas em pacientes de hanseníase. Porto et al. (2019) relataram 16 casos de TVP, a maioria em homens, como em nossa amostra, de modo que recomendam a profilaxia com AAS 100mg/dia quando dessa associação.10 Somado a este relato, existem diversos outros semelhantes, porém provenientes de diferentes países.6,7,11,12
Sharma et al. avaliaram a segurança do uso de talidomida em 25 pacientes com diferentes doenças dermatológicas, tendo observado cinco casos (20%) de TVP.13 A fisiopatologia dos efeitos tromboembólicos da talidomida não é totalmente compreendida, porém em estudos com animais observou‐se a redução do tempo de sangramento, de trombina e de protrombina e aumento dos níveis séricos do fator IX e fibrinogênio.14 Por outro lado, é frequente o achado de anticorpos antifosfolípides (AAF) em pacientes hansenianos.15 Um estudo de 2018 observou a presença de AAF em seis de sete pacientes com hanseníase multibacilar que apresentaram evento tromboembólico.16 Associação da persistência de AAF com a idade, carga bacilar e forma clínica em pacientes com hanseníase também já foi relatada.17 Apesar de a maioria dos relatos de eventos vasculares com o uso da talidomida serem venosos, há relatos de eventos arteriais em pacientes utilizando talidomida para mieloma múltiplo.18 Do mesmo modo, em estudo com pacientes com mieloma múltiplo em uso de talidomida foram observados sete eventos tromboembólicos entre 23 pacientes, dois desses eventos foram arteriais.19
O presente estudo apresenta limitações por ser monocêntrico, retrospectivo e identificar número reduzido de eventos, porém demonstra resultados concordantes com a literatura, extendendo as observações provenientes de outras condições clínicas, como o mieloma múltiplo.
ConclusãoPacientes hansenianos multibacilares em tratamento de reação tipo 2 com talidomida e corticosteroides apresentam risco significante de ECV, devendo‐se estar atento a sinais sugestivos desses eventos, principalmente em pacientes com fatores de risco adicionais para ECV, como o tabagismo. Estudos prospectivos são necessários para esclarecer essas observações, assim como avaliar o benefício de medidas profiláticas para esses eventos em pacientes hansenianos.
Suporte financeiroNenhum.
Contribuição dos autoresMelissa de Almeida Corrêa Alfredo: Elaboração do texto; participação efetiva na propedêutica; revisão de literatura; revisão crítica do manuscrito.
Juliano Vilaverde Schmitt: Elaboração do texto; participação efetiva na orientação; participação efetiva na propedêutica; revisão de literatura; revisão crítica do manuscrito; participação efetiva na orientação; aprovação do manuscrito.
Anna Carolina Miola: Participação efetiva na coleta de dados; elaboração do texto; participação efetiva na propedêutica; revisão de literatura; revisão crítica do manuscrito; aprovação do manuscrito.
Simone de Pádua Milagres: Participação efetiva na coleta de dados; elaboração do texto; participação efetiva na propedêutica; revisão de literatura; revisão crítica do manuscrito; aprovação do manuscrito.
Joel Carlos Lastoria: Revisão crítica do manuscrito; participação efetiva na orientação; aprovação do manuscrito.
Conflito de interessesNenhum.
Como citar este artigo: Alfredo MA, Schmitt JV, Miola AC, Milagres SP, Lastoria JC. Cardiovascular events associated with thalidomide and prednisone in leprosy type 2 reaction. An Bras Dermatol. 2024;99:53–6.
Trabalho realizado no Departamento de Infectologia, Dermatologia, Diagnóstico por Imagem e Radioterapia, Faculdade de Medicina, Universidade Estadual Paulista, Botucatu, SP, Brasil.