A sífilis, em suas diferentes fases, pode ser diagnóstico difícil na área clínica e histopatológica.
ObjetivosAvaliar a detecção e a distribuição tecidual de Treponema pallidum nas lesões de pele de sífilis.
MétodoEstudo cego de acurácia diagnóstica foi realizado com imuno‐histoquímica e impregnação por prata de Warthin‐Starry nas amostras de pele de pacientes com sífilis e outras doenças. Os pacientes foram atendidos em dois hospitais terciários entre os anos de 2000 e 2019. Razões de prevalência (RP) e intervalos de confiança (IC) de 95% foram calculados para avaliar associação entre positividade da imuno‐histoquímica e variáveis clínicas‐histopatológicas.
ResultadosTrinta e oito pacientes com sífilis e suas 40 amostras de biópsias foram incluídas para o estudo. Trinta e seis amostras de pele formaram os controles sem sífilis. A técnica de Warthin‐Starry foi incapaz de demonstrar de maneira acurada a bactéria em todas as amostras. A imuno‐histoquímica mostrou espiroquetas apenas em amostras de pele de pacientes de sífilis (24/40) com sensibilidade de 60% (95% IC 44,8‐75,2). A especificidade foi de 100% e a acurácia de 78,9% (95% IC 69,8‐88,1). A maioria dos nossos casos teve espiroquetas tanto na derme quanto na epiderme, com alta carga bacteriana.
Limitações do estudoAs correlações entre imuno‐histoquímica e características clínico‐histopatológicas foram observadas, mas foram limitadas estatisticamente em decorrência do pequeno tamanho da amostra.
ConclusãoEspiroquetas foram prontamente vistas no protocolo de imuno‐histoquímica, o que pode contribuir para o diagnóstico de sífilis em amostras de biópsias cutâneas. Por outro lado, a técnica de Warthin‐Starry mostrou ser de nenhum valor prático.
A sífilis é infecção sexualmente transmissível (IST) curável, em reemergência global nos últimos anos,1 e um grande desafio de saúde pública, particularmente em grupos com comportamento sexual de alto risco. No Brasil, a frequência da sífilis adquirida tem aumentado progressivamente nos últimos 10 anos. Esse aumento atingiu 30,2% em um único ano, entre 2017 e 2018. Entre 2010 e 2018, a taxa de detecção de sífilis em grávidas aumentou de 3,5 a 21,5 casos por mil nascidos vivos.2,3
A doença é causada pela bactéria espiroqueta não cultivável Treponema pallidum subsp. pallidum. O diagnóstico requer correlação entre dados clínicos, incluindo infecções prévias e exposição recente, e testes laboratoriais. O método diagnóstico mais útil para sífilis é o teste sorológico. No entanto, considerando as manifestações clínicas multifacetadas, o exame histopatológico é muito importante quando a sífilis não é considerada inicialmente.
Treponema pallidum é classicamente reportado como sendo identificado pelas técnicas de impregnação por prata como Warthin‐Starry, Levaditi ou Dieterle modificada por Steiner. Entretanto, fundos de marcação inespecífica ou artefatual de elementos teciduais, como fibras reticulares e melanina, representam dificuldades de interpretação que podem originar resultados falso‐positivos ou falso‐negativos.4–7 Recentemente, a marcação por imunoperoxidase com anticorpo policlonal anti‐Treponema pallidum tem mostrado ser um método sensível e útil para realçar e identificar a espiroqueta.6–11 Este estudo foi realizado para avaliar a contribuição da imuno‐histoquímica (IHQ) e técnica de Warthin‐Starry (WS) na visualização da espiroqueta em amostras de biópsias de pele. A correlação dessa visualização com achados clínicos e histopatológicos também foi investigada, a fim de definir o desempenho esperado em diferentes cenários.
MétodosUm estudo de acurácia diagnóstica foi conduzido usando IHQ e técnica de WS para detecção de espiroquetas nas amostras de biópsias de pele. Dados clínicos e sorológicos de pacientes vistos em dois hospitais terciários no Rio de Janeiro entre os anos de 2000 e 2019 foram recuperados de registros médicos. Os pacientes foram classificados com sífilis quando os achados clínicos foram consistentes e os testes sorológicos foram positivos (Veneral Disease Research Laboratory Test [VDRL] com títulos maiores que 1/8 ou teste treponêmico positivo), ou VDRL foi reagente no líquor em qualquer titulação no momento da biópsia de pele e da investigação diagnóstica. Os pacientes com uma ou mais amostras de pele foram incluídos. Um grupo controle foi formado por amostras de pele de pacientes com testes sorológicos não reagentes para sífilis e diagnosticados com outras dermatoses que poderiam ser consideradas nos diagnósticos diferenciais clínicos e histopatológicos da sífilis.
Cortes histológicos de 4μm de espessura foram obtidos de blocos de parafina para coloração de hematoxilina & eosina e WS, de acordo com protocolo de Luna.12 Os laudos histopatológicos foram revisados e as lâminas, reavaliadas. Padrão de reação inflamatória, distribuição do infiltrado, hiperplasia endotelial e semiquantificação dos plasmócitos foram considerados na avaliação das amostras de pele de pacientes com sífilis. Plasmócitos foram codificados como ++/++ quando compunham mais de 30% do infiltrado; +/++, menos do que 30%; e zero quando eram ausentes ou raros.
Cortes histopatológicos adicionais foram obtidos para o estudo imuno‐histoquímico realizado com pré‐tratamento de recuperação de epítopo induzido pelo calor, anticorpo primário policlonal contra T. pallidum (BIOCARE Medical, Califórnia, EUA) em diluição de 1:200 e sistema de detecção polimérica (Novolink Max Polymer Detection System, Leica Biosystems, Illinois, EUA). A análise IHQ foi cega para o diagnóstico e realizada simultânea e consensualmente por dois patologistas com ampla experiência em diagnóstico histopatológico e imuno‐histoquímico de doenças infecciosas, em microscópio óptico Nikon dual head E200. A análise da carga bacteriana foi feita com escala semiquantitativa considerando (3+) numerosas bactérias em todos os campos; (2+) numerosas bactérias em alguns campos; e (1+) raras bactérias.
As análises estatísticas foram realizadas usando o software SPSS versão 20. Razões de prevalência (RP) e seus respectivos intervalos de confiança (IC) de 95% foram calculados para medir a associação entre a positividade da IHQ e as variáveis clínico‐histopatológicas. Os testes de Qui‐quadrado (χ2) e exato de Fisher foram usados para determinar a significância estatística. O nível de significância de 0,05 foi definido.
ResultadosTrinta e oito pacientes (29 homens e 9 mulheres) com idades entre 19 e 66 anos (média: 42 anos, mediana: 39 anos) com sífilis e suas 40 amostras de pele foram incluídos no estudo. A sorologia anti‐HIV foi positiva em 22 pacientes; 10 pacientes demonstravam carga viral> 1.000 cópias/mL; sete pacientes apresentavam contagem de CD4 <200 células/mm3, e seis pacientes tinham ambos. As lesões de pele eram predominantes nos membros superiores (32/38). Vinte e seis pacientes exibiam lesões papulares, e 22 em placas. Outras lesões de pele descritas foram exantemas (10/38), nódulos (10/38) e pústulas ou crostas (8/38). Vinte e nove amostras (72,5%) vieram de pacientes com sífilis secundária.
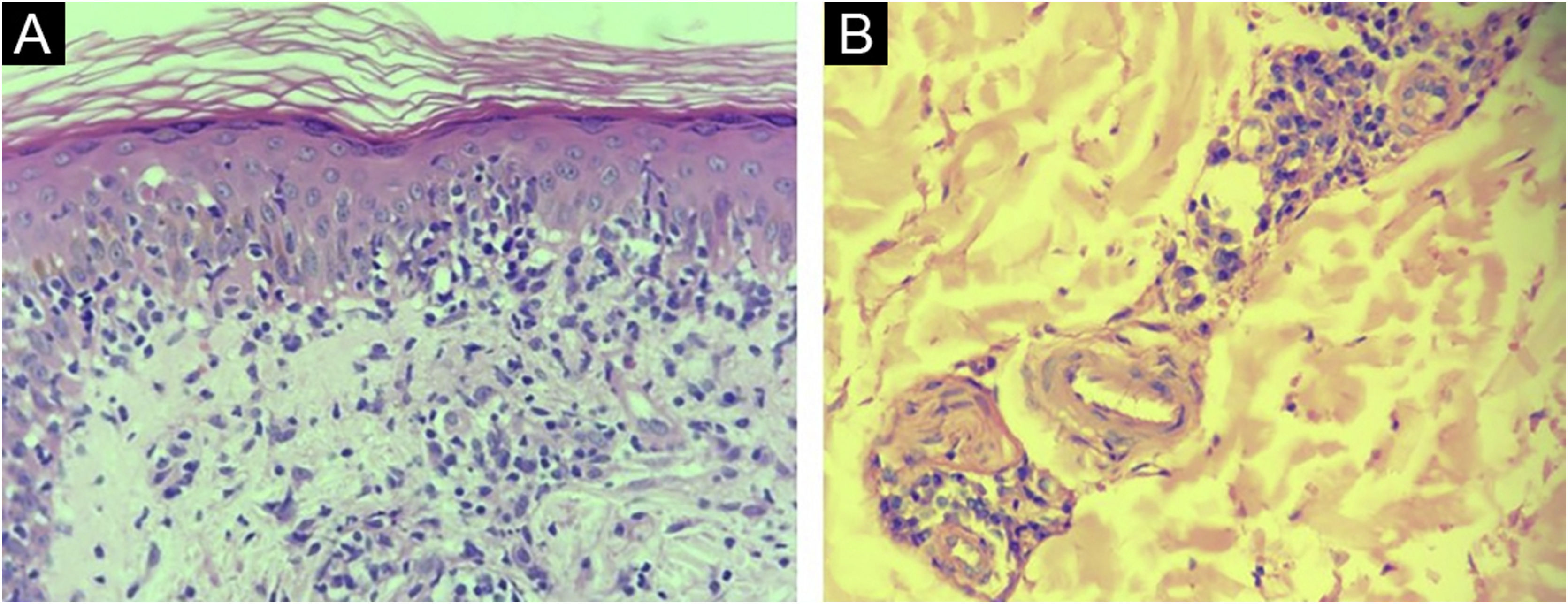
Os laudos histopatológicos de 30/40 (75%) amostras de pacientes com sífilis foram considerados compatíveis com o diagnóstico. Farmacodermia, psoríase, síndrome de Reiter e xantogranuloma foram outros diagnósticos histopatológicos sugeridos. Em cinco laudos (12,5%), nenhuma sugestão de diagnóstico histopatológico foi feita. Os padrões de reação tecidual mais comuns foram dermatite perivascular superficial e profunda e de interface (27,5%), e o achado mais comum foi hiperplasia endotelial (75%) – (fig. 1).
Vinte e seis amostras de pele formaram o grupo controle e eram de pacientes diagnosticados com outras dermatoses (10 farmacodermias, 10 com psoríase, quatro de lúpus eritematoso, quatro eczemas, duas de hanseníase, duas eritrodermias, duas vasculites, uma síndrome de Sweet, e uma líquen plano).
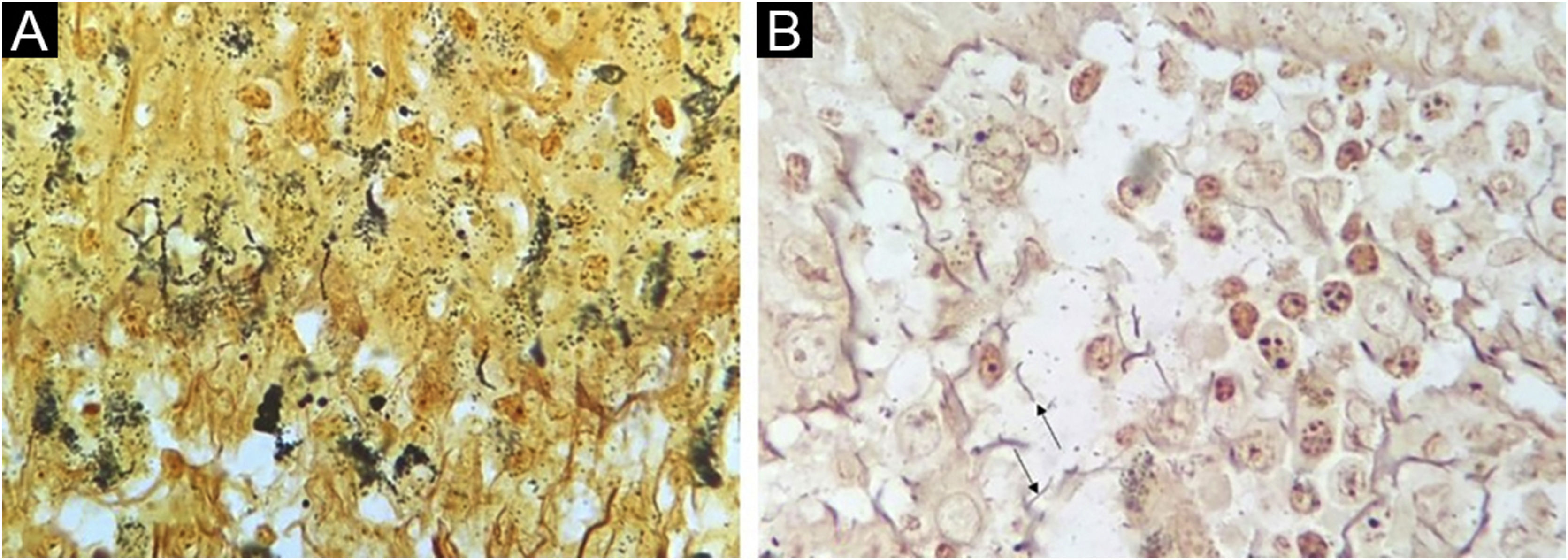
A impregnação pelo WS foi negativa ou inconclusiva em todas as amostras. Um fundo com impregnação de estruturas inespecíficas e de melanina nos dendritos dos melanócitos tornou impossível identificar definitivamente as espiroquetas (fig. 2).
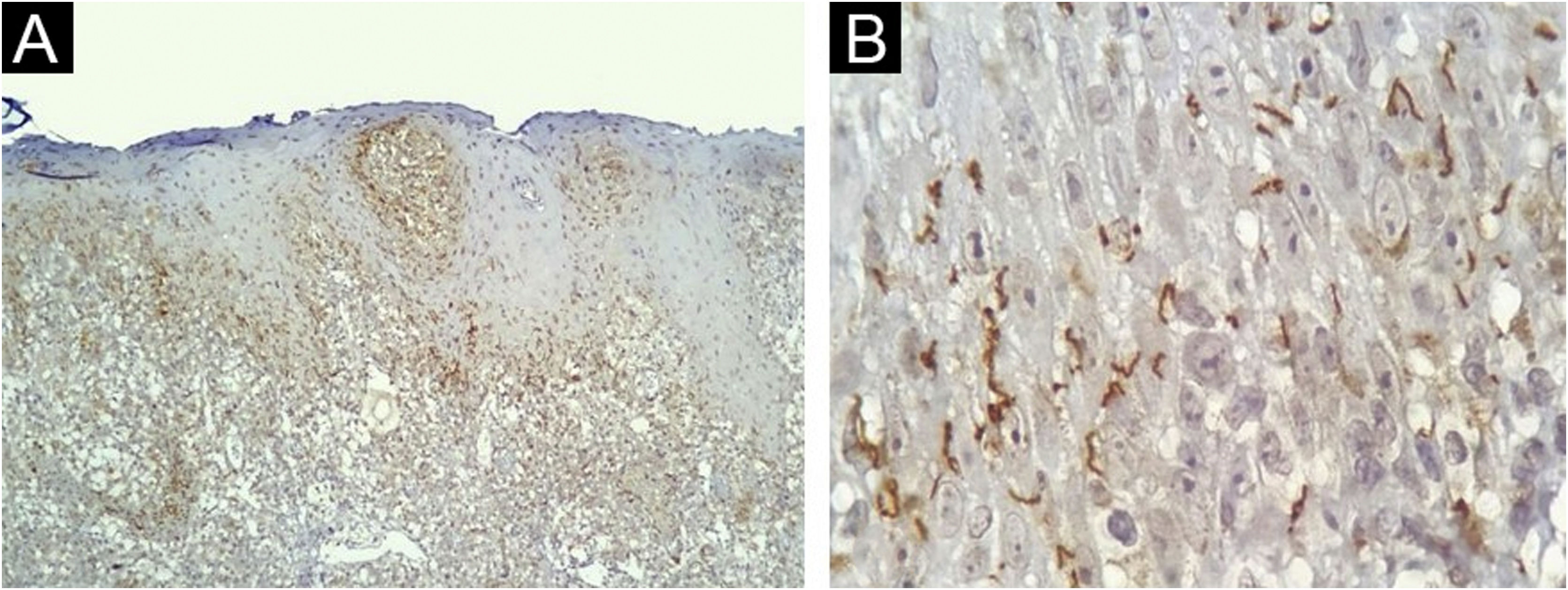
A IHQ foi positiva em 24 das 40 amostras de pele de pacientes com sífilis, e foi negativa em todas as 36 amostras do controle sem sífilis, produzindo sensibilidade de 60% (95% IC 44,8‐75,2), especificidade de 100%, valor preditivo positivo de 100%, valor preditivo negativo de 69,2% (95% IC 56,7‐81,8). A acurácia do teste foi de 78,9% (95% IC 69,8‐88,1). Os diagnósticos histológicos propostos nas amostras positivas de IHQ foram sífilis (17/24); farmacodermia apenas (4/24); farmacodermia e sífilis como hipótese adicional (2/24); síndrome de Reiter (1/24); e nenhuma sugestão histopatológica foi feita em duas amostras. A maioria dos nossos casos apresentava espiroquetas tanto na derme (fig. 3A) quanto na epiderme (fig. 3B). A tabela 1 demonstra os resultados da IHQ.
Pele, achados imuno‐histoquímicos. (A) Espiroquetas na dermoepidérmica e derme papilar (imuno‐histoquímica com anticorpo anti‐Treponema pallidum, 100×). (B) Detalhe da localização das espiroquetas na epiderme baixa (imuno‐histoquímica com anticorpo anti‐Treponema pallidum, 1.000×, ver texto para detalhes técnicos).
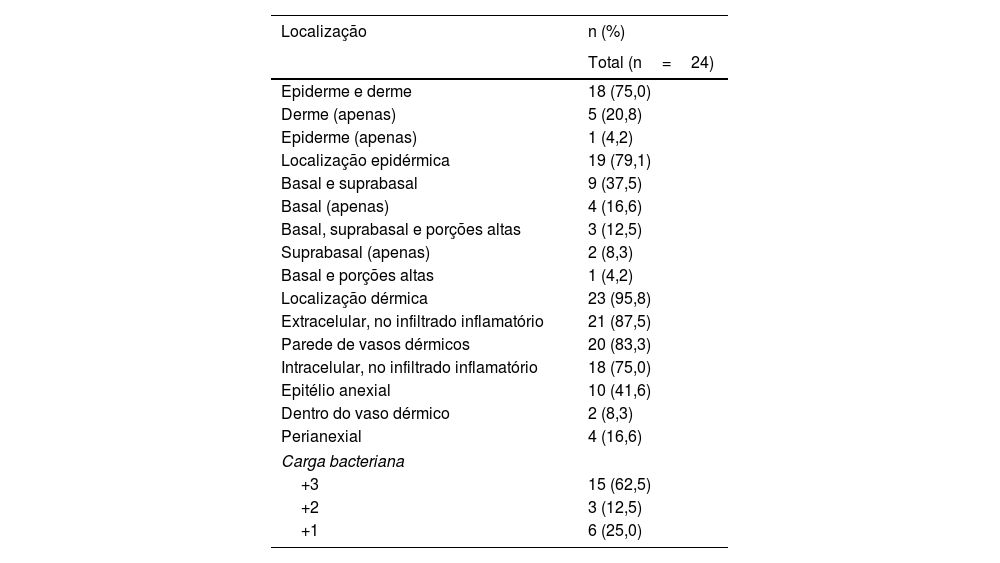
Distribuição e carga bacteriana das espiroquetas nas amostras de pele positivas na imuno‐histoquímica com anticorpo anti‐T. pallidum
| Localização | n (%) |
|---|---|
| Total (n=24) | |
| Epiderme e derme | 18 (75,0) |
| Derme (apenas) | 5 (20,8) |
| Epiderme (apenas) | 1 (4,2) |
| Localização epidérmica | 19 (79,1) |
| Basal e suprabasal | 9 (37,5) |
| Basal (apenas) | 4 (16,6) |
| Basal, suprabasal e porções altas | 3 (12,5) |
| Suprabasal (apenas) | 2 (8,3) |
| Basal e porções altas | 1 (4,2) |
| Localização dérmica | 23 (95,8) |
| Extracelular, no infiltrado inflamatório | 21 (87,5) |
| Parede de vasos dérmicos | 20 (83,3) |
| Intracelular, no infiltrado inflamatório | 18 (75,0) |
| Epitélio anexial | 10 (41,6) |
| Dentro do vaso dérmico | 2 (8,3) |
| Perianexial | 4 (16,6) |
| Carga bacteriana | |
| +3 | 15 (62,5) |
| +2 | 3 (12,5) |
| +1 | 6 (25,0) |
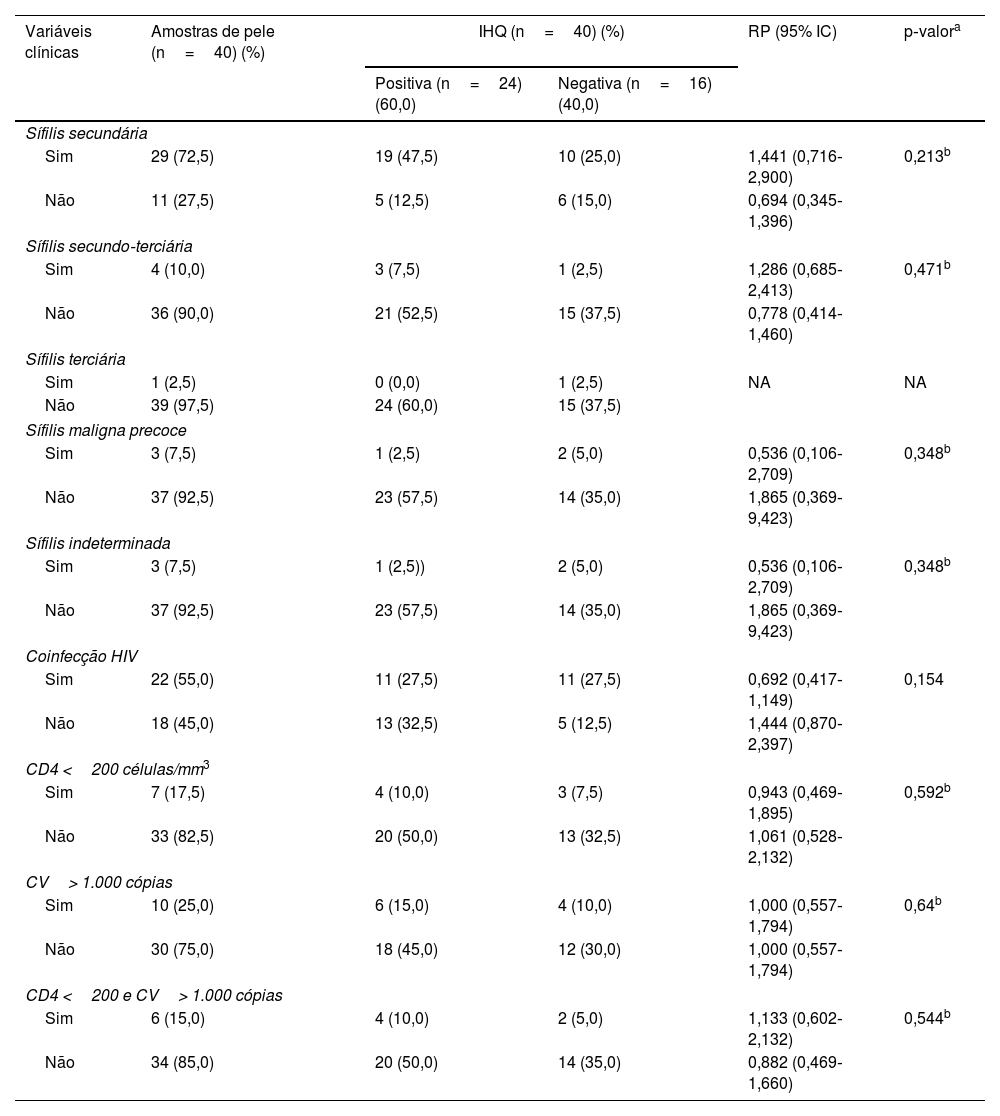
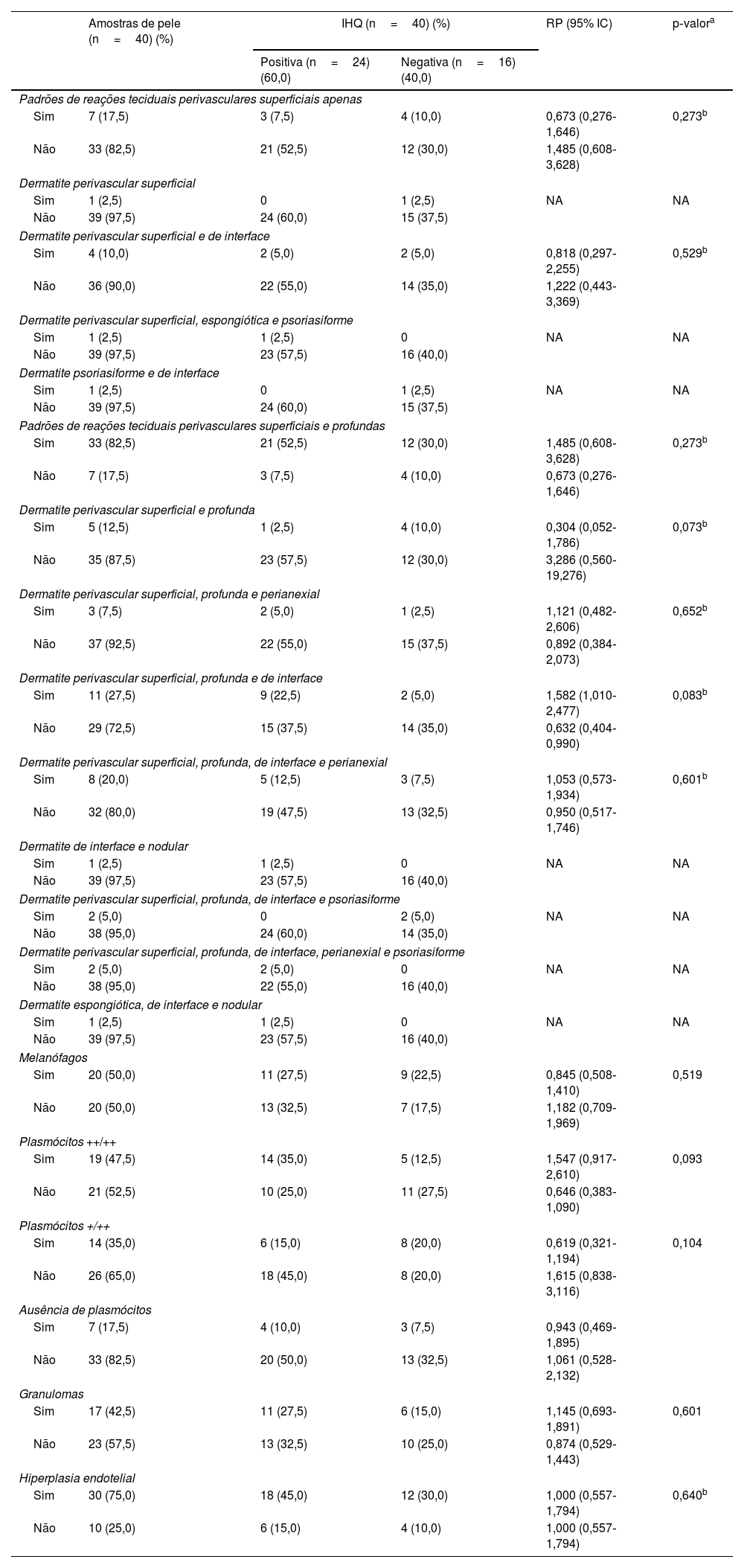
Os resultados da revisão dos dados clínicos e dos achados histopatológicos e suas correlações com a IHQ são apresentados nas tabelas 2 e 3. A IHQ foi frequentemente positiva nas amostras de pacientes com sífilis secundária (RP=1,441) ou com sífilis terciária (RP=1,286), com sorologia anti‐HIV não reagente (RP=1,444) ou em imunossupressão pelo HIV com CD4 <200 células/mm3 e CV>1.000 cópias/mL (RP=1,133). Os resultados positivos também foram mais prevalentes em amostras com dermatite perivascular superficial, profunda e de interface (RP=1,582) ou com plasmócitos abundantes ++/++ (RP=1,547). Amostras com dermatite perivascular superficial e profunda (RP=0,304) ou plasmócitos +/++ (RP=0,619) apresentaram mais resultados negativos na IHQ. Entretanto, essas associações não foram consideradas significantes (p> 0,05).
Associação entre resultados da imuno‐histoquímica com anticorpo anti‐T. pallidum e variáveis clínicas de pacientes com sífilis
| Variáveis clínicas | Amostras de pele (n=40) (%) | IHQ (n=40) (%) | RP (95% IC) | p‐valora | |
|---|---|---|---|---|---|
| Positiva (n=24) (60,0) | Negativa (n=16) (40,0) | ||||
| Sífilis secundária | |||||
| Sim | 29 (72,5) | 19 (47,5) | 10 (25,0) | 1,441 (0,716‐2,900) | 0,213b |
| Não | 11 (27,5) | 5 (12,5) | 6 (15,0) | 0,694 (0,345‐1,396) | |
| Sífilis secundo‐terciária | |||||
| Sim | 4 (10,0) | 3 (7,5) | 1 (2,5) | 1,286 (0,685‐2,413) | 0,471b |
| Não | 36 (90,0) | 21 (52,5) | 15 (37,5) | 0,778 (0,414‐1,460) | |
| Sífilis terciária | |||||
| Sim | 1 (2,5) | 0 (0,0) | 1 (2,5) | NA | NA |
| Não | 39 (97,5) | 24 (60,0) | 15 (37,5) | ||
| Sífilis maligna precoce | |||||
| Sim | 3 (7,5) | 1 (2,5) | 2 (5,0) | 0,536 (0,106‐2,709) | 0,348b |
| Não | 37 (92,5) | 23 (57,5) | 14 (35,0) | 1,865 (0,369‐9,423) | |
| Sífilis indeterminada | |||||
| Sim | 3 (7,5) | 1 (2,5)) | 2 (5,0) | 0,536 (0,106‐2,709) | 0,348b |
| Não | 37 (92,5) | 23 (57,5) | 14 (35,0) | 1,865 (0,369‐9,423) | |
| Coinfecção HIV | |||||
| Sim | 22 (55,0) | 11 (27,5) | 11 (27,5) | 0,692 (0,417‐1,149) | 0,154 |
| Não | 18 (45,0) | 13 (32,5) | 5 (12,5) | 1,444 (0,870‐2,397) | |
| CD4 <200 células/mm3 | |||||
| Sim | 7 (17,5) | 4 (10,0) | 3 (7,5) | 0,943 (0,469‐1,895) | 0,592b |
| Não | 33 (82,5) | 20 (50,0) | 13 (32,5) | 1,061 (0,528‐2,132) | |
| CV> 1.000 cópias | |||||
| Sim | 10 (25,0) | 6 (15,0) | 4 (10,0) | 1,000 (0,557‐1,794) | 0,64b |
| Não | 30 (75,0) | 18 (45,0) | 12 (30,0) | 1,000 (0,557‐1,794) | |
| CD4 <200 e CV> 1.000 cópias | |||||
| Sim | 6 (15,0) | 4 (10,0) | 2 (5,0) | 1,133 (0,602‐2,132) | 0,544b |
| Não | 34 (85,0) | 20 (50,0) | 14 (35,0) | 0,882 (0,469‐1,660) | |
IHQ, imuno‐histoquímica; CV, carga viral HIV; RP, razão de prevalência; 95% IC, intervalo de confiança de 95%; NA, não aplicável, poucos casos.
Associação entre resultados da imuno‐histoquímica com anticorpo anti‐T. pallidum e alterações histopatológicas nas amostras de pele de pacientes com sífilis
| Amostras de pele (n=40) (%) | IHQ (n=40) (%) | RP (95% IC) | p‐valora | ||
|---|---|---|---|---|---|
| Positiva (n=24) (60,0) | Negativa (n=16) (40,0) | ||||
| Padrões de reações teciduais perivasculares superficiais apenas | |||||
| Sim | 7 (17,5) | 3 (7,5) | 4 (10,0) | 0,673 (0,276‐1,646) | 0,273b |
| Não | 33 (82,5) | 21 (52,5) | 12 (30,0) | 1,485 (0,608‐3,628) | |
| Dermatite perivascular superficial | |||||
| Sim | 1 (2,5) | 0 | 1 (2,5) | NA | NA |
| Não | 39 (97,5) | 24 (60,0) | 15 (37,5) | ||
| Dermatite perivascular superficial e de interface | |||||
| Sim | 4 (10,0) | 2 (5,0) | 2 (5,0) | 0,818 (0,297‐2,255) | 0,529b |
| Não | 36 (90,0) | 22 (55,0) | 14 (35,0) | 1,222 (0,443‐3,369) | |
| Dermatite perivascular superficial, espongiótica e psoriasiforme | |||||
| Sim | 1 (2,5) | 1 (2,5) | 0 | NA | NA |
| Não | 39 (97,5) | 23 (57,5) | 16 (40,0) | ||
| Dermatite psoriasiforme e de interface | |||||
| Sim | 1 (2,5) | 0 | 1 (2,5) | NA | NA |
| Não | 39 (97,5) | 24 (60,0) | 15 (37,5) | ||
| Padrões de reações teciduais perivasculares superficiais e profundas | |||||
| Sim | 33 (82,5) | 21 (52,5) | 12 (30,0) | 1,485 (0,608‐3,628) | 0,273b |
| Não | 7 (17,5) | 3 (7,5) | 4 (10,0) | 0,673 (0,276‐1,646) | |
| Dermatite perivascular superficial e profunda | |||||
| Sim | 5 (12,5) | 1 (2,5) | 4 (10,0) | 0,304 (0,052‐1,786) | 0,073b |
| Não | 35 (87,5) | 23 (57,5) | 12 (30,0) | 3,286 (0,560‐19,276) | |
| Dermatite perivascular superficial, profunda e perianexial | |||||
| Sim | 3 (7,5) | 2 (5,0) | 1 (2,5) | 1,121 (0,482‐2,606) | 0,652b |
| Não | 37 (92,5) | 22 (55,0) | 15 (37,5) | 0,892 (0,384‐2,073) | |
| Dermatite perivascular superficial, profunda e de interface | |||||
| Sim | 11 (27,5) | 9 (22,5) | 2 (5,0) | 1,582 (1,010‐2,477) | 0,083b |
| Não | 29 (72,5) | 15 (37,5) | 14 (35,0) | 0,632 (0,404‐0,990) | |
| Dermatite perivascular superficial, profunda, de interface e perianexial | |||||
| Sim | 8 (20,0) | 5 (12,5) | 3 (7,5) | 1,053 (0,573‐1,934) | 0,601b |
| Não | 32 (80,0) | 19 (47,5) | 13 (32,5) | 0,950 (0,517‐1,746) | |
| Dermatite de interface e nodular | |||||
| Sim | 1 (2,5) | 1 (2,5) | 0 | NA | NA |
| Não | 39 (97,5) | 23 (57,5) | 16 (40,0) | ||
| Dermatite perivascular superficial, profunda, de interface e psoriasiforme | |||||
| Sim | 2 (5,0) | 0 | 2 (5,0) | NA | NA |
| Não | 38 (95,0) | 24 (60,0) | 14 (35,0) | ||
| Dermatite perivascular superficial, profunda, de interface, perianexial e psoriasiforme | |||||
| Sim | 2 (5,0) | 2 (5,0) | 0 | NA | NA |
| Não | 38 (95,0) | 22 (55,0) | 16 (40,0) | ||
| Dermatite espongiótica, de interface e nodular | |||||
| Sim | 1 (2,5) | 1 (2,5) | 0 | NA | NA |
| Não | 39 (97,5) | 23 (57,5) | 16 (40,0) | ||
| Melanófagos | |||||
| Sim | 20 (50,0) | 11 (27,5) | 9 (22,5) | 0,845 (0,508‐1,410) | 0,519 |
| Não | 20 (50,0) | 13 (32,5) | 7 (17,5) | 1,182 (0,709‐1,969) | |
| Plasmócitos ++/++ | |||||
| Sim | 19 (47,5) | 14 (35,0) | 5 (12,5) | 1,547 (0,917‐2,610) | 0,093 |
| Não | 21 (52,5) | 10 (25,0) | 11 (27,5) | 0,646 (0,383‐1,090) | |
| Plasmócitos +/++ | |||||
| Sim | 14 (35,0) | 6 (15,0) | 8 (20,0) | 0,619 (0,321‐1,194) | 0,104 |
| Não | 26 (65,0) | 18 (45,0) | 8 (20,0) | 1,615 (0,838‐3,116) | |
| Ausência de plasmócitos | |||||
| Sim | 7 (17,5) | 4 (10,0) | 3 (7,5) | 0,943 (0,469‐1,895) | |
| Não | 33 (82,5) | 20 (50,0) | 13 (32,5) | 1,061 (0,528‐2,132) | |
| Granulomas | |||||
| Sim | 17 (42,5) | 11 (27,5) | 6 (15,0) | 1,145 (0,693‐1,891) | 0,601 |
| Não | 23 (57,5) | 13 (32,5) | 10 (25,0) | 0,874 (0,529‐1,443) | |
| Hiperplasia endotelial | |||||
| Sim | 30 (75,0) | 18 (45,0) | 12 (30,0) | 1,000 (0,557‐1,794) | 0,640b |
| Não | 10 (25,0) | 6 (15,0) | 4 (10,0) | 1,000 (0,557‐1,794) | |
IHQ, imuno‐histoquímica; (++/++),> 30% do infiltrado inflamatório; (+/++), <30% do infiltrado inflamatório; RP, razão de prevalência; IC 95%, intervalo de confiança de 95%; NA, não aplicável, poucos casos.
Uma descrição clínica e histopatológica dos casos de sífilis e estudo de acurácia diagnóstica da IHQ com anticorpo anti‐T. pallidum foi realizada. Nosso estudo mostrou alta frequência de sífilis adquirida em homens (76,3%), assim como reportado pela literatura,1–3 especialmente com relatos entre homens que fazem sexo com homens.1,13 Sífilis também foi observada em adolescentes e pacientes mais velhos, grupos comumente considerados sem risco ou com baixo risco para a infecção. A fase secundária da doença foi predominante, provavelmente em decorrência da alta frequência de biópsias de pele realizadas nessa fase.
A dermatite de interface associada à dermatite perivascular superficial e profunda (27,5%) e à dermatite perivascular superficial e profunda e perianexial (20%) destacou a mistura de padrões de reação tecidual já reportada.14 Hiperplasia endotelial também foi frequente (75%), como nos estudos anteriores.14,15 Plasmócitos foram raros ou ausentes em sete amostras de pele (17,5%), concordando com relatos da literatura de escassez e ausência de plasmócitos em até 25%‐33% das amostras.16–18
As espiroquetas e sua morfologia típica foram facilmente visualizadas pelo método imuno‐histoquímico. Resultados semelhantes são relatados com os mesmos anticorpos,9 ou anticorpos semelhantes.6,8 A IHQ como teste diagnóstico forneceu diagnóstico específico de sífilis em 60% dos casos, número que se aproxima de estudos anteriores (71%‐100% de sensibilidade).6,9 Não foi possível determinar a positividade pela técnica de Warthin‐Starry (WS). Quatresooz e Piérard, em 2009, mostraram achados semelhantes com resultados inconclusivos ou negativos com a técnica WS devido ao fundo de melanina na epiderme e fibrilas de reticulina na derme.9 Outros autores, entretanto, encontraram taxas de sensibilidade de 9% e 60% em amostras de pele.8,10
As espiroquetas podem predominar na derme6 ou na epiderme de lesões de pele da sífilis secundária.7,8 A maioria dos nossos casos apresentava espiroquetas tanto na derme quanto na epiderme, e a alta carga bacteriana (3+) foi predominante. Esses resultados indicam que os micro‐organismos ainda estão difusamente disseminados na pele durante a fase secundária da doença.
Na epiderme, as espiroquetas localizaram‐se principalmente na camada basal ou suprabasal, e em 62,5% das amostras não foram observadas na parte mais alta, ao contrário dos resultados de Phelps et al., que raramente observaram espiroquetas nas porções mais baixas da epiderme.8 O achado de espiroquetas no epitélio folicular e ao redor dos anexos em 58,3% das amostras positivas apoiam ainda mais a teoria de epiteliotropismo do micro‐organismo.7
As alterações vasculares são componentes importantes da resposta inflamatória tecidual na sífilis. Hiperplasia endotelial foi achado comum e evidente, e numerosas espiroquetas imunomarcadas foram detectadas nas paredes dos vasos. Martin‐Ezquerra et al. também encontraram um padrão vasculotrópico – porém, principalmente nas lesões de sífilis primária.7
Nenhuma correlação significante entre IHQ e características clínicas ou histopatológicas foi observada. No entanto, a prevalência de resultados positivos pela IHQ foi alta em amostras de pacientes sem coinfecção pelo HIV (RP=1,444) e naqueles com imunossupressão pelo HIV com CD4 <200 células/mm3 e CV> 1,000 cópias/mL (RP=1,133). Esses resultados sugerem que a infecção pelo HIV por si só não teve impacto principal na detecção de espiroquetas, mas o estado de imunossupressão pode influenciar a disseminação de espiroquetas nas amostras de sífilis. Similar aos nossos achados, pesquisas anteriores reportaram alta carga bacteriana em amostras de pele de pacientes com contagem de CD4 <250 células10 ou em estados de imunossupressão associados com sífilis maligna precoce.11
As amostras cutâneas de sífilis com dermatite perivascular superficial e profunda e de interface e com plasmócitos visíveis no infiltrado (++/++) mostraram alta prevalência de resultados positivos na IHQ em comparação com amostras sem esses achados (RP=1,582; RP=1,547, respectivamente). Ao contrário, amostras com dermatite perivascular superficial e profunda (RP=0,304) ou poucos plasmócitos (+/++; RP=0,619) sugerem que mesmo com resultados negativos na IHQ, o diagnóstico da sífilis não pode ser excluído.
ConclusãoA detecção de antígenos no protocolo de IHQ realçou espiroquetas de Treponema pallidum e possibilitou diagnóstico indubitável de sífilis nas amostras teciduais. A impregnação por WS foi considerada ineficiente na detecção da bactéria e não ofereceu nenhuma contribuição para o diagnóstico específico da doença.
Comitês éticosOs comitês éticos do Hospital Clementino Fraga Filho (HUCFF) da Universidade Federal do Rio de Janeiro (UFRJ) e do Instituto Nacional de Doenças Infecciosas Evandro Chagas (INI), Fundação Oswaldo Cruz (Fiocruz), Brasil, aprovaram o estudo. Os comitês dispensaram informe de consentimento porque nenhuma informação de identificação pessoal foi incluída no conjunto de dados usado para análise.
Suporte financeiroNenhum.
Contribuição dos autoresMariana Freitas de Assis Pereira Rosa: Concepção e o desenho do estudo; levantamento dos dados, ou análise e interpretação dos dados; análise estatística; redação do artigo ou revisão crítica do conteúdo intelectual importante; obtenção, análise e interpretação dos dados; participação efetiva na orientação da pesquisa; revisão crítica da literatura; aprovação final da versão final do manuscrito.
Leonardo Pereira Quintella: Concepção e o desenho do estudo; levantamento dos dados, ou análise e interpretação dos dados; análise estatística; redação do artigo ou revisão crítica do conteúdo intelectual importante; obtenção, análise e interpretação dos dados; participação efetiva na orientação da pesquisa; revisão crítica da literatura; aprovação final da versão final do manuscrito.
Luiz Claudio Ferreira: Levantamento dos dados; obtenção, análise e interpretação dos dados.
Tullia Cuzzi: Concepção e o desenho do estudo; levantamento dos dados, ou análise e interpretação dos dados; análise estatística; redação do artigo ou revisão crítica do conteúdo intelectual importante; obtenção, análise e interpretação dos dados; participação efetiva na orientação da pesquisa; revisão crítica da literatura; aprovação final da versão final do manuscrito.
Conflito de interessesNenhum.
Como citar este artigo: Rosa MFAP, Quintella LP, Ferreira LC, Cuzzi T. Immunohistochemical detection of Treponema pallidum in skin samples with clinical and histopathological correlations and Warthin‐Starry staining critical analysis. An Bras Dermatol. 2023;98:480–6.
Trabalho realizado no Hospital Clementino Fraga Filho, Universidade Federal do Rio de Janeiro e Instituto Nacional de Doenças Infecciosas Evandro Chagas, Fundação Oswaldo Cruz, Rio de Janeiro, RJ, Brasil.