Pulsos de dexametasona‐ciclofosfamida (PDC) e de dexametasona (PD) têm sido utilizados com sucesso para tratar pênfigo, mas os relatos de PDC/PD comparando pênfigo vulgar (PV) e pênfigo foliáceo (PF) são escassos.
ObjetivoComparar o desfecho de PDC/PD em uma coorte brasileira de pacientes com PV e PF de acordo com dados demográficos e clínicos.
MétodosEstudo de coorte analítico retrospectivo, com revisão de prontuários de pacientes com PV e PF (para as fases I‐IV dos ciclos DCP/DP, consultar Pasricha et al.16‐18).
ResultadosTrinta e sete pacientes com PV e 41 com PF, que não responderam aos tratamentos usuais, foram incluídos similarmente na terapia com PDC ou PD. A duração da doença era maior entre os pacientes com PF antes da prescrição de PDC/PD (p <0,001); PF exigiu maior número de pulsos mensais para atingir a remissão na fase I (mediana de 10 e seis pulsos, respectivamente; p=0,005). Os resultados de PDC/PD foram semelhantes em ambos os grupos: remissão em 37,8% dos casos de PV e 34,1% de PF após completar o ciclo de PDC/PD com mediana de 13 meses (1‐56 meses de seguimento); falha ocorreu em 13,5% do grupo PV e 14,6% do PF na fase I; recidiva em 13,5% do grupo PV e 12,2% do PF, e abandono em 27% do PV e 24,4% do PF nas fases II a IV. Efeitos colaterais leves foram documentados.
Limitações do estudoA gravidade do PV e do PF não foi avaliada por índices de escore.
ConclusõesPacientes com PV e PF apresentaram desfechos semelhantes após PDC/PD. PDC/PD deve ser iniciado mais precocemente em pacientes com PF em virtude da longa duração da doença, a fim de diminuir o número de pulsos e a duração da fase I para obter remissão.
O pênfigo compreende um grupo de doenças bolhosas autoimunes caracterizados pela produção de autoanticorpos IgG contra desmogleínas.1,2 Tanto pênfigo vulgar (PV) quanto pênfigo foliáceo (PF) são formas clínicas prevalentes em algumas regiões brasileiras, cuja patogênese ainda não foi amplamente estudada.3–6 No Sudeste do Brasil, suscetibilidade de HLA/alelos protetores/haplótipos foi identificada, diferenciando PV de PF em termos de perfil genético de HLA.7
O principal resultado do tratamento do pênfigo é atingir a remissão clínica. O tratamento padrão do pênfigo consiste em corticosteroide oral, com/sem medicamentos imunossupressores adjuvantes.1,8 Entretanto, várias morbidades associadas ao uso diário prolongado de corticosteroides foram relatadas.9,10
O rituximabe foi introduzido para o tratamento do pênfigo em 2001.11 Nos últimos anos, tem sido considerada a opção de primeira linha para o tratamento do pênfigo em países desenvolvidos.1 Entretanto, no Brasil, rituximabe tem sido prescrito como opção excepcional, para casos que não respondem aos medicamentos mais comuns,12–14 o que nos incentivou a buscar tratamento alternativo a fim de diminuir os efeitos colaterais dos corticoides quando prescritos cronicamente.9,10
Sabendo que as doenças autoimunes são controladas de maneira eficaz com esquemas de pulsoterapia,15 além do fato de trabalharmos em enfermarias para pacientes dermatológicos e reumatológicos em manejo clínico compartilhado, introduzimos a pulsoterapia com dexametasona‐ciclofosfamida (PDC) ou dexametasona exclusivamente (PD) no tratamento do pênfigo, com base no primeiro relato de Pasricha et al. (1998).16
Tivemos por objetivo comparar os desfechos dos ciclos PDC/PD em uma coorte brasileira de pacientes com PV e PF de acordo com os dados demográficos e clínicos.
Materiais e métodosTipo de estudoEste é um estudo analítico retrospectivo, com análise de prontuários na última década, realizado de acordo com o checklist STROBE.
População do estudoOs pacientes foram atendidos no Hospital Universitário da Faculdade de Medicina de Ribeirão Preto da Universidade de São Paulo, Brasil. Histopatologia, características de imunofluorescência direta e/ou indireta, além de sorologia anti‐desmogleína 1 e 3 por ELISA com kits comerciais (MBL, Nagoya, Japão) foram utilizados para confirmar o diagnóstico de pênfigo e ajudaram a alocar os pacientes nos grupos PV e PF. Os critérios de inclusão consistiram em diagnóstico confirmado de PV ou PF e prescrição de ciclo único de terapia PDC/PD (ver Pulsoterapia). Os critérios de exclusão foram gravidez, lactação e tratamento anterior com rituximabe. Os pacientes que tinham tratamentos anteriores foram transferidos para o regime de pulsoterapia devido à refratariedade e efeitos colaterais do uso crônico diário de prednisona oral, anti‐inflamatórios e/ou imunossupressores (tabela 1).
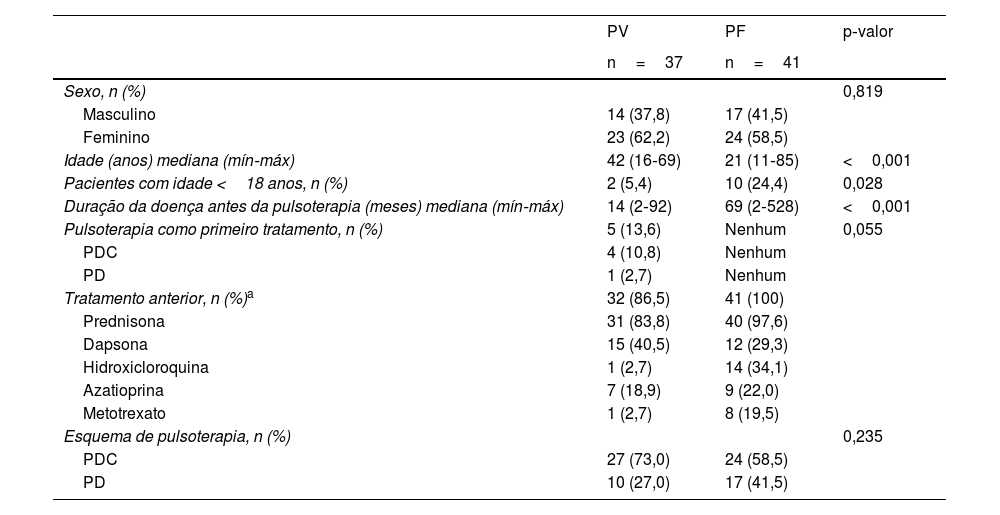
Dados demográficos e clínicos de pacientes com pênfigo vulgar (PV) e pênfigo foliáceo (PF) em esquema de pulsoterapia PDC ou PD
| PV | PF | p‐valor | |
|---|---|---|---|
| n=37 | n=41 | ||
| Sexo, n (%) | 0,819 | ||
| Masculino | 14 (37,8) | 17 (41,5) | |
| Feminino | 23 (62,2) | 24 (58,5) | |
| Idade (anos) mediana (mín‐máx) | 42 (16‐69) | 21 (11‐85) | <0,001 |
| Pacientes com idade <18 anos, n (%) | 2 (5,4) | 10 (24,4) | 0,028 |
| Duração da doença antes da pulsoterapia (meses) mediana (mín‐máx) | 14 (2‐92) | 69 (2‐528) | <0,001 |
| Pulsoterapia como primeiro tratamento, n (%) | 5 (13,6) | Nenhum | 0,055 |
| PDC | 4 (10,8) | Nenhum | |
| PD | 1 (2,7) | Nenhum | |
| Tratamento anterior, n (%)a | 32 (86,5) | 41 (100) | |
| Prednisona | 31 (83,8) | 40 (97,6) | |
| Dapsona | 15 (40,5) | 12 (29,3) | |
| Hidroxicloroquina | 1 (2,7) | 14 (34,1) | |
| Azatioprina | 7 (18,9) | 9 (22,0) | |
| Metotrexato | 1 (2,7) | 8 (19,5) | |
| Esquema de pulsoterapia, n (%) | 0,235 | ||
| PDC | 27 (73,0) | 24 (58,5) | |
| PD | 10 (27,0) | 17 (41,5) |
Os esquemas de pulsoterapia seguiram as recomendações seguintes, compreendendo quatro fases.17 Quando são prescritas infusões de dexametasona (DXM) e ciclofosfamida (CYP) denomina‐se terapia PDC, e o esquema envolvendo infusão exclusiva de DXM é denominado terapia PD. A terapia PDC compreende 100mg de DXM dissolvidos em 500mL de glicose a 5% e é administrada em infusão intravenosa e repetida em três dias consecutivos. No segundo dia, os pacientes também recebem infusão de CYP 500mg. Os pacientes jovens e os que desejam ter filhos são tratados com a terapia PD, infusão de DXM 100mg exclusivamente em três dias consecutivos.
A fase I compreende pulsos a cada 28 a 30 dias até que o paciente atinja a remissão. Se o paciente não atingir a remissão na Fase I, é considerada falha de tratamento. A fase II consiste em nove pulsos consecutivos a cada 28 a 30 dias, e CYP oral diária de 50mg é mantida para consolidar a remissão. A Fase III compreende CYP oral diária de 50mg exclusivamente por nove meses. A Fase IV consiste na remissão sem medicação, considerada como seguimento pós‐tratamento.
Na terapia PDC, o esquema posológico de prednisona prescrito anteriormente foi mantido na fase I. Quando ocorre a remissão, a redução gradual da dose de prednisona é realizada na fase II. Na terapia PD, a dose de prednisona é administrada nas fases I‐III.
Há um protocolo de exames clínicos e laboratoriais para eleger o paciente para receber pulsoterapia, incluindo exame dentário, e exames para excluir doenças oncológicas. Antes de cada pulso ser prescrito nas enfermarias, são realizados exames gerais clínicos e laboratoriais, principalmente hematológicos, função hepática e de urina.
A remissão consiste na resolução das lesões antigas sem aparecimento de novas lesões na fase I. Durante as fases II e III, os pacientes devem permanecer livres de novas lesões bolhosas. Se novas bolhas surgirem, a fase I deve ser reiniciada. Quando novas lesões surgem nas fases II‐IV, é considerada falha de tratamento. Abandono foi considerado quando o paciente não retornou em três meses. O seguimento consistiu em pelo menos 12 meses de consultas médicas semanais com pacientes que atingiram a fase IV.
Análise estatísticaDados discretos e contínuos foram expressos como contagem (porcentagem) e mediana (variação), respectivamente. O teste de Mann‐Whitney foi utilizado para variáveis contínuas, como apropriado. Variáveis categóricas foram comparadas utilizando o teste exato de Fisher. A análise estatística foi realizada com o software Prism GraphPad 9 (La Jolla, CA, EUA). O nível de significância adotado foi α> 5%.
ÉticaOs pacientes assinaram o Termo de Consentimento Livre e Esclarecido, e os pacientes menores de 18 anos tiveram seu termo de consentimento assinado pelos pais ou responsáveis legais. O estudo foi aprovado pelo Comitê de Ética local (n° 10‐51729‐2 e n° 8063‐2015) de acordo com os padrões éticos da Declaração de Helsinque da Associação Médica Mundial.
ResultadosO estudo incluiu 78 pacientes com pênfigo, 37 com PV e 41 com PF. Informações sobre sexo, idade, duração da doença e tratamentos prévios antes da prescrição da pulsoterapia e alocação nos esquemas PDC e PD estão descritas na tabela 1. Ambos os grupos apresentaram diferenças estatísticas quanto à idade e duração da doença; os pacientes com PV eram mais idosos do que os com PF, e tempo de doença do PF foi maior que o do PV (p <0,001 para ambos). A alocação de pacientes com PV e PF em esquemas de PDC ou PD foi semelhante (p=0,235). Portanto, os resultados foram analisados abrangendo ambos os esquemas, denominada terapia PDC/PD.
Cinco pacientes com PV foram alocados no esquema de pulsoterapia como primeira opção em virtude da gravidade da doença. Os dados sobre os resultados da pulsoterapia nas fases I‐IV para os grupos PV e PF estão expressos na tabela 2.
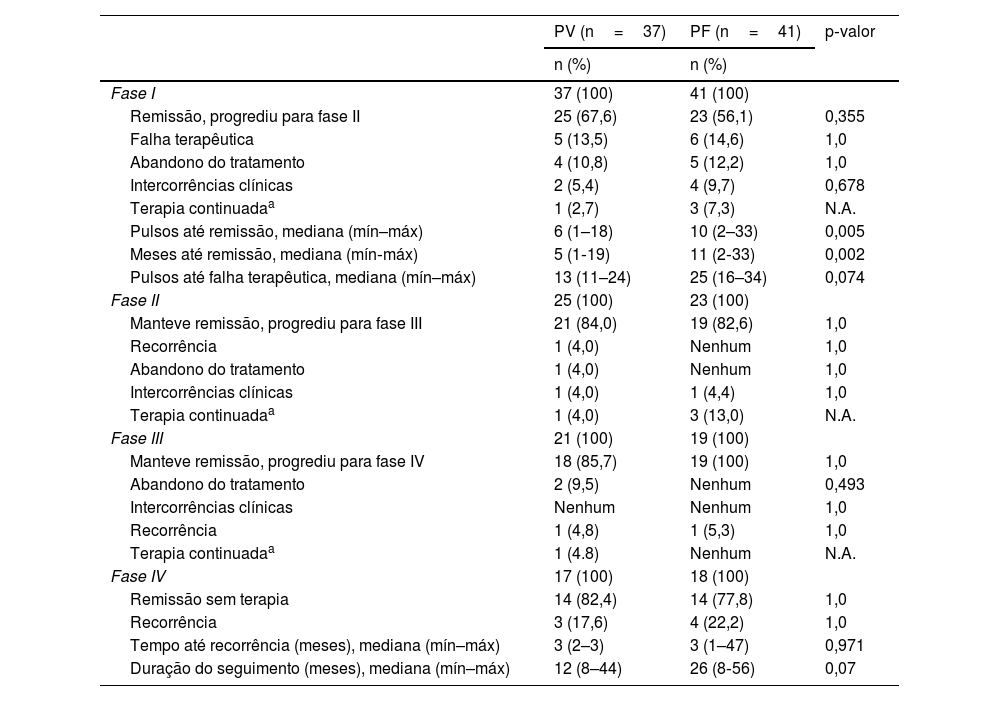
Resultados da pulsoterapia de acordo com a fase dos esquemas PDC/PD nos grupos pênfigo vulgar (PV) e pênfigo foliáceo (PF)
| PV (n=37) | PF (n=41) | p‐valor | |
|---|---|---|---|
| n (%) | n (%) | ||
| Fase I | 37 (100) | 41 (100) | |
| Remissão, progrediu para fase II | 25 (67,6) | 23 (56,1) | 0,355 |
| Falha terapêutica | 5 (13,5) | 6 (14,6) | 1,0 |
| Abandono do tratamento | 4 (10,8) | 5 (12,2) | 1,0 |
| Intercorrências clínicas | 2 (5,4) | 4 (9,7) | 0,678 |
| Terapia continuadaa | 1 (2,7) | 3 (7,3) | N.A. |
| Pulsos até remissão, mediana (mín–máx) | 6 (1–18) | 10 (2–33) | 0,005 |
| Meses até remissão, mediana (mín‐máx) | 5 (1‐19) | 11 (2‐33) | 0,002 |
| Pulsos até falha terapêutica, mediana (mín–máx) | 13 (11–24) | 25 (16–34) | 0,074 |
| Fase II | 25 (100) | 23 (100) | |
| Manteve remissão, progrediu para fase III | 21 (84,0) | 19 (82,6) | 1,0 |
| Recorrência | 1 (4,0) | Nenhum | 1,0 |
| Abandono do tratamento | 1 (4,0) | Nenhum | 1,0 |
| Intercorrências clínicas | 1 (4,0) | 1 (4,4) | 1,0 |
| Terapia continuadaa | 1 (4,0) | 3 (13,0) | N.A. |
| Fase III | 21 (100) | 19 (100) | |
| Manteve remissão, progrediu para fase IV | 18 (85,7) | 19 (100) | 1,0 |
| Abandono do tratamento | 2 (9,5) | Nenhum | 0,493 |
| Intercorrências clínicas | Nenhum | Nenhum | 1,0 |
| Recorrência | 1 (4,8) | 1 (5,3) | 1,0 |
| Terapia continuadaa | 1 (4.8) | Nenhum | N.A. |
| Fase IV | 17 (100) | 18 (100) | |
| Remissão sem terapia | 14 (82,4) | 14 (77,8) | 1,0 |
| Recorrência | 3 (17,6) | 4 (22,2) | 1,0 |
| Tempo até recorrência (meses), mediana (mín–máx) | 3 (2–3) | 3 (1–47) | 0,971 |
| Duração do seguimento (meses), mediana (mín–máx) | 12 (8–44) | 26 (8‐56) | 0,07 |
Dos 37 pacientes com PV, 25 (67,6%) atingiram remissão na fase I após mediana de seis (1–18) pulsos e prosseguiram para a fase II. A falha (13,5%) foi determinada após mediana de 13 (11–24) pulsos; esses pacientes foram alocados em outras modalidades terapêuticas, como rituximabe. Dois (5,4%) pacientes apresentaram intercorrências clínicas: um recebeu tratamento para tuberculose latente e o outro apresentou câncer renal. De fato, o diagnóstico do paciente que morreu de câncer renal foi revisado; ele apresentava pênfigo paraneoplásico. Vinte e um (84%) pacientes da fase II prosseguiram para a fase III. Na fase II, um (4%) paciente teve recorrência e outro (4%) apresentou ideação suicida como intercorrência clínica, atribuída aos corticoides. Na fase III, dois pacientes (9,5%) abandonaram o tratamento e um (4,8%) apresentou recorrência. Dos 17 pacientes na fase IV, 14 (82,4%) mantiveram a remissão sem terapia com seguimento médio de 12 (8 a 44) meses, e três pacientes (17,6%) tiveram recorrência em dois a três meses.
PDC foi prescrita como primeiro tratamento para quatro pacientes com PV, devido à gravidade da doença (tabela 1): dois pacientes apresentaram falha na fase I e rituximabe foi prescrito; um estava na fase I e outro na fase IV. PD foi prescrita como primeiro tratamento para um paciente com PV, que apresentou recorrência após dois meses na fase IV.
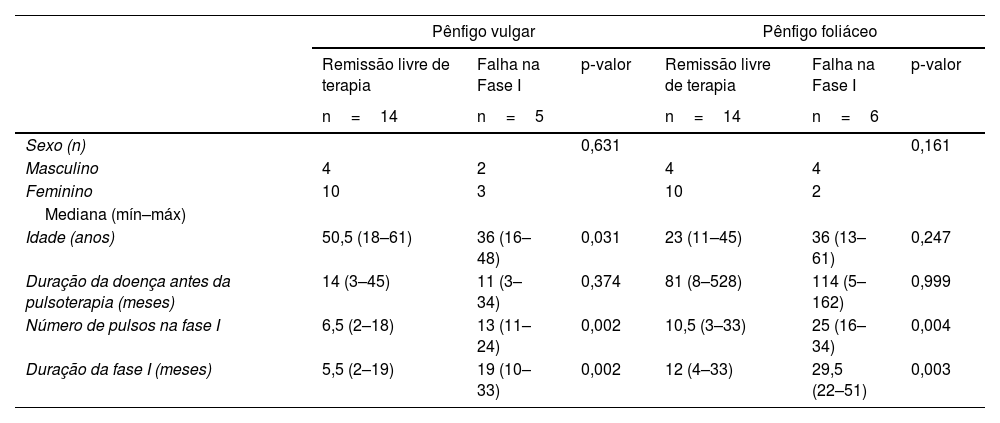
A tabela 3 mostra uma comparação dos dados demográficos e clínicos de 14 pacientes com PV em remissão sem terapia e cinco pacientes que apresentaram falha na fase I. Os pacientes com PV mais jovens apresentaram maior frequência de falha (p=0,031); o número de pulsos e a duração da fase I foram menores nos pacientes que apresentaram remissão (p=0,002 para ambos).
Remissão após a fase IV livre de terapia ou falha nos resultados da fase I da pulsoterapia nos grupos de pênfigo vulgar e pênfigo foliáceo. Comparação de dados demográficos, clínicos e número de pulsos e duração da fase I
| Pênfigo vulgar | Pênfigo foliáceo | |||||
|---|---|---|---|---|---|---|
| Remissão livre de terapia | Falha na Fase I | p‐valor | Remissão livre de terapia | Falha na Fase I | p‐valor | |
| n=14 | n=5 | n=14 | n=6 | |||
| Sexo (n) | 0,631 | 0,161 | ||||
| Masculino | 4 | 2 | 4 | 4 | ||
| Feminino | 10 | 3 | 10 | 2 | ||
| Mediana (mín–máx) | ||||||
| Idade (anos) | 50,5 (18–61) | 36 (16–48) | 0,031 | 23 (11–45) | 36 (13–61) | 0,247 |
| Duração da doença antes da pulsoterapia (meses) | 14 (3–45) | 11 (3–34) | 0,374 | 81 (8–528) | 114 (5–162) | 0,999 |
| Número de pulsos na fase I | 6,5 (2–18) | 13 (11–24) | 0,002 | 10,5 (3–33) | 25 (16–34) | 0,004 |
| Duração da fase I (meses) | 5,5 (2–19) | 19 (10–33) | 0,002 | 12 (4–33) | 29,5 (22–51) | 0,003 |
Dos 41 pacientes com PF, 23 (56,1%) entraram em remissão na fase I após mediana de 10 (2‐33) pulsos e prosseguiram para a fase II. Falha foi observada em seis (14,6%) pacientes, após mediana de 25 (16‐34) pulsos. Cinco (12,2%) pacientes abandonaram o tratamento e quatro (9,7%) apresentaram intercorrências clínicas (artrite séptica e infecções de pele) e foram removidos do estudo. Dezenove (82,6%) pacientes prosseguiram para a fase III, um (4,4%) paciente foi removido do estudo em virtude de tratamento odontológico e outro (5,3%) apresentou recorrência. Dos 18 pacientes na fase IV, 14 (77,8%) mantiveram a remissão sem terapia com mediana de 26 (8‐56) meses. Ainda, a recorrência ocorreu em quatro pacientes (22,2%), após mediana de três (1‐47) meses.
Os dados clínicos comparando 14 pacientes com PF que obtiveram remissão livre de terapia e seis pacientes que apresentaram falha na fase I são apresentados na tabela 3. As variáveis cujos resultados diferiram estatisticamente foram: o número de pulsos e a duração da fase I, que foram menores em pacientes que apresentaram remissão (p=0,004 e p=0,003, respectivamente).
Comparação dos resultados de PDC/PD em pacientes com PV e PF que alcançaram remissão sem terapia (tabela 4)Os resultados da PDC/PD foram semelhantes em ambos os grupos. Em resumo, 14 (37,8%) de 37 pacientes com PV e 14 (34,1%) de 41 pacientes com PF entraram em remissão, considerados livres de doença na Fase IV (p=0,815). Falha ocorreu em cinco (13,5%) de 37 casos de PV e em seis (14,6%) de 41 casos de PF na fase I (p=1,0). Recorrência nas fases II a IV ocorreu em cinco (13,5%) de 37 pacientes com PV e em cinco (12,2%) de 41 pacientes com PF (p=1,0). Pacientes mais jovens com PV apresentaram maior frequência de falha. Os pacientes com PF eram mais jovens, apresentavam maior duração da doença e necessitavam de maior número de pulsos para atingir a remissão na fase I.
Comparação de dados demográficos, clínicos e número de pulsos e duração da fase I entre os grupos de pênfigo vulgar (PV) e pênfigo foliáceo (PF) que atingiram remissão livres de terapia
| PV | PF | p‐valor | |
|---|---|---|---|
| n=14 | n=14 | ||
| Sexo (n) | 1,00 | ||
| Masculino | 4 | 4 | |
| Feminino | 10 | 10 | |
| Mediana (mín–máx) | |||
| Idade (anos) | 50,5 (18–61) | 23 (11–45) | <0,001 |
| Duração da doença antes da pulsoterapia (meses) | 14 (3–45) | 81 (8–528) | 0,006 |
| Número de pulsos na fase I | 6,5 (2–18) | 10,5 (3–33) | 0,026 |
| Duração da fase I (meses) | 5,5 (2–19) | 12 (4–33) | 0,015 |
| Duração do seguimento na fase IV (meses) | 12 (8–44) | 26 (8–56) | 0,070 |
Em geral, a pulsoterapia foi bem tolerada, mas efeitos colaterais menores (infecção cutânea e urinária, náuseas e vômitos, cefaleia e hematúria) ocorreram em três (8,1%) de 37 pacientes com PV e em cinco (12,2%) de 41 com PF (p=0,715). Foi registrado um caso de adenocarcinoma prostático, diagnosticado sete meses após a suspensão da pulsoterapia. Nenhum paciente morreu em decorrência do tratamento. Abandono ocorreu em sete (18,9%) de 37 pacientes com PV e em cinco (12,2%) de 41 pacientes com PF (p=0,534). No total, abandono do tratamento foi observado em 10 (27%) de 37 pacientes com PV e em 10 (24,4%) de 41 pacientes com PF (p=0,802).
DiscussãoNas últimas décadas, a pulsoterapia tornou‐se opção segura para o tratamento do pênfigo, pois evita os efeitos colaterais em longo prazo do tratamento oral diário com corticosteroides e/ou medicamentos imunossupressores.9,10,16–21 As principais modalidades relatadas de pulsoterapia compreendem PDC e pulso de dexametasona com azatioprina oral, resultando em controle semelhante da doença, mas maior frequência de recorrência no regime com azatioprina.22 No Brasil, um único relato sobre pulsoterapia para pênfigo foi encontrado na literatura.23
PDC foi prescrita para mais de 300 pacientes com pênfigo na Índia, dos quais 190 (84%) dos 227 pacientes que completaram o tratamento estavam livres da doença (25,3% com seguimento de mais de cinco anos).18 A comparação do uso de adjuvantes com efeito poupador de esteroides demonstrou que PDC e ciclosporina são os melhores medicamentos em termos de taxas de recorrência.19
No presente estudo, foram comparados os resultados de PDC/PD nas duas principais formas clínicas de pênfigo em uma região brasileira com prevalência de PV e PF.3 Considerando a amostra total dos grupos PV e PF, que completaram um ciclo de PDC/PD, as frequências de remissão foram semelhantes para ambos (14 [37,8%] de 37 casos de PV e 14 [34,1%] de 41 casos de PF). Se forem considerados os pacientes que prosseguiram para a fase IV, 14 (82,4%) dos 17 pacientes com PV e 14 (77,8%) dos 18 com PF apresentaram remissão com mediana de seguimento de 12 meses e 26 meses, respectivamente.
A duração da fase I determina a duração da pulsoterapia completa. Os fatores que influenciam a fase I são importantes para estabelecer o prognóstico da resposta à PDC/PD. Na fase I, 25 (67,7%) de 37 pacientes com PV e 23 (56,1%) dos pacientes com PF atingiram frequências de remissão semelhantes. É digno de nota que, embora o PF seja considerado como tendo melhor prognóstico que o PV, o grupo PF demorou mais para atingir a remissão quando comparado ao PV, com mediana de 10 e seis pulsos (p=0,005) e 11 e cinco meses, respectivamente (p=0,002). Roga, Augustine (2018) descreveram 10 meses para PV e oito meses para PF, mas o grupo com PF necessitou mais ciclos do que o grupo com PV para alcançar o controle.22 Mundakkat, Sridharan (2018) associaram a duração mais longa da fase de indução (fase I) com a gravidade do escore oral e cutâneo e com a duração da doença.24 É importante ressaltar que a terapia PDC/PD, com exceção de cinco casos de PV, foi prescrita para pacientes que não apresentaram resposta ao tratamento anterior.
De fato, o tempo da doença antes da prescrição da pulsoterapia foi maior no grupo PF do que no PV (mediana=69 meses e 14 meses, respectivamente; p <0,001). O comportamento epidemiológico e clínico do PF poderia explicar esse achado ‐ o PF geralmente começa em idade precoce, cursa com baixa gravidade, permitindo um longo período sem o uso de qualquer agente terapêutico agressivo.3 Esses fatos podem justificar o grande número de pulsos para atingir a remissão no grupo PF visto na fase I. Embora a gravidade do PV seja maior do que o PF, os pacientes com PV iniciaram a pulsoterapia mais precocemente após um período mais curto de doença em comparação com o PF, o que poderia justificar a resposta mais rápida e o menor número de pulsos necessários para atingir a remissão na Fase I.22,24
As frequências de falha na fase I foram semelhantes nos grupos PV e PF (13,5% e 14,6%, respectivamente; tabela 2). O número de pulsos considerados para falha foi maior para o grupo PF, comparado ao PV (mediana=25 e 13, respectivamente). Nas fases II e III, poucos pacientes apresentaram recorrência (dois pacientes com PV e um com PF). Na fase IV, quando os pacientes não utilizam nenhum corticoide ou agente imunossupressor, houve recorrência em três (17,6%) dos 17 pacientes com PV e em quatro (22,2%) dos 18 pacientes com PF. Ao buscar fatores que pudessem influenciar os resultados da remissão livre de terapia na fase IV e falha na fase I (tabela 3), o número de pulsos na fase I foi maior no subgrupo de falha tanto em PV quanto em PF. Em termos de idade, os pacientes com PV mais jovens apresentaram maior frequência de falha em comparação com a remissão livre de terapia (mediana de 36 anos e 50,5 anos, respectivamente). Tratamento incompleto ou irregular e/ou pulsoterapia com medicação única podem levar à recorrência ou falha terapêutica. Para Pasricha et al., o sucesso da pulsoterapia depende de protocolo e seguimento rigorosos do paciente.18 Os pacientes mais jovens com PV foram tratados com o esquema PD, o que poderia justificar a maior frequência de falha terapêutica.
Os pacientes com PV e PF não diferiram quanto ao abandono do tratamento ou intercorrências clínicas. O abandono ocorreu em sete (18,9%) dos 37 pacientes com PV e em cinco (12,2%) dos 41 pacientes com PF. Intercorrências clínicas foram observadas em três (8,1%) de 37 pacientes com PV e em cinco (12,2%) de 41 pacientes com PF. Considerando o abandono do tratamento, 27% do grupo com PV e 24,4% do grupo com PF não finalizaram o tratamento. Mahajan et al. (2022) relataram taxa de abandono de 41,5% em pacientes com pênfigo tratados com PDC.21 Foi possível identificar não apenas a dificuldade de transporte de outras cidades até o centro de referência e problemas pessoais e familiares como os principais motivos do abandono, mas também o abandono sem justificativa registrada em prontuário médico. Manter a adesão dos pacientes à pulsoterapia é certamente um desafio para os médicos que trabalham com esse esquema terapêutico. Antecedendo as consultas clínicas, agendamos reuniões com os pacientes para explicar a modalidade terapêutica, o que poderia justificar a melhor adesão ao tratamento.25
Por fim, a pulsoterapia não é isenta de efeitos colaterais, sendo astenia, fadiga, mialgia, artralgia, rubor, palpitações, insônia, cefaleia, anorexia e náuseas e vômitos os mais comumente descritos (ver Ref. 26 para revisar as modalidades de pulsoterapia).21,26 A maioria dos pacientes do presente estudo tolerou bem a pulsoterapia e apresentou efeitos colaterais menores. Não obstante, houve um caso de adenocarcinoma prostático, diagnosticado sete meses após a suspensão da pulsoterapia. Esse paciente de 60 anos fazia uso de CYP havia 4,5 anos, com dose cumulativa de 20g Efeitos colaterais graves relatados para esse medicamento, como doenças linfoproliferativas, cistite hemorrágica e câncer de bexiga, podem ocorrer após 30‐100g de dose cumulativa de CYP.27 Além disso, não há relatos até o momento relacionando CYP e câncer de próstata. Portanto, não é possível atribuir diretamente este caso de câncer de próstata ao uso da terapia PDC. De qualquer modo, os médicos devem monitorar o surgimento desse tipo de evento. Embora mortes durante a pulsoterapia tenham sido descritas, nenhuma morte foi registrada no presente estudo.26
Antes da era dos corticosteroides, a letalidade do pênfigo chegava a 70%. Após a introdução de corticosteroides e terapia adjuvante, essa letalidade caiu para menos de 10%.28 Desde sua introdução em 1982 por Pasricha et al., a terapia PDC vem revolucionando o tratamento do pênfigo. Essa modalidade proporciona não apenas o controle, mas também a remissão do pênfigo, com menos efeitos colaterais graves associados.16,19,21,24,29
Nos países em desenvolvimento, sem o rituximabe como agente poupador de primeira linha para o tratamento do pênfigo, a PDC/PD deve ser considerada uma modalidade segura para tratamento do pênfigo.30 Como o presente estudo mostrou uma associação de maior falha terapêutica com a duração da doença antes da pulsoterapia, recomenda‐se o início imediato da pulsoterapia no PV leve a grave e no PF.
Os resultados do presente estudo possibilitam melhor compreensão sobre a pulsoterapia e podem ser úteis para novos estudos visando esclarecer a associação do perfil genético de pacientes com pênfigo com o tratamento PDC/PD.
ConclusõesOs grupos PV e PF apresentaram frequências semelhantes de desfecho da PDC/PD: remissão, falha terapêutica, recorrência e abandono do tratamento. Em comparação com o grupo PV, os pacientes com PF necessitaram de maior número de pulsos para atingir a remissão durante a fase I, o que pode estar relacionado à maior duração da doença antes da prescrição da pulsoterapia.
Suporte financeiroEste estudo foi parcialmente financiado pela Fundação de Amparo à Pesquisa do Estado de São Paulo (FAPESP; #2010‐51729‐2) e Fundação de Apoio ao Ensino, Assistência e Pesquisa (FAEPA).
Contribuição dos autoresLudmilla Figueiredo Vale Fontenelle: Obtenção, análise e interpretação dos dados; análise estatística; redação do manuscrito; participação efetiva na orientação da pesquisa; revisão crítica da literatura; aprovação da versão final do manuscrito.
Roberto Bueno‐Filho: Análise e interpretação dos dados; revisão crítica de conteúdo intelectual importante; aprovação da versão final do manuscrito.
Sebastián Vernal: Análise e interpretação dos dados; revisão crítica de conteúdo intelectual importante; aprovação da versão final do manuscrito.
Renata Delfino: Obtenção, análise e interpretação dos dados; aprovação da versão final do manuscrito.
Giovanna Stefanne Lópes Barbosa: Análise e interpretação dos dados; revisão crítica de conteúdo intelectual importante; aprovação da versão final do manuscrito.
Eduardo Antonio Donadi: Análise e interpretação dos dados; revisão crítica de conteúdo intelectual importante; aprovação da versão final do manuscrito.
Ana Maria Roselino: Concepção e planejamento do estudo; revisão crítica de conteúdo intelectual importante; participação efetiva na orientação da pesquisa; revisão crítica da literatura; aprovação da versão final do manuscrito.
Conflito de interessesNenhum.
Os autores agradecem ao corpo clínico do ambulatório de dermatoses autoimunes do Hospital Universitário da Faculdade de Medicina de Ribeirão Preto da Universidade de São Paulo, Brasil.
Como citar este artigo: Fontenelle LF, Bueno‐Filho R, Vernal S, Delfino R, Barbosa GSL, Donadi EA, et al. Dexamethasone‐cyclophosphamide pulse therapy outcomes comparing pemphigus vulgaris and pemphigus foliaceus groups in a Brazilian cohort study. An Bras Dermatol. 2023;98:774–80.
Trabalho realizado no Departamento de Clínica Médica, Hospital Universitário da Faculdade de Medicina de Ribeirão Preto da Universidade de São Paulo, Ribeirão Preto, SP, Brasil.