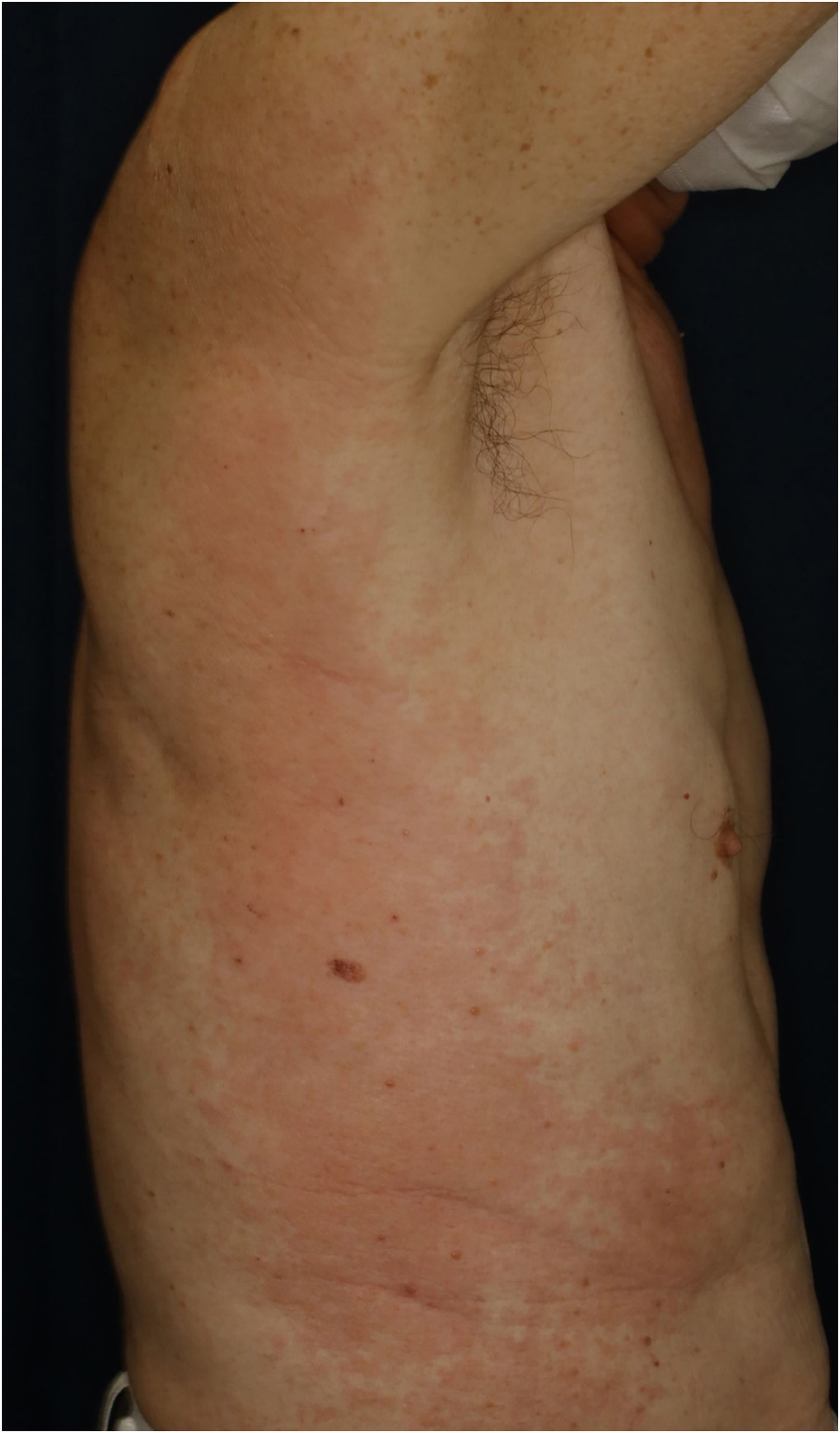
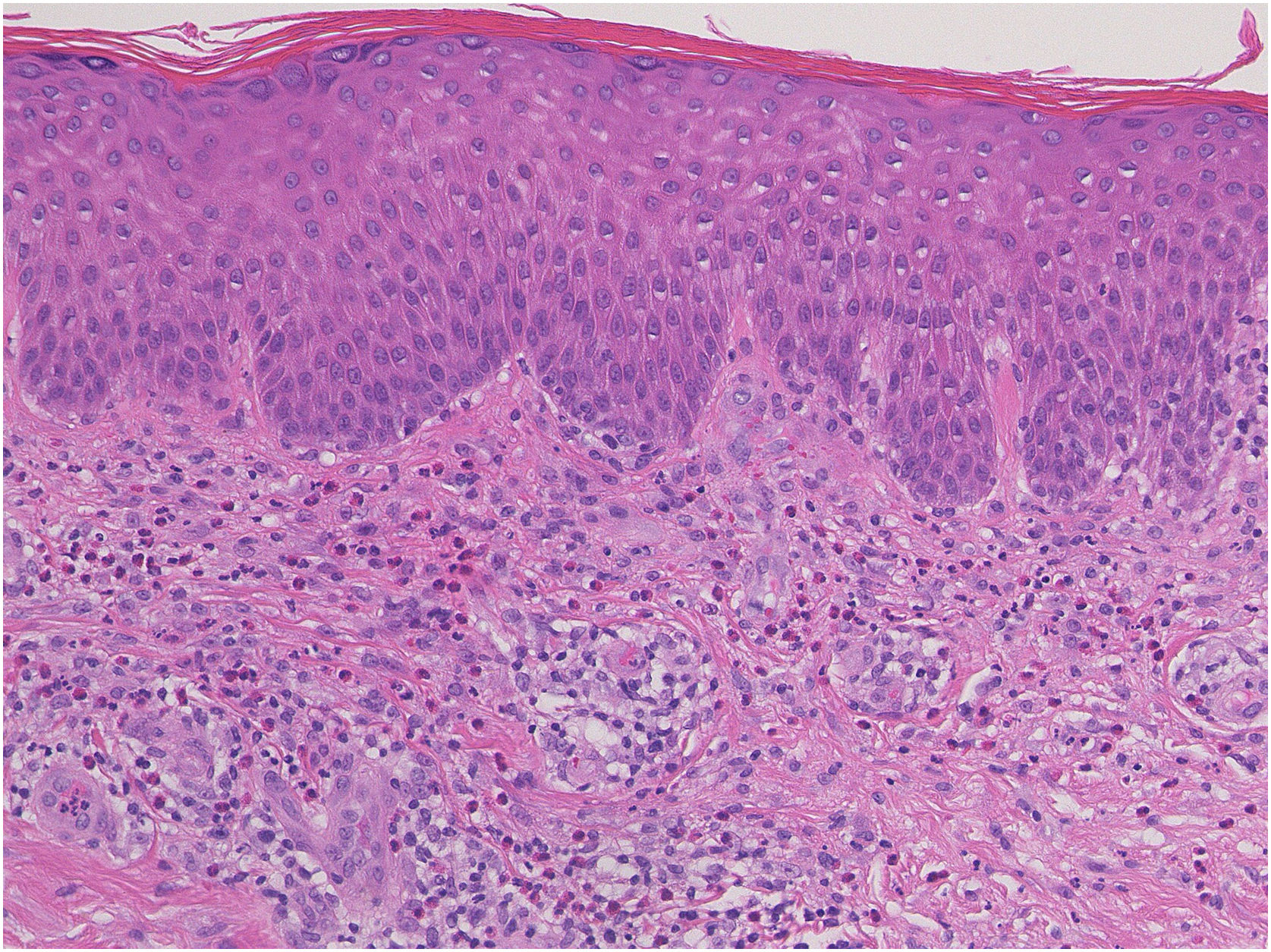
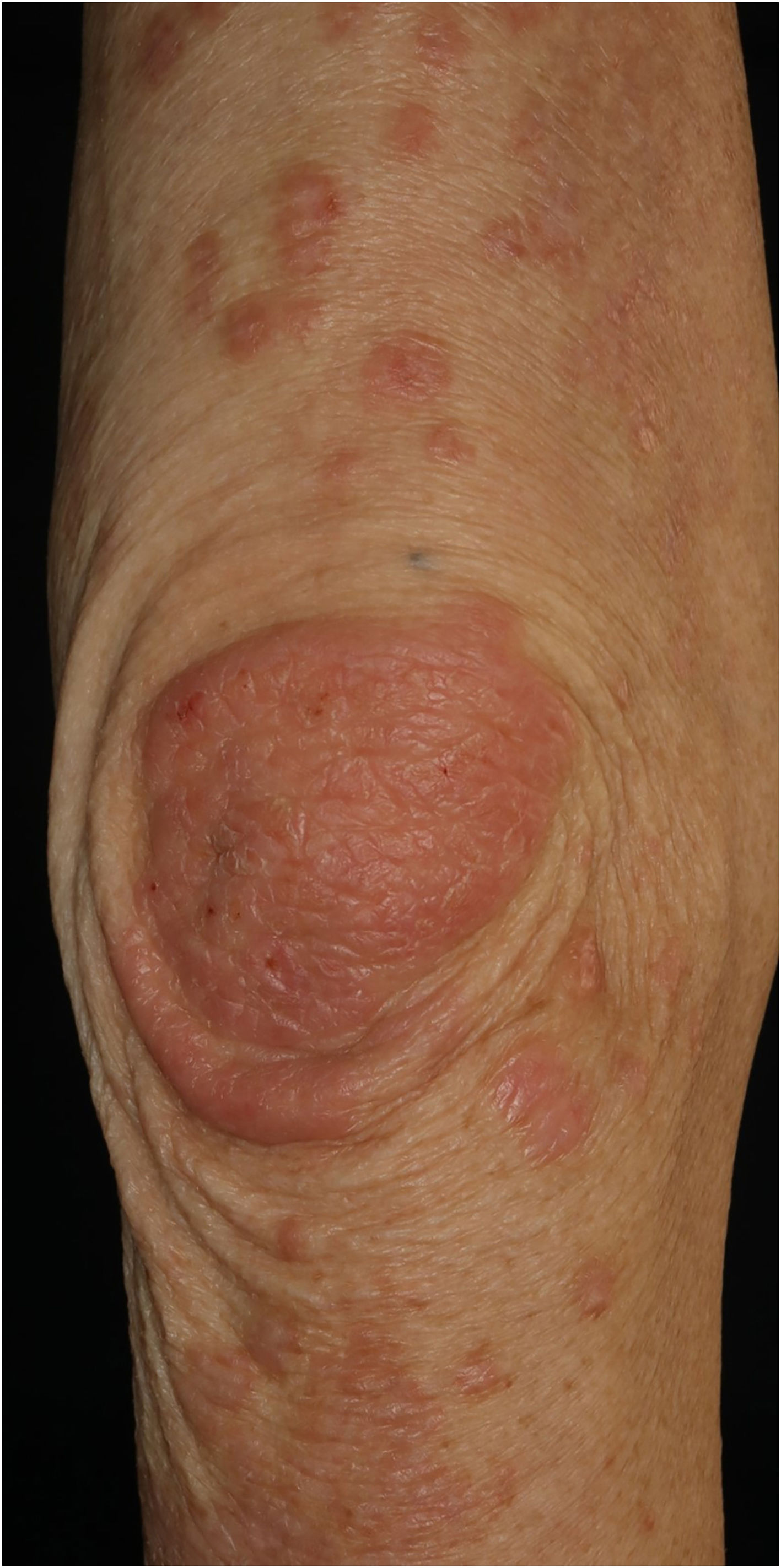
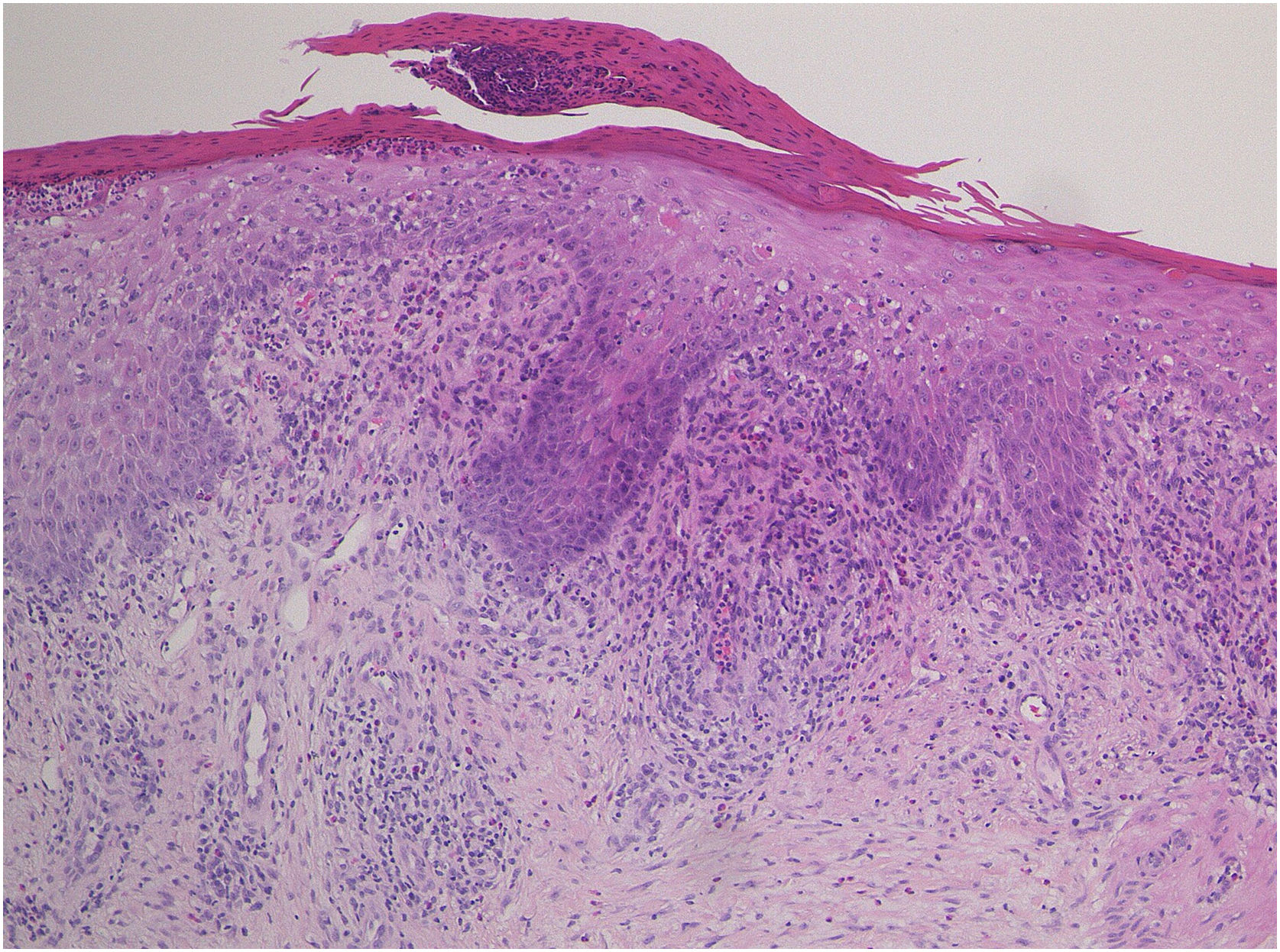
Paciente do sexo masculino, de 73 anos, com carcinoma espinocelular (CEC) irressecável de cabeça e pescoço, foi tratado com pembrolizumabe (200mg) mensalmente. Ele não apresentava histórico familiar ou pessoal de doenças cutâneas, incluindo psoríase. Logo após a segunda administração do medicamento, o paciente desenvolveu exantema pruriginoso, que se espalhou para tronco e extremidades. O exame físico mostrou eritema coalescente e pápulas no tronco e nas extremidades (fig. 1). O exame histopatológico mostrou alterações vacuolares na camada basal da epiderme e infiltração proeminente de eosinófilos na derme superior (fig. 2). Como o grau de eventos adversos imuno‐relacionados (irAEs, do inglês immune‐related adverse events) cutâneos era 2, o pembrolizumabe foi continuado sob tratamento com corticosteroide tópico; entretanto, o eritema piorou gradualmente e, após a quinta administração, o pembrolizumabe foi descontinuado. Prednisolona oral foi administrada na dose de 5‐10mg/dia, mas as lesões cutâneas pioraram ainda mais e surgiram diferentes erupções cutâneas. Um mês após a suspensão do pembrolizumabe foram observados eritema com infiltração e placas eritematosas levemente ceratóticas no tronco e nas extremidades (fig. 3). Não foi observado envolvimento mucoso. A histopatologia em uma segunda biopsia revelou abscesso neutrofílico subcórneo, queratinização celular individual, degeneração por liquefação da camada basal da epiderme e infiltrados celulares dérmicos contendo eosinófilos (fig. 4). Após aumento da dose de prednisolona oral para 30mg/dia e administração por duas semanas, as lesões cutâneas melhoraram. Após a suspensão da prednisolona, não houve recorrência das lesões cutâneas.
O presente caso desenvolveu inicialmente eritema coalescente maculopapular ou morbiliforme no tronco e extremidades cinco semanas após o início do uso de pembrolizumabe. A histopatologia da biopsia inicial mostrou alterações na interface dermoepidérmica e infiltração proeminente de eosinófilos na derme superior. Como o pembrolizumabe foi eficaz para o CEC, seu uso foi continuado em associação com corticosteroide tópico, mas o eritema pruriginoso piorou gradualmente e o pembrolizumabe foi interrompido após a quinta administração. A erupção cutânea foi tratada com prednisolona oral (inicialmente 5mg/dia por uma semana e 10mg/dia por mais uma semana); no entanto, dois meses depois, a erupção cutânea apresentou piora e o fenótipo clínico apresentou agravamento gradual. É interessante observar que a histopatologia na segunda biopsia revelou alterações psoriasiformes, com abscesso neutrofílico subcórneo, enquanto também foram observadas queratinização de células epidérmicas individuais e degeneração por liquefação.
Embora seja bem conhecido o fato de que vários irAEs cutâneos apareceram em decorrência do uso de inibidores de checkpoint imunológico (ICIs),1‐3 há poucos relatos sobre alterações fenotípicas de irAEs cutâneos durante o uso prolongado de ICIs. Até o momento, existe apenas um relato em que o pembrolizumabe causou lesões semelhantes a líquen plano, e posteriormente desenvolveu penfigoide bolhoso.4 Os autores especularam que os ICIs causaram a quebra da tolerância imunológica na junção dermoepidérmica por meio de reações liquenoides. Além disso, a continuidade do uso dos ICIs pode induzir lesões cutâneas iguais ou diferentes,5 em grau escalonado. Na maioria dos casos, os irAEs são de grau 1 ou 2 e podem ser controlados com tratamento tópico sem descontinuação dos ICIs. No entanto, no presente caso, a manifestação cutânea piorou durante a administração continuada de pembrolizumabe, e não foi controlada com corticosteroide tópico e oral. O pembrolizumabe foi finalmente descontinuado, mas as lesões cutâneas pioraram ainda mais mesmo após a interrupção do tratamento. Além disso, o fenótipo das lesões cutâneas mudou de eritema coalescente inicial para placas ceratóticas e alterações histopatológicas psoriasiformes. Posteriormente, as lesões cutâneas pioraram gradualmente e os intervalos de administração de pembrolizumabe foram prolongados; entretanto, as lesões cutâneas não foram controladas e finalmente o pembrolizumabe foi descontinuado, substituindo‐se por prednisolona oral. Contudo, dois meses após a descontinuação do pembrolizumabe, surgiram diferentes fenótipos de lesões cutâneas características psoriasiformes na histopatologia. Portanto, é necessário monitoramento cuidadoso e de longo prazo, bem como manejo adequado dos irAEs cutâneos.
Suporte financeiroNenhum.
Contribuição dos autoresMayu Sato: Concepção do estudo, pesquisa, análise e interpretação dos dados, redação da versão inicial do manuscrito, leitura e aprovação da versão final do manuscrito.
Toshiyuki Yamamoto: Concepção do estudo, elaboração do manuscrito, leitura e aprovação da versão final do manuscrito.
Conflito de interessesNenhum.
Como citar este artigo: Sato M, Yamamoto T. Psoriasiform rash following maculopapular eruption during the continued administration of pembrolizumab. An Bras Dermatol. 2024;99:786–8.
Trabalho realizado no Fukushima Medical University, Fukushima, Japão.