Campo de cancerização cutâneo (CCC) é uma área cutânea com alterações subclínicas decorrentes da exposição solar crônica, com maior predisposição a desenvolvimento de lesões pré‐neoplásicas e neoplásicas. Até o momento, não há parâmetros objetivos bem definidos que possam indicar seu grau de atividade.
ObjetivosDescrever e comparar aspectos morfométricos e expressão de fatores ligados à apoptose e à proliferação celular em queratoses actínicas (QA), epiderme fotoexposta e fotoprotegida.
MétodosEstudo transversal, com pacientes portadores de queratose actínica nos membros superiores, biopsiados em dois pontos: queratose actínica e região axilar. As biópsias de Q queratose actínica A, área perilesional e axila foram avaliadas por meio de KIN (keratinocyte intraepithelial neoplasia), imuno‐histoquímica de p53, survivina e Ki67. Foi feita morfometria nuclear das células da camada basal por meio de análise de imagem digital: entropia, área, perímetro, Ra, dimensão fractal, circularidade, intensidade de cor e maior diâmetro.
ResultadosForam incluídos 13 pacientes e amostradas 38 queratoses actínicas. Na morfometria, foram analisados 1.039 núcleos, dos quais 228 representavam pele íntegra axilar, 396 das queratose actínica e 415da área perilesional à queratose actínica. Houve diferença significativa (p < 0,05) em todas as variáveis testadas para as topografias avaliadas. Identificaram‐se correlação significativa entre os elementos morfométricos nucelares, KIN, marcadores de proliferação e apoptose. Padrões conjuntos de p53, Ki67 e KIN discriminaram as topografias amostradas.
Limitações do estudoEstudo transversal, com pequeno número de pacientes.
ConclusõesHá padrões de proliferação, resistência à apoptose e morfométricos celulares diferentes entre pele fotoprotegida e pele fotoexposta. A expressão conjunta de p53, Ki67 e o KIN pode caracterizar a atividade do campo de cancerização cutâneo.
O conceito de campo de cancerização foi proposto por Slaughter em 1953 e compreende uma área de tegumento aparentemente normal, porém com alterações subclínicas e multifocais, composta por células geneticamente alteradas em decorrência da exposição solar crônica.1,2 O conceito de campo de cancerização cutâneo (CCC) sugere que a pele clinicamente normal adjacente às queratoses actínicas (QAs) seja foco de expansão clonal de células geneticamente alteradas, o que explicaria a ocorrência de novas QAs ou outras neoplasias cutâneas em uma mesma área tegumentar, além da recorrência local de tumores considerados completamente excisados pela análise histopatológica.3
Recentemente, o CCC tem sido intensamente estudado devido a sua importância clínica, pois sua estabilização pode prevenir o surgimento de neoplasias, sua recorrência ou a evolução de lesões já existentes.
Atualmente, as QAs, lesões epiteliais pré‐neoplásicas são consideradas marcadores de atividade do CCC.4 Entretanto, até o momento, não há parâmetros objetivos bem definidos que possam indicar seu grau de atividade.
Determinar a extensão e a intensidade da atividade de um CCC torna‐se importante para criar estratégias de tratamento e prevenção diversas e adequadas para cada tipo de paciente, bem como para avaliar a resposta e o prognóstico após a instituição de terapêuticas adequadas.5 Survivina, p53 e Ki67 são marcadores nucleares presentes em células proliferativas e expressas em lesões neoplásicas e pré‐neoplásicas, que podem auxiliar na caracterização de um CCC em atividade.6
A síntese de p53 induz o reparo ao DNA e apoptose. Mutações na p53 são as alterações genéticas mais encontradas em neoplasias do ser humano.7 Recentemente, a análise de éxons no gene p53 em tumores do trato aerodigestivo tem demonstrado provável método molecular para detecção de campo de cancerização.8 Além disso, mutações na p53 podem ser encontradas em QAs e carcinomas espinocelulares (CEC) na maioria dos casos e em concentrações maiores nos CEC, enquanto pacientes sem lesões suspeitas de câncer não expressam mutações na p53, o que sugere que mutações na p53 podem estar envolvidas na conversão de QAs a CECs e, consequentemente, podem indicar atividade do CCC.9
O antígeno Ki67 é um marcador de proliferação celular10,11 que está correlacionado com crescimento tumoral e potencial metastático.12,13 A expressão nuclear de Ki67 foi estudada previamente em neoplasias cutâneas e é evidenciada em QA, doença de Bowen, carcinoma basocelular e CEC.14,15 Até o momento, não há estudos que descrevam a expressão de Ki67 na atividade de CCC.
A survivina é uma proteína expressa por queratinócitos proliferativos e pode ser encontrada no citoplasma ou no núcleo,16 atua tanto na regulação do ciclo celular quanto no controle da apoptose. Sua função varia de acordo com a localização intracelular:17 enquanto a expressão nuclear está mais associada à divisão celular e é essencial para a mitose, a presença de survivina no citoplasma é considerada citoprotetora.18 Um alto nível de survivina nuclear é preditivo de maior malignidade ou pior prognóstico quando analisado em tumores epiteliais.19–22 Além disso, a localização da survivina nuclear nas camadas da epiderme também influencia e indica prognóstico: enquanto a presença de survivina na camada basal pode ser encontrada em um epitélio sem alterações, a expressão de survivina nuclear nas camadas suprabasais indica ruptura da homeostase das células epidérmicas e, consequentemente, atividade mitótica, pode auxiliar na caracterização do CCC.23
A análise morfológica nuclear pode fornecer indícios sobre a fisiologia celular e contribuir para a avaliação diagnóstica e prognóstica de lesões neoplásicas. Além disso, alterações na arquitetura da cromatina nuclear podem indicar atividade mitótica intensa e se correlacionar com graus de proliferação neoplásicos. Desse modo, a morfometria e as características de texturas nucleares têm sido estudadas como fatores prognósticos em muitas neoplasias.24–27 Investigações sobre morfometria nuclear e heterogeneidade da cromatina foram feitas em CBCs, porém não há estudos que caracterizem tais parâmetros no CCC e os correlacionem com atividade de campo.28
O uso de técnicas morfométricas e imuno‐histoquímicas, juntamente com dados clínicos e histopatológicos, pode fornecer informações sobre o comportamento biológico e contribuir para a avaliação da efetividade de tratamentos.
MétodosEstudo transversal feito com pacientes adultos de ambos os gêneros, com QAs nos membros superiores, biopsiados em dois pontos: pele que engloba uma QA dos membros superiores e outro de pele axilar. Este estudo foi aprovado pelo Comitê de Ética em Pesquisa da instituição (CEP) e todos os pacientes incluídos assinaram termo de consentimento livre e esclarecido.
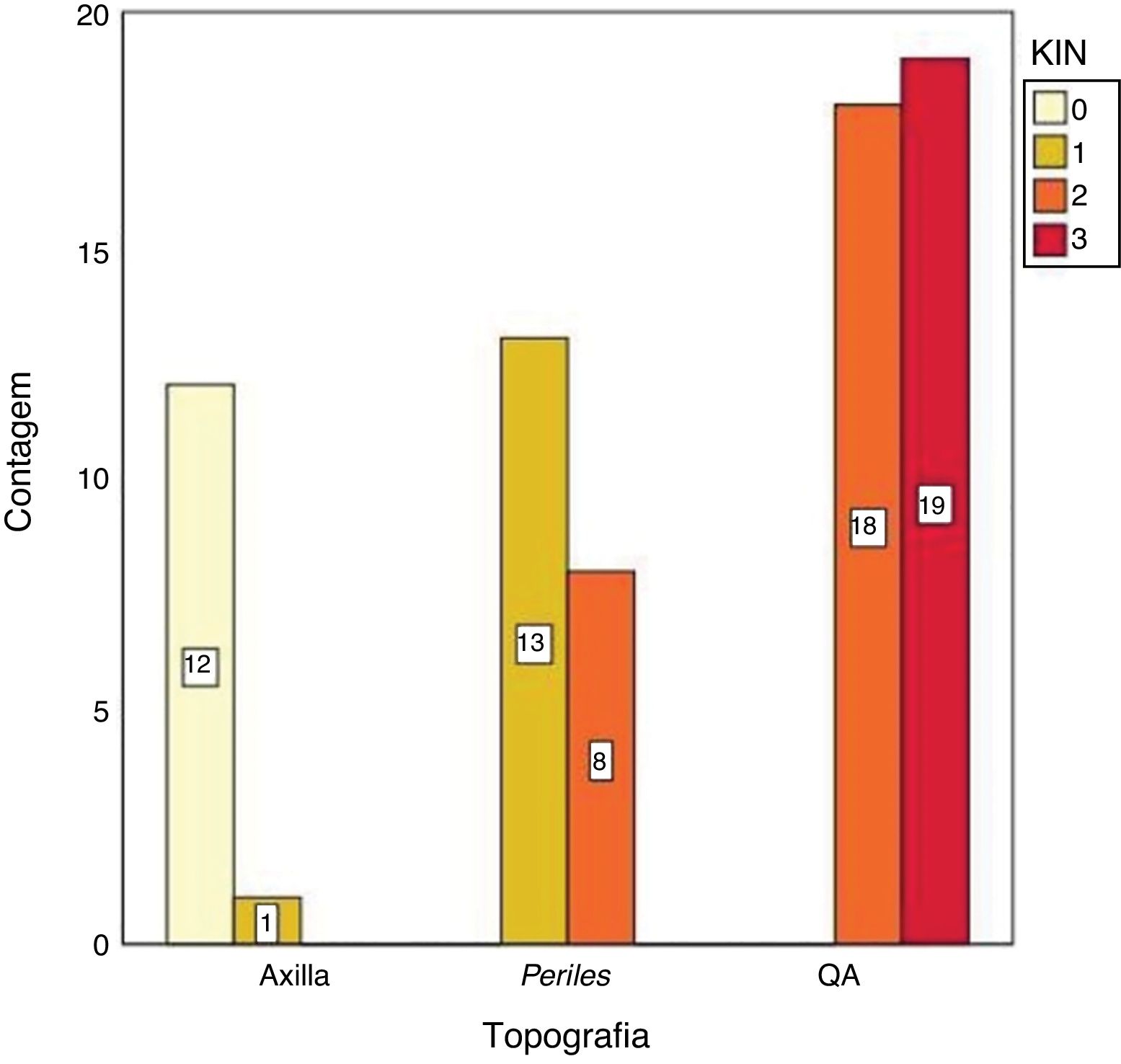
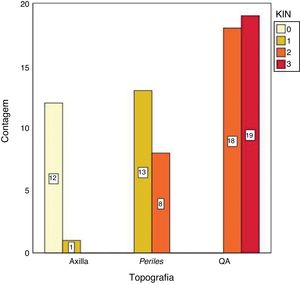
As biópsias de QAs, área perilesional e área fotoprotegida foram analisadas à histopatologia (HE) por meio do método KIN (keratinocyte intraepithelial neoplasia). A classificação KIN é um modo de classificar a intensidade da atipia dos queratinócitos por meio de sua presença nos níveis epidérmicos, de maneira que KIN I apresenta atipia focal no terço inferior dos queratinócitos; KIN II apresenta despolarização nas camadas espinhosa‐granulosa; e KIN III apresenta despolarização em todos os estratos epidérmicos.29 Para fins de análise estatística, a pele normal axilar foi considerada como KIN 0.
À imuno‐histoquímica foi analisada de acordo com a porcentagem de células coradas por survivina, p53 e Ki67 nos hotspots de QA, áreas perilesionais e axilares.
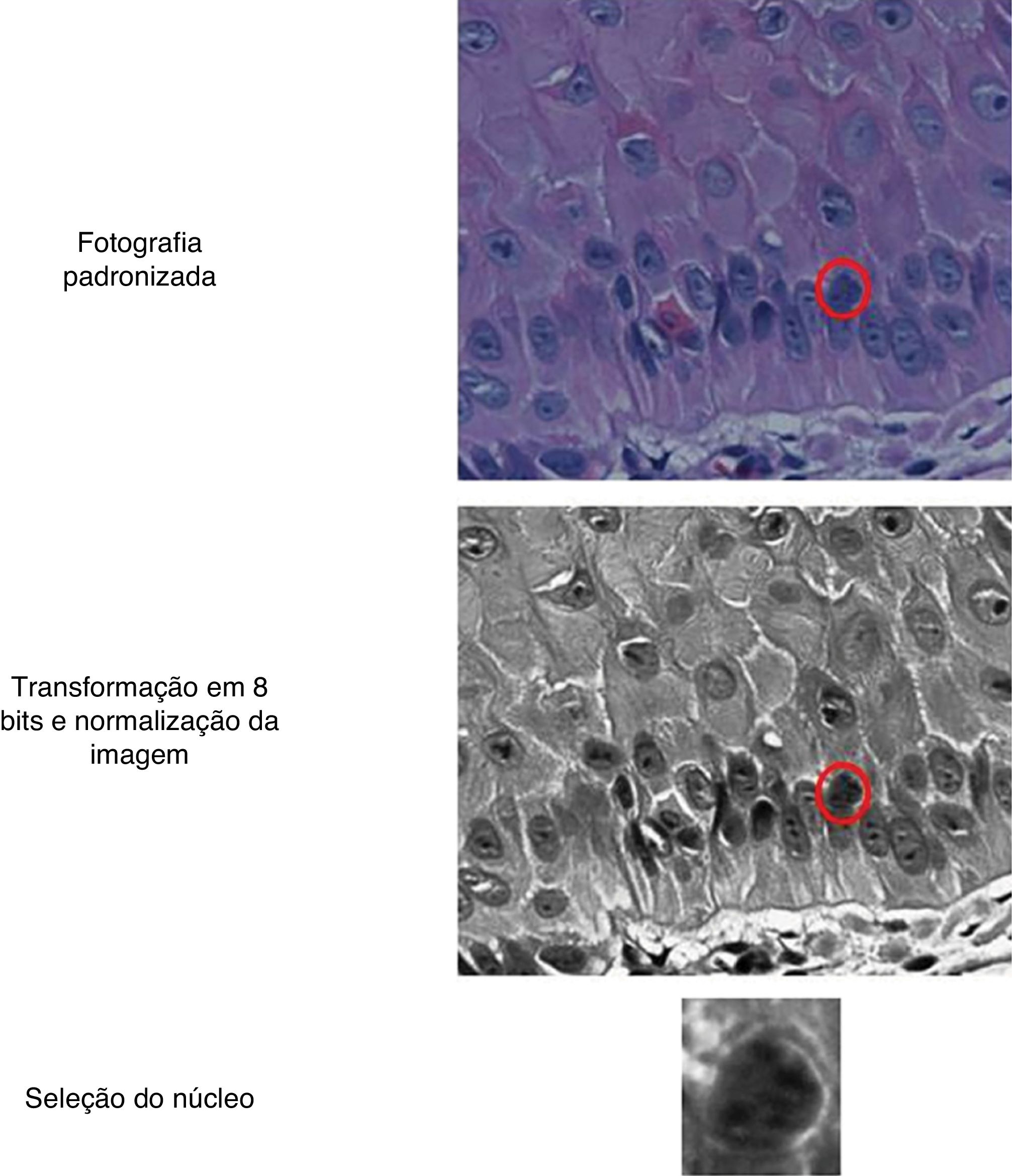
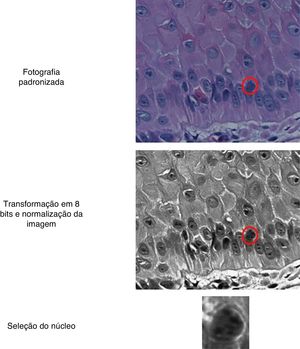
As lâminas foram fotografadas em alta resolução (400×) com microscópio Coolscope II (Nikon Instruments Inc., Tókio, Japão, 2009), com registro de cerca de 30 núcleos/campo. Os núcleos da camada basal da epiderme foram recortados manualmente e suas imagens transformadas para 8 bits e normalizadas. Foi usado o software ImageJ (fig. 1). As imagens resultantes foram submetidas à extração dos índices de entropia, intensidade da cor, dimensão fractal, Ra, circularidade, perímetro e área.
Quanto à análise estatística, os dados foram comparados entre as topografias pelo teste de Jonckheere‐Terpstra. A normalidade foi estimada pelo teste de Shapiro‐Wilk.30 As correlações entre os indicadores foram estimadas pelo coeficiente de Spearman e apresentadas como mapa térmico.31 Os comportamentos das variáveis foram comparados por análise de correspondência múltipla e dispostos pelo mapa perceptual.32 Foram considerados significativos valores de p < 0,05.
ResultadosForam incluídos 13 pacientes: quatro mulheres e nove homens, de 37 a 88 anos, em que foram amostradas 38 QA.
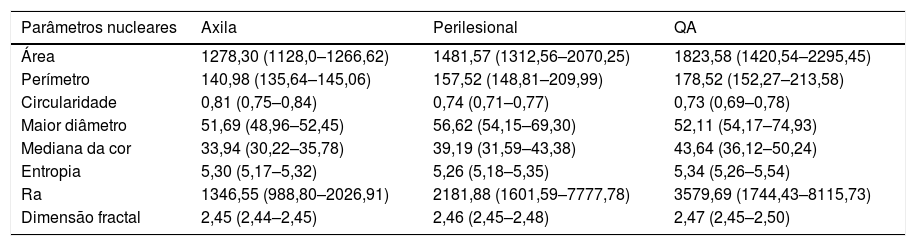
Na morfometria, foram analisados 1.039 núcleos, dos quais 228 representavam pele íntegra axilar, 396 das QA e 415da área perilesional à QA. Os valores médios de das morfometrias estão dispostos na tabela 1.
Valores das variáveis conforme a localização da amostra de pele. Todas as variáveis resultaram em p < 0,05
| Parâmetros nucleares | Axila | Perilesional | QA |
|---|---|---|---|
| Área | 1278,30 (1128,0–1266,62) | 1481,57 (1312,56–2070,25) | 1823,58 (1420,54–2295,45) |
| Perímetro | 140,98 (135,64–145,06) | 157,52 (148,81–209,99) | 178,52 (152,27–213,58) |
| Circularidade | 0,81 (0,75–0,84) | 0,74 (0,71–0,77) | 0,73 (0,69–0,78) |
| Maior diâmetro | 51,69 (48,96–52,45) | 56,62 (54,15–69,30) | 52,11 (54,17–74,93) |
| Mediana da cor | 33,94 (30,22–35,78) | 39,19 (31,59–43,38) | 43,64 (36,12–50,24) |
| Entropia | 5,30 (5,17–5,32) | 5,26 (5,18–5,35) | 5,34 (5,26–5,54) |
| Ra | 1346,55 (988,80–2026,91) | 2181,88 (1601,59–7777,78) | 3579,69 (1744,43–8115,73) |
| Dimensão fractal | 2,45 (2,44–2,45) | 2,46 (2,45–2,48) | 2,47 (2,45–2,50) |
a Mediana (p25–75).
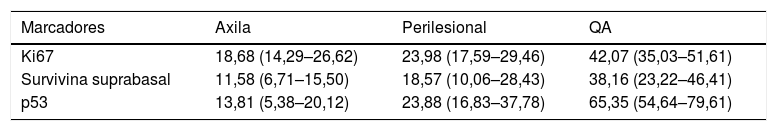
Houve diferença significativa (p < 0,05) nos valores da pele fotoprotegida e fotoexposta em todas as variáveis testadas (p53, Ki67), como observado na tabela 2. Além disso, KIN mostrou‐se diretamente relacionada com a fotoexposição, tendeu a zero na pele fotoprotegida (fig. 2).
Porcentagem de células que expressam survivina, p53 e Ki67 nas QA, pele fotoexposta e pele fotoprotegida. Todas as variáveis resultaram em p < 0,05
| Marcadores | Axila | Perilesional | QA |
|---|---|---|---|
| Ki67 | 18,68 (14,29–26,62) | 23,98 (17,59–29,46) | 42,07 (35,03–51,61) |
| Survivina suprabasal | 11,58 (6,71–15,50) | 18,57 (10,06–28,43) | 38,16 (23,22–46,41) |
| p53 | 13,81 (5,38–20,12) | 23,88 (16,83–37,78) | 65,35 (54,64–79,61) |
a Mediana (p25–75).
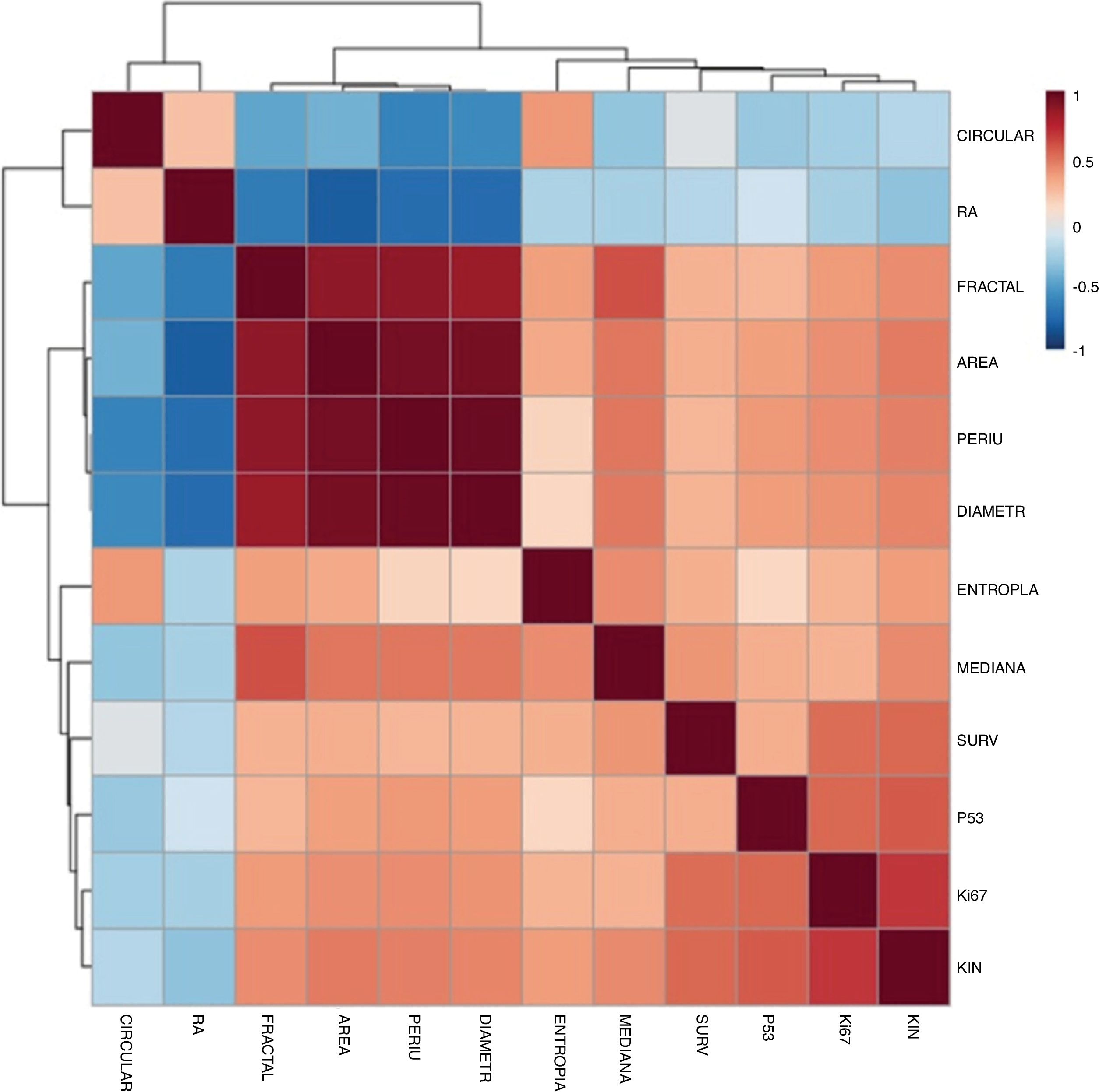
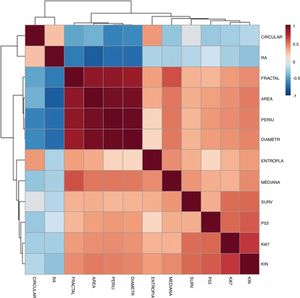
Identificou‐se correlação entre os indicadores morfométricos e de proliferação e apoptose (fig. 3). Os elementos que mais se correlacionaram com o KIN foram o p53 e Ki67. Houve intensa correlação dos elementos morfométricos entre si.
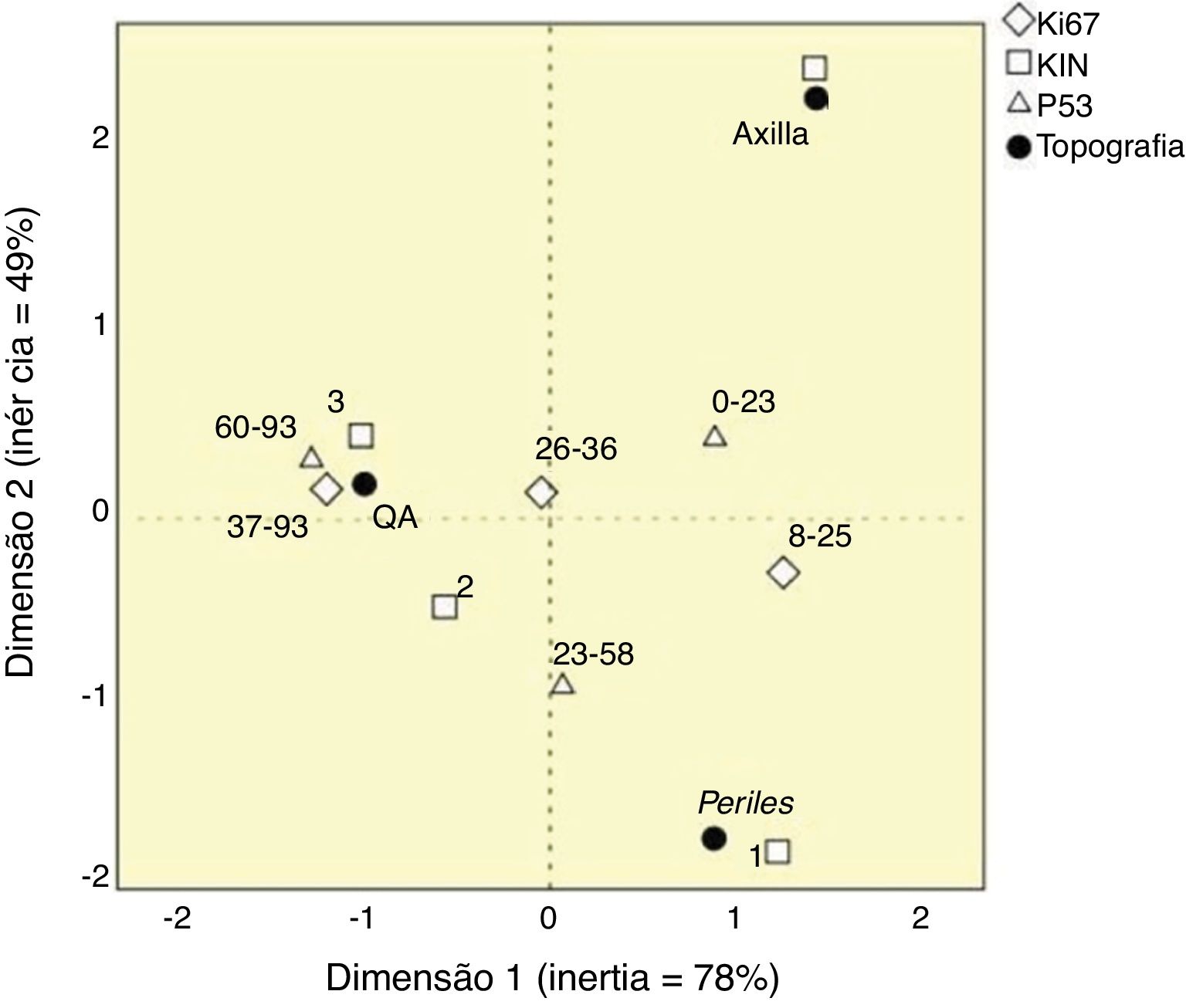
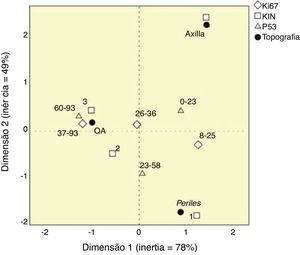
Nenhuma das variáveis testadas destacou‐se como marcador individual de atividade do CCC; entretanto, KIN, p53 e Ki67, em conjunto, puderam caracterizar o comportamento das topografias (fig. 4). Houve grande proximidade espacial da QA com KIN III e os maiores valores de Ki67 e p53; a pele fotoexposta teve grande proximidade ao KIN I e valores intermediários dos outros marcadores, enquanto a epiderme axilar apresentou maior proximidade ao KIN 0.
DiscussãoO CCC, nesse grupo de amostras, caracterizou‐se por maior proliferação epitelial, aumento na expressão de fatores ligados à apoptose e alterações na morfologia nuclear, em concordância com a literatura.9,11 Houve progressiva expressão dessas variáveis na pele fotoprotegida em relação à pele fotoexposta e QAs, mostrou que a exposição crônica à radiação ultravioleta promove alterações teciduais no CCC, com correlação entre a expressão desses fatores e o grau de displasia histológica do epitélio.
As associações dos epitélios com a expressão de KIN, p53 e Ki67 modificaram‐se proporcionalmente de acordo com a fotoexposição, o que os sugere como fortes candidatos à caracterização do CCC e indicam que podem ser usados na análise de sua atividade em ensaios clínicos terapêuticos e no desenvolvimento de medidas que visem à prevenção do desenvolvimento de cânceres de pele.
Houve, também, aumento de expressão de survivina suprabasal com relação diretamente proporcional ao aumento da exposição solar e presença de QA, como esperado pela literatura;23 entretanto, sua correlação com Ki67 e p53, marcadores bem estabelecidos,11–14 foi menos intensa (fig. 3). Além disso, ainda são necessários mais estudos de correlação entre a expressão de survivina suprabasal e atividade do CCC para que haja maior nível de evidência desses achados.
Alterações da morfometria nuclear e da textura da cromatina são usadas em patologia como critérios de diferenciação entre tecidos saudáveis e de neoplasias.24,31 Além disso, tecidos sob estresse, como a radiação ultravioleta, também podem apresentar alterações nucleares, geralmente relacionadas à intensidade da atividade metabólica.24,28 Neste estudo, fenotipicamente, o dano genômico do CCC manifestou‐se como variações do formato do núcleo e heterogeneidade da cromatina, correlacionadas entre si e com alterações de caráter progressivo de acordo com a fotoexposição e presença de QAs, subsidiaram as evidências de instabilidade genômica e sugeriram que essas alterações ocorram de maneira simultânea intranuclear.
As principais limitações do estudo referem‐se à pequena quantidade de participantes, apesar de possibilitarem um número suficiente de lesões para análise. Como o estudo é transversal, embora QAs e CCC sejam entidades instáveis, um desenho longitudinal poderia fornecer elementos mais consistentes de sua atividade ligadas ao prognóstico oncológico.33,34
A caracterização histológica do CCC deve oferecer subsídios adicionais à contagem de QAs e às escalas de qualidade de vida e aos escores clínicos de gravidade4,35,36 na compreensão dos fenômenos subjacente ao CCC. Esses achados estão sendo testados em ensaios clínicos com tratamentos de campo de cancerização, como terapia fotodinâmica,37 mebutato de ingenol e 5‐fluorouracil, assim como de acordo com uma escala de gravidade de QAs, em desenvolvimento por nosso grupo de estudo em CCC.
ConclusãoVariáveis morfométricas e relativas à textura da cromatina apresentaram diferença na comparação da pele fotoexposta e fotoprotegida. KIN, p53 e Ki67 – conjuntamente – tornaram possível a caracterização do CCC.
Suporte financeiroNenhum.
Contribuição dos autoresAnna Carolina Miola: Aprovação da versão final do manuscrito; Elaboração e redação do manuscrito; Obtenção, análise e interpretação dos dados; Revisão crítica da literatura
Mariana Anteghini Castilho: Aprovação da versão final do manuscrito; concepção e planejamento do estudo; obtenção, análise e interpretação dos dados.
Juliano Vilaverde Schmitt: Aprovação da versão final do manuscrito; obtenção, análise e interpretação dos dados; participação efetiva na orientação da pesquisa; participação intelectual em conduta propedêutica e/ou terapêutica de casos estudados; revisão crítica da literatura; revisão crítica do manuscrito.
Mariangela Esther Alencar Marques: Aprovação da versão final do manuscrito; revisão crítica do manuscrito.
Helio Amante Miot: Análise estatística; aprovação da versão final do manuscrito; participação efetiva na orientação da pesquisa; participação intelectual em conduta propedêutica e/ou terapêutica de casos estudados; revisão crítica da literatura.
Conflitos de interesseNenhum.
Como citar este artigo: Miola AC, Castilho MA, Schmitt JV, Marques MEA, Miot HA. Contribution to characterization of the skin field cancerization activity: morphometric, chromatin texture, proliferation, and apoptosis aspects. An Bras Dermatol. 2019;94:698–703.
Trabalho realizado na Faculdade de Medicina de Botucatu, Universidade Estadual Paulista, Botucatu, SP, Brasil.