A isotretinoína é retinoide sintético derivado da vitamina A, com múltiplos mecanismos de ação, altamente eficaz no tratamento da acne, apesar dos eventos adversos comuns controláveis e dose‐dependentes. A teratogenicidade, dose‐independente, é o mais grave deles. Portanto, indicações não aprovadas exigem critérios rigorosos.
ObjetivoComunicar experiência e recomendação de dermatologistas brasileiros sobre uso oral do fármaco em dermatologia.
MétodosOito especialistas, de cinco universidades, foram indicados pela Sociedade Brasileira de Dermatologia para elaborar consenso sobre indicações desse fármaco. Pela metodologia DELPHI adaptada, foram relacionados elementos relevantes e foi feita extensa análise da literatura. O consenso foi definido com aprovação de, no mínimo, 70% dos especialistas.
ResultadosCom aprovação de 100% dos autores, não houve dúvidas sobre a eficácia da isotretinoína oral no tratamento da acne, até como adjuvante na correção das cicatrizes. Os eventos adversos comuns frequentes e controláveis são os mucocutâneos; outros, como atraso no crescimento, cicatrização anormal, depressão e doença inflamatória intestinal, foram exaustivamente investigados e não existem evidências de associação causal – são raros, individuais e não devem contraindicar o uso do fármaco. Sobre indicações não aprovadas, pode representar opção em casos de rosácea refratária, dermatite seborreica grave, estabilização do campo de cancerização com fotoenvelhecimento avançado e, embora incipiente, alopecia frontal fibrosante. Para distúrbios da queratinização, a acitretina apresenta desempenho superior. Na opinião dos autores, não são recomendadas indicações com finalidade unicamente estética ou controle da oleosidade, particularmente para mulheres em idade fértil.
ConclusõesForam apresentadas e avaliadas criticamente as indicações aprovadas e não aprovadas, a eficácia e os efeitos adversos da isotretinoína oral em dermatologia.
A isotretinoína (ácido‐13‐cis‐retinoico) oral é retinoide derivado da vitamina A. Foi sintetizada em 1955, mas somente em 1973 iniciaram‐se estudos sobre seu uso na psoríase, distúrbios genéticos da queratinização, acne cística e carcinoma basocelular. Nos anos 1980, tornou‐se a opção mais efetiva para o tratamento da acne nódulo‐cística. Atualmente, é indicada para formas moderadas resistentes a outros tratamentos. Foi aprovada para acne nos Estados Unidos em 1982, na Europa em 1983 e no Brasil em 1990 e, revolucionou o tratamento das formas graves de acne.1–5
Os efeitos colaterais clínicos (mucocutâneos) e laboratoriais (função hepática e perfil lipídico) são dose‐dependentes, previsíveis, controláveis e reversíveis, exceto a teratogenicidade. A acne é a única indicação aprovada, embora muitos usos não aprovados tenham sido relatados.6–8
A isotretinoína atua como pró‐fármaco, convertida em ácido all‐trans retinoico (ATRA) no citoplasma das células para ser transportada ao núcleo, onde se liga aos receptores nucleares de ácido retinoico, RAR e RXR, isoformas a, b, g.9 Os mecanismos de ação conhecidos são: normalização da hiperqueratinização infundibular, inibição da produção das citoqueratinas 1, 10 e 14, filagrina e metaloproteinases de matriz (MMPs) e aumento das citoqueratinas 7, 13 e 19, laminina B1 e IL‐1. Efeitos na proliferação, diferenciação, apoptose e renovação celular, além da imunomodulação, relacionam‐se à regulação da expressão de genes, influem em fatores de transcrição nucleares. Ocorre ativação de alguns genes (supressores de tumores ou apoptóticos, como p53 e BAX e codificadores da produção de colágeno e fibronectina) e inibição de outros (envolvidos no metabolismo lipídico).10–12 Sobre a apoptose, o ATRA aumenta a expressão do fator de transcrição forkhead box O3 (FoxO3), ativa a via ligante indutora de apoptose relacionada ao fator de necrose tumoral (TRAIL) e a produção das caspases FoxO1, interrompe o ciclo celular, pela expressão dos genes p21, 27 e 53.13–16 A ativação do FoxO1, corregulador negativo do receptor de andrógeno, receptor gama ativado por proliferador de peroxissoma (PPAR gama) e liver X receptor‐[alpha] sterol response element binding protein‐1c (SREBP‐1c), reduz a lipogênese. A atenuação do alvo mecanístico do complexo 1 de rapamicina (mTORC1) estimula a expressão do PPAR gama e SREBP‐1c.16 Pela regulação negativa de genes relacionados à via IGF1 (fator de crescimento semelhante à insulina tipo 1)/PI3K (fosfatidilinositol 3‐quinase)/AKT (proteína quinase B)/mTORC1 e positiva dos responsáveis pelas vias FoxO1 e FoxO3/TRAIL/caspase, há supressão da sebogênese e apoptose de sebócitos.16–18 A ativação das vias p53 representa a interligação entre as vias sinalizadoras reguladas positiva ou negativamente pela isotretinoína. A proteína BAX induz a apoptose de queratinócitos com mutações induzidas pela radiação UV e tem sua expressão reduzida pela isotretinoína, dada sua ação anticarcinogênica.14 É o único fármaco que isoladamente atua nos quatro fatores etiopatogênicos da acne: reduz a hiperqueratinização acroinfundibular e a comedogênese; suprime a sebogênese, pela redução em até 90% do tamanho e atividade das glândulas sebáceas; diminui a população de Cutibacterium acnes (C. acnes), antes denominado Propionibacterium acnes (P. acnes) por alteração no microambiente folicular e modula a inflamação pela regulação negativa dos receptores de membrana toll‐like 2 e 4 (TLR‐2 e 4) dos queratinócitos, sebócitos, monócitos, células da córnea e células imunes.18–22 Esses receptores são ativados ao reconhecer padrões moleculares do C. acnes e, quando inibidos, há regulação negativa das vias nucleares NF‐κB (fator nuclear kappa B) que desencadeia a produção de citocinas (IL‐8, IL‐1 β, IL‐17, IFNγ) e AP‐1 (proteína ativadora 1), responsável pela síntese de MMPs.13,20 Após 40 anos, acredita‐se que não estão elucidados todos os mecanismos de ação na pele e outros órgãos. Porém, o conhecimento existente explica a eficácia na acne vulgar e os eventos adversos e justifica as indicações não aprovadas.23–25
As ações da isotretinoína em diferentes células, que explicam os efeitos benéficos e eventos adversos, estão resumidas na tabela 1.
Mecanismo de ação da isotretinoína oral em diferentes tipos celulares
| Tipo de célula | Efeito da isotretinoína (desejado ou adverso) |
|---|---|
| Sebócito | ↓ Produção de sebo; melhoria da acne |
| Células da crista neural | Teratogenicidade |
| Células do hipocampo | Redução da neurogênese hipocampal: depressão |
| Queratinócito | Efeitos adversos mucocutâneos – alteração corneificação |
| Células do folículo piloso | Eflúvio telógeno |
| Miótico | Liberação de CPK |
| Hepatócito | Liberação de transaminases |
| Epitélio intestinal | Doença inflamatória intestinal |
| Células meibomianas | Olhos secos |
CPK, creatina fosfoquinase.
O objetivo deste artigo é apresentar o consenso sobre os efeitos da isotretinoína oral na pele e suas indicações, na acne e outras ainda não aprovadas, apesar da existência de dados relevantes na literatura consultada.
MétodosOito dermatologistas, experts no tema “isotretinoína”, foram indicados para a composição de um consenso sobre o uso da isotretinoína oral em dermatologia, considerou‐se a metodologia DELPHI adaptada. Na primeira fase, houve discussão sobre tópicos relevantes e estruturação do texto no qual cada autor responsabilizou‐se por um tópico; na segunda fase, foi feita revisão bibliográfica e elaboração dos textos. As bases consultadas foram: Cochrane Skin Group Specialised Register, Cochrane Library, Medline, PubMed, Embase, Lilacs, buscaram‐se publicações em português, inglês e espanhol, por meio das seguintes palavras‐chave: isotretinoína, aliança terapêutica, dermatologia, acne vulgar, dermatite seborreica, rosácea, psoríase, ceratose actínica, envelhecimento da pele, Dermatology, oral isotretinoin, off label use, off label prescribing, acne, skin diseases, rosacea, photoaging of skin, actinic keratosis, seborrheicdermatitis, psoriasis, alopecia. O primeiro autor e o mentor ficaram responsáveis por construir um texto único e enviá‐lo para a revisão pelos demais. Na terceira fase, ambos estabeleceram o consenso dos textos, permaneceram aqueles que atingiram 70% de consenso.
Resultados/discussãoForam definidos dois tópicos sobre isotretinoína oral em dermatologia: acne vulgar e indicações relevantes, não aprovadas (doenças inflamatórias da pele e couro cabeludo, fotoenvelhecimento e campo de cancerização). Os resultados e a discussão de cada tópico são apresentados a seguir.
Acne vulgarA isotretinoína é o único fármaco que atua em todos os fatores etiopatogênicos da acne vulgar, mantém‐se como a única monoterapia capaz de proporcionar a remissão prolongada ou a cura em até 80% dos pacientes, com um ciclo de tratamento.
A acne vulgar, doença inflamatória crônica, imunomediada e multifatorial, acomete a unidade pilossebácea e está entre as três dermatoses mais prevalentes no mundo.26 Pode gerar sequelas físicas (cicatrizes) e psíquicas, só superadas pelos eczemas.27 Acomete 80%−90% da população mundial em alguma fase da vida, com pico de prevalência entre 16−20 anos.28–32 Foi a principal causa de visita ao dermatologista no levantamento entre associados da Sociedade Brasileira de Dermatologia e outros estudos epidemiológicos.33–35
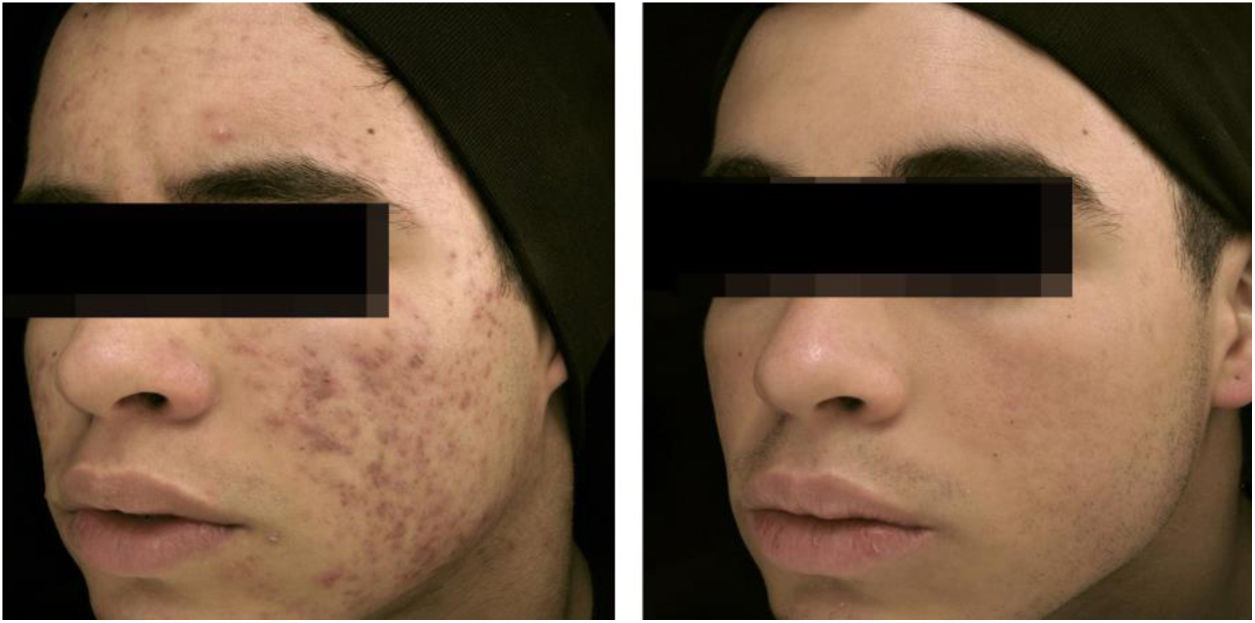
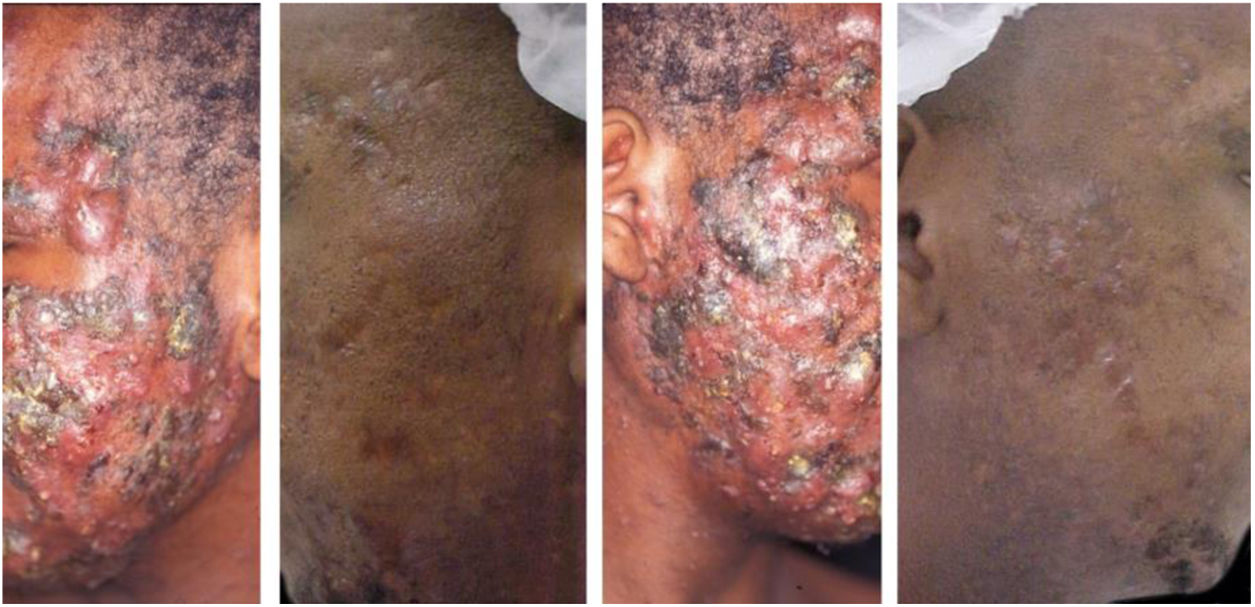
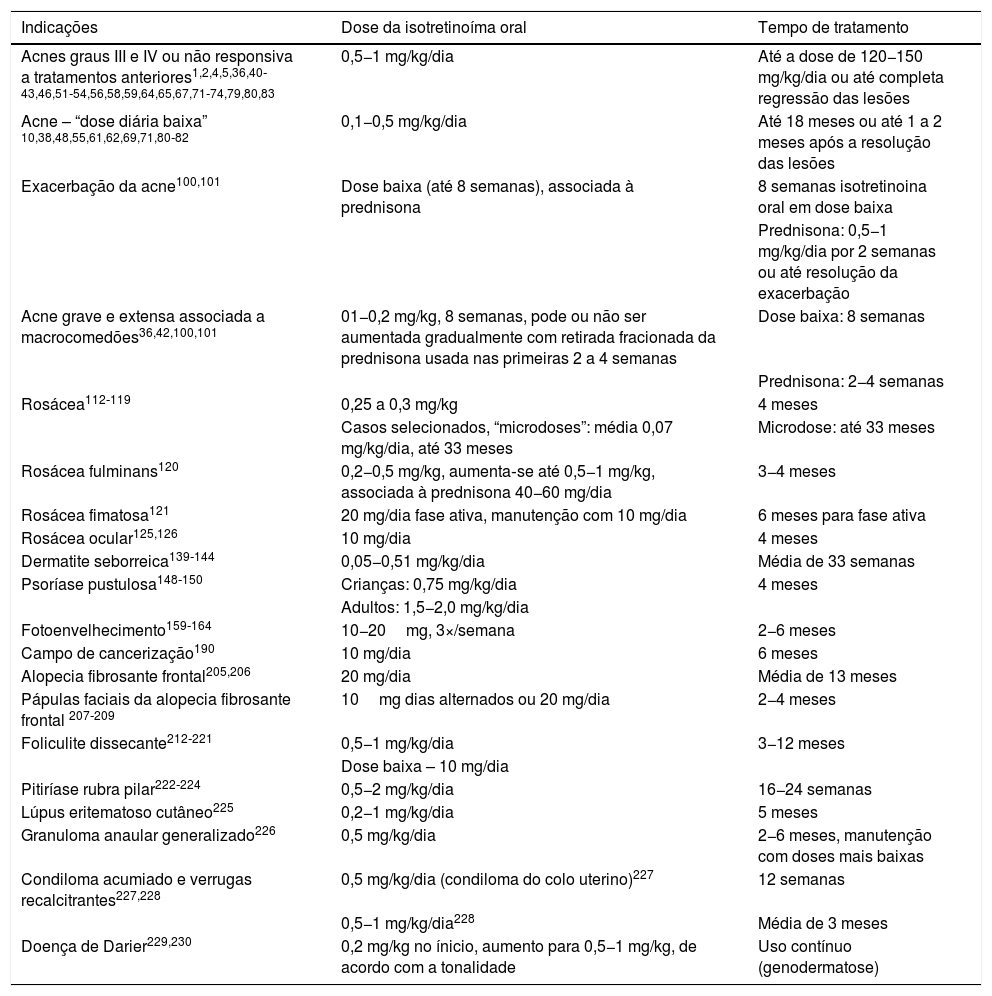
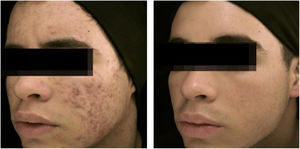
A eficácia clínica da isotretinoína oral é superior aos outros tratamentos da acne, promove cura ou remissão prolongada,36 melhoria da qualidade de vida e do dano psicossocial, porém com efeitos adversos em até 90% dos pacientes.36–39 As figuras 1 e 2 ilustram pacientes tratados com isotretinoína oral, com cura da acne e ausência de recidiva em dois anos de seguimento. Algumas controvérsias sobre eventos raros e graves, particularmente depressão, suicídio e doença inflamatória intestinal (DII), não tiveram associação causal comprovada.40 Foi aprovada para acne grave (conglobata e nódulo‐cística), mas evidências demonstradas em estudos clínicos randomizados e controlados (ECRCs), desde 1980, em revisões sistemáticas (RSs), consensos e recomendações de sociedades de dermatologia tornaram possível expandir a indicação para formas nódulo‐cística e papulopustulosa moderadas, resistentes aos outros tratamentos, tendência a cicatrizes, prejuízo emocional e das funções sociais.1,2,36,38,40–74 Um curso único do fármaco leva à cura em 2/3 dos pacientes. Recorrências podem ocorrer, mas são mais leves e controláveis com tratamentos tópicos.66 Algumas características da doença favorecem a recidiva e o retratamento.66,75–78
Paciente de 18 anos com acne inflamatória moderada na face e tronco havia quatro anos, apresentava cicatrizes, com impacto negativo relevante na qualidade de vida. Submetido anteriormente a quatro ciclos de ciclina oral associada à combinação tópica de peróxido de benzoíla e adapaleno, com melhoria e recidiva em dois a três meses. No último ciclo, apresentou piora na vigência do tratamento. Foi tratado com isotretinoína oral 40 mg/kg/dia (0,6mg/kg/dia), com regressão total das lesões após quatro meses e manutenção por mais um mês (dose total=100 mg/kg/dia) – esquema terapêutico baseado em publicações recentes. Fotos antes e após o tratamento com isotretinoína oral. Tratamento de manutenção com adapaleno 0,1% gel por 12 meses. Não houve recidiva.
Paciente de 22 anos com acne conglobata apenas na face havia 15 meses. Tratado anteriormente com antibióticos orais e produtos tópicos (não soube informar nomes), sem melhora. Foi introduzida isotretinoína 20 mg/dia (0,3 mg/kg/dia) e prednisona 40, 30, 20 e 10 mg/dia a cada sete dias. A duração do tratamento, sempre com a mesma dose diária, foi de 18 meses (160 mg/kg), até resolução completa das lesões. Tratamento de manutenção com peróxido de benzoíla 5% por 12 meses. Não houve recidiva.
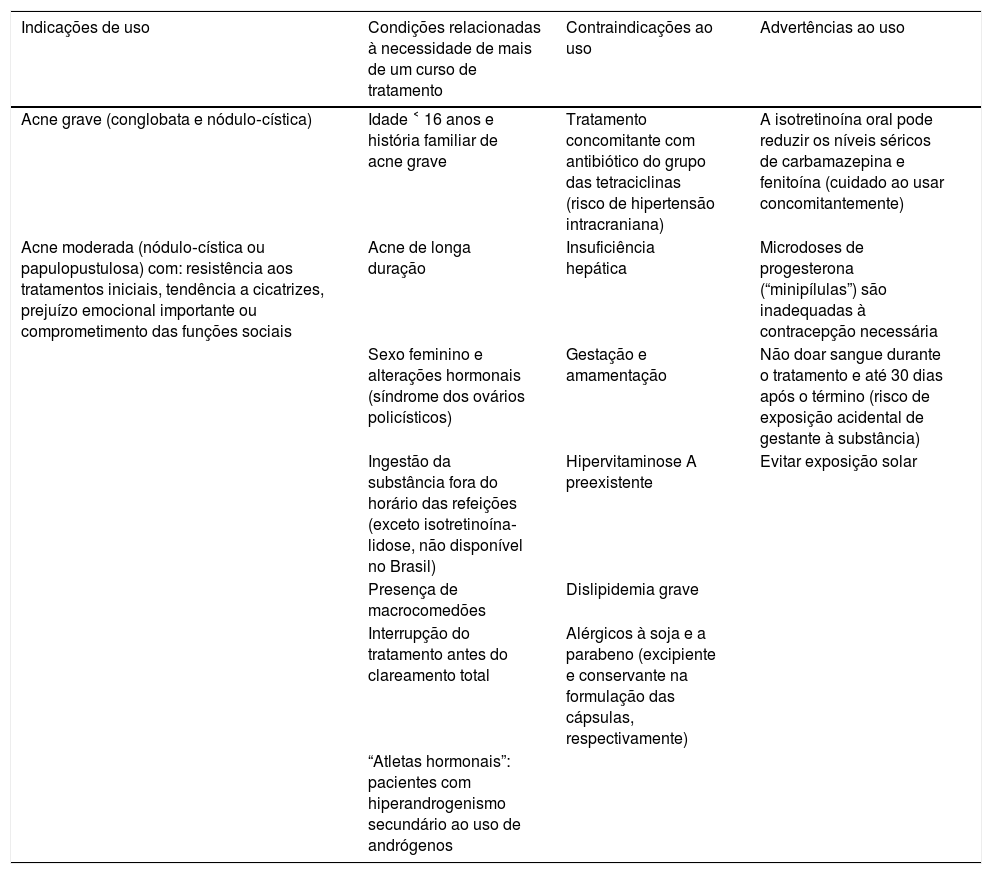
A tabela 2 apresenta indicações, contraindicações e advertências ao uso, além das características da acne relacionadas à necessidade de retratamento. Apesar de 31 ECRC, duas RSs concluíram que são necessários estudos com melhor metodologia, menos heterogêneos quanto aos desfechos sobre a eficácia, particularmente nos estudos comparativos entre o uso da isotretinoína oral e antibióticos orais associados a agentes tópicos (combinações de retinoide e peróxido de benzoíla). Ainda, os estudos devem incluir maior número de participantes, principalmente do sexo feminino, pré‐adolescentes e com acometimento do tronco e analisar desfechos de eficácia em longo prazo, em especial a superioridade desse fármaco quanto à cura ou remissão prolongada da acne.40,70
Indicações, contraindicações, advertências e características da isotretinoína no tratamento da acne e condições relacionadas à necessidade de retratamento
| Indicações de uso | Condições relacionadas à necessidade de mais de um curso de tratamento | Contraindicações ao uso | Advertências ao uso |
|---|---|---|---|
| Acne grave (conglobata e nódulo‐cística) | Idade ˂ 16 anos e história familiar de acne grave | Tratamento concomitante com antibiótico do grupo das tetraciclinas (risco de hipertensão intracraniana) | A isotretinoína oral pode reduzir os níveis séricos de carbamazepina e fenitoína (cuidado ao usar concomitantemente) |
| Acne moderada (nódulo‐cística ou papulopustulosa) com: resistência aos tratamentos iniciais, tendência a cicatrizes, prejuízo emocional importante ou comprometimento das funções sociais | Acne de longa duração | Insuficiência hepática | Microdoses de progesterona (“minipílulas”) são inadequadas à contracepção necessária |
| Sexo feminino e alterações hormonais (síndrome dos ovários policísticos) | Gestação e amamentação | Não doar sangue durante o tratamento e até 30 dias após o término (risco de exposição acidental de gestante à substância) | |
| Ingestão da substância fora do horário das refeições (exceto isotretinoína‐lidose, não disponível no Brasil) | Hipervitaminose A preexistente | Evitar exposição solar | |
| Presença de macrocomedões | Dislipidemia grave | ||
| Interrupção do tratamento antes do clareamento total | Alérgicos à soja e a parabeno (excipiente e conservante na formulação das cápsulas, respectivamente) | ||
| “Atletas hormonais”: pacientes com hiperandrogenismo secundário ao uso de andrógenos |
A dose aprovada em bula é de 0,5 a 1mg/kg/dia, ingerida após as refeições, pelo caráter lipofílico da molécula, exceto para a variante isotretinoína‐lidose, não disponível no Brasil, que pode ser administrada em jejum.66,79 Um ECRC comparou a dose diária em duas refeições versus dose única; não houve diferença na eficácia, mas efeitos adversos foram mais observados com dose única.67 Porém, há preferência pela dose única para maior adesão.79 RS analisou ECRC com diferentes doses diárias e esquemas terapêuticos.40 A eficácia foi maior entre grupos que receberam dose convencional ou baixa (< 0,5mg/kg/dia) diariamente quando comparada ao uso intermitente, em pulsos mensais ou dias alternados.56,62,68 Efeitos adversos leves foram mais frequentes com uso diário e contínuo, sob dose baixa ou convencional.55,56,60,62,68 O uso intermitente foi menos eficaz e não é recomendado.36 Recentemente, estudos mostraram tendência à prescrição de doses diárias mais baixas (0,1−0,5mg/kg, até 5mg) para acne moderada, com duração mais prolongada, até 18 meses, menos eventos adversos, melhor tolerabilidade e índices de recidiva similares aos observados com dose convencional, mantém‐se o tratamento por dois a quatro meses após a resolução total das lesões.38,71,80–82 Duração prolongada é necessária nos casos graves e acometimento extrafacial.77 A dose total aprovada (120 a 150mg/kg) mantém‐se nos estudos clínicos, consensos e prática dermatológica; porém, nunca houve um racional baseado em ECRC.81–84 Estudos com melhor metodologia mostraram que a dose total fixa não é o melhor referencial para a duração do tratamento, que deve considerar condições individuais, regressão da doença e manutenção por dois a quatro meses, após resolução total das lesões.40,71,77,81,82,84,85
Eventos adversos clínicos mucocutâneos, dose‐dependentes, são comuns, como a queilite (que afeta 90%−100% dos pacientes), xerose cutânea, dos olhos e mucosa nasal. São controláveis com o uso de lubrificantes labiais, emolientes oculares e nasais e regridem com a redução da dose ou a suspensão do tratamento.36 Outros eventos raros são: alopecia, granuloma piogênico, fotossensibilidade, artralgias, mialgias, cefaleia, anorexia, insônia e irritabilidade.70 O risco mais grave é a teratogenicidade, dose‐independente.4,40 A gravidez pode ter evolução normal em 65%−85% dos casos, mas há risco de aborto espontâneo (10,9%−20%) e embriopatias (18%−28%), com anomalias craniofaciais, do sistema nervoso central, timo e cardiovasculares.4–7 A possibilidade de gravidez deve ser afastada (teste e aguardar menstruação); é obrigatória a prescrição de anticoncepcionais orais ou dispositivos intrauterinos associados a preservativo para mulheres em idade fértil, exceto se histerectomizadas.4,83 A dosagem da betagonadotrofina coriônica sanguínea deve ser solicitada previamente e mensalmente, durante o tratamento. Não há riscos para gestações futuras, liberadas um mês após o término do tratamento.83,86
A hipótese de desencadeamento de distúrbios psiquiátricos e DII causou inúmeros processos judiciais nos Estados Unidos. Entretanto, nenhum ECRC comprovou essas associações.40,70 Análise qualitativa de 14 estudos não randomizados sobre eventos adversos graves, dos quais nove eram sobre psiquiátricos e sete sobre DII, não detectou aumento do risco.40,87‐95. Outras duas RS, com metanálise, avaliaram depressão e DII e não detectaram risco aumentado pela exposição à isotretinoína. Contrariamente, foi demonstrada redução dos níveis de depressão comparados à terapia tópica.96
A acne relaciona‐se a dano psicossocial, aumento do risco de depressão e suicídio, condições já presentes na adolescência.81,97 Podem existir subgrupos mais suscetíveis à depressão e psicose induzidas, de forma idiossincrásica, pela isotretinoína.40,98 Histórico pessoal e/ou familiar de depressão não contraindicam o uso da substância, em doses diárias baixas e monitoramento do humor e comportamento na rotina diária, junto com psiquiatra.81
O risco aumentado de DII já foi associado ao uso prévio de antibióticos e à própria acne.72,91,99 Assim, histórico de DII não contraindica a isotretinoína.
A exacerbação da acne nas primeiras oito semanas do tratamento está relacionada à apoptose dos sebócitos, liberação de antígenos e resposta inflamatória intensa; ocorre em 15%−18% dos pacientes, com resolução espontânea.100 Entretanto, pode mimetizar acne fulminante, sem sintomas sistêmicos, com intensa inflamação, ulceração, crostas e cicatrizes.101 O fármaco deve ser mantido em dose baixa e associado à prednisona, 0,5−1 mg/kg/dia por duas a quatro semanas ou até resolução. Acne grave e extensa (face, tórax e dorso), macrocomedões e história familiar indicam início do tratamento com dose diária baixa (0,1−0,2mg/kg), associada à prednisona nas primeiras duas a quatro semanas; a dose baixa deve ser mantida por oito semanas, pode ou não ser aumentada gradualmente junto com retirada fracionada do corticoide.36,42,100–102
Alterações laboratoriais correspondem a 2% dos eventos adversos detectados.70 Dosagens séricas mais frequentemente alteradas, de acordo com revisões sistemáticas e metanálises, são: triglicerídeos (44%), colesterol total, LDL‐colesterol (33%) e enzimas hepáticas (11%).70,103 Não há evidência de que essas elevações aumentem o risco cardiovascular.36,40 Recomenda‐se perfil lipídico e hepático prévio, repetidos após um mês e a cada três meses.83 Uma análise do monitoramento laboratorial concluiu que exames solicitados com menor frequência é conduta segura e econômica, uma vez que alterações são raras ou discretas e reversíveis. Assim, recomenda‐se perfil lipídico e hepático basais e após dois meses repetem‐se apenas os alterados, de acordo com a história médica do paciente.102 Entretanto, alguns autores e até o Sistema Único de Saúde (SUS) no Brasil ainda recomendam monitoramento frequente. Estudo bem recente também concluiu que a qualidade do cuidado ao paciente com acne pode ser melhorada pela redução da frequência da avaliação dos lípides e função hepática e eliminação do hemograma.103 A possibilidade de interferência na força, fadiga e resistência muscular foi investigada e nenhuma diferença foi observada em estudo que comparou com indivíduos que não usavam isotretinoína.104 Assim, dosagem de creatina fosfoquinase só são indicadas se o paciente apresentar dor muscular intensa.105
O risco de cicatrizes anormais pelo uso da isotretinoína foi avaliado e cinco guias de conduta recentemente publicados concluíram não haver evidências para retardar os procedimentos cosmiátricos superficiais, biópsias e cirurgias dermatológicas sem envolvimento de planos musculares (tabela 3). Estudo observacional retrospectivo demonstrou não haver tendência à cicatriz hipertrófica e queloide entre pacientes com acne que usaram isotretinoína oral.106 Ao contrário, algumas publicações recentes enfatizaram que o uso do laser é seguro, até com melhores resultados para cicatrizes se iniciado no último mês do tratamento com a isotretinoína.107–111
Procedimentos dermatológicos para pacientes em uso de isotretinoína oral atual ou recente
| Seguros | Não recomendados |
|---|---|
| Dermoabrasão manual | Dermoabrasão mecânica |
| Microdermoabrasão | Peelings profundos |
| Microagulhamento | Lasers ablativos |
| Lasers fracionados ablativos e não ablativos | Excisões dermatológicas profundas, retalhos musculares |
| Peelings médios e superficiais | |
| Q‐Switched lasers e lasers vasculares | |
| Radiofrequência fracionada microagulhada | |
| Biópsias, excisões superficiais |
Acredita‐se que a isotretinoína possa atuar na rosácea pela modulação da imunidade inata e redução da resposta inflamatória por meio da regulação negativa da expressão do TLR‐2 nos queratinócitos. O uso não aprovado é indicado para rosácea papulopustulosa moderada a grave, dose diária baixa (0,25−0,3mg/kg), por quatro meses, redução lenta e progressiva. O tratamento de manutenção é obrigatório, com medicamentos tópicos (metronidazol, ácido azelaico ou ivermectina) ou isotretinoína em microdoses (20 mg/semana), com controle laboratorial e risco de gravidez.112–126
A isotretinoína oral para rosácea grave foi relatada pela primeira vez em 1981, em estudo alemão que demonstrou eficácia e maiores períodos de remissão quando comparada aos tratamentos habituais. Foram usadas doses diárias de 0,05mg/kg, 0,5mg/kg ou 1mg/kg, por 12−28 semanas. Houve regressão de 50% das lesões inflamatórias em duas semanas e 95% em oito semanas. Apenas telangiectasias e conjuntivite crônica apresentaram pouca melhoria. Remissões por mais de 12 meses foram observadas. Os efeitos colaterais foram queilite discreta e aumento leve dos triglicérides e colesterol.112 Um estudo multicêntrico que incluiu 92 pacientes, com duração de 20 semanas e que considerou as mesmas doses, concluiu pela eficácia da isotretinoína na rosácea refratária aos tratamentos prévios recomendados.113 Um ECRC comparou a isotretinoína na dose de 10mg/dia versus tretinoína a 0,025% em creme ou ambos, por 16 semanas e outras 16 semanas manutenção com tretinoína ou placebo creme na rosácea grave, sem diferenças e nem vantagem da associação. Os eventos adversos foram mínimos e bem tolerados.114
O uso da isotretinoína oral no tratamento da rosácea é relatado desde os anos 1980, na maioria das vezes por autores europeus e americanos. Vale destacar a primeira publicação na América Latina em 1994, de autor chileno que observou, em série de seis casos tratados por três a seis meses, com dose de 0,5mg/kg/dia, remissão rápida das pápulas e pústulas, melhoria das manifestações oculares, poucos efeitos colaterais e resultados mantidos por aproximadamente 15 meses.115
Estudo multicêntrico, duplo‐cego, randomizado, incluiu 573 pacientes com rosácea papulopustulosa e fimatosa e comparou diferentes doses (0,3; 0,5; 1mg/kg/dia) versus doxiciclina 100mg/dia, 14 dias e depois 50mg/dia versus placebo. Após 12 semanas, a dose de 0,3mg/kg/dia mostrou‐se mais efetiva do que o placebo, eficácia igual ou superior à doxiciclina (redução de 90% versus 83% das lesões) e menos efeitos colaterais.116
Outro estudo multicêntrico, randomizado, que incluiu 156 pacientes, comparou a dose de 0,25 mg/kg/dia (n=108) versus placebo (n=48) por quatro meses. O desfecho primário (90% de redução no número de lesões) ocorreu em 57% versus 10%. Recidiva em quatro meses ocorreu em 58% dos pacientes. Sugeriram‐se estudos para investigar a dose mínima para manter a remissão.117
Para controlar recidivas, foram propostas microdoses em esquema contínuo. Doze pacientes com rosácea recidivante foram tratados com 10−20mg/dia, quatro a seis meses e posteriormente manutenção com 0,03−0,17mg/kg/dia, média 0,07mg/kg/dia, por até 33 meses. Houve melhoria na qualidade de vida, sugeriu‐se que microdoses seriam uma opção melhor que múltiplos ciclos de antibioticoterapia.118 Em outro estudo, 25 pacientes foram tratados com dose de 20mg/dia, por quatro meses, com redução rápida do eritema e lesões inflamatórias; posteriormente, redução lenta da dose, por seis meses, até 20mg/semana. Houve recidiva em 45% dos casos em 11 meses.119
A rosácea fulminante é forma especial, rara, altamente inflamatória, no centro da face, com início abrupto e presença de pápulas, pústulas, nódulos e trajetos sinuosos que drenam secreção seropurulenta, coalescentes. O tratamento de escolha é a isotretinoína associada à prednisona, 40−60mg/dia. Recomenda‐se dose diária inicial de 0,2−0,5mg/kg, aumentada até 0,5−1mg/kg, durante três a quatro meses.120
Não existem estudos controlados e randomizados sobre o uso da isotretinoína oral na rosácea fimatosa. Um autor de Singapura relatou, em carta, redução de rinofima em um paciente após seis meses de tratamento com isotretinoína, 20 mg/dia, com tendência a recorrência após oito meses. O autor comenta que é uma opção para a redução da lesão para posterior procedimento cirúrgico ou laser.121 Na última RS publicada não foi possível incluir estudos sobre fima.122 Por suprimir a glândula sebácea e diminuir a sebogênese, a isotretinoína poderia atrasar a progressão do fima quando usada na fase pré‐fibrótica, com melhores resultados em pacientes jovens, porém há recorrência após suspensão do fármaco.122,123 O painel global de consenso, ROSaceaCOnsensus (ROSCO), coloca a isotretinoína como opção terapêutica na forma inflamatória (papulopustulosa) grave e no fima inflamado, em estágio inicial, com alto grau de recomendação.124
Em relação à rosácea ocular, um artigo de revisão apontou benefício e segurança da isotretinoína.125 Estudo recente comparativo com doxiciclina, publicado por oftalmologistas e dermatologistas brasileiros, mostrou que, apesar de a doxiciclina ter sido mais eficaz, a isotretinoína, na dose de 10mg/dia, também melhorou a blefarite e a conjuntivite, sem eventos adversos.126
Revisão sistemática, com metodologia Cochrane, concluiu que a isotretinoína tem grau de recomendação elevado para rosácea papulopustulosa moderada a grave ou recidivante ou não responsiva à antibioticoterapia e para fimas inflamados. A dose de 0,25mg/kg/dia por 12−16 semanas é superior a doxiciclina, 50−100mg/dia. A manutenção com tópicos é sempre recomendada.122
Grupo ibero‐latino‐americano de estudos da rosácea publicou algoritmo de tratamento que incluiu a isotretinoína em dose diária baixa para os subtipos papulopustulosa e glandular hiperplásica/fimatosa.127 Guia de conduta canadense foi publicado com a mesma recomendação.128 Artigo de revisão destaca os resultados excelentes desse fármaco para rosácea e recomenda que os dermatologistas considerem essa opção, uma vez que, após mais de 30 anos de uso, sua segurança está estabelecida, reduz o uso de antibióticos orais para doença crônica.129,130 A Sociedade Americana de Acne e Rosácea, em seu consenso, sugere a isotretinoína para eritema centrofacial difuso com pápulas e pústulas, rosácea granulomatosa e fimas iniciais.131 A dose baixa é eficaz, com menos efeitos colaterais e boa adesão. Há necessidade de controle clínico e laboratorial e atenção à teratogenicidade.132 Por afetar a face, a rosácea tem impacto negativo na qualidade de vida; seu controle proporciona benefício nas questões emocionais, sociais e profissionais dos pacientes.133
Dermatite seborreica (DS)A DS é dermatose inflamatória crônica, recorrente, localizada em áreas de alta concentração de glândulas sebáceas: face (88%), região retroauricular, couro cabeludo (70%), face anterior do tórax (27%), membros inferiores (2%) e superiores (1%) e flexuras (5%).133
Apesar do pouco conhecimento sobre a etiopatogenia da DS, admite‐se que a eficácia da isotretinoína seja explicada pela ação sebossupressiva e modulação da imunidade inata e resposta inflamatória, ou seja, regulação negativa do TLR‐2 e da via NF‐κB, com redução na produção de citocinas. Na DS, o TLR‐2 é ativado por fungos lipofílicos do gênero Malassezia em adultos e Candida spp. em lactentes, presentes na microbiota normal da pele,134,135 o que explica a opção de tratamento tópico da DS com antifúngicos.136 Também são usados imunomoduladores e corticosteroides tópicos;137 em quadros extensos e resistentes aos tópicos, pode ser necessário tratamento sistêmico com corticosteroides ou isotretinoína. Esse fármaco é considerado tratamento de segunda linha, usado na prática clínica, mas não há definição de dose e duração do tratamento. Ressalta‐se a necessidade de controle laboratorial e prevenção de gravidez.138
O primeiro relato de uso da isotretinoína com sucesso na DS, em dose diária baixa, foi publicado na Alemanha em 2003.139 Posteriormente, adolescente de 14 anos com pitiríase versicolor (PV) no dorso e acne grave foi tratado com 40mg de isotretinoína, duas vezes ao dia (1mg/kg/dia), por cinco meses. Houve curas clínica e micológica da PV, sugeriu‐se o papel contra Malassezia diretamente ou pela redução do conteúdo lipídico da pele devido à xerose causada pelo fármaco, que interferiu nas condições da microbiota, já que esse fungo é lipofílico.140
Um paciente com DS facial grave havia 22 anos foi tratado com 0,3mg/kg/dia de isotretinoína, com melhora após 30 dias; a dose foi reduzida para 0,15mg/kg, em dias alternados, por dois meses, com remissão completa.141 Em 2017, uma revisão de 46 casos, dos quais 40 estavam associados à acne, 57% mulheres, média de idade de 26 anos, com DS não responsiva tratada com doses de 0,05−0,51mg/kg/dia por 33 semanas em média, associada a cetoconazol e hidrocortisona tópicos, mostrou regressão total ou resposta excelente em 89% e um paciente sem benefício.142 Estudo que comparou 10mg/dia em dias alternados versus tratamento tópico (xampu e sabonete) com ácido salicílico e piroctone olamina, durante seis meses, em grupos paralelos, mostrou redução do escore clínico nos dois grupos, maior para isotretinoína, com redução da taxa de secreção sebácea e nenhum efeito sobre a quantidade e espécies de Malassezia.143,144 Permanece controverso o papel de Malassezia na patogênese da DS.
PsoríaseIsotretinoína, assim como etretinato e acitretina, atuam no controle da psoríase por sua conversão no citoplasma dos queratinócitos em ATRA que penetra no núcleo, liga‐se a receptores nucleares e ativa regiões específicas do DNA, envolvidas na regulação do crescimento e diferenciação celular e apoptose. Dessa maneira, reduz a hiperproliferação dos queratinócitos, que é um dos eventos envolvidos na patogênese da psoríase.24
O relato de quatro casos de psoríase extensa e mulheres tratadas com 0,6mg/kg/dia de isotretinoína associada à fototerapia, com 8‐metoxipsoralen por via oral e exposição ao UVA ou Psoraleno‐ultravioleta A (PUVA), mostrou redução no número de sessões de PUVA.145 Dois estudos clínicos randomizados descreveram o benefício desse fármaco, na dose de 0,5 mg/kg/dia, associado ao ultravioleta B de banda estreita (NB‐UVB) ou ao PUVA, para psoríase em placas disseminadas, reduziu o número de aplicações da fototerapia. A opção pela isotretinoína deve‐se ao menor tempo de anticoncepção e por sua menor meia‐vida em relação ao etretinato ou acitretina.146,147 Pela mesma razão, a isotretinoína foi usada, com excelente resultado, em uma adolescente do sexo feminino com psoríase pustulosa generalizada na dose de 1,0mg/kg/dia e em outros dois pacientes adultos em doses de 1,5−2,0mg/kg/dia, por quatro meses.148,149 Numa revisão sistemática recente sobre tratamento da pustulose palmoplantar não foi possível demonstrar evidência para nenhum tratamento, exceto para corticosteroides tópicos potentes ou sistêmico.150
Há outras opções disponíveis para o tratamento sistêmico da psoríase, como metotrexato, ciclosporina e um grande número de imunobiológicos. A monoterapia com retinoides tem eficácia limitada, mas pode ser útil quando associada aos corticoides na psoríase pustulosa e fototerapia em indivíduos HIV‐positivo, por não ter efeito imunossupressor.151
Hidradenite supurativa (HS)Isotretinoína na HS não é tratamento de escolha; a eficácia é variável e pode ser explicada pelas ações anti‐inflamatória (modulação do TLR‐2) e de redução da expressão de genes relacionados à hiperproliferação dos queratinócitos.24
A HS é doença inflamatória crônica, de tratamento difícil, com impacto negativo na qualidade de vida, com nódulos, fístulas, abscessos e cicatrizes. O tratamento de cura é a exérese profunda das lesões. O uso da isotretinoína, isolada ou associada a outros tratamentos, foi citado, com resultados variáveis, nas formas mais graves, como opção para reduzir as lesões e facilitar a cirurgia posteriormente.152 Um estudo retrospectivo incluiu 209 pacientes, dos quais 39 foram tratados com isotretinoína na dose de 0,5−1,2mg/kg/dia por 4−12 meses; 14 (36%) tiveram melhora, com benefício para a cirurgia.153 Outro estudo recente analisou combinações de fármacos para HS em 31 pacientes e mostrou benefício da isotretinoína associada à espironolactona, em casos mais leves, iniciais, momento ideal para introduzir o tratamento e evitar a evolução da doença.154
FotoenvelhecimentoA isotretinoína oral pode promover melhora das características clínicas, histológicas e moleculares do fotodano na pele, possivelmente por sua conversão em ATRA ou tretinoína.24 O uso tópico da tretinoína é o tratamento de escolha para fotoenvelhecimento moderado a grave, com maior nível de evidência.155–157 Seus mecanismos de ação são: reversão das mutações no gene p53, redução de MMPs, aumento de inibidor tecidual de metaloproteinases (TIMPs), redução da perda e aceleração da recuperação dos receptores nucleares de retinoides após exposição à radiação UV.24,158
Sobre uso no fotoenvelhecimento, um autor de El Salvador relatou, pela primeira vez, sua experiência sobre o uso da isotretinoína como coadjuvante a procedimentos cosmiátricos. O estudo foi aberto e não controlado, apesar de randomizado, incluiu 120 pacientes. A dose foi de 10 ou 20mg/dia, sem referência ao critério usado, três vezes por semana, por apenas dois meses, em um grupo de pacientes submetidos a procedimentos variados (peelings químicos, toxina botulínica, preenchimento com colágeno, blefaroplastia, lipossucção, enxerto de gordura, lifting facial), sem explicar se o uso foi anterior ou concomitante. Os desfechos clínicos, de difícil avaliação, foram: tamanho dos poros, pigmentações, rugas, espessura, elasticidade e cor da pele. Os resultados foram comparados ao grupo que não recebeu o fármaco e foram considerados melhores com a associação.159 Outros cinco estudos foram publicados por autores brasileiros (detalhes na tabela 4).160–164 Um deles incluiu 188 pacientes e apenas comparou efeitos clínicos e histológicos das doses de 10 ou 20mg, em dias alternados, por dois a seis meses, e não observou diferenças.161 Os dois estudos randomizados usaram isotretinoína na dose de 20mg, em dias alternados, por três e seis meses, comparada ao uso de apenas fotoprotetor e hidratante ou tretinoína tópica, respectivamente. Em ambos não houve superioridade da isotretinoína quanto aos desfechos clínicos, histológicos e imuno‐histoquímicos, exceto a expressão da proteína p53 epidérmica, que teve redução significativa com o uso do fármaco oral avaliado. Quanto à segurança, não ocorreram eventos adversos clínicos ou laboratoriais, exceto queilite e xerose leves.162,163
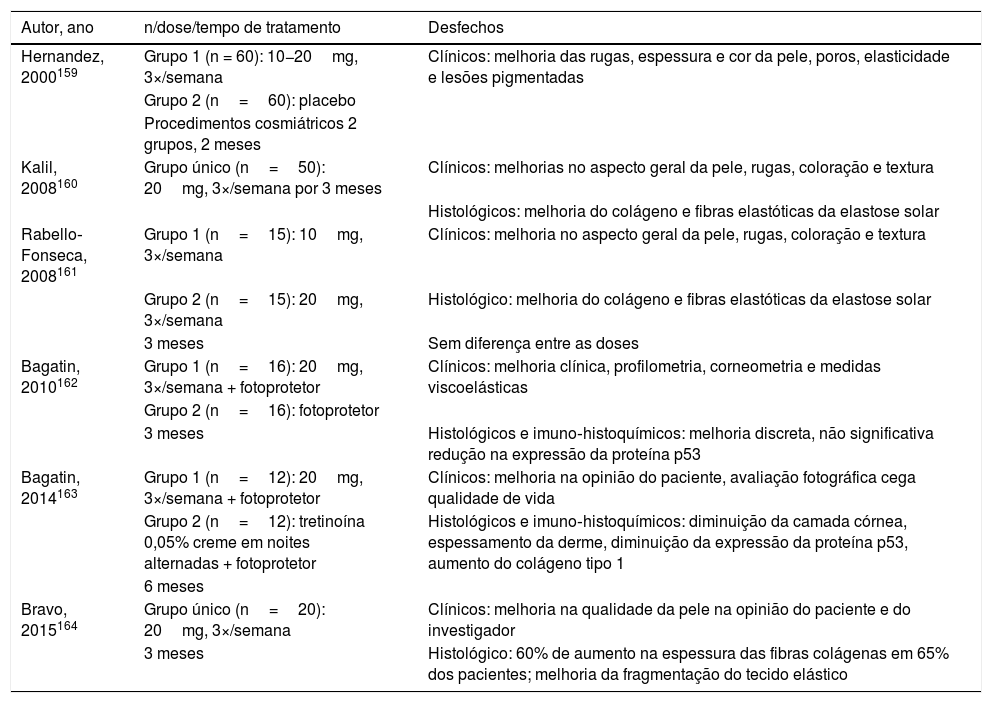
Detalhes dos seis estudos sobre isotretinoína oral para envelhecimento cutâneo
| Autor, ano | n/dose/tempo de tratamento | Desfechos |
|---|---|---|
| Hernandez, 2000159 | Grupo 1 (n = 60): 10−20mg, 3×/semana | Clínicos: melhoria das rugas, espessura e cor da pele, poros, elasticidade e lesões pigmentadas |
| Grupo 2 (n=60): placebo | ||
| Procedimentos cosmiátricos 2 grupos, 2 meses | ||
| Kalil, 2008160 | Grupo único (n=50): 20mg, 3×/semana por 3 meses | Clínicos: melhorias no aspecto geral da pele, rugas, coloração e textura |
| Histológicos: melhoria do colágeno e fibras elastóticas da elastose solar | ||
| Rabello‐Fonseca, 2008161 | Grupo 1 (n=15): 10mg, 3×/semana | Clínicos: melhoria no aspecto geral da pele, rugas, coloração e textura |
| Grupo 2 (n=15): 20mg, 3×/semana | Histológico: melhoria do colágeno e fibras elastóticas da elastose solar | |
| 3 meses | Sem diferença entre as doses | |
| Bagatin, 2010162 | Grupo 1 (n=16): 20mg, 3×/semana + fotoprotetor | Clínicos: melhoria clínica, profilometria, corneometria e medidas viscoelásticas |
| Grupo 2 (n=16): fotoprotetor | ||
| 3 meses | Histológicos e imuno‐histoquímicos: melhoria discreta, não significativa redução na expressão da proteína p53 | |
| Bagatin, 2014163 | Grupo 1 (n=12): 20mg, 3×/semana + fotoprotetor | Clínicos: melhoria na opinião do paciente, avaliação fotográfica cega qualidade de vida |
| Grupo 2 (n=12): tretinoína 0,05% creme em noites alternadas + fotoprotetor | Histológicos e imuno‐histoquímicos: diminuição da camada córnea, espessamento da derme, diminuição da expressão da proteína p53, aumento do colágeno tipo 1 | |
| 6 meses | ||
| Bravo, 2015164 | Grupo único (n=20): 20mg, 3×/semana | Clínicos: melhoria na qualidade da pele na opinião do paciente e do investigador |
| 3 meses | Histológico: 60% de aumento na espessura das fibras colágenas em 65% dos pacientes; melhoria da fragmentação do tecido elástico |
O conceito de campo de cancerização é antigo e baseou‐se em estudos histopatológicos de neoplasias multifocais da mucosa oral que podem coalescer, recidivar e desenvolver novas lesões. Posteriormente, foi estendido para a pele, onde a radiação UV causa mutações no gene p53, origina queratoses actínicas múltiplas e câncer de pele não melanoma.164–167
A isotretinoína oral promove melhoria nos parâmetros clínicos, histológicos e imuno‐histoquímicos do campo de cancerização, notadamente redução da proteína p53 epidérmica.162,163
O mecanismo de ação dos retinoides na prevenção e no tratamento do câncer de pele não melanoma não é totalmente elucidado. Sabe‐se que tem ação antiproliferativa e antiapoptótica, regulam diferenciação e apoptose dos queratinócitos, interferem no processo de iniciação tumoral, reduzem a regulação de proto‐oncogenes, alteram a expressão de p53 e caspases pró‐apoptóticas.168–170 Evitam a proliferação do papilomavírus humano (HPV), um conhecido cocarcinógeno.171
Estudos que envolvem retinoides orais focaram na prevenção e no tratamento dos tumores de pele não melanoma que são apenas uma parte do processo de cancerização. Detalhes dos estudos que a usaram para o tratamento são apresentados na tabela 5.172–175
Estudos que envolvem isotretinoína oral, câncer de pele não melanoma, queratoses actínicas e campo de cancerização
| Autor (ano) | Desenho de estudo (n): indicação | Dose/duração do tratamento | Resultado |
|---|---|---|---|
| Haydey, 1980173 | Relato de caso (1): queratoacantomas múltiplos | De 2−6 mg/kg/dia, 16 semanas | Sem aparecimento de novas lesões |
| Peck, 19822 | Séries de casos (3): múltiplos CBC's | Médias de 1,5 mg/kg/dia, 2,5−4 anos | Regressão de 9/65 lesões; sem lesões novas em 2−4 anos |
| Levine, 1984174 | Relato de caso (1): CEC e múltiplos queratoacantomas | 2 mg/kg/dia, 16 semanas | Regressão de várias lesões e diminuição de novos tumores |
| Peck, 1987191 | Relato de casos (2): múltiplos CBCs | 2 mg/kg/dia, 7 e 8 anos | Regressão de 15% das lesões, diminuição no número de lesões novas no paciente exposto a arsênio |
| Lippman, 1987175 | Série de casos (4): queratoacantoma e CEC | Paciente 1– regressão total do queratoacantoma; 2– regressão parcial; 3− regressão parcial de massa subcutânea; 4− redução de 70% de CECs | |
| Kraemer, 1988182 | Serie de casos (5): xeroderma pigmentoso | 2 mg/kg/dia, 2 anos | 121 tumores antes do tratamento |
| Redução para 21 tumores em 2 anos de tratamento, suspensão, seguimento por 1 ano: 25 tumores | |||
| Peck, 1988170 | Série de casos (12): CBCs | Média de 3,1 mg/kg/dia, 8 meses | Doses de 0,25−1,5 mg/kg/dia foram ineficazes |
| Moshell, 1989183 | Série de casos (5): xeroderma pigmentoso | 2 mg/kg/dia, 2 anos | Redução de 63% em 25 tumores |
| Suspensão: 8 vezes mais tumores | |||
| Lippman, 1992187 | Série de casos (32/28): CEC | 1 mg/kg/dia + interferon alfa, 2 meses | Resposta parcial: 68%; resposta total: 25% |
| Tangrea, 1992180 | Estudo clínico randomizado, placebo‐controlado (951): múltiplos CBCs | 10 mg/dia, 3 anos | Sem diferença com placebo |
| Majewski, 1994181 | Série de casos (4): múltiplas QAs | 10,4−0,5 mg/kg/dia + calcitriol, 12 meses | Paciente 1: resposta completa; 2 e 3: 50%−80% de regressão |
| Levine, 1997190 | Estudo clínico randomizado, placebo‐controlado (525): 4 ou mais CBCs ou CECs | Retinol (25.000) × isotretinoína (5−10 mg/dia) × placebo | Sem diferença entre as substâncias e o placebo |
| Feldman, 2007172 | Relato de caso (1): múltiplos queratoacantomas | 40 mg/dia, seguido de acitretina e retinoide tópico | Regressão de algumas lesões |
| Troyanova, 2018171 | Relato caso (1): epidermodisplasia verruciforme | 0,33−1 mg/kg/dia, 18 anos | Redução no número de CECs |
| Ianhez, 2019189 | Estudo clínico, randomizado (60): QAs | 10 mg/dia × tretinoíma 0,05% creme | Redução no número de QAs |
CBC, carcinoma basocelular; CEC, carcinoma espinocelular; QA, queratose actínica.
Indicações relatadas para a prevenção incluem: múltiplos cânceres de pele não melanoma (> 5 anos), ceratoses ou queratoses actínicas (QAs) múltiplas, queratoacantomas eruptivos, em transplantados e/ou imunodeprimidos, xeroderma pigmentoso, exposição à fototerapia crônica e epidermodisplasia verruciforme.171,176–183
Pouco se sabe sobre o uso dos retinoides em QAs múltiplas e campo de cancerização, em pacientes imunocompetentes ou imunodeprimidos, com risco de desenvolvimento de câncer de pele não melanoma. A delimitação do campo de cancerização e a metodologia para avaliar a eficácia de terapias para seu controle representam um desafio. O método mais empregado é o tratamento em área restrita e bem definida e a contagem das QAs como desfecho primário. As doses recomendadas variam de 0,25 a 6mg/kg/dia, com duração de meses até anos.184,185
Considerando que as QAs são sinais precoces no campo de cancerização e os estudos sobre retinoides orais são escassos,186‐190 destacamos o estudo mais recente com isotretinoína oral, 10mg/dia versus tretinoína 0,05% creme, em noites alternadas. Os resultados foram semelhantes, com diminuição de 28% no número de QAs novas, após destruição de todas as visíveis com crioterapia. Houve melhora nos parâmetros imuno‐histoquímicos, com redução da expressão das proteínas p53 e BAX epidérmicas. Os genes que codificam essas proteínas sofrem mutações induzidas pela radiação UV e passam a atuar como indutores de tumores em vez de induzir apoptose dos queratinócitos também mutados como mecanismo de proteção contra a carcinogênese.189
A acitretina é mais usada em imunodeprimidos e a isotretinoína, em imunocompetentes e mulheres com potencial para engravidar, em razão da meia‐vida mais curta. Doses baixas são menos eficazes para justificar o uso no tratamento do câncer de pele não melanoma. Entretanto, para a prevenção em pacientes de risco, doses altas e longo prazo devem ser desencorajados pelo risco de eventos adversos; doses baixas justificam‐se para estabilizar o campo de cancerização.190‐192
Doenças dos cabelos e do couro cabeludoAlopecia fibrosante frontal (AFF)A AFF caracteriza‐se pelo recuo da linha de implantação capilar e perda das sobrancelhas e, às vezes, dos pelos corporais e também por pápulas faciais, pontos vermelhos glabelares, depressão das veias frontais e associação com líquen plano pigmentoso.193‐196 Constitui‐se numa epidemia, pois em duas décadas deixou de ser doença “recentemente descrita” para se tornar a alopecia cicatricial mais comum, conforme estudo multicêntrico.197
Estudo retrospectivo comparou isotretinoína, 20mg/dia (n=29), acitretina, 20mg/dia (n=11) ou finasterida, 5mg/dia (n=14), durante média de 13,5 meses. Os objetivos de não aumento da distância entre glabela e linha de implantação após 12 meses e manutenção dos resultados após um ano do tratamento foi atingido em 76% e 73% versus 72% e 73% dos pacientes, respectivamente com isotretinoína e acitretina e em 43% com a finasterida.198 Outro estudo retrospectivo incluiu 291 pacientes com líquen plano pilar e 26 com AFF. Desses, sete foram tratados com isotretinoína 20mg/dia e quatro com associação à finasterida ou dutasterida. Seis tiveram resposta completa com isotretinoína, assim como os quatro da associação. Todos usaram concomitantemente tacrolimus e clobetasol tópicos. A resposta foi avaliada por fotos clínicas, descamação perifolicular e pápulas, sem método objetivo.199 As pápulas faciais, em três pacientes, melhoraram em 15 dias e regrediram com isotretinoína 20mg/dia no primeiro mês e 0,5mg/kg/dia no segundo e terceiro meses. Já os sinais de atividade da doença, eritema e descamação perifoliculares permaneceram.200 Estudo posterior relatou redução das pápulas faciais após dois a quatro meses com isotretinoína 10mg em dias alternados, em 10 pacientes.201 Recentemente, dois casos tratados com isotretinoína 10mg/dia apresentaram melhoria das pápulas após 30−45 dias de tratamento.202 Nos três últimos estudos, a progressão da AFF não foi avaliada. Até o momento, os dados de literatura não possibilitam conclusão absoluta sobre a eficácia desse fármaco na AFF. Mais estudos são necessários.
Foliculite dissecante (FD)A FD é alopecia cicatricial primária neutrofílica com pústulas foliculares, nódulos, abscessos intercomunicantes e destruição folicular irreversível. Pode constituir a tétrade de oclusão folicular quando associada ao cisto pilonidal, hidradenite e acne conglobata.203,204
O primeiro relato de sucesso terapêutico com a isotretinoína na dose de 0,5mg/kg/dia por três meses mostrou recidiva e necessidade de mais dois ciclos com 1mg/kg/dia até a remissão.205 Três pacientes com FD receberam 1mg/kg/dia, depois 0,75mg/kg/dia para manutenção, durante nove a 11 meses, sem recidiva em 10 meses (um paciente) e dois anos e meio (dois pacientes). Os autores sugeriram doses elevadas e tratamento prolongado para reduzir recidivas.206 Estudo retrospectivo que incluiu sete pacientes tratados com dose de 0,75mg/kg/dia por 9−12 meses não observou recidiva em 16−42 meses.207 Estudo retrospectivo com 51 pacientes tratados com 0,5−0,8mg/kg/dia mostrou remissão completa em 92% após três meses e recidivas frequentes.208 Em outro relato de 28 pacientes tratados com dose média de 30mg/dia, sete tiveram redução da atividade inflamatória; recidiva e necessidade de retratamento não foram especificados.208
Doses de 10mg/dia até 1mg/kg/dia, duração, doses de manutenção e associações variadas foram relatadas. Apesar do pequeno número de relatos, recidivas frequentes e poucos estudos com seguimento longo, uma revisão sistemática concluiu que, mesmo sem evidência, a isotretinoína oral é considerada tratamento de escolha para FD.204
Foliculite decalvante de Quinquaud (FDQ)A FDQ é alopecia cicatricial neutrofílica rara, crônica e recidivante que acomete adultos jovens de ambos os sexos. Caracteriza‐se por placas fibróticas de alopecia com tufos de cabelo na periferia, eritema, pústulas foliculares, descamação e crostas. Etiologia pouco esclarecida, sem terapêutica capaz de induzir remissão prolongada. A isotretinoína pode atuar pela inibição da migração de neutrófilos e modulação da imunidade inata contra bactérias Gram‐positivas, por meio da regulação negativa do TLR‐2. A isotretinoína é muito citada, com divergências sobre eficácia, segurança, tempo de remissão e recidivas.209
Em estudo retrospectivo que envolveu 82 pacientes, 16 (20%) usaram isotretinoína; 8 (50%) melhoraram, mas a duração da resposta foi de apenas três meses.210 Estudo multicêntrico, prospectivo, incluiu 60 pacientes com FQD e diferentes tratamentos; 15 (25%) foram tratados com isotretinoína por três meses, sem diferença na eficácia comparada à combinação de rifampicina e clindamicina, no seguimento de cinco anos. Os autores elaboraram um protocolo terapêutico para FQD, sugeriram a isotretinoína apenas para casos graves, com resposta não mantida aos outros tratamentos.211 Outro estudo avaliou 39 pacientes tratados com isotretinoína, 0,1−1,02mg/kg/dia, média de dois meses e meio; 82% apresentaram resposta parcial ou completa. Doses acima de 0,4mg/kg/dia e duração maior que três meses foram associadas à melhor resposta.212
Revisões sistemáticas recentes apresentam resultados controversos. Uma concluiu que a isotretinoína é o tratamento com maior número de publicações, apesar da resposta limitada;213 a outra concluiu que a opção ideal é a associação clindamicina e rifampicina, com nível de evidência 3.214
Outras doenças com distúrbios da queratinização e inflamaçãoModulação da resposta inflamatória, hiperproliferação e diferenciação dos queratinócitos justificam a indicação da isotretinoína para distúrbios da queratinização, com inflamação, de difícil tratamento. Existem relatos de casos e citação em revisões, sem conclusões sobre dose e duração. Genodermatoses necessitam tratamento contínuo e não existem dados sobre riscos em longo prazo.
Resultados de estudos que justificam a recomendaçãoPitiríase rubra pilarDoença crônica, papulodescamativa, de etiologia desconhecida, familiar ou adquirida, de difícil tratamento, que inclui UVB associado ao coaltar, corticosteroides tópicos, calcipotrieno, queratolíticos, retinoides orais, metotrexato, azatioprina e ciclosporina. O uso da isotretinoína é relatado desde os anos 1980, com bons resultados.215,216 Revisão sistemática recente incluiu 182 estudos e 475 pacientes. Entre os tratados com retinoides, a isotretinoína determinou boa resposta em 61%, o etretinato em 47% e a acitretina em 24%. Os autores sugeriram que o tratamento de primeira linha é a isotretinoína, seguido por metotrexato e imunobiológicos. A xerose cutânea é agravada pelo fármaco e requer uso de emolientes.217
Lúpus eritematoso (LE) cutâneoA isotretinoína 0,2−1mg/kg/dia foi citada como opção para casos refratários de LE subagudo e eritematoso crônico, formas hiperqueratósicas, com eficácia semelhante à hidroxicloroquina. Porém, eventos adversos e recidiva mais rápida são mais frequentes; na prática, é pouco usada. Contraindicada na associação de LE e síndrome de Sjögren.218
Granuloma anular generalizadoDoença granulomatosa, não infecciosa, com pápulas e placas, de causa desconhecida. Não existe tratamento efetivo; indicação de isotretinoína 0,5mg/kg/dia, dois a seis meses para formas generalizadas, relatada com boa resposta, mas com recidiva, sugere‐se manutenção com dose diária baixa.219
Vírus dos papilomas humanos (HPV)/condiloma acuminadoA isotretinoína oral 0,5−1mg/kg/dia foi eficaz para condiloma da cérvice e verrugas mucocutâneas, especialmente planas, recalcitrantes.220,221 Pode não haver resposta, mesmo com dose de 1mg/kg/dia; entretanto, contribui para a redução do volume ou da multiplicidade das lesões, favorecendo tratamentos coadjuvantes.
Doença de DarierDermatose genética, com áreas extensas de pápulas e placas hiperqueratósicas. Relatos de casos e artigo de revisão reportam melhora com isotretinoína em doses diárias de 0,2−0,7mg/kg. Como é doença crônica, há necessidade de uso contínuo com vigilância sobre hepatotoxicidade, hipertrigliceridemia e teratogenicidade.222–224
OutrasIndicações variadas e não aprovadas, sem possibilidade de conclusões sobre eficácia e segurança por serem relatos únicos, incluem: queratodermia aquagênica; úlcera mucosa oral; dermatite perioral; doença de Galli‐Galli; erupção acneiforme ao vemurafenibe; dermatofitose; líquen plano pilar e pigmentoso; doença de Cushing; hiperplasia sebácea, grânulos de Fordyce, esteatocistoma múltiplo, papilomatose confluente reticulada (Gougerot‐Carteaud), dermatose pustular erosiva do couro cabeludo.225–239
A tabela 6 apresenta um resumo de indicações aprovadas e não aprovadas da isotretinoína oral em dermatologia quanto a doses e tempo de tratamento, relatados em estudos clínicos, guias de conduta e consensos.
Resumo das doses e tempo de tratamento das indicações aprovadas e não aprovadas da isotretinoína oral, de acordo com estudos clínicos, séries de casos, relatos de casos e consensos
| Indicações | Dose da isotretinoíma oral | Tempo de tratamento |
|---|---|---|
| Acnes graus III e IV ou não responsiva a tratamentos anteriores1,2,4,5,36,40‐43,46,51‐54,56,58,59,64,65,67,71‐74,79,80,83 | 0,5−1 mg/kg/dia | Até a dose de 120−150 mg/kg/dia ou até completa regressão das lesões |
| Acne – “dose diária baixa” 10,38,48,55,61,62,69,71,80‐82 | 0,1−0,5 mg/kg/dia | Até 18 meses ou até 1 a 2 meses após a resolução das lesões |
| Exacerbação da acne100,101 | Dose baixa (até 8 semanas), associada à prednisona | 8 semanas isotretinoina oral em dose baixa |
| Prednisona: 0,5−1 mg/kg/dia por 2 semanas ou até resolução da exacerbação | ||
| Acne grave e extensa associada a macrocomedões36,42,100,101 | 01−0,2 mg/kg, 8 semanas, pode ou não ser aumentada gradualmente com retirada fracionada da prednisona usada nas primeiras 2 a 4 semanas | Dose baixa: 8 semanas |
| Prednisona: 2−4 semanas | ||
| Rosácea112‐119 | 0,25 a 0,3 mg/kg | 4 meses |
| Casos selecionados, “microdoses”: média 0,07 mg/kg/dia, até 33 meses | Microdose: até 33 meses | |
| Rosácea fulminans120 | 0,2−0,5 mg/kg, aumenta‐se até 0,5−1 mg/kg, associada à prednisona 40−60 mg/dia | 3−4 meses |
| Rosácea fimatosa121 | 20 mg/dia fase ativa, manutenção com 10 mg/dia | 6 meses para fase ativa |
| Rosácea ocular125,126 | 10 mg/dia | 4 meses |
| Dermatite seborreica139‐144 | 0,05−0,51 mg/kg/dia | Média de 33 semanas |
| Psoríase pustulosa148‐150 | Crianças: 0,75 mg/kg/dia | 4 meses |
| Adultos: 1,5−2,0 mg/kg/dia | ||
| Fotoenvelhecimento159‐164 | 10−20mg, 3×/semana | 2−6 meses |
| Campo de cancerização190 | 10 mg/dia | 6 meses |
| Alopecia fibrosante frontal205,206 | 20 mg/dia | Média de 13 meses |
| Pápulas faciais da alopecia fibrosante frontal 207‐209 | 10mg dias alternados ou 20 mg/dia | 2−4 meses |
| Foliculite dissecante212‐221 | 0,5−1 mg/kg/dia | 3−12 meses |
| Dose baixa – 10 mg/dia | ||
| Pitiríase rubra pilar222‐224 | 0,5−2 mg/kg/dia | 16−24 semanas |
| Lúpus eritematoso cutâneo225 | 0,2−1 mg/kg/dia | 5 meses |
| Granuloma anaular generalizado226 | 0,5 mg/kg/dia | 2−6 meses, manutenção com doses mais baixas |
| Condiloma acumiado e verrugas recalcitrantes227,228 | 0,5 mg/kg/dia (condiloma do colo uterino)227 | 12 semanas |
| 0,5−1 mg/kg/dia228 | Média de 3 meses | |
| Doença de Darier229,230 | 0,2 mg/kg no ínicio, aumento para 0,5−1 mg/kg, de acordo com a tonalidade | Uso contínuo (genodermatose) |
Para a cura da acne, consideramos relevante ampliar a prescrição da isotretinoína para adolescentes e adultos, assim como dos antiandrógenos (contraceptivos e espironolactona) para mulheres adultas, e assim reduzir a indicação dos antibióticos orais, considerando‐se o alerta crescente sobre resistência bacteriana. É preocupante o uso desses fármacos, ainda muito elevado, com duração superior a seis meses até um ano ou mais, média de 331 dias, de acordo com estudo de 2016 que ressalta a falta de conhecimento ou desrespeito às recomendações sobre o uso racional dos antibióticos.240 Sabe‐se que não há idade mínima para prescrever a isotretinoína, já que a acitretina é indicada para crianças de qualquer idade a fim de tratar distúrbios graves da queratinização. No entanto, é preciso orientar o paciente e a família que o uso na pré‐adolescência pode implicar a necessidade de novos ciclos de tratamento; um novo ciclo pode ser iniciado após três meses.241 Até o momento e expirada a patente da empresa que desenvolveu a isotretinoína, parece não existir interesse da indústria farmacêutica na condução de estudos multicêntricos, randomizados e controlados com vistas a futuras aprovações para outras dermatoses. Apenas estudos com amostras de tamanho adequado e metodologia de alta qualidade tornarão possível a aprovação pelas agências regulatórias e a possibilidade de definição de níveis de evidência de acordo com padrões internacionais.242–245 Talvez o desenvolvimento de um novo retinoide oral que possa atender outras indicações, além da acne e da psoríase, possa ampliar o uso desses fármacos em dermatologia.
ConclusõesEste consenso visa a orientar os dermatologistas sobre uso da isotretinoína oral para benefício dos pacientes. Só existe evidência de nível I (revisão sistemática e metanálise), com relação à eficácia e segurança, garantida pelo monitoramento dos eventos adversos, no tratamento da acne vulgar. Para rosácea, seu emprego em dose diária baixa é citado em revisão sistemática, sem mencionar nível de evidência. Para as demais indicações, a literatura é escassa, em geral baseada em relatos de casos, alguns até anedóticos, e raros estudos clínicos randomizados com pequenas amostras (dermatite seborreica, fotoenvelhecimento), sem possibilidade de estabelecer nível de evidência. Entretanto, algumas condições dermatológicas de difícil controle, em que houve tentativa de uso da isotretinoína oral justificada por seus múltiplos mecanismos de ação, merecem ser citadas. Houve 100% de consenso entre os autores deste manuscrito de que as indicações não aprovadas estão em expansão e deveriam ser incluídas. Por outro lado, na opinião dos autores, não são recomendadas indicações com finalidade unicamente estética ou controle da oleosidade, particularmente para mulheres em idade fértil. Finalmente, é preciso bom senso para prescrever um fármaco teratogênico, particularmente para indicações não aprovadas quando a responsabilidade é integralmente do médico.
Suporte financeiroSociedade Brasileira de Dermatologia (SBD).
Contribuição dos autoresEdiléia Bagatin: Aprovação da versão final do manuscrito; concepção e planejamento do estudo; elaboração e redação do manuscrito; revisão crítica da literatura; revisão crítica do manuscrito.
Caroline Sousa Costa: Aprovação da versão final do manuscrito; revisão crítica da literatura; revisão crítica do manuscrito.
Marco Alexandre Dias da Rocha: Aprovação da versão final do manuscrito; revisão crítica da literatura; revisão crítica do manuscrito.
Fabíola Rosa Picosse: Aprovação da versão final do manuscrito; revisão crítica da literatura; revisão crítica do manuscrito.
Cristhine Souza Leão Kamamoto: Aprovação da versão final do manuscrito; elaboração e redação do manuscrito; revisão crítica da literatura; revisão crítica do manuscrito.
Rodrigo Pirmez: Aprovação da versão final do manuscrito; elaboração e redação do manuscrito; revisão crítica da literatura; revisão crítica do manuscrito.
Mayra Ianhez: Aprovação da versão final do manuscrito; elaboração e redação do manuscrito; revisão crítica da literatura; revisão crítica do manuscrito.
Hélio Amante Miot: Aprovação da versão final do manuscrito; concepção e planejamento do estudo; elaboração e redação do manuscrito; revisão crítica da literatura; revisão crítica do manuscrito.
Conflitos de interesseNenhum.
Como citar este artigo: Bagatin E, Costa CS, Rocha MAD, Picosse FR, Kamamoto CSL, Pirmez R, et al. Brazilian Society of Dermatology consensus on the use of oral isotretinoin in dermatology. An Bras Dermatol. 2020;95(S1):19–38.
Trabalho realizado na Sociedade Brasileira de Dermatologia, Rio de Janeiro, RJ, Brasil.