Ceratoses actínicas são displasias queratinocíticas intraepiteliais com potencial de transformação maligna. Clinicamente, apresentam‐se como máculas, pápulas ou placas hiperqueratóticas sobre uma base eritematosa em áreas fotoexpostas; podem ser pigmentadas e apresentar variados graus de infiltração. Além disso, nas fases iniciais podem ser mais palpáveis do que visíveis, e, quando múltiplas, as lesões podem fazer parte do campo de cancerização. Apresentam prevalência que varia entre 11% e 60% nos indivíduos brancos com mais de 40 anos. A radiação ultravioleta é o principal fator envolvido na patogênese, porém fatores individuais também interferem na predisposição ao surgimento das lesões. O diagnóstico das lesões é baseado no exame clínico e dermatoscópico, porém em algumas situações o exame histopatológico é necessário. Seu potencial risco de transformação em carcinoma espinocelular permanece como a principal situação clínica de maior atenção. As modalidades terapêuticas para o manejo de ceratoses actínicas incluem métodos ablativos, cirúrgicos e medicamentosos, que devem ser individualizados conforme a necessidade do paciente.
As ceratoses actínicas, também denominadas ceratoses solares ou senis, foram descritas em 1826 por Dubreuilh.1,2 Posteriormente, o termo “keratoma senilis” foi proposto por Freudenthal e, em 1958, Pinkus renomeou as lesões como ceratoses actínicas.3 Embora classicamente categorizadas como lesões pré‐neoplásicas, alguns autores sugerem considerá‐las como neoplasias in situ, uma vez que derivam de modificações clonais no DNA de queratinócitos.2,4–7 Nesse sentido, consideram as ceratoses actínicas como tendo características de malignidade desde sua gênese, tanto do ponto de vista das alterações citológicas apresentadas pelos queratinócitos epidérmicos, que são semelhantes às observadas nos carcinomas espinocelulares (CEC), inclusive perda de polaridade, pleomorfismo nuclear, maturação desregulada e aumento do número de mitoses, quanto do ponto de vista molecular, apresenta mutações idênticas na proteína p53.3 A dificuldade de estabelecer critérios inequívocos para determinar quando uma ceratose actínica sofre transformação para CEC reforça essa hipótese. De acordo com Ackerman, não existe um limiar claro entre ceratoses actínicas e CECs finos e a ceratose actínica é considerada parte do espectro evolutivo dos CECs, descrita como um CEC em fase “embrionária”.2 Assim, nomenclaturas propostas em substituição ao termo ceratose actínica incluiriam neoplasia intraepidérmica queratinocítica e CEC intraepidérmico queratótico solar.3
As ceratoses actínicas são formadas pela proliferação de queratinócitos com variados graus de displasia na epiderme, ou seja, representam displasias queratinocíticas intraepiteliais; as lesões apresentam potencial de transformação maligna para câncer de pele não melanoma (CPNM), em especial para CEC, e ocorrem preferencialmente em áreas fotoexpostas.1,8,9
EpidemiologiaCeratoses actínicas representam o terceiro motivo de consulta dermatológica, perdem apenas para acne e dermatites.10 Com o processo de envelhecimento global da população, estima‐se que ocorrerá aumento gradual na frequência de ceratoses actínicas.10 Em relação à prevalência de ceratoses actínicas, a Organização Mundial da Saúde estima que os maiores índices são observados em indivíduos brancos que moram próximos à linha do Equador.11
No cenário internacional, a prevalência de ceratoses actínicas é maior na Austrália, onde predominam fototipos baixos e alta taxa de exposição à radiação ultravioleta (UV), seguida pelos Estados Unidos e, por fim, a Europa.12 A prevalência de ceratoses actínicas varia de 40% a 60% na Austrália, nos indivíduos brancos com mais de 40 anos, e de 11,5% a 26% nos Estados Unidos em indivíduos com mais de 30 anos.13–18 Na Inglaterra, um estudo de base populacional observou prevalência de ceratoses actínicas de 15,4% nos homens e de 5,9% nas mulheres com mais de 40 anos; essa prevalência foi elevada para 34,1% e 18,2%, para homens e mulheres, respectivamente, quando apenas os pacientes com mais de 70 anos foram considerados.19 Estudo espanhol observou prevalência de ceratoses actínicas de 28,6% nos pacientes com mais de 45 anos; essa prevalência foi maior em homens do que em mulheres e aumentou conforme a idade para ambos os sexos.20 Outro estudo, feito na Áustria, observou prevalência de 31% nos pacientes com mais de 30 anos; essa prevalência foi maior nos pacientes do sexo masculino (39,2% em homens versus 42,3% em mulheres).21 Por fim, na população asiática os estudos apontam prevalência muito menor: na Coreia do Sul, os valores variam de 0,02% em pacientes com 40 anos; 0,09% em pacientes com 60 anos e 0,21% nos pacientes com 70 anos;22 na China, estudo de base populacional (1.590.817 pacientes avaliados) observou prevalência de 0,52%, com média de 69,8 ± 11,8 anos.23
No Brasil, ceratoses actínicas representam o quarto diagnóstico dermatológico mais comum.1 Além disso, em indivíduos com mais de 65 anos elas representam o principal motivo de consulta dermatológica no Brasil (17,2%); na Região Sul isso se traduz em 7,4% dos diagnósticos e na Região Norte, em 2,89% das visitas.24 Em estudo feito na cidade de Curitiba, com 491 pacientes com média de 59,8 anos, a prevalência de ceratose actínica foi de 60,79% nas mulheres e 30,9% nos homens.25 Outro estudo, feito na cidade de Bauru (SP), que incluiu apenas descendentes japoneses que vivem no Brasil, a prevalência de ceratoses actínicas foi de 13,4%, com média dos pacientes de 68,9 anos – essa prevalência é mais alta do que a observada em indivíduos de mesma composição étnica que vivem no Japão.26
Conforme observamos nos estudos citados, a prevalência de ceratoses actínicas aumenta conforme a idade dos pacientes, varia de < 10% em indivíduos brancos entre 20‐29 anos, até 80% em indivíduos entre 60‐69 anos.27 Exceção ocorre nos pacientes albinos e portadores de genodermatoses que apresentam defeitos nos genes de reparo ao DNA, como xeroderma pigmentoso, síndrome de Rothmund‐Thompson, síndrome de Cockayne e síndrome de Bloom, que podem apresentar lesões na primeira década de vida, de maior agressividade e risco de transformação maligna.1,28–30 A idade é um fator de risco independente para desenvolvimento de ceratoses actínicas, a odds ratio (OR) varia entre 1,6 a 41,5 de acordo com a idade – OR de 4,8 para indivíduos entre 46 e 60 anos e de até 41,5 nos indivíduos com mais de 70 anos.31–34
Indivíduos do sexo masculino apresentam prevalência de ceratoses actínicas mais elevada, com OR de 1,7 a 3,9, devido à maior carga média de exposição UV a que homens são expostos.31,32,34–36
Populações cuja composição étnica apresenta predominantemente indivíduos de fototipos baixos (I e II), mais suscetíveis aos efeitos carcinogênicos da radiação UV, apresentam maior risco de ceratoses actínicas, com OR de 1,7 a 6,9.31,32,34–36 Além disso, a localização geográfica também é de suma importância, uma vez que representa a taxa de radiação UV a que determinada população está exposta, pode até modificar as taxas de prevalência em populações que fizeram movimentos migratórios, como é o caso do que foi observado no estudo feito com descendentes nipônicos em Bauru.26
Poucos estudos que avaliam a incidência de ceratoses actínicas estão disponíveis. O primeiro data de 1986, feito em Maryborough/Austrália (37°S), com 1.040 indivíduos com mais de 40 anos, avaliados em dois momentos em período de 12 meses. Na primeira avaliação, 59% dos indivíduos apresentavam ceratoses actínicas; na segunda avaliação, 60% deles apresentaram novas lesões. Entre os pacientes sem lesões na primeira avaliação, 19% desenvolveram lesões observadas na segunda visita.37 Estudo populacional feito no País de Gales com 1.034 indivíduos com mais de 60 anos observou uma taxa de incidência de ceratoses actínicas de 149 lesões por pessoas‐ano e uma prevalência de 23%.38 Outro estudo, feito na Coreia do Sul, avaliou 77.975 indivíduos com mais de 40 anos com ceratoses actínicas que haviam consultado com médicos dermatologistas de 2006 a 2015 pelo menos duas vezes em um ano.22 A taxa de incidência no período avaliado variou de 17,95 a cada 100 mil pessoas‐ano em 2006 e 53,99 a cada 100 mil pessoas‐ano em 2015, taxas muito mais baixas do que as esperadas na população ocidental. Além disso, os autores observaram aumento da taxa de incidência conforme a idade do paciente aumentava e esse aumento foi mais intenso na faixa de 70 anos.22
PatogêneseA etiologia das ceratoses actínicas envolve tanto fatores individuais quanto ambientais.13
A exposição excessiva à radiação UV é o principal fator envolvido, atua como um carcinógeno completo, tanto na indução quanto na promoção de expansão tumoral.8,39,40 A radiação UV ativa cascatas de sinalização molecular, resulta em modificações nos níveis de citocinas regulatórias, efeito imunossupressivo, além de diferenciação celular e apoptose defeituosas.8 A radiação UV é dividida em UVA, UVB e UVC; 94%‐97% da radiação que atinge a superfície da Terra são compostas por raios UVA; os raios UVB são parcialmente absorvidos pela camada de ozônio e representam 3%‐6%, enquanto os raios UVC são filtrados pela camada de ozônio na atmosfera e níveis mínimos atingem a superfície terrestre.8
A radiação UVA (320‐400nm) atinge a pele mais profundamente e estimula a produção de espécies reativas de oxigênio, que danificam membranas celulares, seus núcleos e proteínas;41 além disso, o UVA promove mutações de reposição de guanina (G) por timina (T) no DNA.42 Como resultado, vias de transdução de sinal e de interação celular são afetadas, ocorre proliferação celular anormal.8
A radiação UVB (290‐320nm), por sua vez, é absorvida pelo DNA celular, promove erros no reparo de dímeros de ciclobutano pirimidina e produção de 6‐4 fotoprodutos, além de substituições de DNA de citosina‐timina (C‐T) características.41 Tais efeitos resultam em mutações na proteína p53, que regula o ciclo celular e atua no reparo de danos ao DNA, mutações no gene da telomerase e aumento na produção de citocinas pró‐inflamatórias.42,43
Desse modo, os mecanismos envolvidos no surgimento de ceratoses actínicas são inflamação, estresse oxidativo, imunossupressão, apoptose prejudicada, desregulação do ciclo celular e da proliferação celular e remodelamento tecidual (fig. 1).8
O processo inflamatório é mediado pela via do ácido araquidônico, pela produção de citocinas pró‐inflamatórias e pela ativação de mastócitos e de fator inibitório da migração de macrófagos; os resultados da ativação desses mediadores incluem peroxidação lipídica, aumento nos níveis intralesionais de linfócitos T e células de Langerhans, aumento do p53 e Bcl‐2 e redução no Fas (cd95) e Fas‐ligand, fatores iniciais importantes no processo de apoptose de células mutadas pela radiação UV.8 A conexão entre inflamação e desenvolvimento de ceratoses actínicas parte de observações de lesões que progrediram para CECs; em muitos casos, observou‐se que passaram por uma fase inflamatória antes de se tornar invasivas.44 Tal fato justifica por que terapias anti‐inflamatórias são efetivas no tratamento de ceratoses actínicas.45
O estresse oxidativo também está envolvido no processo de fotocarcinogênese, resultante da exposição excessiva à radiação UV, que leva à produção de espécies reativas de oxigênio e culmina com a peroxidação lipídica e destruição celular, com danos ao DNA genômico e mitocondrial.8 As vias de transdução de sinal alteradas decorrem da fosforilação de tirosina quinase de membranas, de alteração no fator de crescimento epidérmico, na Ras e RAF e da dissociação do fator nuclear κB do complexo inibitório B.46–49 Esses eventos resultam na produção de citocinas, inclusive interleucina (IL)‐1, fator de necrose tumoral (TNF) e IL‐6, e na ativação da via do ácido araquidônico. O resultado final é o deslocamento de fatores de transcrição para o núcleo celular, com modificações na expressão gênica.50
Os distúrbios da apoptose ocorrem por supressão, eliminação ou ativação de mediadores apoptóticos, como CD95 e TRAIL (fator ligante de apoptose associado ao TNF), e de genes pró‐apoptóticos supressores tumorais e pela regulação da atividade apoptótica do p53.51,52 Além disso, a mutação do gene supressor tumoral p53 induzida pela radiação UVB é uma etapa precoce na tumorigênese cutânea.8
Os cinco fatores de risco independentes mais importantes para o desenvolvimento de ceratoses actínicas são idade, sexo, fototipos I e II, história prévia de neoplasias cutâneas e exposição solar por motivos ocupacionais.34 A presença de neoplasias cutâneas prévias (OR = 6,47) é importante, pois reflete a associação de fatores individuais genéticos, que podem influenciar na sensibilidade à radiação UV, e do grau de exposição crônica à radiação UV a que o indivíduo se expôs durante a vida.33,34 Ao avaliar o fator exposição solar ocupacional, os trabalhadores de áreas externas apresentam risco duas a três vezes maior de desenvolver ceratoses actínicas e têm risco aumentado para todas as neoplasias cutâneas, com um OR de 3,45 para ceratoses actínicas, 3,67 para CEC, 3,32 para carcinoma basocelular (CBC) e 1,97 para melanoma (p < 0,005).53,54 Outros fatores de risco para ceratoses actínicas incluem episódios de queimaduras solares dolorosas antes dos 20 anos (OR = 1,21), não usar filtro solar (OR = 1,81) e história familiar positiva para neoplasias cutâneas (OR = 1,85).34 Os episódios de queimaduras solares dolorosas antes dos 20 anos poderiam representar os eventos iniciadores do processo de carcinogênese, uma vez que tanto exposição aguda quanto crônica à radiação UV podem levar a mutações no gene p53 e expansão clonal queratinocítica subsequente.55
Pacientes em uso crônico de medicamentos imunossupressores sistêmicos compõem um grupo de risco específico para neoplasias e displasias cutâneas decorrentes dos efeitos carcinogênicos da radiação UV.56 Em transplantados de órgãos sólidos, o CPNM é a neoplasia mais prevalente, ocorre em 27% desses indivíduos.56,57 Pacientes imunossuprimidos apresentam maior prevalência de ceratoses actínicas e maior risco de progressão dessas lesões para CEC.58 Estudo conduzido com 495 pacientes transplantados renais e hepáticos na cidade de Queensland, Austrália, com média na amostra de 54 anos e tempo médio de imunossupressão de 8,9 anos, observou presença de ceratoses actínicas em 80% da amostra estudada; 30% dos pacientes apresentavam mais do que cinco lesões.59 Nos pacientes imunossuprimidos, a prevalência de CPNM é maior do que na população em geral e há maior risco de progressão das ceratoses actínicas para CEC (a incidência de CECs em imunossuprimidos é 65 vezes maior do que na população geral) e seus CECs apresentam maior risco de progredir para estágio IV (ocorrência de metástases em 0,5%‐5% na população geral versus 8% em imunossuprimidos).58–61 O tempo de imunossupressão é o fator mais importante para o aumento do risco de desenvolver CPNM nesses pacientes e as lesões tendem a ocorrer sobre áreas de campo de cancerização, com OR de 93 para desenvolvimento de CEC versus 20 vezes nos pacientes com ceratoses actínicas isoladas.61,62
O desenvolvimento de ceratoses actínicas nos pacientes imunossuprimidos envolve os fatores já descritos e aspectos relacionados às medicações imunossupressoras, que podem até atuar como carcinógenos, por exemplo, a azatioprina. Ela causa danos diretos ao DNA quando há exposição à radiação UVA, além de ser fotossensibilizante. No caso da ciclosporina, os efeitos carcinogênicos ocorrem por meio da regulação positiva do TGF‐β. Há evidência científica de aumento do risco de desenvolver CECs com uso de azatioprina, ciclosporina, tacrolimus, prednisolona e inibidores de m‐TOR (mammalian target of rapamycin), como sirolimus e everolimus. Entretanto, pacientes em uso de inibidores de m‐TOR apresentam risco 51% menor de desenvolver CECs quando comparados aos pacientes que fizeram uso de ciclosporina ou tacrolimus.63 Soma‐se a isso o fato de o estado de imunossupressão crônica afetar as vias de correção de mutações pré‐oncogênicas.57 O papel do papilomavírus humano na carcinogênese cutânea de pacientes imunossuprimidos segue controverso e o mecanismo proposto não está claro.63 O risco de desenvolver CPNM nos cinco primeiros anos pós‐transplante reduziu de maneira significativa nos pacientes submetidos a transplantes de órgãos sólidos de 1983‐1987 para 2003‐2007. Na população norueguesa, a incidência de CEC era 102 vezes maior do que a observada na população geral naquele período, reduziu para 21,6 vezes em 2003‐2007.64 A implantação de protocolos imunossupressores individualizados e menos agressivos, o seguimento clínico periódico desses pacientes, bem como medidas educativas sobre hábitos de segurança solar, foram responsáveis por essa redução.57,64
Características adicionais consideradas de risco para desenvolvimento de ceratoses actínicas incluem telangiectasias na face, efélides, lentigos solares (OR = 1,6),65 elastose solar (OR = 4,4), cutis rhomboidalis nuchae (OR = 2,9) e 10 ou mais melanoses no dorso das mãos (OR = 6).31,65
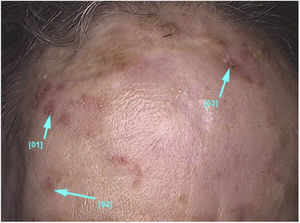
Aspectos clínico‐histológicosAs ceratoses actínicas apresentam‐se como máculas, pápulas ou placas eritematosas, geralmente com bordas mal definidas, podem ser cobertas por escamas secas aderentes, que são por vezes mais bem identificadas à palpação do que à inspeção visual e podem apresentar graus variados de hiperceratose.1,66 As lesões se manifestam únicas ou múltiplas (fig. 2), podem variar de coloração rósea às variantes eritematosas ou acastanhadas, no caso das ceratoses actínicas pigmentadas.67,68 O grau de infiltração também pode ser variável conforme a intensidade e o grau de displasia das lesões. Apresentam‐se de forma assintomática na maioria dos casos, apesar de não ser raro que pacientes manifestem desconforto como ardência, dor, sangramento e prurido.1,66,69
As ceratoses actínicas localizam‐se predominantemente em áreas de fotoexposição crônica, como face, couro cabeludo em calvos, colo, região cervical, ombros, antebraços e dorso das mãos.13 Em ambos os sexos, a ocorrência das lesões é maior nas regiões dos membros superiores e de face e couro cabeludo.13 Essas regiões, em especial cabeça, pescoço e antebraços, são responsáveis por 75% das lesões relatadas.15
As ceratoses actínicas podem se manifestar de formas distintas e apresentam variantes clínicas, como ceratose actínica hiperqueratótica, atrófica, pigmentada, ceratose actínica liquenoide, corno cutâneo e queilite actínica. As diferentes variantes apresentam características clínico‐morfológicas específicas de cada subtipo e, consequentemente, esse reconhecimento muitas vezes é aplicável para seu correto manejo, uma vez que determinadas ceratoses respondem melhor a algumas modalidades terapêuticas, como será descrito a seguir (tabela 1).68
Variantes clínicas de ceratoses actínicas e suas manifestações usuais
| Corno cutâneo | Projeção cônica, acentuadamente hiperqueratótica, de coloração branca a amarelada e base papulosa eritematosa com grau variado de infiltração70 |
| Diagnóstico diferencial com carcinoma espinocelular68 | |
| Queilite actínica | Placa avermelhada e/ou leucoplásica com descamação, fissuras, ulcerações e/ou áreas de hiperceratose focal nos lábios (95% dos casos no lábio inferior) |
| Diagnóstico diferencial com carcinoma espinocelular71 | |
| Ceratose actínica pigmentada | Pápulas ou placas descamativas, ásperas com tons de marrom e preto66 |
| Diagnóstico diferencial com lentigo maligno | |
| Ceratose actínica liquenoide | Placa ou pápula rósea |
| Usualmente nas extremidades superiores ou no tronco | |
| Diagnóstico diferencial principalmente com carcinoma basocelular66 |
Em pacientes com fotodano severo, ceratoses actínicas podem ser múltiplas e mal‐delimitadas, de modo que não é possível fazer a contagem das lesões; nessas situações tem‐se o chamado campo de cancerização, caracterizado por alterações pré‐neoplásicas do epitélio após longa exposição a agentes carcinogênicos, em especial radiação UV, e constituído por lesões em diferentes fases, desde ceratoses actínicas subclínicas até CECs.72,73 O campo de cancerização foi descrito por Slaughter em 1957, ao analisar o epitélio escamoso estratificado perilesional de CECs na mucosa oral; Slaughter reportou que nos espécimes histológicos avaliados para ressecção tumoral, a pele adjacente aos CECs, apesar de clinicamente sem alterações, apresentava alterações histológicas tais como atipias celulares e até mesmo CECs in situ.73 Esse conceito de múltiplos focos contíguos de carcinogênese do campo de cancerização representa o conjunto de alterações encontradas na pele com fotodano crônico e com múltiplos focos de CPNM, inclusive múltiplas ceratoses actínicas; nesse caso, a pele perilesional sem alterações clínicas aparentes pode apresentar modificações citogenéticas associadas à carcinogênese.1,74 O conceito de campo de cancerização auxilia na explicação do curso crônico do paciente com ceratoses actínicas, com tendência à recorrência. Além disso, reitera a necessidade de tratar toda a extensão da área com lesões para uma remissão mais duradoura. De maneira contrastante, se apenas lesões visíveis forem tratadas, áreas mutantes adjacentes poderão desenvolver novas lesões.74
Embora o diagnóstico das ceratoses actínicas seja baseado no exame clínico, em algumas situações a biópsia cutânea e o envio do material para análise histopatológica são necessários – critérios maiores: lesões grandes (> 1cm de diâmetro), presença de sangramento, ulceração ou induração, rápido crescimento lesional e eritema; critérios menores: prurido intenso sobre a lesão, dor, pigmentação, hiperceratose e lesão palpável. Além disso, ausência de resposta aos tratamentos habituais e presença de alguma característica não usual também podem estar associadas à progressão de ceratoses actínicas para CEC e indicam necessidade de exame histopatológico.3,5,68,75,76
Cabe salientar que CECs provenientes de queilite actínica apresentam maior risco de metástase e, por esse motivo, torna‐se fundamental elucidar precocemente a etiologia das lesões labiais. Nesse contexto, a biópsia e o envio do material para análise histopatológica são de suma importância. A biópsia cutânea é imperativa em casos de suspeita de CEC quando houver ulcerações, aumento da espessura da semimucosa, mudança na textura do lábio ou perda da definição entre a transição da comissura labial e a pele adjacente.71
ClassificaçõesDistintas propostas de classificar as ceratoses actínicas já foram descritas, levaram em consideração aspectos clínicos, dermatoscópicos e histopatológicos, isolados ou associados (tabela 2). Inicialmente, Olsen et al. classificaram as lesões em três graduações, de acordo com aspectos clínicos. Essa graduação é recomendada para avaliar o grau de severidade das lesões na prática clínica.76,77 Já Röwert‐Huber et al. classificaram as lesões de acordo com o exame histológico em grau I ao grau III; essa é a classificação histológica indicada pelo Guideline Europeu para tratamento de ceratoses actínicas de 2015.6,76 Ao avaliar o grau de concordância entre as graduações clínica e histológica, observa‐se que é baixo, reforça a necessidade de tratamento de todas as ceratoses actínicas, independentemente da graduação.78 Além dessas duas classificações, outras estão disponíveis, inclusive a de Cockerell, que associa exame clínico e grau de atipias dos queratinócitos, e a de Goldberg, que as classifica como proliferativa ou não com base no comportamento clínico e nas características histológicas.3,79,80 Além disso, Zalaudek et al. usaram a dermatoscopia para classificar ceratose actínica facial. Com base no exame histopatológico, é ainda possível categorizar a ceratose actínica em sete subtipos: hipertrófica, atrófica, bowenoide, acantolítica, epidermolítica, liquenoide e pigmentada.1,7,81 Nessa classificação pode ocorrer sobreposição de subtipos histológicos em uma única lesão.43 Por fim, não há consenso sobre a validação dessas classificações. Seu uso permanece controverso e ainda não é possível definir um padrão‐ouro de sistema de classificação para ceratoses actínicas na prática clínica.82
Classificações existentes para ceratoses actínicas
| Publicações por ordem cronológica | Métodos que baseiam a classificação |
|---|---|
| Olsen et al., 199177 | Exame clínico |
| Grau I: facilmente palpáveis e pouco visíveis | |
| Grau II: facilmente visíveis e palpáveis | |
| Grau III: visíveis e hiperqueratóticas | |
| Goldberg et al., 199480 | Exame clínico e características evolutivas |
| Lesões proliferativas: resistentes à terapêutica, tendência ao crescimento e a evoluir para CEC | |
| Não proliferativas | |
| Cockerell, 20003 | Exame clínico e anatomopatológico |
| Grau I: mácula plana sem hiperceratose, inclusive subclínica, histopatologia com atipia de queratinócitos no terço inferior da epiderme | |
| Grau II: lesão hiperqueratótica com induração variável, histopatologia com atipia nos 2/3 inferiores da epiderme | |
| Grau III: placas induradas, podem ser pigmentadas, atipia intensa em todo o epitélio | |
| Röwert‐Ruber et al., 20076 | Achados anatomopatológicos |
| Grau I: queratinócitos atípicos na camada basal e suprabasal da epiderme | |
| Grau II: queratinócitos atípicos nos 2/3 inferiores da epiderme | |
| Grau III: atipia superior a 2/3da epiderme e envolvimento do epitélio anexial | |
| Zalaudek et al., 201479 | Achados dermatoscópicos |
| Grau I: pseudorrede eritematosa, escamas discretas | |
| Grau II: pseudorrede eritematosa, aberturas foliculares queratóticas e alargadas | |
| Grau III: hiperceratose com escamas espessas ou aberturas foliculares queratóticas e alargadas associadas a escamas |
As ceratoses actínicas são diagnosticadas clinicamente na maioria dos casos. Lesões com dados de anamnese compatíveis e com aspectos clínicos inequívocos podem ser reconhecidas e não precisam de análises complementares. A dermatoscopia tem se mostrado extremamente importante para aumentar o nível de confiança e acurácia nas lesões suspeitas. Outros métodos de imagem não invasivos, como a microscopia confocal, também podem ser de utilidade em situações específicas quando disponíveis. Finalmente, casos duvidosos irão necessitar de estudo anatomopatológico para confirmação diagnóstica.
Conhecer as características clínicas dos principais diagnósticos diferenciais das ceratoses actínicas e saber fazer uso dos métodos auxiliares para diagnóstico é fundamental nesse processo.
DermatoscopiaA dermatoscopia é um método não invasivo de rápida execução que auxilia no diagnóstico das ceratoses actínicas e permite diferenciá‐las de seus diagnósticos diferenciais; além disso, as ceratoses actínicas apresentam critérios dermatoscópicos bem estabelecidos. A dermatoscopia apresenta alta sensibilidade e especificidade para o diagnóstico de ceratoses actínicas, com valores de 98,7% e 95%, respectivamente.83,84
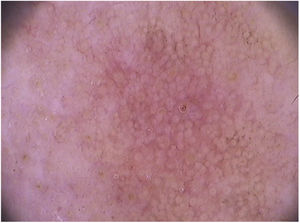
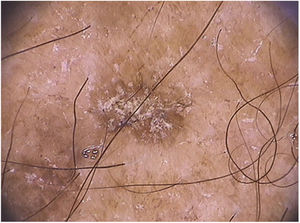
Nas ceratoses actínicas faciais, quatro achados dermatoscópicos são descritos como essenciais: 1) Eritema que forma pseudorrede vascular róseo‐avermelhada e circunda folículos pilosos; 2) Escamas branco‐amareladas; 3) Vasos finos e ondulados que circundam os folículos; e 4) Aberturas foliculares preenchidas por plugs queratóticos amarelados.83 Essas estruturas definem o chamado “padrão em morango” descrito para a maioria das ceratoses actínicas faciais (fig. 3).83 Outro achado que pode ser encontrado é o “sinal da roseta”, visto na dermatoscopia com luz polarizada, uma figura que lembra um trevo de quatro folhas, formada por quatro pontos esbranquiçados que circundam a abertura folicular.85–87
Peculiaridades dermatoscópicas são observadas em alguns subtipos de ceratoses actínicas: a ceratose actínica bowenoide apresenta vasos glomerulares regularmente distribuídos ao longo da lesão, o que a diferencia da doença de Bowen, cujos vasos são irregularmente distribuídos e agrupados; a ceratose actínica hiperqueratótica apresenta padrão inespecífico devido à hiperceratose, que impede a visualização das estruturas subjacentes.66,88
A dermatoscopia de ceratoses actínicas extrafaciais inclui eritema e escamas superficiais, por vezes acompanhados de vasos em ponto.88,89 Além disso, a pseudorrede eritematosa pode eventualmente ser encontrada, embora seja característica das lesões faciais.89,90
Quando o paciente apresenta múltiplas ceratoses actínicas, alguns autores descrevem que as lesões tendem a seguir um mesmo padrão dermatoscópico.91 Essa tendência ocorre em relação à pigmentação: pacientes de fototipos mais altos tendem a apresentar múltiplas lesões pigmentadas, enquanto os de fototipos mais baixos apresentam lesões não pigmentadas.91
A dermatoscopia pode ser útil para avaliar a progressão espectral de ceratoses actínicas até a formação de CEC invasivo, conforme descrito por Zalaudek et al. (tabela 3).92
Modelo de progressão a partir de análise dermatoscópica de ceratoses actínicas para carcinoma espinocelular (CEC) invasivo
| Diagnóstico clínico | Achados dermatoscópicos |
|---|---|
| Ceratose actínica | Pseudorrede eritematosa |
| Ceratose actínica que evolui para CEC in situ | Padrão starburst |
| CEC in situ | Estruturas opacas amareladas e vasos em ponto |
| CEC in situ que progride para invasor | Áreas brancas sem estruturas, vasos em ponto e em grampo |
| CEC minimamente invasivo | Massa central de queratina e vasos em grampo |
| CEC invasivo | Massa central de queratina, ulceração e vasos lineares irregulares |
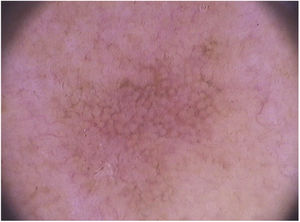
Em relação à dermatoscopia de ceratoses actínicas pigmentadas, os principais tipos de pigmentação são: pseudorrede acastanhada, pigmento homogêneo, pigmento anular‐granular, pigmento acastanhado ou acinzentado em pontos e glóbulos e halo pigmentado acinzentado perifolicular.93 Na face, predomina a pseudorrede pigmentada e o pigmento anular‐granular (fig. 4).
As ceratoses actínicas pigmentadas extrafaciais podem apresentar padrão reticular com uma rede pigmentar delicada, padrão pigmentado homogêneo ou múltiplos pontos e glóbulos irregulares de coloração acastanhada a cinza‐azulada (fig. 5).66
Exames de imagem não invasivosMicroscopia confocalA microscopia confocal (MC) é uma técnica não invasiva, in vivo, com imagens cuja resolução se aproxima da histologia. O princípio da MC baseia‐se na reflexão, dispersão e absorção de comprimentos de luz próximo ao infravermelho, possibilita avaliações horizontais das lesões ao nível da epiderme e derme superficial.94,95 Por esse motivo, lesões hiperqueratóticas não apresentam boa visualização com MC devido à baixa penetrância da luz infravermelha.94,96 Os principais achados das ceratoses actínicas à MC incluem: escamas superficiais, que se apresentam como material amorfo com refratibilidade variável ao nível do estrato córneo; paraceratose, apresentada como células delimitadas por halo esbranquiçado com centro enegrecido; e padrão em favo de mel irregular na camada granular e espinhosa devido à presença de queratinócitos de variados tamanhos.60 A diferenciação entre ceratoses actínicas e CECs pela MC é feita pelas alterações dérmicas, presentes apenas em CECs, e incluem a presença de células pleomórficas dérmicas.94
Em relação às ceratoses actínicas pigmentadas, a MC também pode ser usada.93 Os achados descritos incluem os já descritos para as lesões não pigmentadas, acrescidos de aumento da espessura da epiderme e células dendríticas intraepidérmicas correspondentes a células de Langherans.94
Tomografia de coerência ópticaA tomografia de coerência óptica (TCO) é outro método de imagem não invasivo, in vivo, com sensibilidade de 86% e especificidade de 83% para o diagnóstico de ceratoses actínicas.94 A técnica baseia‐se no princípio da interferiometria, que usa a radiação infravermelha e torna possível a visualização de camadas da epiderme, estruturas anexiais e vasculares.94 As imagens produzidas pela TCO são biologicamente tridimensionais, com profundidade de penetração de 500‐1.000mm e dimensão lateral de 4‐6mm.97 Os principais achados observados nas ceratoses actínicas incluem espessamento e espalhamento mais forte do estrato córneo devido à paraceratose, além de aumento da espessura total da epiderme, com demarcação bem definida com a derme.97 Nas ceratoses actínicas hiperqueratóticas, a visualização com TCO fica dificultada.97
Exame histopatológicoO exame histopatológico das ceratoses actínicas caracteriza‐se por queratinócitos atípicos e pleomórficos na camada basal da epiderme e por maturação defeituosa dos queratinócitos nas camadas superficiais, com arquitetura anormal da epiderme. O número de mitoses está aumentado e ocorre perda da polaridade dos queratinócitos.43 O chamado “sinal da bandeira” pode ser observado, decorrente da alternância de paraceratose e de hiperceratose no estrato córneo, pois as lesões tendem a poupar o acrossiríngeo e o acrotríqueo, e sobre essas estruturas a queratinização ocorre normalmente.3 Outros achados que podem ser encontrados incluem infiltrado inflamatório leve composto por linfócitos e histiócitos, áreas de acantose e acantólise e elastose solar.3,67,69
Exame imuno‐histoquímicoNão é feito de rotina para diagnóstico de ceratoses actínicas, mas pode ser útil na diferenciação de lesões duvidosas, as diferencia de doença de Bowen, doença de Paget e melanoma.98 Os anticorpos anticitoqueratinas (CK) são os principais anticorpos usados no painel imuno‐histoquímico das ceratoses actínicas, uma vez que as queratinas são as principais proteínas presentes na epiderme.99 Ceratoses actínicas tendem a apresentar painel histoquímico positivo para CK5/8 na epiderme, além de alguns casos apresentarem positividade para CK15 e CK19, marcadores de células‐tronco epidérmicas, e negativo para CK7.98,100 A positividade de S100 favorece o diagnóstico de lesões melanocíticas e pode ser útil na diferenciação entre a ceratose actínica e o melanoma.101
Além disso, embora não sejam usados rotineiramente, marcadores de proliferação celular e de desregulação do ciclo celular são observados nas camadas epidérmicas.102,103
Diagnóstico diferencialO diagnóstico diferencial das ceratoses actínicas inclui ceratose seborreica, doença de Bowen, CEC, lentigo solar, estucoceratose, CBC, poroceratose, acantoma de células claras, psoríase, lúpus eritematoso, líquen plano e verruga viral.1,90 Nas ceratoses actínicas pigmentadas faciais, o principal diagnóstico diferencial é o lentigo maligno, embora outras lesões benignas entrem no diagnóstico diferencial, como lentigo solar, ceratose seborreica e ceratose liquenoide (tabela 4).93,104–106 O correto reconhecimento de cada um desses diagnósticos diferenciais é essencial, pois eles variam em relação ao prognóstico e aos tratamentos necessários.106 Nesse contexto, a dermatoscopia é fundamental, pois auxilia a diferenciá‐los.
Presença de estruturas dermatoscópicas nos distintos diagnósticos diferenciais das lesões pigmentadas faciais
| Ceratoses actínicas pigmentadas | Lentigo maligno melanoma | Lentigo senil | Ceratose seborreica | Ceratose liquenoide | |
|---|---|---|---|---|---|
| Estruturas romboidais | + | + | − | − | +/− |
| Granulação cinza‐acastanhada | Distribuição uniforme perifolicular | Distribuição difusa | − | − | Distribuição difusa |
| Padrão anular‐granular | + | + | − | − | + |
| Pigmentação folicular assimétrica | − | + | − | − | − |
| Áreas de pigmentação homogênea | − | + | − | − | − |
| Bordas roídas por traças | +/− | − | + | + | − |
| Sinal da geleia | − | − | + | + | − |
| Estruturas em impressão digital | − | − | + | + | − |
Adaptado de: Ciudad C, et al. Diagnostic utility of dermoscopy in pigmented actinic keratosis. Actas Dermosifiliogr. 2011;102:623‐6.107.
Apesar do difícil diagnóstico diferencial entre ceratose actínica pigmentada e lentigo maligno na face, a dermatoscopia pode ser útil. A presença de áreas homogêneas (obliteração de folículos) é fortemente sugestiva de lentigo maligno, enquanto estruturas foliculares poupadas de pigmento melânico e com um halo acinzentado mais tampões córneos centrais favorecem a hipótese de ceratose actínica pigmentada.66,108
Evolução e prognósticoAs ceratoses actínicas podem seguir sua evolução de três maneiras distintas e a mais relevante delas é a transformação para CEC. Por outro lado, uma parcela importante das lesões permanece estável ao longo de sua evolução e, ainda, pode involuir espontaneamente, embora recidivas sejam frequentes.8,109,110
O processo de carcinogênese nas ceratoses actínicas segue o modelo de carcinogênese em múltiplas etapas: uma mutação inicial em um gene supressor tumoral leva à lesão precursora e, posteriormente, mutações em oncogenes levariam às propriedades invasivas.111 Essa progressão pode ocorrer pela via clássica, em que há progressão da displasia queratinocítica desde as camadas mais superficiais da epiderme em direção à camada basal e à derme,3 ou pela via diferenciada, mais agressiva e comum, em que a displasia de queratinócitos apenas na camadas basais da epiderme evolui para CEC invasivo por avanço lesional pelas glândulas sudoríparas e folículos pilosos.112
Dados sobre o risco de transformação maligna de uma única ceratose actínica variam de 0,1% a 16%.37,109,113–115 Em 10 anos, o risco de transformação maligna de uma única lesão é de cerca de 10% para pacientes imunocompetentes e de 20% em imunocomprometidos.67,115,116 Desse modo, ao avaliarmos o risco de transformação maligna de ceratoses actínicas em pacientes com múltiplas lesões, o risco será maior do que o descrito para pacientes que apresentam lesões únicas.117 De fato, o risco de esses pacientes desenvolverem CBCs e CECs é maior do que na população em geral.118 Em um estudo populacional nos Estados Unidos (média da população analisada de 79 anos), o risco de um paciente com ceratose actínica apresentar câncer de pele, tanto para CPNM quanto para melanoma, foi seis vezes maior, em comparação com a população sem ceratose actínica (p < 0,001).119 O estudo demonstrou ainda que esse risco estava aumentado na população branca (p < 0,01), com aumento conforme a idade dos pacientes se elevava.119
De acordo com alguns autores, 60% a 80% dos CECs desenvolvem‐se em áreas de ceratoses actínicas.109,114,120,121 Alguns estudos sugerem até que o tempo seria um cofator para a transformação das ceratoses actínicas em lesões invasivas, com tempo médio de transformação para lesões invasivas de 24,6 meses (95% IC: 21,04‐28,16 meses).39,122
Comprovadamente uma parcela importante (63,1%) das lesões permanece estável ao longo de seu curso; essa é a evolução mais frequente das ceratoses actínicas.37 Muitas vezes elas crescem em tamanho, quantidade ou se tornam mais hiperqueratóticas, se não tratadas.37
Por fim, existe uma minoria das lesões (de 20% a 23% em pacientes com lesão única e de 0% a 7,2% em pacientes com campo de cancerização) que podem desaparecer de maneira espontânea; no entanto, os relatos referem recidiva lesional em parcela significativa dos pacientes, atinge 57% dos casos.110 O mecanismo proposto para explicar a remissão espontânea de ceratoses actínicas envolve uma resposta imunológica suficiente para ocasionar destruição lesional; além disso, a redução da exposição à radiação UV poderia estar envolvida.37 Nos pacientes imunossuprimidos, as taxas de regressão lesional espontânea são ainda menores.123
Essa progressão varia de acordo com características clínicas do paciente. Indivíduos imunossuprimidos ou com CPNM prévio apresentam maior risco de transformação maligna de suas ceratoses actínicas. Além disso, em um mesmo indivíduo as ceratoses actínicas apresentam características dinâmicas: algumas lesões regridem de maneira espontânea, enquanto outras evoluem para lesões invasivas; identificar quais lesões irão evoluir para CEC é um desafio.110 Outra consideração importante é que pacientes diagnosticados com ceratoses actínicas apresentam risco de novas lesões nos 12 meses que se seguem de 60%, o que demonstra as características crônicas dessa patologia.13,37
Pacientes com ceratoses actínicas costumam ter um bom prognóstico, uma vez que essa dermatose não está associada diretamente à mortalidade; entretanto, diferentes graus de morbidade associados aos tratamentos das lesões e aos sintomas da doença são frequentes. Além disso, o prognóstico pode variar naqueles pacientes com lesões mais agressivas e associação com CEC. A mortalidade geral para essa neoplasia gira em torno de 3% a 4% dos casos.124 Ainda, pacientes cronicamente fotoexpostos com ceratoses actínicas estão sob maior risco de desenvolver CPNM do tipo CBC e melanoma; por isso, maior vigilância para essa ocorrência deve ser feita nesses indivíduos.125–127
TratamentoTendo em vista o potencial de transformação maligna das ceratoses actínicas e o fato de não ser possível predizer quais lesões irão ou não evoluir para CPNM, recomenda‐se que todas sejam tratadas.1,9,116,128
Algumas atitudes são essenciais no manejo de pacientes com ceratoses actínicas: 1) Avaliação dermatológica periódica; 2) Avaliação da presença e tratamento do campo de cancerização; 3) Tratamento pontual de lesões mais queratóticas; 4) Educação do paciente quanto ao caráter crônico do problema, necessidade de fotoproteção e de tratamentos frequentes; e 5) Autoexame regular da pele pelo paciente.129
Existe uma variedade significativa de opções terapêuticas para as ceratoses actínicas. Basicamente, podemos dividi‐las em métodos ablativos ou cirúrgicos e de tratamento medicamentoso por via tópica (tabela 5).130 Uma associação entre métodos ou seu uso de maneira sequencial são atitudes muito frequentes no manejo desses pacientes.131 A escolha do tratamento varia de acordo com aspectos clínicos das ceratoses, sua localização e o número e a extensão de lesões, deve ser individualizado conforme a necessidade de cada paciente.132 Um ponto importante é que 25% a 75% dos pacientes tratados necessitarão de retratamento em 12 meses pelo surgimento de novas lesões, o que demonstra o caráter crônico das ceratoses actínicas, mesmo que tenha sido feito tratamento de campo de cancerização.127 Os piores índices são observados em pacientes submetidos apenas à crioterapia e os melhores, nos que fazem tratamento de campo de cancerização.133
Opções terapêuticas ablativo‐cirúrgicas e medicamentosas para as ceratoses actínicas e seus respectivos níveis de evidência
| Modalidades de tratamentos cirúrgicos | Modalidades de tratamentos tópicos e orais |
|---|---|
| Criocirurgia (grau de recomendação A, nível de evidência 1++)131 | 5‐fluorouracil (grau de recomendação A, nível de evidência 1++)131 |
| Imiquimode (grau de recomendação A, nível de evidência 1++)131 | |
| Laser de CO2 (grau de recomendação B, nível de evidência 1+)131 | Mebutato de ingenol (grau de recomendação A, nível de evidência 1+)131 |
| Terapia fotodinâmica (grau de recomendação A, nível de evidência 1+)131 | |
| Curetagem e eletrodissecação (grau de recomendação D, nível de evidência 4) | Diclofenaco (grau de recomendação A, nível de evidência 1+)131 |
| Retinoides tópicos (grau de recomendação B. nível de evidência 1+)131 | |
| Exérese cirúrgica (grau de recomendação D, nível de evidência 4 | Terapias sistêmicas (grau de recomendação C, nível de evidência 2+)131 |
ECR, ensaio clínico randomizado.
Grau de recomendação: A, ao menos uma metanálise, revisão sistemática ou ECR 1++ e metanálises; B, grupo de estudos 2++ com resultados consistentes; C, grupo de estudos 2+ com resultados consistentes; D, evidência nível 3 ou 4, ou consenso formal.
Nível de evidência: 1++: metanálises de alta qualidade, revisão sistemática de ECRs ou ECRs com risco muito baixo de viés; 1+: metanálises bem conduzidas, revisão sistemática de ECR ou ECR com risco baixo de viés; 1) metanálise, revisão sistemática ou ECR com risco alto de viés; 2++: revisões sistemáticas de alta qualidade, estudos caso‐controle ou coorte. Os estudos caso‐controle e coorte têm baixo risco de confundidores, vieses e alta probabilidade de apresentar relação causal; 2+: casos‐controle ou coortes bem conduzidas com risco baixo de confundidores, vieses e probabilidade moderada de apresentar relação causal; 2) estudos de casos‐controle ou coortes bem conduzidas com baixos fatores de confusão, vieses e alta probabilidade de não apresentar relação causal; 3) estudos não analíticos (relatos de caso, série de casos); 4) opinião de especialista, consenso formal.
A última revisão da Cochrane para tratamento de ceratoses actínicas foi publicada em 2012 e concluiu que 5‐fluorouracil (5‐FU), diclofenaco, imiquimode e mebutato de ingenol apresentavam eficácia similar.134 No ano seguinte, Gupta et al. avaliaram as terapias tópicas para ceratoses actínicas em termos de eficácia e os resultados analisados, da melhor para a pior eficácia, foram: 5‐FU a 5%, 5‐FU a 0,5%; terapia fotodinâmica (TFD) com ácido aminolevulínico (ALA), imiquimode, mebutato de ingenol, TFD com metilaminolevulínico (MAL), crioterapia, gel de diclofenaco.135 Outra metanálise observou que TFD com ALA apresentava a maior eficácia em termos de resposta completa das lesões; no entanto, essa metanálise apresenta limitações por não ter incluído estudos publicados nos anos prévios à publicação.136,137
Classicamente, os pacientes podem ser divididos em quatro subgrupos de acordo com o grau de extensão da doença para definição do método terapêutico: pacientes com lesões únicas (< 5 lesões por área corporal), com múltiplas lesões (6 ou mais lesões por área corporal), com áreas de campo de cancerização ou pacientes imunossuprimidos.76
Tratamentos tópicos5‐fluorouracilO uso de 5‐FU é descrito em concentrações de 0,5% e 5% para o tratamento de ceratoses actínicas. No Brasil, o produto está disponível comercialmente apenas em concentração a 5%. O 5‐FU age interferindo na síntese de DNA por inativação irreversível da timidilato sintetase; o resultado final é a apoptose de células de alta proliferação, como os queratinócitos de ceratoses actínicas.138
Recomenda‐se que o 5_FU creme a 5% seja usado duas vezes ao dia na área com lesões até que a resposta inflamatória esteja em estado de erosão, o que ocorre após período de tratamento de duas a quatro semanas. A superfície cutânea a ser tratada não deve ser maior do que 500 cm2 e o tratamento deve ser escalonado caso a área a ser tratada seja superior. Após a aplicação ocorrem com frequência sensação de queimação, formação de crostas, eritema, vesiculação, erosão, dor, fotossensibilidade, prurido e ulceração; tais efeitos são decorrentes da atividade farmacológica do 5‐FU e é necessário que o paciente esteja ciente dessa sintomatologia. A ocorrência de eritema em áreas sem lesões aparentes demonstra a capacidade do 5‐FU de revelar lesões subclínicas, possibilita assim o tratamento do campo de cancerização. O desaparecimento completo das lesões pode não ser evidente até um a dois meses após a interrupção da terapia.
Estudo split‐face que comparou o uso das concentrações de 0,5% uma vez ao dia versus 5‐FU a 5% duas vezes ao dia por período de quatro semanas de aplicação observou eficácia similar no percentual de redução do número de lesões e no percentual de pacientes que atingiram resposta completa; além disso, a concentração a 0,5% foi superior na redução do número total de lesões e foi preferida pelos pacientes pelo maior perfil de tolerabilidade.139 No caso do 5‐FU a 5%, dados de resposta completa variam de 50%‐96%, com remissão completa em um ano de seguimento de 54% e 33%, respectivamente, para pacientes com lesões circunstanciais e aqueles com campo de cancerização.133,140
O grau de recomendação para uso do 5‐FU a 0,5% para tratamento de campo de cancerização em pacientes imunocompetentes é forte e essa concentração é preferida em relação à concentração de 5%. Em pacientes imunossuprimidos, recomenda‐se o uso de 5‐FU a 5%.76 No entanto, nesse cenário, sua eficácia é limitada e o grau de recomendação para essa população específica também é baixo.76
Há descrição do uso de 5‐FU a 0,5% associado a ácido salicílico a 10% em preparações tópicas. Nesse caso, o ácido salicílico é usado como agente queratolítico para aumentar a permeação do 5‐FU e é indicado para tratamento de ceratoses actínicas grau I e II, em aplicação diária por período de 6 a 12 semanas.141 O grau de recomendação para o uso dessa combinação é fraco em pacientes imunocompetentes, tanto para lesões únicas quanto múltiplas, inclusive campo de cancerização.76
ImiquimodeImiquimode é um composto sintético da família das imidazoquinolonas que atua como imunomodulador. A medicação atua como receptor tool‐like na expressão de RNA mensageiro de genes imunomodulatórios que induzem a produção de citocinas; como resultado, ocorre aumento da resposta imune inata e adquirida, com aumento de atividade antitumoral e antiviral.142 Além disso, o imiquimode ativa as vias pró‐apoptóticas.143
O imiquimode tópico para tratamento de ceratoses actínicas pode ser usado em concentrações de 2,5%, 3,75% e 5%. No Brasil, o produto está disponível apenas em concentração de 5%. Recomenda‐se que o imiquimode a 3,75% para o tratamento de ceratoses actínicas seja usado diariamente por duas semanas, seguido de uma pausa de duas semanas e outro ciclo de duas semanas de uso.144 A recomendação para uso da concentração a 5% no tratamento de ceratoses actínicas é de aplicação dois a três dias por semana, por 4 a 16 semanas, com aplicação à noite, antes de dormir; o produto deve permanecer sobre a pele por 8 horas.76 O uso de imiquimode a 5% três vezes por semana por quatro semanas foi o tratamento mais eficaz em estudo que o comparou com o 5‐FU a 5% e crioterapia.132 Nesse estudo, a taxa de remissão completa após um ano de tratamento foi de 73% nos pacientes que haviam usado o imiquimode.133
O grau de recomendação para o tratamento de campo de cancerização com iquimimode a 3,75% é forte; para a concentração de 5%, o grau de recomendação é fraco. Essa diferença ocorre em função da qualidade metodológica dos estudos.76
Mebutato de ingenolO mebutato de ingenol (MI) é um derivado da planta Euphorbia peplus, encontrado comercialmente em concentrações de 0,015% para uso em lesões de face e couro cabeludo, com uso indicado por três dias consecutivos (uma bisnaga/dia), e na concentração de 0,05% para uso em outras áreas corporais por dois dias consecutivos. O MI age por mecanismo de ação duplo de efeitos citotóxico e imunomodulatório mediado por neutrófilos.145 Os efeitos adversos esperados com o tratamento incluem eritema (94%), edema (79%), vesiculação (56%), formação de crostas (80%), descamação (85%), erosão e ulceração (32%), o pico ocorre quatro dias após o término do curso de tratamento nas lesões faciais e entre o terceiro e o oitavo dia nas lesões extrafacias.146
Estudos controlados por placebo evidenciaram taxa de resposta completa com MI 37%‐44% nas ceratoses actínicas faciais e de couro cabeludo e de 39%‐42% nas lesões de tronco e extremidades. Essa resposta foi mantida no seguimento de 12 meses em 46,1% das lesões faciais e em 44% das lesões extrafaciais tratadas.146 Além disso, de 171 pacientes avaliados nesses estudos apenas três apresentaram efeitos adversos leves não relacionados ao tratamento.147 Estudo longitudinal na população brasileira com 27 pacientes tratados demonstrou resposta completa em 53,8% das ceratoses actínicas faciais e em 42,8% das lesões extrafaciais tratadas. Além disso, o tratamento foi bem tolerado.148
Além dos estudos controlados por placebo, existem estudos que comparam o uso de MI com outras modalidades terapêuticas, como diclofenaco de sódio gel e 5‐FU. Estudo de fase IV que comparou MI com diclofenaco gel para tratamento de ceratoses actínicas grau I e II de face e couro cabeludo observou resposta completa após um ciclo de tratamento com mebutato de ingenol de 34% das lesões tratadas e de 23% após 90 dias de uso de diclofenaco gel; após um segundo tratamento, as taxas de resposta completa foram de 53% para o grupo ingenol e de 45% para o grupo diclofenaco (p < 0,001).149 Outro estudo comparou o uso de MI por três dias consecutivos em ceratoses actínicas faciais com 5‐FU, aplicado duas vezes ao dia por período de quatro semanas, em relação ao perfil de efeitos adversos e perfil de segurança. Ambos os tratamentos mostraram‐se seguros e a taxa de desistência foi semelhante entre os grupos tratados; no entanto, o pico e a duração das reações cutâneas locais diferiram entre os grupos: com MI, o pico ocorreu em quatro dias, com duração média de 15 dias; com 5‐FU, o pico ocorreu em 29 dias e os sintomas perduraram até o 36° dia.150
O grau de recomendação para o MI é forte para tratamento de campo de cancerização em pacientes imunocompetentes e é menos valioso para pacientes com lesões localizadas.76 Pela falta de estudos, não é possível tecer uma recomendação de seu uso para pacientes imunossuprimidos, embora Muhlstadt tenha descrito um único caso de paciente transplantado renal imunossuprimido com resposta parcial ao MI para tratamento de ceratoses actínicas faciais.151
Terapia fotodinâmicaA TFD consiste em usar um agente fotossensibilizante e uma fonte luminosa de comprimento de onda apropriado para produzir espécies reativas de oxigênio, que irão destruir as lesões‐alvo por meio de uma reação fotoquímica.152,153 Essa reação é conseguida pela aplicação de ácido 5‐aminolevulínico (5‐ALA) ou de metilaminolevulinato (MAL), que são os precursores de metabólitos fotoativos (protoporfirina IX) mais usados; esses metabólitos se acumulam nas células neoplásicas e, ao serem ativados pela luz visível, levam à formação de espécies reativas de oxigênio e singlets de oxigênio.152 Como resultado, essas espécies reativas de oxigênio iniciam uma cascata bioquímica de eventos que induzem a morte da célula‐alvo por apoptose ou necrose e um efeito imunomodulatório.154
A reação fotoquímica para cada agente fotossensibilizante ocorre após irradiação com fonte luminosa de determinado comprimento de onda no espectro da luz visível.155 Existem quatro picos da absorção de porfirinas no espectro da luz visível – o maior deles no espectro da luz azul, a 410nm, com picos menores a 540nm, 580nm e 635nm.156 A luz vermelha (625‐740nm) penetra mais profundamente do que a azul, atinge até 3mm de profundidade e é mais usada para tratamento de lesões espessas. Já o espectro da luz azul (440‐485nm) atinge 1 a 2mm de profundidade e pode ser usado no tratamento de lesões mais superficiais.157 A fonte de luz mais usada é fornecida por aparelhos de light emitting diode (LED), considerados o padrão‐ouro, porém luz intensa pulsada, luz de halogênio ou xenônio, laser de argônio, laser Nd:YAG e laser de corante pulsado também são usados.158 Antes da aplicação do agente fotossensibilizante sobre a área a ser tratada, recomenda‐se curetagem superficial das lesões.156 Alguns métodos podem ser usados para potencializar a permeação do agente fotossensibilizante, como microagulhamento, laser fracionado ablativo e aplicação de calcipotriol.156,159,160 De acordo com revisão da Cochrane para manejo de ceratoses actínicas, a TFD com ALA ou com MAL é efetiva tanto se for usada luz de LED vermelha quanto com LED azul, sem alteração na efetividade.133
No Brasil, o agente fotossensibilizante disponível para TFD é o MAL. No protocolo de TFD convencional, uma camada de 1mm do produto deve ser aplicada na área a ser tratada e ocluída por 3 horas; após esse período, é indicado remover o produto remanescente da superfície cutânea e prossegue‐se à irradiação com a fonte de luz escolhida. Os principais ensaios clínicos randomizados que avaliam a taxa de resposta completa três meses após a TFD com ALA demonstram que 69%‐91% dos pacientes tratados obtiveram eliminação completa das lesões.161 A remissão completa com a técnica que usa MAL em três meses ocorre em 90% dos casos.162 Além disso, resultados cosméticos considerados excelentes são observados em 91% a 98% dos pacientes tratados.163 No seguimento de 12 meses, recorrências são observadas em cerca de um quarto dos pacientes tratados com TFD (24%).164 Isso faz da TFD uma opção com grau de recomendação forte para tratamento das ceratoses actínicas e do campo de cancerização.165,166 Por outro lado, os efeitos colaterais são frequentes. Cerca de 20% dos pacientes queixam‐se de dor considerada forte (graduação da dor acima de 6 em uma escala de 0 a 10) durante a emissão dos LEDs e permanecem com eritema e descamação mais intensos por até 21 dias.167–169 Uma limitação da TFD é seu uso em lesões pigmentadas que diminuem a eficácia da reação fotoquímica, uma vez que o pigmento melânico compete com a protoporfirina IX na absorção pela luz, reduz o efeito fotodinâmico desejado.170
Mais recentemente, a TFD com luz do dia foi descrita como uma técnica que apresenta taxas de resposta similares à TFD convencional, porém com menos efeitos colaterais relacionados à irradiação.171 A técnica consiste em aplicar o creme com MAL e após 30 minutos de incubação, sem oclusão, o paciente é exposto à luz do dia por aproximadamente duas horas, o que possibilita a ativação do MAL pelos comprimentos da luz visível, que variam de 380 a 740nm.172 A TFD com luz do dia tem sua principal recomendação para tratamento de ceratoses actínicas não pigmentadas grau I e II.172 Estudo em amostra de 20 pacientes brasileiros (Fortaleza, CE) com ceratoses actínicas de face e couro cabeludo submetidos à técnica demonstrou excelente tolerabilidade dos pacientes; 80% deles relataram incômodo mínimo durante o período de irradiação.171 Estudos que comparam TFD convencional com TFD com luz do dia demonstraram efetividade e segurança semelhantes das técnicas para tratamento de ceratoses actínicas grau I e II de face e couro cabeludo.173–175 Para tratamento de lesões múltiplas e campo de cancerização, tanto a TFD com ALA quanto com MAL têm grau de recomendação forte. Novamente, a ausência de ensaios clínicos em pacientes imunocomprometidos e o desafio que é tratar ceratoses nesses pacientes conferem um grau de recomendação fraco para essa indicação.76
DiclofenacoO uso de gel de diclofenaco 3%, um anti‐inflamatório não esteroidal, mais ácido hialurônico 2,5%, usado para aprimorar a permeação do diclofenaco na epiderme, para tratamento de ceratoses actínicas, é recomendado com aplicação duas vezes ao dia mínimo de 60 a 90 dias.176 O mecanismo de ação proposto é a inibição da cicloxigenase‐2 (COX‐2), que leva à redução na síntese de prostaglandinas e à inibição da diferenciação celular e da angiogênese, à indução de apoptose e a alterações na proliferação celular.177 O diclofenaco ainda ativa receptores hormonais nucleares envolvidos na diferenciação celular e na apoptose.177 O uso de gel de diclofenaco por 90 dias resulta em resposta completa das lesões em 50% dos pacientes tratados e, se usado por 60 dias, em 33% deles.176 Em relação à eficácia em longo prazo, estudo mais recente encontrou remissão sustentada após um ano em 95% daqueles pacientes inicialmente com resposta completa e em 45% dos imunossuprimidos com resposta completa inicial tratados com 90 dias do gel de diclofenaco.178 Além disso, de acordo com estudo de Segatto et al. que comparou o uso de 5‐FU 5% duas vezes ao dia por quatro semanas e gel de diclofenaco 3% duas vezes ao dia por 12 semanas, embora a redução no número total de ceratoses actínicas tenha sido significativamente maior no grupo que usou o 5‐FU (p < 0,001), houve maior tolerância e menor número de efeitos adversos no grupo do diclofenaco (93,3% para 5‐FU vs. 38,4% para diclofenaco, p = 0,008).179 Uma possível limitação ao tratamento de ceratose actínica com gel de diclofenaco é a adesão ao longo tratamento, que varia de 60 a 90 dias (p = 0,008).76
Assim, o tratamento com gel de diclofenaco pode ser uma opção para pacientes que não toleraram outras modalidades de tratamento tópico para ceratoses actínicas.180,181
Tratamentos ablativo‐cirúrgicosCuretagemA curetagem sob anestesia local para tratamento de ceratose actínica pode ser feita de forma isolada ou em associação com eletrodissecação. Esse processo parece incrementar a resolução de potenciais células displásicas remanescentes e também alcançar hemostasia. Uma opção à eletrodissecação é a crioterapia.130 Como monoterapia, a curetagem tem especial indicação para pacientes com poucas lesões, em especial ceratoses actínicas hiperqueratóticas. É um método frequentemente usado no cenário de pacientes com grande variabilidade clínica de ceratoses como terapia complementar para lesões resistentes à terapia de campo de cancerização, além de permitir envio do material para análise histopatológica.130 Desvantagens em relação ao método incluem necessidade de anestesia injetável da área, tempo de cicatrização, que pode ser prolongado quando forem tratadas lesões nos membros inferiores, e risco de hipercromia ou hipocromia residual na área tratada.76,130 A falta de ensaios clínicos randomizados que avaliem o tema faz com que o grau de recomendação do procedimento seja fraco, apesar de ser amplamente feito na prática diária.76
CrioterapiaÉ um método destrutivo usado para tratamento pontual de ceratose actínica que usa nitrogênio líquido (NL) para executar processo de congelamento e descongelamento tecidual que leva à destruição tecidual.182 É o tratamento de eleição em muitos casos de lesões isoladas e em pequeno número, em que pese a correta análise da área tratada em vistas à identificação de um campo de cancerização. A técnica consiste em aplicar o NL na forma de spray ou em algum objeto que exerça pressão direta na pele, como um cotonete.182 Em sua forma líquida, o NL está em uma temperatura de ‐196°C, permanece em temperatura negativa quando em contato com a pele (idealmente aproximadamente ‐50°C). O congelamento pode atingir até 10mm de profundidade, de acordo com a duração e a distância da aplicação.183
A eficácia da técnica pode variar de 69% de resposta completa das lesões com congelamento superior a 5 segundos até 83% com mais de 20 segundos.184 Alterações histológicas foram observadas em ceratoses actínicas tratadas com crioterapia depois de 10 segundos de duração: houve redução na atipia de queratinócitos, na espessura epidérmica e do estrato córneo e no infiltrado linfocítico.185 Os estudos disponíveis que consideraram o congelamento em ciclo único ou em ciclo duplo compararam a efetividade da crioterapia com TFD; um estudo fez sessões com ciclos únicos (10’) de crioterapia, repetida a cada três meses conforme a necessidade de cada paciente, e atingiu resposta completa em 85% dos casos tratados em 12 meses.166 Outro estudo usou ciclo duplo de crioterapia (tempo de congelamento não informado) em uma única sessão e atingiu resposta completa em 88% dos casos tratados em 24 meses de seguimento.186 Um terceiro estudo comparou TFD com MAL e crioterapia (ciclo duplo) em ceratoses actínicas; aos 12 meses de seguimento, a resposta completa com TFD foi de 89,1% versus 86,1% com crioterapia, sem diferença estatística entre os grupos.187
Efeitos adversos descritos envolvem dor e sensação de queimação durante o procedimento, bem como eritema, edema, vesiculação durante os dias seguintes e hipopigmentação residual.184 Devido à hipopigmentação residual, é importante ter cuidado com o tempo de congelamento, especialmente em pacientes de fototipo alto. Apesar de seu amplo uso na prática dermatológica, na remissão completa sustentada da crioterapia em pacientes com lesões circunstanciais após um ano de acompanhamento, o resultado é inferior (apenas 28%) ao observado com 5‐FU (54%) e imiquimode (73%), justamente pelo fato de alguns pacientes terem sintomas pré‐clínicos nas adjacências das lesões tratadas.133
A crioterapia é uma modalidade terapêutica de baixo custo, fácil acessibilidade e boa adesão ao tratamento por parte do paciente devido ao modo de aplicação em consultório. Além disso, pode ser usada circunstancialmente sobre as lesões associada a tratamentos de campo de cancerização.188,189 Desvantagens incluem o fato de o método isolado não possibilitar tratamento de campo de cancerização e os graus variados de desconforto no momento da aplicação e na recuperação citados. De qualquer modo, o grau de recomendação para tratamento de lesões circunstanciais em pacientes imunocompetentes é forte, enquanto em pacientes imunossuprimidos o efeito é mais limitado.76
Laser de CO2Lasers induzem necrose coagulativa, ablação e hipertermia, o que leva à destruição lesional. Uma passada única do laser de CO2 não fracionado poderia ser usada para remoção de lesões superficiais da epiderme, como ceratoses actínicas. O uso de laser não fracionado de CO2 10.600nm tem comprimento de onda absorvido pela água, resulta em destruição tecidual não específica. Ele pode ser usado para tratamento de campo de cancerização ou para lesões circunstanciais. Nas lesões circunstanciais, os resultados no clareamento completo das lesões nos primeiros meses se assemelham aos obtidos com a crioterapia (72,8% no grupo do laser versus 78% para crioterapia); no entanto, no seguimento em longo prazo as lesões tratadas com laser de CO2 apresentam menores taxas de resposta sustentada – apenas 37% dos pacientes tratados com laser permanecem sem lesões versus 66,8% dos tratados com crioterapia.190 Além disso, como é um procedimento operador dependente, a técnica é influenciada pela experiência e familiaridade do profissional.76 Além disso, há risco de infecção secundária, cicatrizes inestéticas e discromias. Devido ao risco aumentado de infecção em pacientes imunossuprimidos, o uso do laser de CO2 para tratamento de campo de cancerização não é recomendado e deve ser usado apenas para lesões circunstanciais nesses pacientes.76 Não obstante, o uso de laser de CO2 pode ser considerado para ceratoses actínicas, porém o grau de recomendação em pacientes imunocompetentes é fraco.191
PrevençãoRetinoides tópicosUm dos primeiros estudos com retinoides tópicos e ceratoses actínicas data de 1970: uma série de casos de 60 pacientes que relatou benefícios do uso de tretinoína a 0,1%‐0,3% para redução nas contagens de ceratoses actínicas de cerca de 50%.192 Estudos subsequentes demonstraram que a tretinoína em menor concentração (0,05%) não apresentava tanta efetividade, com redução máxima de 45% na contagem de ceratoses actínicas.193,194 Todavia, apesar desses resultados positivos iniciais, estudos mais recentes que avaliam o uso de retinoides tópicos em amostra significativa (> 1.000 indivíduos) não demonstraram eficácia na redução do surgimento de CECs e CBCs em pacientes de risco, sem benefício na redução da contagem de ceratoses actínicas.195,196
Peelings seriadosAlguns estudos descrevem o efeito de peelings seriados com ácido glicólico, ácido tricloroacético (ATA) e ácido salicílico em modelos animais expostos previamente à radiação UV e demonstram redução de p53 mutada e da expressão de mRNA de COX‐2, demonstra‐se a possível função na prevenção tumoral.197–199 Em humanos, há poucos estudos com alto nível de evidência no assunto. Um estudo fez sessão única de peeling de Jessner e ATA 35% e apresentou efetividade semelhante ao uso de 5‐FU duas vezes ao dia por três semanas em estudo split‐face com 15 pacientes com ceratoses actínicas faciais.200 Houve redução de 75% no número total de lesões em ambos os grupos, além de redução semelhante entre as hemifaces na atipia queratinocítica, paraceratose, hiperceratose e inflamação na análise histopatológica.
Mais recentemente, a associação de peeling de ácido glicólico ou Jessner com 5‐FU a 5% em intervalos quinzenais demonstrou efetividade para tratamento de campo de cancerização.201 Trinta e uma pacientes foram submetidas a sessões até remissão lesional completa ou até completar 10 sessões. O tratamento foi efetivo e de boa tolerabilidade e apenas cinco pacientes apresentaram recidivas após 36 meses de seguimento.
Retinoides oraisOs retinoides orais, derivados sintéticos da vitamina A, são usados para quimioprevenção de CPNM em pacientes de alto risco, tanto em pacientes imunocompetentes quanto imunossuprimidos, inclusive ainda pacientes que apresentam genodermatoses, como xeroderma pigmentoso.202–204 As principais medicações descritas nos estudos são acitretina, etretinato e isotretinoína; a acitretina é a que apresenta maior grau de evidência em relação ao seu efeito protetor.205 Diversos mecanismos de ação são propostos para explicar o efeito quimiopreventivo dos retinoides, inclusive imunomodulação, apoptose, promoção da diferenciação celular e inibição da queratinização e proliferação celular.202 O primeiro ensaio clínico randomizado que avaliou 100 pacientes com ceratoses actínicas e o uso de etretinato 5mg três vezes por semana por dois meses observou remissão completa ou parcial das ceratoses actínicas em 84% (37 de 44 pacientes) do grupo tratado versus 5% (2 de 42 pacientes) no grupo placebo.206
Posteriormente, ensaio clínico com 44 transplantados usou acitretina 30mg ao dia por seis meses e observou redução de 13,4% das ceratoses actínicas no grupo tratado versus aumento do número de ceratoses actínicas em 28,2% no placebo.207 Além disso, houve redução no surgimento de novos CECs no grupo tratado com acitretina: apenas 2 dos 19 pacientes do grupo intervenção (11%) desenvolveram CECs versus 9 dos 19 pacientes do grupo placebo (47%) (redução relativa do risco de desenvolver CECs de 78% para pacientes que fazem uso de acitretina).205,207 Smit et al. avaliaram o uso de acitretina 0,4mg/kg/dia em 33 transplantados renais por três meses com exame histológico e imuno‐histoquímico; modificações observadas nas ceratoses actínicas incluíram redução da espessura epidérmica (p < 0,002) e normalização no padrão de queratinização K10 (p < 0,02). No entanto, não houve modificação na proliferação celular, o que poderia explicar a recorrência precoce de ceratoses actínicas após a suspensão da acitretina.208 Dados a respeito da dose ideal e duração do tratamento não são definidos na literatura.203
Nicotinamida oralA nicotinamida, forma amida da vitamina B3, é um cofator para a produção de ATP que impede a depleção de ATP e o bloqueio glicolítico induzido pela radiação UV e, portanto, auxilia no reparo do DNA. Além disso, a nicotinamida reduz a imunossupressão induzida pela radiação UV sem alterar a imunidade basal. Os estudos para prevenção de ceratoses actínicas são poucos e o uso para esse propósito ainda é debatido.
Em estudo que avaliou o uso da nicotinamida como agente quimioprotetor para reduzir o surgimento de novas lesões de CPNM e de ceratoses actínicas em pacientes de alto risco, a medicação foi efetiva quando usada na dose de 1g diário, dividida em duas tomadas. Após 12 meses de seguimento, houve redução de 23% das taxas de surgimento dessas lesões em comparação com o grupo placebo (p = 0,02), com redução tanto de novos CBCs (redução de 20%) quanto de CECs (redução de 30%) e ceratoses actínicas (13%). Esse efeito protetor seria mantido apenas durante o uso da medicação, que apresentou um bom perfil de segurança. No entanto, estudos subsequentes são necessários para confirmar a reprodutibilidade dos efeitos benéficos encontrados, bem como o tempo de tratamento adequado.209
FotoproteçãoIndependentemente do tipo de tratamento, todos os pacientes com ceratose actínica devem ser orientados quanto à fotoproteção física e uso de filtros solares como adjuvante ao tratamento e para prevenir o surgimento de novas lesões.132,210 O uso regular de protetor solar com fator de proteção solar (FPS) acima de 15 reduz o desenvolvimento de novas ceratoses actínicas em pacientes imunocompetentes, varia de uma redução de 50% no número de novas lesões em um ano (estudo usou FPS 29) e de 37% em dois anos (estudo usou FPS 16) (p < 0,05).211,212 Além disso, pacientes que mais se beneficiam com redução da velocidade de desenvolvimento de novas ceratoses actínicas são mais jovens, que não tiveram CPNM prévio e que se bronzeiam após pegar sol (fototipo ≥ III).211 Em relação aos pacientes imunocomprometidos, estudo caso‐controle que seguiu 120 pacientes imunossuprimidos por 24 meses observou que o uso de protetor solar FPS 50 de amplo espectro reduziu de maneira significativa o surgimento de novas lesões no grupo intervenção (p < 0,05).56 O efeito do uso diário de protetor solar na regressão espontânea das ceratoses actínicas também é observado, tanto em pacientes imunocompetentes quanto imunossuprimidos; essa regressão é superior à observada nas lesões dos pacientes que não usam protetor solar.56,210,212,213 Além disso, o uso diário de protetor solar reduz a incidência de novos CECs (p < 0,01).56,213
Mais recentemente, estudos com uso de fotoliase, enzima reparadora do DNA celular com ação fotoprotetora de amplo espectro, ativada quando o indivíduo se expõe à luz visível azul, parecem demonstrar benefício em seu uso nos pacientes com ceratoses actínicas e com campo de cancerização.214,215 Em estudo que avaliou o uso de fotoliase em pacientes submetidos à TFD, nove meses após o procedimento nenhum dos 15 pacientes do grupo que usou fotoliase diariamente necessitou de novo tratamento de campo de cancerização versus 67% (n = 10) dos 15 pacientes no grupo que usou protetor solar regular com FPS 50.215
Considerações finaisCeratoses actínicas representam uma condição cutânea de impacto na qualidade de vida dos pacientes e um importante precursor de neoplasias cutâneas.92 Por esse motivo, o reconhecimento e pronto tratamento são de extrema importância, uma vez que podemos agir e evitar a progressão da lesão. Nesse sentido, aspectos clínicos e de técnicas não invasivas de imagem, especialmente a dermatoscopia, auxiliam nessa tarefa. As opções terapêuticas disponíveis são extensas e a escolha da melhor opção deve ser individualizada dentro do contexto de cada paciente e, sempre que possível, fundamentada por evidência científica.
Suporte financeiroNenhum.
Contribuição dos autoresClarissa Prieto Herman Reinehr: Aprovação da versão final do manuscrito; concepção e planejamento do estudo; composição do manuscrito; revisão crítica da literatura.
Renato Marchiori Bakos: Aprovação da versão final do manuscrito; concepção e planejamento do estudo; participação no design do estudo; revisão crítica do manuscrito.
Conflitos de interesseNenhum.
Questões EMC| 1. Assinale a afirmativa incorreta: |
| a) No Brasil, as ceratoses actínicas representam o quarto diagnóstico dermatológico mais frequente. |
| b) A maior prevalência de ceratoses actínicas no Brasil encontra‐se na Região Sudeste. |
| c) No cenário internacional, as ceratoses actínicas apresentam prevalência mais elevada na Austrália do que na Europa. |
| d) Em pacientes com mais de 65 anos, as ceratoses actínicas representam o principal motivo de consulta dermatológica no Brasil. |
| 2. A respeito do efeito da radiação ultravioleta UVA na carcinogênese, é correto afirmar que: |
| a) É responsável por alterações no gene da telomerase. |
| b) Promove mutações na proteína p53. |
| c) Promove mutações do DNA com substituição de guanina (G) por timina (T). |
| d) Promove erros no reparo de dímeros de ciclobutano pirimidina e na produção de 6‐4 fotoprodutos. |
| 3. Características adicionais consideradas de risco para desenvolvimento de ceratoses actínicas incluem: |
| a) Telangiectasias na face e efélides. |
| b) Elastose solar e cutis rhomboidalis nuchae. |
| c) As opções A e B estão incorretas. |
| d) As opções A e B estão corretas. |
| 4. Em relação à localização preferencial das ceratoses actínicas, assinale a opção correta: |
| a) 75% das lesões localizam‐se nos membros inferiores e na face. |
| b) Localizam‐se em áreas fotoexpostas, como face, couro cabeludo em indivíduos calvos, colo, região cervical, ombros, antebraços e dorso das mãos. |
| c) As opções A e B estão corretas. |
| d) Nenhuma opção está correta. |
| 5. Entre os achados histopatológicos das ceratoses actínicas, pode‐se incluir: |
| a) Sinal da bandeira: alternância de paraceratose e ortoceratose no estrato córneo. |
| b) A paraceratose ocorre sobre a área do acrossiríngeo e do acrotríqueo. |
| c) Não ocorre perda da polaridade dos queratinócitos. |
| d) Uma vez que se trata de lesão pré‐neoplásica, não há atipia de queratinócitos. |
| 6. Em relação ao campo de cancerização, é correto afirmar que: |
| a) O conceito foi suplantado pelo modelo de carcinogênese em múltiplas etapas. |
| b) Ocorre unicamente em pacientes com genodermatoses, como xeroderma pigmentoso e síndrome de Bloom. |
| c) Caracteriza‐se por alterações pré‐neoplásicas do epitélio após longa exposição à radiação UV e é constituído por lesões em diferentes fases. |
| d) Diz respeito a ceratoses actínicas múltiplas, bem delimitadas e de fácil contagem em determinada área corporal. |
| 7. Em relação à dermatoscopia de ceratoses actínicas faciais, é correto afirmar que: |
| a) É método sensível, porém pouco específico para o diagnóstico de ceratose actínica. |
| b) É método com alta sensibilidade e especificidade para o diagnóstico de ceratose actínica. |
| c) O método é pouco usado devido à complexidade de execução. |
| d) É pouco sensível, embora altamente específico para o diagnóstico de ceratose actínica. |
| 8. Sobre a evolução das ceratoses actínicas para CEC, é incorreto afirmar que: |
| a) 60% a 80% dos CECs desenvolvem‐se em áreas de ceratoses actínicas. |
| b) O risco de evolução para CEC é similar em pacientes imunocompetentes e imunocomprometidos. |
| c) O tempo médio de transformação das ceratoses actínicas para lesões invasivas é de 24,6 meses. |
| d) O modelo de carcinogênese em múltiplas etapas é aplicado para explicar a transformação maligna de ceratoses actínicas. |
| 9. A respeito do uso de 5‐FU no tratamento de ceratose actínica, é incorreto: |
| a) Em relação à tolerabilidade, a concentração a 5% foi preferida pelos pacientes nos estudos. |
| b) 5‐FU age por meio da interferência na síntese de DNA por inativação irreversível da timidilato sintetase. |
| c) O grau de recomendação para uso de 5‐FU a 0,5% para tratamento de campo de cancerização em pacientes imunocompetentes é forte. |
| d) O uso de 5‐FU a 0,5% associado a ácido salicílico a 10% aumenta a permeação do 5‐FU. |
| 10. Em relações aos métodos preventivos para ceratoses actínicas e câncer de pele não melanoma, é correto afirmar que: |
| a) Retinoides tópicos são efetivos e seguros para redução do número de novos CECs e CBCs, além de reduzir a contagem de ceratoses actínicas após três meses de uso. |
| b) Dentre os retinoides sistêmicos, a isotretinoína demonstrou maior efetividade na redução do número de novos CECs e CBCs em pacientes de alto risco. |
| c) A nicotinamida oral tem sido descrita como agente promissor em reduzir o surgimento de novas lesões de câncer de pele não melanoma e de ceratoses actínicas em pacientes de alto risco. |
| d) O uso de protetor solar tem benefício unicamente na prevenção de novas ceratoses actínicas. |
Gabarito:
Albinismo: epidemiologia, genética,caracterização cutânea e fatores psicossociais. An Bras Dermatol.2019;94(5):503-520.
Como citar este artigo: Reinehr CPH, Bakos RM. Actinic keratoses: review of clinical, dermoscopic and therapeutic aspects. An Bras Dermatol. 2019;94:637–57.
Trabalho realizado no Departamento de Dermatologia, Hospital de Clínicas de Porto Alegre, Porto Alegre, RS, Brasil.



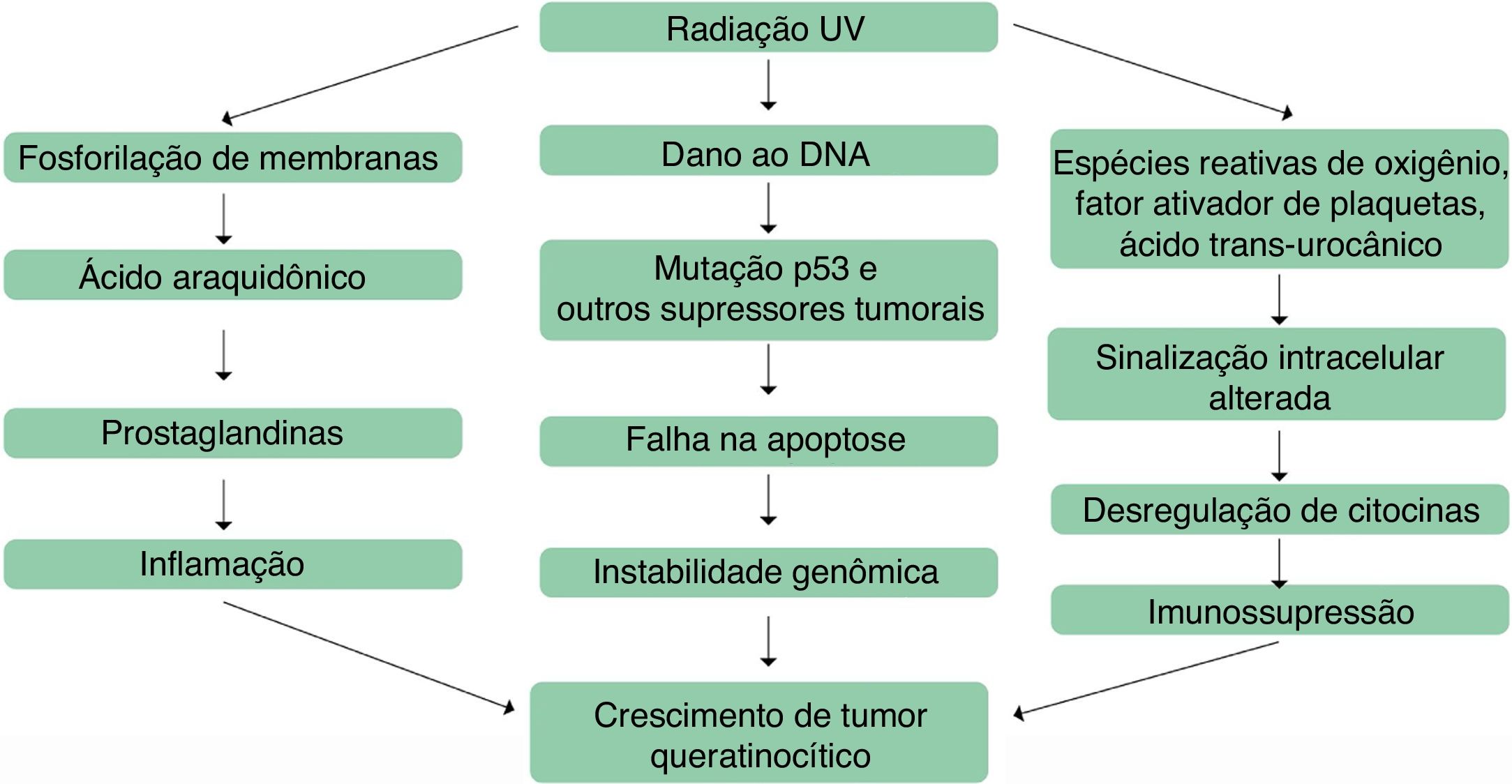
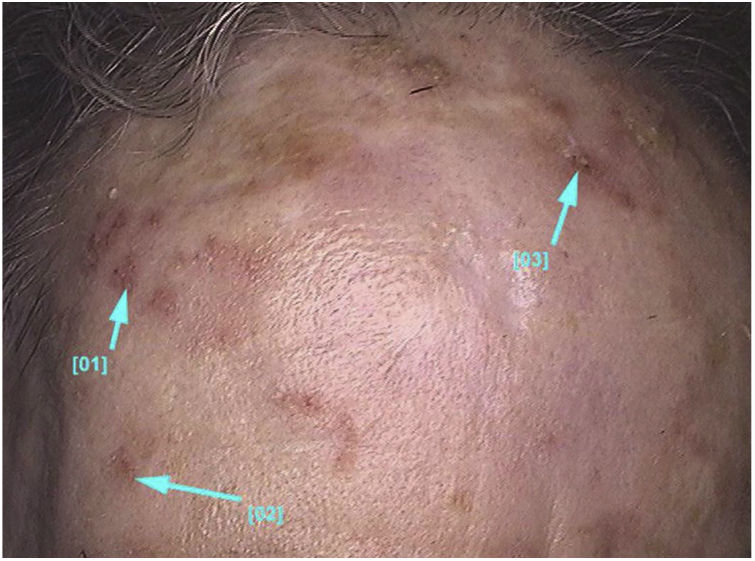
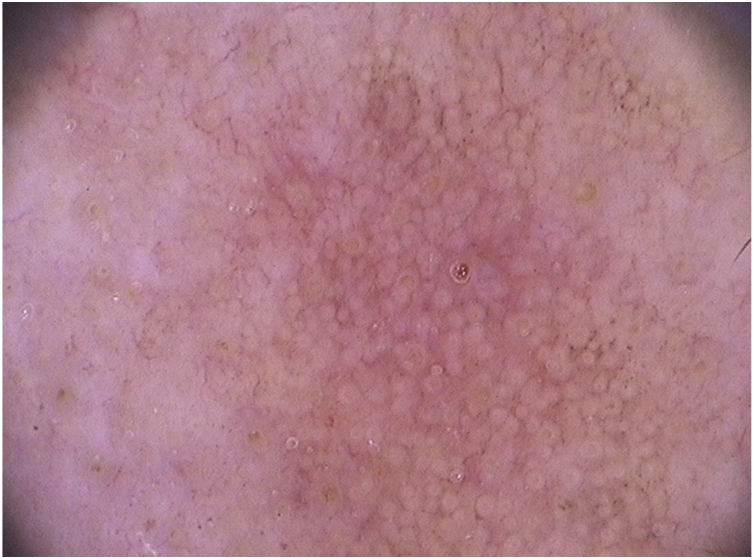
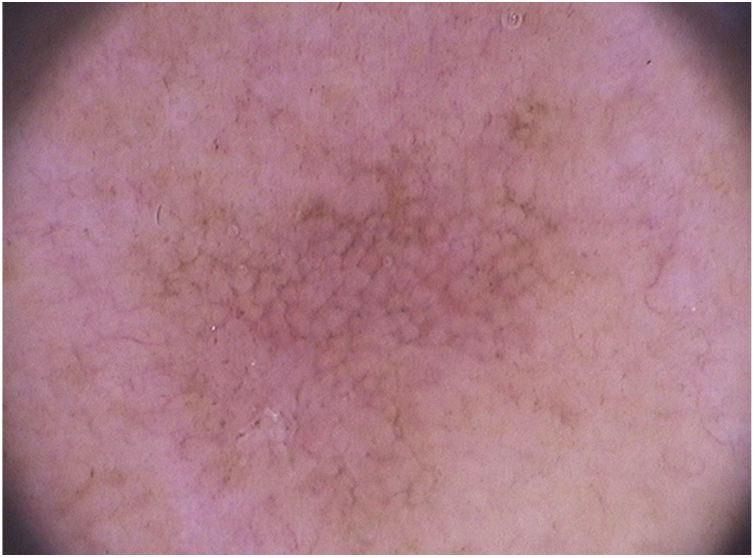
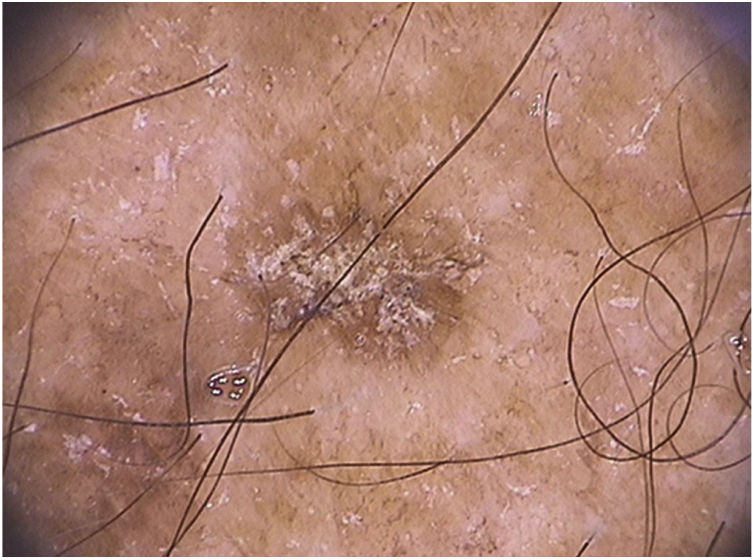

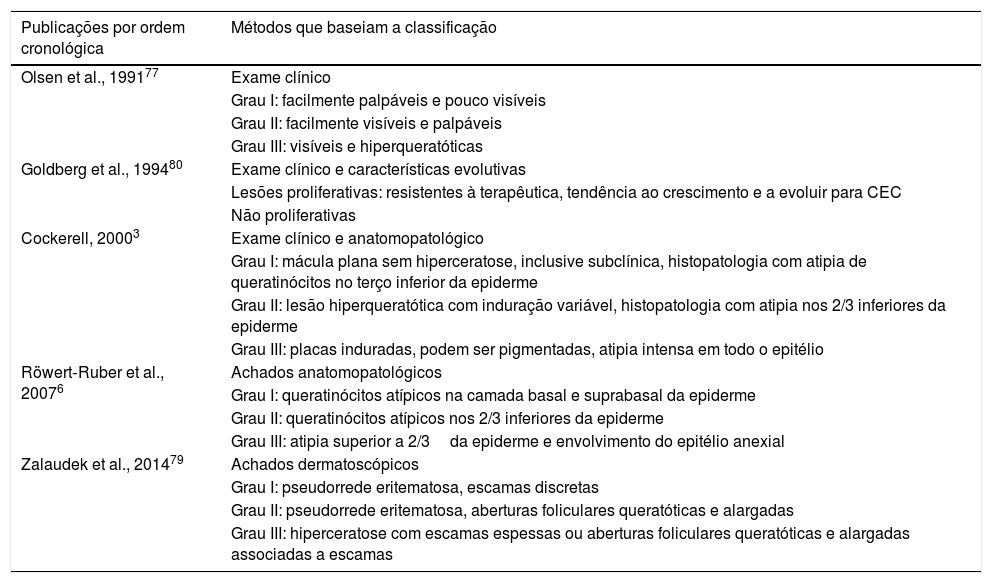

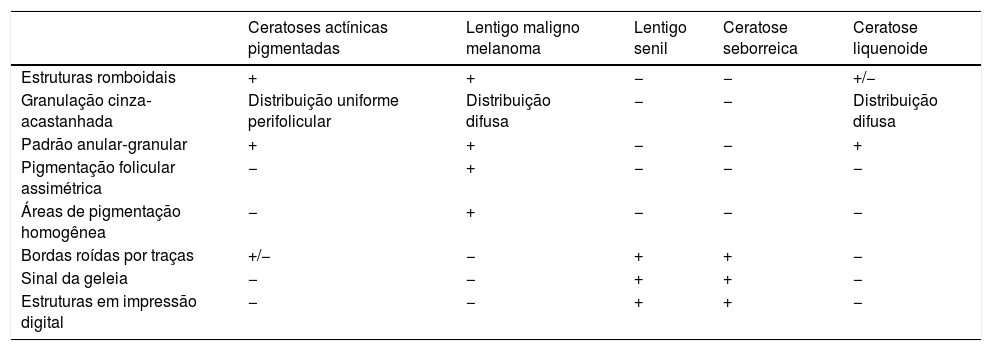
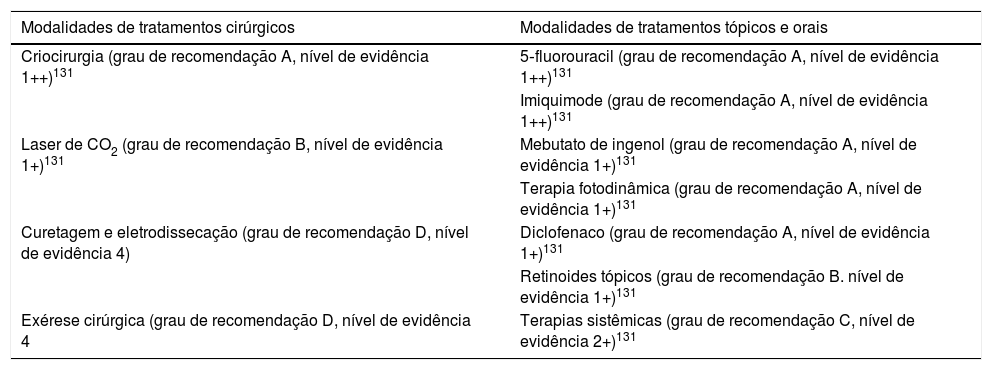

![Mecanismos envolvidos na patogênese das ceratoses actínicas. Adaptado de: Berman B, Cockerell CJ. Pathobiology of actinic keratosis: ultraviolet‐dependent keratinocyte proliferation. J Am Acad Dermatol. 2013;68:S10‐9.[8]. Mecanismos envolvidos na patogênese das ceratoses actínicas. Adaptado de: Berman B, Cockerell CJ. Pathobiology of actinic keratosis: ultraviolet‐dependent keratinocyte proliferation. J Am Acad Dermatol. 2013;68:S10‐9.[8].](https://static.elsevier.es/multimedia/26662752/0000009400000006/v1_202001311238/S2666275219300773/v1_202001311238/pt/main.assets/thumbnail/gr1.jpeg?xkr=ue/ImdikoIMrsJoerZ+w99UWGL/RPJZyNYV9edvxfE4=)