Alopecia areata (AA) é uma doença dos folículos pilosos que causa perda de cabelos sem deixar cicatrizes. A etiopatogenia da AA ainda não foi totalmente compreendida.
ObjetivoDeterminar os níveis séricos de interleucinas (IL‐2, IL‐4, IL‐15 e IL‐17) em pacientes com diagnóstico de AA e investigar a relação dos níveis de IL com a duração e gravidade da AA e a resposta à terapia com tofacitinibe.
MétodosPacientes (≥ 16 anos) com diagnóstico de AA e indivíduos saudáveis como grupo controle foram incluídos. Os níveis séricos basais de IL dos pacientes e controles foram medidos. No grupo de pacientes que recebeu terapia com tofacitinibe, os níveis séricos de IL foram medidos novamente após seis meses. A gravidade da AA foi avaliada utilizando a ferramenta Severity of Alopecia Tool.
ResultadosSessenta e um pacientes com AA e 30 indivíduos saudáveis foram incluídos; eles eram comparáveis em relação à idade e sexo. A duração média da AA foi de 7±6 anos e o escore médio inicial na ferramenta Severity of Alopecia Tool foi de 71±30 (variação, 20‐100). Os níveis basais de IL‐2, IL‐4 e IL‐15 foram significativamente maiores no grupo de pacientes do que no grupo controle (p<0,001 para cada um). Nenhuma correlação significativa foi encontrada entre os níveis basais de IL e a duração ou gravidade da doença (escore basal da ferramenta Severity of Alopecia Tool). Entre os pacientes que receberam tofacitinibe (n=22), os níveis de todas as IL diminuíram significativamente após o tratamento. Entretanto, nenhuma relação significativa entre a mudança nos níveis de IL e a mudança nos escores da Severity of Alopecia Tool foi observada após o tratamento com tofacitinibe.
Limitações do estudoTrata‐se de um estudo monocêntrico, realizado em um único hospital universitário.
ConclusãoOs níveis elevados de IL em pacientes com AA e a diminuição significativa com o tratamento corroboram a ideia de que as IL têm um papel na patogênese. Entretanto, nenhuma relação pode ser demonstrada entre os níveis de IL e a duração ou gravidade da doença.
Alopecia areata (AA) é uma doença que causa queda de cabelos sem deixar cicatrizes. A doença atinge o epitélio dos folículos pilosos do couro cabeludo e outras partes do corpo.1 A prevalência de AA na população em geral é estimada em 0,1%‐0,2% e o risco de desenvolver AA ao longo da vida é estimado em cerca de 1,7%.1 A apresentação clínica da AA pode ser uma ou várias áreas de rarefação de cabelos no couro cabeludo ou, muito mais raro, como calvície completa (alopecia total) ou perda total de pelos corporais (alopecia universal).2 A gravidade da doença é avaliada utilizando os escores da ferramenta Severity of Alopecia Tool (SALT). 3
A etiopatogenia da AA ainda não foi totalmente esclarecida. Em seu estudo, Petukhova et al. mostraram que a base genética tem um papel na patogênese da AA.4 Além do histórico genético, considera‐se que fatores ambientais e imunológicos desempenhem um papel na doença.5,6 Há evidências crescentes de que esta seja uma doença autoimune poligênica. Estudos anteriores demonstraram uma relação entre AA e alelos HLA, alguns alelos DQB e DR e cluster de genes da interleucina (IL)‐1.6
No tratamento da AA grave, a resposta às abordagens tradicionais é limitada e a busca por um tratamento eficaz ainda está em andamento. Tratamentos que têm como alvo diferentes vias do sistema imunológico estão sendo introduzidos como novas opções terapêuticas.7 Relatos de casos, séries de casos e estudos open‐label sobre o uso de tofacitinibe, um inibidor da Janus quinase (JAK) 1 e 3, foram publicados nos últimos anos.8 Estudos anteriores mostraram que as IL, especialmente IL‐2, IL‐4 e IL‐15, podem ter um papel na patogênese da AA. Os estudos atuais também mencionam a IL‐17 como uma potencial citocina pró‐inflamatória com um papel no mecanismo da doença. O tofacitinibe é um inibidor de JAK que interfere com a JAK1 e JAK3. A JAK3 interage com o receptor de citocina, o cyc, utilizado especificamente para alguns receptores de IL, incluindo IL‐2, IL‐4, IL15.9 Além disso, o tofacitinibe inibe as células Th17 que produzem IL‐17.10
O presente estudo teve como objetivo determinar os níveis séricos de IL (IL‐2, IL‐4, IL‐15 e IL‐17), que provavelmente desempenham um papel na patogênese em pacientes com diagnóstico de AA. Em comparação com os estudos anteriores, a relação dos níveis de IL com a duração e a gravidade de AA (escore SALT) e a resposta à terapia com tofacitinibe também foi investigada.
MétodosForam incluídos no estudo pacientes com idade ≥ 16 anos, com diagnóstico clínico de AA entre 09/01/2019 e 06/01/2020 em nossa instituição. Alguns pacientes apresentavam queda de pelos no corpo, além de queda de cabelo no couro cabeludo. Pacientes com doenças críticas agudas ou crônicas que pudessem dificultar o estudo, que estivessem grávidas ou em período de lactação, recebendo quaisquer medicamentos que pudessem interferir nos níveis de IL e aqueles recebendo qualquer tratamento incluindo terapia tópica para AA nos últimos dois meses foram excluídos. As doenças agudas ou crônicas críticas incluem qualquer disfunção orgânica ou presença de infecção que precisa ser tratada ou monitorada. O grupo controle consistiu em indivíduos saudáveis sem qualquer doença aguda ou crônica. Eles estavam dispostos a participar da pesquisa e foram recrutados em domínios públicos. A aprovação do Comitê de Ética (Data e n° IUC 08/08/2019‐121094) e o consentimento informado de todos os participantes foram obtidos antes do estudo.
Os dados demográficos e clínicos dos pacientes foram coletados. Os níveis basais de IL foram medidos no soro dos pacientes e controles. No grupo de pacientes recebendo terapia com tofacitinibe, os níveis séricos de IL foram medidos novamente após seis meses de tratamento. Os pacientes com AA resistentes à terapia tópica iniciaram a terapia com tofacitinibe após terem dado o consentimento informado. Antes de iniciar o tratamento com tofacitinibe, hemograma, testes de função hepática, testes de função renal, níveis de amilase, lipase, sorologia viral, teste de quantiferon e radiografia de tórax foram solicitados para todos os pacientes. Os exames de sangue foram repetidos a cada mês, e os pacientes foram acompanhados em nossa clínica. A dose diária de tofacitinibe foi de 10mg/dia.
A gravidade da AA foi avaliada utilizando a ferramenta SALT. No sistema de escore SALT, o couro cabeludo é dividido em quatro áreas; o vértice corresponde a 40%, o perfil direito corresponde a 18%, o perfil esquerdo corresponde a 18% e a região occipital corresponde a 24% da superfície do couro cabeludo. Após determinar a porcentagem de queda de cabelo nessas quatro regiões, ela é multiplicada pelo valor percentual correspondente à área em questão, e o escore SALT é obtido como a soma dos escores obtidos em cada uma das quatro áreas. Escores mais altos indicam doença grave; a perda total de cabelos no couro cabeludo corresponde a 100 pontos.3
Amostras de sangue periférico obtidas dos pacientes e controles para análise dos níveis séricos de IL foram centrifugadas a 3.000rpm por 10 minutos e, em seguida, o soro foi separado e armazenado a−30°C até o momento da análise. Os níveis séricos de IL‐2, IL‐4, IL‐15 e IL‐17 foram medidos pelo método ELISA. Os valores foram apresentados como ng/L.
Análise estatísticaOs dados foram analisados usando o software SPSS, versão 18.0 (SPSS Inc., Chicago, IL, EUA). A adequação das variáveis à distribuição normal foi analisada por métodos visuais (histograma e gráficos de probabilidade) e analíticos (testes de Kolmogorov‐Smirnov/Shapiro‐Wilk). As estatísticas descritivas foram apresentadas como números e porcentagens para variáveis categóricas e como mediana, percentil 25 (Q1) e percentil 75 (Q3) para as variáveis numéricas. Para as variáveis categóricas, a comparação de grupos pareados foi realizada por meio do teste de Qui‐quadrado. Como a condição de distribuição normal não foi fornecida, o teste U de Mann‐Whitney foi utilizado na comparação de grupos pareados para variáveis numéricas. As análises pré‐pós para cada grupo foram realizadas utilizando o teste de postos sinalizados de Wilcoxon. A relação entre as variáveis numéricas foi analisada pelo teste rho de Spearman. As situações em que o erro do tipo 1 foi inferior a 5% foram interpretadas como estatisticamente significativas.
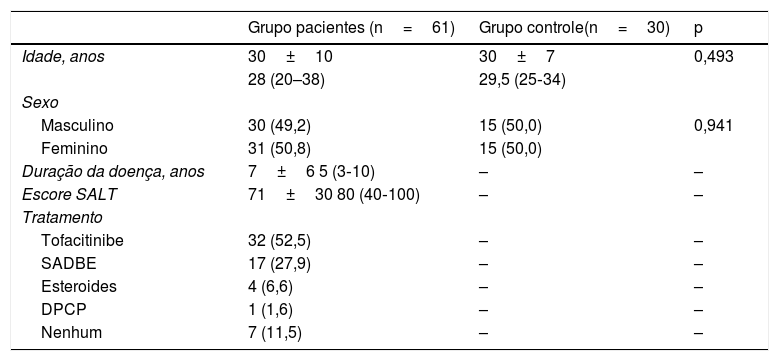
ResultadosO estudo incluiu 61 pacientes com AA e 30 voluntários saudáveis como grupo controle. O grupo de pacientes e o grupo controle eram comparáveis em termos de idade e sexo (tabela 1). A duração média da doença para AA foi de 7±6 anos e o escore SALT basal médio foi 71±30 (variação, 20‐100). O tratamento com tofacitinibe foi usado em 52,5% dos pacientes. No grupo restante, 36,1% dos pacientes iniciaram outros tratamentos, incluindo imunoterapia tópica e tratamento sistêmico com esteroides.
Características gerais dos pacientes com alopecia areata e dos controles
| Grupo pacientes (n=61) | Grupo controle(n=30) | p | |
|---|---|---|---|
| Idade, anos | 30±10 | 30±7 | 0,493 |
| 28 (20–38) | 29,5 (25‐34) | ||
| Sexo | |||
| Masculino | 30 (49,2) | 15 (50,0) | 0,941 |
| Feminino | 31 (50,8) | 15 (50,0) | |
| Duração da doença, anos | 7±6 5 (3‐10) | – | – |
| Escore SALT | 71±30 80 (40‐100) | – | – |
| Tratamento | |||
| Tofacitinibe | 32 (52,5) | – | – |
| SADBE | 17 (27,9) | – | – |
| Esteroides | 4 (6,6) | – | – |
| DPCP | 1 (1,6) | – | – |
| Nenhum | 7 (11,5) | – | – |
Os valores são apresentados como número (%) ou média±desvio‐padrão e mediana (Q1 – Q3). DPCP, difenilciclopropenona; SADBE, éster dibutílico de ácido esquárico; SALT, Severity of Alopecia Tool.
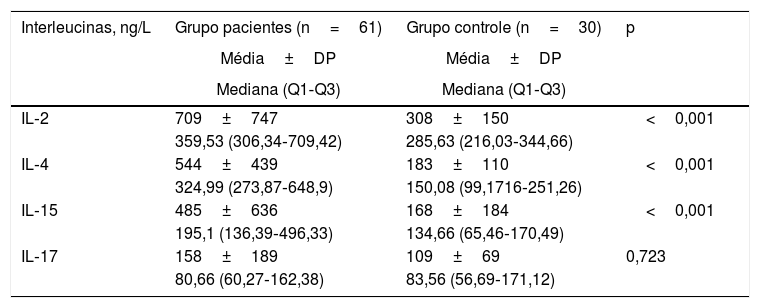
As concentrações séricas de IL dos pacientes e do grupo controle são mostradas na tabela 2. Os níveis basais de IL‐2, IL‐4 e IL‐15 foram significativamente maiores no grupo de pacientes em comparação com os do grupo controle.
Níveis basais de interleucinas dos pacientes e do grupo controle
| Interleucinas, ng/L | Grupo pacientes (n=61) | Grupo controle (n=30) | p |
|---|---|---|---|
| Média±DP | Média±DP | ||
| Mediana (Q1‐Q3) | Mediana (Q1‐Q3) | ||
| IL‐2 | 709±747 | 308±150 | <0,001 |
| 359,53 (306,34‐709,42) | 285,63 (216,03‐344,66) | ||
| IL‐4 | 544±439 | 183±110 | <0,001 |
| 324,99 (273,87‐648,9) | 150,08 (99,1716‐251,26) | ||
| IL‐15 | 485±636 | 168±184 | <0,001 |
| 195,1 (136,39‐496,33) | 134,66 (65,46‐170,49) | ||
| IL‐17 | 158±189 | 109±69 | 0,723 |
| 80,66 (60,27‐162,38) | 83,56 (56,69‐171,12) |
IL, interleucina; DP, desvio‐padrão.
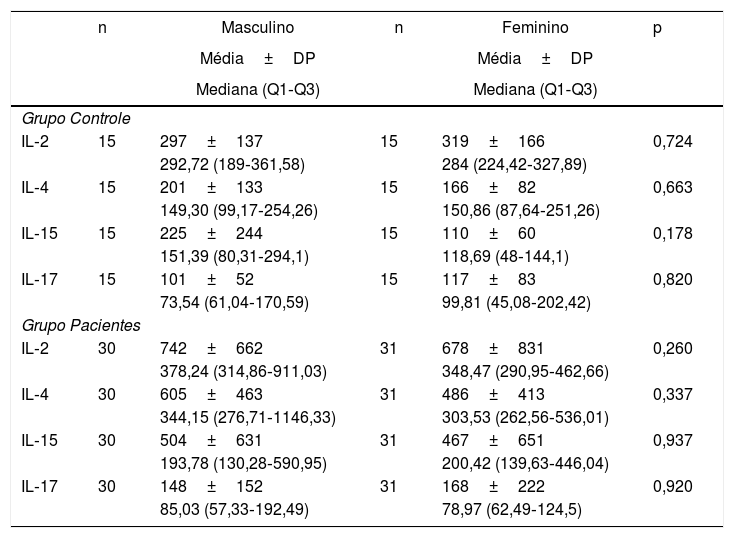
Os níveis de IL foram analisados de acordo com o sexo no grupo de pacientes e no grupo controle. Nenhuma diferença significativa foi determinada entre homens e mulheres em relação aos níveis de IL, tanto no grupo de pacientes quanto no grupo controle (tabela 3).
Níveis de interleucinas de acordo com o sexo
| n | Masculino | n | Feminino | p | |
|---|---|---|---|---|---|
| Média±DP | Média±DP | ||||
| Mediana (Q1‐Q3) | Mediana (Q1‐Q3) | ||||
| Grupo Controle | |||||
| IL‐2 | 15 | 297±137 | 15 | 319±166 | 0,724 |
| 292,72 (189‐361,58) | 284 (224,42‐327,89) | ||||
| IL‐4 | 15 | 201±133 | 15 | 166±82 | 0,663 |
| 149,30 (99,17‐254,26) | 150,86 (87,64‐251,26) | ||||
| IL‐15 | 15 | 225±244 | 15 | 110±60 | 0,178 |
| 151,39 (80,31‐294,1) | 118,69 (48‐144,1) | ||||
| IL‐17 | 15 | 101±52 | 15 | 117±83 | 0,820 |
| 73,54 (61,04‐170,59) | 99,81 (45,08‐202,42) | ||||
| Grupo Pacientes | |||||
| IL‐2 | 30 | 742±662 | 31 | 678±831 | 0,260 |
| 378,24 (314,86‐911,03) | 348,47 (290,95‐462,66) | ||||
| IL‐4 | 30 | 605±463 | 31 | 486±413 | 0,337 |
| 344,15 (276,71‐1146,33) | 303,53 (262,56‐536,01) | ||||
| IL‐15 | 30 | 504±631 | 31 | 467±651 | 0,937 |
| 193,78 (130,28‐590,95) | 200,42 (139,63‐446,04) | ||||
| IL‐17 | 30 | 148±152 | 31 | 168±222 | 0,920 |
| 85,03 (57,33‐192,49) | 78,97 (62,49‐124,5) | ||||
IL, interleucina; DP, desvio‐padrão.
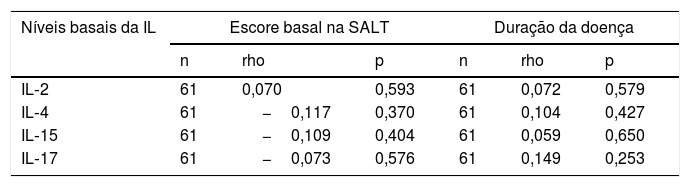
Nenhuma correlação estatisticamente significativa foi encontrada entre os níveis basais de IL e a duração ou gravidade da doença (escore SALT basal, tabela 4).
Correlação entre os níveis basais das interleucinas e a duração e gravidade da doença (escore na ferramenta Severity of Alopecia Tool)
| Níveis basais da IL | Escore basal na SALT | Duração da doença | ||||
|---|---|---|---|---|---|---|
| n | rho | p | n | rho | p | |
| IL‐2 | 61 | 0,070 | 0,593 | 61 | 0,072 | 0,579 |
| IL‐4 | 61 | −0,117 | 0,370 | 61 | 0,104 | 0,427 |
| IL‐15 | 61 | −0,109 | 0,404 | 61 | 0,059 | 0,650 |
| IL‐17 | 61 | −0,073 | 0,576 | 61 | 0,149 | 0,253 |
IL, interleucina; SALT, Severity of Alopecia Tool.
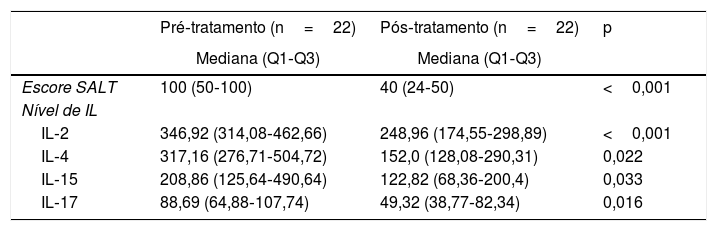
Havia 32 pacientes em tratamento com tofacitinibe. Os níveis de IL pré e pós‐tratamento e os escores SALT foram comparados em 22 desses pacientes, nos quais as medidas foram repetidas no sexto mês. Uma diminuição significativa foi encontrada nos níveis de todas as IL após o tratamento quando comparados àqueles antes do tratamento (basal). Além disso, foi observada uma diminuição significativa na gravidade da doença avaliada pelo escore SALT (tabela 5).
Níveis de interleucina e escore na ferramenta Severity of Alopecia Tool em pacientes recebendo tratamento com tofacitinibe
| Pré‐tratamento (n=22) | Pós‐tratamento (n=22) | p | |
|---|---|---|---|
| Mediana (Q1‐Q3) | Mediana (Q1‐Q3) | ||
| Escore SALT | 100 (50‐100) | 40 (24‐50) | <0,001 |
| Nível de IL | |||
| IL‐2 | 346,92 (314,08‐462,66) | 248,96 (174,55‐298,89) | <0,001 |
| IL‐4 | 317,16 (276,71‐504,72) | 152,0 (128,08‐290,31) | 0,022 |
| IL‐15 | 208,86 (125,64‐490,64) | 122,82 (68,36‐200,4) | 0,033 |
| IL‐17 | 88,69 (64,88‐107,74) | 49,32 (38,77‐82,34) | 0,016 |
IL, interleucina; SALT, Severity of Alopecia Tool.
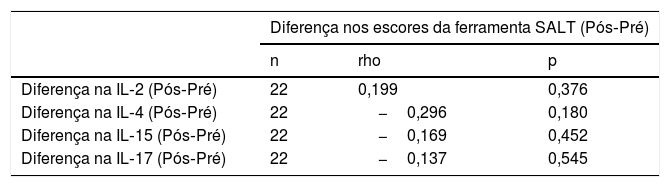
Não houve relação significativa entre a mudança nos níveis de IL e a mudança nos escores SALT após o tratamento em comparação com aqueles observados antes do tratamento nos pacientes que receberam tofacitinibe (tabela 6).
Relação entre a mudança nos níveis das interleucinas e a mudança nos escores na ferramenta SALT em pacientes recebendo tratamento com tofacitinibe
| Diferença nos escores da ferramenta SALT (Pós‐Pré) | |||
|---|---|---|---|
| n | rho | p | |
| Diferença na IL‐2 (Pós‐Pré) | 22 | 0,199 | 0,376 |
| Diferença na IL‐4 (Pós‐Pré) | 22 | −0,296 | 0,180 |
| Diferença na IL‐15 (Pós‐Pré) | 22 | −0,169 | 0,452 |
| Diferença na IL‐17 (Pós‐Pré) | 22 | −0,137 | 0,545 |
IL, interleucina; SALT, Severity of Alopecia Tool.
Dependendo da gravidade da doença, o estado psicossocial dos pacientes com AA é influenciado e sua qualidade de vida é prejudicada.11 A falta de tratamento curativo para esta doença leva à continuação da busca por um tratamento eficaz e de estudos que esclareçam sua patogênese. Acredita‐se que os mecanismos imunológicos estejam envolvidos na patogênese da AA e que várias citocinas, como interferon (IFN), fator de necrose tumoral (TNF) e IL também desempenhem um papel.12,13
Há um número limitado de estudos clínicos que investigam a relação das IL com a gravidade da doença e seu papel na patogênese da AA. No presente estudo, avaliamos os níveis de IL‐2, IL‐4, IL‐15 e IL‐17. Os níveis basais de IL‐2, IL‐4 e IL‐15 foram significativamente maiores no grupo de pacientes do que no grupo controle (p<0,001 para cada uma). Nenhuma correlação significativa foi encontrada entre os níveis basais de IL e a duração ou gravidade da doença. Não houve diferença estatisticamente significativa nos níveis de IL‐17 entre o grupo de pacientes e o grupo controle e nenhuma correlação significativa entre os níveis de IL‐17 e a duração ou gravidade da AA.
A IL‐2 é uma citocina que desempenha um papel na memória imunológica, que tem uma relação comprovada com doenças autoimunes, e o uso de IL‐2 ou de seus receptores na imunoterapia é discutível.14 Kasumagić‐Halilovic et al.15 encontraram níveis mais elevados de IL‐2 em pacientes com AA em comparação com os controles. Nenhuma correlação foi encontrada entre os níveis de IL‐2 e o tipo clínico de AA ou duração da doença. Do mesmo modo, também encontramos níveis mais elevados de IL‐2 em pacientes com AA do que nos controles. Não encontramos correlação significativa entre os níveis de IL‐2 e a duração ou gravidade da AA.
A IL‐4 é uma IL que participa de vários processos fisiológicos e patológicos e desempenha um papel na adesão e inflamação dos tecidos.16 Kalkan et al.17 concluíram que o polimorfismo VNTR da IL‐4 pode ser um fator de risco para o desenvolvimento de AA. No presente estudo, os níveis de IL‐4 foram maiores nos pacientes com AA quando comparados aos controles (p<0,001). Não houve correlação significativa entre os níveis de IL‐4 e a duração ou gravidade da AA.
A IL‐15 é uma citocina multifuncional com relação documentada com doenças autoimunes.18 Ebrahim et al.19 relataram níveis séricos de IL‐15 mais elevados em pacientes com AA em comparação com os controles e uma correlação significativamente positiva entre os escores SALT e os níveis de IL‐15. Eles concluíram que a IL‐15 pode ser um marcador de gravidade da AA. Do mesmo modo, no presente estudo, os níveis de IL‐15 foram maiores nos pacientes com AA em comparação aos controles (p<0,001). Entretanto, nenhuma correlação significativa foi encontrada entre os níveis de IL‐15 e a duração ou gravidade da AA.
A IL‐17 é uma citocina que desempenha um papel crítico na barreira epitelial das partes do corpo que são frequentemente expostas a microrganismos, bem como na imunopatologia, defesa do hospedeiro e inflamação.20 El‐Morsy et al.21 observaram níveis séricos mais elevados de IL‐17A em pacientes com AA em comparação com os controles; entretanto, eles relataram a ausência de uma correlação significativa entre os níveis de IL‐17A e sexo, duração da doença, escore SALT ou gravidade da doença. Com base nesses achados, eles concluíram que a IL‐17A potencialmente desempenha um papel na patogênese, mas não afeta a gravidade da doença. Em outro estudo, não foi encontrada diferença entre os níveis de IL‐17A de pacientes com AA e dos controles; no entanto, os níveis de IL‐17A dos pacientes mostraram uma diminuição significativa após o tratamento com ultravioleta B de banda estreita.22 Loh et al.23 relataram níveis séricos de IL‐17 mais elevados em pacientes com AA em comparação com os controles em seu estudo. Em sua revisão, Ramot et al.24 concluíram que não há uma relação clara entre os níveis de IL‐17 e a gravidade ou duração da doença, apesar dos níveis mais elevados de IL‐17 relatados em pacientes com AA. No presente estudo, embora o nível de IL‐17 tenha sido maior em pacientes com AA do que nos controles, a diferença não foi estatisticamente significativa. Além disso, não houve correlação significativa entre os níveis de IL‐17 e a duração ou gravidade da AA.
A seleção de medicamentos para o tratamento de AA depende de vários fatores, como idade do paciente, extensão/duração da doença, expectativa do paciente, custo do tratamento e presença de comorbidades. Embora ainda não exista tratamento curativo, várias terapias estão sendo implementadas para obter a remissão. Corticosteroides, minoxidil tópico, imunoterapia tópica (DPCP, SADBE), antralina, fototerapia, agentes imunossupressores, análogos de prostaglandinas, agentes biológicos e inibidores de JAK estão entre as terapias que têm sido implementadas atualmente e consideradas benéficas.25 Recentemente, junto com o aumento das informações sobre a patogênese e a introdução do papel da via JAK, o potencial terapêutico dos inibidores de JAK (tofacitinibe, ruxolitinibe e baricitinibe) na AA começou a atrair atenção.26 Os efeitos benéficos do tofacitinibe no tratamento da AA moderada a grave foram relatados em séries de casos e estudos clínicos.27–31 Guo et al.32 realizaram uma revisão sistemática e uma metanálise e relataram que o tofacitinibe é benéfico no tratamento de pacientes com AA e causa apenas eventos adversos leves, e recomendaram a verificação desses dados em futuros ensaios clínicos randomizados de grande escala. No presente estudo, os níveis de interleucina foram reestudados e o escore SALT foi medido novamente no sexto mês de tratamento em 22 dos pacientes com AA que receberam tofacitinibe. Embora a mediana do escore SALT (Q1‐Q3) dos pacientes tenha sido 100 (50‐100) na linha de base, ela apresentou um valor de 40 (24‐50) no sexto mês de terapia com tofacitinibe. Essa diminuição na gravidade da doença foi considerada estatisticamente significativa (p<0,001). Os níveis de interleucina dos pacientes estudados no presente estudo demonstraram redução significativa após terapia com tofacitinibe.
Em conclusão, os níveis elevados de interleucina em pacientes com AA e a diminuição significativa com o tratamento corroboram a ideia de que as IL têm um papel na patogênese. No entanto, nenhuma relação foi demonstrada entre os níveis de IL e a duração ou gravidade da doença. Mais estudos com populações maiores de pacientes são necessários. Compreender o papel das IL na patogênese da AA contribuirá para o desenvolvimento de novas terapias direcionadas.
ConclusãoNíveis elevados de IL em pacientes com AA e a diminuição significativa após o tratamento com tofacitinibe apoiam a ideia de que as IL tenham um papel na patogênese da AA. Mais estudos são necessários para investigar o papel das IL na patogênese da AA.
Suporte financeiroNenhum.
Contribuição dos autoresÖzge aşkın: Aprovação da versão final do manuscrito; revisão crítica da literatura; obtenção, análise e interpretação de dados; participação efetiva na orientação da pesquisa; participação intelectual em conduta propedêutica e/ou terapêutica de casos estudados; revisão crítica do manuscrito; elaboração e redação do manuscrito; análise estatística; concepção e planejamento do estudo.
Sera Nur Yücesoy: Aprovação da versão final do manuscrito; revisão crítica da literatura; obtenção, análise e interpretação de dados; participação efetiva na orientação da pesquisa; participação intelectual em conduta propedêutica e/ou terapêutica de casos estudados; revisão crítica do manuscrito; elaboração e redação do manuscrito.
Erkam Coşkun: Aprovação da versão final do manuscrito; revisão crítica da literatura; obtenção, análise e interpretação de dados; participação efetiva na orientação da pesquisa.
Burhan Engin: Aprovação da versão final do manuscrito; revisão crítica da literatura; obtenção, análise e interpretação de dados; participação efetiva na orientação da pesquisa.
Server Serdaroğlu: Aprovação da versão final do manuscrito; revisão crítica da literatura; obtenção, análise e interpretação de dados; participação efetiva na orientação da pesquisa; participação intelectual em conduta propedêutica e/ou terapêutica de casos estudados; revisão crítica do manuscrito; elaboração e redação do manuscrito.
Conflito de interessesNenhum.
Como citar este artigo: Aşkın Ö, Yücesoy SN, Coşkun E, Engin B, Serdaroğlu S. Evaluation of the level of serum Interleukins (IL‐2, IL‐4, IL‐15 and IL‐17) and its relationship with disease severity in patients with alopecia areata. An Bras Dermatol. 2021;96:551–7.
Trabalho realizado no Istanbul University Cerrahpasa, Istambul, Turquia.