Melasma é discromia crônica adquirida, mais prevalente em mulheres na menacme e caracterizado por hipermelanose cutânea em áreas fotoexpostas, especialmente a face. O melasma pode ser desencadeado por fotoexposição, gestação, alterações hormonais e medicamentos, porém sua patogênese não é completamente compreendida, refletindo‐se na frequente recorrência após o tratamento.1,2
O estresse oxidativo, causado por fatores externos como exposição à radiação solar, distúrbios do sono, poluição, inflamação da pele e estresse emocional, pode induzir e perpetuar a melanogênese, independentemente da irradiação ultravioleta. Ademais, a eumelanogênese é um processo oxidativo intracelular.1 Marcadores séricos de estresse oxidativo são elevados em pacientes com melasma, havendo forte correlação entre níveis de glutationa peroxidase plasmática e sua gravidade.1,3
Nos últimos anos, antioxidantes orais e tópicos mostraram‐se eficazes no tratamento do melasma; entretanto, nenhum ensaio clínico foi conduzido com N‐acetilcisteína, que constitui composto “tiol” e atua como doador de L‐cisteína, levando à reposição e ao aumento dos níveis da glutationa intracelular.2,4–6 O objetivo deste estudo foi avaliar a eficácia do uso da N‐acetilcisteína oral, por oito semanas, no tratamento do melasma facial em mulheres adultas.
Entre abril e julho/2022 foi conduzido ensaio clínico randomizado, paralelo, multicêntrico (Inst1, Inst2, Inst3), duplo‐cego, e controlado com placebo em 50 mulheres. Os critérios de inclusão foram: mulheres entre 18 e 60 anos com melasma facial moderado a grave (mMASI >4), sem tratamento há pelo menos 45 dias, exceto pelo uso de filtro solar. Não foram incluídas portadoras de outras dermatoses faciais concomitantes, dermatoses com fotossensibilidade, história de hipersensibilidade à N‐acetilcisteína, gestantes ou lactantes.
As participantes foram randomizadas (1:1) compondo 25 blocos com duas participantes cada, a partir de simulação computacional (randomização central), e alocadas consecutivamente segundo sequência numérica dos produtos acondicionados em envelopes pardos. O grupo NAC recebeu cápsulas contendo N‐acetilcisteína 600mg, 2×/dia, por oito semanas; o grupo PLAC recebeu cápsulas de placebo, idênticas quanto à cor e formato do ativo. Todas receberam filtro solar de amplo espectro (FPS 60) com cor e foram orientadas para uso cada 3 horas.
As participantes foram avaliadas na inclusão (T0) e após oito semanas (T8). O desfecho primário foi a redução do escore mMASI (modified Melasma Area and Severity Index), aferido por pesquisador “cego” quanto aos grupos. Os desfechos secundários foram: MELASQoL (Melasma Quality of Life Scale), colorimetria (Dif‐L, diferença entre a luminosidade *L entre pele sã e melasma), GAIS (Global Aesthetic Improvement Scale) por avaliação fotográfica cega, e efeitos adversos.
O tamanho da amostra foi calculado para detectar uma diferença> 10% na mudança no escore mMASI entre os grupos no T8, com coeficiente de correlação de 0,75 e desvio padrão de 18%, considerando poder de 80% e nível alfa de 0,05%, resultando em 25 pacientes em cada grupo (n=50). Os dados foram analisados por intenção de tratamento (quanto à aderência), e casos faltantes (dropouts) não foram analisados. As variações dos escores foram comparadas de acordo com os grupos e ajustados pelos valores iniciais usando modelos lineares generalizados com análise robusta. Os escores GAIS foram comparados pelo teste de Mann‐Whitney. Considerou‐se significante p<0,05.7 O estudo foi aprovado no comitê de ética e registrado no REBEC (RBR‐73zrnjh).
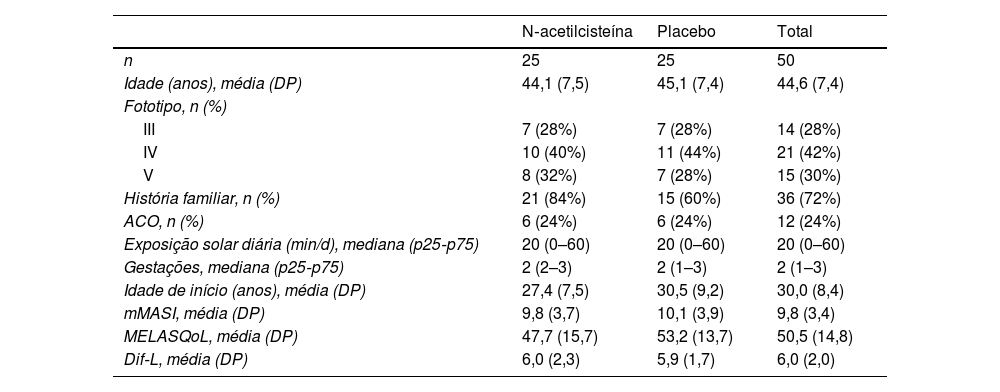
Dentre 64 mulheres elegíveis, 10 não preencheram os critérios de inclusão, e quatro não concordaram em participar do estudo. Das 50 mulheres incluídas, 49 concluíram o estudo, havendo um dropout no grupo PLAC por razão independente do tratamento. Os principais dados clínicos e demográficos da amostra estão dispostos na tabela 1, e não diferiram entre os grupos (p> 0,1).
Principais dados clínicos e demográficos da amostra
| N‐acetilcisteína | Placebo | Total | |
|---|---|---|---|
| n | 25 | 25 | 50 |
| Idade (anos), média (DP) | 44,1 (7,5) | 45,1 (7,4) | 44,6 (7,4) |
| Fototipo, n (%) | |||
| III | 7 (28%) | 7 (28%) | 14 (28%) |
| IV | 10 (40%) | 11 (44%) | 21 (42%) |
| V | 8 (32%) | 7 (28%) | 15 (30%) |
| História familiar, n (%) | 21 (84%) | 15 (60%) | 36 (72%) |
| ACO, n (%) | 6 (24%) | 6 (24%) | 12 (24%) |
| Exposição solar diária (min/d), mediana (p25‐p75) | 20 (0–60) | 20 (0–60) | 20 (0–60) |
| Gestações, mediana (p25‐p75) | 2 (2–3) | 2 (1–3) | 2 (1–3) |
| Idade de início (anos), média (DP) | 27,4 (7,5) | 30,5 (9,2) | 30,0 (8,4) |
| mMASI, média (DP) | 9,8 (3,7) | 10,1 (3,9) | 9,8 (3,4) |
| MELASQoL, média (DP) | 47,7 (15,7) | 53,2 (13,7) | 50,5 (14,8) |
| Dif‐L, média (DP) | 6,0 (2,3) | 5,9 (1,7) | 6,0 (2,0) |
ACO, anticoncepcional oral; Dif‐L, diferença entre a luminosidade (*L) entre pele adjacente e melasma; DP, desvio padrão; mMASI, modified Melasma Area and Severity Index; MELASQoL, Melasma Quality of Life Scale.
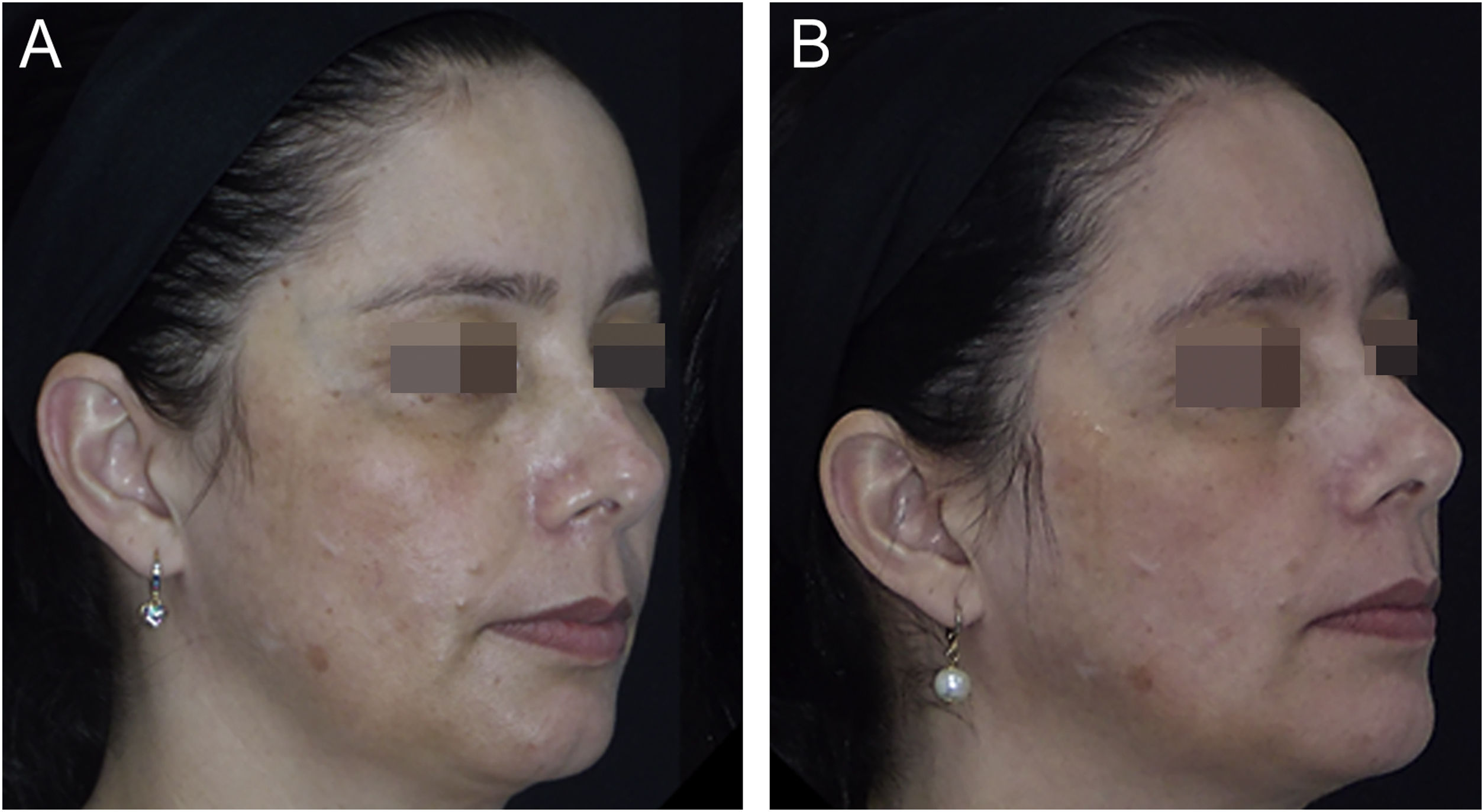
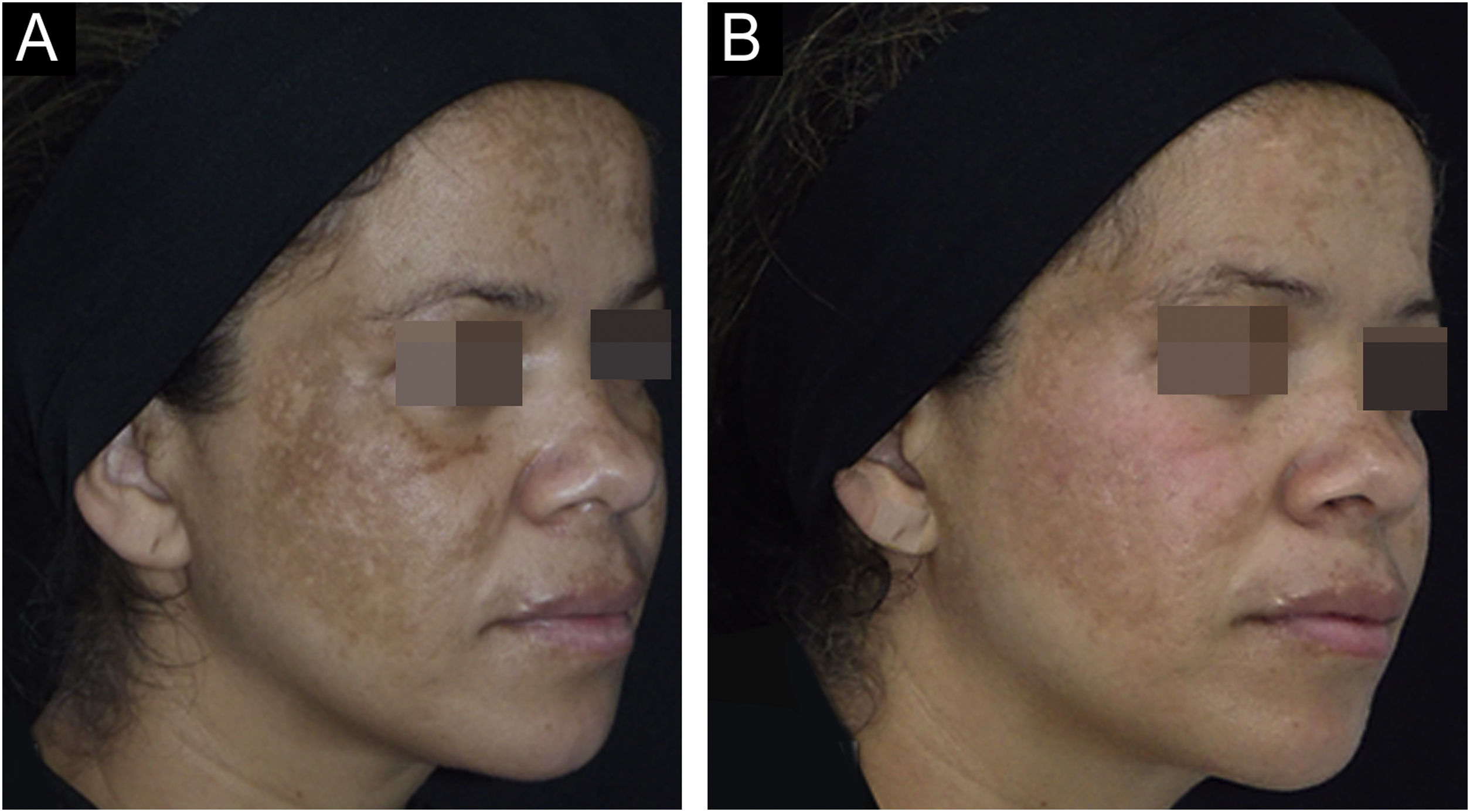
Os desfechos e ilustrações clínicas estão demonstrados nas figuras 1 a 3. Após oito semanas, ambos os grupos reduziram o escore de gravidade (mMASI): houve redução de 12% (95%CI 8%‐19%) no grupo NAC e 12% (95%CI 5%‐21%) no grupo PLAC (p=0,613). MELASQoL e colorimetria reduziram nos participantes de ambos os grupos (p <0,03); entretanto, suas reduções não mostraram diferença entre os grupos (p> 0,7). De acordo com a análise de fotografias, o grupo NAC resultou em 60% (95%CI 40%‐76%) de melhora global (GAIS), contra 29% (95%CI 12%‐44%) do grupo PLAC (p=0,317).
A medicação foi bem tolerada pelas participantes. Apenas oito mulheres do grupo NAC e duas do grupo PLAC relataram pirose ou epigastralgia, sem necessidade de interromper o tratamento; duas mulheres do NAC e três do PLAC referiram sonolência, e uma do NAC relatou sensação de boca seca.
Este ensaio foi o primeiro a avaliar o uso da N‐aceticisteína oral em regime isolado associada a filtro solar de amplo espectro para o tratamento do melasma. Demonstrou‐se que, embora bem tolerada, N‐acetilcisteína oral, no regime testado, não reduziu os escores objetivos e subjetivos avaliados, quando comparado ao desempenho do placebo oral.
N‐acetilcisteína oral é potente antioxidante com potencial de restaurar a glutationa intracelular. Em dermatologia, é empregado principalmente no tratamento de dermatocompulsões, e na pseudoporfiria.8,9 Em ensaio não randomizado com 30 mulheres egípcias, um grupo (n=10) recebeu glutationa oral 500mg/dia, outro utilizou glutationa tópica 2%, e outro utilizou placebo por quatro semanas, sempre associado com filtro solar com FPS 30. Houve superioridade no desempenho dos grupos oral e tópico, sem registros de efeitos adversos. O estudo utilizou uma pequena amostra, não empregou as métricas convencionais (p. ex., mMASI) e foi de curta duração; entretanto, seus resultados reiteram o papel de antioxidantes no tratamento do melasma.10
As possíveis limitações deste estudo incluem a brevidade da intervenção (oito semanas); entretanto, espera‐se que após dois ciclos de renovação do epitélio possa‐se perceber mínima interferência na melanização, como evidenciado em outros ensaios terapêuticos no melasma com ativos orais.6,11,12 Além disso, a inclusão de apenas adultos do sexo feminino, e com melasma moderado a grave (mMASI> 4), reduz a generalização dos resultados. Outros estudos devem ser conduzidos para prospectar substâncias antioxidantes no tratamento do melasma ou na prevenção de sua recorrência.
Em conclusão, apesar de bem tolerado no regime empregado, N‐acetilcisteína oral não foi eficaz no tratamento do melasma.
Suporte financeiroNenhum.
Contribuição dos autoresMelissa de Almeida Corrêa Alfredo: Idealização do estudo, escrita e aprovação do texto final.
Ingrid Rocha Meireles Holanda: Idealização do estudo, escrita e aprovação do texto final.
Daniel Pinho Cassiano: Idealização do estudo, escrita e aprovação do texto final.
Paula Basso Lima: Idealização do estudo, escrita e aprovação do texto final.
Ana Cláudia Cavalcante Espósito: Idealização do estudo, escrita e aprovação do texto final.
Hélio Amante Miot: Idealização do estudo, escrita e aprovação do texto final.
Conflito de interessesNenhum.
Como citar este artigo: Alfredo MAC, Holanda IRM, Cassiano DP, Espósito ACC, Lima PB, Miot HA. Lack of efficacy of oral N‐acetylcysteine in the treatment of facial melasma in women: a randomized, double‐blind, placebo‐controlled clinical trial. An Bras Dermatol. 2024;99:928–31.
Trabalho realizado na Faculdade de Medicina de Botucatu, Universidade Estadual Paulista, Botucatu, SP, Brasil.



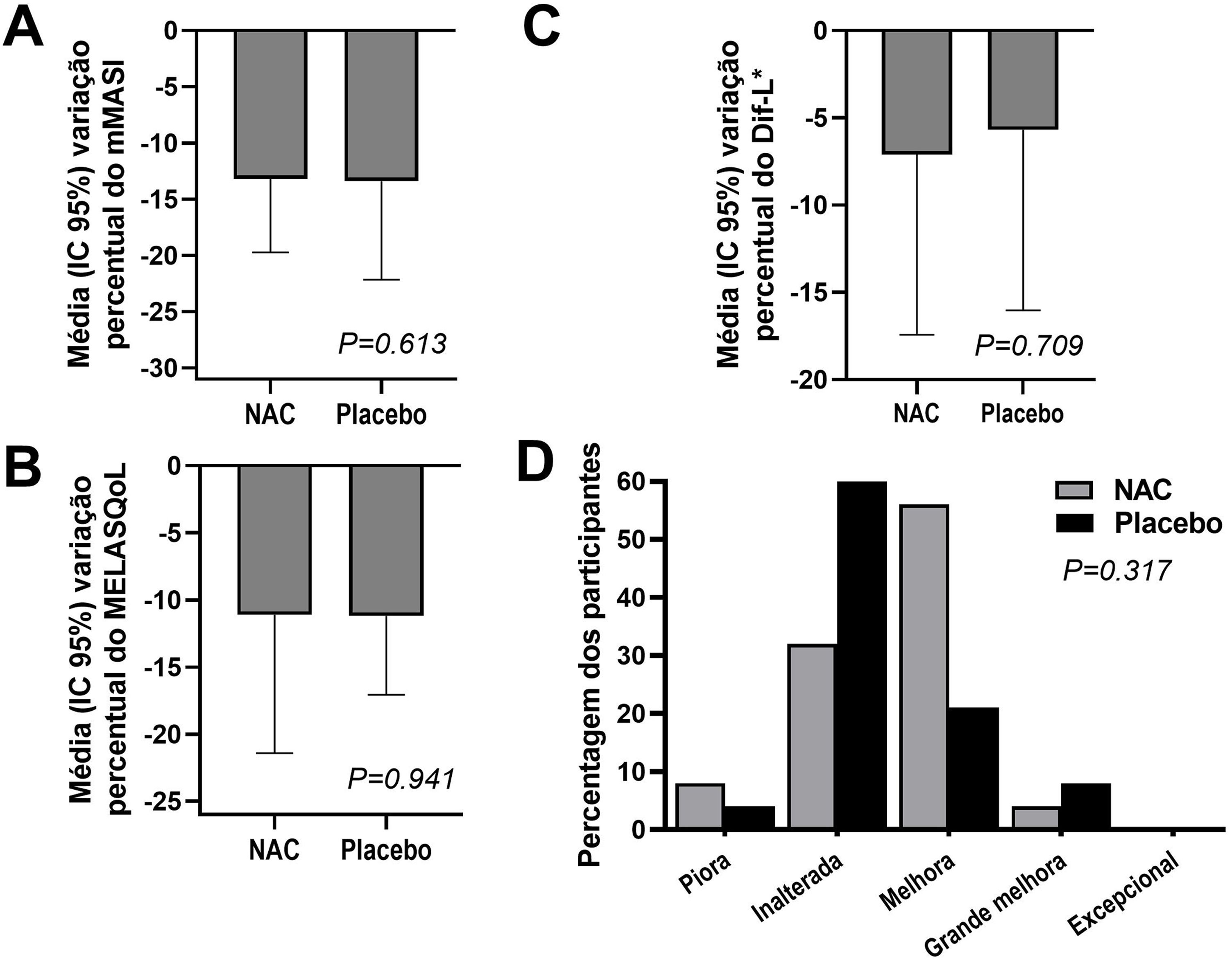
![Gráficos da variação do mMASI (A), MELASQoL (B), colorimetria (Dif‐*L [C]), e avaliação da melhora entre os grupos estudados (GAIS – Global Aesthetic Improvement Scale [D]), no T8. Gráficos da variação do mMASI (A), MELASQoL (B), colorimetria (Dif‐*L [C]), e avaliação da melhora entre os grupos estudados (GAIS – Global Aesthetic Improvement Scale [D]), no T8.](https://static.elsevier.es/multimedia/26662752/0000009900000006/v1_202410301154/S2666275224001838/v1_202410301154/pt/main.assets/thumbnail/gr1.jpeg?xkr=ue/ImdikoIMrsJoerZ+w99UWGL/RPJZyNYV9edvxfE4=)


