Alopecia androgenética feminina ou alopecia de padrão feminino (APF) apresenta alta prevalência e inflige grande impacto na qualidade de vida. Seu tratamento é desafio rotineiro na prática do dermatologista, pois muitas opções terapêuticas apresentam limitado nível de evidência e frequentemente não atingem a expectativa da paciente. A incompreensão da patogênese, do processo de miniaturização dos fios e dos fatores que regulam a morfogênese folicular restringe a prospecção de terapias inovadoras. Há, ainda, carência de estudos randomizados, controlados com seguimento longitudinal, que utilizem desfechos objetivos e que explorem o desempenho dos tratamentos disponíveis e suas combinações. Minoxidil de uso tópico, que é empregado para tratamento da alopecia de padrão feminino desde a década de 1990, é o único medicamento que apresenta alto nível de evidência e continua sendo o de primeira escolha. Porém, cerca de 40% das pacientes não apresentam melhora com esse tratamento. Nesse texto discutimos criticamente as principais alternativas terapêuticas clínicas e cirúrgicas para APF, assim como apresentamos métodos de camuflagem que podem ser utilizados em casos mais extensos ou não responsivos.
Alopecia de padrão feminino (APF), ou alopecia androgenética (AAG) feminina, é caracterizada por miniaturização progressiva dos folículos pilosos e diminuição da densidade capilar principalmente na região centro‐parietal do couro cabeludo.1 Recente estudo epidemiológico realizado em população brasileira evidenciou prevalência geral da APF de 32,3% (95% IC 27,4%‐36,9%) entre mulheres adultas, aumentando com a idade: 8% (20‐29 anos) a 68% (60‐75 anos). A gravidade da APF foi associada ao sedentarismo, hipertensão arterial sistêmica e vida em área urbana.2
A patogênese da APF ainda não foi completamente elucidada, nem são conhecidos os fatores que modulam a morfogênese do folículo miniaturizado.1 Além do papel dos androgênios, mais claramente demonstrado na AAG masculina, há evidências da participação de elementos genéticos, hormonais e ambientais.1,3,4
Para a mulher, a representação do cabelo denso e saudável implica em sentimentos de autoestima, autoconfiança, reflete sua capacidade de mudança, segurança, e implica na interação social. Esses elementos, associados à cronicidade da doença, e sua refratariedade terapêutica, infligem importante impacto negativo na qualidade de vida das mulheres.5
Apesar de inúmeros tratamentos já terem sido propostos para APF, em recente metanálise, apenas o minoxidil tópico acumulou adequado nível de evidência.6 De fato, há carência de estudos randomizados, controlados com seguimento longitudinal e uso de desfechos objetivos que explorem o desempenho dos tratamentos disponíveis e suas combinações.
A comparação entre os estudos é dificultada também pelo uso de diferentes desfechos, tempos de seguimento e a inclusão de diferentes graus de gravidade de APF. Ademais, não é adequada a inferência direta de resultados dos ensaios clínicos de AAG masculina para a APF.
O objetivo deste texto é apresentar e discutir as principais alternativas terapêuticas para APF, assim como apresentar métodos de camuflagem que possam ser utilizados em casos mais extensos ou não responsivos.
Tratamentos clínicosMinoxidil tópicoMinoxidil é um vasodilatador inicialmente utilizado por via oral para tratamento da hipertensão arterial. Ele obteve liberação da Food and Drug Administration (FDA) para essa finalidade em 1979. O minoxidil ativa o canal de ATP modulado por potássio (K+ ATP) causando hiperpolarização, efluxo de íons de K++ e relaxamento da musculatura lisa dos vasos.7
Quando usado para tratamento da hipertensão arterial, cerca de 80% dos pacientes desenvolvem hipertricose. O minoxidil foi descrito como eficaz para melhora da AAG masculina em 1980.8 Após as primeiras observações, passou a ser estudado como solução tópica para tratamento da AAG inicialmente nos homens e, posteriormente, nas mulheres.
O mecanismo de ação do minoxidil no tratamento da AAG ainda não foi completamente elucidado.9 Além de sua ação vasodilatadora, esse medicamento aumenta a proliferação em cultura de células na papila dérmica e pode atuar na expressão gênica e na ativação de vias de sinalização, levando à regulação positiva de genes que codificam proteínas associadas à queratina.10
A maioria dos estudos clínicos com minoxidil tópico em mulheres foi realizada com solução 2% aplicada duas vezes/dia.11 A metanálise desses estudos mostrou uma diferença média de 12,4 fios/cm2 no grupo de minoxidil 2% em comparação com placebo após 24 semanas de tratamento.11 Minoxidil solução 5% duas vezes/dia e minoxidil espuma 5% uma vez/dia não apresentaram diferença significante de resposta quando comparado à solução a 2% aplicada duas vezes/dia.12,13
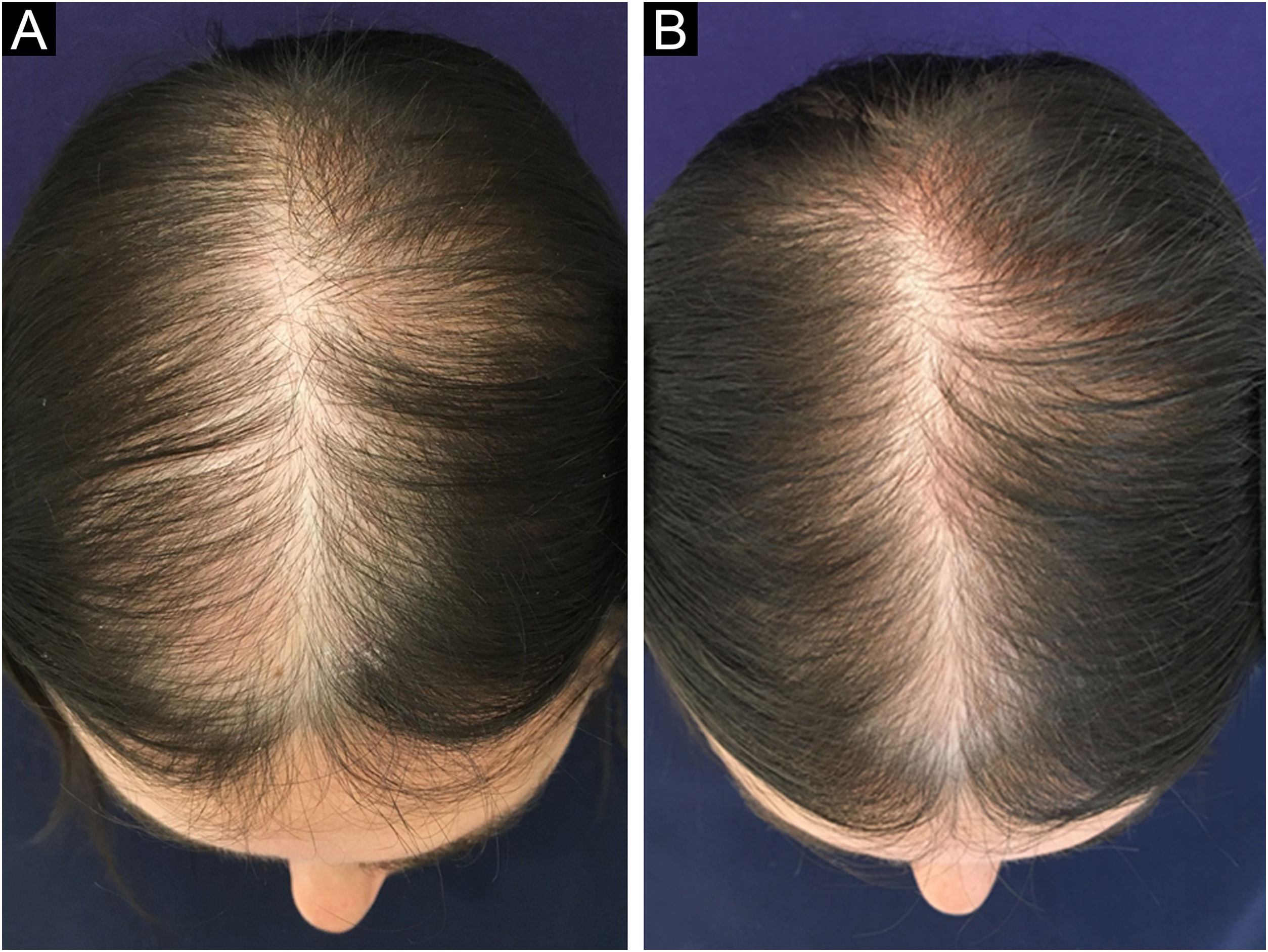
No Brasil, o minoxidil só é comercializado em solução a 5%. Por questões cosméticas e pela praticidade de uso, há preferência no uso do minoxidil 5% uma vez/dia em vez do minoxidil 2% duas vezes/dia para tratamento da APF, apesar de a solução a 5% não ser reconhecida pelos órgãos regulatórios (FDA nos Estados Unidos ou ANVISA no Brasil), para uso no sexo feminino. Em 2014, a FDA aprovou o uso do minoxidil 5% em veículo espuma (foam) para o tratamento da APF (fig. 1).
O minoxidil é um pró‐fármaco. Para exercer seu efeito (tanto vasodilatador quanto de estímulo ao folículo), o minoxidil base precisa ser convertido à forma sulfatada pela enzima minoxidil sulfotransferase.7,14,15 A sulfotransferase está presente em diversos tecidos e apresenta alta expressão no fígado.16 Ela também pode ser encontrada na bainha radicular externa do folículo piloso.14 Existe uma variação interindividual na atividade da sulfotransferase folicular, e foi observado que pacientes com maior atividade enzimática apresentam melhor resposta terapêutica.17
Quando formulado em farmácias de manipulação, muitas vezes o minoxidil sulfato é utilizado no lugar do minoxidil base, em razão de sua maior facilidade de solubilização. Aparentemente, essa opção poderia até ser vantajosa em função da não necessidade de metabolização, porém o sulfato de minoxidil apresenta alto peso molecular e baixa penetração cutânea. Por isso, é importante que, ao optar pela manipulação, o clínico especifique na prescrição que deseja formular o minoxidil base.15
Os efeitos adversos mais comuns do minoxidil tópico são hipertricose na região da face e reações locais no couro cabeludo, como prurido, sensação de queimação, eritema, pápulas ou pústulas. A frequência dessas manifestações depende da concentração de minoxidil e do tipo de veículo, variando de 1,9% a 5,7% em diferentes estudos.9 Apesar de o minoxidil poder causar dermatite de contato, o ativo que mais frequentemente leva a esse quadro é o propilenoglicol, substância frequentemente presente no veículo.18 Nesses casos, haverá resolução dos sintomas com a troca para minoxidil tópico livre de propilenoglicol.
Cerca de 18% dos pacientes em uso de minoxidil tópico apresentam aumento transitório da queda de cabelo nas primeiras semanas de tratamento (shedding). Isso ocorre pelo encurtamento da fase telógena.19 É importante que as pacientes sejam avisadas dessa possibilidade, a fim de evitar a interrupção precoce do tratamento.
A adesão é fundamental para o sucesso do tratamento. Os primeiros resultados são observados após quatro a seis meses e, para que sejam mantidos, o minoxidil deve ser continuado indefinidamente.20,21 Além dos efeitos adversos, a interrupção prematura pode ocorrer pela percepção de resultados insatisfatórios ou por problemas no uso diário do tratamento tópico, como alteração da textura dos cabelos e dificuldade de penteá‐los.
O minoxidil tópico é a terapêutica com maior nível de evidência para tratamento da APF e, apesar de antigo, ainda é o tratamento de primeira linha.
Minoxidil oralApesar de o minoxidil tópico ser eficaz para o tratamento da APF, 30%‐60% das pacientes que o utilizam não apresentam melhora.22 Mesmo para pacientes sem efeitos colaterais, a adesão ao tratamento tópico pode ser problemática. O uso do minoxidil oral para APF visa aumentar a potência e melhorar a adesão ao tratamento por sua maior comodidade em relação à aplicação tópica.
A principal limitação do uso de minoxidil oral para tratamento da APF são seus possíveis efeitos colaterais. Quando utilizado para tratamento da hipertensão arterial, em doses de 10 a 40mg/dia, os principais efeitos adversos são taquicardia, edema e hipertricose.7 Considerando que os efeitos são dose‐dependentes, o uso do minoxidil oral em baixas doses minimiza os efeitos adversos, preservando certa ação estimulatória no folículo piloso.
O primeiro estudo sobre minoxidil oral para tratamento da APF foi uma avaliação prospectiva de 100 pacientes que o usaram na dose de 0,25 mg associado à espironolactona 25 mg/dia, publicado por Sinclair em 2018.23 Nesse estudo, foi observada melhora na escala clínica e de queda.
Estudo iraniano que incluiu 72 pacientes comparou essa mesma dose de 0,25 mg/dia de minoxidil oral contra minoxidil tópico 2% na APF. Houve melhora na densidade capilar e na espessura das hastes nos dois grupos, porém sem diferença entre eles.24
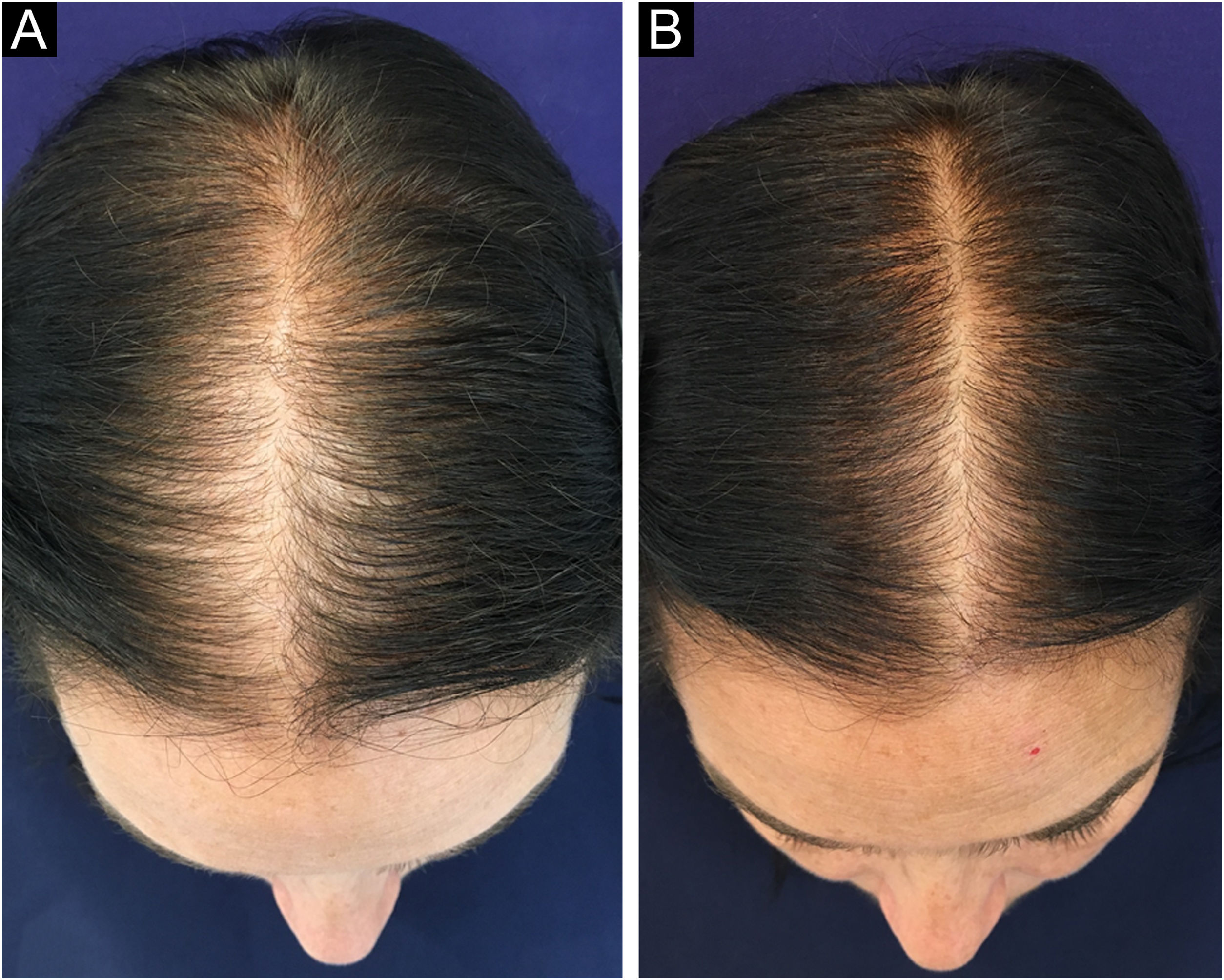
Em 2019, Ramos et al. publicaram um ensaio clínico randomizado aberto comparando minoxidil oral 1mg/dia vs. minoxidil tópico 5%, uma vez/dia em 52 brasileiras com APF. Ambos os grupos apresentaram melhora da densidade capilar e na avalição fotográfica, sem diferença entre eles. Porém, houve tendência de superioridade do grupo oral em relação ao grupo tópico, o que talvez poderia ter sido evidenciado em uma amostragem maior25 (fig. 2).
O efeito clínico do minoxidil oral parece guardar correlação com sua dose. Em um ensaio clínico duplo‐cego randomizado envolvendo 30 pacientes com APF, Silva et al. observaram que o minoxidil oral 1 mg foi superior ao minoxidil oral 0,25 mg/dia.26 No primeiro estudo, as pacientes em uso de minoxidil oral 1 mg apresentaram aumento da densidade capilar de 20,1 fios/cm2, e no segundo estudo, de 27 fios/cm2.25,26
Não há publicações de séries de mulheres com APF utilizando doses diárias maiores que 2 mg de minoxidil oral, apesar dos relatos anedóticos do uso de até 2,5 mg/dia. Também não há dados sobre a associação de minoxidil tópico e oral para o tratamento da APF.27
Recentemente, a via sublingual tem sido proposta como alternativa à via oral visando melhorar a biodisponibilidade do minoxidil para o folículo piloso e minimizar os possíveis efeitos adversos cardiovasculares.28 Ainda não existem estudos comparativos entre as duas vias.
Recente estudo retrospectivo avaliou os efeitos adversos do minoxidil oral em 220 homens e 215 mulheres com AAG.29 Entre as mulheres, os efeitos adversos mais frequentes foram: hipertricose (54%), cefaleia (10%), edema de membros inferiores (9%), tontura (7%), insônia (7%) e palpitação (4%). Quarenta e quatro por cento das pacientes apresentaram aumento temporário da queda de cabelos no início do tratamento. Apesar de frequentes, os efeitos adversos foram leves e bem tolerados. Apenas 13% das pacientes descontinuaram o tratamento.29 Episódios de hipotensão não são frequentes no uso do minoxidil oral para AAG, pois apesar de seu potente efeito anti‐hipertensivo, ele apresenta pouco efeito hipotensor em indivíduos normotensos.30
O uso do minoxidil oral para tratamento da AAG, tanto no homem quanto na mulher, tem se tornado cada vez mais frequente nos últimos anos. Esse rápido crescimento foi alavancado pela facilidade de uso e adesão, assim como pela percepção de bons resultados clínicos. Apesar do rápido crescimento em popularidade, ainda há necessidade de maiores ensaios clínicos comparando diferentes doses e seus resultados frente à terapia tópica tradicional.
Inibidores de 5α‐redutaseA ação da testosterona e, principalmente, da di‐hidrotestosterana (DHT), seu metabólito produzido pela ação da enzima 5α‐redutase (5αR), são cruciais no desenvolvimento e na evolução da AAG no homem.
Apesar de as evidências que mostram a participação dos androgênios na fisiopatologia da AAG terem sido demonstradas de maneira clara apenas nos homens, presumiu‐se seu papel também na mulher.
A eficácia dos inibidores da 5αR (finasterida e dutasterida) no tratamento da AAG masculina corrobora a importância do DHT em sua fisiotagênese. Porém, a finasterida 1 mg/dia (dose padrão para tratamento da AAG masculina) não foi eficiente para tratamento da APF em mulheres menopausadas.31
Em estudo prospectivo não controlado, 37 pacientes fizeram uso de finasterida 2,5mg/dia por 12 meses. Vinte e três pacientes (62%) apresentaram melhora na avaliação fotográfica e 12 (32%) apresentaram melhora no escore de densidade capilar.32
Outro estudo prospectivo não controlado avaliou a finasterida na dose de 5mg em 87 mulheres. Após um ano de tratamento, 81% das pacientes apresentaram melhora na avaliação fotográfica e houve aumento de densidade capilar de 17 fios/cm2.33 Ainda não foram realizados ensaios clínicos randomizados avaliando doses entre 2,5 a 5mg/dia de finasterida na mulher.34
A finasterida é um inibidor da 5αR tipo 2, e na dose de 1 mg/dia leva à redução de cerca de 70% do DHT sérico. A dutasterida inibe a 5αR tipos 1 e 2, e na dose de 0,5 mg/dia reduz o DHT em cerca de 90%. Em decorrência de sua maior potência, a dutasterida pode ser alternativa interessante, porém as evidências que subsidiam seu uso na APF ainda são escassas.34
A menor resposta das mulheres aos inibidores de 5αR provavelmente ocorre em decorrência do envolvimento de mecanismos não hormonais na fisiopatologia da APF que ainda não são totalmente esclarecidos.
Finasterida 1 mg/dia e dutasterida 0,5 mg/dia apresentam indicação de bula no Brasil para tratamento da AAG masculina. Seu uso em mulheres é off‐label e deve ser realizado de maneira criteriosa em mulheres em idade fértil em razão de seu potencial teratogênico (feminilização de feto masculino).34 Não há elementos que indiquem claramente o aumento do risco de câncer de mama em usuárias de inibidores de 5αR; ainda assim, permanece a recomendação de cuidado ao usá‐los em mulheres com alto risco de câncer de mama.
Não existem estudos que avaliem o desempenho da associação de inibidores de 5αR e minoxidil (tópico ou oral) na APF.
Outros fármacos antiandrogênicosOs antagonistas dos receptores androgênicos são frequentemente utilizados no tratamento da APF, principalmente quando a paciente apresenta sinais de hiperandrogenismo. Apesar de seu uso rotineiro, ainda não há evidência de alta qualidade que subsidie o uso desses medicamentos, tampouco se conhece seu desempenho associado ao minoxidil (oral ou tópico).
EspironolactonaDiurético poupador de potássio e antagonista dos receptores da aldosterona e dos receptores nucleares de androgênicos (NR3C4). As doses utilizadas para tratamento da APF variam de 25 a 200 mg/dia. Em estudo prospectivo aberto, 40 mulheres receberam espironolactona 200 mg/dia e 40 mulheres receberam ciproterona 50 mg/dia (ou 100 mg por 10 dias ao mês se pré‐menopausa) por período de 12 meses. Na avaliação fotográfica, 44% das pacientes apresentaram melhora com tratamento e sem diferença entre os grupos.35
Os efeitos colaterais mais frequentes são: sensação de fatiga, mastalgia, irregularidade menstrual e hipotensão. A hipercalemia é uma preocupação em pacientes em uso de espironolactona, porém estudo retrospectivo que avaliou 974 mulheres saudáveis em uso de espironolactona não observou aumento da frequência de hipercalemia nessa população após início do tratamento.36 Revisão sistemática não observou associação da espironolactona com aumento de câncer de mama.37
CiproteronaInibidor da liberação do hormônio liberador de gonadotrofina (GnRH) e antagonista competitivo dos receptores nucleares de androgênicos (NR3C4). Está disponível comercialmente em comprimidos de 50 e 100 mg; além disso, também pode ser encontrado em doses bem menores (2 mg) associado ao etinilestradiol nos anticoncepcionais hormonais combinados orais (AHCO).
A eficácia da ciproterona foi avaliada em estudo randomizado que dividiu 66 mulheres em dois grupos: 1) minoxidil tópico 2% em associação com AHCO (gestodeno 75μg e etinilestradiol 30μg) e 2) ciproterona 50mg/dia por 20 dias (a cada 28 dias) em associação com AHCO (ciproterona 2mg e etinilestradiol 35μg). Após 12 meses de tratamento, o grupo minoxidil foi superior ao grupo da ciproterona (aumento de 6,2 fios/0,36cm2 vs. redução de 2,4 fios/0,36cm2). Porém, a ciproterona foi mais eficaz na presença de sinais clínicos associados com hiperandrogenismo, como acne, irregularidade menstrual e obesidade.38 Os efeitos colaterais mais frequentes da ciproterona são irregularidade menstrual, alteração de libido, mastalgia e ganho ponderal.
FlutamidaFármaco com potente ação antiandrogênica, com indicação de bula para tratamento do câncer de próstata pela inibição dos NR3C4. Por sua alta potência, a flutamida era frequentemente utilizada para tratamento de acne, seborreia, hirsutismos, além da APF. Porém, seu uso com essa finalidade foi proscrito após a descrição de casos de hepatotoxicidade aguda grave.39
BicalutamidaAntiandrogênico também utilizado no tratamento do câncer de próstata pela inibição dos NR3C4, porém apresenta maior meia‐vida e menor risco de hepatotoxicidade quando comparado à flutamida. Recentemente, dois estudos retrospectivos avaliaram o uso da bicalutamida no tratamento da APF.
O maior deles avaliou 316 indivíduos que haviam utilizado a bicalutamida em doses variando entre 10 e 50mg/dia. Duzentos e vinte pacientes (70%) utilizaram a dose de 10 mg. Cento e trinta e oito pacientes que completaram seis meses de tratamento foram avaliadas quanto à eficácia. Houve redução de 20% na escala clínica de Sinclair.40 O segundo estudo avaliou 44 mulheres com APF que utilizaram doses de 25 (15 pacientes) e 50mg (29 pacientes) ao dia. Trinta e duas pacientes foram submetidas à avaliação após seis meses, com redução de 27,5% na escala de Sinclair.41 Em ambos os estudos, os resultados de eficácia são limitados pelo uso concomitante de outros medicamentos para APF pela maioria das pacientes. Os efeitos colaterais mais frequentes foram leve alteração de transaminases, mastalgia, amenorreia e edema periférico.42
Para aumentar a segurança no tratamento, sugere‐se a coleta de exames laboratoriais (hemograma, transaminases, fosfatase alcalina, gama glutamil transferase, bilirrubinas, tempo de protrombina, creatinina, ureia, sódio, potássio e perfil lipídico) antes do tratamento, após 4, 12 e 24 semanas.42
Observou‐se que a associação entre minoxidil oral e bicalutamida (10‐25 mg/dia) reduz a incidência de hipertricose, possibilitando o uso de maiores doses de minoxidil oral.43 Entretanto, isso deve ser confirmado em estudos prospectivos.43
Nenhum dos antiandrogênicos apresentados é seguro na gestação; portanto, é fundamental o uso de contraceptivos de alta eficácia quando utilizados no período pré‐menopausa.
Os anticoncepcionais hormonais orais (ACHO) atuam como bloqueadores hormonais, levando a efeito antiandrogênico, além do aumento dos níveis de SHBG (sexual hormone binding globuline). Esse efeito pode ser maximizado quando a fração estrogênica é associada a progestinas com ação antiandrogênica. Além da ciproterona, outras progestinas como a drospirenona e clormadiona também apresentam essa característica.44 Deve‐se levar em conta as contraindicações para uso de ACHO, como obesidade, risco de trombofilia, câncer de mama, doença hepática e enxaqueca.
AlfaestradiolO alfaestradiol é um esteroisômero do hormônio 17‐beta‐estradiol com baixa afinidade pelos receptores de estrógeno. Seu provável mecanismo de ação no tratamento da AAG seria por inibição local da 5αR. O folículo piloso ainda expressa receptores de estrogênios, que modulam o ciclo, prolongando a fase anágena. No Brasil, o alfaestradiol está disponível para uso tópico em solução a 0,025%.
Não existem evidências robustas do benefício do alfaestradiol para o tratamento da APF. Em estudo comparativo randomizado para tratamento da APF que comparou minoxidil tópico e alfaestradiol 0,025%, não houve melhora do grupo em uso de alfaestradiol após seis meses de tratamento.45
Não se conhece o desempenho do alfaestradiol tópico em associação com minoxidil (oral ou tópico), tampouco com outros antiandrogênicos.
Análogos de prostaglandinasOs análogos de prostaglandinas são importantes moduladores da atividade folicular. Eles estimulam tanto a atividade dos queratinócitos quanto a dos melanócitos, promovendo crescimento e pigmentação capilar.46,47
A latanoprosta, análoga da prostaglandina F2α (PGF2α), é utilizada no tratamento de glaucoma de ângulo aberto como solução oftálmica a 0,005%. Os efeitos colaterais incluem aumento no comprimento, espessura e pigmentação ciliar.46 Em estudo randomizado duplo‐cego incluindo 16 pacientes do sexo masculino com AAG leve, houve aumento significante da densidade capilar (pelos terminais e velus) após oito semanas em uso de latanoprosta tópica a 0,1%, quando comparado ao quadro inicial e grupo placebo, (aumento de 32 fios/cm2 em relação placebo).47
A bimatoprosta é uma prostamida sintética, análoga da PGF2α, originalmente utilizada no tratamento de hipertensão ocular e glaucoma de ângulo aberto. Seu uso tópico diário a 0,03% foi aprovado pela FDA para pacientes com hipotricose ciliar.46
Apesar de sua interessante ação folicular, o uso dos análogos de prostaglandinas ainda é limitado no tratamento da APF por falta de evidências clínicas e alto custo para a aplicação em áreas extensas do couro cabeludo.
NutracêuticosOs micronutrientes podem desempenhar papel importante nas alopecias por atuarem no desenvolvimento do folículo piloso e na função das células imunes.48 Ademais, alterações nutricionais estão associadas ao eflúvio telógeno, que comprometem o resultado do tratamento da APF.
Diversos suplementos vitamínicos e produtos naturais, como saw palmetto, cafeína, melatonina, extratos marinhos, óleo de alecrim, procianidina, óleo da semente de abóbora e óleo de canabidiol, já foram descritos como tratamento da AAG e eflúvio telógeno.48,49
Menores níveis séricos de vitamina D e ferritina foram observados em pacientes com alopecias não cicatriciais em comparação com a população saudável.50,51 Apesar disso, ainda não há evidências de melhora da APF com reposição dessas substâncias. Também não há evidência do benefício da suplementação de biotina e zinco em pacientes saudáveis com APF.49
Apesar de serem extremamente utilizados, tanto por demanda espontânea do paciente quanto por orientação médica, ainda não há estudo clínicos que demonstrem evidência consistente do benefício do uso de nutracêuticos ou suplementações específicas no tratamento da APF.
ProcedimentosMesoterapiaA mesoterapia ou intradermoterapia é uma técnica minimamente invasiva que consiste em infundir uma mistura de ativos farmacêuticos em doses diluídas por via intradérmica.52 Uma vez administradas, as substâncias aparentemente atingem efeito mais intenso e duradouro em virtude de maior biodisponibilidade local, além de potencialmente reduzir efeitos adversos sistêmicos.53
Os ativos entregues por meio de múltiplas injeções diretamente nos locais afetados são moléculas já utilizadas por outras vias de administração, como minoxidil, finasterida, dutasterida, fatores de crescimento, pantenol, biotina e esteroides.52
Uzel et al. realizaram ensaio clínico comparando injeções intradérmicas com solução estéril de minoxidil 0,5% com injeções de solução salina 0,9%. Cinquenta e quatro pacientes foram divididas em dois grupos e receberam aplicações semanais durante 10 semanas. No grupo de tratamento houve aumento da relação entre fios terminais e velos (p<0,001). Entretanto, o aumento de densidade no grupo de tratamento não foi estatisticamente superior ao grupo placebo (p=0,54).54
Um estudo comparativo avaliou 126 mulheres com APF divididas em dois grupos. O primeiro grupo recebeu injeções com dutasterida 0,05% associada a biotina, pantenol e piridoxina, e o segundo, com solução salina. As pacientes receberam 12 injeções num intervalo de 18 semanas. Na avaliação fotográfica, houve melhora em 62,8% das pacientes no grupo de tratamento e 17,5% no grupo controle (p <0,05).55
A frequência semanal e o desconforto das infiltrações podem limitar a adesão de alguns pacientes ao tratamento com a mesoterapia. Uma alternativa seria o uso das injeções intradérmicas de dutasterida trimestralmente, em razão de sua meia‐vida mais longa, mas ainda faltam estudos controlados para avaliar o desempenho desse regime terapêutico.56
As principais críticas feitas em relação à mesoterapia dizem respeito à falta de padronização quanto a forma de aplicação, ativos utilizados e frequência entre as sessões.52 A dor pode ser uma limitação para essa modalidade terapêutica complementar. Para redução da dor em pacientes submetidas à mesoterapia do couro cabeludo, opções não farmacológicas como os dispositivos anestésicos vibratórios foram considerados seguros, eficazes e de simples manejo, fornecendo distração tátil no local da aplicação e, com isso, conforto durante o procedimento.57
Além de dor local pelas punturas e cefaleia de leve intensidade, algumas complicações como edema persistente, infecção microbacteriana, urticária, necrose cutânea, paniculite, acromia e alopecia cicatricial já foram relatadas. Entretanto, acredita‐se que parte desses efeitos adversos estejam mais relacionados à indicação clínica não adequada, cuidado indevido com a assepsia, uso de material não estéril e até mesmo execução do procedimento por profissional não médico, do que com a mesoterapia per se.53
Deve‐se ter particular atenção para o uso de fatores de crescimento sintéticos na mescla da mesoterapia. A literatura que embasa seu uso é muito escassa, e há relato de surgimento de melanoma após injeções de fatores de crescimento como terapêutica para eflúvio telógeno.58 Outra complicação relatada foi edema frontal temporário após mesoterapia para AAG. Os autores correlacionaram o edema frontal ao uso de lidocaína injetável – um dos componentes da fórmula e maiores volumes injetados estão relacionados com esse efeito colateral. Todos os pacientes tiveram desfecho favorável entre um e quatro dias apenas com o uso de compressas geladas.59
A mesoterapia pode ser considerada opção adjuvante para o tratamento de APF, embora mais estudos sejam necessários para padronizar os ativos, suas concentrações, periodicidade das aplicações e número de sessões indicadas. Ainda que minimamente invasiva, é fundamental que seja executada por profissional médico com experiencia clínica e farmacológica, seguindo as normativas de assepsia condizentes com o procedimento, visando evitar complicações anteriormente mencionadas.60
Não se conhece o desempenho dos procedimentos injetáveis em associação com minoxidil (oral ou tópico), tampouco com outros antiandrogênicos no tratamento da APF. Finalmente, além de os ativos não apresentarem aprovação da FDA ou da ANVISA para essa via de administração, eles geralmente são produtos de manipulação, cuja esterilização pode ser questionada.
MicroagulhamentoO microagulhamento é uma técnica minimamente invasiva que consiste no uso de microagulhas estéreis para punturas cutâneas repetitivas que formam microcanais na pele.52,61 O mecanismo de ação proposto para aumentar o crescimento dos cabelos deve‐se à liberação de fatores de crescimento plaquetário (TGF‐α, TGF‐β, fator de crescimento derivado de plaquetas e do endotélio vascular) que posteriormente resultariam em neovascularização, aumento da produção de colágeno e elastina, além de estímulo à expressão de genes relacionados ao crescimento dos cabelos.52,61
Existem vários dispositivos que podem ser utilizados para a realização do procedimento. Os mais tradicionais são rolos, carimbos (stamp) e canetas elétricas contendo agulhas que variam em número e comprimento.61
O microagulhamento é procedimento de baixo custo, rápida execução e com curva de aprendizado simples. Pode ser feito sob anestesia tópica ou bloqueio anestésico, para maior conforto da paciente.52,62,63
Após a anestesia, a área a ser tratada deve ser lavada com soro fisiológico e etanol. A fim de garantir um campo asséptico. A caneta tem velocidade e profundidade de penetração ajustáveis e deve ser movida linearmente, levantando‐se o dispositivo após cada aplicação, em um total de até três passadas por local.
No caso do rolo agulhado (roller), diversas passadas em vários sentidos podem ser feitas até que se atinja um orvalho sangrento sobre uma área de eritema homogêneo no couro cabeludo, apesar de ainda ser controverso o endpoint ideal para o procedimento em questão.62
Apesar de alguns estudos apontarem resultados favoráveis do microagulhamento no tratamento da AAG, a evidência do benefício desse tratamento ainda é de baixa qualidade.61 Em estudo aberto, Starace et al. avaliaram 29 pacientes com APF que apresentaram aumento da densidade de 19,57 fios/cm2 na área frontal após três sessões de microagulhamento com intervalo de quatro semanas.63 Há relatos de dor tolerável e linfadenopatia transitória.
O microagulhamento pode ser opção adjuvante para o tratamento de APFs refratárias ou para pacientes que não desejam fazer o tratamento clínico padrão. Sua real eficácia, assim como a frequência e o comprimento ideal das agulhas, precisam ser estabelecidos por estudos com desenhos específicos. Há controvérsia se a puntura deve ser profunda o suficiente para penetrar a barreira e entregar a medicação ou se superficial o bastante para produzir mínimos danos e pouco desconforto durante o procedimento Agulhas de 0,5 a 2,5mm já foram estudadas, com resultados favoráveis.61,64
Como tratamento adjuvante para APF, o microagulhamento é um procedimento relativamente novo e carece de padronizações sobre melhores dispositivos, frequência de aplicações, endpoint e número de sessões.62 Da mesma maneira, não se sabe se a fibrose decorrente de diversas sessões de microagulhamento pode interferir na dificuldade técnica para a execução de transplantes foliculares, posteriormente.
O emprego tópico de ativos farmacêuticos solúveis estéreis após o microagulhamento com intenção de drug delivery ainda não foi sistematicamente estudado quanto à eficácia adicional; tampouco esses ativos têm autorização dos órgãos regulatórios (FDA e ANVISA) para uso por essa via de administração.
Microinfusão de medicamentos na pele (MMP®)A técnica de microinfusão de medicamentos na pele (MMP®) objetiva promover a infusão de medicamentos (drug delivery) e estímulo com agulhas na epiderme e derme superficial. Para tanto, utiliza máquina para tatuagens e agulhas apropriadas, que atendem a princípios adequados de esterilização do equipamento e descarte de material perfurocortante após o procedimento, podendo ser feito em ambiente ambulatorial.65 As mesclas com os ativos infundidos são estéreis e podem ser os mesmos descritos na seção de mesoterapia.
Mesmo quando a função de infundir medicamentos não é utilizada, por opção do médico, os próprios orifícios produzidos pela máquina já podem induzir efeito semelhante ao do uso de rollers, dependendo do regime de profundidade.65
Um estudo demonstrou que a entrega da medicação com a técnica de MMP® ocorre de maneira uniforme na derme superficial, demandando apenas pequeno volume dos ativos, além de não formar efeito de “massa”, o que reduz a chance de reações adversas locais. Além disso, o fato de o operador poder ajustar a administração do medicamento e a profundidade da infusão também aumenta a segurança dessa técnica.66
A dor, que é um efeito indesejável na técnica de microagulhamento, pode também ocorrer na MMP®.65 A técnica da prega consiste em realizar o pregueamento da pele da área a ser tratada, entre os dedos polegar e indicador da mão não dominante do médico executante. Pode ser útil na diminuição da dor durante o procedimento, em consequência da alteração da percepção dolorosa pelo estímulo tátil e pelo distanciamento das agulhas em relação à gálea, que é ricamente inervada.67 Outros efeitos colaterais mais graves não foram relatados até o momento.65
Embora aparentemente promissora como terapia adjuvante, a literatura sobre o tema ainda é escassa, sobretudo no que se refere à APF. Além disso, algumas recomendações importantes permanecem empíricas, como as indicações precisas da técnica, o número de sessões necessárias para a percepção do início dos resultados, o intervalo ideal entre as sessões e a necessidade de recomendação de aplicações de manutenção. Os ativos farmacêuticos utilizados ainda não têm autorização dos órgãos regulatórios (FDA e ANVISA) para uso por essa via de administração.
Plasma rico em plaquetas (PRP)O PRP é uma técnica que consiste na injeção intradérmica no couro cabeludo de uma preparação autóloga concentrada de plaquetas que liberam diversos fatores de crescimento, como fator de crescimento derivado de plaquetas (PDGF), fator de transformação do crescimento beta (TGF‐β), fator de crescimento endotelial vascular (VEGF), fator de crescimento epidérmico (EGF) e fator de crescimento semelhante à insulina‐1 (IGF‐1). Todos esses fatores de crescimento desempenham papel importante no ciclo capilar, pois estimulam as células‐tronco situadas no bulge, responsável pelo crescimento da unidade folicular.68
Ensaio clínico controlado randomizado em mulheres com APF avaliou o efeito de duas sessões mensais de PRP contra placebo. Esse estudo constatou que, após 24 meses de acompanhamento, houve melhora na avaliação fotográfica em 57% dos pacientes com PRP, contra a melhora de 7% dos pacientes com solução salina.69
Recentemente, uma metanálise abrangendo 15 ensaios clínicos que avaliaram PRP para AAG descreveu um aumento na densidade capilar de 36,8 fios/cm2 (95% IC 22,6‐51,1). Porém, muitos desses estudos são limitados pelo pequeno tamanho amostral e pela falta de cegamento adequado.70
O PRP é um tratamento coadjuvante promissor no manejo da APF; no entanto, ainda não há padronização quanto ao preparo do sangue, regimes de centrifugação, densidade das plaquetas, necessidade de ativação plaquetária e aplicação da técnica.70,71 Em recente revisão, Stevens et al. sugeriram o seguinte protocolo: centrifugação única com enriquecimento de plaquetas de três a seis vezes a concentração média do sangue total, intervalo das sessões proposto de três sessões mensais seguidas de sessões trimestrais em um ano.68
Tanto o PRP quanto o microagulhamento promovem liberação local de fatores de crescimento e traumatismo epidérmico e na derme superior, porém não há estudos comparativos entre os dois métodos de tratamento.
Até a presente data, o uso do PRP para tratamentos dermatológicos no Brasil é vetado pelo Conselho Federal de Medicina.
Toxina botulínicaO estresse oxidativo, a microinflamação perifolicular e a insuficiência microvascular são apontados como fatores associados à AAG.72,73 Goldman et al. observaram que, na AAG, as áreas calvas apresentam níveis mais baixos de oxigênio (O2) do que as áreas não calvas, sugerindo certo grau de insuficiência microvascular.74 Além disso, a conversão de testosterona em DHT ocorre preferencialmente em meio pobre em O2 e, por isso, o aumento do aporte sanguíneo reduziria a hipóxia local e poderia, assim, ser benéfico no tratamento da AAG.75,76
Sabe‐se que a DHT induz a produção do fator de crescimento transformador‐β1 (TGF‐β1) nas células da papila dérmica, tendo ação importante na supressão do crescimento de células epiteliais foliculares. Assim, o TGF‐β1 é um fator pró‐apoptótico com relevante papel no surgimento da AAG, e antagonizá‐lo poderia ser um caminho na prevenção da progressão da doença.77
A toxina botulínica (TB) é uma neurotoxina obtida por meio da bactéria Clostridium botulinum, que inibe a contração muscular via bloqueio da acetilcolina. A justificativa do uso injetável da TB na AAG seria a promoção do relaxamento da musculatura do couro cabeludo, reduzindo a pressão muscular sobre as artérias perfurantes e aumentando potencialmente o fluxo sanguíneo e de O2 para as áreas calvas. Por conseguinte, haveria redução de DHT tecidual pelo efeito conhecido como “washout” e, consequentemente, menor taxa de miniaturização folicular, considerada a principal base fisiopatogênica da doença.75 Como mecanismo adicional, recentemente, Shon et al. sugeriram que a injeção intradérmica de TB pode ser uma possível opção de tratamento para AAG, já que inibe a secreção de TGF‐β1 dos folículos capilares, contribuindo assim para os efeitos mencionados.77
Estudo prospectivo avaliou 37 homens em uso de finastererida e minoxidil para AAG que foram submetidos à aplicação de TB em metade do couro cabeludo; na outra metade foi injetada solução salina. Após seis meses, houve maior aumento da densidade de fios 47,43 (± 25,72) na área tratada com TB em comparação ao lado controle 21,68 (± 11,09) (p <0,05).78 Apesar da sugestão da aplicação de uma unidade intradérmica com distância de 1 cm entre elas, ainda não existe consenso sobre a forma de aplicação e intervalos.
A proposta do uso da TB para tratamento da AAG é recente, promissora e apresenta bom perfil de segurança. Entretanto, estudos sistemáticos são necessários para comprovar sua eficácia tanto em homens quanto em mulheres.76
FotobiomodulaçãoFotobiomodulação ou terapia com laser de baixa potência (LLLT; do inglês, low level laser therapy) é uma modalidade de tratamento utilizada para pacientes portadores de alopecias, aprovada pela FDA em 2009.79
Os dispositivos de terapia de fotobiomodulação normalmente contêm laser de diodo ou diodos emissores de luz (LEDs) que emitem luz continuamente (onda contínua) ou em pulsos curtos e rápidos (emissão pulsada). Enquanto os lasers produzem luz coerente e monocromática com área de irradiação mais focada, os LEDs produzem luz incoerente com espectro de emissão mais amplo e maior campo de irradiação. A luz laser coerente foi historicamente considerada mais eficaz do que a luz LED, mas ainda permanece controverso se uma fonte de luz realmente oferece benefícios clínicos sobre a outra.80
O exato mecanismo de ação da fotobiomodulação no tratamento da AAG ainda é desconhecido. Sugere‐se que o LLLT promova a mitose de queratinócitos e fibroblastos por meio do estímulo de citocinas anti‐inflamatórias e antioxidantes, além do efeito vasodilatador perifolicular.79 Os estudos para ambos os sexos mostraram que o LLLT seria uma terapia bem tolerada e sem efeitos adversos relatados. Do ponto de vista de eficácia, na maior parte das vezes, os resultados em AAG apontam para aumento quantitativo da densidade capilar e redução da queda de cabelos em relação ao grupo placebo.79
Existem diversos dispositivos para uso domiciliar em formato de bonés, capacetes, tiaras e pentes. Cada um tem uma quantidade diferente de pontos de laser e alguns vêm associados a LED; é inadequada a inferência dos resultados entre um aparelho e outro.
O número de aplicações semanais e o tempo de duração de cada aplicação varia de acordo o aparelho. Os resultados clínicos, conforme os estudos, iniciam em torno de quatro meses após o início do tratamento.79
Em relação à energia fornecida pelos dispositivos, os estudos de revisão mostram variação entre 630 e 808 nanômetros. Do ponto de vista biomolecular, o LLLT revelou aumento das principais proteínas da matriz extracelular, o que corrobora com a percepção clínica de aumento do diâmetro capilar em usuários portadores de AAG. Um dado interessante é que o regime de tratamento de baixa frequência (menos de 60 minutos/semana) parece ser mais eficaz do que a alta frequência (mais de 60 minutos/semana).81
LLLT é opção como tratamento adjuvante para APF ou como alternativa para aqueles que não desejam submeter‐se aos tratamentos clínicos ou cirúrgicos. Não há evidências que suportem o uso de LLLT pontualmente antes de procedimentos capilares minimamente invasivos como mesoterapia, microagulhamento e MMP®.81
Cirurgia de restauração capilar (transplante de cabelo)Apesar das diversas opções de tratamento, muitas pacientes não atingem o resultado desejado, seja por baixa resposta à terapêutica ou por condição clínica inicialmente avançada. Nesses casos, a restauração cirúrgica pode aumentar o volume capilar em determinada área mediante a distribuição de unidades foliculares obtidas de outra região da própria paciente.82
A cirurgia de restauração capilar na APF é indicação de exceção, devendo ser realizada em condições muito específicas. Ela não deve ser considerada procedimento isolado, muito menos ser promovida como cura da APF. A manutenção do tratamento clínico é fundamental para evitar a expansão da perda capilar para outras áreas.
Na consulta inicial da paciente com APF, cabe ao cirurgião de restauração capilar fazer minuciosa história clínica e exame acurado de todo o couro cabeludo. Além das áreas mais afetadas pela APF, a avaliação da área doadora é fundamental para verificar a quantidade de unidades foliculares (UFs) que poderão ser retiradas. É importante que sejam excluídos outros tipos de alopecias não são passíveis de tratamento cirúrgico, como alopecia areata, eflúvio telógeno crônico e alopecias cicatriciais em atividade.
É preciso, ainda, ouvir a queixa da paciente e compreender suas expectativas. Muitas vezes, a paciente expressa o desejo de cobrir mais área do que é possível; então, devemos orientá‐la que a parte anterior do couro cabeludo (frontal e central) devem ser prioritariamente preenchidas, por serem as regiões mais visíveis. Caso ocorra comprometimento da linha anterior, ela deve ser criada de maneira irregular e com as UFs mais delicadas para não denunciar tratar‐se de linha artificialmente construída. Os recessos frontotemporais (entradas) também costumam ser queixa frequente, e o especialista deve desenhar uma linha condizente com o traçado feminino.
O objetivo final da restauração capilar em pacientes com APF é atingir boa densidade na área receptora. Para isso, ou se tem uma grande reserva de UFs ou se deve limitar a área a ser transplantada. Na maioria dos casos, ao examinar a área doadora, percebe‐se que não existe grande densidade ou os cabelos são igualmente finos em comparação às regiões afetadas pela miniaturização. Nessa situação, não se deve propor o tratamento cirúrgico. São casos com boa indicação quando existe, na região posterior do couro cabeludo, uma quantidade grande de folículos e fios mais espessos do que na área a ser coberta.
Quando bem indicado, o especialista pode assegurar à paciente que o resultado do procedimento na maioria das vezes será natural e com boa densidade. As UFs serão transplantadas de maneira individual, dentro de orifícios mínimos, sem criar cicatrizes visíveis e sem o aspecto dos tufos que antigamente eram popularmente chamados de “cabelo de boneca”. Existem duas abordagens a ser discutidas com a paciente quanto à retirada das UFs da área doadora, e essas técnicas são comumente referidas por seus acrônimos.
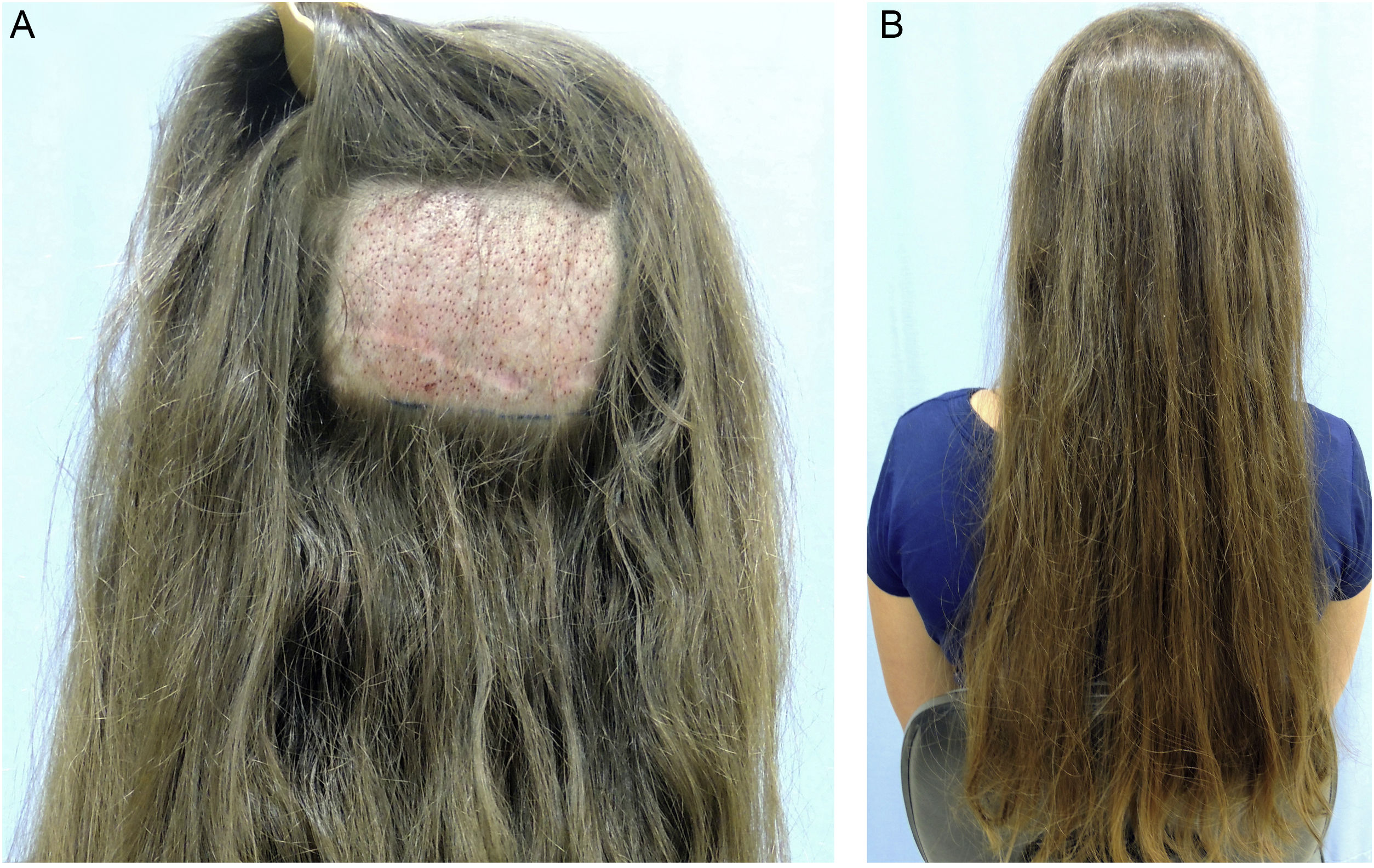
A folicular unit transplantation (FUT) refere‐se à retirada de um fuso de pele do couro cabeludo que, consequentemente, deixará uma única cicatriz horizontal na área doadora (fig. 3). Esse fuso de pele deverá ser submetido à dissecção microscópica pela equipe para produzir as UFs. É importante avaliar a elasticidade do couro cabeludo, uma vez que a largura do fuso não deve ultrapassar a possibilidade de uma aproximação das bordas sem excessiva tensão.
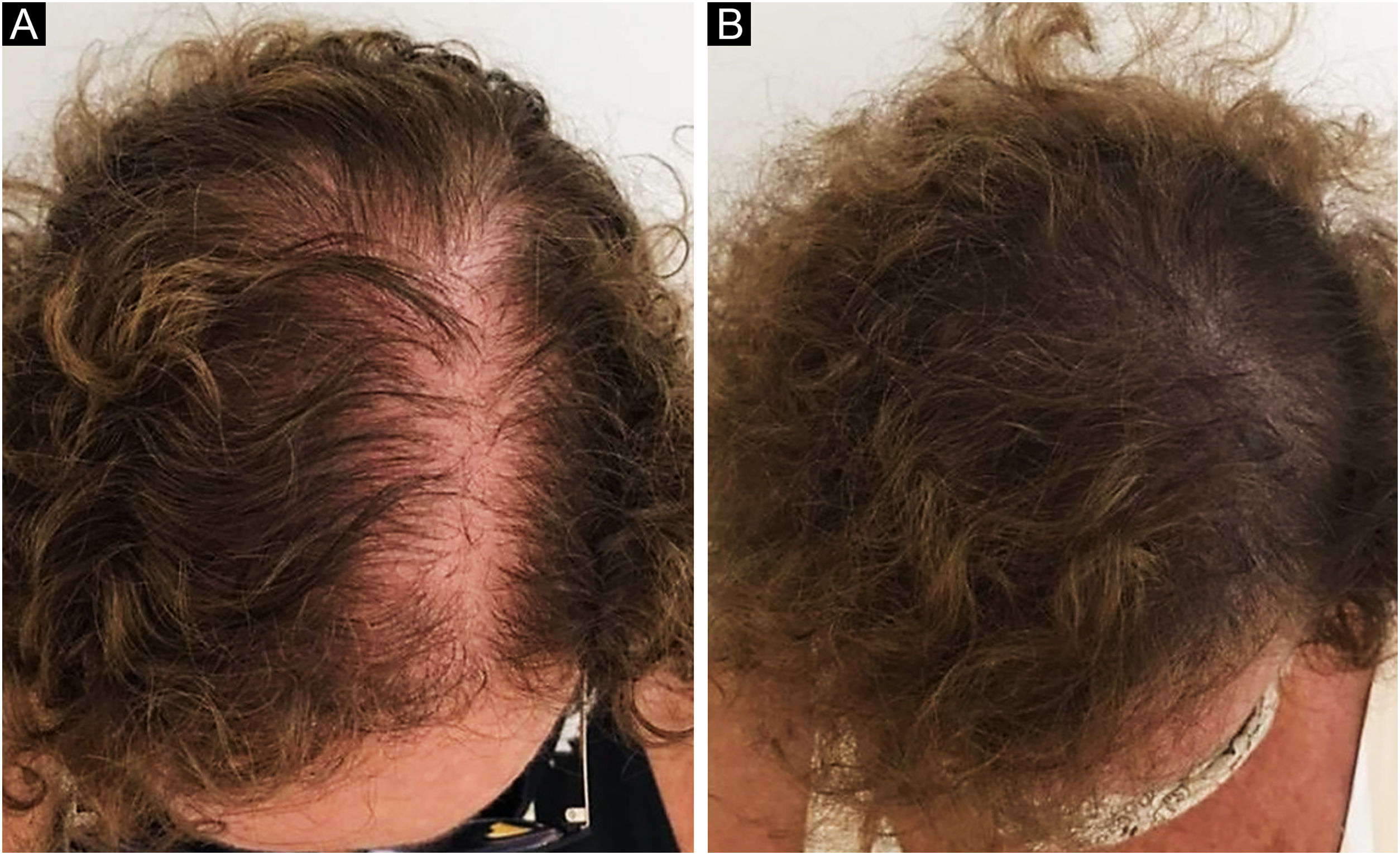
A folicular unit excision (FUE) prevê a excisão das UFs diretamente do couro cabeludo mediante utilização de equipamento específico, um micro‐punch de 0,85‐1,00mm que poderá ser acoplado à máquina de rotação ou poderá ser usado manualmente. A consequência dessa abordagem são milhares de microcicatrizes espalhadas homogeneamente pela área doadora (fig. 4). Em ambas as técnicas, a inserção das UFs nas áreas receptoras será realizada da mesma maneira, seja mediante uso de pinças delicadas ou de implanters.
A técnica FUT não requer raspagem dos cabelos, o que costuma ser vantajoso nas mulheres pois elas comumente não desejam ter a cabeça raspada e não têm receio da cicatriz linear. Habitualmente, a técnica FUE é realizada com raspagens dos fios na área doadora, porém podem‐se fazer “janelas” raspadas mantendo os cabelos longos acima desses setores para cobrir a área doadora. É possível a retirada dos fios longos pela técnica FUE, porém com dificuldade técnica muito maior e aumento de tempo cirúrgico. Entretanto, ambas estão bem indicadas, a depender da escolha da paciente e do conhecimento técnico do especialista.
Durante a consulta, além da decisão sobre qual a melhor técnica para o caso, também deve‐se informar à paciente quantas sessões serão planejadas. Comumente, pretende‐se realizar apenas uma etapa, mas pode ser necessário uma segunda sessão, com pelo menos um ano de intervalo. A paciente também deverá ser preparada com exames pré‐operatórios, bem como avaliação de risco cirúrgico.
Uma segunda consulta é agendada, chamada visita pré‐operatória, que serve para verificar os exames, responder dúvidas, rever planejamento e marcação, realizar fotos pré‐operatórias, assinar os termos de consentimento e receber as instruções para o dia da cirurgia. O procedimento pode realizado com técnica estéril, em sala de cirurgia ambulatorial, que permita monitorização constante da paciente. A anestesia é local, com bloqueio anestésico do couro cabeludo. A sedação endovenosa realizada pelo anestesista não é mandatória, mas traz conforto à paciente, pois permite infiltração indolor e diminui a percepção do tempo de cirurgia, que geralmente é de quatro a seis horas.
As atividades cotidianas podem ser retomadas no dia seguinte, mas é uma conduta prudente fazer repouso de quatro a seis dias, em decorrência de possível desconforto na área doadora e discreto edema na fronte. Na FUT, a incisão não fica aparente, e os pontos serão retirados entre 8‐10 dias de pós‐operatório. Pela abordagem FUE, podem‐se deixar cabelos longos o suficiente para cobrir a área raspada; não existem suturas nessa técnica (fig. 4). Após duas semanas, a paciente pode retomar as atividades esportivas, banho de mar etc.
É importante esclarecer sobre eventual eflúvio telógeno, que pode afetar os fios na área transplantada. Esse fenômeno ocorre a partir do primeiro mês após o procedimento, e – se for intenso – pode ser necessário usar algum disfarce (p. ex., lenço, chapéu) em situações sociais. Os folículos transplantados iniciam seu crescimento entre três a seis meses de pós‐operatório. O resultado final poderá ser observado com um ano, quando fotos são feitas e comparadas com as imagens anteriores à cirurgia.
Indicar cirurgia de restauração capilar em pacientes com APF requer conhecimento técnico, bem como acurada capacidade de estimar se haverá ganho apreciável de volume capilar na área de rarefação. Caso a expectativa da paciente seja irreal, especialmente aquelas com transtornos dismórficos corporais, ou quando não existam boas condições da área doadora, é preferível não indicar a cirurgia.83
Métodos de camuflagemNo arsenal terapêutico da APF, os métodos de camuflagem representam muito mais do que uma simples ferramenta cosmética. Eles podem minimizar danos psicológicos, melhorar a autoestima, o ajustamento social e a qualidade de vida das pacientes afetadas, principalmente enquanto não há resposta terapêutica, assim como nos casos mais avançados.
Próteses capilaresPrótese capilar é um termo mais específico do que peruca para descrever a cobertura capilar utilizada em virtude de condições médicas, a exemplo dos estágios avançados de APF.
Embora a literatura médica sobre esse assunto ainda seja limitada, é fundamental que o dermatologista conheça as peculiaridades das próteses capilares, como os tipos de fibras das quais podem ser feitas, as características das bases, seus principais métodos de fixação e extensão das próteses, para melhor indicá‐las.84
Tipos de fibras capilaresQuanto ao tipo de fibras capilares, as próteses podem ser divididas em sintéticas ou oriundas de cabelos naturais. As de fibras sintéticas são mais duradouras, têm preços mais acessíveis e requerem manutenção mais simples. As principais desvantagens desse tipo de prótese são seu aspecto pouco natural, a impossibilidade de estilizar e de se expor a altas temperaturas, como o calor dos secadores de cabelo, por exemplo. As próteses feitas de fibras de cabelo humano proporcionam aparência mais natural decorrente da variação gradual na cor e no diâmetro da fibra. Elas se comportam como cabelos naturais e, por isso, podem ser estilizadas, coloridas e até mesmo resistem a altas temperaturas. Algumas desvantagens das próteses de cabelo humano incluem custo mais alto, maior suscetibilidade ao desbotamento da luz solar e danos ambientais, além de exigirem manutenção constante.
Tipos de base ou fundaçãoA base da prótese é o local onde o cabelo é fixado para ser aplicado na paciente. Pode ser moldado para cobrir toda a cabeça da paciente ou apenas uma área de alopecia. Pode ser feita de diversos materiais, e geralmente tenta simular o couro cabeludo. Os principais tipos de base são a “skin”, confeccionada com materiais duráveis, que proporciona aspecto natural; a “net”, feita de malha delicada com cabelo sintético ou humano amarrado à mão, que pode se camuflar naturalmente com o couro cabeludo; e a “renda”, feita de material de náilon transparente e fino.
Métodos de fixaçãoAlgumas próteses têm tiras de velcro ou faixas ajustáveis em seu perímetro para prendê‐las ao couro cabeludo. As mais modernas apresentam adesão em toda a base, permitindo fixação mais estável, o que é importante para a confiança da paciente.
Se for necessária uma prótese que precise ser temporariamente removida, o uso de presilhas, grampos ou “tic‐tacs” seria adequado. A principal vantagem desse método é que as pacientes podem manter paralelamente seu tratamento clínico. A desvantagem é uma possível alopecia por tração ou quebra do cabelo em virtude das presilhas.
As fitas adesivas são fixações indicadas para os que necessitam de adesão por períodos mais longos, inclusive durante o sono, banho, relação sexual ou práticas desportivas. Além da alopecia de tração e quebra dos fios, uma desvantagem das fitas adesivas seria a possibilidade de originar dermatite de contato, especialmente causadas por adesivos que contenham cianoacrilato.
Os tipos de próteses mais caros são aqueles feitos sob medida com bases a vácuo, para os quais primeiramente cria‐se um molde de gesso personalizado do couro cabeludo do paciente. O molde é utilizado para formar uma base de silicone ou poliuretano a vácuo, processo que pode ser demorado. Essa prótese encaixa‐se perfeitamente no couro cabeludo e não precisa de outra forma de adesivo para fixação.
Extensão das prótesesAs próteses totais, conhecidas como “full cap”, são fabricadas sob medida, feitas de cabelos humanos e cobrem todo o couro cabeludo. As parciais variam conforme as necessidades da paciente e a extensão da APF. São projetadas principalmente para cobrir áreas localizadas de perda de cabelos.
Os sistemas de integração capilar (interlace) integram a prótese com o cabelo da paciente e são uma opção para adicionar mais densidade à área calva.
Em linhas gerais, as fibras podem ser naturais ou sintéticas; as bases podem abranger todo o couro cabeludo ou parte; e as próteses podem ser removíveis ou fixas. Cada tipo apresenta vantagens e desvantagens quanto a custo, aparência natural e praticidade. As próteses capilares promovem um resultado cosmético imediato e devem ser lembradas como opções complementares ao tratamento clínico, sobretudo nos casos mais avançados de APF.84
Sprays, pós e fibrasSprays, pós ou fibras são métodos de camuflagem capilar que agem como disfarce temporário para cobrir áreas com menor densidade ou ausência de fios no couro cabeludo.
As fibras capilares, por exemplo, são compostas por queratina que aderem eletrostaticamente ao fio, conferindo aspecto de maior volume e disfarçando, assim, as áreas de alopecia. Já os sprays são mais indicados para cobrir fios brancos ou amenizar diferenças de coloração entre áreas sem cabelo e com cabelo.
O efeito de cobertura é natural e obtido imediatamente após a aplicação. Não causa danos ao paciente e é compatível com os demais tratamentos dermatológicos. Em geral, são resistentes ao suor, chuva e vento, e são removidas após lavagem com xampus. Por não apresentarem toxicidade ou absorção, gestantes e crianças podem fazer uso. As coberturas com esses produtos promovem um resultado natural e imediato, devendo ser lembradas como opções complementares ao tratamento clínico.
TricomicropigmentaçãoA tricomicropigmentação, também conhecida como micropigmentação capilar, é um procedimento estético não cirúrgico que utiliza tatuagem convencional no couro cabeludo e nas áreas pilosas com a finalidade de disfarçar cicatrizes inestéticas, deformidades, áreas de calvície e outras condições que cursem com rarefação capilar.85
A técnica inclui a inserção de microgotículas de pigmento através da pele na derme superior (aproximadamente 1,5mm de profundidade) utilizando instrumento de tatuagem padrão, que suporta entre uma a seis agulhas e cicla entre 100 a 150 ciclos/segundo. É realizada uma tatuagem em padrão pontilhado imitando os óstios foliculares para diminuir o contraste entre o cabelo e a cor da pele. Assim, produz efeito de maior densidade capilar.85 O tamanho e o distanciamento dos pontos variam conforme os julgamentos artísticos do profissional.
Os pigmentos utilizados na micropigmentação são principalmente inertes, não tóxicos, não alergênicos, estáveis no tecido e injetados com agulhas de aproximadamente 6μm de calibre. As substâncias do pigmento diferem dependendo da cor necessária. Cinábrio e sulfato de mercúrio são utilizados para coloração vermelha; óxido de ferro para preto e marrom; e sulfeto de cádmio para a coloração amarela.60 Pode haver tonalidade azulada ou esverdeada resultante da exposição direta à luz ultravioleta sobre o pigmento através da pele. Ademais, essa exposição prolongada ao sol pode acelerar as mudanças na tonalidade do pigmento.86
Esse procedimento deve ser realizado por profissionais treinados – conta com riscos como infecção bacteriana e reação alérgica, e pode complicar com sangramento seguido de perda do pigmento, quando inserido em profundidade superficial.85
A tricomicropigmentação é opção interessante para pacientes com APF em estágios mais avançados, com resposta insatisfatória com tratamento clínico ou com limitações para realizar a cirurgia de restauração capilar. Além disso, promove camuflagem permanente das áreas de rarefação dos cabelos, devolvendo prontamente a autoestima às pacientes afetadas (fig. 5).
Considerações finaisO tratamento da APF é desafio rotineiro na prática do dermatologista em decorrência de sua alta prevalência, grande impacto na qualidade de vida e opções terapêuticas com limitado nível de evidência e que muitas vezes não atingem a expectativa da paciente.
Por se tratar de entidade crônica e progressiva, o tratamento deve der mantido por período indeterminado; porém, considerando que a maioria dos ensaios clínicos tem duração de até um ano, os dados sobre resultados de longo prazo são escassos.
De modo geral, casos mais leves de APF são mais responsivos à terapêutica do que casos mais extensos. O exame clínico e tricoscópico rotineiro na consulta dermatológica possibilita o diagnóstico precoce de casos, especialmente naquelas de maior risco, como as portadoras de hiperandrogenismo, usuárias de fármacos androgênicos (p. ex., anabolizantes esportivos, ou anastrozol), e aquelas com história familiar de AAG.
Nenhum dos medicamentos utilizados para APF apresenta perfil de segurança adequado para uso durante o período gestacional, em especial os antiandrogênicos e inibidores de 5αR.
O dermatologista deve estar ciente que a adesão pode ser problemática, e deve ficar atento a todos os elementos que podem impactá‐la. O seguimento adequado com fotos clínicas e dermatoscópicas padronizadas é importante não apenas para avaliação de eficácia, mas também para motivar a paciente a manter o tratamento.
A realização de ensaios clínicos randomizados comparando os diversos tratamentos disponíveis é essencial para conhecermos de maneira mais clara a eficácia das opções terapêuticas disponíveis, bem como de suas associações. Além disso, é fundamental avançarmos na compreensão da fisiopatologia da APF, que vai além da predisposição genética e ação dos androgênios. Esse conhecimento possibilitará a identificação de alvos terapêuticos que permitirão o desenvolvimento de tratamentos mais específicos e eficazes.
Suporte financeiroNenhum.
Contribuição dos autoresPaulo Müller Ramos: Aprovação da versão final do manuscrito; planejamento do texto; elaboração e redação do manuscrito; revisão crítica da literatura; revisão crítica do manuscrito.
Daniel Fernandes Melo: Aprovação da versão final do manuscrito; planejamento do texto; elaboração e redação do manuscrito; revisão crítica da literatura; revisão crítica do manuscrito.
Henrique Radwanski: Aprovação da versão final do manuscrito; planejamento do texto; elaboração e redação do manuscrito; revisão crítica da literatura; revisão crítica do manuscrito.
Rita Fernanda Cortez de Almeida: Aprovação da versão final do manuscrito; planejamento do texto; elaboração e redação do manuscrito; revisão crítica da literatura; revisão crítica do manuscrito.
Hélio Amante Miot: Aprovação da versão final do manuscrito; planejamento do texto; elaboração e redação do manuscrito; revisão crítica da literatura; revisão crítica do manuscrito.
Conflito de interessesNenhum.
A enfermeira Lizzandra Tavares, por ceder as fotos de tricomicropigmentação capilar.
Como citar este artigo: Müller Ramos P, Melo DF, Radwanski H, Almeida RFC, Miot HA. Female pattern hair loss: therapeutic update. An Bras Dermatol. 2023;98:506–19.
Trabalho realizado no Departamento de Dermatologia, Faculdade de Medicina, Universidade Estadual Paulista, SP, Brasil.