A alopecia androgenética masculina (AAGM) é doença bastante frequente e piora com a idade, com impacto relevante na qualidade de vida. Cada vez mais, a AAGM tem sido causa de consulta ao dermatologista. Sua etiopatogenia é multifatorial, com destaque para as influências genéticas e hormonais. A AAGM tem início com a miniaturização folicular em diversos padrões fenotípicos. Seu diagnóstico é basicamente clínico, e atualmente é corroborado por achados tricoscópicos bem estabelecidos. Apesar disso, as opções terapêuticas são limitadas, especialmente quando consideramos medicamentos com alto nível de evidência científica. Esta revisão visa ajudar o dermatologista geral a ter uma melhor compreensão da AAGM, além de oferecer embasamento para boas decisões terapêuticas individualizadas e criteriosas.
A alopecia androgenética masculina (AAGM) é condição comum que afeta grande proporção de homens. No Egito Antigo e na Grécia Clássica (séculos XII a.C. a II d.C.), indivíduos importantes e sábios eram representados sem cabelos. Religiosos hindus, católicos, muçulmanos e budistas tinham seus cabelos cortados como prova de humildade e pureza.1
Ao longo da história, os cabelos longos se tornaram sinal biológico de boa saúde; heróis bíblicos, mitológicos e reis foram representados com cabelos fartos. O século XX amplificou esse conceito, e a AAGM passou a ser percebida como negativa ou indesejável, em parte pela disponibilização maciça de produtos antiqueda e em outra pela explosão de meios de divulgação cultural e de propaganda negativa – rádio, cinema, televisão e internet.2 Uma busca em todos os programas infantis dos EUA no ano de 2006 mostrou que apenas 3% dos personagens avaliados eram calvos. Personagens calvos em televisão ou cinema tendem a ser vilões ou idosos.3 Em estudo com 5.000 imagens de homens em revistas populares publicadas entre 2011 e 2012, foram observados apenas 8% de calvos.4
Hamilton, estudando eunucos e eunucoides, constatou que seus irmãos desenvolviam calvície enquanto aqueles eram protegidos da alopecia. Tal observação levou à teoria de que essa condição endócrina pudesse ser a causa da AAGM.5
EpidemiologiaA AAGM costuma se manifestar a partir da segunda década de vida e acomete 30% dos homens por volta dos 30 anos, 50% aos 50 anos, e tende a piorar com o avanço da idade.6,7 Em estudo conduzido na Austrália com homens entre 40 e 69 anos, observou‐se que, para casos avançados de calvície, a prevalência aumentava com a idade, passando de 31% entre 40 e 55 anos para 53% no grupo entre 65 e 69 anos.8 Dados de um estudo norte‐americano mostraram que 53% dos homens entre 40 e 49 anos apresentavam calvície de moderada a grave.9 Corroborando a informação de aumento da incidência com a idade, um estudo em homens de Singapura demonstrou prevalência de 100% após os 80 anos.10
Dados epidemiológicos diferentes são observados em grupos étnicos variados; a AAGM é quatro vezes mais frequente em caucasianos quando comparado com negros americanos. Japoneses costumam apresentar início da doença até 10 anos depois do que caucasianos,11 enquanto chineses costumam apresentar menor incidência em relação a outras etnias.10
EtiopatogeniaA AAGM é doença de etiopatogênese multifatorial e envolve fatores genéticos, hormonais e ambientais. É importante compreendermos o ciclo folicular, pois a AAGM é determinada pela alteração desse ciclo e pela miniaturização folicular. Mais recentemente, o papel da microinflamação no âmbito de sua etiologia também vem sendo discutido.12
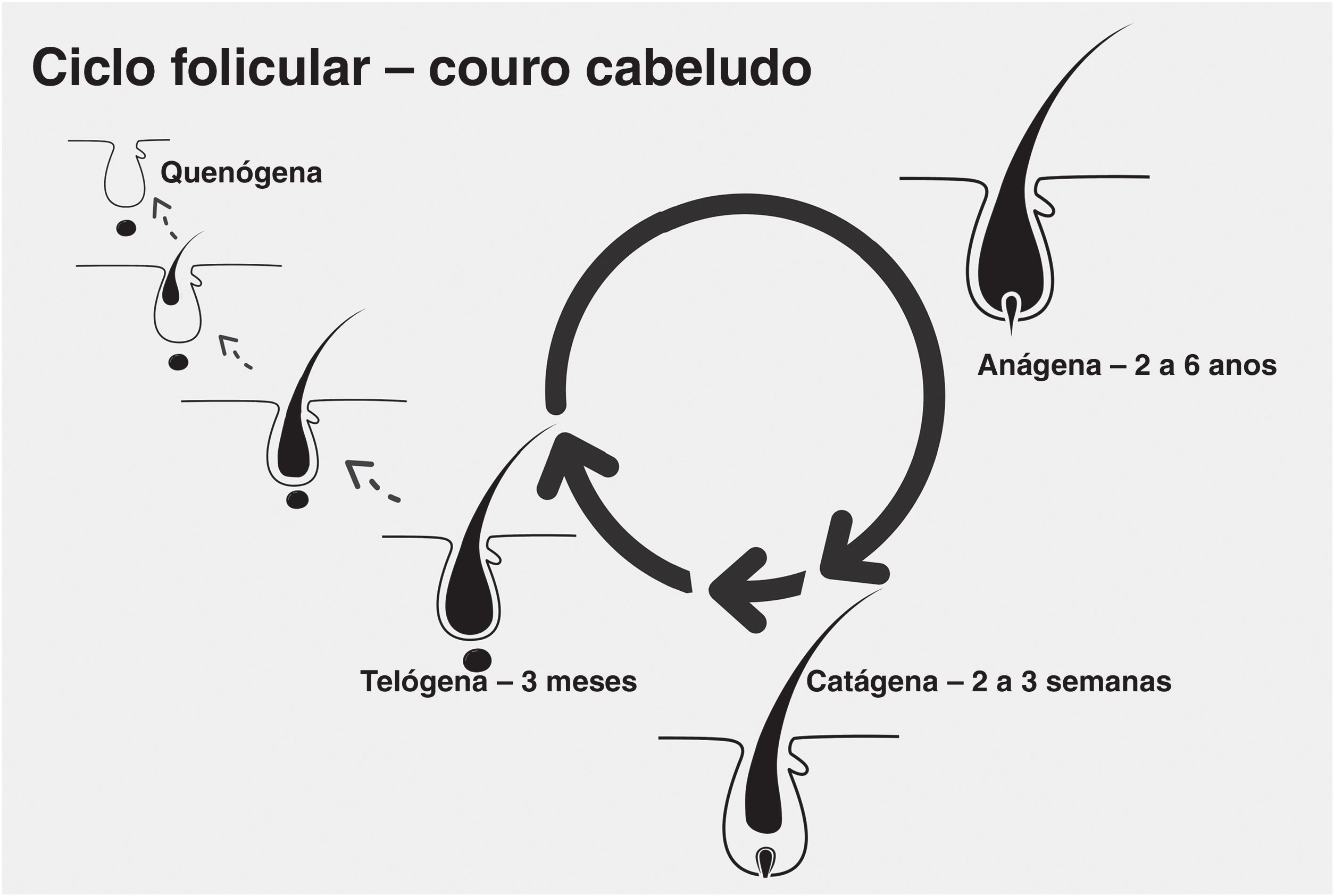
Ciclo folicularCada fio de cabelo é formado em um folículo piloso que passa por três fases, divididas didaticamente em anágena (fase de crescimento), catágena (fase de involução) e telógena (fase latente ou de repouso). Ao final da fase telógena, o folículo piloso reinicia a fase anágena e uma nova haste já começa a ser produzida, antes mesmo de a anterior se desprender. O desprendimento da haste é também conhecido como teloptose ou fase exógena.
Excepcionalmente, o folículo pode entrar em período de inatividade, no qual se encontra vazio por certo tempo (fase quenógena). Essa fase pode estar presente fisiologicamente, mas se torna mais comum e mais longa em pacientes mais idosos ou com AAG avançada (fig. 1).13
Na AAGM ocorre redução da fase anágena, com entrada prematura na fase catágena, além de redução da proporção anágeno‐telógeno. Com maior predominância de telógenos, o paciente pode notar aumento da queda dos fios. Alguns estudos sugerem que a entrada na fase catágena é consequência da diminuição da expressão de fatores que mantém o anágeno, como o fator de crescimento semelhante à insulina (IGF‐1), o fator de crescimento básico de fibroblastos (bFGF) e o fator de crescimento endotelial vascular (VEGF) e aumento da expressão de citocinas que promovem apoptose celular, como o fator de crescimento transformador beta (TGF‐β1), a interleucina‐1 alfa (IL‐1α) e o fator de necrose tumoral alfa (TNF‐α).14
Além da alteração do ciclo folicular, existe também uma alteração morfológica dos folículos e, consequentemente, dos fios: a miniaturização. O fio miniaturizado é bastante semelhante a um fio velo, com espessura <0,03mm.15
A miniaturização provavelmente acontece em algum ponto entre a fase catágena e o início da próxima fase anágena, quando a papila dérmica está em movimento e, portanto, mais suscetível a forças externas.16 O diâmetro do fio é determinado pelo tamanho da papila dérmica; a redução do volume da papila por mecanismos envolvendo a perda de regulação entre agentes pró e antiapoptóticos pode estar relacionada a esse processo de miniaturização.17
GenéticaPor ser doença tão comum, é difícil estabelecer um padrão de herança genética para a AAGM.12 Evidências da importância do fator hereditário no desenvolvimento da AAGM se sustentam no fato de que, apesar de rara, a doença já foi identificada em crianças em idade pré‐puberal, e esses casos de início precoce apresentam forte histórico familiar positivo para a condição.18 Além disso, existe maior concordância da AAGM em gêmeos monozigóticos em comparação com os dizigóticos.19
Alterações no gene do receptor de andrógeno (RA) no cromossomo Xq12 podem levar ao aumento da expressão desse receptor e consequente tendência à AAGM,20 não sendo, no entanto, suficientes para levar à calvície. A presença local e sistêmica dos andrógenos também exerce influência e pode ser determinada geneticamente, apontando para uma provável herança poligênica no desenvolvimento da doença.21
Esse modelo de herança poligênica e expressividade variável pode explicar os diferentes fenótipos e a variação na idade de início da doença.22 Existem dois estudos importantes no campo do genoma da AAGM, atualmente com 10 loci de suscetibilidade identificados: 2012;8.1p36.22, 2q37.3, 7p21.1, 7q11.22, 17q21.31, 18q21.123, 2q35, 3q25.1, 5q33.3 e 12p12.1.23,24
Fator hormonalEstrogênio, hormônios tireoidianos, glicocorticoides, retinoides, prolactina e hormônio de crescimento interferem no crescimento capilar, mas os andrógenos têm a maior importância.25
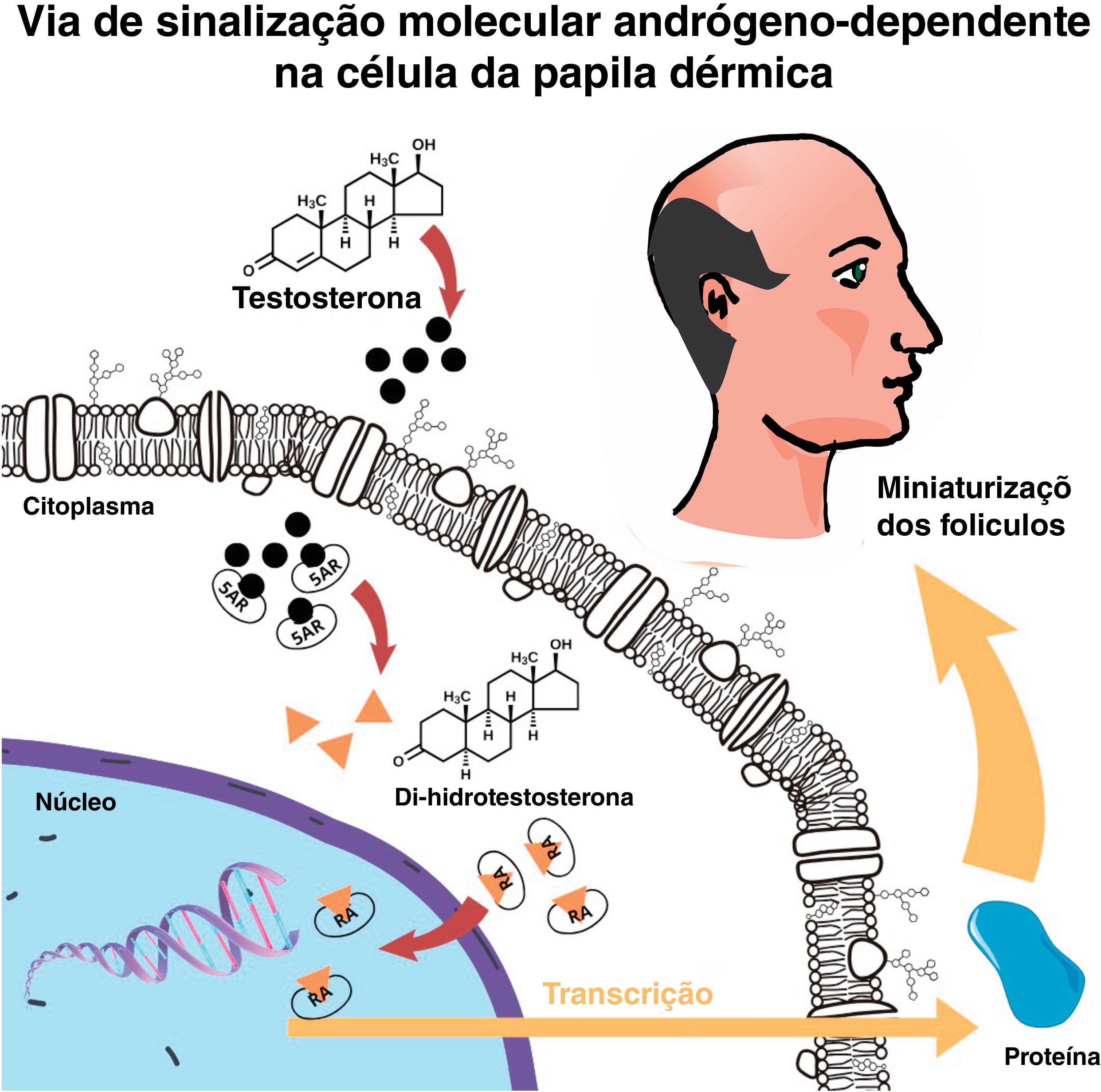
A pele e a unidade pilossebácea têm capacidade de metabolização e conversão de esteroides sexuais,26 e no folículo piloso a enzima 5‐alfa redutase tipo 2 (5‐αR2) converte a testosterona em di‐hidrotestosterona (DHT), que se liga aos RA intracelulares iniciando uma cascata de sinalização que culmina no afinamento capilar14 (fig. 2). Comparada à testosterona, a DHT tem aproximadamente cinco vezes mais afinidade pelo RA.14
Homens com deficiência de 5‐αR não desenvolvem AAGM, independentemente do nível sérico de testosterona. Logo, é a DHT, e a consequente ativação gênica, um dos grandes responsáveis pela doença. A relativa eficácia dos inibidores de 5‐αR2 no tratamento da AAGM ajuda a corroborar essa hipótese.27
MicroinflamaçãoO sucesso limitado das terapias com moduladores androgênicos e promotores de crescimento capilar leva a crer que outros mecanismos possam estar envolvidos na AAGM.12
O termo microinflamação é utilizado atualmente para se referir à inflamação mais leve e superficial que acomete os folículos na AAGM, em comparação com a inflamação das alopecias cicatriciais.28
Uma questão importante é a origem dessa inflamação. O fato de ser mais superficial pode indicar origem no infundíbulo e, nesse caso, a colonização por Propionibacterium sp., Staphilococcus sp. e Malassezia sp., entre outros microrganismos, poderia contribuir com toxinas e/ou antígenos para o início do processo inflamatório.29 Fatores ambientais como irritantes, poluentes, radiação ultravioleta, tabagismo e radicais livres de oxigênio também podem ativar a resposta inflamatória nos queratinócitos foliculares por meio da liberação de IL‐1α.30 Fibroblastos adjacentes respondem a esse sinal inflamatório, perpetuando a cascata, até a destruição dos antígenos.31 Por meio da atividade da DHT, o aumento da glândula sebácea poderia proporcionar um microambiente mais favorável ao desenvolvimento dos microrganismos pró‐inflamatórios citados.28
Por fim, outros receptores podem estar envolvidos na microinflamação, como o receptor de vitamina D e os receptores retinoides, pois já foi demonstrado que esses têm ações antagônicas sobre a expressão de IL‐8 e podem fazer parte de um delicado equilíbrio na complexa cascata inflamatória do crescimento capilar.32,33 No entanto, vale ressaltar que permanece controverso se a microinflamação na AAGM é o gatilho inicial para seu desenvolvimento ou, ainda, se ela é relevante na patogênese da doença.34
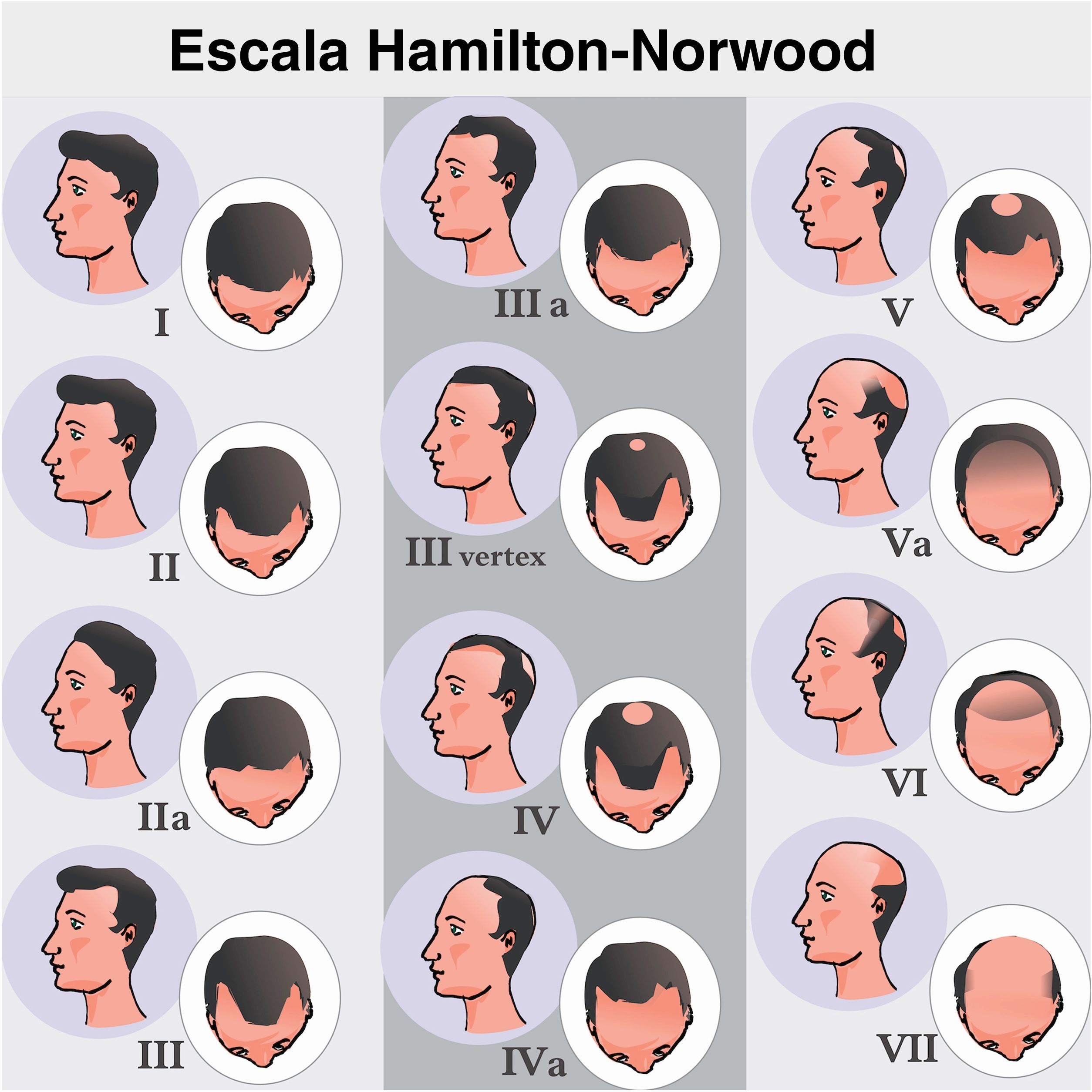
Quadro clínico e classificaçãoA AAGM tem início com o processo de miniaturização folicular nas regiões temporais e no vértice. Hamilton, em 1951, classificou os padrões de evolução da doença.6 Mais tarde, em 1975, Norwood modificou a classificação a fim de simplificá‐la, e deu origem à mais utilizada de todas as classificações: Hamilton‐Norwood.35 São sete estágios que descrevem a evolução do quadro clínico e padrões de acometimento da perda capilar (fig. 3).
Classificação de Hamilton‐Norwood. Estágio I, sem perda de cabelo aparente ou mínima perda nas regiões temporais. Estágio II, leve recesso bitemporal, assumindo formato triangular simétrico. Estágio III, perda importante com pouca ou nenhuma cobertura capilar nas regiões temporais. Estágio III vértice, a perda capilar é mais pronunciada no vértice e o recesso na região temporal não excede aquele descrito no estágio III. Estágio IV, rarefação importante nas regiões temporais e no vértice, restando uma faixa densa de cabelos que separa as duas áreas. Estágio V, recuo da linha de implantação e rarefação mais evidente no vértice; a faixa de cabelos que separa as duas regiões apresenta densidade ainda mais reduzida, deixando menos evidente a área de transição. Estágio VI, regiões frontotemporal e vértice se unem pela perda completa da faixa de cabelos que as separava. Estágio VII, forma mais extensa de acometimento, restando apenas uma estreita faixa de cabelos nas regiões laterais e occipital.
As formas de III a V ainda podem apresentar o subtipo A, quando o acometimento é exclusivamente anterior e a faixa de cabelos separando as regiões frontotemporal e vértice não se forma.
Apesar de ser a classificação mais utilizada, a Hamilton‐Norwood tem limitações, como o excesso de detalhes e a não aplicabilidade para alopecia de padrão feminino. Lee et al., em 2007, descreveram uma nova classificação com o objetivo de simplificar e unificar informações: a Basic and Specific Classification (BASP), dividida em dois tipos: básico, que descreve o desenho da linha de implantação, e específico, relacionado à gravidade (fig. 4).36
DiagnósticoO diagnóstico da AAGM é essencialmente clínico, não havendo necessidade de exames laboratoriais ou histopatológico, que devem ser realizados apenas em casos duvidosos. O exame do cabelo e do couro cabeludo revela o padrão de queda característico, sem evidência de quadro cicatricial.
Além do quadro clínico e exame físico, o exame mais útil para o diagnóstico de AAGM é a dermatoscopia do couro cabeludo (tricoscopia).37 Outros exames menos importantes na rotina serão apenas citados.
Tricoscopia38,39Os achados mais frequentes na tricoscopia são baseados em estudos em caucasianos:
- •
Diversidade de espessura dos fios em virtude da miniaturização progressiva, típico da AAGM. Isso ocorre porque os pelos terminais vão sendo gradualmente substituídos por pelos mais finos e mais curtos (velos), exceto na região occipital;
- •
Presença de fios mais grossos e mais longos que os típicos velos, porém mais curtos e mais finos que o fio terminal com aspecto ondulado (wavy hair);
- •
O número de fios emergindo da unidade folicular diminui para um ou dois, caracterizando diminuição do volume dos cabelos. O couro cabeludo apresenta unidades foliculares com dois a cinco fios, e a proporção de unidades com apenas um fio é de menos de 30% nos indivíduos sem AAGM. Esse dado é bastante útil para diagnóstico precoce;
- •
Pontos amarelos podem ser encontrados em casos avançados, correspondendo a queratina e sebo acumulados no óstios dilatados dos folículos;
- •
Presença do sinal peripilar (ou hiperpigmentação perifolicular), que corresponde à presença de infiltrado linfocítico perifolicular, observado em 22%–60% dos pacientes, mas não patognomônico;
- •
Pigmentação em favo de mel em indivíduos caucasianos com AAGM avançada que tiveram o couro cabeludo exposto ao sol. Pode ser encontrada em caucasianos com qualquer tipo de alopecia não cicatricial e no couro cabeludo saudável de pacientes de fototipos mais altos.
Momentos de maior queda de fios podem ser identificados com um teste positivo durante o exame.
TricogramaTeste semi‐invasivo e doloroso. Substituído pela tricoscopia e cada vez menos realizado na AAGM.38
FototricogramaExame não invasivo que realiza a contagem dos fios (densidade capilar), sua espessura e a velocidade de crescimento. Atualmente, é mais utilizado em ensaios clínicos.38
Teste de rastreamento genéticoDetermina se há presença de genes de suscetibilidade à calvície.38
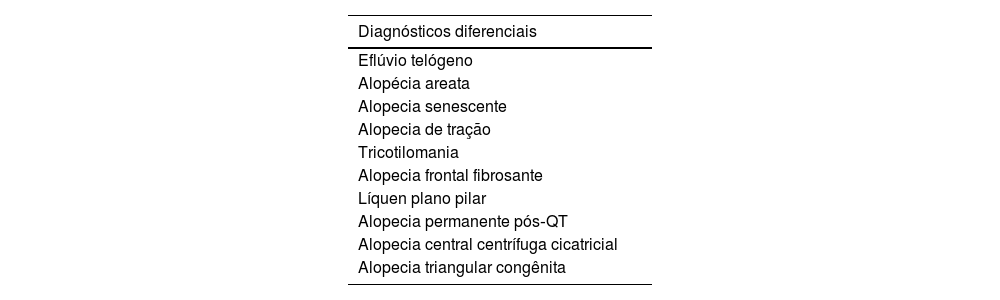
Diagnósticos diferenciaisHistologiaA biopsia é útil quando o padrão de AAGM não é típico ou para diagnóstico diferencial de alopecia cicatricial.
A técnica recomendada é de punch de 4mm, profundo, incluindo a hipoderme em uma área não totalmente sem cabelos. O ideal é que sejam realizadas duas biopsias na mesma área de alopecia: uma para corte histológico horizontal (em que serão avaliados número de folículos, fase do ciclo e localização do infiltrado inflamatório) e outra para corte longitudinal (para avaliação da epiderme, derme e processo inflamatório).
Para a AAGM em sua fase inicial, duas biopsias devem ser realizadas: uma em área envolvida e a segunda em área não envolvida, a fim de se comparar o tamanho e o número de folículos. Em casos avançados, uma biopsia é suficiente para o diagnóstico.41
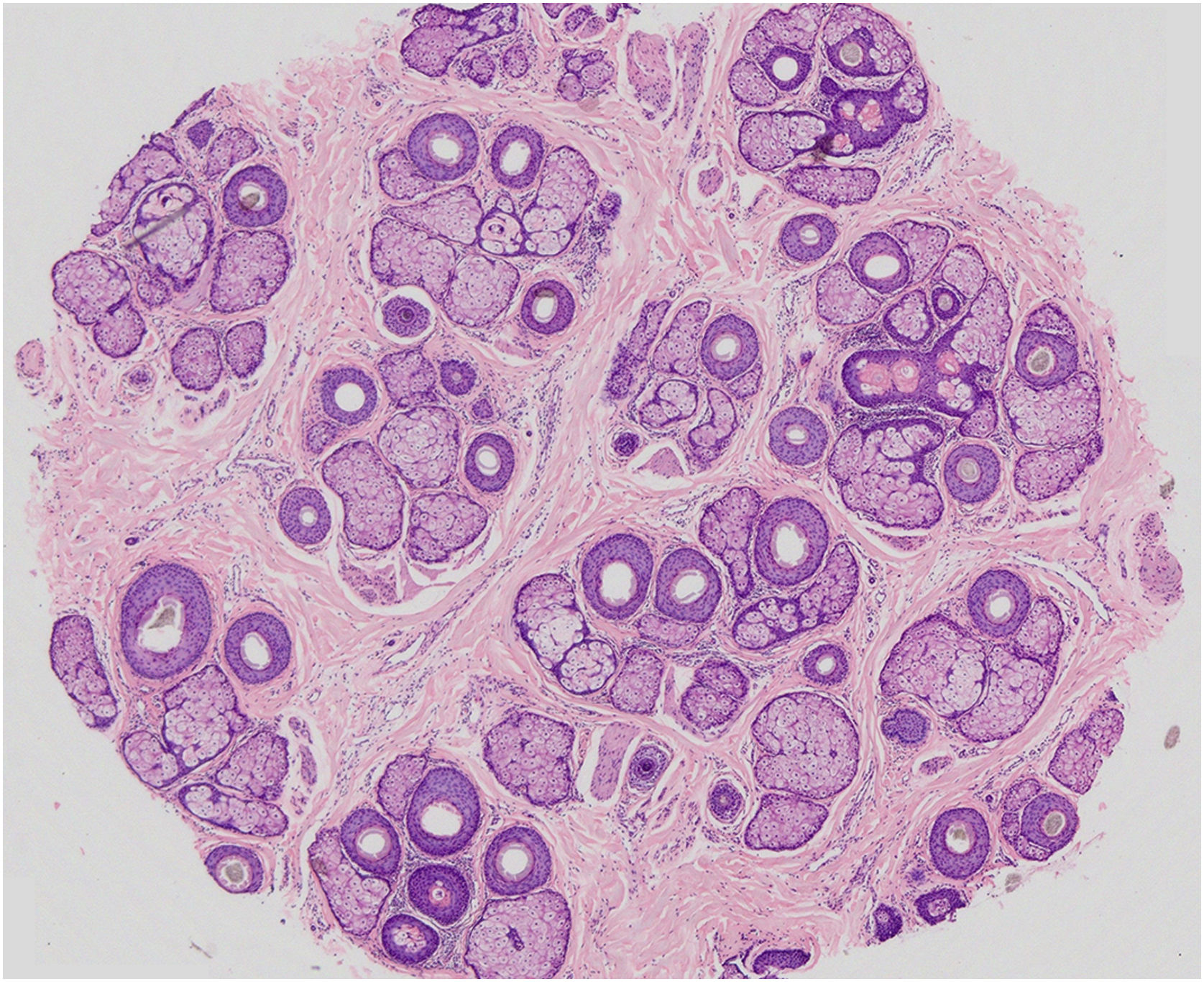
Na AAGM, a característica histológica principal é a miniaturização progressiva dos folículos terminais culminando em velo. Com a miniaturização, os folículos ascendem para a derme superficial, levando ao aumento de tratos fibrosos. Há aumento numérico de folículos em fase telógena e diminuição da relação anágeno/telógeno de 7:1 para até 2:1. Processo inflamatório linfocitário peri‐infundibular leve também pode ser observado, bem como elastose solar em casos mais acentuados de perda capilar (fig. 5).42
Corte horizontal de fragmento de pele do couro cabeludo AAGM (Hematoxilina & eosina, 20×) – 39 folículos pilosos ao nível dos istmos sendo nove velos e os demais terminais e intermediários. Epitélio folicular preservado e glândulas sebáceas com lóbulos aumentados. Todos os folículos estão em fase de anágena e uma unidade germinativa telógena.
A AAGM impacta significantemente a qualidade de vida dos pacientes, principalmente homens mais jovens com diagnóstico recente de calvície.43
TratamentoMuitos tratamentos são descritos para a AAGM, porém apenas minoxidil tópico, finasterida e dutasterida via oral têm aprovação em bula por órgão regulatório no Brasil (Anvisa).
Minoxidil tópico e oralAo observar hipertricose nos pacientes em uso de minoxidil oral como anti‐hipertensivo, foi desenvolvida a formulação tópica a 2% que recebeu liberação do FDA (EUA) para o tratamento da AAGM em 1988. Posteriormente, em 1991, estudos relataram a superioridade da solução a 5% quando comparado a 2% e placebo.44
O mecanismo de ação do minoxidil no folículo piloso não é totalmente conhecido e provavelmente não ocorre apenas por seu efeito vasodilatador. Possíveis efeitos incluem: aumento do VEGF na papila dérmica, indicando que a substância induz angiogênese; ativação da prostaglandina‐1‐sintetase, enzima promotora da atividade folicular; e aumento da expressão do fator de crescimento dos hepatócitos, promotor da atividade celular no folículo.45
Dados recentes sugerem que o minoxidil atue na expressão gênica e na ativação de vias de sinalização, levando à regulação positiva de alguns genes. Também foram relatados possíveis mecanismos antiandrogênicos, interferindo não só com os RA, mas também atuando em dois diferentes alvos relacionados à biossíntese de esteroides.46
Em sua apresentação tópica, o uso em homens é recomendado em solução a 5%, 2×/dia. Para que os resultados obtidos sejam mantidos, o tratamento deve ser continuado indefinidamente.47 É medicamento seguro, bem tolerado e com poucos efeitos adversos (dentre os mais comuns, estão prurido e descamação do couro cabeludo). Embora o minoxidil possa causar dermatite de contato, é o propilenoglicol, presente no veículo, a substância mais frequentemente causadora da dermatite. Nesses casos, os sintomas são resolvidos com a troca para minoxidil tópico sem propilenoglicol.
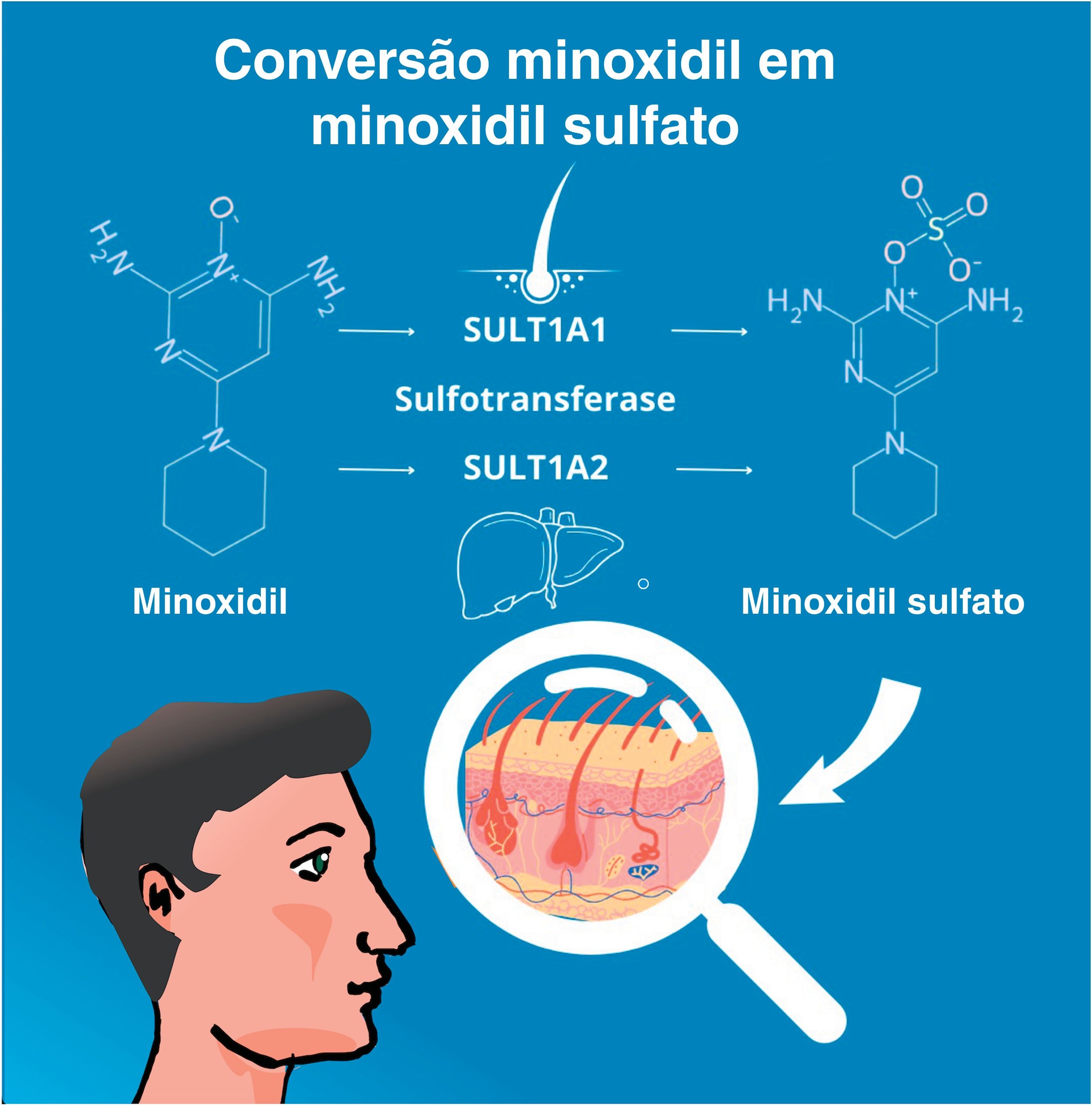
Na aplicação tópica, a enzima sulfotransferase (SULT1A1) no couro cabeludo humano converte o minoxidil em minoxidil sulfato, que é a forma ativa da molécula. Diferenças na atividade da SULT1A1 entre indivíduos podem afetar a eficácia do medicamento, levando a inconsistências na resposta ao tratamento.48 Em sua forma oral, o minoxidil também necessita ser convertido em sua forma ativa (fig. 6), por meio da sulfotransferase hepática (SULT1A2).
Estudos demonstram eficácia clínica tanto de minoxidil solução 5%, 2×/dia,49 quanto do minoxidil oral em baixa dose (MOBD), com doses de 1 a 5mg/dia.49,50 Entretanto, a adesão ao longo de um ano é maior com o medicamento oral,51 o que pode explicar percepção de maior eficácia do MOBD no consultório dermatológico.52
O minoxidil por via oral pode ocasionar efeitos colaterais sistêmicos em uma pequena porcentagem de pacientes, como aumento da frequência cardíaca, cefaleia, retenção de líquido, hipertricose e edema de extremidades inferiores. O evento mais comumente observado é a hipertricose, em cerca de 15% dos pacientes.53 Os eventos adversos do minoxidil oral, no entanto, são tipicamente dependentes da dose e reversíveis com a descontinuação do medicamento. Efeitos colaterais raros e idiossincrásicos – ou seja, dose independentes – incluem derrame pericárdico, insuficiência cardíaca congestiva e reações alérgicas. É provável que o MOBD tenha perfil de segurança em pacientes com hipertensão ou arritmia similar à população geral,54 mas a avaliação cardiológica se faz necessária nesse grupo.
No início do uso das formas oral ou tópica, alguns pacientes podem apresentar eflúvio, cujo mecanismo é a liberação imediata de telógenos. Tal queda pode durar de duas a oito semanas e se resolve espontaneamente. Durante os dois primeiros meses de tratamento, observou‐se incidência de eflúvio telógeno de 16% no grupo tratado com minoxidil tópico, enquanto no grupo tratado com minoxidil oral essa incidência foi significantemente menor, com apenas 9%.55
Inibidores de 5‐alfa redutase (5αR)Consideradas substâncias modificadoras da calvície masculina, são aprovadas para uso a finasterida 1mg/dia e a dutasterida 0,5mg/dia.56 A literatura mostra que são eficazes no tratamento de pacientes com AAGM; o uso a longo prazo mostrou crescimento capilar e estabilização da calvície.57 Sua eficácia é maior no tratamento da calvície do vértice do que da região frontoparietal, e recomenda‐se que sejam continuadas indefinidamente para preservar o cabelo recuperado.58 Embora potencialmente reversível por se tratar de alopecia não cicatricial, a AAGM em pacientes com miniaturização de folículos importante é um desafio terapêutico, e os inibidores de 5αR isolados não se mostraram capazes de reverter totalmente a doença.
Apesar da eficácia e do mecanismo de ação bem estabelecidos no tratamento da AAGM, inclusive com resposta sustentada ao longo dos anos, o maior obstáculo ao uso oral dos inibidores de 5αR é a insegurança dos homens com possíveis efeitos colaterais, como diminuição de libido e impotência.59 Estudos de coorte relatam aumento do risco de depressão em pacientes tratados para hiperplasia benigna prostática principalmente nos primeiros 18 meses do uso da medicação.60 Isso é parcialmente justificado, pois a DHT e a 5αR participam da produção de diversos esteroides neuroativos. Além disso, testosterona e DHT modulam a resposta neuroendócrina ao estresse e estão inversamente relacionadas a índices de depressão.61 Por outro lado, o efeito nocebo, ou seja, quando uma pessoa desenvolve sintomas e efeitos colaterais de um medicamento simplesmente porque leu ou foi alertado sobre tal possibilidade, foi bem documentado em homens em uso de inibidores de 5αR.62 A escolha do tratamento deve envolver avaliação criteriosa, evitando‐se a prescrição em indivíduos com episódios recentes de depressão ou queixas de disfunção sexual. Outros efeitos adversos dessa classe de medicação incluem hipotensão ortostática, tontura, ginecomastia e redução do volume espermático.63
A supressão dos níveis circulantes de DHT na gestação pode inibir o desenvolvimento dos órgãos genitais externos de feto do sexo masculino; portanto, gestantes e crianças devem evitar o contato com as cápsulas. Homens em tratamento com finasterida e dutasterida não devem doar sangue por um e seis meses, respectivamente, após a última dose, a fim de se prevenir a administração a uma receptora de transfusão grávida.64
Alguns estudos têm abordado os efeitos dos inibidores de 5αR na motilidade e morfologia dos espermatozoides e no volume espermático. Um estudo analisou os efeitos da terapia diária com finasterida (5mg) e dutasterida (0,5mg) por um ano, examinando amostras de soro e sêmen antes e depois do tratamento, e concluiu que nenhum dos tratamentos teve impacto na morfologia dos espermatozoides.65 Não é necessária a descontinuação da medicação em homens tentando engravidar suas parceiras ou com vida sexual ativa com parceiras grávidas, já que a excreção de finasterida e dutasterida no sêmen é mínima e improvável de causar efeitos teratogênicos.66
Existe uma preocupação de que os inibidores de 5αR possam causar ou agravar quadro de infertilidade masculina subjacente. Não há dados suficientes na literatura para se afirmar categoricamente qual seu papel na fertilidade masculina.
Nesse contexto, é importante definir infertilidade, condição caracterizada pela incapacidade de um casal estabelecer gravidez clínica após 12 meses de relações sexuais regulares e desprotegidas. Portanto, avaliar a infertilidade masculina isolada fora de um contexto de tentativa de gravidez do casal não é abordagem que envolva apenas a solicitação de um único exame. De fato, a infertilidade masculina é multifatorial e sua incidência vem aumentando ao longo do tempo.67 A solicitação do espermograma pode documentar características do sêmen abaixo dos limites inferiores estabelecidos e não necessariamente implicar em infertilidade, e valores considerados “normais” não garantem a fertilidade.68
Não existe padronização na solicitação de exames laboratoriais para a prescrição de inibidores de 5αR. O monitoramento laboratorial não é necessário em pacientes sem comorbidades.69 Em pacientes com mais de 45 anos de idade, após seis meses de tratamento, é recomendado que se estabeleça um novo nível basal de antígeno prostático específico (PSA).70,71 Aumentos contínuos de PSA durante o tratamento podem indicar câncer de próstata ou não adesão à terapia. O tratamento com essa classe de medicações não interfere no uso do PSA para diagnóstico de câncer de próstata após a nova linha de base ter sido estabelecida. Após a interrupção do tratamento, os níveis de PSA retornam aos valores iniciais em cerca de seis meses.
Os inibidores da 5αR são considerados pela Agência Mundial Antidoping (WADA) potenciais fatores de confusão na avaliação do perfil esteroide do atleta, já que podem interferir na excreção urinária de vários compostos diagnósticos.72 No entanto, diante dos avanços diagnósticos de doping, não estão incluídos na lista de medicamentos proibidos pela entidade.73
Finasterida oralA finasterida é um inibidor de 5αR‐2 que diminui a conversão de testosterona em DHT com meia‐vida plasmática entre cinco a oito horas. Após o pico de melhora inicial, estudos de acompanhamento a longo prazo demonstram progressão da alopecia em 10,3% dos casos de AAGM em vértice, 16,2% do tipo frontal e controle da doença dos tipos bifásico ou difuso.58
Relatos recentes sobre a síndrome pós‐finasterida, condição controversa que pode incluir problemas sexuais, depressão e ansiedade, criaram um medo entre os pacientes que buscam tratamento. Enquanto estudos não confirmam nem refutam a síndrome como entidade nosológica válida, o uso oral da finasterida com segurança a longo prazo durante um período de 10 anos já foi documentado.74
Dutasterida oralA dutasterida é um inibidor da 5αR‐1 e 2, com meia‐vida de cinco semanas, três vezes mais potente na inibição da 5αR‐2 do que a finasterida e 100 vezes mais potente na inibição da 5α‐1.75 Essas características justificam o efeito superior da dutasterida 0,5mg/dia em relação à finasterida 1mg/dia no tratamento da AAGM,76 sem apresentar, até o momento, diferenças significantes de efeitos adversos (tabela 2).
Finasterida tópicaNa tentativa de mitigar seus efeitos sistêmicos, a finasterida na forma tópica tem sido estudada e vem mostrando capacidade de diminuir os níveis de DHT tanto no plasma quanto no couro cabeludo.77 A ausência de concentração e veículos padronizados torna imprevisível determinar a eficácia dessa via de administração.
Dutasterida tópicaEm virtude do grande tamanho molecular da dutasterida, é difícil formulá‐la e administrá‐la como um agente tópico. Por outro lado, seu grande tamanho e natureza lipofílica podem contribuir para que permaneça no couro cabeludo, com menor absorção sistêmica. No momento, porém, não há dados suficientes na literatura que corroborem sua utilidade no tratamento da AAGM.78
Tratamentos adjuvantesIntradermoterapia capilarA intradermoterapia (muito citada como mesoterapia) é feita com injeções no couro cabeludo com medicação ou com mistura de várias substâncias. Embora venha sendo amplamente utilizada, a escolha das dosagens e misturas baseia‐se em experiências pessoais. Poucos tratamentos são apoiados por estudos científicos com evidência.
Dentre as medicações utilizadas por essa via, destaca‐se a dutasterida pela crescente utilização e publicações científicas. Isso ocorre como tentativa de se romper a barreira epidérmica e pela minimização de possíveis eventos adversos.79 Não existe padronização quanto à frequência de aplicação. O principal evento adverso é a dor, que pode ser contornada com bloqueios anestésicos. Menos comumente, edema da fronte ou até da face e hematomas podem ocorrer. Com o conhecimento atual, ainda são necessários mais estudos para se avaliar sua eficácia terapêutica quando comparada à já estabelecida via oral.80
Há evidências limitadas sobre a intradermoterapia com finasterida e minoxidil. O uso de vitaminas como a biotina não demonstrou eficácia.70
Eventos adversos raros são descritos, incluindo casos de alopecia secundária a injetáveis, que se apresentam clinicamente mimetizando alopecia areata e/ou alopecias cicatriciais.81 Diferentes substâncias podem provocar perda de cabelo por inflamação, danificando os folículos capilares por mecanismos ainda não totalmente compreendidos.
A microinfusão de medicamentos na pele (MMP®) combina a entrega de medicamentos com a proposta de distribuição em menor quantidade e de maneira mais homogênea.82 Embora essa técnica seja amplamente difundida no Brasil, apenas relatos de caso foram publicados.
MicroagulhamentoO microagulhamento é procedimento minimamente invasivo no qual a injúria percutânea é induzida com microagulhas, resultando na liberação de diversos fatores de crescimento e promovendo a remodelação do colágeno. Esses fatores potencialmente promovem a angiogênese, a cicatrização de feridas e revertem a fibrose.83 Uma revisão envolvendo 17 estudos avaliou melhora com microagulhamento na AAG e na alopecia areata quando usado com soluções, entre elas o minoxidil a 5% e/ou plasma rico em plaquetas (PRP). A maioria dos ensaios clínicos mostrou resultados positivos; entretanto, o nível de evidência dos estudos e a heterogeneidade de método não permitem avaliar a eficácia a longo prazo.84 O microagulhamento é frequentemente usado como tratamento adjuvante e não deve ser indicado como monoterapia. Na AAGM, foi demonstrado que o microagulhamento isoladamente não evita a progressão da doença.85
Dor, hematomas e foliculite podem ser observados com a técnica, assim como em outros procedimentos que envolvam injeções (intradermoterapia).
Fotobiomodulação: low‐level laser therapy e LEDA terapia de fotobiomodulação (FBM) usa lasers ou diodos emissores de luz (LEDs) de baixa irradiância para promover bioestimulação celular sem produzir efeitos térmicos. O mecanismo de ação não é totalmente esclarecido; no entanto, acredita‐se que a absorção de luz vermelha pelo citocromo C oxidase em mitocôndrias conduz à fotodissociação do óxido nítrico inibitório, o que resulta em aumento da produção de ATP, modulação de espécies reativas de oxigênio e indução de fatores de transcrição.86
Em 1967, Endre Mester testou laser em camundongos, buscando o potencial de desenvolver câncer. Surpreendentemente, os camundongos tratados com laser de baixa potência não desenvolveram câncer e apresentaram crescimento acelerado de pelos.87 Além disso, foi relatada hipertricose paradoxal, ou seja, crescimento de pelos em áreas tratadas com doses baixas de laser para epilação, corroborando o mecanismo de fotobiomodulação.88
Para o tratamento da AAGM, os comprimentos de onda mais utilizados estão situados próximos de 655nm.89 Uma metanálise comparou diferentes dispositivos e não encontrou diferenças na eficácia entre as formas de apresentação (pente, capacete ou boné), mas favoreceu dispositivos com laser sobre o LED.90
Embora o mecanismo de ação do LLT na AAGM tenha fundamento teórico, o impacto clínico como terapia isolada na cobertura capilar é pequeno. Os novos fios detectados nos fototricogramas provavelmente são miniaturizados e curtos, resultando em benefício limitado quando em monoterapia. Entretanto, o laser representa opção segura como terapia adjuvante.90
Lasers fracionados e outras tecnologiasLasers fracionados ablativos e não ablativos e radiofrequência microagulhada também têm sido utilizados, especialmente para aumento da penetração de medicamentos (laser and energy assisted drug delivery – LEADD).91 Quando comparado ao uso do laser em monoterapia, o LEADD não mostrou superioridade. Considerando que ambos os tratamentos melhoraram os critérios de alopecia avaliados, podemos supor que existem mecanismos próprios do laser na modulação do crescimento capilar; no entanto, mais estudos são necessários para corroborar esses achados.91
Plasma rico em plaquetasA intradermoterapia com plasma rico em plaquetas autólogo (PRP) é considerada adjuvante nos esquemas terapêuticos da AAGM. O mecanismo exato pelo qual o procedimento induz o crescimento capilar é desconhecido. Os fatores de crescimento derivados de plaquetas, liberados na intradermoterapia com PRP, podem levar ao aumento da expressão de colágeno tipo I e mRNA da metaloproteinase 1da matriz em fibroblastos dérmicos, aumento da regulação positiva de Bcl‐2, uma proteína antiapoptótica e ativação da β‐catenina e do FGF‐7 em fibroblastos dérmicos, ajudando a prolongar a fase anágena do cabelo.92 Esse conjunto de efeitos combinados pode contribuir para o aumento da densidade e a regeneração folicular. Foi demonstrado efeito adicional do PRP à terapia padrão ouro, minoxidil 5% e finasterida 1mg/dia.93
No Brasil, é considerada terapia experimental atrelada a protocolos de pesquisa aprovados por Comitês de Ética em Pesquisa.94 Apesar dos desfechos favoráveis no aumento de espessura e densidade capilar no uso do PRP na AAGM,95 uma recente metanálise mostrou não haver evidência científica suficiente para concluir sua eficácia em virtude da grande heterogeneidade de parâmetros usados para avaliação da técnica.96
Abordagens terapêuticas menos estabelecidasNutracêuticosOs micronutrientes desempenham papel essencial no ciclo folicular, em virtude do alto metabolismo e da renovação celular acelerada que ocorre nos folículos.97,98
Os regimes orais são de fácil aceitação para os pacientes; no entanto, muitos ainda carecem de comprovação de eficácia e sua prescrição deve ser individualizada, considerando‐se a relação risco‐benefício da suplementação. Polivitamínicos são vendidos sem prescrição médica, e existe uma preocupação quanto ao atraso do correto diagnóstico das doenças do couro cabeludo causado pelo uso indiscriminado dessas medicações. Até o momento, não há dados suficientes na literatura que suportem a suplementação de quaisquer substâncias, exceto em casos de deficiência comprovada laboratorialmente.
Enquanto a deficiência de biotina (vitamina B7) pode levar a alopecia, rash e unhas frágeis, a suplementação dessa vitamina em pacientes sem deficiência não demonstrou ser eficaz para o crescimento capilar.99 São considerados pacientes de risco para deficiência de biotina: ingestão de alta quantidade de ovos crus, síndromes de má‐absorção intestinal, alcoolismo, gestação, uso prolongado de antibióticos, e medicações como ácido valproico e isotretinoína.100 Considerando que essa deficiência é extremamente rara na população geral, a suplementação não deve ser recomendada de rotina pois pode levar a erros em diversos exames laboratoriais.101
A vitamina D modula o crescimento e a diferenciação de queratinócitos por meio de sua ligação com um receptor nuclear. Em casos de mutação nesse receptor, existe um quadro de resistência a vitamina D caracterizado, entre outros sinais, por rarefação de pelos e alopecia. A suplementação de vitamina D em pacientes sem essa mutação já foi estudada em alopecias não cicatriciais e mostrou resultados conflitantes.98
Embora sejam importantes fatores na síntese proteica e no crescimento celular, respectivamente, selênio e vitamina A em excesso são associados à queda de cabelo e também não devem ser repostos de rotina.102 A hipervitaminose A é um risco nessas situações e pode levar à toxicidade.95
A deficiência de ferro é comum, especialmente em mulheres, porém não está necessariamente associada a aumento do risco de AAG ou eflúvio telógeno.103
A deficiência de zinco também pode levar à alopecia, mas uma correlação mais forte foi vista na alopecia areata e eflúvio telógeno em comparação com a AAG, e mais estudos são necessários para avaliar sua eficácia no tratamento dessa doença.103
Extratos botânicosSaw palmetto (Serenoa repens), chá verde (Camellia sinensis), semente de abóbora (Curcurbita pepo) e licorice (Glycyrrhiza glabra) são fitoterápicos que podem ter ação inibitória da enzima 5αR e, portanto, poderiam eventualmente ser usados no tratamento da AAGM. Estudos maiores e comparativos com inibidores de 5αR estabelecidos como padrão ouro são necessários para caracterizar melhor seu grau de eficácia e perfil de segurança.104
CetoconazolAlém de suas propriedades antifúngicas e anti‐inflamatórias contra Malassezia para o tratamento da dermatite seborreica, foram descritas propriedades antiandrogênicas com possível mecanismo de inibição do DHT com o uso do cetoconazol.105 Loções ou xampus a 2% podem ser aplicados no couro cabeludo como terapia adjuvante. Estudos mais robustos são necessários para caracterizar melhor seu mecanismo de ação e eficácia.106
Latanoprosta/bimatoprosta – análogos de prostaglandinasO uso de análogos de prostaglandina para alopecia foi sugerido quando o crescimento de pelos das sobrancelhas e cílios foi observado em pacientes com glaucoma em uso de colírios a base dessas substâncias. Prostaglandina F2 (PGF2) e prostaglandina E2 (PGE2) induzem o crescimento capilar e prolongam a fase anágena.107 Dois estudos publicados com latanoprosta sugerem eficácia dessa medicação em doses variando de 0,005% a 0,1%; no entanto, os resultados ainda são inferiores aos do minoxidil tópico. Por esse motivo e pelo fato de essas medicações terem custo elevado, atualmente são pouco utilizadas para o tratamento da AAGM.108,109
Cirurgia restauradoraNa AAGM, áreas sem cabelo podem ser permanentemente cobertas novamente de forma cosmética, embora com densidade reduzida. A cirurgia de restauração capilar envolve a cirurgia de redução do couro cabeludo, transplante capilar ou uma combinação de ambos.
Nas últimas décadas, o transplante capilar evoluiu para um procedimento microcirúrgico no qual unidades foliculares de um a quatro fios são transplantadas em grande número e em alta densidade. Atualmente, existem duas técnicas para a extração das unidades foliculares: a Folicular Unit Extraction (FUE) e a Folicular Unit Transplantation (FUT). Na técnica FUT, uma faixa de couro cabeludo é retirada da região occipital; as unidades foliculares são separadas, lapidadas e implantadas na região receptora. Esse procedimento deixa uma cicatriz linear na região doadora. Na técnica FUE, as unidades foliculares são extraídas com micropunchs, manualmente ou com aparelhos automatizados, e posteriormente implantadas à semelhança do que ocorre com a FUT. A diferença é que, na FUE, as cicatrizes resultantes são puntiformes e esparsas pela área doadora, podendo ficar praticamente imperceptíveis.110
A cirurgia de restauração capilar não constitui cura para a calvície; portanto, mesmo após o procedimento, é necessário que se mantenha o tratamento da doença – caso contrário, encara‐se a possibilidade de evolução da condição e perda do resultado cosmético pela progressiva miniaturização dos fios nativos daquela região. Além disso, é importante excluir condições nas quais o transplante possa estar contraindicado, como dismorfismo corporal, expectativas irreais, alopecia areata e outras em que o procedimento não trará benefício estético, como no caso de áreas doadoras insuficientes e alopecias cicatriciais inflamatórias não controladas.111
ConclusãoA AAGM é entidade há muito tempo conhecida, com suas características clínicas, parâmetros diagnósticos, opções terapêuticas e instrumentos de análise de eficácia em constante evolução. As evidências aqui apresentadas são as mais recentes.
Nesta revisão, algumas abordagens terapêuticas não padronizadas, com análise de eficácia e segurança de insuficiente nível de evidência, não foram mencionadas.
O tratamento da AAGM deve ser personalizado, pois um dos fatores mais importantes para o sucesso terapêutico é melhorar a aderência por meio de estratégia terapêutica individualizada. No uso de fármacos ou terapias off label, o profissional tem o dever de informar o paciente bem como obter seu consentimento (verbal ou escrito), e isso deve ser registrado no prontuário. A avaliação da eficácia de determinado tratamento deve ser realizada, após pelo menos seis a 12 meses de uso.
Suporte financeiroNenhum.
Contribuição dos autoresGabriel Lazzeri Cortez: Concepção e o desenho do estudo; levantamento dos dados, ou análise e interpretação dos dados; redação do artigo ou revisão crítica do conteúdo intelectual importante; participação efetiva na orientação da pesquisa; revisão crítica da literatura; aprovação final da versão final do manuscrito.
Karime Hassun: Concepção e o desenho do estudo; levantamento dos dados, ou análise e interpretação dos dados; redação do artigo ou revisão crítica do conteúdo intelectual importante; participação efetiva na orientação da pesquisa; revisão crítica da literatura; aprovação final da versão final do manuscrito.
Luciana Ribeiro Patricio Linhares: Concepção e o desenho do estudo; levantamento dos dados, ou análise e interpretação dos dados; redação do artigo ou revisão crítica do conteúdo intelectual importante; participação efetiva na orientação da pesquisa; revisão crítica da literatura; aprovação final da versão final do manuscrito.
Verena Florenço: Concepção e o desenho do estudo; levantamento dos dados, ou análise e interpretação dos dados; redação do artigo ou revisão crítica do conteúdo intelectual importante; participação efetiva na orientação da pesquisa; revisão crítica da literatura; aprovação final da versão final do manuscrito.
Maria Valeria Bussamara Pinheiro: Concepção e o desenho do estudo; levantamento dos dados, ou análise e interpretação dos dados; redação do artigo ou revisão crítica do conteúdo intelectual importante; participação efetiva na orientação da pesquisa; revisão crítica da literatura; aprovação final da versão final do manuscrito.
Mauricio Mendonça do Nascimento: Concepção e o desenho do estudo; levantamento dos dados, ou análise e interpretação dos dados; redação do artigo ou revisão crítica do conteúdo intelectual importante; participação efetiva na orientação da pesquisa; revisão crítica da literatura; aprovação final da versão final do manuscrito.
Conflito de interessesNenhum.
Gostaríamos de expressar nossa sincera gratidão à revisora, Dra. Danielle Ioshimoto Shitara do Nascimento, cujos comentários e sugestões valiosas foram essenciais para o aprimoramento deste artigo.
Como citar este artigo: Cortez GL, Hassun K, Linhares LRP, Florenço V, Pinheiro MVB, Nascimento MM. Male androgenetic alopecia. An Bras Dermatol. 2025;100. https://doi.org/10.1016/j.abd.2024.08.004.
Trabalho realizado no Departamento de Dermatologia, Escola Paulista de Medicina, Universidade Federal de São Paulo, São Paulo, SP, Brasil.