A psoríase juvenil é uma doença inflamatória crônica da pele que afeta 0,6% a 1,4% dos pacientes pediátricos.1 Está associada a várias comorbidades, entre as quais artrite psoriática, doenças psiquiátricas, diabetes melito 1 e 2, hipertensão, obesidade, hiperlipidemia e doença de Crohn;2–4 portanto, é essencial instituir um tratamento precoce e adequado. Devido aos efeitos adversos, as opções terapêuticas sistêmicas em crianças são limitadas. Até o momento, poucas terapias biológicas foram aprovadas para tratamento da psoríase grave. O adalimumabe foi aprovado pela Agência Europeia de Medicamentos (European Medicines Agency [EMA]) para o tratamento da psoríase em placas grave em pacientes a partir dos 4 anos e, recentemente, um ensaio clínico randomizado e duplo‐cego demonstrou sua segurança e superioridade em comparação ao metotrexato.5 No Chile, não há reembolso econômico para terapias biológicas, que devem ser pagas integralmente pelo paciente; portanto, o acesso a essas terapias é limitado devido aos custos. O objetivo do presente artigo é apresentar a experiência dos autores com o uso de adalimumabe em pacientes pediátricos com psoríase grave.
Pacientes < 18 anos com psoríase grave que não responderam às terapias tópicas e/ou sistêmicas não biológicas foram selecionados para receber adalimumabe 0,8mg/kg por via subcutânea na semana 0 e depois em semanas alternadas a partir da semana 1. Eles foram acompanhados por pelo menos 40 semanas, com avaliações clínicas mensais. O Índice de Área e Gravidade da Psoríase (PASI, do inglês Psoriasis Area and Severity Index) e a escala de 6 pontos da Avaliação Médica Global (Physician Global Assessment [PGA]) foram avaliados em todas as visitas.
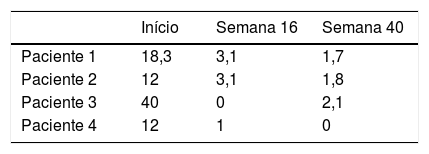
Quatro pacientes foram selecionados, três do sexo feminino. A idade mediana ao diagnóstico da psoríase foi de 11 anos e a duração média da doença antes do uso de adalimumabe foi de 4,2 anos. Dois pacientes apresentavam histórico familiar positivo para psoríase, mas não em parentes de primeiro grau. Todos os pacientes apresentavam psoríase em placas grave. O paciente 4 apresentou psoríase genital grave e artrite psoriática HLA B27+, com comprometimento das articulações sacroilíacas, que não responderam ao tratamento com metotrexato. O paciente 2 tinha sobrepeso. Não foram identificadas outras comorbidades metabólicas, articulares ou psiquiátricas. No início do estudo, os seguintes escores foram observados: PASI mediano 21,3, PGA mediano 4 e superfície corporal mediana 29%. Na semana 16, o escore PASI de três dos quatros pacientes foi 75 e a pontuação mediana na PGA foi 2. Na semana 40, o PASI mediano foi de 1,7; todos os pacientes atingiram apresentaram PASI 75 e dois, PASI 90. Todos os pacientes atingiram uma pontuação PGA de 1‐0 (tabelas 1 e 2). Apenas eventos adversos leves foram relatados: infecção do trato respiratório superior (3 casos), infecção do trato respiratório inferior (3 casos) e dor de cabeça (1 caso).
Não foram encontrados relatos anteriores em pacientes pediátricos chilenos com psoríase grave tratados com adalimumabe. Na presente série, o tratamento com adalimumabe 0,8mg/kg em pacientes pediátricos que não responderam ao tratamento não biológico resultou em melhorias significativas no PASI (escore 75 na semana 16, que foram mantidos até a semana 40).
A psoríase juvenil tem sido associada a comorbidades importantes; a taxa geral estimada foi relatada como duas vezes mais alta do que em pacientes sem psoríase.1 Apenas um dos pacientes apresentou artrite psoriática, com boa taxa de resposta, com melhoria dos sintomas e da qualidade de vida. Considerando as comorbidades da psoríase juvenil, o importante prejuízo na qualidade de vida e a literatura recentemente publicada, o adalimumabe parece ser uma opção eficaz e segura para pacientes pediátricos com psoríase grave. No entanto, como não há reembolso econômico para essas terapias no Chile, o tratamento da psoríase grave que não respondeu ao tratamento convencional se torna desafiador.
Suporte financeiroNenhum.
Contribuição dos autoresDaniela Armijo Fernandez: Aprovação da versão final do manuscrito; elaboração e redação do manuscrito; obtenção, análise e interpretação dos dados; participação efetiva na orientação da pesquisa; revisão crítica da literatura; revisão crítica do manuscrito.
Fernando Valenzuela: Aprovação da versão final do manuscrito; concepção e planejamento do estudo; obtenção, análise e interpretação dos dados; participação efetiva na orientação da pesquisa; participação intelectual em conduta propedêutica e/ou terapêutica de casos estudados; revisão crítica do manuscrito.
Gustavo Saint‐Pierre Contreras: Aprovação da versão final do manuscrito; elaboração e redação do manuscrito; obtenção, análise e interpretação dos dados; revisão crítica da literatura.
Andrea Cortés González: Aprovação da versão final do manuscrito; obtenção, análise e interpretação dos dados; participação intelectual em conduta propedêutica e/ou terapêutica de casos estudados; revisão crítica do manuscrito.
Conflitos de interesseNenhum.
Como citar este artigo: Armijo D, Valenzuela F, Saint-Pierre G, Cortés A. Adalimumab for severe psoriasis in Chilean paediatric patients. An Bras Dermatol. 2020;95:105–6.
Trabalho realizado no Hospital Clinico Universidad de Chile, Santiago, Chile.