Varicela é doença infectocontagiosa causada pelo vírus varicela‐zóster (VZV) transmitida por aerossóis ou contato direto com as lesões cutâneas ativas. Em crianças imunocompetentes, geralmente é doença autolimitada e benigna, porém formas mais graves, potencialmente fatais, podem ocorrer em maiores de 12 anos e em pacientes imunossuprimidos.
Relato do casoPaciente do sexo masculino, 22 anos, referia lesões cutâneas pruriginosas havia quatro dias, inicialmente no abdome com disseminação para o restante do tegumento, precedidas por dor epigástrica irradiada para mesogástrio e hipogástrio, de intensidade moderada e padrão contínuo, associado a hiporexia, náuseas e vômitos. Negava febre, sintomas respiratórios ou outras queixas. Transplantado renal havia seis meses por má formação vesical, e desde então em terapia imunossupressora com tacrolimus 3mg/dia, micofenolato mofetil 2g/dia e prednisona 5mg/dia. Negava antecedente de varicela e apresentava cartão vacinal incompleto, sem registro de vacinação contra varicela.
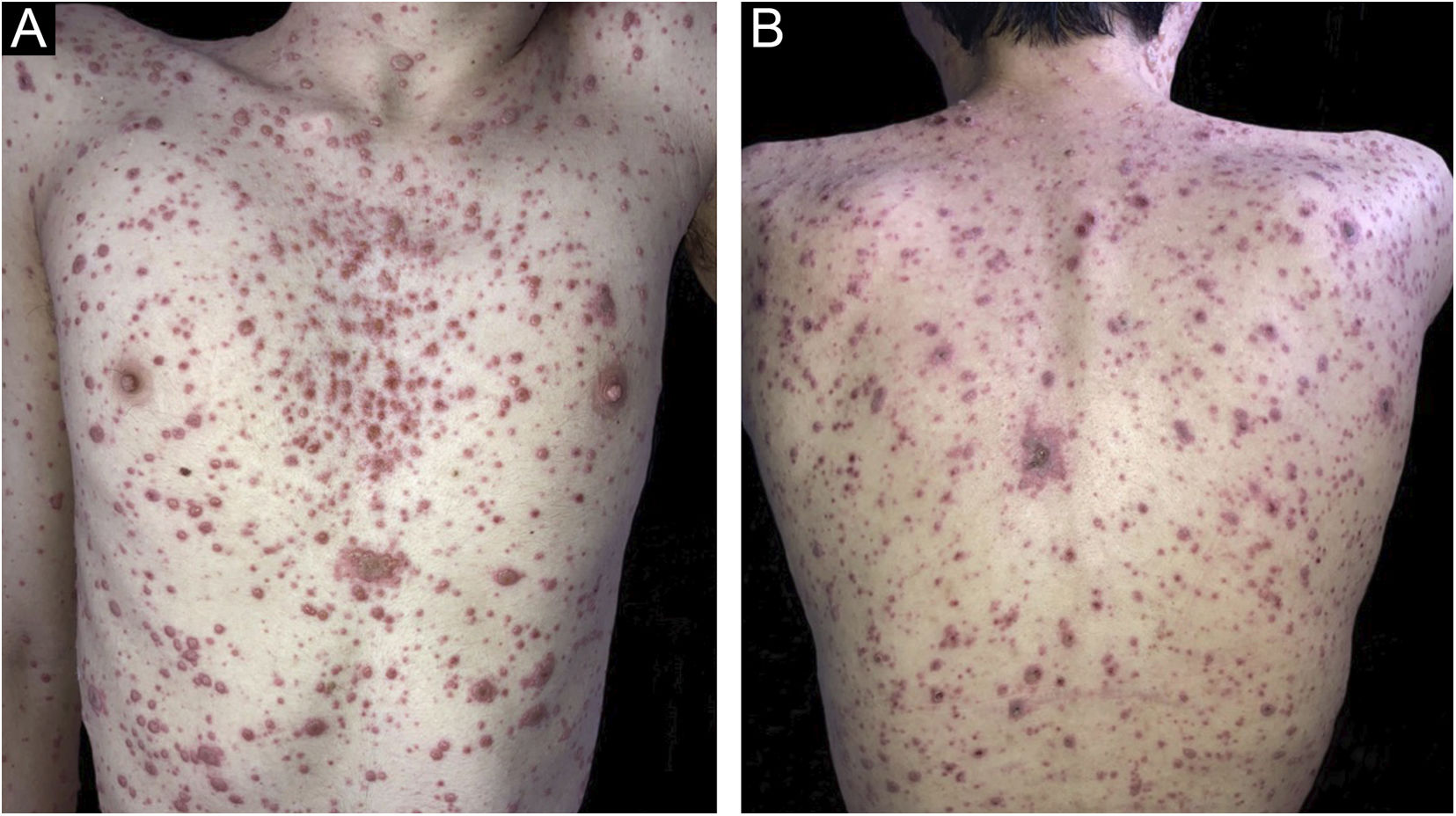
Ao exame, observavam‐se inúmeras vesículas e vesico‐bolhas sobre base eritematosa, disseminadas, particularmente no tronco e face (figs. 1 e 2), incluindo mucosa oral e genital.
Na admissão, foram solicitados exames laboratoriais, exame citológico e biopsia de vesícula íntegra. Além disso, iniciou‐se de imediato tratamento com aciclovir intravenoso na dose de 10mg/kg de 8 em 8 horas em regime de internação e isolamento hospitalar.
O exame citológico de Tzank evidenciou esfregaço com células escamosas multinucleadas, núcleos grandes e aspecto em vidro fosco, alterações citológicas compatíveis com efeito citopático causado pelo herpes vírus (fig. 3A).
O exame anatomopatológico demonstrou lesão bolhosa com clivagem intraepidérmica contendo células epiteliais aumentadas, citopáticas, multinucleadas e com núcleos amoldados, com a cromatina em “vidro fosco” (fig. 3B). A investigação adicional por imuno‐histoquímica para anticorpos HSV‐1 e 2 e coloração de Grocott‐Gomori e Ziehl‐Nielsen resultou negativa.
Os exames laboratoriais evidenciaram elevação progressiva de enzimas hepáticas (fig. 4) e canaliculares. Realizado RT‐PCR para COVID‐19 durante a internação, apesar de assintomático respiratório, com resultado positivo. Realizada tomografia computadorizada (TC) de tórax com pequenos focos de opacidades e consolidações nodulares esparsas pelo parênquima pulmonar, predominando na periferia do pulmão esquerdo, algumas com halo em vidro fosco, alterações sugestivas de infecção viral mais compatíveis com infecção por VZV do que pelo SARS‐CoV‐2. Realizado TC de abdome apresentando hepatoesplenomegalia homogênea.
Durante a internação, as lesões cutâneas aumentaram em número, algumas de padrão necro‐hemorrágicas, associada às complicações hepáticas e pulmonares. Após uma semana do início do tratamento, observou‐se melhora dermatológica e sistêmica. Após duas semanas, o paciente apresentava todas as lesões em fase de crostas e evoluindo para cicatrização, melhora da dor abdominal e progressiva regressão das enzimas hepáticas e canaliculares.
O paciente recebeu alta hospitalar com transição de aciclovir (D15) para via oral, na dose de 800mg, cinco vezes/dia até completar 21 dias de tratamento. Na reavaliação, encontrava‐se plenamente recuperado, em bom estado geral e com lesões cicatrizadas.
Relatamos caso clínico de paciente transplantado renal em uso de terapia imunossupressora, sem histórico de varicela pregressa, que não apresentava vacinação contra varicela e não havia sido submetido à atualização do cartão vacinal pré‐transplante.
O VZV é alfa‐herpes vírus humano patogênico que causa varicela como infecção primária. É doença altamente contagiosa, mais comumente observada em crianças menores de 10 anos.1
Sua transmissão ocorre em hospedeiros suscetíveis por meio do contato com aerossóis de secreções nasofaríngeas de indivíduo infectado ou por contato cutâneo direto com fluido vesicular de lesões cutâneas ativas e período de incubação de 10 a 21 dias. Considera‐se que o período de infecciosidade dura de 48 horas antes do início da erupção cutânea até que as lesões cutâneas tenham evoluído totalmente para a fase de crostas.2
Em crianças imunocompetentes, é geralmente doença autolimitada e benigna, evoluindo para a cura dentro de 7 a 10 dias. No entanto, formas mais graves podem ocorrer em maiores de 12 anos e em pacientes imunossuprimidos. Nesses, a infecção pode apresentar período de febre mais prolongado, número maior de lesões, com duração prolongada e risco de complicações.3,4
A complicação mais comum é a infecção das lesões pelo Staphylococcus aureus ou pelo Streptococcus pyogenes, expressando‐se desde piodermites mais simples até celulite, síndrome do choque tóxico – estafilocócico ou estreptocócico, e mesmo fasciíte necrosante.5 Além disso, complicações neurológicas, pneumonia e hepatite também não são raras.6,7 As alterações neurológicas mais frequentemente descritas são ataxia cerebelar e encefalite.6
Pneumonia ocorre com frequência em pacientes imunossuprimidos, e é a principal causa de óbito. Os sintomas iniciam logo após o surgimento do rash e incluem tosse, dispneia e hemoptise. A TC mostra infiltrado nodular e intersticial difuso. Antes da terapia antiviral e do suporte da terapia intensiva, a mortalidade dos casos chegava a 30%, com rápida evolução para óbito. Atualmente, a mortalidade é menor que 10%.6
Em pacientes imunossuprimidos, a lesão hepática se dá por efeito citopático viral direto aos hepatócitos. A clínica é de dor abdominal de variável intensidade, e as lesões cutâneas podem preceder, ser coincidente ou serem posteriores à hepatite, o que pode retardar o diagnóstico específico.6,7
O diagnóstico da infecção pelo VZV geralmente é clínico; no entanto, investigação adicional é recomendável, incluindo sorologia, cultura, biopsia e teste de Tzanck.
Nos pacientes adultos, indivíduos que apresentam complicações e/ou imunocomprometidos, o tratamento com antivirais é obrigatório. A terapia oral é utilizada para indivíduos imunocompetentes sem evidência de complicações, por 5 a 7 dias. Nos imunocomprometidos, indica‐se aciclovir intravenoso na dose de 10mg/kg de 8 em 8 horas até que haja melhora significante dos sintomas e que não ocorram novas lesões. Recomenda‐se transição para terapia oral, que deve ser mantida até que as lesões evoluam para fase de crostas e cicatrizes.8
A prevenção da infecção é de suma importância para a crescente população de receptores de transplante de órgãos sólidos e em imunossuprimidos por diferentes razões. Recomenda‐se imunização com a vacina contra varicela para os pacientes de risco, pelo menos quatro semanas antes do transplante ou terapêutica imunossupressora.9,10 É importante que esses pacientes recebam duas doses da vacina contra varicela, se possível, com intervalo mínimo de quatro semanas entre as doses para indivíduos com idade ≥ 13 anos e intervalo mínimo de três meses para indivíduos de 1 a 12 anos.9,10
Suporte financeiroNenhum.
Contribuição dos autoresIngrid Rocha Meireles Holanda: Concepção e planejamento do estudo; elaboração e redação do manuscrito; obtenção, análise e interpretação dos dados; participação efetiva na orientação da pesquisa; participação intelectual em conduta propedêutica e/ou terapêutica de casos estudados; revisão crítica da literatura; revisão crítica do manuscrito; aprovação da versão final do manuscrito.
Marina Oliveira Dias: Concepção e planejamento do estudo; elaboração e redação do manuscrito; obtenção, análise e interpretação dos dados; participação intelectual em conduta propedêutica e/ou terapêutica de casos estudados; revisão crítica da literatura; revisão crítica do manuscrito.
Rebecca Perez de Amorim: Elaboração e redação do manuscrito; obtenção, análise e interpretação dos dados; participação intelectual em conduta propedêutica e/ou terapêutica de casos estudados; revisão crítica da literatura; revisão crítica do manuscrito.
Aline Lutz Garcia: Elaboração e redação do manuscrito; obtenção, análise e interpretação dos dados; participação intelectual em conduta propedêutica e/ou terapêutica de casos estudados; revisão crítica da literatura; revisão crítica do manuscrito.
Ricardo Augusto Monteiro de Barros Almeida: Elaboração e redação do manuscrito; obtenção, análise e interpretação dos dados; participação intelectual em conduta propedêutica e/ou terapêutica de casos estudados; revisão crítica da literatura; revisão crítica do manuscrito.
Silvio Alencar Marques: Concepção e planejamento do estudo; elaboração e redação do manuscrito; participação efetiva na orientação da pesquisa; participação intelectual em conduta propedêutica e/ou terapêutica de casos estudados; revisão crítica da literatura; revisão crítica do manuscrito; aprovação da versão final do manuscrito.
Conflito de interesseNenhum.
Como citar este artigo: Holanda IRM, Dias MO, Amorim RP, Garcia AL, Almeida RAMB, Marques SA. Disseminated varicella with systemic implications in a renal transplant recipient. An Bras Dermatol. 2023;98:875–8.
Trabalho realizado na Universidade Estadual Paulista, Faculdade de Medicina de Botucatu, SP, Brasil.