A rubeose facial diabética é um eritema facial persistente em pacientes com diabetes. A patogênese real não foi estudada. No entanto, especula‐se que seja uma microangiopatia diabética cutânea.
ObjetivoExaminar a correlação entre a gravidade do eritema facial e as possíveis causas das complicações diabéticas microvasculares, a saber, estresse oxidativo, hiperglicemia e acúmulo cutâneo de produtos finais de glicação avançada.
MétodosPacientes diagnosticados com diabetes tipo 2 (n = 32) foram incluídos no estudo. O índice de eritema facial foi medido com Mexameter MX18. A acumulação cutânea de glicação avançada foi estimada medindo a autofluorescência da pele com glicação avançada Reader (DiagnOptics Technologies BV – Groningen, Holanda). Os níveis de hemoglobina glicada, estado antioxidante total e malondialdeído foram mensurados pelo ensaio TBARS. A correlação entre as variáveis selecionadas foi avaliada pelo teste de Spearman; valores de p ≤ 0,05 foram considerados estatisticamente significativos.
ResultadosObservou‐se uma correlação estatisticamente significativa entre estado antioxidante total e o índice de eritema facial (ρ = 0,398; p = 0,024). A correlação entre o índice de eritema facial e malondialdeído, autofluorescência da pele, hemoglobina glicada, índice de massa corporal, duração do diabetes e idade não foi estatisticamente significativa.
Limitações do estudoEste foi um estudo observacional. A elevação do estado antioxidante total pode ter sido causada por vários fatores que também podem ter influenciado o desenvolvimento de rubeose facial, incluindo hiperbilirrubinemia e hiperuricemia.
ConclusõesOs resultados foram diferentes do esperado. O estado antioxidante total estava positivamente correlacionado com o índice de eritema facial; no entanto, não houve correlação com estresse oxidativo e autofluorescência da pele. Novos estudos devem ser realizados para revelar a causa da elevação do estado antioxidante total em pacientes com rubeose facial.
Diabetes mellitus (DM) é uma doença caracterizada por hiperglicemia persistente, seja por destruição autoimune de células β pancreáticas e produção deficiente de insulina (DM1), seja pela falência dos tecidos periféricos em responder adequadamente à insulina (DM2). DM também pode ser causado por doença pancreática ou trauma, bem como gravidez, certos defeitos genéticos, medicamentos e endocrinopatias.1 O DM2 é responsável por até 90% de todos os casos de diabetes, estando fortemente associado à obesidade e a uma predisposição genética.1,2 A prevalência global de DM foi estimada em 8,8% em 2017.2 O DM está associado ao desenvolvimento de complicações macro e microvasculares, nomeadamente retinopatia, neuropatia e nefropatia. A prevalência de retinopatia entre os pacientes com DM é estimada em 34,6%; aproximadamente um terço desenvolve retinopatia diabética com risco de perda de visão.3 Neuropatia e nefropatia diabéticas são causas comuns de amputações de membros inferiores e doença renal terminal, respectivamente.4,5 O desenvolvimento de complicações microvasculares está relacionado à hiperglicemia crônica, como demonstrado no Estudo Prospectivo de Diabetes do Reino Unido (UKPDS) e no Estudo de Controle e Complicações do Diabetes/Estudo das Intervenções e Complicações do Diabetes (DCCT/EDIC).6–8 Portanto, o papel do diagnóstico e do tratamento precoces do DM não pode ser subestimado.
A rubeose facial diabética é uma manifestação cutânea do DM. É caracterizada por um eritema facial difuso e persistente, mais comum entre os pacientes diabéticos. O aumento do número e diâmetro das vênulas superficiais nas regiões malares de pacientes diabéticos foi descrito histologicamente.9 Devido à falta de estudos recentes nesse campo, a prevalência e a patogênese da rubeose diabética não são conhecidas. No entanto, especula‐se que seja um tipo de microangiopatia diabética e, portanto, poderia ser usada como um marcador potencial para outras complicações microvasculares diabéticas. A literatura não apresenta nenhum estudo que tenha realmente examinado essa associação.9–11
O estresse oxidativo é considerado um elo crucial entre a hiperglicemia e o desenvolvimento de microangiopatias diabéticas.12,13 Estresse oxidativo é definido como uma produção excessiva de espécies reativas de oxigênio (ROS), como superóxido, hidroxila e peróxido de hidrogênio, e consequente insuficiência do sistema antioxidante em combatê‐la.14 Brownlee postulou que a hiperglicemia causa superprodução de superóxido pela cadeia de transporte de elétrons mitocondrial, que por sua vez ativa quatro vias que promovem o dano microvascular no diabetes: um aumento no fluxo de glicose por meio da via do poliol, aumento da produção de produtos finais de glicação avançada (AGEs) derivados de glicose, indução da atividade da proteína quinase‐C (PKC) e suprarregulação da atividade da via da hexosamina.13–18
Os AGEs são produtos de uma glicação não enzimática ou reação de Maillard, que é aumentada em casos de hiperglicemia e estresse oxidativo.19 Os AGEs formam ligações cruzadas anormalmente estáveis com colágeno e alteram proteínas intracelulares, incluindo fatores reguladores da transcrição. A glicação relacionada ao AGE das proteínas da cadeia respiratória mitocondrial estimula a produção adicional de ROS.17 A ativação de receptores de AGEs (RAGEs) induz a expressão do fator nuclear κB (NF‐κB), pró‐inflamatório.20 O fator endotelial de crescimento vascular (VEGF) é uma proteína angiogênica sinalizadora crucial que promove a proliferação e a migração de células endoteliais e aumenta a permeabilidade do vaso.20 O NF‐kB aumenta a expressão do VEGF e desencadeia a neovascularização da retina, que é uma característica da retinopatia diabética proliferativa.21 Alterações na microvasculatura conjuntival também foram observadas em pacientes com retinopatia diabética.22,23
Os processos mencionados também poderiam promover a angiogênese na pele facial, manifestada clinicamente como rubeose facial diabética. Portanto, o objetivo deste estudo foi examinar a possível correlação entre estresse oxidativo, hiperglicemia, acúmulo cutâneo de AGEs e o grau de rubeose facial.
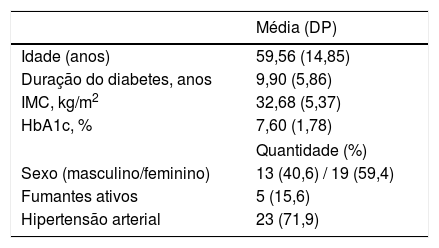
MétodosPopulação de estudoPacientes diagnosticados com DM2 (n = 32) de acordo com os critérios diagnósticos da Organização Mundial da Saúde (OMS, 2011) foram incluídos no estudo.1 Uma entrevista estruturada foi realizada para obter dados sobre a duração do diabetes, tabagismo, uso de medicamentos e presença de hipertensão. Indivíduos com história de eventos cardiovasculares ou policitemia, bem como sinais clínicos de doença aguda, dano actínico ou condições inflamatórias da pele facial, como dermatite seborreica, lúpus eritematoso sistêmico, rosácea papulopustular, eczema, psoríase e dermatomiosite foram excluídos do estudo. O índice de massa corporal (IMC) foi calculado no exame físico. As medições foram realizadas durante o inverno e início da primavera. Todos os pacientes foram classificados como fototipos I‐II de Fitzpatrick, sem sinais de bronzeamento da pele. Esses dados estão resumidos na tabela 1. Todos os participantes assinaram um termo de consentimento livre e esclarecido. O protocolo do estudo foi aprovado pelo Comitê de Ética da Universidade de Riga Stradins (aprovação n° 79/25.01.2018).
Características dos pacientes com diabetes mellitus tipo 2
| Média (DP) | |
|---|---|
| Idade (anos) | 59,56 (14,85) |
| Duração do diabetes, anos | 9,90 (5,86) |
| IMC, kg/m2 | 32,68 (5,37) |
| HbA1c, % | 7,60 (1,78) |
| Quantidade (%) | |
| Sexo (masculino/feminino) | 13 (40,6) / 19 (59,4) |
| Fumantes ativos | 5 (15,6) |
| Hipertensão arterial | 23 (71,9) |
IMC, índice de massa corporal.
Mexamater MX18 (Courage & Khazaka electronic GmbH – Colônia, Alemanha), um dispositivo colorimétrico que emite comprimentos de onda específicos e analisa a luz que é refletida da pele, foi usado para avaliar rubeose facial ou eritema facial em pacientes diabéticos e no grupo controle. Isso possibilita calcular a quantidade de luz absorvida pela hemoglobina, apresentando‐a como um índice de eritema (IE) em unidades arbitrárias de eritema (0–999 UAE).24 Antes da medição, os pacientes foram autorizados a descansar por 30 minutos em uma sala com uma temperatura estável de 23°C. O IE foi medido em cinco locais: malar esquerda e direita, região frontal, nariz e mento. O valor médio do IE para cada paciente foi calculado para análise posterior.
Medição de autofluorescência da peleOs níveis de AGE na pele foram estimados de forma não invasiva pela mensuração da autofluorescência da pele. As medições foram realizadas usando o AGE Reader (DiagnOptics Technologies BV – Groningen, Holanda) em uma sala a 23°C, com os pacientes em jejum. O mecanismo de ação do AGE Reader se baseia no fato de que certos AGEs têm propriedades fluorescentes. Uma área cutânea de 4cm2 é estimulada por luz ultravioleta. Posteriormente, um espectrômetro óptico detecta a luz emitida pela pele. O software estima a concentração relativa de AGEs na pele e a apresenta em unidades arbitrárias de eritema (UAE). As medidas foram feitas na face interna do antebraço direito, a aproximadamente 5cm distalmente da fossa cubital.
Análise laboratorialAmostras de sangue foram coletadas da veia antecubital dos pacientes diabéticos após jejum noturno.
O estado antioxidante total (TAS) foi medido por espectrofotometria automatizada (RX Daytona Analyser; Randox Laboratories, Ltd. – Reino Unido) no plasma de pacientes diabéticos. O kit RANDOX TAS (Cat. NX 2332; Randox Laboratories, Ltd. – Reino Unido) foi utilizado de acordo com as instruções do fabricante. O plasma foi obtido a partir de tubos com heparina de lítio. As amostras foram centrifugadas a 3.500rpm e armazenadas a −20°C até a análise. O ABTS® (2,2’‐azino‐di‐ 3‐etilbenzotiazolin sulfonato) é incubado com metamioglobina e H2O2 para produzir o radical cátion ABTS®*+, caracterizado pela cor azul esverdeada, medido a 600nm. Os antioxidantes no plasma dos pacientes diminuem a formação dessa cor proporcionalmente à sua concentração.25,26
O malondialdeído (MDA) foi medido por espectrofotometria no plasma de pacientes diabéticos com o leitor de microplaca de absorbância Sunrise (TECAN – Suíça). Utilizou‐se o ensaio de substâncias reativas ao ácido tiobarbitúrico (TBARS) OxiSelect™ (Cat No. STA‐330, CellBiolabs, Inc., Estados Unidos) de acordo com as instruções do fabricante. O plasma foi obtido em tubos que continham EDTA. As amostras foram centrifugadas a 3.500rpm e armazenadas a −80°C até a análise. As amostras foram incubadas com TBA a 95°C. Após um breve período de tempo, os resultados foram obtidos espectrofotometricamente. Para avaliar o conteúdo de MDA no plasma dos pacientes, os resultados foram então comparados com a curva padrão para MDA.27
A hemoglobina glicada (HbA1c) foi medida por imunoensaio turbidimétrico de inibição (TINIA) em hemolisado, usando o analisador Cobas Integra (Roche – Mannheim, Alemanha).
Análise estatísticaOs dados foram analisados no software SPSS (v. 23). A correlação entre as variáveis selecionadas foi avaliada pelo teste de Spearman devido ao pequeno tamanho da amostra e à distribuição não normal de vários dados, como observado pelo teste de Shapiro‐Wilk; valores de p ≤ 0,05 foram considerados estatisticamente significantes.
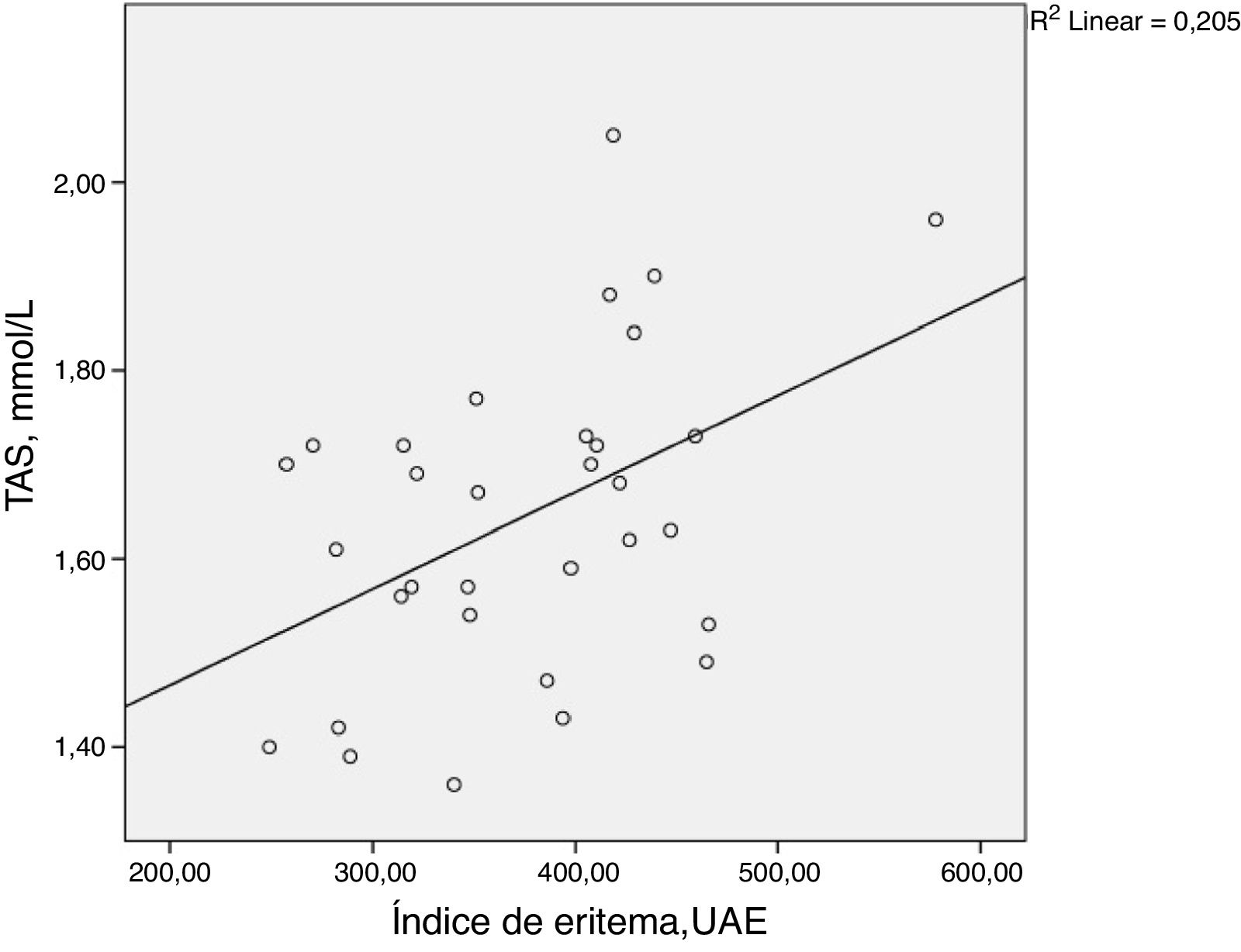
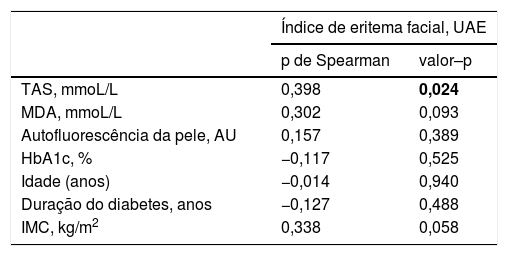
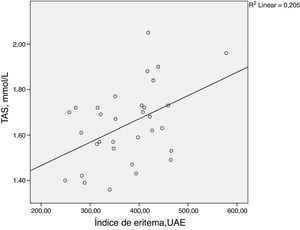
ResultadosObservou‐se uma correlação estatisticamente significativa entre o TAS e índice de eritema facial (ρ = 0,398; p = 0,024). MDA, autofluorescência da pele, níveis de HbA1c, IMC, duração do diabetes e idade não apresentaram correlação estatisticamente significante com o índice de eritema facial. Os resultados estão resumidos na tabela 2 e na figura 1.
Correlação de postos de Spearman entre o eritema facial e vários parâmetros medidos. Valores de p ≤ 0,05 foram considerados estatisticamente significativos e estão destacados em negrito
| Índice de eritema facial, UAE | ||
|---|---|---|
| p de Spearman | valor–p | |
| TAS, mmoL/L | 0,398 | 0,024 |
| MDA, mmoL/L | 0,302 | 0,093 |
| Autofluorescência da pele, AU | 0,157 | 0,389 |
| HbA1c, % | −0,117 | 0,525 |
| Idade (anos) | −0,014 | 0,940 |
| Duração do diabetes, anos | −0,127 | 0,488 |
| IMC, kg/m2 | 0,338 | 0,058 |
IMC, índice de massa corporal; MDA, malondialdeído; TAS, estado antioxidante total; UAE, unidades arbitrárias de eritema.
A rubeose facial diabética é uma manifestação cutânea do DM na forma de eritema facial. Embora a literatura não apresente estudos sobre o tema, havia uma crença amplamente aceita de que essa seria uma forma de microangiopatia diabética.10 Os resultados deste estudo contradizem essa crença.
A hiperglicemia e o acúmulo de AGEs promovem o surgimento de complicações microvasculares no diabetes.16,19 O exame de biópsias de pele demonstrou que o acúmulo de AGEs está associado à presença de gravidade das complicações microvasculares no diabetes. Em estudos prospectivos, os níveis de AGEs nas biópsias cutâneas poderiam até mesmo predizer o risco de desenvolvimento de retinopatia diabética. A autofluorescência da pele é um método não invasivo e validado para estimar os níveis de AGE na pele. A associação entre a autofluorescência da pele e o desenvolvimento de complicações microvasculares diabéticas foi demonstrada em uma revisão sistemática.19 Esperava‐se que pacientes com rubeose facial diabética apresentassem hiperglicemia e acúmulo de AGEs cutâneos mais pronunciados. No entanto, no presente estudo, o índice de eritema facial não estava correlacionado com HbA1c nem com autofluorescência da pele.
O estresse oxidativo é considerado um dos fatores que liga a hiperglicemia ao desenvolvimento de microangiopatias.15,16 Vários estudos apontam o aumento do estresse oxidativo em pacientes com DM, que é maior em pacientes com retinopatia diabética, neuropatia e nefropatia.28,29 Parecia plausível supor que o estresse oxidativo desempenhasse um papel importante no desenvolvimento da rubeose facial diabética.
MDA é um marcador de peroxidação lipídica, especialmente em caso de estresse oxidativo. Estudos anteriores observaram uma elevação nesse marcador em casos de diabetes.30 Pacientes com complicações microvasculares no diabetes tendem a apresentar níveis mais altos de MDA do que aqueles com diabetes não complicada, conforme medido pelo ensaio TBARS.31 Esse fato é especialmente observado em pacientes diabéticos com neuropatias e feridas crônicas, bem como em casos de retinopatia diabética.28,32
No presente estudo, não se observou uma correlação significativa entre os níveis de MDA e o grau de eritema facial. Ensaios cromatográficos são considerados o padrão ouro para a determinação dos níveis de MDA no plasma devido a sua maior especificidade. No entanto, esse método é dispendioso e oneroso; assim, o ensaio TBARS ainda é amplamente utilizado.33
O plasma sanguíneo contém vários compostos com propriedades antioxidantes, como bilirrubina, ácido úrico, ácido ascórbico, polifenóis e grupos tiol proteicos. É tecnicamente difícil mensurar a contribuição de cada antioxidante separadamente. Portanto, TAS é um método conveniente para descrever a capacidade antioxidante global de antioxidantes conhecidos e desconhecidos no plasma, considerando seus efeitos sinérgicos e antagônicos; como esse método não mede a contribuição de enzimas antioxidantes para a capacidade antioxidante do plasma é uma limitação.25,34–36
No presente estudo, o eritema facial em pacientes diabéticos foi positivamente correlacionado com o TAS. Esse achado também foi diferente do esperado. Estudos anteriores relataram níveis de TAS reduzidos em pacientes com diabetes mellitus.37,38 Níveis mais baixos de TAS foram observados em pacientes com retinopatia diabética quando comparados com aqueles com diabetes não complicada.39 Esse achado é geralmente interpretado como um sinal de estresse oxidativo. Incomumente, alguns estudos relatam um aumento do nível de TAS em pacientes diabéticos.40,41 Alterações nos níveis de TAS podem ser mediadas por vários fatores; portanto, os resultados devem sempre ser interpretados com cautela.25,34–36 Por exemplo, sabe‐se que a bilirrubina eleva os níveis de TAS.42 A bilirrubina atua como um antioxidante endógeno e também promove a angiogênese via VEGF. Níveis de bilirrubina sérica clinicamente elevados em pacientes diabéticos têm sido associados a um menor risco para o desenvolvimento de pé diabético e amputação de membros inferiores.37,43 Experimentos in vivo em ratos diabéticos demonstraram melhor cicatrização da ferida após a aplicação de pomada contendo bilirrubina. Nesse caso, a bilirrubina promoveu a angiogênese na ferida diabética, aumentando a expressão do VEGF.44 Além disso, níveis séricos aumentados de ácido úrico também podem influenciar o TAS e têm sido associados a um risco maior de surgimento de retinopatia diabética.25,34–36,45 Teoricamente, tanto o ácido úrico quanto a bilirrubina podem causar elevação do TAS, bem como promover o desenvolvimento de rubeose facial diabética. Infelizmente, esses parâmetros não foram avaliados na presente investigação. É aconselhável medir os níveis de bilirrubina e ácido úrico e examinar sua associação com o surgimento de eritema facial em pacientes diabéticos.
ConclusõesA rubeose facial diabética não foi associada a níveis elevados de HbA1c, autofluorescência da pele e MDA. No entanto, observou‐se uma correlação positiva significativa com o TAS. Isso contradiz as expectativas originais. A elevação do TAS pode ter sido causada por vários fatores que também podem ter influenciado o desenvolvimento de rubeose facial, incluindo hiperbilirrubinemia e hiperuricemia. Essa hipótese deve ser testada em estudos futuros. A associação direta entre rubeose facial diabética e retinopatia diabética também deve ser investigada.
Suporte financeiroRiga Stradins University, Bolsas de Doutorado.
Contribuição dos autoresAleksejs Zavorins: Análise estatística; aprovação da versão final do manuscrito; concepção e planejamento do estudo; elaboração e redação do manuscrito; obtenção, análise e interpretação dos dados; participação efetiva na orientação da pesquisa; participação intelectual em conduta propedêutica e/ou terapêutica de casos estudados; revisão crítica da literatura; revisão crítica do manuscrito.
Alise Silova: Aprovação da versão final do manuscrito; concepção e planejamento do estudo; obtenção, análise e interpretação dos dados; participação efetiva na orientação da pesquisa; participação intelectual em conduta propedêutica e/ou terapêutica de casos estudados; revisão crítica da literatura; revisão crítica do manuscrito.
Julija Voicehovska: Aprovação da versão final do manuscrito; concepção e planejamento do estudo; elaboração e redação do manuscrito; obtenção, análise e interpretação dos dados; participação efetiva na orientação da pesquisa; participação intelectual em conduta propedêutica e/ou terapêutica de casos estudados; revisão crítica da literatura; revisão crítica do manuscrito.
Janis Kisis: Aprovação da versão final do manuscrito; concepção e planejamento do estudo; obtenção, análise e interpretação dos dados; participação efetiva na orientação da pesquisa; participação intelectual em conduta propedêutica e/ou terapêutica de casos estudados; revisão crítica da literatura; revisão crítica do manuscrito.
Conflito de interessesNenhum.
Como citar este artigo: Zavorins A, Silova A, Voicehovska J, Kisis J. Rubeosis faciei diabeticorum is not associated with oxidative stress and skin autofluorescence. An Bras Dermatol. 2019;94:561–6.
Trabalho realizado no SIA “Veselības Centre 4” e no Laboratório Científico de Bioquímica, Riga Stradins University, Riga, Letônia.